向盛有黄绿色气体(氯气)的集气瓶中投入几块木炭,右侧烧杯内盛有水,一段时间后打开止水夹.
 liu70802022-10-04 11:39:541条回答
liu70802022-10-04 11:39:541条回答实验过程中你能观察到得现象是?
产生现象的原因是?
其中漏斗的作用是?(此实验右面烧杯里导管口下水面之上有一个漏斗)
为什么不用导管来代替漏斗?
急!今天之内解决,不然作废

已提交,审核后显示!提交回复
共1条回复
 tsuiforrest 共回答了24个问题
tsuiforrest 共回答了24个问题 |采纳率83.3%- 黄绿色消失 (如果是燃烧的木炭 则是因为氧化还原 生成四氯化碳 这是无色液体 不是燃烧 则是木炭类似活性炭的吸附性把气体吸入纤维管)打开水加 水吸入集气瓶(真空了嘛) 漏斗防倒吸嘛
- 1年前
相关推荐
- 将浓盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色退去,现有一氧化还原反应体系中,共有KCL、CL2.浓H2SO
将浓盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色退去,现有一氧化还原反应体系中,共有KCL、CL2.浓H2SO4、H2O.KMNO4.MnSO4.K2SO4七种物质
1、该氧化还原体系中,还原剂是()化合价没发生变化的反应物是()
2、写出一个包含上述七种物质的氧化还原反应方程式()
3、上述反应中,1mol氧化剂在反应中转移的电子数是()mol
4、如果反应后溶液中加入NaBiO3,溶液变为紫红色,BiO3(-)反应后变为无色Bi3
证明NaBiO3的一个性质是() 昆虫之王1年前2
昆虫之王1年前2 -
 sukerelyning1 共回答了14个问题
sukerelyning1 共回答了14个问题 |采纳率71.4%KMnO4是氧化剂,KCl是还原剂,氧化产物是Cl2,还原产物是MnSO4.
1.该氧化还原体系中,还原剂是(KCl),化合价没发生变化的反应物是(H2SO4).
2.写出一个包含上述七种物质的氧化还原反应方程式(2KMnO4+10KCl+8H2SO4=6K2SO4+2MnSO4+5Cl2↑+8H2O)
3.上述反应中,1mol氧化剂在反应中转移的电子数是(5)mol
1个KMnO4中的Mn由+7变为MnSO4中的+2,得到5个电子,转移5个电子.
4.如果反应后溶液中加入NaBiO3,溶液变为紫红色,BiO3(-)反应后变为无色Bi3
证明NaBiO3的一个性质是(NaBiO3的氧化性比KMnO4的氧化性强).
Mn2+被BiO3-氧化为MnO4-,溶液由无色变为紫色.1年前查看全部
- 在试管中加入过量的块状碳酸钙,再加入约20毫升饱和氯水,充分反应,发现有( )生成,溶液黄绿色(
 爱音乐飞鱼1年前2
爱音乐飞鱼1年前2 -
 何日共剪西窗烛 共回答了17个问题
何日共剪西窗烛 共回答了17个问题 |采纳率88.2%少量气泡产生1年前查看全部
- 室温下,单质A,B,C分别为固体,黄绿色气体,无色气体,在应当条件下能相互转化,则A,B,C分别是什么
 ccfjt1年前1
ccfjt1年前1 -
 pkurc 共回答了20个问题
pkurc 共回答了20个问题 |采纳率95%A:氢氧化钠B:氯气C:氢气1年前查看全部
- 为什么氯气呈黄绿色,而氯原子不呈黄绿色(注意是氯原子不是氯离子)
 跟我去爬山吧1年前5
跟我去爬山吧1年前5 -
 猪口余香 共回答了19个问题
猪口余香 共回答了19个问题 |采纳率94.7%氯原子半径小于可见光波长,光会发生衍射现象,绕过氯原子,不会反射光,因此单个的氯原子不会有颜色1年前查看全部
- 镁条在其中燃烧可产生黄绿色固体的气体
镁条在其中燃烧可产生黄绿色固体的气体
这是什么气体? f道可道非常道1年前3
f道可道非常道1年前3 -
 niqusibayee 共回答了19个问题
niqusibayee 共回答了19个问题 |采纳率94.7%3Mg+N2==(点燃)==Mg3N2,二氮化三镁是黄绿色固体.1年前查看全部
- 下列说法正确的是a.光照氯水有气泡逸出,该气体是氯气b.新制氯水呈黄绿色是因为其中存在氯气c.久置氯水
下列说法正确的是a.光照氯水有气泡逸出,该气体是氯气b.新制氯水呈黄绿色是因为其中存在氯气c.久置氯水
遇硝酸银不会产生白色沉淀 飞儿咻咻1年前2
飞儿咻咻1年前2 -
 haoqjy 共回答了20个问题
haoqjy 共回答了20个问题 |采纳率90%a. 光照氯水有气泡逸出,该气体是氯气 错,是氧气
b. 新制氯水呈黄绿色是因为其中存在氯气 对
c. 久置氯水遇硝酸银不会产生白色沉淀 错,久置氯水就是稀盐酸,含Cl-,会生产AgCl白色沉淀1年前查看全部
- 为什么说氯水黄绿色说明氯气主要以分子形式存在?如果以离子形式或原子形式就不是黄绿色的了?
 txksd11年前1
txksd11年前1 -
 莫小了 共回答了19个问题
莫小了 共回答了19个问题 |采纳率94.7%氯水成分:HClO,HCl,Cl2,H2O.
只有Cl2才是黄绿色.1年前查看全部
- 氯气、氯水和盐酸中都含有氯元素,所以它们都呈黄绿色,为什么?
氯气、氯水和盐酸中都含有氯元素,所以它们都呈黄绿色,为什么?
请仔细回答, WESTLIFES1年前2
WESTLIFES1年前2 -
 KG_KG 共回答了25个问题
KG_KG 共回答了25个问题 |采纳率92%不对,显黄绿色的是氯气,氯水中及盐酸中是溶解了少量的氯气而显黄绿色的
氯离子是无色的1年前查看全部
- 亚硝酸钠与浓盐酸反应放出黄绿色气体即氯气的化学方程式
 卡卡奴1年前3
卡卡奴1年前3 -
 Elflight 共回答了17个问题
Elflight 共回答了17个问题 |采纳率88.2%这题不难:正确方程式为:
2NaNO2 + 4HCl= Cl2 + 2NO + 2NaCl + 2H2O
我还查了它们的电极电势,能发生上述反应.1年前查看全部
- 什么黑色粉末与浓盐酸加热熔解后生成黄绿色气体?又有什么黑色粉末与浓盐酸溶解后得到蓝色溶液?
 8又二分之一1年前5
8又二分之一1年前5 -
 英熊无敌 共回答了23个问题
英熊无敌 共回答了23个问题 |采纳率91.3%前者是二氧化锰,有强氧化性,气体为氯气,
MnO2+4HCl==+MnCl2+C12↑+2H2O
后者为CuO,溶解得到CuCl2,铜离子为蓝色,
Cuo+2HCl=CuCL2+H2O1年前查看全部
- 浓硒酸与盐酸混合产生黄绿色气体化学方程式是什么?
浓硒酸与盐酸混合产生黄绿色气体化学方程式是什么?
第三个回答里的H2SeO3貌似应该掰开成H2O和SeO2,谢谢各位 苍龙七宿-心宿1年前1
苍龙七宿-心宿1年前1 -
 gaowuchi 共回答了21个问题
gaowuchi 共回答了21个问题 |采纳率95.2%H2SeO4 (浓)+ 2 HCl ==== Cl2 ↑ + H2SeO3 +H2O1年前查看全部
- 什么物质与二氧化锰催化加热生成黄绿色气体?
 morandy11年前3
morandy11年前3 -
 yefeng88 共回答了13个问题
yefeng88 共回答了13个问题 |采纳率100%在实验室常利用它的氧化性,与浓盐酸(HCl)混合加热制备氯气(Cl₂):
MnO₂+ 4HCl(浓) ==Δ== MnCl₂+ Cl₂↑ + 2H₂O
如不用浓盐酸,亦可用NaCl(固体)跟浓硫酸来代替.
如:2NaCl+MnO₂+3H₂SO₄(加热)=2NaHSO₄+MnSO₄+Cl₂↑+2H₂O1年前查看全部
- HCL加上某金属生成某物质在加上黄绿色的气体生成另一中物质的反应方程式
HCL加上某金属生成某物质在加上黄绿色的气体生成另一中物质的反应方程式
最后在和NAOH反应生成红棕色沉淀 wulei1111年前1
wulei1111年前1 -
 hw929000 共回答了19个问题
hw929000 共回答了19个问题 |采纳率100%顶一楼,氯气本身是氧化性很强的物质,所以需要氧化性更强的物质才能将其还原出来,而金属绝大多数情况下只能表现出还原性1年前查看全部
- 次氯酸钠和亚硫酸钠2:1混合水浴加热在滴加硫酸溶液生成黄绿色气体是什么
 liuxuan20051年前1
liuxuan20051年前1 -
 cn_xf 共回答了14个问题
cn_xf 共回答了14个问题 |采纳率92.9%二氧化氯(ClO2) 是一种水溶性的强氧化剂1年前查看全部
- 紫黑色固体.紫色溶液.棕黄色溶液.橙色溶液.黄绿色气体.臭鸡蛋气味.
紫黑色固体.紫色溶液.棕黄色溶液.橙色溶液.黄绿色气体.臭鸡蛋气味.
白色沉淀 lhm_0201年前4
lhm_0201年前4 -
 ll琳 共回答了23个问题
ll琳 共回答了23个问题 |采纳率91.3%高锰酸钾固体;高锰酸钾溶液;三价铁盐溶液;溴水;氯气;硫化氢气体1年前查看全部
- 在漂白粉中滴入 70%的 硫酸,立刻产生黄绿色气体,说明硫酸具有还原性.这句话对吗?为什么?
 难取名字啊1年前4
难取名字啊1年前4 -
 哭泣稻草人 共回答了18个问题
哭泣稻草人 共回答了18个问题 |采纳率66.7%这句话是不对的.漂白粉是由次氯酸钙和氯化钙组成的混合物,当加入硫酸后次氯酸根和氯离子发生倒歧化反应生成黄绿色的氯气,这是利用了硫酸的酸性,而不是利用了硫酸的氧化性或还原性.在这个过程中硫酸根没有发生变化:Ca(ClO)2+CaCl2 + 2H2SO4==2CaSO4+2Cl2↑+2H2O.氯气单质在碱性溶液中发生歧化反应,生成次氯酸盐和氯化物;在酸性溶液中次氯酸根和氯离子又发生了上述反应的逆反应(称倒歧化反应).我支持你,1年前查看全部
- 氯水呈黄绿色说明氯气没有全部溶于水还是氯水中有氯气
 loveoscar1年前3
loveoscar1年前3 -
 bx7npi 共回答了18个问题
bx7npi 共回答了18个问题 |采纳率88.9%没有溶于水时氯气你能看见吗,气体的,因该在气相
氯水呈黄绿说明是氯气分子在水中,就是已经溶解1年前查看全部
- 铵明矾+盐为什么变黄绿色铵明矾溶液+盐为什么变黄色(略带黄色)溶液变黄色(略带绿色),但是性能没变,是不是重金属超标,影
铵明矾+盐为什么变黄绿色
铵明矾溶液+盐为什么变黄色(略带黄色)
溶液变黄色(略带绿色),但是性能没变,是不是重金属超标,影响质量吗? 红泥花园1年前1
红泥花园1年前1 -
 山水居士2008 共回答了16个问题
山水居士2008 共回答了16个问题 |采纳率87.5%有杂质,还有一个重要的原因就是,铵明矾会水解产生胶体Al(OH)3,胶体具有很强的吸附能力并且胶体表面带有电荷,加入电解质(盐)可以中和胶体表面的电荷,而使胶体聚沉,聚沉的同时溶液的折光能力就有所变化,所以看起来略带黄色1年前查看全部
- 为什么我电解稀食盐水第二天水变黄绿色并无刺激性气味,而黄铜导线变红,收集气体一罐为氢另一为氧
 紫藤兰1年前2
紫藤兰1年前2 -
 andy83 共回答了16个问题
andy83 共回答了16个问题 |采纳率100%稀的食盐水中氯离子含量小,反应完后就会有水中的氢氧根离子放电,生成氧气,阴极一直生成氢气
黄铜导线中含有铜、锌两种活泼性不同的金属,所以锌会发生电化学腐蚀溶进液体,铜单质露出所以导线呈红色,氢氧根环境中可以生成铜绿和溶进水,使水呈黄绿色1年前查看全部
- 用石墨电极电解饱和食盐水发现出现不溶固体 两极气泡产生正常 溶液变为黄绿色 请给出化学方程式离子方程式
 岁月胡胡匆匆1年前2
岁月胡胡匆匆1年前2 -
 draculahdw 共回答了17个问题
draculahdw 共回答了17个问题 |采纳率94.1%2Cl-+2H2O=Cl2+H2+2OH-
变黄绿色是因为部分Cl2溶于水1年前查看全部
- 溶液呈黄绿色,且有刺激性气味,说明什么
 1022woshi1年前5
1022woshi1年前5 -
 net2002 共回答了21个问题
net2002 共回答了21个问题 |采纳率85.7%溶液呈黄绿色,且有刺激性气味,说明有Cl2分子存在1年前查看全部
- NaOH吸收Cl2后,向其中加稀硫酸至酸性,有黄绿色气体?为什么?
 南海de游鱼1年前2
南海de游鱼1年前2 -
 aschenputtel 共回答了19个问题
aschenputtel 共回答了19个问题 |采纳率84.2%NaOH吸收Cl2后,向其中加稀硫酸至酸性,有黄绿色气体
因为2NaOH+Cl2=NaClO+NaCl+H2O.
NaClO+NaCl+H2SO4=Na2SO4+Cl2(气体)+H2O
满意望采纳,谢谢,祝你学习进步,天天开心,天天提高.1年前查看全部
- 若A为黑色固体,B为黄绿色气体则满足A+B-----C+D+H2O的离子方程式是什么
 山顶的树1年前1
山顶的树1年前1 -
 悠悠我心_看碧海 共回答了14个问题
悠悠我心_看碧海 共回答了14个问题 |采纳率100%根据颜色可知 B肯定是Cl2 那么 根据元素守恒,可知A中必含H 和O元素,是黑色固体,又和Cl2反应,还必须含O和H元素的,高中好像还真没见过 楼主确定题干如此吗?1年前查看全部
- 在两个容积不同的容器中,一个盛有HCl气体,另一个盛有H 2 和C1 2 (黄绿色气体)的混合气体。在同温同压下,两容器
在两个容积不同的容器中,一个盛有HCl气体,另一个盛有H 2 和C1 2 (黄绿色气体)的混合气体。在同温同压下,两容器内的气体可能具有相同的 [ ]A.分子数
B.颜色
C.原子数
D.密度 shilixin20081年前1
shilixin20081年前1 -
 娃哈哈x9q 共回答了20个问题
娃哈哈x9q 共回答了20个问题 |采纳率85%D1年前查看全部
- 若将浓H2SO4慢慢滴入浓盐酸中,可能产生的实验现象是( )A.冒白雾,混合物温度升高 B.产生黄绿色气体
若将浓H2SO4慢慢滴入浓盐酸中,可能产生的实验现象是( )A.冒白雾,混合物温度升高 B.产生黄绿色气体
C.冒白雾,混合物温度降低 D.液体四溅,冒白烟
网上有答案,但我需要请你解释每一个选项. sue_77771年前1
sue_77771年前1 -
 嘿哈喵 共回答了16个问题
嘿哈喵 共回答了16个问题 |采纳率93.8%A
白雾是HCl气体挥发时结合水蒸气形成的,而浓硫酸溶於水放热,温度升高.
B错,浓硫酸无法氧化HCl成Cl2
C错,溶於水放热
D错,白烟是固体,但是这里没有固体.而且液体也不会四溅,像你稀释浓硫酸的时候是不会液体四溅的.1年前查看全部
- 实验室用下图装置制取氢气,进行氢气在氯气(Cl 2 )中燃烧的实验。纯净的氢气可以在黄绿色的氯气中安静地燃烧,发出苍白色
实验室用下图装置制取氢气,进行氢气在氯气(Cl 2 )中燃烧的实验。纯净的氢气可以在黄绿色的氯气中安静地燃烧,发出苍白色火焰,生成氯化氢气体。请回答下列问题: 
(1)用上图装置制氢气,发生反应的化学方程式为_______________________,长颈漏斗插入以下的原因是__________________。
(2)在点燃氢气之前,要先检验___________,写出氢气在氯气中燃烧的化学方程式________________,该反应的基本类型属于___________。
(3)根据氢气可以在氯气中燃烧的实验,谈谈你对燃烧的新认识_______________________。
(4)根据题中所给的信息归纳氯气的物理性质__________________________。 fasdfgqweg1年前1
fasdfgqweg1年前1 -
 广州白云区 共回答了15个问题
广州白云区 共回答了15个问题 |采纳率80%1年前查看全部
- 在通常情况下,氯气(Cl 2 )是黄绿色气体,溴(Br 2 )是深红棕色液体,碘(I 2 )是紫黑色固体。实验证明,氯、
在通常情况下,氯气(Cl 2 )是黄绿色气体,溴(Br 2 )是深红棕色液体,碘(I 2 )是紫黑色固体。实验证明,氯、溴、碘这三种元素中,氯比溴活泼,溴比碘活泼,氯可以把溴或碘从它们化合物的溶液中置换出来,溴可以把碘从它化合物的溶液中置换出来;碘单质具有遇淀粉生成蓝色物质的特性。 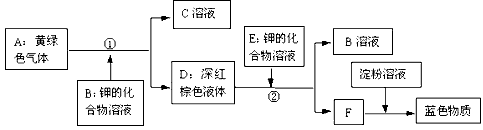
⑴根据上图所示变化关系推断出下列指定物质(用化学式表示): B是_________ ;C是___________ ;F是_____________ 。
⑵写出上图中②反应的化学方程式:_____________ 。 asdkvj1年前1
asdkvj1年前1 -
 ss_yao 共回答了15个问题
ss_yao 共回答了15个问题 |采纳率100%⑴B是KBr;C是KCl;F是I 2
⑵Br 2 +2KI = I 2 +2KBr1年前查看全部
- 硫酸铁和氢氧化铜反应出现黄绿色沉淀
硫酸铁和氢氧化铜反应出现黄绿色沉淀
我把铁棍放到硫酸铜溶液中置换,然后另一边让氢氧化钠与硫酸铜反应,产生蓝色沉淀(氢氧化铜),然后把置换了一会的硫酸铁倒入到反应完的氢氧化铜沉淀中,结果蓝色沉淀瞬间变成黄绿色沉淀,请问这是怎么回事? 独倚天柱1年前1
独倚天柱1年前1 -
 sundragoninter 共回答了18个问题
sundragoninter 共回答了18个问题 |采纳率100%氢氧化钠与硫酸铜反应中,氢氧化钠过量.
铁与硫酸铜反应生成的硫酸亚铁与氢氧化钠反应沉淀了,然后反应生成的氢氧化亚铁被空气氧化成了氢氧化铁,未反应完的硫酸铜与氢氧化钠反应生成的氢氧化铜和氢氧化铁小颗粒混在一起,颜色就那样1年前查看全部
- 下列说法正确的是( )A.光照氯水有气泡逸出,该气体是Cl2B.新制氯水呈黄绿色是因为其中存在Cl2C.久置氯水遇Ag
下列说法正确的是( )
A.光照氯水有气泡逸出,该气体是Cl2
B.新制氯水呈黄绿色是因为其中存在Cl2
C.久置氯水遇AgNO3溶液会产生白色沉淀
D.新制氯水经光照一段时间pH增大 诗曼青藤1年前1
诗曼青藤1年前1 -
 二月鸡头 共回答了16个问题
二月鸡头 共回答了16个问题 |采纳率93.8%解题思路:A、氯水中的次氯酸见光易分解为盐酸和氧气;
B、氯气溶于水中得到的氯水是浅黄绿色的;
C、久置的氯水成分是盐酸,含有氢离子和氯离子;
D、氯水中的次氯酸见光易分解为盐酸和氧气.A、氯水中的次氯酸见光易分解为盐酸和氧气,所以光照氯水有气泡逸出,该气体是O2,故A错误;
B、氯气溶于水中得到氯水,是浅黄绿色的,故B正确;
C、久置的氯水成分是盐酸,含有氢离子和氯离子,向其中加入AgNO3溶液会产生白色沉淀氯化银,故C正确;
D、新制的氯水中的次氯酸见光易分解为盐酸和氧气,新制氯水经光照一段时间,即变为盐酸,酸性增强,pH变小,故D错误.
故选BC.点评:
本题考点: 氯气的化学性质.
考点点评: 本题考查学生新制氯水的成分以及与久置的氯水的区别,可以根据所学知识来回答,注意知识的归纳和整理是关键,难度不大.1年前查看全部
- “氯气在通常情况下是一种黄绿色有剌激性气味的气体”这句话说明的是氯气的( )
“氯气在通常情况下是一种黄绿色有剌激性气味的气体”这句话说明的是氯气的( )
A.物理变化
B.化学变化
C.物理性质
D.化学性质 灵岛兔1年前1
灵岛兔1年前1 -
 梵笙歌 共回答了23个问题
梵笙歌 共回答了23个问题 |采纳率100%解题思路:变化是一个过程,性质是物质固有的属性,根据物理变化、化学变化、物理性质与化学性质的定义进行选择.物理变化是不产生新物质的变化,化学变化是产生新物质的变化;物理性质是不需要发生化学变化就可表现出来的性质,如颜色、状态、气味、熔点、沸点、硬度、密度、溶解性等,化学性质是通过化学变化才能表现出来的性质,如可燃性、稳定性、还原性、氧化性等.氯气在通常情况下是一种黄绿色有剌激性气味的气体描述的是氯气的颜色、状态、气味,不需要发生化学变化就能表现出来,因此是物理性质.
故选C点评:
本题考点: 化学性质与物理性质的差别及应用.
考点点评: 物理性质、化学性质与物理变化、化学变化是一对对应的概念,明确性质与变化之间的联系1年前查看全部
- 氧化性还原性强弱比较向KmnO4晶体滴加浓盐酸,产生黄绿色气体.向FeCl2溶液中通入少量Cl2,溶液变黄.为什么可以断
氧化性还原性强弱比较
向KmnO4晶体滴加浓盐酸,产生黄绿色气体.向FeCl2溶液中通入少量Cl2,溶液变黄.为什么可以断定氧化性MnO4离子>Cl2>Fe3+离子...什么依据 sansanxuebu1年前1
sansanxuebu1年前1 -
 巧乐紫 共回答了24个问题
巧乐紫 共回答了24个问题 |采纳率87.5%根据氧化剂的氧化性大于还原产物,KMnO4氧化浓盐酸生成Cl2,Cl2氧化Fe2+生成Fe3+,所以说氧化性MnO4》Cl2》Fe3+离子1年前查看全部
- 啥都不说直接上图!我想知道氯水为什么从黄绿色褪去,氯水不是无色么!为什么会褪去!
啥都不说直接上图!
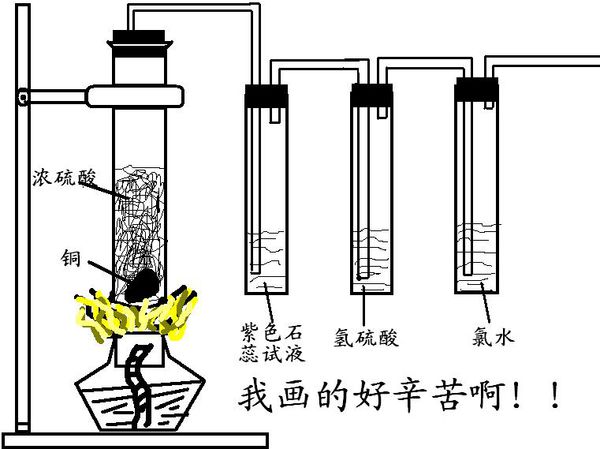
我想知道氯水为什么从黄绿色褪去,氯水不是无色么!为什么会褪去! mm出差了1年前1
mm出差了1年前1 -
 闲人客 共回答了20个问题
闲人客 共回答了20个问题 |采纳率90%第一个试管反应生成SO2,所以石蕊变红,氢硫酸出黄色浑浊(S单质),氯水褪色.
氯水有一定颜色的,应该是黄绿色,不算很深.1年前查看全部
- A+B生成X+Y+H2O(未配平,反应条件略去)是中学常见的化学方程式请回答 1、若Y为黄绿色气体 1:当AB的
A+B生成X+Y+H2O(未配平,反应条件略去)是中学常见的化学方程式请回答 1、若Y为黄绿色气体 1:当AB的
物质的量之比为1:4且A为黑色固体,该反应的离子方程式是
2:当AB的物质的量之比为1:6时,写出该反应的化学方程式,并用双线桥表示反应过程中的电子转移
3:实验室处理尾气Y时常用naoh而不用nahso3溶液,其原因是(用离子方程式表示)
(2)若A为单质B为无色油状黏稠液体,当AB物质的量之比为1:2时,则A可能为.,检查其刺激性气体产物X的方法是
(3)常温下A在B的浓溶液中会钝化,且A可溶于X溶液中,若A为金属单质,A和B以物质的量之比1:4反应
1:过量的A和100ml2mo l/l的B溶液充分反映后将溶液稀释至500ml后溶液中阴离子的物质的量浓度为 坚持到胜利1年前1
坚持到胜利1年前1 -
 cxcool 共回答了17个问题
cxcool 共回答了17个问题 |采纳率94.1%(1) MO2 + 2CI- + 4H+ == Mn2+ CI2 + 2H2O
KCIO3 + 6HCI == KCI + 3CI2 +3H2O
CI2 + SO32- + H2O == SO42- +2CI- +2H+
2H+ SO32- == H2O + SO21年前查看全部
- 为什么氯水不是无色的? 氯水中有氯气和次氯酸,因为溶有氯气所以呈黄绿色,而次氯酸不是有漂白性,为什么氯水不是无色的?
 cfqtree1年前3
cfqtree1年前3 -
 LI3344 共回答了23个问题
LI3344 共回答了23个问题 |采纳率95.7%因为氯水中溶解了少量的氯气,氯气能溶于水,1:2溶解,氯气有黄绿色,氯水显浅黄绿色.
次氯酸的强氧化性漂白对本身就是强氧化性的cl2来说无影响.1年前查看全部
- 氯气是一种黄绿色,有毒气体,发出蓝色火焰,说明燃烧不一定需要氧气
氯气是一种黄绿色,有毒气体,发出蓝色火焰,说明燃烧不一定需要氧气
这句话是对还是错判断 yanming811年前4
yanming811年前4 -
 RRAPEME 共回答了17个问题
RRAPEME 共回答了17个问题 |采纳率94.1%发出蓝色火焰说明它燃烧了,没有加热或点燃说明氯气与氧气没反应.得出结论1年前查看全部
- 二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.
 二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.
二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.
(1)工业上制备ClO2的反应原理常采用:2NaClO3+4HCl=2ClO2↑+Cl2↑+2H2O+2NaCl.
①浓盐酸在反应中显示出来的性质是______(填序号).
A.只有还原性B.还原性和酸性C.只有氧化性D.氧化性和酸性
②若上述反应中产生0.1mol ClO2,则转移电子的物质的量为______mol.
(2)目前已开发出用电解法制取ClO2的新工艺.
①如图示意用石墨做电极,在一定条件下电解饱和食盐水制取ClO2.写出阳极产生ClO2的电极反应式:______.
②电解一段时间,当阴极产生的气体体积为112mL(标准状况)时,停止电解.通过阳离子交换膜的阳离子的物质的量为______mol;用平衡移动原理解释阴极区pH增大的原因______.
(3)ClO2对污水中Fe2+、Mn2+、S2-和CN-等有明显的去除效果.某工厂污水中含CN- a mg/L,现用ClO2将CN-氧化,只生成两种气体,其离子反应方程式为______;处理100m3这种污水,至少需要ClO2[50a/13][50a/13]mol. kakaup1年前1
kakaup1年前1 -
 ajiu555 共回答了13个问题
ajiu555 共回答了13个问题 |采纳率92.3%解题思路:(1)①HCl中的氯元素在产物存在于Cl2,氯元素的化合价升高,氯元素被氧化,存在NaCl中氯元素的化合价未变化,据此解答;
②ClO2是还原产物,氯元素的化合价由+5价降低为+4价,转移电子物质的量等于ClO2的物质的量;
(2)①由题意可知,氯离子放电生成ClO2,由元素守恒可知,有水参加反应,同时生成氢离子;
②在阴极发生2H++2e-=H2↑,通过阳离子交换膜的阳离子为+1价离子,根据n=
计算氢气的物质的量,根据电子转移守恒计算阳离子的物质的量,电解中H+浓度减小,使得H2O⇌OH-+H+的平衡向右移动;V Vm
(3)ClO2将CN-氧化,只生成两种气体,应生成氮气与二氧化碳,同时生成氯离子;
根据方程式计算需要ClO2的物质的量.(1)①HCl中的氯元素在产物存在于Cl2,氯元素的化合价升高,氯元素被氧化,HCl起还原剂注意,同时存在NaCl中氯元素的化合价未变化,故HCl还起酸的作用,故答案为:B;
②ClO2是还原产物,氯元素的化合价由+5价降低为+4价,转移电子物质的量为0.1mol×(5-4)=0.1mol,
故答案为:0.1mol;
(2)①由题意可知,氯离子放电生成ClO2,由元素守恒可知,有水参加反应,同时生成氢离子,电极反应式为:Cl--5e-+2H2O=ClO2↑+4H+,
故答案为:Cl--5e-+2H2O=ClO2↑+4H+;
②在阴极发生2H++2e-=H2↑,氢气的物质的量为[0.112L/22.4L/mol]=0.005mol,通过阳离子交换膜的阳离子为+1价离子,故交换膜的阳离子的物质的量为0.005mol×2=0.01mol,电解中阴极H+浓度减小,使得H2O⇌OH-+H+的平衡向右移动,溶液的pH增大,
故答案为:0.01;在阴极发生2H++2e-=H2↑,H+浓度减小,使得H2O⇌OH-+H+的平衡向右移动,OH-浓度增大,pH增大;
(3)ClO2将CN-氧化,只生成两种气体,应生成氮气与二氧化碳,同时生成氯离子,反应离子方程式为:2ClO2+2CN-=N2↑+2CO2↑+2Cl-,
100m3废水中CN-质量=100m3×ag/m3=100ag,CN-的物质的量为[100ag/26g/mol]=[50a/13]mol,由方程式可知,至少需要ClO2的物质的量=[50a/13]mol,
故答案为:2ClO2+2CN-=N2↑+2CO2↑+2Cl-;[50a/13]mol.点评:
本题考点: 电解原理;氯、溴、碘及其化合物的综合应用.
考点点评: 本题考查氧化还原反应、常用化学用语、电解原理、化学计算等,题目难度中等,电解反应是难点、易错点,是对学生综合能力的考查,需要学生具有扎实的基础与分析解决问题的能力.1年前查看全部
- 已知将浓盐酸滴入高锰 已知将浓盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去.现在一氧化还原反应的体系中,共
已知将浓盐酸滴入高锰
已知将浓盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去.现在一氧化还原反应的体系中,共有KCl、Cl 2 、H 2 SO 4 (浓)、H 2 O、KMnO 4 、MnSO 4 、K 2 SO 4 七种物质:
(1)该氧化还原反应的体系中,还原剂是________,化合价没有发生变化的反应物是________.
(2)写出一个包含上述七种物质的氧化还原反应方程式(需配平):________________
(3)如果在反应后的溶液中加入NaBiO 3 溶液又变为紫红色,BiO 3 - 反应后变为无色的Bi 3+ 该实验证明NaBiO 3 具有_________性.写出该反应的离子反应方程式:____________________上述反应中,每生成1mol
Bi 3+ 移的电子数为_________. momo糖糖1年前1
momo糖糖1年前1 -
 怪宝宝 共回答了20个问题
怪宝宝 共回答了20个问题 |采纳率85%(1)KCl;H 2 SO 4
(2)2KMnO 4 +10KCl+8H 2 SO 4 =6K 2 SO 4 +2MnSO 4 +5Cl 2 ↑+8H 2 O
(3)强氧化性;2Mn 2+ +5BiO 3 - +14H + ==5Bi 3+ +2MnO 4 - +7H 2 O;2N A 或2×6.02×10 231年前
11年前查看全部
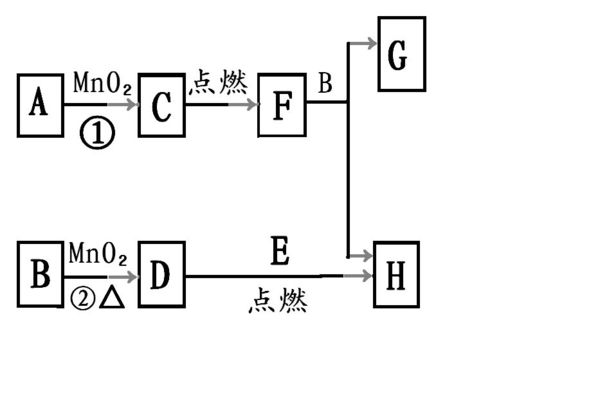
- 下图所涉及的物质均为中学化学中的常见物质,其中D为黄绿色气体,E为Fe,除D、E、C外其余为化合物.它们存在如下转化关系
下图所涉及的物质均为中学化学中的常见物质,其中D为黄绿色气体,E为Fe,除D、E、C外其余为化合物.它们存在如下转化关系,反应中生成的水及次要产物均已略去.
(1)写出有关物质的化学式B---、F---、H---、
(2)指出MnO₂在相关反应中的作用:反应①中是----剂,反应②中是---剂.
(3)若反应①是在加热条件下进行,则A的化学式是------
若反应①是在常温条件下进行,则A的化学式是------
(4)写出B与MnO₂共热获得D的化学方程式.
(5)写出F与B反应的化学方程式.
图片正在补充过程中,稍后...
从C→F的箭头下面应该还有一个E
 abcsde1年前2
abcsde1年前2 -
 东北小刁 共回答了22个问题
东北小刁 共回答了22个问题 |采纳率86.4%1.D为黄绿色气体 Cl2 所以B为HCl H为FeCl3 所以 F为铁的氧化物Fe3O4,
2Fe+3Cl2=点燃==2FeCl3
B 为HCl、F为Fe3O4、 H为FeCl3
2.反应①中是催化剂,反应②中是氧化剂.
3.若反应①是在加热条件下进行,则A的化学式是 KClO3;
2KClO3===(横线上写MnO2,横线下写△)2KCl+3O2↑
若反应①是在常温条件下进行,则A的化学式是H2O2
2H2O2===MnO2(在等号上)==2H2O+O2↑
4.MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O
5)写出F与B反应的化学方程式.
Fe3o4 + 8HCl == 2FeCl3 + FeCl2 + 4H2O1年前查看全部
- 氯气(Cl 2 )是黄绿色气体,其水溶液叫氯水。把品红试纸(染有品红的纸)伸入氯水中,品红褪色。请回答下列各题。
氯气(Cl 2 )是黄绿色气体,其水溶液叫氯水。把品红试纸(染有品红的纸)伸入氯水中,品红褪色。请回答下列各题。
【发现问题】 氯水中的哪些成分能使品红褪色呢?
【查阅资料】 氯气溶于水,部分与水反应,方程式为Cl 2 + H 2 O =" HCl" + HClO。其中,HClO的名称叫次氯酸,是一种弱酸,具有强氧化性。
【猜想】猜想1:是氯水中的水使品红褪色的;
猜想2:是氯水中的氯气使品红褪色的;
猜想3:是氯水中的盐酸使品红褪色的;
猜想4:是氯水中的次氯酸使品红褪色的。
【实验探究】
【结论】实 验 操 作 实验现象 过程分析 ①把品红试纸伸入水中 没有褪色 猜想1不成立 ②把品红试纸伸入干燥的氯气中 没有褪色 猜想2不成立 ③ 没有褪色 猜想3不成立
综合分析:氯水中的 (填化学式)使品红褪色,具有漂白作用(能使品红等有色物质褪色)。
【反思】HClO中氯元素的化合价为 价。 1389617ww71年前1
1389617ww71年前1 -
 哆咧咪 共回答了23个问题
哆咧咪 共回答了23个问题 |采纳率91.3%把品红试纸伸入盐酸中 HClO +1
1年前查看全部
- 1.将气体样品溶于水,发现气体A溶于水:2.将A的浓溶液与Mno2,公热产生一种黄绿色气体单质B,B通入石灰乳
1.将气体样品溶于水,发现气体A溶于水:2.将A的浓溶液与Mno2,公热产生一种黄绿色气体单质B,B通入石灰乳
中可以得漂白粉.求A,
写出A的浓溶液与MNO2共热的化学方程式
写出B通入石灰乳中的化学方程式
知道的帮帮忙,关于氯气的,高一必修一的. pisp1年前2
pisp1年前2 -
 mmgzs 共回答了15个问题
mmgzs 共回答了15个问题 |采纳率86.7%代楼上的回答
A是氯化氢气体(HCl)就可以了.1年前查看全部
- 在浓盐酸中加固体,产生黄绿色气体和红色不溶物, 如果固体中有Fe 和CuO,铁为什么不会和浓盐酸反应
在浓盐酸中加固体,产生黄绿色气体和红色不溶物, 如果固体中有Fe 和CuO,铁为什么不会和浓盐酸反应
固体以二氧化锰,铁 和氧化铜组成的情况下,氧化铜和铁都会和浓盐酸反应生成盐,为什么会有红色不溶物,铁为什么不会和浓盐酸反应而与氯化亚铜置换? wangbin611年前1
wangbin611年前1 -
 za7za8 共回答了15个问题
za7za8 共回答了15个问题 |采纳率100%是因为铜离子的氧化性强于浓盐酸中氢离子的氧化性.所以铁与氯化铜置换会有红色不溶物.1年前查看全部
- 在CuCl2水溶液中存在如下平衡:[Cu(H2O)4]2+(蓝)+4Cl-⇌[CuCl4]2-(绿)+4H2O能使黄绿色
在CuCl2水溶液中存在如下平衡:[Cu(H2O)4]2+(蓝)+4Cl-⇌[CuCl4]2-(绿)+4H2O能使黄绿色CuCl2溶液向蓝色转化的操作是( )
A.蒸发浓缩
B.加水稀释
C.加入CuCl2 固体
D.加入食盐晶体 jinong19991年前1
jinong19991年前1 -
 xx8032 共回答了15个问题
xx8032 共回答了15个问题 |采纳率93.3%解题思路:使黄绿色CuCl2溶液向蓝色转化,采取的操作使溶液中[Cu(H2O)4]2+浓度增大,即使平衡向逆反应方向移动,根据勒夏特列原理,只有通过减小Cl-浓度才能达到这种移动.
A、溶液中存在平衡Cu2++2H2O⇌Cu(OH)2+2HCl,蒸发浓缩HCl挥发,产生氢氧化铜沉淀,溶液中Cu2+降低;
B、加水稀释,溶液中离子浓度降低,平衡向生成:[Cu(H2O)4]2+方向移动;
C、加入CuCl2 固体,溶液中Cl-浓度浓度增大;
D、加入食盐晶体,溶液中Cl-浓度浓度增大.使黄绿色CuCl2溶液向蓝色转化,采取的操作使溶液中[Cu(H2O)4]2+浓度增大,即使平衡向逆反应方向移动,根据勒夏特列原理,只有通过减小Cl-浓度才能达到这种移动.
A、溶液中存在平衡Cu2++2H2O⇌Cu(OH)2+2HCl,蒸发浓缩HCl挥发,产生氢氧化铜沉淀,故A错误;
B、加水稀释,溶液中离子浓度降低,平衡向生成[Cu(H2O)4]2+方向移动,故B正确;
C、加入CuCl2 固体,溶液中Cl-浓度浓度增大,平衡向右移动,故C错误;
D、加入食盐晶体,溶液中Cl-浓度浓度增大,平衡向向右移动,故D错误.
故选B.点评:
本题考点: 化学平衡的影响因素.
考点点评: 本题考查平衡的移动,难度中等,可以借助平衡常数理解稀释对平衡的影响.1年前查看全部
- 黄绿色气体(氯气)使湿润的碘化钾淀粉试纸变蓝的方程式?
黄绿色气体(氯气)使湿润的碘化钾淀粉试纸变蓝的方程式?
黄绿色气体(氯气)使湿润的碘化钾淀粉试纸变蓝的方程式是什么?
拜托大家告诉我~~~~
 纯蓝GG1年前1
纯蓝GG1年前1 -
 ilucweb2006 共回答了19个问题
ilucweb2006 共回答了19个问题 |采纳率89.5%Cl2 + 2KI = 2KCl +I2
回答完毕,1年前查看全部
- 氯气(Cl2)通常情况下为有刺激性气味的黄绿色的有毒气体,密度比空气大,可跟水反应,反应后溶液呈酸性.实验室通常用浓盐酸
氯气(Cl2)通常情况下为有刺激性气味的黄绿色的有毒气体,密度比空气大,可跟水反应,反应后溶液呈酸性.实验室通常用浓盐酸与二氧化锰共热的方法来制取氯气.实验室制取气体的一套完整装置应包括发生装置、净化装置(包括干燥)、收集装置、尾气处理装置.回答下列问题:
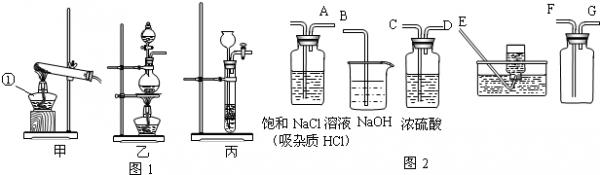

(1)制取氯气的发生装置应选用图1中的______装置;仪器①的名称是______.
(2)在放入药品之前必须检查______.
(3)氯气的化学性质为:______.
(4)用图2中的仪器(不一定全部用到)完成氯气的净化(包括干燥)、收集、尾气处理,其正确的连接方法是:A接______、______接______、______接______. renbude1年前1
renbude1年前1 -
 junbopre 共回答了12个问题
junbopre 共回答了12个问题 |采纳率91.7%解题思路:(1)根据题目所给反应物的状态和发生装置的选择依据即可.
(2)凡是有气体参加或有气体生成的反应装置开始前都要检验气密性,防止泄气.
(3)这个空是要学生通过题目信息搜索答案,注意必须是化学性质.
(4)根据二氧化碳的性质及其反应后的杂质即可做出判断.(1)根据题目信息可知,实验室通常用浓盐酸与二氧化锰共热的方法来制取氯气;二氧化锰是固体,浓盐酸是液体,结合发生装置的选择条件,应该选择乙装置;故答案为:乙;酒精灯.
(2)凡是有气体参加或有气体生成的反应装置开始前都要检验气密性,防止泄气,故答案为:装置气密性
(3)根据题目信息可知,可于水反应,反应后溶液显酸性,酸性物质可以和碱反应生成盐和水;故答案为:可跟水反应,也可与碱溶液反应.
(4)反应后气体有三种:氯气和氯化氢(浓盐酸有挥发性)和水蒸汽,所以应该先除氯化氢,再除水蒸气;在收集装置中,由于氯气密度比空气大,所以气体应该F口进去;氯气有毒性,所以要进行尾气处理,同时氯气可以和碱反应;故答案为:C、DF、GB点评:
本题考点: 常用气体的发生装置和收集装置与选取方法;常用仪器的名称和选用;化学性质与物理性质的差别及应用.
考点点评: 这是一个完整的气体制取、净化、收集、尾气处理装置,使学生对气体的生成到收集有了完整的理解.本题需要注意的是净化的先后顺序和收集气体时的进气口选择.1年前查看全部
- Ⅰ.二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水.工业上用稍潮湿的K
 Ⅰ.二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水.工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得.某学生拟用如图所示装置模拟工业制取并收集ClO2.
Ⅰ.二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水.工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得.某学生拟用如图所示装置模拟工业制取并收集ClO2.
(1)A必须添加温度控制装置,除酒精灯、温度计外,还需要的玻璃仪器有______.
(2)反应后在装置C中可得NaClO2溶液.已知在温度低于38℃时NaClO2饱和溶液中析出晶体是NaClO2•3H2O,在温度高于38℃时析出晶体是NaClO2.根据图所示的NaClO2的溶解度曲线,请补充从NaClO2溶液中制得NaClO2晶体的操作步骤:①蒸发结晶;②______;③洗涤;④干燥.
(3)ClO2很不稳定,需随用随制,用水吸收得到ClO2溶液.为测定所得溶液中ClO2的浓度,进行了下列实验:
①准确量取ClO2溶液V1 mL加入到锥形瓶中,加适量蒸馏水稀释,调节试样的pH≤2.0.
②加入足量的KI晶体,静置片刻.此时发生反应的离子方程式为:______;
③加入淀粉指示剂,用c mol/L Na2S2O3溶液滴定,至终点时消耗Na2S2O3溶液V2 mL.则原ClO2溶液的浓度为cV2 5V1 mol/L(用含字母的代数式表示).(已知2Na2S2O3+I2=Na2S4O6+2NaI)cV2 5V1
Ⅱ.将由Na+、Ba2+、Cu2+、SO42-、Cl-组合形成的三种强电解质溶液,分别装入如图装置中的甲、乙、丙三个烧杯中进行电解,电极均为石墨电极.
接通电源,经过一段时间后,测得乙中c电极质量增加.常温下各烧杯中溶液pH与电解时间t的关系如图(忽略因气体溶解带来的影响).据此回答下列问题:
(1)写出乙烧杯中发生反应的化学方程式2CuSO4+2H2O
2Cu+O2↑+2H2SO4通电 .2CuSO4+2H2O;
2Cu+O2↑+2H2SO4通电 .
(2)电极f上发生的电极反应为______;
(3)若经过一段时间后,测得乙烧杯中c电极质量增加了8g,要使丙烧杯中溶液恢复到原来的状态,应进行的操作是______. 礼物漂亮1年前1
礼物漂亮1年前1 -
 三年天下 共回答了19个问题
三年天下 共回答了19个问题 |采纳率89.5%解题思路:(1)根据反应需要的温度介于60~100℃之间的要采用水浴加热;
(2)从溶液中制取溶质,一般采用蒸发结晶、过滤、洗涤、干燥的方法,根据题意温度高于38℃时析出晶体是NaClO2来确定过滤的温度;
(3)②二氧化氯具有氧化性,可以将碘离子氧化为碘单质,据此书写方程式;
③根据关系式2ClO2~5I2~10Na2S2O3计算c(ClO2);
Ⅱ、乙中c电极质量增加,说明c属于阴极,所以d是阳极,则M是负极,N是正极,f是阳极,e是阳极,b是阳极,a是阴极,根据电解后溶液pH的变化可知甲中的电解质是NaCl,乙中的电解质是CuSO4,丙中的电解质是Na2SO4,根据电解池的工作原理以及电子守恒来书写电解方程式并进行计算即可.I.(1)KClO3和草酸(H2C2O4)在60℃时的反应来制取目标产物,需要的温度介于60~100℃之间的要采用水浴加热,所以还缺少盛水的装置:烧杯,
故答案为:烧杯;
(2)从溶液中制取溶质,一般采用蒸发结晶、过滤、洗涤、干燥的方法,并且只有温度高于38℃时析出晶体才是NaClO2,所以要趁热过滤,故答案为:趁热过滤;
(3)②二氧化氯具有氧化性,可以将碘离子氧化为碘单质,2ClO2+8H++10I-═Cl2+5I2+4H2O,故答案为:2ClO2+8H++10I-═Cl2+5I2+4H2O;
③设原ClO2溶液的浓度为x,
2ClO2~5I2~10Na2S2O3
2 10
10-3×xV110-3×cV2
解得x=
cV2
5V1,故答案为:
cV2
5V1;
Ⅱ.乙中c电极质量增加,说明c属于阴极,所以d是阳极,则M是负极,N是正极,f是阳极,e是阳极,b是阳极,a是阴极,根据电解后溶液pH的变化可知甲中的电解质是NaCl,乙中的电解质是CuSO4,丙中的电解质是Na2SO4,
(1)乙烧杯为电解硫酸铜溶液,反应的总反应式为2CuSO4+2H2O
通电
.
2Cu+O2↑+H2SO4,故答案为:2CuSO4+2H2O
通电
.
2Cu+O2↑+H2SO4;
(2)丙为电解硫酸钠溶液,f为阳极,电极f上发生的电极反应为4OH--4e-=2H2O+O2↑,故答案为:4OH--4e-=2H2O+O2↑;
(3)c电极质量增加了8g,为Cu,n(Cu)=[8g/64g/mol]=0.125mol,转移0.25mol电子,丙中发生2H2O
通电
.
O2↑+2H2↑,转移0.25mol电子应消耗0.125mol水,质量为0.125mol×18g/mol=2.25g,应加入2.25g水可恢复到原来的浓度,
故答案为:向丙烧杯中加入2.25g水.点评:
本题考点: 氯、溴、碘及其化合物的综合应用;电解原理.
考点点评: 本题是一道综合知识的考查题,涉及物质的制备实验,电解池的工作原理等方面知识,综合性强,难度大.1年前查看全部
- 1.石灰水长期露置在空气中,瓶壁和石灰水底部均会出现白色固体物质,说明空气中含有___ 2.在通常状况下,氯气呈黄绿色﹙
1.石灰水长期露置在空气中,瓶壁和石灰水底部均会出现白色固体物质,说明空气中含有___ 2.在通常状况下,氯气呈黄绿色﹙ ﹚,有剧烈的刺激性气味﹙ ﹚,氯气在1.01×10的5次方pa时,冷却到﹣34.6℃,变成液态氯﹙ ﹚,继续冷却到﹣101℃,变成固态氯﹙ ﹚.红热的铜丝在氯气中会发生燃烧﹙ ﹚.氢气也能在氯气中燃烧,生成一种叫氯化氢的气体﹙ ﹚.把氯气通入水中,部分氯气跟水反应,生成盐酸和次氯酸﹙ ﹚.3.将暗紫色固体a加热到固体b和c,同时得到无色气体d,把带火星木条伸入d中,能使木条重新燃烧;把c加入一种无色溶液e中,混合后,即得到气体d,同时得到一无色液体f,f为日常生活中比较常见的一种液体氧化物.请写出以上各种物质的名称:a﹙ ﹚b﹙ ﹚c﹙ ﹚d﹙ ﹚e﹙ ﹚f﹙ ﹚
小明整理出了空气成分的性质和用途的关系,其中错误的是﹙ ﹚a.氧气支持燃烧,常作宇宙航行中的重要燃料 b.氮气化学性质不活泼可用作焊接金属的保护气 c.二氧化碳可供给植物进行光合作用 d.稀有气体化学性质不活泼,可用作霓虹灯中的填充气体
下列物质和氧气反应的生成物在常温下有液体的是﹙ ﹚a.蜡烛 b.铝 c.磷 d.铁
“神舟六号”太空舱利用NiFe₂O₄将航天员呼出的CO₂转化为O₂,而NiFe₂O₄的质量和化学性质都不变,则NiFe₂O₄在该过程中是﹙ ﹚a.反应物 b.生成物 c.催化剂 d.消毒剂
计算题
军军在实验室中学制氧气,他的任务是制出四瓶氧气,每个集气瓶的容积是250ml.那么他至少要制出多少克氧气才能将集气瓶装满?﹙提示:ρo₂=1.429g/L﹚
第二题补充下。是填物理变化、化学变化、物理性质、化学性质四个选项,不是判断对错 钢牙辉1年前4
钢牙辉1年前4 -
 馨儿_ 共回答了17个问题
馨儿_ 共回答了17个问题 |采纳率88.2%1.石灰水长期露置在空气中,瓶壁和石灰水底部均会出现白色固体物质,说明空气中含有CO2___ 2.在通常状况下,氯气呈黄绿色﹙ 物理性质 ﹚,有剧烈的刺激性气味﹙ 物理性质 ﹚,氯气在1.01×10的5次方pa时,冷却到﹣34.6℃,变成液态氯﹙物理变化 ﹚,继续冷却到﹣101℃,变成固态氯﹙物理变化 ﹚.红热的铜丝在氯气中会发生燃烧﹙化学性质 ﹚.氢气也能在氯气中燃烧,生成一种叫氯化氢的气体﹙化学性质 ﹚.把氯气通入水中,部分氯气跟水反应,生成盐酸和次氯酸﹙ 化学变化 ﹚.3.将暗紫色固体a加热〖得〗到固体b和c,同时得到无色气体d,把带火星木条伸入d中,能使木条重新燃烧;把c加入一种无色溶液e中,混合后,即得到气体d,同时得到一无色液体f,f为日常生活中比较常见的一种液体氧化物.请写出以上各种物质的名称:a﹙ KMnO4 ﹚b﹙ K2MnO4 ﹚c﹙ MnO2 ﹚d﹙ O2 ﹚e﹙ H2O2﹚f﹙H2O ﹚
小明整理出了空气成分的性质和用途的关系,其中错误的是﹙ b﹚a.氧气支持燃烧,常作宇宙航行中的重要燃料 b.氮气化学性质不活泼可用作焊接金属的保护气 c.二氧化碳可供给植物进行光合作用 d.稀有气体化学性质不活泼,可用作霓虹灯中的填充气体
下列物质和氧气反应的生成物在常温下有液体的是﹙ a ﹚a.蜡烛 b.铝 c.磷 d.铁
“神舟六号”太空舱利用NiFe₂O₄将航天员呼出的CO₂转化为O₂,而NiFe₂O₄的质量和化学性质都不变,则NiFe₂O₄在该过程中是﹙ c ﹚a.反应物 b.生成物 c.催化剂 d.消毒剂
计算题
军军在实验室中学制氧气,他的任务是制出四瓶氧气,每个集气瓶的容积是250ml.那么他至少要制出多少克氧气才能将集气瓶装满?﹙提示:ρo₂=1.429g/L﹚
根据m=v×ρ,得氧气的质量为1.429×1=1.429(4个集气瓶总体积为1L)1年前查看全部
- 已知:①向KClO 3 晶体中滴加浓盐酸,产生黄绿色气体;②向NaI溶液中通入少量实验①产生的气体,溶液变黄色;③取实验
已知:①向KClO 3 晶体中滴加浓盐酸,产生黄绿色气体;②向NaI溶液中通入少量实验①产生的气体,溶液变黄色;③取实验②生成的溶液滴在淀粉KI试纸上,试纸变蓝色.下列判断正确的是( ) A.实验③说明KI被氧化 B.实验②中氧化剂与还原剂的物质的量之比为2:1 C.实验①证明Cl - 具有还原性 D.上述实验证明氧化性:ClO 3 - <Cl 2 <I 2  花殇之魇1年前1
花殇之魇1年前1 -
 silentsoun 共回答了14个问题
silentsoun 共回答了14个问题 |采纳率92.9%①向KClO 3 晶体中滴加浓盐酸,产生黄绿色气体,反应的化学方程式为:KClO 3 +6HCl=KCl+3Cl 2 ↑+3H 2 O,说明Cl - 具有还原性,氧化剂KClO 3 的氧化性大于氧化产物Cl 2 ;
②向NaI溶液中通入少量实验①产生的气体,反应的化学方程式为:Cl 2 +2NaI=2NaCl+I 2 ;氧化剂Cl 2 和还原剂NaI物质的量之比为1:2;氧化剂Cl 2 的氧化性大于氧化产物I 2 ;
③取实验②生成的溶液中含有碘单质,滴在淀粉KI试纸上,碘单质遇淀粉试纸变蓝色,说明溶液中含有碘单质;所以:
A、说明实验②生成的溶液中含有碘单质,不是试纸上的碘化钾被氧化,故A错误;
B、实验②中氧化剂与还原剂的物质的量之比为1:2,故B错误;
C、实验①反应可知能证明Cl - 具有还原性,故C正确;
D、上述实验证明氧化性:ClO 3 - >Cl 2 >I 2 ,故D错误;
故选C.1年前查看全部
- A、B、C三种短周期元素,A是地壳中含量最多的元素,B的单质是最轻的气体,C的单质通常情况下是一种黄绿色的气体,该气体常
A、B、C三种短周期元素,A是地壳中含量最多的元素,B的单质是最轻的气体,C的单质通常情况下是一种黄绿色的气体,该气体常用于自来水的杀菌消毒.请按要求填空:
(1)A的原子结构示意图为:______.
(2)B的同位素中常用于制造氢弹的是:______.
(3)用电子式表示B2A的形成过程______.
(4)写出实验室制取C的单质的化学方程式:MnO2+4HCl
MnCl2+Cl2↑+2H2O△ .MnO2+4HCl.
MnCl2+Cl2↑+2H2O△ .
(5)A,B,C组成一种有强氧化性,且有漂白性的一种物质是:______. 卡伦耶申科1年前0
卡伦耶申科1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 电镀废水斜管沉淀池出水黄绿色电镀废水斜管沉淀池出刚开始水黄绿色,现在颜色正常了,可是沉淀池给人的感觉是不够清澈,不是污泥
电镀废水斜管沉淀池出水黄绿色
电镀废水斜管沉淀池出刚开始水黄绿色,现在颜色正常了,可是沉淀池给人的感觉是不够清澈,不是污泥上泛的那种,沉淀正常,就是不清澈. mmsaraqi1年前1
mmsaraqi1年前1 -
 tazj 共回答了19个问题
tazj 共回答了19个问题 |采纳率94.7%你反应的这种情况是水的浊度高,主要是微小悬浮物没法沉淀,环.保通论坛有人就建议你挑选比较理想的聚丙烯酰胺来做絮凝剂,聚丙是有很多型号的,根据离子度的不同,其对微小悬浮物的絮凝作用有强弱.
还有你可以通过调整pH值来观察其沉淀性;通过实验选择比较理想的pH值后通过加药泵来调节.1年前查看全部
大家在问
- 1下图概括显示人体对不同性质刺激的两种反应模式.
- 2天平称量的相对误差为±0.1%,称量:(1)0.5g; (2)1g; (3)2g.试计算绝对误差各为多少
- 3因式分解计算:1-2^2+3^2-4^2+5^2-6^2+…+99^2-100^2
- 4某班级共有15名歌唱爱好者,其中男10名,女5名,现要选出3人组成一个合唱小组去参加比赛 1.若至
- 5英语作文啊!80个字,照下来就可以。
- 6我的爱好 一篇80字左右的英语作文 谢谢
- 7功用到了.自能会成功这句话用哪个词语来概括
- 8C60和金刚石是同一种物质吗?为什么不是?
- 9你想成倍增长你的词汇量吗?请仿照例词填写下表,有多少写多少.(下面所给单词为例词)
- 10“冲冠一怒为红颜”的英文解释是什么?
- 11男生人数的[2/5]相当于女生人数,是把______看作单位“1”,等量关系式是:男生人数×______=女生人数.
- 12一个面积为24平方厘米的平行四边形,底与高的比是3:2,这个平行四边行的底是多少厘米
- 13性状和相对性状的概念.
- 14已知(x-1)的平方+y+2的绝对值=0,求(5xy-2x的平方)-2(3xy-4x的平方)的值
- 15设A,B为实数且满足a^2+b^2-2a+b+2=0,求-2a除以b的平方根及4a除以b的立方根

