用铂做电极将Nacl和cuso4混合电解当通过4mol电子时两极各产生4mol气体此时混合溶液为4L求溶液的PH
 lhc79702022-10-04 11:39:541条回答
lhc79702022-10-04 11:39:541条回答
用铂做电极将Nacl和cuso4混合电解当通过4mol电子时两极各产生4mol气体此时混合溶液为4L求溶液的PH
用铂做电极将Nacl和cuso4混合电解当通过4mol电子时两极各产生1.4mol气体此时混合溶液为4L求溶液的PH
用铂做电极将Nacl和cuso4混合电解当通过4mol电子时两极各产生1.4mol气体此时混合溶液为4L求溶液的PH

已提交,审核后显示!提交回复
共1条回复
 ufoxg 共回答了19个问题
ufoxg 共回答了19个问题 |采纳率84.2%- 这个题目有错,建议你重新审视一下题目,然后我再解答.我分析一下题目错的原因.以铂做电极来电解氯化钠与硫酸铜的混合溶液:两极反应为:阳极:2Cl- - 2e- = Cl2↑,当氯离子完成析出后,由氢氧根放电,反应为:4OH- - 4e- = ...
- 1年前
相关推荐
- 串联电路中的四个电解池分别装有0.1mol/L的下列溶液,用铂做电极,接通直流电源一段时间后,溶液pH最小的是( )
串联电路中的四个电解池分别装有0.1mol/L的下列溶液,用铂做电极,接通直流电源一段时间后,溶液pH最小的是( )
A.CuCl2溶液
B.NaCl溶液
C.AgNO3溶液
D.KNO3溶液 michael5209151年前1
michael5209151年前1 -
 雨情雪松 共回答了22个问题
雨情雪松 共回答了22个问题 |采纳率81.8%解题思路:根据放电顺序确定所得溶液的溶质,根据溶质的酸碱性确定选项.阳离子的放电顺序为:Ag+>Cu2+>H+>Na+>K+,阴离子的放电顺序为:I->Br->Cl->OH-,
根据离子的放电顺序,电解各溶液的电解方程式分别为:
A、电解CuCl2溶液的电解方程式为:CuCl2
电解
.
Cu+Cl2↑,所得液体为水;
B、电解NaCl溶液的电解方程式为:2 NaCl+2H2O
电解
.
H2↑+Cl2↑+2NaOH,所得溶液为氢氧化钠溶液,呈碱性;
C、电解Ag NO3溶液的电解方程式为:4AgNO3+2H2O
电解
.
4Ag+O2↑+4HNO3,所得溶液为硝酸溶液,呈酸性;
D、电解KNO3溶液实际是电解水,2H2O
电解
.
2H2↑+O2↑,所得溶液仍是硝酸钾溶液,只是浓度增大,呈中性.
故选C.点评:
本题考点: 电解原理.
考点点评: 本题考查了电解原理,知道阴阳离子的放电顺序解本题的关键;电解电解质溶液时,电解类型有:电解水型、电解电解质型、电解电解质和水型.1年前查看全部
- 用铂做电极,电解100mL,0.4mol/L的氯化钠溶液和100mL,0.1mol/L的稀硫酸,标况下产生0.224L氯
用铂做电极,电解100mL,0.4mol/L的氯化钠溶液和100mL,0.1mol/L的稀硫酸,标况下产生0.224L氯气时
停止电解,取出电极,将两烧杯溶液混合冷却至常温,所得溶液的PH是7..怎么算?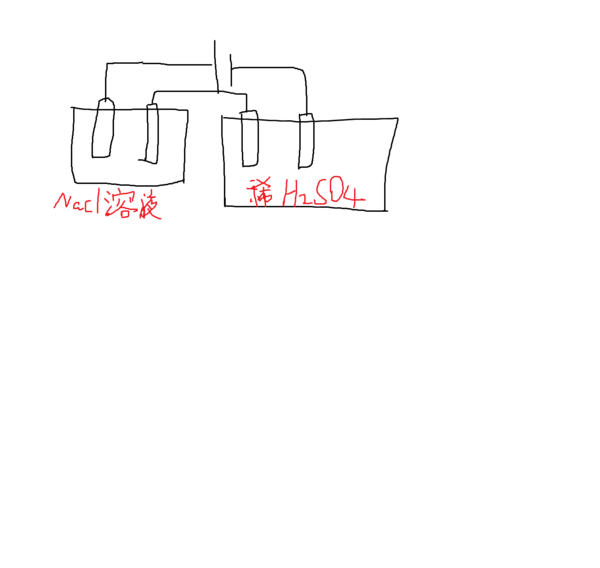
 小坭子1年前3
小坭子1年前3 -
 jiji64839 共回答了17个问题
jiji64839 共回答了17个问题 |采纳率94.1%NaCl溶液中.
阳极:2Cl- -2e ===Cl2
阴极:2H+ +2e === H2
总反应式:2NaCl + 2H2O ====2NaOH + H2 + Cl2
2mol 22.4L
x=0.02mol 0.224L
H2SO4溶液:
总反应式:2H2O ===2H2 + O2
n(H2SO4)=0.1*0.1=0.01mol
2NaOH + H2SO4 ===Na2SO4 + 2H2O
2mol 1mol
0.02mol 0.01mol
所以恰好完全反应.最后只有 Na2SO4
所得溶液的PH是71年前查看全部
- 串联电路中的四个电解池分别装有0.1mol?L-1的下列溶液,用铂做电极,接通直流电源一段时间后,溶液的pH最小的是(
串联电路中的四个电解池分别装有0.1mol?L-1的下列溶液,用铂做电极,接通直流电源一段时间后,溶液的pH最小的是( ).
A.CuCl2溶液 B.NaCl溶液
C.AgNO3溶液 D.KNO3溶液
答案选B,为什么,D错了?能写下四个电极方程吗? 声音如斯1年前1
声音如斯1年前1 -
 我rryy 共回答了16个问题
我rryy 共回答了16个问题 |采纳率93.8%A.电解CuCl2溶液:溶质减少,PH值增大,接近等于7 .B.电解NaCl溶液:产生氢氧化钠,PH值增大,大于7
C.电解AgNO3溶液:产生硝酸,PH值减小,小于7 D.电解KNO3溶液 :相当于电解水,溶液浓度增大,PH值不变,等于7 .所以选B1年前查看全部
大家在问
- 1(2012•宝应县一模)白炽灯是日常生活中最重要的光源,小明对图甲所示的白炽灯和灯口进行了仔细观察后,结合所学有关知识,
- 21.整理一批图书,由一个人做要40个小时完成,现在计划由一部分人先做4小时,由于工作劳累预计下午这部分人员工作效率将会下
- 3在一条笔直的公路上,小强和小明骑车同时从相距1500米的AB两地出发,小明每分300米,小强每分200米,几分后两人相距
- 4The old man had his______(eighty) 根据括号的提示,完成单词
- 5求救一个一元一次方程的解十分之三乘(200+X)减十分之二乘(300减X)=300乘二十五分之九是不是等于216,请把过
- 6一根长方体木料,它的横截面是边长0.4M的正方体,长是3.5M,这跟木料的体积是多少立米?
- 7从点(-4,0)向圆x^2+y^2=4x引切线,求切线长?
- 8The last man _____ the sinking ship was the captain.
- 9谁能给我推荐几首宋词 婉约派的要李清照 豪放派苏轼和辛弃疾的 大约十首
- 10某学校七年级一班一共有x人,七年级二班比七年级一班的三分之二少少十人.如果从七年级二班调出八人到七年级一班,那么调动后七
- 11彩电按原价格销售,每台获利60元;现在降价销售,结果彩电销售量增加一倍,获得的总利润增加了0.5倍,则每台彩电降价了(
- 12利用一面墙围成一个梯形花园,已知篱笆长80米,求花园的面积.
- 13\(≧▽≦)/~设x>0,求y=根号x加根号x分之一减根号(x加x分之一加一)的最大值
- 14既是陆生,又是有脊椎的动物是——
- 15为什么函数定义域是x的取值范围?
