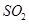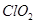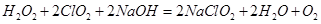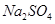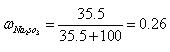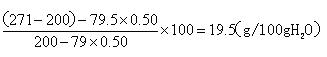漂白剂发挥作用是Ca(clo2)2或者其他偏氯酸盐与水和二氧化碳反映生成Hclo在起作用么?
 jfghfghfghhhh2022-10-04 11:39:542条回答
jfghfghfghhhh2022-10-04 11:39:542条回答就高一的知识来看

已提交,审核后显示!提交回复
共2条回复
 Marx1840 共回答了21个问题
Marx1840 共回答了21个问题 |采纳率81%- 是的
Ca(ClO)2+CO2+H2O=2HClO+CaCO3↓
即生成的HClO具有强氧化性有漂白作用 - 1年前
 qinsensanxiao 共回答了1个问题
qinsensanxiao 共回答了1个问题 |采纳率- Ca(clo2)2是漂白粉的有效成分,
漂白剂的有效成分是次氯酸钠。
但是这两种东西其实在实际反应中是通过生成次氯酸来漂白的,反应方程式:
Ca(clo)2+2H2O==Ca(OH)2+2HCLO
NaClO与色素的作用很复杂,只能对漂白原理作一般说明。 根据NaClO溶液组成的资料,产生漂白作用的有效成分可能是ClO-、HClO和Cl2,且溶液由碱性转变为酸性... - 1年前
相关推荐
- (2004•眉山二模)被称为“绿色氧化剂”的过氧化氢(H2O2)俗称双氧水,是一种无色液体,常用作无公害的消毒剂和漂白剂
(2004•眉山二模)被称为“绿色氧化剂”的过氧化氢(H2O2)俗称双氧水,是一种无色液体,常用作无公害的消毒剂和漂白剂等.在有少量催化剂的条件下,它迅速分解,生成水和氧气.某同学想探究二氧化锰是否能作过氧化氢分解的催化剂.请你设计实验的方法步骤,预测可能的实验结果等,来帮助他解决问题.
(1)方法步骤:
①在试管中加入5mL 15%的过氧化氢溶液,用______.
(2)预测可能出现的实验现象及相应的结论:
第一步现象及结论:______;
第二步的现象及结论:______.
(3)如果二氧化锰能作双氧水分解的催化剂.分离反应混合物中的MnO2,洗净、干燥、称量,其质量将______(填:增大、减小、不变);此反应化学方程式为2H2O2
2H2O+O2↑MnO2 .2H2O2.
2H2O+O2↑MnO2 . yuding861年前1
yuding861年前1 -
 503983347 共回答了25个问题
503983347 共回答了25个问题 |采纳率100%解题思路:根据氧气具有助燃性能使带火星的木条复燃以及催化剂改变其它反应的化学反应速率,本身的质量和化学性质在化学反应前后都不变进行解答.(1)氧气具有助燃性能使带火星的木条复燃.①在试管中加入5mL 15%的过氧化氢溶液,用带火星木条伸入试管内;②再加入少量二氧化锰后,用带火星木条伸入试管内;
(2)预测可能出现的实验现象及相应的结论:
第一步现象:木条没有复燃;结论:没有氧气生成;
第二步的现象木条复燃;结论:有氧气生成;
(3)如果二氧化锰能作双氧水分解的催化剂.分离反应混合物中的MnO2,洗净、干燥、称量,其质量将不变;反应化学方程式为2H2O2
MnO2
.
2H2O+O2↑.
故答案为:(1)用带火星木条伸入试管内;
②再加入少量二氧化锰后,用带火星木条伸入试管内;
(2)现象:木条没有复燃;结论:没有氧气生成;
现象:木条复燃;结论:有氧气生成;
(3)不变;2H2O2
MnO2
.
2H2O+O2↑.点评:
本题考点: 催化剂的特点与催化作用;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题要抓住催化剂的特点“一变、二不变”.即改变其它反应的化学反应速率,本身的质量和化学性质在化学反应前后都不变,就可以设计有关的实验步骤.本考点主要出现在实验题中.1年前查看全部
- 过氧化钠是强氧化剂 漂白剂 和 _剂
 女巫藏猫猫1年前1
女巫藏猫猫1年前1 -
 iceliu413 共回答了15个问题
iceliu413 共回答了15个问题 |采纳率100%供养剂1年前查看全部
- 亚氯酸钠(NaClO 2 )是一种性能优良的漂白剂,但遇酸性溶液发生分解:5HClO 2 4ClO 2 ↑+H + +C
亚氯酸钠(NaClO 2 )是一种性能优良的漂白剂,但遇酸性溶液发生分解:5HClO 2
 4ClO 2 ↑+H + +Cl - +2H 2 O。向亚氯酸钠溶液中加入盐酸,反应剧烈。若将盐酸改为硫酸,开始时反应缓慢,稍后一段时间产生气体速度较快,其原因可能是……()。
4ClO 2 ↑+H + +Cl - +2H 2 O。向亚氯酸钠溶液中加入盐酸,反应剧烈。若将盐酸改为硫酸,开始时反应缓慢,稍后一段时间产生气体速度较快,其原因可能是……()。A.逸出ClO 2 使生成物浓度降低 B.酸使亚氯酸的氧化性增强 C.溶液中的H + 起催化作用 D.溶液中的Cl - 起催化作用  蓝白蓝白1年前1
蓝白蓝白1年前1 -
 wtuxia 共回答了18个问题
wtuxia 共回答了18个问题 |采纳率94.4%D
1年前查看全部
- 被称为“绿色氧化剂”的过氧化氢(H 2 O 2 ),俗称双氧水,是一种无色液体,常用作氧化剂、消毒杀菌剂和漂白剂等.在较
被称为“绿色氧化剂”的过氧化氢(H 2 O 2 ),俗称双氧水,是一种无色液体,常用作氧化剂、消毒杀菌剂和漂白剂等.在较低温度下和少量催化剂(如MnO 2 )条件下,它能迅速分解,生成氧气和水.请回答下列问题:
(1)写出图1中标号仪器的名称:
a、______;b、______;
c、______;d、______;
(2)若实验室用过氧化氢代替氯酸钾制取氧气,可采用上面的哪种发生装置?______(填序号),主要理由是______.
(3)当过氧化氢接触二氧化锰后,反应便立即开始并不能人为控制其速度.如果稍改变你所选择的装置,便可控制其反应的速度.请从如图2的仪器中选择一种仪器更换你选择的装置中的一种仪器,以达到控制反应速度的目的.你选择的仪器是______(填序号),它更换原装置的______.控制反应速度的原理是:______.
(4)天然气、沼气的主要成分是甲烷(CH 4 ),它是无色无味的气体,密比空气小,极难溶于水,能燃烧.实验室用无水醋酸钠和碱石灰固体混合物加热制取甲烷气体. 若用此法制取甲烷气体,其气体发生装置选择______(从图1A、B、C中选择),可采用______或______收集.
 qsaei1年前1
qsaei1年前1 -
 obsidian1945 共回答了18个问题
obsidian1945 共回答了18个问题 |采纳率88.9%(1)熟悉常见仪器,了解它们的名称.仪器分别是:酒精灯、长颈漏斗、试管、铁架台.故答案为:酒精灯、长颈漏斗、试管、铁架台;
(2)用过氧化氢制取氧气,要用二氧化锰做催化剂,在常温下反应,所以要用装置B.故答案为:B、过氧化氢在常温下(不需要加热)可以分解生成氧气;
(3)图中的分液漏斗可以使液体的滴加随开随停,从而控制反应的速度,所以要控制反应的速度,我们可用图中C代替原装置中的长颈漏斗;
故答案为:C、b、分液漏斗可以使液体的滴加随开随停;
(4)甲烷的制取是用无水醋酸钠和碱石灰的固体混合物加热制取的.也就是固体和固体的加热反应,属于“固体加热型”,所以可用装置C作为发生装置;因为甲烷的密度比空气小,极难溶于水,可用排水法和向下排空气法收集.
故答案为:C、排水法或向下排空气法(两点顺序可颠倒).1年前查看全部
- 漂白剂是Hclo还是Ca(clo)2
漂白剂是Hclo还是Ca(clo)2
这两者有什么关系 木子水缘1年前1
木子水缘1年前1 -
 tft_1981 共回答了25个问题
tft_1981 共回答了25个问题 |采纳率96%漂白剂的有效成分是Ca(clo)2.当漂白剂溶于水后,强电解质Ca(clo)2电离生成clo负离子,clo负离子与水中的氢离子结合生成Hclo,Hclo有强氧化性,是真正产生消毒作用的物质.1年前查看全部
- 臭氧可用于净化空气、饮用水消毒、处理工业废物和作为漂白剂.
臭氧可用于净化空气、饮用水消毒、处理工业废物和作为漂白剂.
(1)臭氧几乎可与除铂、金、铱、氟以外的所有单质反应.如:6Ag(s)+O3(g)═3Ag2O(g),△H=-235.8kJ•mol-1
已知:2Ag2O(s)═4Ag(g)+O2(g),△H=+62.2kJ•mol-1,则常温下反应:2O3(g)═3O2(g)的△H=______.
(2)配平下面反应的化学方程式(将各物质的化学计量数填在相应的空格内):______NaOCN+______O3
______Na2CO3+______N2+______O2+______CO2△ .
(3)科学家P•Tatapudi等人首先使用在酸性条件下电解水的方法制得臭氧,臭氧在阳极周围的水中产生,电极反应式为3H2O-6e-═O3↑+6H+,阴极附近溶解在水的氧气生成过氧化氢,其电极反应式为______.
(4)空气中臭氧的检测方法是将空气慢慢通过足量KI-淀粉溶液,若溶液变蓝色,则说明空气中含有O3,已知O3与KI溶液反应生成两种单质,则反应的化学方程式为______. 吃喝tt赌抢1年前1
吃喝tt赌抢1年前1 -
 sshbsh_fhp 共回答了19个问题
sshbsh_fhp 共回答了19个问题 |采纳率94.7%解题思路:(1)①6Ag(s)+O3(g)═3Ag2O(s),△H=-235.8kJ•mol-1,
②2Ag2O(s)═4Ag(s)+O2(g),△H=+62.2kJ•mol-1,
根据盖斯定律可知①×2+②×3可得到,2O3(g)═3O2(g),以此计算反应热;
(2)根据氧化还原反应中得失电子守恒,先配平变价的元素,再利用原子守恒平衡其它物质;
(3)阴极附近的氧气则生成过氧化氢,其电极反应式为3O2+6H++6e-═3H2O2;
(4)O3与KI溶液反应生成两种单质为O2、I2,根据元素守恒可知还生成KOH.(1)①6Ag(s)+O3(g)═3Ag2O(s),△H=-235.8kJ•mol-1,
②2Ag2O(s)═4Ag(s)+O2(g),△H=+62.2kJ•mol-1,
根据盖斯定律可知①×2+②×3可得到,2O3(g)═3O2(g),则反应热△H=(-235.8kJ•mol-1)×2+(+62.2kJ•mol-1)×3=-285kJ/mol,
故答案为:-285kJ/mol;
(2)NaOCN中N的化合价为-3价,-3价的N被氧化为0价的N2,而O3中的一个O原子被还原为O2-,则根据电子守恒可知,参加反应的NaOCN与O3的物质的量之比为2:3,再根据原子守恒可得:2NaOCN+3O3═Na2CO3+N2+3O2+CO2;
故答案为:2、3、1、1、3、1;
(3)酸性条件下电解水的方法制得臭氧,臭氧在阳极周围的水中产生,其电极反应式为3H2O-6e-═O3↑+6H+,阴极附近的氧气得电子生成过氧化氢,其电极反应式为3O2+6H++6e-═3H2O2,
故答案为:3O2+6H++6e-═3H2O2;
(4)O3与KI溶液反应生成两种单质为O2、I2,还生成KOH,该反应为O3+2KI+H2O═O2+I2+2KOH,
故答案为:O3+2KI+H2O═O2+I2+2KOH.点评:
本题考点: 臭氧;氧化还原反应方程式的配平;用盖斯定律进行有关反应热的计算;电解原理.
考点点评: 本题考查较综合,涉及热化学反应方程式、电解池、氧化还原反应方程式的配平,侧重反应原理的考查,注重知识的迁移应用,题目难度中等.1年前查看全部
- (2008•南昌一模)过氧化氢俗称双氧水,为一种易分解无色液体,常作氧化剂、漂白剂和消毒剂.为贮存、运输、使用方便,工业
(2008•南昌一模)过氧化氢俗称双氧水,为一种易分解无色液体,常作氧化剂、漂白剂和消毒剂.为贮存、运输、使用方便,工业上将H2O2转化为固体的过碳酸钠(化学式为:2Na2CO3•3H2O2),该晶体具有Na2CO3和H2O2的双重性质.下列物质不会使通过碳酸晶体失效变质的是( )
A.K2S
B.NaHCO3
C.稀HCl
D.MnO2 nan631年前1
nan631年前1 -
 武汉二曜路 共回答了25个问题
武汉二曜路 共回答了25个问题 |采纳率88%解题思路:根据题意可知,固态的过碳酸钠晶体具有碳酸钠和过氧化氢的双重性质,考虑到碳酸钠能够和酸反应,而过氧化氢能在二氧化锰的催化下分解,所以可以据这两种物质的性质来答题.A、硫化钾具有还原性,能被双氧水氧化,会导致过碳酸钠晶体变质,故A错误;
B、碳酸氢钠不会和碳酸钠及过氧化氢反应,所以碳酸氢钠不会导致过碳酸钠晶体变质,故B正确;
C、稀盐酸能够和碳酸钠反应生成二氧化碳,所以盐酸会导致过碳酸钠晶体变质,故C错误;
D、过氧化氢遇到而二氧化锰会在二氧化锰的催化之下发生分解反应,所以会导致过碳酸钠晶体变质,故D错误;
故选:D.点评:
本题考点: 钠的重要化合物.
考点点评: 本题主要考查了碳酸盐及过氧化氢的性质,要求熟练掌握过氧化氢和碳酸钠的性质,然后利用它们的性质来正确的解答该题.1年前查看全部
- (2010•启东市模拟)过碳酸钠是一种有多用途的新型氧系漂白剂,化学式可表示为aNa2CO3•bH2O2.现将一定质量的
(2010•启东市模拟)过碳酸钠是一种有多用途的新型氧系漂白剂,化学式可表示为aNa2CO3•bH2O2.现将一定质量的过碳酸钠粉末溶于水配成稀溶液,再向其中加入适量MnO2粉末,充分反应后生成672mL气体(标准状况).反应后的混合物经过滤、洗涤后,将滤液和洗涤液混合并加水配成100mL溶液A.现向三份体积为10mL、浓度为cmol/L的稀硫酸中分别逐滴滴入溶液A,边滴边振荡,充分反应后,测得实验数据如下表所示:
(1)计算稀硫酸的物质的量浓度.实验序号 Ⅰ Ⅱ Ⅲ 滴加溶液A的体积/mL 10.0 20.0 30.0 生成气体的体积/mL(标准状况) 89.6 179.2 224
(2)通过计算确定过碳酸钠的化学式.
(3)工业上常以所含活性氧的质量分数[w(活性氧)=
×100%]来衡量过碳酸钠产品的优劣,13%以上者为优等品.现将0.2g某厂家生产的过碳酸钠样品(所含杂质不参与后面的氧化还原反应)溶于水配成溶液,加入15.0mL 1mol/L硫酸,再加入足量KI,摇匀后置于暗处,充分反应后,加入少量淀粉试液,用0.1mol/L Na2S2O3溶液滴定到蓝色恰好消失时,共消耗30.00mL,试计算判断该样品是否为优等品.(已知:2Na2S2O3+I2→Na2S4O6+2NaI)16n(H2O2) m(样品)  zazhi1年前1
zazhi1年前1 -
 yzjjkfq 共回答了17个问题
yzjjkfq 共回答了17个问题 |采纳率82.4%解题思路:(1)由图表可知,第三份稀硫酸完全反应,根据碳酸钠和稀硫酸反应的化学方程式以及生成的气体的体积即可计算出稀硫酸的物质的量,然后求出稀硫酸的物质的量浓度;
(2)分别求出碳酸钠和双氧水的物质的量即可;
(3)根据2I-+H2O2+2H+=I2+2H2O,2Na2S2O3+I2→Na2S4O6+2NaI可知n(H2O2)=
.n(Na2S2O3) 2 (1)设稀硫酸的物质的量为x,
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
1 22.4L/mol
x 0.224L
[1/X ]=[22.4L/mol/0.224L]
解之得:x=0.01mol,
稀硫酸的物质的量浓度为:C=[n/V]=[0.01mol/0.01L]=1 mol/L,
答:稀硫酸的物质的量浓度为1mol/L;
(2)n(O2)=[0.672L/22.4L/mol]=0.03mol,n(H2O2)=0.06mol,由实验Ⅰ中数据可知,10mLA溶液中:n(Na2CO3)=n(CO2)=0.004 mol,所以100mLA中含有0.04molNa2CO3,n(Na2CO3):n(H2O2)=0.04:0.06=2:3
所以化学式为2Na2CO3•3H2O2(用实验Ⅰ中数据也得分),
答:过碳酸钠的化学式为2Na2CO3•3H2O2;
(3)根据2I-+H2O2+2H+=I2+2H2O,2Na2S2O3+I2→Na2S4O6+2NaI可知:n(H2O2)=
n(Na2S2O3)
2=[0.1mol/L×0.030L/2]=1.5×10-3mol,
该过碳酸钠的活性氧的质量分数为:
1.5×10 −3×16
0.2=12%<13%,所以该样品不是优等品,
答:该样品不是优等品.点评:
本题考点: 复杂化学式的确定.
考点点评: 本题考查根据化学方程式的计算,难度较大,注意弄清楚方程式中各物质的量的关系是解题的关键.1年前查看全部
- 下列说法正确的是( )A.SO2具有漂白性,能使品红溶液和KMnO4褪色且常作食品的漂白剂B.活性炭、胶体、H2O2、
下列说法正确的是( )
A.SO2具有漂白性,能使品红溶液和KMnO4褪色且常作食品的漂白剂
B.活性炭、胶体、H2O2、O3等都有漂白性
C.次氯酸盐只有在酸性环境中才有漂白性
D.Na2O2也有漂白性,其漂白原理和SO2相似 点上一枝烟1年前1
点上一枝烟1年前1 -
 我的羊羊我的太阳 共回答了25个问题
我的羊羊我的太阳 共回答了25个问题 |采纳率92%解题思路:A.SO2与KMnO4发生氧化还原反应,与漂白性无关,且不能用二氧化硫漂白食品;
B.活性炭、胶体具有吸附性,H2O2、O3等具有强氧化性,均可用于漂白;
C.次氯酸盐本身具有强氧化性,则具有漂白性;
D.Na2O2的漂白性与强氧化性有关,而SO2的漂白性与化合反应有关.A.SO2与KMnO4发生氧化还原反应,与漂白性无关,二氧化硫使品红褪色与漂白性有关,但二氧化硫有毒且不能用二氧化硫漂白食品,故A错误;
B.活性炭、胶体具有吸附性,H2O2、O3等具有强氧化性,均可用于漂白,但漂白原理不同,故B正确;
C.次氯酸盐本身具有强氧化性,则具有漂白性,在酸性条件下漂白效果更好些,故C错误;
D.Na2O2的漂白性与强氧化性有关,而SO2的漂白性与化合反应有关,二者漂白原理不同,故D错误;
故选B.点评:
本题考点: 二氧化硫的化学性质;氯、溴、碘及其化合物的综合应用;过氧化氢;钠的重要化合物.
考点点评: 本题考查二氧化硫的性质及漂白性,为高频考点,把握常见的具有漂白性的物质及漂白原理为解答的关键,注意归纳分类总结,明确有毒物质不能用于食品漂白,题目难度不大.1年前查看全部
- Cl2是纺织工业中常用的漂白剂,Na2S2O3可作漂白布匹后的“脱氯剂”.脱氯反应为S2O32-+Cl2+H2O→SO4
Cl2是纺织工业中常用的漂白剂,Na2S2O3可作漂白布匹后的“脱氯剂”.脱氯反应为S2O32-+Cl2+H2O→SO42-+Cl-+H+(未配平).下列对该反应的说法不正确的是( )
A.反应中硫元素发生了氧化反应
B.脱氯反应后的溶液显酸性
C.根据该反应可判断还原性:S2O32->Cl-
D.反应中每脱去1mol Cl2会生成1mol SO42- 嘈嘈切切错杂弹1年前1
嘈嘈切切错杂弹1年前1 -
 龙呱呱 共回答了17个问题
龙呱呱 共回答了17个问题 |采纳率64.7%解题思路:S2O32-+Cl2+H2O→SO42-+Cl-+H+中,S元素的化合价由+2价升高为+6价,Cl元素的化合价由0降低为-1价,以此来解答.A.S元素的化合价升高,发生氧化反应,故A正确;
B.由反应可知生成氢离子,酸性增强,故B正确;
C.由还原剂的还原性大于还原产物的还原性可知,还原性:S2O32->Cl-,故C正确;
D.反应中每脱去1mol Cl2会转移2mol电子,由电子守恒可知生成
2mol
2×(6−2)=0.25mol SO42-,故D错误;
故选D.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子的考查,题目难度不大.1年前查看全部
- (1)臭氧可用于净化空气、饮用水消毒、处理工业废物和作为漂白剂。
(1)臭氧可用于净化空气、饮用水消毒、处理工业废物和作为漂白剂。
①臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。如:
6Ag(s)+O 3 (g)=3Ag 2 O(s);△H=-235.8 kJ/mol。
己知:2 Ag 2 O(s)=4Ag(s)+O 2 (g);△H=+62.2kJ/mol,则O 3 转化为O 2 的热化学方程式为 ;②科学家P.Tatapudi等人首先使用在酸性条件下电解水的方法制得臭氧。臭氧在阳极周围的水中产生,阴极附近的氧气则生成过氧化氢,阴极电极反应式为 。时间/min浓度(mol/L) NO N 2 CO 2 0 1.00 0 0 10 0.58 0.21 0.21 20 0.40 0·30 0.30 30 0.40 0.30 0.30 40 0.32 0.34 0.17 50 0.32 0.34 0.l7
(2)用活性炭还原法处理氮氧化物,有关反应为: C(s)+2NO(g) N 2 (g)+CO 2 (g)。某研究小组向某密闭的真空容器(假设容器体积不变,固体试样体积忽略不计)中加入NO和足量的活性炭,恒温(T 1 ℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N 2 (g)+CO 2 (g)。某研究小组向某密闭的真空容器(假设容器体积不变,固体试样体积忽略不计)中加入NO和足量的活性炭,恒温(T 1 ℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
①10 min~20 min以内v(CO 2 )表示的反应速率为
②根据表中数据,计算T 1 ℃时该反应的平衡常数K= (保留两位小数);
③下列各项能作为判断该反应达到平衡状态的是 (填序号字母);
A.容器内压强保持不变
B.2v 正 (NO)=v 逆 (N 2 )
C.容器内CO 2 的体积分数不变
D.混合气体的密度保持不变
④30 min时改变某一条件,反应重新达到平衡,则改变的条件可能是 ;
⑤一定温度下,随着NO的起始浓度增大,则NO的平衡转化赞
共回答了16个问题采纳率:100% 举报
(1)①2O 3 (g)=3O 2 (g) △H=-285kJ/mol (2分)②2H + +O 2 +2e - =H 2 O 2 (2分)
(2)①0.009mol/(L•min)(没写单位不给分,2分)1年前
4可能相似的问题-
1年前1个回答
-
1年前1个回答
-
1年前1个回答
-
1年前1个回答
-
1年前3个回答
-
1年前5个回答
-
二氧化氯处理在水处理方面和人员消毒有哪些注意事项是饮用水消毒
1年前1个回答
-
1年前1个回答
-
1年前5个回答
你能帮帮他们吗
Copyright © 2022 YULUCN.COM - 雨露学习互助 - 17 q. 0.067 s. - webmaster@yulucn.com hyhhgg1年前1
hyhhgg1年前1 -
-
 97453efe140235ba 共回答了16个问题
97453efe140235ba 共回答了16个问题 |采纳率100%(1)①2O 3 (g)=3O 2 (g) △H=-285kJ/mol (2分)②2H + +O 2 +2e - =H 2 O 2 (2分)
(2)①0.009mol/(L•min)(没写单位不给分,2分)1年前查看全部
- 下列叙述正确的是 [ ] A. 具有还原性,故可作漂白剂
下列叙述正确的是 [ ]A.  具有还原性,故可作漂白剂
具有还原性,故可作漂白剂
B.Na的金属活性比Mg强,故可用Na与MgCl 2 溶液反应制Mg
C.浓硝酸中的 见光分解,故有时在实验室看到的浓硝酸呈黄色
见光分解,故有时在实验室看到的浓硝酸呈黄色
D.Fe在Cl 2 中燃烧生成FeCl 3 ,故在与其他非金属反应的产物中的Fe也显+3价 王普通1年前1
王普通1年前1 -
 忻然而视 共回答了19个问题
忻然而视 共回答了19个问题 |采纳率89.5%C1年前查看全部
- 过碳酸钠是一种有多用途的新型氧系漂白剂
 智勇1年前1
智勇1年前1 -
 小猪爱生活 共回答了14个问题
小猪爱生活 共回答了14个问题 |采纳率92.9%主要用作漂白剂和氧化剂,以及化工、造纸、纺织、染整、食品、医药、卫生等部门的去污剂、清洗剂、杀菌剂.其他的用途与过硼酸钠似,可代替过硼酸钠以节约硼盐.1年前查看全部
- 氧化性和漂白性的关系为什么同具有强氧化性 为什么有的可做漂白剂 有的却不行?我想知道的是 为什么有的物质能因强氧化性而具
氧化性和漂白性的关系
为什么同具有强氧化性 为什么有的可做漂白剂 有的却不行?
我想知道的是 为什么有的物质能因强氧化性而具有漂白性 有的物质却不能因强氧化性具有漂白性 到底是它们的强氧化性不同 还是 针对的物质不一样?
不是问强氧化剂能成为 漂白剂的原因 问的是原因 不是问例子 blueskyfr1年前4
blueskyfr1年前4 -
 蚁38 共回答了24个问题
蚁38 共回答了24个问题 |采纳率79.2%氧化性与漂白性没有直接的关系.所以这两个性质不能混着讨论.1年前查看全部
- 汶川发生特大地震后,为防止疫病流行,全国各地向灾区运送了大量的消毒剂、漂白剂等.过碳酸钠是一种有多用途的新型固态漂白剂,
汶川发生特大地震后,为防止疫病流行,全国各地向灾区运送了大量的消毒剂、漂白剂等.过碳酸钠是一种有多用途的新型固态漂白剂,化学式可表示为Na2CO3•3H2O2,它具有Na2CO3和H2O2的双重性质.过碳酸钠与下列物质均会发生化学反应而失效,其中过碳酸钠只发生了氧化反应的是______(填序号);
A.稀硫酸 B.KMnO4溶液C.稀盐酸D.Na2SO3溶液
漂白剂亚氯酸钠(NaClO2)在常温与黑暗处可保存一年,但亚氯酸不稳定可分解,反应的离子方程式为:HClO2→ClO2↑+H++Cl-+H2O(未配平).当1mol HClO2发生分解反应时,转移的电子数是______. 650252081年前1
650252081年前1 -
 angglli 共回答了15个问题
angglli 共回答了15个问题 |采纳率86.7%解题思路:Na2CO3•3H2O2具有Na2CO3和H2O2的双重性质,过碳酸钠只发生了氧化反应,表现为还原性;
HClO2中Cl元素化合价为+3价,ClO2中Cl元素化合价为+4价,化合价升高1价,结合化合价变化计算转移电子数.A.稀硫酸与过碳酸钠反应生成二氧化碳气体,没有发生氧化还原反应,故A不选;
B.KMnO4溶液与过碳酸钠发生氧化还原反应,被氧化,过碳酸钠表现出还原性,故B选;
C.盐酸和过碳酸钠反应生成二氧化碳气体,没有发生氧化还原反应,故C不选;
D.Na2SO3溶液与过碳酸钠发生氧化还原反应,过碳酸钠表现出氧化性,故D不选.
HClO2中Cl元素化合价为+3价,ClO2中Cl元素化合价为+4价,化合价升高1价,变化为Cl-化合价降低4价,4HClO2~4ClO2~4e-,HClO2~Cl-~4e-,5molHClO2反应转移的电子为4mol,当1mol HClO2发生分解反应时,转移的电子为0.8mol,电子数为0.8NA,
故答案为:B;0.8NA.点评:
本题考点: 氧化还原反应;氧化还原反应的电子转移数目计算.
考点点评: 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析能力和氧化还原反应转移电子数的考查,题目难度不大.1年前查看全部
- (20中3•槐荫区三模)漂白粉的主要成分为次氯酸钙[Ca(ClO)2]和氯化钙,即可用作漂白剂,又可用作消毒剂.漂白粉中
(20中3•槐荫区三模)漂白粉的主要成分为次氯酸钙[Ca(ClO)2]和氯化钙,即可用作漂白剂,又可用作消毒剂.漂白粉中有效成分是Ca(ClO)2,漂白的原理是Ca(ClO)2在空气中发生反应Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO;次氯酸(HClO)是一种酸性比盐酸弱的酸,不稳定,具有漂白性,能使部分有色物质褪色.请回答下列问题:
(中)次氯酸钙是一种______(填“氧化物”“酸”“碱”“盐”之一).
(2)HClO在常温下分解,反应方程式为2HClO=2HCl+O2↑.某瓶HClO溶液放置一段时间后,溶液的pH______(填“增大”“减右”“不变”之一).在HClO中氯元素的化合价是______价.
(3)在漂白粉中滴加盐酸生成一种盐和次氯酸.写出漂白粉中加入盐酸反应的化学方程式______. 去去11年前1
去去11年前1 -
 三生六世 共回答了19个问题
三生六世 共回答了19个问题 |采纳率84.2%解题思路:(1)酸是电离时电离出的阳离子全部是氢离子的化合物;碱是电离时电离出的阴离子全部是氢氧根离子的化合物;盐是由金属阳离子(铵根离子)和酸根阴离子组成的化合物;氧化物是指由两种元素组成,其中一种为氧元素的化合物;
(2)根据次氯酸分解的产物结合题中信息考虑;根据在化合物中正负化合价代数和为零,结合次氯酸(HClO)的化学式进行解答;
(3)根据题中信息结合化学方程式的写法考虑.(1)次氯酸钙是由钙离子和次氯酸根离子组成的化合物,属于盐;
(2)由次氯酸分解的生成物中含有盐酸,根据题中信息可知盐酸的酸性比次氯酸强,因此某瓶HClw溶液放置一段时间后,酸性增强,即溶液的pH减小;
根据在化合物中正负化合价代数和为零,氢元素显+1,氧元素显-2,设氯元素的化合价是x,可知次氯酸(HClw)中氯元素的化合价:(+1)+x+(-2)=s,则x=+1;
(3)漂白粉中加入盐酸反应的反应物是次氯酸钙和盐酸,生成物是氯化钙和次氯酸,反应的化学方程式是Ca(Clw)2+2HCl=CaCl2+2HClw.
故答案为:(1)盐;(2)减小;+1;(3)Ca(Clw)2+2HCl=CaCl2+2HClw.点评:
本题考点: 常见的氧化物、酸、碱和盐的判别;溶液的酸碱性与pH值的关系;有关元素化合价的计算;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题难度不大,掌握物质的分类知识,知道酸性越强pH越小;知道方程式写法:一写二配三注明四等号是解题的关键所在.1年前查看全部
- (14分) 亚氯酸钠(NaClO 2 )主要用于棉纺、造纸业的漂白剂,也用于食品消毒、水处理等,亚氯酸钠受热易
(14分) 亚氯酸钠(NaClO 2 )主要用于棉纺、造纸业的漂白剂,也用于食品消毒、水处理等,亚氯酸钠受热易分解。以
 氯酸钠等为原料制备亚氯酸钠的工艺流程如下:
氯酸钠等为原料制备亚氯酸钠的工艺流程如下: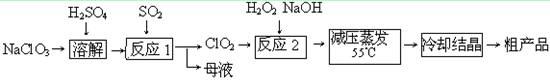
(1)提高“反应1”反应速率的措施有_________________、___________等。
(2)“反应2”的的氧化剂是_________,该反应的化学方程式为_____________。
(3)采取“减压蒸发”而不用“常压蒸发”,原因是______________________。
(4)从“母液”中可回收的主要物质是_________。
(5)“冷却结晶”后经______________(填操作名称)即可获得粗产品。 没有墙的城1年前1
没有墙的城1年前1 -
 玉面玲珑透 共回答了18个问题
玉面玲珑透 共回答了18个问题 |采纳率77.8%1年前查看全部
- (2011•顺义区一模)生活中用到各种漂白剂.化学课上,老师带来一种常用漂白剂的物质,可能是双氧水(H2O2)、过碳酸钠
 (2011•顺义区一模)生活中用到各种漂白剂.化学课上,老师带来一种常用漂白剂的物质,可能是双氧水(H2O2)、过碳酸钠(2Na2CO3•3H2O2)和过氧化钙(CaO2)中的一种.同学们观察发现,该漂白剂为白色粉末(如图).
(2011•顺义区一模)生活中用到各种漂白剂.化学课上,老师带来一种常用漂白剂的物质,可能是双氧水(H2O2)、过碳酸钠(2Na2CO3•3H2O2)和过氧化钙(CaO2)中的一种.同学们观察发现,该漂白剂为白色粉末(如图).
【提出猜想】该漂白剂肯定不是H2O2H2O2.
【查阅资料】①过碳酸钠是一种白色结晶颗粒,溶于水时,分解生成碳酸钠和过氧化氢.
②过氧化氢常温下不稳定,实验室用过氧化氢制取氧气的化学方程式为2H2O2
2H2O+O2↑2H2O2MnO2 .
2H2O+O2↑.MnO2 .
③过氧化钙,白色固体,难溶于水.与水反应缓慢释放氧气,同时生成一种碱,反应的化学方程式为2CaO2+2H2O=2Ca(OH)2+O2↑2CaO2+2H2O=2Ca(OH)2+O2↑.
【实验验证】同学们设计了下列实验方案进行验证,请将方案的空格填写完整.
【交流反思】小刚认为根据步骤1可确定白色固体的成分,不需要后两步实验,理由是溶液浑浊,说明该漂白剂难溶于水,而过氧化钙难溶于水,过碳酸钠能溶于水,说明该漂白剂是过氧化钙溶液浑浊,说明该漂白剂难溶于水,而过氧化钙难溶于水,过碳酸钠能溶于水,说明该漂白剂是过氧化钙.小强认为不行,小强反对的理由是一定量的水中固体不完全溶解,可能是因为固体不溶,也可能是因为水量不足,溶解达到饱和,所以不能确定是过氧化钙.一定量的水中固体不完全溶解,可能是因为固体不溶,也可能是因为水量不足,溶解达到饱和,所以不能确定是过氧化钙..实验步骤 实验操作 实验现象 结论 步骤1 取2g白色固体放入试管中,加入5ml水,充分振荡. 液体浑浊,
有持续的细小气泡冒出.步骤2 向步骤1的试管中继续滴加无色酚酞. 无色酚酞变红. 步骤3 向试管中滴加稀盐酸,将产生的气体通入澄清石灰水向试管中滴加稀盐酸,将产生的气体通入澄清石灰水. 溶液红色消失,有气泡产生,澄清石灰水不变浑浊溶液红色消失,有气泡产生,澄清石灰水不变浑浊. 该消毒剂的成分不是过碳酸钠.  wswf10911年前1
wswf10911年前1 -
 张海清1986 共回答了15个问题
张海清1986 共回答了15个问题 |采纳率80%提出猜想:过氧化氢是液体,而所给的物质是固体,所以不可能是过氧化氢.故本题答案为:H2O2
查阅资料:②直接写出化学方程式 2H2O2
MnO2
.
2H2O+O2↑
③实验验证:根据实验结论该消毒剂不是碳酸钠,我们可以设计验证碳酸钠的实验及结论,
故本题答案为:
实验步骤 实验操作 实验现象 结论
步骤1 取2g白色固体放入试管中,加入5ml水,充分振荡. 液体浑浊,
有持续的细小气泡冒出.
步骤2 向步骤1的试管中继续滴加无色酚酞. 无色酚酞变红.
步骤3 向试管中滴加稀盐酸,将产生的气体通入澄清石灰水
. 溶液红色消失,有气泡产生,澄清石灰水不变浑浊
. 该消毒剂的成分不是过碳酸钠.交流反思:氧化钙难溶于水,过碳酸钠能溶于水,说明该漂白剂是过氧化钙,但是考虑到如果水的量不足固体液体也溶解不了,所以必须排除水的量不足的情况,故本题答案为:小刚:溶液浑浊,说明该漂白剂难溶于水,而过氧化钙难溶于水,过碳酸钠能溶于水,说明该漂白剂是过氧化钙.
小强:一定量的水中固体不完全溶解,可能是因为固体不溶,也可能是因为水量不足,溶解达到饱和,所以不能确定是过氧化钙.1年前查看全部
- 亚氯酸钠(NaClO2)可用作漂白剂,在酸性溶液中因生成亚氯酸而发生分解,分解的化学方程式为5HClO2=4ClO2↑+
亚氯酸钠(NaClO2)可用作漂白剂,在酸性溶液中因生成亚氯酸而发生分解,分解的化学方程式为5HClO2=4ClO2↑+HCl+2H2O,ClO2是广谱型消毒剂.下列说法正确的是( )
A.HClO2是有机酸
B.上述反应中,ClO2是还原产物
C.上述反应中,1 mol HClO2分解转移2 mol电子
D.上述反应中,氧化剂与还原剂物质的量之比为1:4 zyk2181年前1
zyk2181年前1 -
 51smzgbbs 共回答了22个问题
51smzgbbs 共回答了22个问题 |采纳率90.9%解题思路:5HClO2=4ClO2↑+HCl+2H2O中,Cl元素的化合价由+3价升高为+4价,Cl元素的化合价由+3价降低为-1价,以此来解答.A.HClO2中没有碳元素,不是有机物,属于无机酸,故A错误;
B.Cl元素的化合价升高被氧化,则ClO2是氧化产物,故B错误;
C.由反应可知,5mol HClO2分解转移4mol电子,则1mol HClO2分解转移[4/5]mol电子,故C错误;
D.由反应可知,5mol HClO2分解时,4mol作还原剂与1mol作氧化剂的得失电子相等,则氧化剂与还原剂物质的量之比为1:4,故D正确;
故选D.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子的考查,注意元素化合价判断,题目难度不大.1年前查看全部
- 亚硫酸钠用途广泛,可作漂白剂、显影剂、防护剂等.近年来,以SO2、NH3和NaCl为原料生产无水亚硫酸钠的新
亚硫酸钠用途广泛,可作漂白剂、显影剂、防护剂等.近年来,以SO2、NH3和NaCl为原料生产无水亚硫酸钠的新
亚硫酸钠用途广泛,可作漂白剂、显影剂、防护剂等.近年来,以SO2、NH3和NaCl为原料生产无水亚硫酸钠的新方法得到发展.生产流程如图1所示: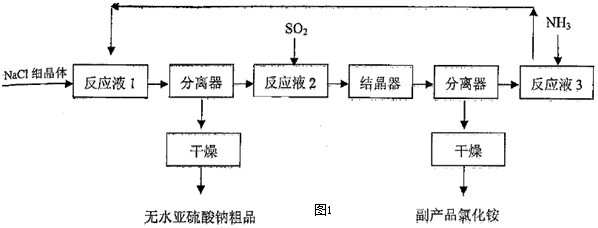
(1)中学化学实验室实现上述流程中“分离器”作用的操作名称是:______;所需玻璃仪器有______.
(2)“反应液1”是由SO2通入14.8%氨水形成的亚硫酸铵溶液,在60℃~80℃时,不断搅拌,加入NaCl细晶体,就有无水亚硫酸钠析出,析出无水亚硫酸钠的离子反应方程式为______.
(3)在“反应液2”通入足量SO2后,溶液中的阴离子除OH-外还有______;在“反应液3”中通入足量NH3的目的是:______.
(4)该生产方法的原料利用率(每制100g无水亚硫酸钠,各物质的消耗量及副产品物量)如表格:
副产品NH4Cl的理论值a为:______;它与NH4Cl实际值有差别的可能原因是:______.原料 理论值 实际值 利用率 SO2 50.79 54.4 93.36% NaCl 92.86 101.0 91.94% NH3 26.98 30.5 88.46% 副产品NH4Cl a 87.1 --------
(5)无水亚硫酸钠粗品常用重结晶的方法进行精制,请完善能实现物料循环的精制亚硫酸钠操作的流程图(如图2所示).
 宁德师专1年前1
宁德师专1年前1 -
 六日恋 共回答了14个问题
六日恋 共回答了14个问题 |采纳率85.7%(1)流程中“分离器”作用是分离固体和液体,所以操作名称是:过滤;根据过滤操作可知所需玻璃仪器有漏斗、烧杯、玻璃棒;
故答案为:过滤;漏斗、烧杯、玻璃棒;
(2)亚硫酸铵与NaCl生成晶Na2SO3体,所以析出无水亚硫酸钠的离子反应方程式为2Na++SO32-=Na2SO3↓;
故答案为:2Na++SO32-=Na2SO3↓;
(3)通入足量SO2后有亚硫酸氢根生成,已知原溶液中有Cl-,所以在“反应液2”通入足量SO2后,溶液中的阴离子除OH-外还有HSO3-、Cl-;在“反应液3”中通入足量NH3把HSO3-转化为SO32-,然后循环到“反应液1”与NaCl反应生成无水亚硫酸钠晶体;
故答案为:HSO3-、Cl-;补充氨使溶液中的HSO3-转化为SO32-;
(4)生成NH4Cl的反应方程为:(NH4)2SO3+2NaCl=Na2SO3↓+2NH4Cl;已知消耗NaCl的理论值为92.86g,
则 NaCl~NH4Cl
58.5 53.5
92.86g ag
即[58.5/92.86g]=[53.5/ag],解得a=84.92g,由于产品中可能含有杂质,所以理论值比实际值要小;
故答案为:84.92g;NH4Cl实际值偏高,可能产品中含有杂质;
(5)重结晶的实验操作为:将样品加水溶解,然后蒸发浓缩、冷却结晶,再过滤,干燥,得到较纯的晶体,所以精制亚硫酸钠操作的流程图为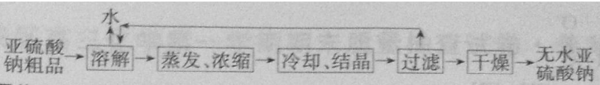
故答案为: .
1年前查看全部
.
1年前查看全部
- (2013•河东区二模)某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究.
(2013•河东区二模)某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究.
实验I:制取NaClO2晶体
己知:NaClO2饱和溶液在温度低于38℃时析出品体是NaClO2•3H2O,高于38℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl.利用如图所示装置进行实验.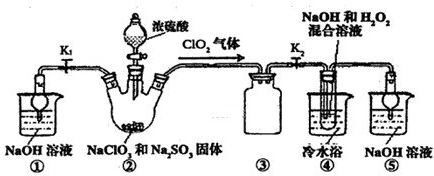
(1)装置③的作用是______;装置①的作用是______.
(2)装置②中产生ClO2的还原剂是______;装置④中制备ClO2的化学方程式为______.
(3)从装置④反应后的溶液获得NaClO2晶体的操作步骤为:①减压,55℃蒸发结晶:②趁热过滤;③______;④低于60℃干燥,得到成品.
实验Ⅱ:测定某亚氯酸钠样品的纯度.
设计如下实验方案,并进行实验:
①准确称取所得亚氯酸钠样品小打烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO2-+4I-+4H+═2H2O+2I2+Cl-).将所得混合液配成250mL待测溶液.
②移取25.00mL待测溶液于锥形瓶中,加几滴淀粉溶液,用c mol•L-1 Na2S2O3标准液滴定,至滴定终点.重复2次,测得平均值为V mL(已知:I2+2S2O32-═2I-+S4O62-).
(4)达到滴定终点时的现象为______.
(5)该样品中NaClO2的质量分数为[22.625cV/m]%[22.625cV/m]%(用含m、c、V的代数式表示).
(6)在滴定操作正确无误的情况下,此实验测得结果偏高,原因用离子方程式表示为______. 逆水潇潇1年前1
逆水潇潇1年前1 -
 指北轩谈命 共回答了26个问题
指北轩谈命 共回答了26个问题 |采纳率88.5%解题思路:(1)装置④中气体反应,装置内压强降低,装置③防止倒吸;
装置中有未反应的ClO2,装置①可以吸收ClO2,防止逸出污染空气;
(2)亚硫酸钠具有还原性,在反应中作还原剂;
装置④反应后的溶液获得NaClO2晶体,故装置④中生成NaClO2,Cl元素的化合价降低,双氧水应表现还原性,有氧气生成,结合原子守恒可知,还有水生成,配平书写方程式;
(3)从溶液中制取晶体,一般采用蒸发结晶、过滤、洗涤、干燥的方法,注意温度控制;
(4)反应结束时,碘反应完全,滴加最后一滴液体时溶液由蓝色变为无色且半分钟内不变色,说明到达滴定终点;
(5)根据关系式NaClO2~2I2~4S2O32-进行计算;
(6)实验测得结果偏高,说明滴定消耗的Na2S2O3标准液体积偏高,溶液中碘的含量偏高,应是生成的碘离子被氧气氧化为碘所致.(1)装置④中气体反应,装置内压强降低,装置③防止倒吸;装置中有未反应的ClO2,装置①可以吸收未反应的ClO2,防止逸出污染空气;
故答案为:防止倒吸;吸收未反应的ClO2,防止逸出污染空气;
(2)亚硫酸钠具有还原性,在反应中作还原剂;
装置④反应后的溶液获得NaClO2晶体,故装置④中生成NaClO2,Cl元素的化合价降低,双氧水应表现还原性,有氧气生成,结合原子守恒可知,还有水生成,配平后方程式为:2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2,
故答案为:Na2SO3;2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2;
(3)从溶液中制取晶体,一般采用蒸发结晶、过滤、洗涤、干燥的方法,为防止析出晶体NaClO2•3H2O,应趁热过滤,由题目信息可知,应控制温度38℃~60℃进行洗涤,低于60℃干燥,
故答案为:用38℃~60℃热水洗涤;
(4)碘遇淀粉变蓝色,反应结束时,碘反应完全,滴加最后一滴Na2S2O3标准液时溶液由蓝色变为无色且半分钟内不变色,说明到达滴定终点,
故答案为:滴加最后一滴Na2S2O3标准液时溶液由蓝色变为无色且半分钟内不变色,说明到达滴定终点;
(5)令样品中NaClO2的质量分数为a,则:
NaClO2~2I2~4S2O32-
90.5g 4mol
magc mol•L-1×V×10-3L×[250mL/25mL]
所以90.5g:mag=4mol:c mol•L-1×V×10-3L×[250mL/25mL]
解得a=[22.625cV/m]%,
故答案为:[22.625cV/m]%;
(6)实验测得结果偏高,说明滴定消耗的Na2S2O3标准液体积偏高,溶液中碘的含量偏高,应是生成的碘离子被氧气氧化为碘,同时生成水,反应离子方程式为4I-+O2+4H+=2I2+2H2O,
故答案为:4I-+O2+4H+=2I2+2H2O.点评:
本题考点: 氯、溴、碘及其化合物的综合应用;探究物质的组成或测量物质的含量;制备实验方案的设计.
考点点评: 本题考查物质的制备、对信息的利用、对装置的理解、氧化还原反应滴定等,理解原理是解题的关键,同时考查学生分析问题、解决问题的能力,难度较大,注意氧化还原反应滴定中利用关系式进行的计算.1年前查看全部
- 石灰石 水 氯气怎么制漂白剂
 大梦方觉1年前1
大梦方觉1年前1 -
 温先生 共回答了17个问题
温先生 共回答了17个问题 |采纳率94.1%CaCO3=加热=CaO+CO2↑
CaO+H2O=Ca(OH)2
2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O1年前查看全部
- (2007•滨湖区二模)过氧化氢(H2O2)是一种无色粘稠液体,易分解为水和氧气,常用作氧化剂、漂白剂和消毒剂,为了贮存
(2007•滨湖区二模)过氧化氢(H2O2)是一种无色粘稠液体,易分解为水和氧气,常用作氧化剂、漂白剂和消毒剂,为了贮存、运输、使用的方便,工业上将过氧化氢转化为固态的过碳酸钠晶体(2Na2CO3•3H2O2),该晶体具有碳酸钠和过氧化氢的双重性质.接触下列物质不会使过碳酸钠失效的是( )
A.红砖粉末
B.氯化钠
C.氢氧化钙
D.硫酸 lhh02141年前1
lhh02141年前1 -
 l449263883 共回答了25个问题
l449263883 共回答了25个问题 |采纳率84%解题思路:仔细审题,从题干中信息可以得出过碳酸钠晶体(2Na2CO3•3H2O2)既具有H2O2的化学性质(即遇到二氧化锰时放出氧气,生成了水而发生变化),又具有碳酸钠的化学性质(即能够与酸反应放出气体;与铜离子的盐、钙离子的盐、镁离子的盐等发生复分解反应生成沉淀).所以根据他们二者的性质,只要找出一个不与他们二者都反应的物质即可.A、红砖粉末的主要成分是氧化铁,和过氧化氢接触会催化其分解为水和氧气,那么固态的过碳酸钠晶体(2Na2CO3•3H2O2)也会有此类现象而发生失效;故错误;
B、氯化钠既不与过氧化氢(H2O2)反应也不与碳酸钠反应而变质,正确;
C、氢氧化钙能与碳酸钠发生复分解反应生成白色沉淀碳酸钙,也会使过碳酸钠变质,故错误;
D、硫酸与碳酸钠反应生成二氧化碳气体,那么固态的过碳酸钠晶体(2Na2CO3•3H2O2)也会因此而失效;故错误;
故选B.点评:
本题考点: 盐的化学性质;实验室制取氧气的反应原理.
考点点评: 本题是一道信息题,借固态的过碳酸钠晶体(2Na2CO3•3H2O2)为题设,考查学生对过氧化氢的性质和常见的盐---碳酸钠的性质的掌握和综合应用能力,并将所学的知识进行了迁移.1年前查看全部
- 过氧化钠为什么可以用作漂白剂?过氧化钠与co2反应固体增重指的是什么?
 走夜路不怕黑1年前1
走夜路不怕黑1年前1 -
 真六六哥 共回答了24个问题
真六六哥 共回答了24个问题 |采纳率95.8%因为过氧化钠具有强氧化性
指的是过氧化钠和二氧化碳反应生成的碳酸钠与氧气,但是反应后固体的重量加重了.
2 Na2O2 + 2 CO2 = 2 Na2CO3 + O21年前查看全部
- Na 2 SO 3 ·7H 2 O是食品工业中常用的漂白剂、抗氧化剂和防腐剂。Na 2 SO 3 在30℃时的溶解度为3
Na 2 SO 3 ·7H 2 O是食品工业中常用的漂白剂、抗氧化剂和防腐剂。Na 2 SO 3 在30℃时的溶解度为35.5g/100gH 2 O。
1)计算30℃时Na 2 SO 3 饱和溶液中Na 2 SO 3 的质量分数 。(保留2位小数)
。(保留2位小数)
[来源:学#科#网Z#X#X#K]
2)计算30℃时271g Na 2 SO 3 饱和溶液中水的质量。
3)将30℃的Na 2 SO 3 饱和溶液271g冷却到10℃,析出Na 2 SO 3 ·7H 2 O晶体79.5g。计算10℃时Na 2 SO 3 在水中的溶解度。 anwcwccc1年前1
anwcwccc1年前1 -
 wetfgewqukkeu 共回答了28个问题
wetfgewqukkeu 共回答了28个问题 |采纳率92.9%1年前查看全部
- 化学必修一漂白剂有哪些?原理?
 youxiayue1年前1
youxiayue1年前1 -
 aa有情 共回答了22个问题
aa有情 共回答了22个问题 |采纳率100%主要记住两种
一种是有强氧化性的物质,如氯气,次氯酸,原理为氧化还原漂白,不可逆
另一种是SO2,原理是化合漂白(主要漂白品红和纸制品),可逆
还有活性炭为物理漂白1年前查看全部
- 为什么漂白性在酸性环境中更强?我指的漂白性 是来自NaClO 或 Ca(ClO)2 中的 .漂白剂不是将Cl2 通入碱中
为什么漂白性在酸性环境中更强?
我指的漂白性 是来自NaClO 或 Ca(ClO)2 中的 .
漂白剂不是将Cl2 通入碱中 制得以NaClO等为有效成分的吗?怎么会和HClO有关? 凌晨靓点1年前2
凌晨靓点1年前2 -
 上有素质下有气质 共回答了16个问题
上有素质下有气质 共回答了16个问题 |采纳率93.8%漂白性是因为反应生成了次氯酸HClO
次氯酸是弱酸,故酸性时,生成次氯酸的速率快些,浓度大些.更强1年前查看全部
- 超市里卖的漂白剂(主要成分次氯酸钠)和洁厕灵(主要成分盐酸),两者混合的化学反应方程式怎么写.
 reddoll1年前4
reddoll1年前4 -
 wsbz112 共回答了17个问题
wsbz112 共回答了17个问题 |采纳率94.1%二者混合会出危险,生成氯气,方程如下(注:漂白粉的有效成分为次氯酸钙而不是次氯酸钠):
Ca(ClO)+4HCl=CaCl2+H2O+Cl2(气体符号)
改写成离子方程式为:ClO- +2H+ +Cl- =H2O+Cl2(气体符号)1年前查看全部
- 漂白剂漂白粉有漂白作用,众所周知,Fe(OH)3有红色,如果直接把漂白剂加入Fe(OH)3中,
 Catherine云1年前2
Catherine云1年前2 -
 然_后是什么 共回答了16个问题
然_后是什么 共回答了16个问题 |采纳率87.5%Fe(OH)3是红褐色,加入漂白剂不会变白,因为漂白剂漂白是因为其会生成次氯酸,利用次氯酸的强氧化性漂白,而Fe(OH)3根本没有还原性.1年前查看全部
- 高中化学中常见的漂白剂和漂白原理
 mony20051年前3
mony20051年前3 -
 我就蜜麦 共回答了14个问题
我就蜜麦 共回答了14个问题 |采纳率85.7%高中化学中常见的漂白剂有:氯水(Cl2)、NaClO、Ca(ClO)2、Na2O2、H2O2、O3、SO2 、活性炭
其中氯水(Cl2)、NaClO、Ca(ClO)2、Na2O2、H2O2、O3的漂白原理是他们都是强氧化剂,与有色物质发生氧化还原反应,生成稳定的无色物质
而SO2漂白原理是二氧化硫跟有机色素结合成了不稳定的无色化合物,该化合物见光、遇热或长久放置又能恢复为原来的颜色.用二氧化硫漂白过的草帽日久又渐渐变成黄色,就是这个缘故.SO2漂白原理属于非氧化—还原反应.
活性炭的漂白原理是吸附有色物质,是物理变化1年前查看全部
- 次氯酸钠漂白剂中的氯化钠影响其作用吗
次氯酸钠漂白剂中的氯化钠影响其作用吗
用纯碱吸收氯气得到次氯酸钠和氯化钠的溶液,可以作为漂白剂吗?
我们知道通常有漂白作用的成分是次氯酸钠,那么反应生成的氯化钠影响吸收后的溶液作为商品出售马? sinkship1年前1
sinkship1年前1 -
 舍舍219 共回答了20个问题
舍舍219 共回答了20个问题 |采纳率95%纯碱吸收氯气得到次氯酸钠和氯化钠的确有漂白的功效,但成本高且反应程度和产品纯度很难控制.1年前查看全部
- 漂白性是否仅针对使有机物漂白?我不是说漂白剂一定是有机,而是说漂白性是否是针对能漂白有机物来说的(当然也可使某些无机物褪
漂白性是否仅针对使有机物漂白?
我不是说漂白剂一定是有机,而是说漂白性是否是针对能漂白有机物来说的(当然也可使某些无机物褪色,不过是氧化还原反应)? 喜鹊装夜莺1年前1
喜鹊装夜莺1年前1 -
 threesheeps 共回答了21个问题
threesheeps 共回答了21个问题 |采纳率90.5%大部分颜料都是有机物(所以漂白是针对有机物而言)
含有双键和苯环的物质的分子光谱在可见光的范围内
这就是颜料的化学原理
当氧化剂氧化双键或者苯环时
分子光谱改变
这就是漂白剂漂白原理1年前查看全部
- 有刺激性气味的气体有哪些?求整理好的各种颜色的气体.哪些物质可做漂白剂?
有刺激性气味的气体有哪些?求整理好的各种颜色的气体.哪些物质可做漂白剂?
那些液体易挥发?可用于人工降雨的物质有哪些?
谢谢. wjn05851年前1
wjn05851年前1 -
 moun114 共回答了21个问题
moun114 共回答了21个问题 |采纳率90.5%刺激性:臭氧、氯气、溴蒸气、二氧化氮、氟化氢、硫化氢、氯化氢、溴化氢、碘化氢、磷化氢、二氧化硫、光气
氯气:黄绿色 二氧化氮:红棕色 中学里一般就这两种有色气体了.
漂白:氯气、氯水、二氧化硫、双氧水、漂白粉、84消毒液、甲醛、过氧苯甲酰、保险粉等等
人工降雨:干冰、碘化银等.1年前查看全部
- 二氧化硫具有还原性,故可做漂白剂对吗
 没事偷乐1年前1
没事偷乐1年前1 -
 ii统计局 共回答了17个问题
ii统计局 共回答了17个问题 |采纳率88.2%二氧化硫漂白不是氧化还原反应,而是二氧化硫与有颜色的物质化合成一种无色物质,受热后又会分解成原来的颜色
没有因果关系,其漂白原理是一种飞氧化还原的化合反应,不稳定,受热或时间长久后又会发生分解而溢出SO2,无色即还为有色,如草帽1年前查看全部
- 氢氧化钙在工业上用它做原料制作____,漂白剂或处理工业废水中_____? 急求啊!
 御前带两把刀侍卫1年前1
御前带两把刀侍卫1年前1 -
 LOVE婷子 共回答了15个问题
LOVE婷子 共回答了15个问题 |采纳率93.3%氢氧化钙在工业上用它做原料制作次氯酸钙,漂白剂或处理工业废水中的酸? 急求啊!1年前查看全部
- 过氧化硫脲属于还原性漂白剂?还是氧化漂白剂?
 jm198407071年前1
jm198407071年前1 -
 haiqing898 共回答了20个问题
haiqing898 共回答了20个问题 |采纳率85%氧化1年前查看全部
- 请问次氯酸钠是氧化漂白剂还是还原漂白剂?祝节日快乐!
 770586291年前1
770586291年前1 -
 huangxianyong 共回答了15个问题
huangxianyong 共回答了15个问题 |采纳率100%次氯酸钠易溶于水,不稳定,易成新生氧,新生氧的氧化能力很强,所以次氯酸钠是强氧化剂,因此,应该是氧化漂白剂 .1年前查看全部
- 假如要在水中加入漂白剂,知道水的体积为一立方米,加入后漂白剂的浓度为2ppm,求漂白剂的加入量为多少ml
假如要在水中加入漂白剂,知道水的体积为一立方米,加入后漂白剂的浓度为2ppm,求漂白剂的加入量为多少ml
请解释是如何计算得来的。求计算方法和计算公式中数字由来。 俯听闻惊风1年前1
俯听闻惊风1年前1 -
 zf020 共回答了16个问题
zf020 共回答了16个问题 |采纳率100%在溶液中
ppm是重量的百分率,ppm=mg/kg=mg/L
漂白剂的浓度:2ppm=2mg/L
1m³=1000L
漂白剂的加入量为2000mg1年前查看全部
- 从化学物质的角度怎么解释漂白剂对皮肤的腐蚀性?
 音响玲玲1年前3
音响玲玲1年前3 -
 haohaosc 共回答了19个问题
haohaosc 共回答了19个问题 |采纳率94.7%强氧化剂氧化皮肤细胞的蛋白质,磷脂等1年前查看全部
- Na2SO3•7H2O是食品工业中常用的漂白剂、抗氧化剂和防腐剂.Na2SO3在30℃时的溶解度为35.5g/100gH
Na2SO3•7H2O是食品工业中常用的漂白剂、抗氧化剂和防腐剂.Na2SO3在30℃时的溶解度为35.5g/100gH2O.
1)计算30℃时Na2SO3饱和溶液中Na2SO3的质量分数ω.(保留2位小数)
2)计算30℃时271g Na2SO3饱和溶液中水的质量.
3)将30℃的Na2SO3饱和溶液271g冷却到10℃,析出Na2SO3•7H2O晶体79.5g.计算10℃时Na2SO3在水中的溶解度. yingyin_star1年前1
yingyin_star1年前1 -
 lixiurong 共回答了15个问题
lixiurong 共回答了15个问题 |采纳率86.7%解题思路:1)根据溶质的质量分数=[溶质的质量/溶液的质量]和Na2SO3在30℃时的溶解度来计算饱和溶液中Na2SO3的质量分数ω;
2)根据Na2SO3在30℃时的溶解度来计算271g Na2SO3饱和溶液中水的质量;
3)根据Na2SO3•7H2O晶体和原溶液中溶质的质量求出10℃是饱和溶液中溶质的质量和溶剂的质量,再求出10℃时Na2SO3在水中的溶解度,即100g水中溶解 Na2SO3的质量.1)根据Na2SO3的溶解度,其饱和溶液中溶质为35.5g,溶剂为100g,溶液总质量=100+35.5=135.5g,
则ω(Na2SO3)=[35.5g/135.5g]≈0.26;
2)271g饱和溶液中,假设其含有的溶剂为x,
Na2SO3在30℃时的溶解度为35.5g/100gH2O,
则[100g/135.5g=
x
271g],
解之得:x=200(g);
3)冷却溶液后,析出晶体79.5g,根据其晶体Na2SO3•7H2O的组成,其中含有水和亚硫酸钠为:
m(Na2SO3)=79.5g×[126/126+126]=39.75g
m(H2O)=79.5g-39.75g=39.75g
10℃时Na2SO3的质量为271-200-39.75=31.25g
10℃时H2O的质量为200-39.75=160.25g
假设10℃时Na2SO3的溶解度为y
[100g/y=
160.25g
31.25g],
解得y=19.5g;
答:1)30℃时Na2SO3饱和溶液中Na2SO3的质量分数为0.26;
2)30℃时271g Na2SO3饱和溶液中水的质量为200g;
3)10℃时Na2SO3在水中的溶解度为19.5g.点评:
本题考点: 溶液中溶质的质量分数及相关计算;溶解度、饱和溶液的概念.
考点点评: 此题考查了溶液的质量分数、溶剂的质量、溶解度等化学计算知识,要理解溶解度的概念.1年前查看全部
- 被称为“绿色氧化剂”的过氧化氢(H 2 O 2 )俗称双氧水,是一种无色液体,常用做氧化剂、消毒剂和漂白剂.过氧化氢溶液
被称为“绿色氧化剂”的过氧化氢(H 2 O 2 )俗称双氧水,是一种无色液体,常用做氧化剂、消毒剂和漂白剂.过氧化氢溶液在二氧化锰做催化剂的条件下能迅速分解,生成氧气;分液漏斗可以通过调节活塞控制液体的滴加速度.回答下列问题: 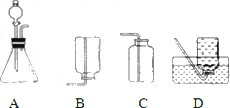
(1)分液漏斗中应加入的物质是 _________ ;锥形瓶中应放入的物质是 _________ .
(2)写出利用该方法制取氧气的反应的文字表达式: _________ ;要想收集一瓶纯净的氧气,最好选择装置 _________ (填字母).
(3)某同学在观察到锥形瓶内有大量气泡时,开始用C装置收集氧气,过了一段时间后,将带火星的木条伸入瓶口、瓶中和瓶底,都未见木条复燃.其原因可能是 _________ .
(4)如果在实验室中用此方法代替加热高锰酸钾制取氧气,请简述其优点有哪些.(至少写出两点) _________ ; _________ .
(5)小路同学用过氧化氢制取并收集了两瓶氧气,准备做硫粉燃烧和铁丝燃烧的实验,他在瓶底都加了少量水.请你来想一想,加水的目的分别是什么? _________ ; _________ . LunaMaldini1年前1
LunaMaldini1年前1 -
 蓝色小米330 共回答了18个问题
蓝色小米330 共回答了18个问题 |采纳率94.4%1年前查看全部
- 氯气可用来自来水消毒和作漂白剂的原理是什么?
 li78273221年前3
li78273221年前3 -
 sunking1982 共回答了26个问题
sunking1982 共回答了26个问题 |采纳率92.3%氯气溶于水生成盐酸和次氯酸,其中次氯酸是强氧化性酸,具有氧化消毒和氧化漂白的作用,另外次氯酸分解生成的初生态氧O具有很强的氧化性,能消毒.
化学方程式:
1.Cl2+H2O=HCl+HClO
2.HClO=HCl+O1年前查看全部
- 如何使钟乳石表面漂白,用什么漂白剂,流程?
如何使钟乳石表面漂白,用什么漂白剂,流程?
就是石头上面由杂色,现在想把它漂白.怎么做?
具体工艺啊,石头是蛮大的啊
没有人了吗? kisskiss3261年前1
kisskiss3261年前1 -
 jzhaoqc_us 共回答了15个问题
jzhaoqc_us 共回答了15个问题 |采纳率73.3%向上面淋澄清的石灰水,待略干后再向上淋小苏打水,用电吹风机烘干,不可烘烤过度,以免钟乳石炸裂.1年前查看全部
- 那些化学物质可以作为漂白剂并说明原理
 emeng12341年前1
emeng12341年前1 -
 尚****电脑椅 共回答了15个问题
尚****电脑椅 共回答了15个问题 |采纳率93.3%常用的漂白剂及其漂白原理
常用的漂白剂有:氯水、漂粉精、O3、H2O2、Na2O2、SO2、活性炭
1、 活性炭:吸附有色物质,是物理变化.
2、 SO2:由于溶于水后生成的H2SO3与有色物质结合,形成不稳定的无色化合物,褪色后在一定条件下又能恢复原来的颜色.可用于漂白和消毒.
3、 氯水、Ca(ClO)2、O3、H2O2、Na2O2漂白原理是:它们都具有强氧化性,均可以将有色物质氧化成无色物质,而褪色后不能恢复原色.
4、 既是漂白剂又是消毒剂的有:氯气、漂白粉、过氧化氢、臭氧等.它们的消毒作用是自身的强氧化作用使细菌体内的系统彻底遭到破坏.
5、 Na2O2也可作漂白剂:因遇水或稀酸后,生成H2O2.但不能作消毒剂,因为生成H2O2的同时,还生成腐蚀性强的NaOH.
6、 非氧化性消毒剂一般没有漂白作用.如:浓盐酸、酒精等.
总之,物质的强氧化性常与漂白和消毒联系在一起.但具有强氧化性的物质不一定能作漂白剂和消毒剂.如:浓H2SO4、浓HNO3等.1年前查看全部
- 求石灰石和食盐和水为原料生成漂白剂的化学方程式
 ayu14241年前3
ayu14241年前3 -
 monkeyline 共回答了16个问题
monkeyline 共回答了16个问题 |采纳率81.3%(1)2NaCl+2H2O Ca(OH)2
(4)2Ca(OH)2+2Cl2====CaCl2+Ca(ClO)2+2H2O1年前查看全部
- 下列叙述正确的是( )A.HClO可以使有色物质漂白,所以具有氧化性物质可作漂白剂B.Na的金属活动性比Mg强,故可用
下列叙述正确的是( )
A.HClO可以使有色物质漂白,所以具有氧化性物质可作漂白剂
B.Na的金属活动性比Mg强,故可用Na与MgCl2溶液反应制Mg
C.浓硝酸中的HNO3,见光会分解,故有时在实验室看到的浓硝酸呈黄色
D.因为SO2具有较强还原性,所以不能用浓硫酸来干燥它 yologocn1年前1
yologocn1年前1 -
 宝贝vs天天 共回答了18个问题
宝贝vs天天 共回答了18个问题 |采纳率83.3%解题思路:A.具有氧化性的物质不一定能做漂白剂;
B.Na与MgCl2溶液反应生成氢氧化镁和氢气;
C.硝酸分解生成二氧化氮,二氧化氮溶于水;
D.二氧化硫与浓硫酸不反应.A.具有氧化性的物质不一定能做漂白剂,如浓硫酸,一般来说,用作漂白剂的物质通常可生成氧气,故A错误;
B.Na性质活泼,可与水反应,钠与MgCl2溶液反应生成氢氧化镁和氢气,故B错误;
C.硝酸分解生成红棕色二氧化氮,二氧化氮溶于水导致浓硝酸呈黄色,故C正确;
D.二氧化硫与浓硫酸不反应,同种元素相邻化合价,氧化剂和还原剂之间不发生氧化还原反应,故D错误.
故选C.点评:
本题考点: 氯、溴、碘及其化合物的综合应用;硝酸的化学性质;二氧化硫的化学性质;钠的化学性质.
考点点评: 本题考查较为综合,涉及物质的漂白性、钠、硝酸以及二氧化硫的性质,为高考常见题型,侧重元素化合物知识的综合理解和运用的考查,有利于学习良好的科学素养的培养,难度中等,注意相关基础知识的积累.1年前查看全部
- 发酵粉可用作消毒剂和漂白剂,是因为氯气与水反应生成的次氯酸具有强氧化性,还是生成游离态的氧气强氧化性?
 sntuu1年前1
sntuu1年前1 -
 chuiliu 共回答了16个问题
chuiliu 共回答了16个问题 |采纳率81.3%应该是漂白粉(有效成分:次氯酸钙)而不是发酵粉.
是次氯酸的氧化性导致了细菌的死亡.
因为次氯酸在常温下光不强时,其分解并不是很快的,产生的原子氧并不多.所以主要还是依靠了次氯酸的氧化作用.1年前查看全部
- 关于是否能用水浸出纸张漂白剂成分的问题!急
关于是否能用水浸出纸张漂白剂成分的问题!急
如题,我试过把白纸剪碎用蒸馏水浸了几天,见到水都变色了就拿出些浸出液来,放试剂进去想检验什么成分,跟漂白剂检验有关的试剂试过了好多,都没有现象,就连检验个PH都是中性.就想是不是纸里的漂白剂不会析出还是漂白剂已经变成其他东西了.
我是想问能不能用水把纸里的漂白成分浸泡出来,如果不行的话是为什么?这样。不是问纸为什么会变色~可能说得不够清楚,不好意思。感谢那么快就有人来回答, shenlong20021年前2
shenlong20021年前2 -
 魔龙无敌 共回答了15个问题
魔龙无敌 共回答了15个问题 |采纳率86.7%纸张漂白一般使用俗名为“保险粉”的一种物质通用名为连二亚硫酸钠
注意,它对纸张的作用只是退去杂色(就和氯气的作用效果一样,不可逆)并不是覆盖在纸面上让纸张增白,所以即使浸出也是微量的而且是反应过的(即使可以得到连二亚硫酸钠,检验方法也不是你在家就可以检验的,具体内容见http://bike.baidu.com/view/141849.htm )
.
附着在纸上使得纸面发白的物质是荧光剂,用紫外线灯照射纸张会有荧光产生.可以用有机溶剂浸泡得到,显然你得到的不是荧光剂.
纸变色是因为纸张已经腐烂了,处理掉吧,不然该长霉了.1年前查看全部
- 能使指示剂褪色的漂白剂有哪些?RT,HCLO,O3等行不行?指示剂就是紫色石蕊、酚酞这些
 任我写1年前1
任我写1年前1 -
 深圳168 共回答了11个问题
深圳168 共回答了11个问题 |采纳率90.9%H2O2、SO2、Cl2、HClO、O31年前查看全部
大家在问
- 1某商场出售某种电视机,每台1800元,可盈利20%,则这种电视机进价为( )
- 2朱自清的背影 史铁生的秋天的怀念
- 3(2009•崇文区)请你认真观察下面例题,学习例题中介绍的大小比较方法.
- 4汶川大地震震的面积有多大
- 5有些人永远也忘不了英语怎么说怎么说,谢
- 6给大海的一封信 作文
- 714.2g(NH4)2C2O4•xH2O中含有1.204×1023个NH4+,该物质的摩尔质量是______,x的值是_
- 8英语翻译用英语翻译这段文字,“下周我们要进行英语测验,同学让我考试给他传答案,我怕影响我自己考试,又怕得罪他?”
- 9把盒子放进去/把盒子埋了 英语怎么说?
- 10“由是先主遂诣亮”的“由是”什么意思?
- 11表示坚强不屈,遇到困难不低头的词语有哪些
- 12若M-N=5,MN=-2,则(N-M)的平方-4MN=
- 13高中地理有关计算时间那部分看听不懂,求方法
- 14英语翻译此公司的上市地点为“天交所”,与一般沪深两市有较大不同,在该所挂牌的企业基本条件之一(财会方面)为:最近两年连续
- 15It is so cold与It is too cold的区别.表达程度有不同吗?怎么使用?