相对原子质量是一个比值吗?如题
 jmz20002022-10-04 11:39:541条回答
jmz20002022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 jennywjy 共回答了17个问题
jennywjy 共回答了17个问题 |采纳率82.4%- 是的,以一个碳原子的1/12作为基准,其他原子的质量与这一基准的比,称为这种原子的相对原子质量.
- 1年前
相关推荐
- 己知一个R原子的质量是一个氧原子质量的2倍,假设以一个氧原子质量的1/n作为国际相对原子质量标准,则R的氧化物RO2的相
己知一个R原子的质量是一个氧原子质量的2倍,假设以一个氧原子质量的1/n作为国际相对原子质量标准,则R的氧化物RO2的相对分子质量为( )
A. 3n
B. 2n
C. n
D. 4n cbr98051年前3
cbr98051年前3 -
 擎剑问天 共回答了25个问题
擎剑问天 共回答了25个问题 |采纳率88%解题思路:相对原子质量是指以标准碳原子质量的十二分之一作为标准,其他的原子与它作比得出的比值,由于都是和同一标准作比值,因此相对原子质量之比就等于原子的实际质量之比;相对分子质量是指各个原子的相对原子质量的和.根据题意可得,O的相对原子质量为:[一个氧原子的质量
1/n×一个氧原子的质量]=n,由于一个R原子的质量是一个氧原子质量的2倍,则R的相对原子质量也是氧的相对原子质量的2倍,因此RO2的相对分子质量为:2n+n×2=4n,故选D.点评:
本题考点: 相对原子质量的概念及其计算方法;相对分子质量的概念及其计算.
考点点评: 本题难度较大,主要考查了对相对原子质量概念的理解及其应用.1年前查看全部
- 相对原子质量随着原子序数的递增呈周期性变化吗
 泡沫_青绿茶1年前3
泡沫_青绿茶1年前3 -
 310188369 共回答了25个问题
310188369 共回答了25个问题 |采纳率100%质量没有周期性变化1年前查看全部
- 假设12C相对原子质量为24,如果以0.024kg12C所含的原子数为阿伏加德罗常数的数值,下列数值肯定不变的是( )
假设12C相对原子质量为24,如果以0.024kg12C所含的原子数为阿伏加德罗常数的数值,下列数值肯定不变的是( )
A. 气体摩尔体积(标准状况)
B. 标准状况下16g氧气所占体积
C. 氧气的相对分子质量
D. 一定条件下,跟2gH2相化合的O2的物质的量 花差花差gg1年前4
花差花差gg1年前4 -
 wangdatou1983 共回答了21个问题
wangdatou1983 共回答了21个问题 |采纳率85.7%解题思路:根据假设12C的相对原子质量为24,且以0.024 千克12C所含有的原子数为阿伏加德罗常数,
则在规定12C的相对原子质量为24时,实际上是把作为相对原子质量的标准从原来用12C质量的[1/12],改为[1/24],但是单个碳原子的质量并没有因此而发生改变;
原来是以0.012kg12C所含有的碳原子数作为阿伏加德罗常数(即6.02×1023),现在用0.024kg12C中所含的原子个数为阿伏加德罗常数(NA),显然0.024kg12C中所含的原子个数是0.012kg12C中所含的原子个数的2倍;故阿伏加德罗常数(NA)变为原来阿伏加德罗常数的2倍(即2×6.02×1023),据此进行分析.A、气体摩尔体积是单位物质的量的气体所占的体积,阿伏伽德罗常数变大,标况下1mol氧气占有的体积变大,即气体摩尔体积也变大,故A错误;
B、气体的密度不变,所以一定质量气体的体积不变,故B正确;
C、因相对原子质量的标准变化,变为原来的[1/2],氧原子质量不变,则氧气相对分子质量变为原先的2倍,即变为64,故C错误;
D、由于阿伏伽德罗常数变为原先的2倍,1mol氧气具有的质量由32g/mol变为64g/mol,摩尔质量变大,消耗的氧气的物质的量变小,故D错误;
故选B.点评:
本题考点: 阿伏加德罗常数.
考点点评: 本题考查阿伏伽德罗常数,明确常数的规定发生变化时其数值的变化是解答本题的关键,并熟悉摩尔质量、摩尔体积等概念来解答.1年前查看全部
- 什么是相对分子质量,什么是相对原子质量,什么是元素的质量比,什么是质量分数
 七帘幽梦1年前1
七帘幽梦1年前1 -
 ppodddds 共回答了9个问题
ppodddds 共回答了9个问题 |采纳率88.9%相对原子质量是指以一个碳12原子质量的1/12作为标准,任何一种原子的平均原子质量跟一个碳-12原子质量的1/12的比值,称为该原子的相对原子质量.
而相对分子质量则为化学式中各个原子的相对原子质量的总和,如H2o为1+1+16=18.
元素质量比:
如H2o中H和O的元素质量比为:
氢的相对原子质量乘以它在该化学式中原子个数,比上氧元素的相对原子质量乘以氧原子个数:mH:m0 = 1×2 :16×1 = 1 :8
质量分数:如H2o中H的质量分数为:(H原子相对原子质量×H原子个数)/(O原子的相对原子质量×O原子个数)×100%1年前查看全部
- K的密度为什么比Na 的小呢?课本上说是从Na到K相对原子质量增大所起的作用小于原子体积增大所引起的作用.但是我真的不理
K的密度为什么比Na 的小呢?课本上说是从Na到K相对原子质量增大所起的作用小于原子体积增大所引起的作用.但是我真的不理解也.
 白胡杨1年前2
白胡杨1年前2 -
 艾夜妖 共回答了22个问题
艾夜妖 共回答了22个问题 |采纳率86.4%随着原子序数的增加,碱金属的密度一般是增大的.这说明由于这几种金属的晶体结构方式相同,随着原子序数的增加,相对原子质量增加所起的作用超过了(或者抵消了)原子半径(或原子体积)增大的作用.但有一个例外,就是从Na到K出现了“反常现象”,理由是由于从Na到K的相对原子质量增大所起的作用小于原子体积增大所起的作用,因此K的密度比钠的密度反而小.1年前查看全部
- 衰变后原子核的质量是不是变为原来的一半?相对原子质量呢?为什么?
 z_yfzhao1年前2
z_yfzhao1年前2 -
 折苇 共回答了20个问题
折苇 共回答了20个问题 |采纳率85%不是变为一半,不同元素衰变的过程不一样,有的可以衰变为一种元素,这种元素再衰变,然后继续生成新元素一直衰变,直至一个稳定的元素.你可以百度一下同位素/放射性同位素.
相对原子量肯定会发生变化.衰变的原子量基本上遵循质量守恒.1年前查看全部
- 为什么"质量/相对原子质量=原子个数"
为什么"质量/相对原子质量=原子个数"
一个原子质量/相对原子质量=C12的质量的1/12啊,和上面的有什么关系 superhhhhhh1年前3
superhhhhhh1年前3 -
 superna 共回答了14个问题
superna 共回答了14个问题 |采纳率100%"质量/相对原子质量=原子个数"的说法是错误的!
正确的表述应该是这样的:
质量/摩尔质量=物质的量
物质的量×阿佛加得罗常数=微粒个数
例如112克铁的原子数量是多少?
112克铁的物质的量=112克/56克/mol=2mol
112克铁的原子数量=6.02×10^23×2=1.202×10^24
当然一定要牢记物质摩尔质量其数值等于它的分子(原子)量.1年前查看全部
- 质子数、中子数、核外电子数、相对原子质量之间的规律(3条以上)
质子数、中子数、核外电子数、相对原子质量之间的规律(3条以上)
你们说的我都写了,有没有不和“质子数=核外电子数
质子数+中子数=相对原子质量
核外电子数+中子数=相对原子质量”一样的? 2ydpgdi1年前4
2ydpgdi1年前4 -
 nuidans64 共回答了19个问题
nuidans64 共回答了19个问题 |采纳率94.7%原子中 质子数=核外电子数
正离子中 质子数>核外电子数
负离子中 质子数1年前查看全部
- 化合价相等的金属与酸反应时,为什么相对原子质量大的金属产生的氢气少?
 蓝_扣子1年前1
蓝_扣子1年前1 -
 halishigedasb 共回答了23个问题
halishigedasb 共回答了23个问题 |采纳率91.3%因为,这个有前提,取相同质量的金属,它的摩尔量就少.就是参与反应的原子数少.1年前查看全部
- 甲乙两原子质量之比是a:b,乙与碳12原子质量比是c:d,则甲原子相对原子质量是?
 bension1年前1
bension1年前1 -
 淡漠绝情谷 共回答了21个问题
淡漠绝情谷 共回答了21个问题 |采纳率85.7%M1/M2=a/b,M2/12=c/d,从而M1=12ac/bd1年前查看全部
- 若已知化合物的相对原子质量为Mr,则可求元素的相对原子质量或原子个数.A的相对原子质量=?n=?
若已知化合物的相对原子质量为Mr,则可求元素的相对原子质量或原子个数.A的相对原子质量=?n=?
这个问题是想问什么啊?什么都没告诉我,我连用代数关系式都写不出,火速. 水亭莼1年前1
水亭莼1年前1 -
 ps0256 共回答了24个问题
ps0256 共回答了24个问题 |采纳率95.8%若已知化合物的相对原子质量为Mr,
1、求元素的相对原子质量,需要知道化合物中,组成元素的原子个数比;
2、求原子个数,需要知道元素的质量比.1年前查看全部
- 化学式有了中间的一点后怎么计算相对原子质量?比如H2so4·5H2o
 huangtaizi20081年前2
huangtaizi20081年前2 -
 本图相与 共回答了15个问题
本图相与 共回答了15个问题 |采纳率86.7%相对原子质量?这个点对原子质量没影响,只会对相对分子质量有影响,而且上述的分子貌似有问题,就说CuSo4·5H2o ,这个的相对分子质量是硫酸铜的质量加上五个水分子的质量,这个分子的相对分子质量是250.1年前查看全部
- 高中化学必修一中有一句话“当物质的质量以克为单位时,摩尔质量在数值上等于相对原子质量或相对分子质量”,这里的“物质”指的
高中化学必修一中有一句话
“当物质的质量以克为单位时,摩尔质量在数值上等于相对原子质量或相对分子质量”,这里的“物质”指的只是宏观的物质,还是宏观的物质以及微观的粒子?既然氢氧化钠的摩尔质量是40g/mol,那么我可以说钠离子的摩尔质量是23g/mol,氢氧根离子的摩尔质量是17g/mol吗?还请大师出手相救啊 我就不说11年前1
我就不说11年前1 -
 linaodan 共回答了21个问题
linaodan 共回答了21个问题 |采纳率76.2%这个物质可以是宏观的也可以是微观粒子,其实并不矛盾,宏观的物质都是由微观粒子组成,如氢氧化钠的摩尔质量是40g/mol,钠离子的摩尔质量是23g/mol,氢氧根离子的摩尔质量是17g/mol1年前查看全部
- 我们刚开始接触化学的分子和原子 老师 让我们 在作业本上写 什么 M=pv (肉味 ,下同) 相对原子质量*原子个数=.
我们刚开始接触化学的分子和原子 老师 让我们 在作业本上写 什么 M=pv (肉味 ,下同) 相对原子质量*原子个数=.PH2=0.0899g/L,PO2=1.429g/L VH2=VO2=2:1 还说 一个氢原子的相对质量是1,一个氧原子的相对质量是16 ,求为什么 是 H2O
标准点 好的 ++++++分 不关风与月1年前1
不关风与月1年前1 -
 love_booby 共回答了18个问题
love_booby 共回答了18个问题 |采纳率94.4%这个“肉味:.巨雷人.姐姐我看了半天才懂.
1、M(质量)=pv的意思是对于所有物质,质量=密度*体积
2、VH2=VO2=2:1,我们假设有2L的H2,1L的O2,那么根据1中的公式和已知的密度,可以知道
MH2(质量)=pv=0.0899g/L*2L==0.1798g MO2=1.429g/L*1L=1.429g
3、根据 质量=物质的量*相对分子质量可以算出H2和O2的物质的量n
nH2=质量/相对分子量=0.1798/2(注意H2中是两个H原子)=0.0899
nO2=1.429/32(2个氧原子是16*2)=0.045
4、从上一步可以看出,H2和O2 的比例是0.0899:0.045约等于2
那么水中这两种原子的数量比例也就是2:1
综上所述,水的化学式是H2O
看在姐姐回答这么详细的份上,给分了吧!1年前查看全部
- 问一道化学常用计量的问题A、B两种金属相对原子质量比为8∶9,它们以3∶2的物质的量比混合.取混合物1.26g与足量稀硫
问一道化学常用计量的问题
A、B两种金属相对原子质量比为8∶9,
它们以3∶2的物质的量比混合.
取混合物1.26g与足量稀硫酸反应,放出氢气1.344L(标准状况)
已知A、B生成氢气质量相等,求A、B的相对原子质量. 科比吴1年前2
科比吴1年前2 -
 涂鸦天使 共回答了17个问题
涂鸦天使 共回答了17个问题 |采纳率94.1%若这两种金属单质在反应中生成的氢气的体积相等说明分别放出0.03molH2,
金属单质按物质的量之比为3:2,放出一样多的氢气,说明金属化合价为+2价和+3价
在置换反应中金属只有:+1,+2,+3.
所以是+2,+3价的元素.
A+2价 ; B+3价
A:24g/mol; B:27g/mol
A的相对原子质量24
B的相对原子质量271年前查看全部
- 随着相对原子质量的不断增大,会不会发现常温下为固体或液体的零族元素?拜托各位大神
 梦入清扬1年前2
梦入清扬1年前2 -
 火凝枫 共回答了18个问题
火凝枫 共回答了18个问题 |采纳率88.9%只能说理论上有可能,因为原子量越大的元素,其放射性越强,也就越会从原子核中释放物质,因此核就越不稳定了,存在时间就越短.实际上这种元素的单质在常温下一会儿就衰变为别的物质了.1年前查看全部
- 原子真实质量*阿伏加德罗常数=碳原子质量的1/12*相对原子质量*阿伏加德罗常数)=12g*1/12*相对原子质量
原子真实质量*阿伏加德罗常数=碳原子质量的1/12*相对原子质量*阿伏加德罗常数)=12g*1/12*相对原子质量
证数值上摩尔质量=相对原子质量中,“12g*1/12*相对原子质量”这一步是如何推导出的?
摩尔质量=1mol物质微粒的质量=原子真实质量*阿伏加德罗常数=碳原子质量的1/12*相对原子质量*阿伏加德罗常数(阿伏加德罗常数定义为12克12C的原子数)=12g*1/12*相对原子质量=相对原子质量,证毕.
第三步:碳原子质量的1/12*相对原子质量*阿伏加德罗常数 怎么推导出 =12g*1/12*相对原子质量,碳原子质量的1/12 和阿伏加德罗常熟是怎么约掉的?
mc/12 * m其/mc*12*1g碳的数量,楼下说的很简单,谁能说一下这步是如何约分的? 我爱小涛1年前2
我爱小涛1年前2 -
 richarqi 共回答了15个问题
richarqi 共回答了15个问题 |采纳率100%12g*1/12*相对原子质量:这是因为相对原子质量的定义就是以一个C12原子的质量的1/12为标准,其他原子的质量和它的比值就是这个原子的相对原子质量.1年前查看全部
- 已知CI的平均相对原子质量为35.5,求23Na和35CI、37CI等微粒组成的29.25gNaCI晶体汗37CI多少克
已知CI的平均相对原子质量为35.5,求23Na和35CI、37CI等微粒组成的29.25gNaCI晶体汗37CI多少克?
23Na:表示它的相对原子质量是23. wo701年前2
wo701年前2 -
 黄桔子皮 共回答了18个问题
黄桔子皮 共回答了18个问题 |采纳率83.3%先算37cl占氯元素两种原子的比例 35.5=37*X+35*(1-X) X=25%
29.52gNaCl物质的量:29.25/58.5=0.5mol
所以其中含37CL的质量:0.5*25%*37 g =4.625g1年前查看全部
- 碳氢氧氮氯硫磷,钾钙钠镁铝锌铁,溴碘锰钡铜汞银,氦氖氩硅氟铂金,这28个元素的相对原子质量怎样好记?
碳氢氧氮氯硫磷,钾钙钠镁铝锌铁,溴碘锰钡铜汞银,氦氖氩硅氟铂金,这28个元素的相对原子质量怎样好记?
最好是顺口溜 sand200620061年前6
sand200620061年前6 -
 平凡小辉的BLOG 共回答了15个问题
平凡小辉的BLOG 共回答了15个问题 |采纳率93.3%jia gai na mei lv xin tie xi qian tong gong yin bo
钾 钙 钠 镁 铝 锌 铁 锡 铅 铜 汞 银 铂
jin
金1年前查看全部
- 相对分子质量和相对原子质量有什么关系?大家都是怎么求的?举例说明~~~
 sildenafil1年前1
sildenafil1年前1 -
 sunfire2 共回答了19个问题
sunfire2 共回答了19个问题 |采纳率94.7%某分子的相对分子质量是该分子中所有原子的相对原子质量之和.
如H2O的相对分子质量为:1*2+16*1=18
CO2的相对分子质量为:12*1+16*2=44
H2SO4的相对分子质量为:1*2+32*1+16*4=981年前查看全部
- A原子与B原子的质量之比为a:b,而B原子与作为相对原子质量标准的碳12原子的质量比为m:n,则A原子的相对原子
 wenhuahao1年前2
wenhuahao1年前2 -
 Yvonne7 共回答了11个问题
Yvonne7 共回答了11个问题 |采纳率90.9%C-12的原子量为12,因此B的原子量为12*m/n,A的原子量为a*12*m/n/1年前查看全部
- 2.16克X2O5中含有0.05mol氧原子,X相对原子质量多少
 道明虱1年前1
道明虱1年前1 -
 益龙 共回答了20个问题
益龙 共回答了20个问题 |采纳率95%设原子量 X
所以 [2.16 /(2*x+80)] *5 = 0.05
x = 681年前查看全部
- 相对原子质量是指:______ 相对分子质量是指:______ ,也叫分子量
 tianyaqi1年前1
tianyaqi1年前1 -
 hugang456 共回答了18个问题
hugang456 共回答了18个问题 |采纳率94.4%相对原子质量是指:___原子质量与C(碳)12原子质量的1/12之比___ 相对分子质量是指:___分子质量与C(碳)12原子质量的1/12之比___ ,也叫分子量1年前查看全部
- 化学相对原子质量的题由x,y两种元素组成的混合物是xy2,其相对分子质量为A,一个y原子的相对原子质量为M,一个x原子的
化学相对原子质量的题
由x,y两种元素组成的混合物是xy2,其相对分子质量为A,一个y原子的相对原子质量为M,一个x原子的质量为m千克求W千克xy2中有多少个原子 名曰清风1年前2
名曰清风1年前2 -
 ghlg 共回答了19个问题
ghlg 共回答了19个问题 |采纳率89.5%X的相对原子质量为A-2M);
一个xy2分子的质量为mA/(A-2M)千克;
W千克含有的xy2分子数为W(A-2M)/(mA);
总的原子数为3W(A-2M)/(mA).1年前查看全部
- 有个公式是这么说的 原子个数只比=(元素质量除以相对原子质量)之比 怎么理解,
有个公式是这么说的 原子个数只比=(元素质量除以相对原子质量)之比 怎么理解,
原子个数之比 不就是元素右下角坐标之比么 到底怎么回事 尉迟惜朝1年前5
尉迟惜朝1年前5 -
 lovely_shine01 共回答了23个问题
lovely_shine01 共回答了23个问题 |采纳率78.3%化学式中不同元素的原子个数比即元素右下角的角数,实际是根据化学式中化合价的规律推算出来的,即要保持化学式中元素化合价的代数和为零.1年前查看全部
- 由相对原子质量的定义式推出其的数学表达式
由相对原子质量的定义式推出其的数学表达式
要有一定的过程,谢谢! oly20051年前1
oly20051年前1 -
 橘小夜 共回答了20个问题
橘小夜 共回答了20个问题 |采纳率75%这个要打很多字的,你都不给分,不厚道吧~
相对分子质量的关键在“相对”.相对的是一个C-12原子的实际质量的十二分之一
元素A的相对原子质量是:原子核内有6个质子和6个中子的碳原子的质量的1/12(约1.66×10-27kg)作为标准,其它原子的质量跟它的比值,就是这种原子的相对原子质量.1年前查看全部
- 相对原子质量相同的原子都是同一元素的原子
相对原子质量相同的原子都是同一元素的原子
这说法对吗
不是这样的,
liuwei880502,到北海放羊,都错了哦
“相对原子质量”不能等同于“质量数”
相对原子质量,是准确值,用一个原子的质量除碳十二的1/12
而质量数,是一个近似值,是质子数与中子数相加
温加加同学
应该和同位素没关系吧
同种元素的各种同位素的相对原子质量,明显不同
但我的问题不在于此 adoskk1年前6
adoskk1年前6 -
 xiongzq 共回答了22个问题
xiongzq 共回答了22个问题 |采纳率81.8%同种原子要求质子数和中子数都相等,而同种元素要求质子数相等,并不要求中子数也相等,所以说相对原子质量相同的原子都是同一元素的原子是错的,比如说一个质子一个中子的原子(氘),相对原子质量的2,和氦一样,但去不是同种原子.1年前查看全部
- 质量数 相对原子质量 摩尔质量 它们之间有什么关系?
 dragon_jy1年前4
dragon_jy1年前4 -
 网网情深 共回答了18个问题
网网情深 共回答了18个问题 |采纳率94.4%相对原子质量:以C12质量的1/12作为标准,其他元素的原子质量跟它相比较所得的数值.相对原子质量的单位为“1”.
摩尔质量:单位物质的量的物质所具有的质量叫做摩尔质量.即含阿伏加德罗常数个粒子的总质量,摩尔质量以g/mol为单位时,在数值上等于该物质的相对原子质量或相对分子质量.
质量数是将原子内所有质子和中子的相对质量取近似整数值相加而得到的数值,没有单位1年前查看全部
- 原子质量等于相对原子质量吗?还有,原子的质量=质子的质量+中子的质量吗?
 花芜缺1年前4
花芜缺1年前4 -
 hnwuhai 共回答了20个问题
hnwuhai 共回答了20个问题 |采纳率85%不是.相对原子质量是粒子相对碳12的1/12的数值,原子质量是质量.
原子质量=质子质量+中子质量+电子质量(一般电子质量忽略)1年前查看全部
- 初二教的相对原子质量怎么求比如一个氢原子的质量为1.674×10负二十七次方 千克,一个氧原子的质量是2.657×10的
初二教的相对原子质量怎么求
比如一个氢原子的质量为1.674×10负二十七次方 千克,一个氧原子的质量是2.657×10的负二十六次方 千克, 当我们计算一个水分子的质量是多少时 中的 1.674×10负二十七次方和2.657×10的负二十六次方 这2个数是哪里来的 这里都不懂 求解
如一个氢原子的实际质量为1.674x10(-27)千克,(限于格式,10(-27)表示科学记数法,意为10的-27次幂,下同),一个氧原子的质量为2.657x10(-26)千克。一个碳-12原子的质量为1.993x10(-26)千克。 中的1.674x10(-27) 和2.657x10(-26) 这2个数是取哪里的 hblhkzt1年前1
hblhkzt1年前1 -
 瞬间的冬天 共回答了16个问题
瞬间的冬天 共回答了16个问题 |采纳率93.8%相对原子质量的求法:以碳6,12原子质量的1/12作为标准,其他原子的质量和该值相比较后得到的数值即为该原子的相对原子质量.1年前查看全部
- 元素周期表,符号,名称,相对原子质量都得背吗
 qqqq八雌八雄1年前1
qqqq八雌八雄1年前1 -
 ddlovehh 共回答了19个问题
ddlovehh 共回答了19个问题 |采纳率94.7%周期表前二十个用背.符号名称也用背.原子质量不用背,考试的时候会给出来的.1年前查看全部
- 相对原子质量=质子数+中子数,为什么不是核外电子数+中子数,好像和什么离子有关吧,
 御剑流1年前1
御剑流1年前1 -
 我的阴暗无可救药 共回答了14个问题
我的阴暗无可救药 共回答了14个问题 |采纳率92.9%原子的核外电子数=质子数
但原子变成离子时会失去或得到电子,此时核外电子数≠质子数
即此时相对原子质量=质子数+中子数,不是核外电子数+中子数1年前查看全部
- 相对分子质量的单位是?相对原子质量的单位?
 不浅蓝涩1年前7
不浅蓝涩1年前7 -
 百年二锅头 共回答了26个问题
百年二锅头 共回答了26个问题 |采纳率80.8%相对分子质量的单位就是1 因为分子级的重量难以用g等单位来衡量,所以再分子级的重量下重新定义了一个单位,就是相对分子质量的1
相对原子量是指元素的平均原子质量与核素12c原子质量的1/12之比.
相对原子质量=原子质量(kg)/(16606*10(-27次方))
相对原子质量是有单位的,其单位为“1”,只不过常省略而已.
相对原子质量的概念是以一种碳原子(原子核内有6个质子和6个中子的一种碳原子,即C-12)的质量的1/12(约1.66×10-27kg)作为标准,其它原子的质量跟它的比值,就是这种原子的相对原子质量.1年前查看全部
- 在元素A的氧化物中,A于氧元素的质量比为7:20,相对原子质量之比为7:8,写出该氧化物的化学式
 陌上花111年前2
陌上花111年前2 -
 浓茶小罐 共回答了14个问题
浓茶小罐 共回答了14个问题 |采纳率92.9%根据:“相对原子质量之比为7:8”可知,A是氮元素(因为氧的相对原子质量是16,则A就是14,根据元素周期表,只有元素氮符合)
又因为A于氧元素的质量比为7:20,所以设该氧化物是NxOy,则有:
14x:16y=7:20
解得:x:y=2:5
所以该氧化物的化学式是N2O51年前查看全部
- 化学元素相对原子质量(急)请帮我列一份化学元素相对原子质量表.
 尕朵觉悟1年前1
尕朵觉悟1年前1 -
 liyin 共回答了21个问题
liyin 共回答了21个问题 |采纳率81%H=1 He=4 Li=7 C =12 N=14 0=16 F=1 Ne=20 Na=23 Mg=24 Al=27
Si=28 p=31 S=32 Cl=35 Ar=40 K=39 Ca =40 Mn=55 Fe=56 Zn=65 Cu=64
I=127 Sn=119 Ag=108 Br=80 Ba=137
常用的1年前查看全部
- 下列说法正确的是a原子不能在分.b原子核都是由质子和中子构成的.c相对原子质量只是一个比值没有单位.
下列说法正确的是a原子不能在分.b原子核都是由质子和中子构成的.c相对原子质量只是一个比值没有单位.
d原子可以直接构成分子也可以直接构成物质.好像c和d都是对的 但只有一个答案? 36697751年前3
36697751年前3 -
 爱我你怕了吗 共回答了16个问题
爱我你怕了吗 共回答了16个问题 |采纳率81.3%A、错误.化学变化中原子不能再分.
B、错误.氢原子核没有中子
C、正确.相对原子质量只是一个比值,没有单位.有时候认为单位是 1
D、正确.比如氧原子构成了氧分子,铁元素直接构成了金属铁
选择CD.要是单选就选D
但化学有时候会有双选题的1年前查看全部
- 为什么太阳、白炽灯的光会是连续光谱?相对原子质量大的原子便放出连续光谱?
 剪西窗烛1年前2
剪西窗烛1年前2 -
 cenychen 共回答了21个问题
cenychen 共回答了21个问题 |采纳率90.5%太阳、白炽灯所发的光不是由单一种类的原子发出的,若是有单一种类的原子发出的光就会是不连续光谱1年前查看全部
- 有等质量的A、B两金属,相对原子质量Ar(A)<Ar(B),将A放入质量分数为15%的稀硫酸中,B放入质量分数为15%的
有等质量的A、B两金属,相对原子质量Ar(A)<Ar(B),将A放入质量分数为15%的稀硫酸中,B放入质量分数为15%的稀盐酸中,在反应中A、B均为正二价,产生氢气的质量随反应时间变化曲线如图.下列说法正确的是( )
 A. 产生氢气的速率A<B
A. 产生氢气的速率A<B
B. 反应后A、B一定都有剩余
C. 消耗的稀硫酸和稀盐酸质量一定不相等
D. 消耗B的质量一定小于A的质量 初恋一0211年前1
初恋一0211年前1 -
 泠风1977 共回答了16个问题
泠风1977 共回答了16个问题 |采纳率87.5%解题思路:根据图象可以得出:①比较氢气的多少,从而可以判断出金属的相对原子质量的大小,得到氢气多的则相对原子质量小;②判断金属的活动性强弱,反应时间短或斜线斜率大的则该金属的活动性强.A、金属的活动性越强的,和酸溶液反应时产生气体的速率也就越快,根据图象不难看出,金属A完全反应后所需要的时间短,即A的活动性强,故A错误;
B、等质量的不同金属得到的氢气一样多,说明参与反应的金属的质量一定不一样多,因此至少有一种金属剩余,故B错误;
C、由于得到的氢气一样多,根据元素的质量守恒可知,参加反应的稀盐酸和稀硫酸的溶质中氢元素的质量一定相等,又因这两种酸溶液中溶质的质量分数相同,从而说明参与反应的两种酸的质量一定不一样多,故C正确;
D、由于A的相对原子质量小,因此得到相同质量的氢气,参加反应的金属A的质量要少一些,故D错误;
故选C点评:
本题考点: 金属的化学性质;金属活动性顺序及其应用;化合物中某元素的质量计算;质量守恒定律及其应用;常见化学反应中的质量关系.
考点点评: 本题难度较大,主要考查了金属的化学性质、金属活动性顺序的应用及有关的计算,培养学生分析问题、解决问题的能力.1年前查看全部
- 我国科学家在世界上首次合成铪元素的一种原子.已知铪元素在元素周期表中的原子序数是72,相对原子质量为185.下列说法错误
我国科学家在世界上首次合成铪元素的一种原子.已知铪元素在元素周期表中的原子序数是72,相对原子质量为185.下列说法错误的是( ) A.该元素的原子有72个质子 B.该元素是金属元素 C.该元素的原子有113个电子 D.该元素原子的中子数为113  落228片叶子1年前1
落228片叶子1年前1 -
 悠_着 共回答了12个问题
悠_着 共回答了12个问题 |采纳率91.7%在原子中质子数=核电荷数=核外电子数=原子序数,已知铪元素在元素周期表中的原子序数是72,故其质子数=核外电子数=原子序数=72,所以A正确,C错误;
铪元素的汉语名称的偏旁为金字旁,应为金属元素,所以B正确.
根据相对原子质量≈质子数+中子数,铪元素原子的相对原子质量为185,其中子数为185-72=113,所以D正确.
故选C.1年前查看全部
- 科学家在研究相对原子质量时,为什么不取1个氢1原子的质量为标准,而要取碳12原子质量的十二分之一为标准
科学家在研究相对原子质量时,为什么不取1个氢1原子的质量为标准,而要取碳12原子质量的十二分之一为标准
氢原子最轻,以一个氢原子的相对原子质量为“1”,来求其它原子的相对原子质量,不是更好理解吗? 玩猫的老鼠睿1年前2
玩猫的老鼠睿1年前2 -
 viva_qian 共回答了27个问题
viva_qian 共回答了27个问题 |采纳率92.6%因为一个氢原子只有一个质子,一个质子是1.007,一个中子是1.008,一般来说原子中质子和中子的数量不会相差太多.
C正好是6个质子6个中子,这样除以12之后,相当于一原子量=半个中子+半个质子,这样来说用来表示其他原子的原子质量时候就会比较标准.
而如果用一个氢表示1,则用来表示高原子序数的原子的相对原子质量时就会出现一定误差1年前查看全部
- 已知作为相对原子质量标准的一个碳-12原子质量为akg.(1)一个R原子的质量为bkg,则R原子
已知作为相对原子质量标准的一个碳-12原子质量为akg.(1)一个R原子的质量为bkg,则R原子
已知作为相对原子质量标准的一个碳-12原子质量为akg.
(1)一个R原子的质量为bkg,则R原子的相对原子质量为?
(2)一个X离了带两个单位负电荷,一个X原孑的质量为mkg,核内质子数比中子数少1则X的核电荷数为? f_cnq22fzc4f331年前2
f_cnq22fzc4f331年前2 -
 雨中鱼108 共回答了17个问题
雨中鱼108 共回答了17个问题 |采纳率88.2%(1)b/(a/12)=12b/a
(2)质量数=m/(a/12)=12m/a,
则X的核电荷数=12m/a-中子数1年前查看全部
- 相对原子质量的计算为什么以C12为标准?
 嫩萝卜1年前3
嫩萝卜1年前3 -
 vv草 共回答了19个问题
vv草 共回答了19个问题 |采纳率94.7%原子的绝对质量很小,如果用千克来表示,很不方便.于是采用这样一种碳原子质量的1/12作标准,其他原子的质量跟它比较所得的值,就是这种原子的相对原子质量.
之所以采用C-12作为相对原子质量的标准而不采用其它的原子,其原因大致是:(1)碳形成很多高质量的“分子离子”和氢化物,利于测定质谱;(2)12C很容易在质谱仪中测定,而用质谱仪测定相对原子质量是现代最准确的方法;(3)采用C-12后,所有元素的相对原子质量都变动不大,仅比过去减少0.004 3%;(4)这种碳原子在自然界的丰度比较稳定;(5)碳在自然界分布较广,它的化合物特别是有机化合物繁多;(6)密度最小的氢的相对原子质量仍不小于1.1年前查看全部
- 关于化学元素周期表的问题高中化学课本的元素周期表中,元素名称和相对原子质量之间那行数字和字母表示什么,象f d s p和
关于化学元素周期表的问题
高中化学课本的元素周期表中,元素名称和相对原子质量之间那行数字和字母表示什么,象f d s p和前面的系数以及右上角的数字各是什么含义? 张辰雨1年前1
张辰雨1年前1 -
 vertuqd 共回答了17个问题
vertuqd 共回答了17个问题 |采纳率88.2%你是刚上高中的学生吗?那么你的知识层面还没达到,这是高中竞赛以及大学的内容.
我们都知道原子由原子核及核外电子组成,而核外电子依据其能量和运动情况可以分为若干个电子层,即K,L,M,N...等等,越往后的离核越远,一个电子层最多可容纳电子数为2乘以n的平方个(n=K时取1,L时取2,依次类推).
这只是一种粗略的分层方法,实际上,每一电子层内部还有能量及运动状态的区别,以此每一电子层内部还可细分为诸如s,p,d,f...为名称的电子亚层,你看到的即是某一元素原子最外层电子层的亚层的分布状况,系数表明这是第几电子层的亚层,角标表明该亚层里容纳了几个电子.每一电子亚层里最多可容纳电子数为2*(2n-1)个(n取s时为1,依次类推,但还要考虑一个电子层内最多会有几个亚层,根据上一段就能知道).
在高等化学中,对这些概念都有特殊规定,电子所在电子层称为主量子数,所在亚层称为角量子数,所在轨道称为磁量子数,自旋方向称为自旋量子数.是描述核外电子运动的四大重要特征,将其代入著名的薛定谔方程可以求得电子核外的运动波形.至于磁量子数和自旋量子数,在这里不赘述了.
如果你有兴趣,可以翻阅高中化学读本或高等教育出版社的无机化学,当然,也可以去参加化学竞赛小组,限于篇幅,我只说这么多了.希望对你有所帮助.1年前查看全部
- 化学上通常用AZX来表示一种原子的组成.其中X为元素符号,Z为核电荷数,A为相对原子质量.现有12 6 C、13 6 两
化学上通常用AZX来表示一种原子的组成.其中X为元素符号,Z为核电荷数,A为相对原子质量.现有12 6 C、13 6 两种粒子 回答:1 它们是否属于同一种元素?为什么?2 比较它们这两种原子的异同点.并体会元素和原子的关系!
 yaun1年前1
yaun1年前1 -
 弹琴的月光 共回答了19个问题
弹琴的月光 共回答了19个问题 |采纳率100%1.是 核电荷数相同就是同一种元素.2.一种元素可以有多种原子.1年前查看全部
- R元素的氧化物相对分子质量 142,其中氧原子相对原子质量和 80,R原子核16粒子不带电,儿核电荷数为15 求
R元素的氧化物相对分子质量 142,其中氧原子相对原子质量和 80,R原子核16粒子不带电,儿核电荷数为15 求
2.R元素化合价 babylady111年前3
babylady111年前3 -
 贫血的蚂蚁 共回答了19个问题
贫血的蚂蚁 共回答了19个问题 |采纳率94.7%P2O5
化合价为-3,+5 ,在P2O5中显示+5价1年前查看全部
- 铀元素的平均相对原子质量为238.0289 它有三种同位素 238-92U 235-92U 234-92U,其中中子数为
铀元素的平均相对原子质量为238.0289 它有三种同位素 238-92U 235-92U 234-92U,其中中子数为146的同位素所占原子百分数应最接近于
A 99% B 50% C 10% D无法确定 转瞬即逝anni1年前1
转瞬即逝anni1年前1 -
 老--屋 共回答了16个问题
老--屋 共回答了16个问题 |采纳率81.3%铀的质子数为92,中子数为146,则质量数为238.三个同位素中的第一种.
平均相对原子质量=质量数1×原子百分数+质量数2×原子百分数+质量数3×原子百分数+……
这个只有三个,用三个就可以了.
238.0289=238×原子百分数+235×原子百分数+234×原子百分数
其实不用算,就可以看出来,为A.1年前查看全部
- 相对原子质量就是什么和衡量基准的一个比值
 345加菲1年前1
345加菲1年前1 -
 叛逆ll 共回答了25个问题
叛逆ll 共回答了25个问题 |采纳率92%相对原子质量就是原子的实际质量和衡量基准的一个比值.1年前查看全部
- 八年级下能力测试作为相对原子质量标准的碳-12可以写成12C(12在C的左上角,下同).一个12C的原子的质量为a千克,
八年级下能力测试
作为相对原子质量标准的碳-12可以写成12C(12在C的左上角,下同).一个12C的原子的质量为a千克,一个12CO2(2在O的右下角,下同)分子的质量为b千克,若以12CO2分子中的一个氧原子质量的1/16作为相对原子质量的标准,则12CO2的式量是()
A、(32b)/(b-a) B、(32b)/(a-b)
C、(16b)/(b-a) D、(8b)/(b-a)
为什么?要具体说明理由! yangwenzhe200481年前1
yangwenzhe200481年前1 -
 funfun26 共回答了17个问题
funfun26 共回答了17个问题 |采纳率70.6%选a
计算式是 如果以二氧化碳中的氧的1/16为标准
氧原子的质量就是 (b-a)*1/2
二氧化碳的分子量的计算方法就是 b/[(b-a)*1/2*1/16]1年前查看全部
- 题目提供了密度 相对原子质量 阿伏伽德罗常数 以及晶胞图 且体对角线上的三个球彼此两两相切,求na
题目提供了密度 相对原子质量 阿伏伽德罗常数 以及晶胞图 且体对角线上的三个球彼此两两相切,求na
题目提供了密度 相对原子质量 阿伏伽德罗常数 以及晶胞图 且体对角线上的三个球彼此两两相切,求na的半径,
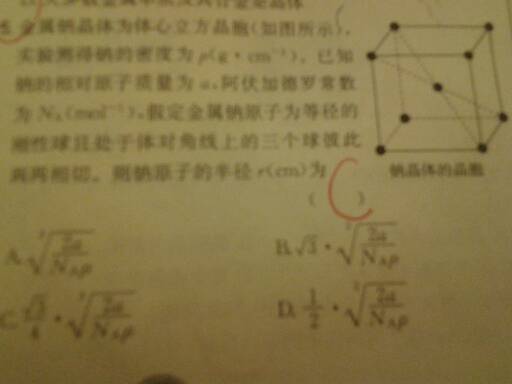
 紫艺na1年前1
紫艺na1年前1 -
 lks9803 共回答了12个问题
lks9803 共回答了12个问题 |采纳率100%金属钠的堆积方式为体心立方堆积,其体对角线长为钠原子半径的四倍.所以求钠原子半径最终转化为求该晶胞的棱长,设其为a.
每个晶胞中所含钠原子数为8*1/8 +1=2,其体积为a^3(a的立方).
钠的摩尔质量为23g/mol,除以其密度ρ即为一摩尔钠原子所占的体积.
可得出如下对应关系如下
2 NA
a^3 23/ρ
列比例式可求得晶胞的棱长a.
体对角线为棱长的根号三倍.
再除以四可得钠原子半径.
具体思路如上,因个人技术原因,很多符号打不出来,请见谅.希望对你有所帮助.1年前查看全部
大家在问
- 1相对原子质量就是什么和衡量基准的一个比值
- 2矩形ABCD中,AC,BD对角线交于O,角AOB=60度,AC=15cm,AB是多少
- 3有限个可列集之并可列证明证明有限个可列集之并是可列的我觉得可以用归纳法证,A1={a1,...,an,..}A2={b1
- 4急求问题:设直线y等于2x-4与抛物线y的平方等于4x交于A,B两点,点A在第一象限. ...
- 5非常专业的回答,解决了我很多疑问,但我还有2点不明白,所以再提一个问题,感觉您对语法很相当精通
- 6That is a factory.(改为复数句)
- 7已知分段函数f(x)={1-x,x≤0;a的x次方,x>0,若f(1)=f(-1),a的值?
- 8What is the __________ of the parcel?(post) 答案是postage,难道pos
- 9limx趋向无穷 xcos1/x的极限 limx趋向0xtanx的极限
- 10沪科版高一第一学期4.1 物质在溶解过程中有能量变化吗
- 11左边是幺字下面加四点,右边是一个定字.这是什么字?
- 121.红磷在空气中燃烧时产生黄色火焰,放热,产生大量____
- 13用酒精灯给试管里的液体加热时,发现试管破裂了,造成试管破裂的可能原因有:
- 14不是整个诗的意思,是诗题的意思.不会的被乱答.
- 15英语中,on the desk 在B动词前,如何提问
