将5.85gNaCl晶体溶入水中制成100mL溶液,制得1mol/L的NaCl溶液
 xiaojiatangzi2022-10-04 11:39:542条回答
xiaojiatangzi2022-10-04 11:39:542条回答将5.85gNaCl晶体溶入100mL水中,制得0.1mol/L的NaCl溶液,这话为什么对?NaCl晶体不是含水吗?称出的NaCl的质量应该少于5.85克吖?有个类似的题目把晶体的水不算是那个物质.好象是五水CuSO4

已提交,审核后显示!提交回复
共2条回复
 qpliu 共回答了18个问题
qpliu 共回答了18个问题 |采纳率83.3%- 那要看怎么说了,分子式都写出来了,还哪能说带结晶水呢?NaCl也可以以无水的形式存在嘛.不过这话说的不太精确,忽略了加入后体积的变化,应该是在容量瓶中定容至100毫升才好呀.
- 1年前
 13的王13 共回答了51个问题
13的王13 共回答了51个问题 |采纳率- NaCl晶体不含水,含结晶水的盐,组成他的离子一般最少都有一个是复杂的,比如硫酸铜,中的硫酸根,
- 1年前
相关推荐
- 饱和nacl溶液,滴入浓hcl,是否会因cl离子浓度增大而有晶体析出,为什么
 wannis1年前2
wannis1年前2 -
 srene 共回答了12个问题
srene 共回答了12个问题 |采纳率91.7%不一定,因为HCl可能浓度不够,即浓度小于NaCl中的Cl-的浓度,如果浓度够的话会有c(Na+)*c(Cl-)=Ksp为定值,Cl-浓度增大,显然平衡向沉淀方向移动,除去Cl2中的HCl就是通过饱和NaCl1年前查看全部
- 怎么制取硫酸铝晶体?有的人说加热硫酸铝溶液结晶,但是这样不会促使铝离子水解吗?
 thirtyfour1年前2
thirtyfour1年前2 -
 漫游fish 共回答了13个问题
漫游fish 共回答了13个问题 |采纳率84.6%因为硫酸是不挥发性酸.硫酸铝如果水解,那么水解产物是氢氧化铝和硫酸,硫酸不挥发,那么硫酸仍旧会溶解氢氧化铝.所以硫酸铝不水解.
我所说的水解是蒸发结晶的强烈的水解.不是单纯在溶液中的水解.1年前查看全部
- t℃时,将某硝酸钾溶液第一次蒸发掉l 0g水,冷却至原温度析出晶体1g;第二次蒸发掉10g水,冷却至原温度析出
t℃时,将某硝酸钾溶液第一次蒸发掉l 0g水,冷却至原温度析出晶体1g;第二次蒸发掉10g水,冷却至原温度析出晶体3g;第三次再蒸发掉10g水,冷却至原温度析出晶体应为( )
A.等于3g
B.大于3g
C.等于lg
D.小于或等于lg 一绝阿伟1年前1
一绝阿伟1年前1 -
 besd 共回答了18个问题
besd 共回答了18个问题 |采纳率88.9%在一定温度下,将某硝酸钾溶液蒸发掉10g水,析出晶体1g,说明这时候的溶液是饱和溶液;再蒸发掉10g水,析出3g硝酸钾,则可得出此温度下硝酸钾的溶解度就等于30g,再蒸发10g水,会析出3g晶体.
故选A.1年前查看全部
- 13.9g XSO4•nH2O晶体,完全失水后,剩余7.6g粉末,若X的原子量为结晶水分子数的8倍,则X的原子
13.9g XSO4•nH2O晶体,完全失水后,剩余7.6g粉末,若X的原子量为结晶水分子数的8倍,则X的原子量为( )
A. 23
B. 27
C. 40
D. 56 好好点1年前4
好好点1年前4 -
 inb3tv 共回答了25个问题
inb3tv 共回答了25个问题 |采纳率84%解题思路:13.9g XSO4•nH2O晶体,完全失水后,剩余7.6g粉末,则水的质量为13.9g-7.6g=6.3g,利用组成中的质量可知,XSO4与水的物质的量之比为1:n,以此来计算解答.13.9g XSO4•nH2O晶体,完全失水后,剩余7.6g粉末,则水的质量为13.9g-7.6g=6.3g,
若X的原子量为结晶水分子数的8倍,
XSO4与水的物质的量之比为1:n,
则
7.6g
n×8+96:
6.3
18=1:n,
解得n=7,
则X的相对原子质量为7×8=56,
故选D.点评:
本题考点: 相对原子质量及其计算.
考点点评: 本题考查相对原子质量的计算,明确定组成是解答本题的关键,题目难度不大,但计算较繁琐.1年前查看全部
- 不规则的硫酸铜晶体放入饱和的硫酸铜溶液中是否会变成规则的晶体
不规则的硫酸铜晶体放入饱和的硫酸铜溶液中是否会变成规则的晶体
大概要多长时间?
大概要多长时间?较大的 俺的确良1年前1
俺的确良1年前1 -
 mayaren 共回答了23个问题
mayaren 共回答了23个问题 |采纳率91.3%会变成规则的晶体,但很小,8-12小时即可(一夜)
附:
制备晶体方法:
①选用纯净胆矾在洁净的烧杯里制成饱和溶液,制备时的温度可高出室温12~15℃
②取出上层清液倒在洁净的蒸发皿里(溶液浑浊不清则应过滤).当蒸发皿里溶液冷却时,可产生一些较大颗粒的晶体.在这些晶体里选出几何形状比较完整的备用.
③将其余的晶体连同饱和溶液一起倒入洁净的烧杯里,加热并不断搅袢,至晶体全部溶解,停止加热并静止,让其逐渐冷却.
④将挑选出的一颗晶体用细丝系住,悬挂在饱和溶液里,晶体在液面以下约2~3厘米处,静置不动,加盖防止灰尘进入,数天后可获得大晶体.
制备注意事项
①必须用纯净的晶体和蒸馏水配制溶液;
②容器要十分洁净;
③降温速度越慢越好;
④必须静置较长时间;
⑤盛溶液的烧杯必须加盖.
这样即可从硫酸铜溶液中得到大块的硫酸铜晶体1年前查看全部
- 摄氏温度规定冰水混合物的温度为0摄氏度,即在环境温度高于和低于0℃时,冰水混合物的温度总是0℃。请运用晶体熔化和凝固时温
摄氏温度规定冰水混合物的温度为0摄氏度,即在环境温度高于和低于0℃时,冰水混合物的温度总是0℃。请运用晶体熔化和凝固时温度变化的规律,分析冰水混合物的温度为什么会总保持为0℃?  wwmm1年前1
wwmm1年前1 -
 周婷 共回答了19个问题
周婷 共回答了19个问题 |采纳率84.2%当环境温度高于0℃时,冰水混合物吸热,其中冰开始熔化,即相当于处于熔化过程中,温度保持0℃不上升,当环境温度低于o℃时,冰水混合物放热,其中的水开始结冰,即相当于凝固过程,温度仍保持0℃不下降,故冰水混合物的温度总为0℃1年前查看全部
- 晶体的外形有规则和物理性质各向异性,从微观结构看是由于________的缘故。液晶是一种特殊的物质,它既具有液体的___
晶体的外形有规则和物理性质各向异性,从微观结构看是由于________的缘故。液晶是一种特殊的物质,它既具有液体的________,又像某些晶体那样具有光学各向异性。  清凉情绪1年前1
清凉情绪1年前1 -
 ysp211 共回答了19个问题
ysp211 共回答了19个问题 |采纳率94.7%物质微粒在空间有规则排列,流动性1年前查看全部
- GaN晶体中为什么Ga原子会与4个N原子链接(山东2007高考题)
GaN晶体中为什么Ga原子会与4个N原子链接(山东2007高考题)
很奇怪啊,Ga是第三主族元素,外围仅3个电子,而N为第五主族元素,外围有5个电子,从理论上说应该只与3个N原子相连啊.为什么会凭空多出一根价键呢?是因为Ga是金属元素,有空轨道成了配位键吗?如果是那又怎么解释同族元素B所成的立方氮化硼也是B与4个N原子相连呢(虽然用等电子体理论可以说明)? zgz07511年前1
zgz07511年前1 -
 隆锅台看好快男 共回答了17个问题
隆锅台看好快男 共回答了17个问题 |采纳率82.4%GaN中的成键方式确实是Ga和N各用三个成单电子形成三个共价键,再用Ga的空轨道和N的孤电子对形成第四个共价键——配位键;由于成键后四条化学键无法区分,因此其结构与SiC是一样的,与BN也相同;等价电子体就具有相似的...1年前查看全部
- 使白色CuSO4变为蓝色晶体的是什么气体
使白色CuSO4变为蓝色晶体的是什么气体
是CO2、CO、H2,中的哪一种? wamyisafool1年前2
wamyisafool1年前2 -
 牛股牛市 共回答了20个问题
牛股牛市 共回答了20个问题 |采纳率80%呃…这三种都不会使白色CuSO4变成蓝色晶体,但是若是其中混有水蒸气的话就会变蓝了.
白色CuSO4是检验是否含有水蒸气的检验剂.1年前查看全部
- 化学(是否正确)以下说法是否正确?常温下,0.1 mol/L某一元弱酸(HA)溶液中加入一定量的CH3COONa晶体或加
化学(是否正确)
以下说法是否正确?
常温下,0.1 mol/L某一元弱酸(HA)溶液中加入一定量的CH3COONa晶体或加水稀释,溶液的c(OH-)均增大. 罗白菜1年前3
罗白菜1年前3 -
 爱的精灵 共回答了23个问题
爱的精灵 共回答了23个问题 |采纳率87%加入醋酸钠晶体是增大的,CH3COO- + H+ H+ + OH-表面上看加入水后平衡向右移动,OH浓度上升,但是加水稀释的倍数远比平衡移动增加的量大得多,所以应该是减小的1年前查看全部
- 某物质(仅含一种溶质)的溶液在t℃时,恒温蒸发掉10g水,析出了2g晶体,再恒温蒸发掉10g水,又析出了3g晶体,则下列
某物质(仅含一种溶质)的溶液在t℃时,恒温蒸发掉10g水,析出了2g晶体,再恒温蒸发掉10g水,又析出了3g晶体,则下列说法正确的是( )
A. 原溶液在t℃时一定是不饱和溶液
B. 原溶液一定是稀溶液
C. 最后剩余的溶液一定比原溶液稀
D. 最后剩余溶液的溶质质量分数比原溶液的溶质质量分数小 北方的一条狼1年前1
北方的一条狼1年前1 -
 木鱼糖 共回答了19个问题
木鱼糖 共回答了19个问题 |采纳率94.7%解题思路:根据饱和溶液与不饱和溶液的概念分析;利用溶质质量分数的计算公式分析,溶质质量分数=溶质质量溶液质量×100%A、因为该溶液饱和后恒温蒸发掉10g水,要析出3g晶体,而刚开始恒温蒸发掉10g水,只析出了2g晶体,所以原溶液一定不是饱和溶液,故A正确;
B、溶液的浓稀只是相对来说的,所以不能讨论原溶液的浓稀;故B错误;
C、原溶液为不饱和溶液,而最后的溶液是该温度下的饱和溶液,所以最后的溶液一定比原溶液浓,故C错;
D、原溶液为不饱和溶液,而最后的溶液是该温度下的饱和溶液,所以最后的溶液溶质质量分数比原溶液的溶质质量分数大,故D错;
故选A点评:
本题考点: 晶体和结晶的概念与现象;饱和溶液和不饱和溶液;浓溶液、稀溶液跟饱和溶液、不饱和溶液的关系.
考点点评: 本题考查了饱和溶液和不饱和溶液的相关知识,饱和溶液:一定温度下,一定量的溶剂里不能继续溶解某物质的溶液;不饱和溶液:一定温度下,一定量溶剂里还能继续溶解某物质的溶液.1年前查看全部
- 共价键、离子键、配位键和范德华力是粒子之间的四种作用力.现有下列晶体:①Na2O2②SiO2③[Cu(NH3
共价键、离子键、配位键和范德华力是粒子之间的四种作用力.现有下列晶体:①Na2O2②SiO2③[Cu(NH3 )4]Cl2④NH4Cl ⑤NaCl ⑥AlCl3,其中含有三种作用力的是( )
A.只有①②③
B.只有①②③⑥
C.只有③④⑥
D.只有③④ 大丈夫_hh1年前1
大丈夫_hh1年前1 -
 耒姒 共回答了23个问题
耒姒 共回答了23个问题 |采纳率91.3%解题思路:一般来说,活泼金属与非金属形成离子键,非金属元素之间形成共价键,单方提供空轨道和单方提供孤对电子可形成配位键,分子之间存在分子间作用力(范德华力),以此来解答.①Na2O2存在离子键和共价键;
②SiO2中只存在共价键;
③[Cu(NH3)4]Cl2中存在氯离子与四氨合铜离子之间的离子键、N-H之间的共价键及铜离子提供空轨道和N原子孤对电子形成的配位键;
④NH4Cl中含氯离子与铵根离子之间的离子键、N-H之间的共价键及氢离子提供空轨道和N原子孤对电子形成的配位键;
⑤NaCl中只含离子键;
⑥AlCl3中含共价键、配位键和范德华力,
则含有三种作用力的是③④⑥,
故选C.点评:
本题考点: 化学键;配合物的成键情况.
考点点评: 本题考查化学键,为高频考点,把握化学键形成的一般规律为解答的关键,注意特殊物质中的化学键(铵盐、氯化铝)即可解答,氯化铝中含配位键为解答的难点,一般不涉及氯化铝中的配位键,题目难度不大.1年前查看全部
- 晶体中分子间作用力越大,分子越稳定.为什么?
 夕1591年前1
夕1591年前1 -
 百合幽兰lily 共回答了21个问题
百合幽兰lily 共回答了21个问题 |采纳率85.7%楼上说的没错.题目如果真是这样说的话就是非常不严谨的,也就是错的.
分子晶体中分子间作用力越大,晶体就越稳定.分子本身稳定与否与分子间作用力大小没什么关系.1年前查看全部
- 如何证明具有对称心的晶体不可能具有三阶张量
 错误的相与1年前1
错误的相与1年前1 -
 坤孩儿 共回答了20个问题
坤孩儿 共回答了20个问题 |采纳率100%这要把对称操作施加到晶体上,通过分析坐标的变换和性质的不变性,才能确定出三阶张量的18个分量是否为0.
一般,正交晶系、三斜晶系和立方晶系的若干种晶体就具有三阶张量常数.1年前查看全部
- KI晶体和HgCl2晶体不反应,在溶液中能反应的原因是什么?
KI晶体和HgCl2晶体不反应,在溶液中能反应的原因是什么?
与接触面积有关还是离子浓度有关 sycqcwb1年前1
sycqcwb1年前1 -
 spincity 共回答了19个问题
spincity 共回答了19个问题 |采纳率94.7%KI晶体和HgCl2晶体不反应,是因为晶体中没有自由移动的离子.
在溶液中能反应的原因是溶于水后,HgCl2能电离出离子,其中的Hg2+与I—结合生成红色的HgI2沉淀,使离子浓度减小,使反应能进行.1年前查看全部
- 元素金(Au)处于周期表中的第六周期,与Cu同族,Au原子外围电子排布式为________;一种铜金合金晶体具有立方最密
元素金(Au)处于周期表中的第六周期,与Cu同族,Au原子外围电子排布式为________;一种铜金合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心、Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为________;该晶体中,原子之间的作用力是________.
 gyzh83101年前1
gyzh83101年前1 -
 sos_anita 共回答了27个问题
sos_anita 共回答了27个问题 |采纳率81.5%Cu原子核外有29个电子,其核外电子排布式为[Ar]3d104s1,Au与Cu同族,则Au原子的外围电子排布式为5d106s1.铜金合金晶体具有立方最密堆积结构,晶胞中Cu原子处于面心、Au原子处于顶点,则每个晶胞中含有Cu原子个数为1/2 ×6=3个,含有Au原子个数为1/8 ×8=1个,故Cu、Au原子个数比为3∶1.铜金合金属于金属晶体,原子之间的作用力为金属键.1年前查看全部
- 熔融的氢氧化钠 硝酸钾晶体 这两个哪个能导电 又是电解质?
熔融的氢氧化钠 硝酸钾晶体 这两个哪个能导电 又是电解质?
怎样才能知道 哪种物质导电 哪种不导电呢? sammyhe761年前1
sammyhe761年前1 -
 夜魔之刃 共回答了15个问题
夜魔之刃 共回答了15个问题 |采纳率73.3%能否导电,看其中有无自由移动的离子或自由电子.
熔融的氢氧化钠——有自由移动的钠离子和氢氧根离子——能导电.
硝酸钾晶体——无自由移动的离子——不能导电.
电解质,指的是化合物,且在熔融状态或在溶液中能电离出自由移动的离子,能导电.熔融的氢氧化钠、硝酸钾晶体都属于电解质.
所以,能导电又是电解质的是熔融的氢氧化钠.1年前查看全部
- 题目问碳形成的单质晶体可能是什么,我知道金刚石是原子晶体,C60是分子晶体.但是
题目问碳形成的单质晶体可能是什么,我知道金刚石是原子晶体,C60是分子晶体.但是
石墨是混合晶体,那我能不能填原子晶体分子晶体和金属晶体?就是问金属晶体可不可以填? 糙级先生1年前8
糙级先生1年前8 -
 wolfwang03 共回答了18个问题
wolfwang03 共回答了18个问题 |采纳率94.4%金属晶体是肯定不能填在石墨上的1年前查看全部
- 山东初4化学题举例说明溶解度曲线有那些应用?我国北方有一个盐硝湖,当地居民“夏天晒盐(NaCl晶体),冬天捞硝(KNO3
山东初4化学题
举例说明溶解度曲线有那些应用?我国北方有一个盐硝湖,当地居民“夏天晒盐(NaCl晶体),冬天捞硝(KNO3晶体)”,请说明其中的道理? littleplane1年前1
littleplane1年前1 -
 xcvksoaidfuoasip 共回答了19个问题
xcvksoaidfuoasip 共回答了19个问题 |采纳率94.7%问题 举例说明溶解度曲线有那些应用?答:溶解度曲线的应用 1.查找指定温度时物质的溶解度,并根据溶解度判断溶解性.2.比较相同湿度时(或一定湿度范围内)不同物质溶解度的大小.3.比较和确定物质的溶解度受温度影响的程度,并据此确定物质结晶或混合物分离提纯的方法.4.确定溶液的状态(饱和与不饱和).问题 我国北方有一个盐硝湖,当地居民“夏天晒盐(NaCl晶体),冬天捞硝(KNO3晶体)”,请说明其中的道理?答:1.少数固体物质的溶解度受温度的影响很小,曲线为"缓升型",如氯化钠.夏天的温度高,水蒸发而结晶出NaCl晶体; 2.大多数固体物质的溶解度随温度升高而增大,曲线为"陡升型",如硝酸钾.冬天天气冷,使KNO3的溶解度降低而结晶出KNO3晶体.1年前查看全部
- 海波是一种晶体,图中哪个是海波熔化的图象( )
海波是一种晶体,图中哪个是海波熔化的图象( )
A.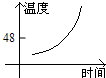
B.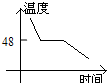
C.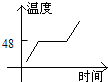
D.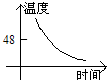
 horizonwing1年前1
horizonwing1年前1 -
 anly82 共回答了17个问题
anly82 共回答了17个问题 |采纳率76.5%解题思路:晶体和非晶体的主要区别是晶体有一定的熔点,而非晶体没有熔点.在熔化图象上的区别是晶体的熔化图象有一个水平线段,该线段对应的温度就是晶体的熔点;而非晶体的熔化图象测没有水平线段.海波是晶体,其熔化过程虽然吸热,但温度不变.
A、图中图象显示随时间的增加,温度逐渐上升,但是温度在不断地升高,是非晶体的熔化图象,与题意不符;
B、图象显示随时间的增加,温度下降,但中间有一段时间内温度不变,说明是晶体的凝固图象,与题意不符;
C、图象显示随时间的增加,温度上升,而且有一段时间温度保持不变,说明这一段时间内,虽然吸热,但温度不变,是晶体的熔化过程,故本选项正确
D、图象显示随时间的增加,温度逐渐下降,是非晶体的凝固图象,与题意不符.
故选C.点评:
本题考点: 晶体的熔化和凝固图像.
考点点评: 该题考查晶体与非晶体的熔化、凝固图象的区别,关键是从晶体熔化(或凝固)过程温度不变这一特征来考虑.1年前查看全部
- t摄氏度时,a毫升某物质的饱和溶液的质量为b克,将其蒸干,得到晶体c克,则该物质的溶液在t摄氏度时的质量
 yy0081921年前4
yy0081921年前4 -
 yanligl 共回答了13个问题
yanligl 共回答了13个问题 |采纳率84.6%该物质的溶液在t摄氏度时的质量为b克
该物质的溶液在t摄氏度时的质量分数为c/b*100%1年前查看全部
- 一定温度时,向密闭容器里的食盐饱和溶液中加入5G食盐晶体,经过一段时间后( )
一定温度时,向密闭容器里的食盐饱和溶液中加入5G食盐晶体,经过一段时间后( )
A.饱和溶液质量增大
B.晶体的质量不变
很奇怪,为什么给出答案是A?
加入5克食盐晶体, 愤然居士1年前1
愤然居士1年前1 -
 yyhuohu75430 共回答了20个问题
yyhuohu75430 共回答了20个问题 |采纳率100%B.
首先是在一定温度下,密闭容器里水分不会蒸发. 而且它原本就是食盐饱和溶液,溶质质量为100%.当它加入5克食盐晶体,它不会再继续溶解. 不排除很多习题集难免会有答案印刷错误的情况.1年前查看全部
- 为什么 熔点 原子晶体大于离子晶体大于分子晶体
 南欣儿1年前2
南欣儿1年前2 -
 禹夭 共回答了23个问题
禹夭 共回答了23个问题 |采纳率91.3%原子晶体断裂的是共价键,离子晶体断裂的是离子键,分子晶体断裂的是分子间作用力或氢键,断裂的键型不同1年前查看全部
- 关于鲁米诺的困惑鲁米诺(又称发光氨),它是一种黄色的晶体,一种刺激性的强酸.如果要跟血迹反应,是应该先把它配成溶液试剂吗
关于鲁米诺的困惑
鲁米诺(又称发光氨),它是一种黄色的晶体,一种刺激性的强酸.如果要跟血迹反应,是应该先把它配成溶液试剂吗?如果时晶体状态,可以跟血迹反应吗? 寓羚先尊1年前1
寓羚先尊1年前1 -
 裴不了 共回答了12个问题
裴不了 共回答了12个问题 |采纳率83.3%鲁米诺luminol,又名发光氨.可以鉴别经过擦洗,时间很久以前的血痕.它常温下是一种黄色晶体或者米黄色粉末,是一种比较稳定的化学试剂.它的化学式是C8H7N3O2 结构式在下面的图图里面有.同时,鲁米诺又是一种碱性物质,对眼睛、皮肤、呼吸道有一定刺激作用.在检验血痕时,鲁米诺与血红素(hemoglobin,血红蛋白中负责运输氧的一种蛋白质)发生反应,显出蓝绿色的荧光.鲁米诺的灵敏度可以达到一百万分之一.即1滴血混在 999,999滴水中时也可以被检验出来.不过它与其他具有氧化性的物质也发生反应,但是显示的颜色和显色的时间长短都是不同的.任何东西都不会不留痕迹地消失.这对于暴力犯罪受害者尤为适用.凶手可以处理掉受害者尸体,擦去一滩滩的血,但如果不使用强效清洁剂,仍将会留下一些痕迹.血液中的微小粒子将会附着在现场表面许多年,却无人知晓.
编辑本段基本原理
发光氨的基本原理是:几种化学物质与血液中的含氧蛋白——血红蛋白发生发光化学反应,从而显示血液的痕迹.分子会分裂成原子,原子重新组合成新分子.在这一特定反应中,反应物(原有分子)比生成物(生成分子)能量大.分子以可见光子的形式释放出多余的能量.这一过程通常称为化学发光,与萤火虫和荧光棒发光现象类似.
编辑本段适用范围
.使用发光氨的一个问题是化学反应会破坏犯罪现场的其他证据.基于这一原因,调查人员仅会在尝试其他办法之后,才使用发光氨.发光氨的确是警察的有用工具,但在现实犯罪调查中,并不像有些电视节目上使用得那样普遍.警察不会一走进犯罪现场,便开始向所有物体表面喷射发光氨.
编辑本段缺点
发光氨的缺点:它能照亮如铜和漂白剂等物质而不是血液.一直用发光氨来检测血液,也能摧毁血液证据,虽然研究证明一个能自行生产发育的DNA匹配经常在发光氨血液检测中被发现.最后一点就是,目前还不清楚发光氨是否是一种致癌物质.当CSI用发光氨检测血液时,他们首先将发光氨与过氧化氢混合.发光氨与过氧化氢进行化学反应.发光氨损耗氢和氮生成过氧化物,而过氧化物损耗氧生成发光氨.反应产生3个氨基.当发光氨进行化学反应时,它会损失电子,使之成为一个氧化反应.所以,在这个化学反应过程中,过氧化氢是氧化剂,因为它正在不断减少.反应后,3个氨基中的电子留在较高的能量水平.当电子回落到它们的正常能量水平,能量被释放,而人眼所看到的是一缕浅蓝色的光 虽然,发光氨的用途没有一些化学品的多.但是,在加拿大,在抓捕极端危险的罪犯时,它发挥了非常重要的作用,使其成为一个非常重要的化学品.1年前查看全部
- 将不饱和溶液蒸发,至开始有晶体析出时停止加热,这时得到的溶液是
将不饱和溶液蒸发,至开始有晶体析出时停止加热,这时得到的溶液是
如上.是 饱和溶液 还是 不饱和溶液?
为什么 小鱼瞎溜达1年前7
小鱼瞎溜达1年前7 -
 oO年 共回答了19个问题
oO年 共回答了19个问题 |采纳率84.2%饱和溶液.
从有晶体开始析出时就是饱和溶液了.因为溶液中已经不能溶解更多的溶质了.1年前查看全部
- 晶体的概念和基本性质是?
 ycym1271年前1
ycym1271年前1 -
 lclgye 共回答了16个问题
lclgye 共回答了16个问题 |采纳率93.8%晶体即是内部质点在三维空间呈周期性重复排列的固体.晶体的分布非常广泛,自然界的固体物质中,绝大多数是晶体.气体、液体和非晶物质在一定的合适条件下也可以转变成晶体.1.长程有序:晶体内部原子在至少在微米级范围...1年前查看全部
- 尿素,醋酸.硝酸三者的相对分子质量相近,形成的晶体都属于分子晶体,但三者的溶沸点相差较大,
 魍魉魑魅111年前3
魍魉魑魅111年前3 -
 寒城风云 共回答了24个问题
寒城风云 共回答了24个问题 |采纳率100%首先硝酸是无机物,无机物的溶沸点一般都比有机物要高,醋酸和尿素的主要是空间结构不同!1年前查看全部
- 溶质,溶剂,在硫酸铜饱和溶液中,加入少量白色硫酸铜粉末,可能出现下列现象:1.有兰色晶体析出2.饱和溶液中的溶质减小3.
溶质,溶剂,
在硫酸铜饱和溶液中,加入少量白色硫酸铜粉末,可能出现下列现象:1.有兰色晶体析出2.饱和溶液中的溶质减小3.饱和溶液中的溶质增加4.饱和溶液中的溶剂减小5.饱和溶液中的溶剂增加6.饱和溶液的总质量不变.以下判断正确的一组是:
A,1.2.4
B:1.3.5
C:3.4.6
D:2.5.6 巴山劲松21年前1
巴山劲松21年前1 -
 redmapleleaf 共回答了25个问题
redmapleleaf 共回答了25个问题 |采纳率92%A 1、2、4
白色粉末是CuSO4,加水后变成五水硫酸铜(CuSO4·5H2O),水减少所以溶剂减少,溶剂减少所以蓝色晶体析出,蓝色晶体析出所以溶质减少,1年前查看全部
- ===初三化学===甲、乙两同学在室温时各取50gA物质的溶液,分别做制备晶体实验.
===初三化学===甲、乙两同学在室温时各取50gA物质的溶液,分别做制备晶体实验.
甲、乙两同学在室温时各取50gA物质的溶液,分别做制备晶体实验.甲将溶液蒸发掉10g水后冷却到室温,得到晶体1.2g(晶体不含结晶水),乙将溶液蒸发掉15g水后冷却到室温,得到晶体2.4g.若两人实验结果都正确,问:
(1)室温时A物质的溶解度___________(求计算过程)
(2)A物质原溶液的质量分数___________(求计算过程)
可不可以把过程每一步写的详细一点,鄙人比较笨- . 摆渡fei1年前1
摆渡fei1年前1 -
 cd_xa 共回答了13个问题
cd_xa 共回答了13个问题 |采纳率84.6%1)室温时A物质的溶解度_(2.4g-1.2g)/(15g-10g)*100g=24g_.
(2)A物质原溶液的质量分数.
蒸发掉10g水后冷却至室温,得到晶体1.2g.溶液蒸发掉15g水后冷却至室温,得到晶体2.4g.
则 50gA物质的溶液蒸发5g水刚好饱和,溶质质量为 24g/(24g+100g)*(50g-5g)=8.7g
A物质原溶液的质量分数 8.7g/50g*100%=17.4%
肯定是对的,我有答案,对过了1年前查看全部
- 晶体都是固体吗 NH3 F2 NF3 之中有没有分子晶体
 ssg46481年前1
ssg46481年前1 -
 挺华盟主 共回答了17个问题
挺华盟主 共回答了17个问题 |采纳率100%晶体都是固体吗
当然.
NH3 F2 NF3 之中有没有分子晶体?
如果深冷冷冻到结晶,他们都是分子晶体.1年前查看全部
- 500克与200克质量分数相同的氯化钾溶液在某一温度时恒温蒸发80克水,两者析出晶体质量比较
 我的故事无人能懂1年前1
我的故事无人能懂1年前1 -
 qw008 共回答了15个问题
qw008 共回答了15个问题 |采纳率80%200克的析出晶体质量比较大,(200克的氯化钾溶液在某一温度时恒温蒸发相对含值较小)1年前查看全部
- 考考你:例如:三个日本人→(答案是晶体) 1:上岸的化学名词是→(?) 2:怒发冲冠的化学名词是→(?
 完美微笑1年前3
完美微笑1年前3 -
 4月的窦娥 共回答了17个问题
4月的窦娥 共回答了17个问题 |采纳率94.1%1:上岸的化学名词是→脱水
2:怒发冲冠的化学名词是→蒸发1年前查看全部
- 求晶体和非晶体熔化的温度变化记录(采纳分:50)
求晶体和非晶体熔化的温度变化记录(采纳分:50)
(晶体和非晶体不限)
每分钟记录一次或两次,记录时间固定,每个被测物体约需20个的温度记录 pzy07051年前2
pzy07051年前2 -
 hedtan 共回答了21个问题
hedtan 共回答了21个问题 |采纳率85.7%这里作业设计的2题有:1年前查看全部
- 把5.85g NaCl 晶体和10g 98%的浓硫酸(H2SO4)混合,强热,问可产生多少升HCl气体.(标准状况)
 忆蓝鸟1年前2
忆蓝鸟1年前2 -
 panlu01 共回答了14个问题
panlu01 共回答了14个问题 |采纳率100%NaCl +H2SO4= NaHSO4+HCl
58.5g 98g 22.4L
5.85g x y x=9.8g y=2.24L1年前查看全部
- 为什么溶解度相减等于析出的晶体?
 吉仓秀1年前1
吉仓秀1年前1 -
 超强悟空 共回答了14个问题
超强悟空 共回答了14个问题 |采纳率92.9%这样想:
两个温度下,物质的溶解度有差异.
就是说,两个温度下,溶液中的溶质不一样多.
那么少了的溶质去哪里了?只能是析出了
所以溶解度相减等于析出的晶体1年前查看全部
- 下列叙述正确的是 A.酒精和水混合,体积变小的过程系统熵增加.B.在特定的条件下,晶体和非
下列叙述正确的是 A.酒精和水混合,体积变小的过程系统熵增加.B.在特定的条件下,晶体和非
下列叙述正确的是
A.酒精和水混合,体积变小的过程系统熵增加.
B.在特定的条件下,晶体和非晶可以相互转化.
C.质量相同的零摄氏度的氢气和零摄氏度的氧气,内能一定相同
D.从单一热源吸收热量并把它全部用来做功是不可能的 ztbeer1年前3
ztbeer1年前3 -
 立言 共回答了19个问题
立言 共回答了19个问题 |采纳率89.5%一定质量的分子内能包括:分子总动能动能和分子总势能,分子动能和温度有关,势能和体积有关,此题,他们的势能不一样,所以内能就不一样.1年前查看全部
- 石英中无色透明晶体就是通常所说的什么?
 would1681年前1
would1681年前1 -
 ahaya 共回答了14个问题
ahaya 共回答了14个问题 |采纳率100%ggg石英中无色透明的晶体就是通常所说的水晶.水晶通常呈无色透明状,当含有某些金属元素等杂质时,可呈现出紫色,蔷薇色...紫晶是淡紫到深紫色的水晶晶体,是水晶家族中身价最高的一员,因为水晶晶体内含有Mn,Fe3+而呈现紫色.1年前查看全部
- 常温下,决定晶体热导和金属电阻的主要因素是什么?如果不是常温,影响晶体热导的因素是什么?影响金属热导的因素是什么?
 tbest1年前2
tbest1年前2 -
 迷惘小伙 共回答了11个问题
迷惘小伙 共回答了11个问题 |采纳率100%晶格畸变程度和晶界密度.间隙原子越多、位错密度越高、晶格畸变程度越大、晶界越多的晶体声子散射越强,电阻越大.1年前查看全部
- 急 无色硫酸锌晶体与氢氧化铜 加稀盐酸反应,求硫酸锌晶体中税额质量分数
急 无色硫酸锌晶体与氢氧化铜 加稀盐酸反应,求硫酸锌晶体中税额质量分数
现取无色硫酸锌晶体(ZnSO4·x H2O)和呈蓝色的氢氧化铜共17.29克样品,进行如下实验,(下列各步加入的试剂都刚好完全反应):
样品17.29克 →加适量稀盐酸 搅拌 →有颜色的溶液内含CuCl2 4.05克 →加适量硝酸钡溶液 过滤 → 白色沉淀,烘干,质量为11.65克
{ 有颜色的溶液
求:(1)样品中Cu(OH)2的质量是 ▲ 克.
(2)硫酸锌晶体(ZnSO4•x H2O)里含结晶水的质量分数为 ▲ . 过敏世界20051年前1
过敏世界20051年前1 -
 冰咆哮 共回答了19个问题
冰咆哮 共回答了19个问题 |采纳率89.5%(1)设参加反应的Cu(OH)2的质量为X
Cu(OH)2-----------CuCl2
98 135
X 4.05g
所以X=2.94g
(2)设参加反应的ZnSO4质量为Y
ZnSO4--------BaSO4
161 233
Y 11.65g
所以Y=8.05g
所以M(XH2O)=17.29-2.64-8.05=6.6g
H2O%=6.6/(8.05+6.6)*100%=45.1%1年前查看全部
- 请问晶体SiO2的XRD的标准峰值分别是多少
 猪不是这么想的1年前1
猪不是这么想的1年前1 -
 娇气女孩 共回答了16个问题
娇气女孩 共回答了16个问题 |采纳率81.3%20.86 26.64 36.54 39.46 42.451年前查看全部
- 在一定温度下,将一包白色无水硫酸铜粉末投入到150g蒸馏水中,充分搅拌,过滤,得到一定质量的蓝色晶体和84g滤液,若此温
在一定温度下,将一包白色无水硫酸铜粉末投入到150g蒸馏水中,充分搅拌,过滤,得到一定质量的蓝色晶体和84g滤液,若此温度下无水硫酸铜的溶解度为40g,则此包无水硫酸铜的质量是多少?
 默儿爱李强1年前3
默儿爱李强1年前3 -
 光看不回帖 共回答了20个问题
光看不回帖 共回答了20个问题 |采纳率90%解题思路:根据饱和溶液中质量分数不变和溶解度计算出剩余饱和溶液中溶质和溶剂的质量,根据硫酸铜晶体组成计算晶体中溶质的质量,两者之和为此包无水硫酸铜的质量.把无水硫酸铜粉末加入150g蒸馏水中,得到一定量的蓝色晶体CuSO4•5H20,剩余溶液仍然是饱和溶液,设剩余溶液中的溶质为xg,
则[40g/100g+40g]=[xg/84g]得:x=24
结晶水的质量=150g-(84g-24g)=90g,设结晶中硫酸铜的质量为yg
CuSO4~5H20
160 90
yg90g
[160/90]=[yg/90g]
y=160,此包无水硫酸铜的质量为=160g+24g=184g.
答:此包无水硫酸铜的质量是184g.点评:
本题考点: 溶液中溶质的质量分数及相关计算.
考点点评: 本题考查质量守恒定律,质量分数的计算,解题时注意守恒思想的运用.1年前查看全部
- 20℃时,有二杯饱和的A溶液:甲杯盛100g,乙杯盛150g,在下列条件下,两杯溶液中析出晶体质量相同的是( )
20℃时,有二杯饱和的A溶液:甲杯盛100g,乙杯盛150g,在下列条件下,两杯溶液中析出晶体质量相同的是( )
A. 两杯溶液都降温至10℃
B. 同温下,甲杯蒸发掉10g水,乙杯蒸发掉60g水
C. 甲杯加25gA溶液,乙杯减少25gA溶液
D. 同温下,两杯都蒸发掉30g水 xbl20021年前1
xbl20021年前1 -
 明明强人一个 共回答了23个问题
明明强人一个 共回答了23个问题 |采纳率91.3%解题思路:A、根据降温后析出晶体的影响因素考虑;B、根据饱和溶液蒸发水,析出晶体的质量的影响因素考虑;C、根据加入溶液和减少溶液后溶液的变化情况考虑;D、根据饱和溶液蒸发水,析出晶体的质量的影响因素考虑.A、饱和溶液降温后析出晶体,与降温后的溶解度有关,还与原来溶液中的溶剂和溶解的溶质的多少有关,由于原来溶液的总质量不同,溶液中含有的溶质和溶剂各不相同,所以降温后析出的晶体的质量也不同,故A错;
B、饱和溶液蒸发溶剂析出晶体的原因是:被蒸发的水中,原来溶解的溶质不能继续被溶解,就以晶体的形式析出,所以析出晶体的质量与蒸发的水有关,与原来溶液的质量无关,因为甲杯蒸发掉10g水,乙杯蒸发掉60g水,蒸发水的质量不同,所以析出晶体的质量也不同,故B错;
C、甲杯加25gA溶液,因为加入的溶液和原来的溶液性质相同,溶液不会析出晶体,乙杯减少25gA溶液,也不会析出晶体,因为溶液是均一的,故C错;
D、饱和溶液蒸发溶剂析出晶体的原因是:被蒸发的水中,原来溶解的溶质不能继续被溶解,就以晶体的形式析出,所以析出晶体的质量与蒸发的水有关,与原来溶液的质量无关,因为两杯都蒸发掉30g水,所以析出晶体质量相同.
故选D.点评:
本题考点: 晶体和结晶的概念与现象.
考点点评: 解答本题关键是要知道饱和溶液蒸发溶剂,析出晶体的质量与原溶液质量无关,只与蒸发水的质量大小有关.1年前查看全部
- 在30℃时,把氯酸钾不饱和溶液等分成两份,恒温蒸发,一份蒸发去10克水析出晶体0.5克,另一份蒸发去20克水
在30℃时,把氯酸钾不饱和溶液等分成两份,恒温蒸发,一份蒸发去10克水析出晶体0.5克,另一份蒸发去20克水
析出晶体1.5克,则30℃时氯酸钾的溶解度是? henryxiang19801年前1
henryxiang19801年前1 -
 llhecf 共回答了17个问题
llhecf 共回答了17个问题 |采纳率94.1%蒸发10克水后溶液析出固体,说明蒸发10克水,溶液已经饱和
这样饱和溶液再蒸发10克水析出1.5-0.5=1克固体.(相当与原溶液直接蒸发20克水)
说明10克水溶解1克氯酸钾达到饱和
1/10=10/100 氯酸钾溶解度为10克/100克水1年前查看全部
- 晶体和非晶体的区别分别从 力学 光学 热学 磁场学 电学 解释简单的说下就可以了!
 linjhsony1年前3
linjhsony1年前3 -
 691120yoyo 共回答了21个问题
691120yoyo 共回答了21个问题 |采纳率90.5%晶体是原子、离子或分子按照一定的周期性在空间排列形成在结晶过程中形成具有一定规则的几何外形的固体.晶体通常呈现规则的几何形状,就像有人特意加工出来的一样.其内部原子的排列十分规整严格,比士兵的方阵还要整齐得多.如果把晶体中任意一个原子沿某一方向平移一定距离,必能找到一个同样的原子.而玻璃、珍珠、沥青、塑料等非晶体,内部原子的排列则是杂乱无章的.准晶体是最近发现的一类新物质,其内部排列既不同于晶体,也不同于非晶体.
非晶体又称无定形体 常见非晶体(两种)
内部原子或分子的排列呈现杂乱无章的分布状态的固体称为非晶体. 如玻璃、沥青、石蜡等.非晶态固体包括非晶态电介质、非晶态半导体、非晶态金属.它们有特殊的物理、化学性质.例如金属玻璃(非晶态金属)比一般(晶态)金属的强度高、弹性好、硬度和韧性高、抗腐蚀性好、导磁性强、电阻率高等.这使非晶态固体有多方面的应用.它是一个正在发展中的新的研究领域,近年来得到迅速的发展.
[晶体与非晶体区别]
本质区别
晶体有自范性,非晶体无自范性
物理性质不同
晶体是内部质点在三维空间成周期性重复排列的固体,具有长程有序,并成周期性重复排列. 非晶体是内部质点在三维空间不成周期性重复排列的固体,具有近程有序,但不具有长程有序.外形为无规则形状的固体. 晶体有各向异性,非晶体是各向同性 晶体有固定的熔点,非晶体无固定的熔点
微观结构不同
晶体和非晶体所以含有不同的物理性质,主要是由于它的微观结构不同. 组成晶体的微粒——原子是对称排列的,形成很规则的几何空间点阵;空间点阵排列成不同的形状,就在宏观上呈现为晶体不同的独特几何形状;组成点阵的各个原子之间,都相互作用着,它们的作用主要是静电力;对每一个原子来说,其他原子对它作用的总效果,使它们都处在势能最低的状态,因此很稳定,宏观上就表现为形状固定,且不易改变;晶体内部原子有规则的排列,引起了晶体各向不同的物理性质;如果外力沿平行晶面的方向作用,则晶体就很容易滑动(变形),这种变形还不易恢复,称为晶体的范性;从这里可以看出沿晶面的方向,其弹性限度小,只要稍加力,就超出了其弹性限度,使其不能复原,而沿其他方向则弹性限度很大,能承受较大的压力、拉力而仍满足虎克定律;当晶体吸收热量时,由于不同方向原子排列疏密不同,间距不同,吸收的热量多少也不同,于是表现为有不同的传热系数和膨胀系数. 而非晶体没有这结构
X射线衍射实验
当单一波长的X射线通过非晶体时,不会在记录仪上看到分立的斑点或明锐的谱线,而同一条件下摄取的晶体图谱中能看到分立的斑点或明锐的谱线.
21年前查看全部
- 氯化钠晶体中钠离子与氯离子个数是怎么查的
氯化钠晶体中钠离子与氯离子个数是怎么查的
老师是这么计算的 顶点1/8 棱 1/4 面1/2 体心1
然后Na+:1/8 * 8 + 1/4 *0 + 1/2 *6 + 1*0
棱不就是边吗 可是边上是有钠离子的呀 怎么能是0呢 hu_is_un1年前0
hu_is_un1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 常温下,固体分为晶体和非晶体.那么晶体与非晶体的最主要区别在哪里?
 hover1511年前5
hover1511年前5 -
 xx才 共回答了17个问题
xx才 共回答了17个问题 |采纳率94.1%晶体:具有固定熔沸点
非晶体:没有固定熔沸点1年前查看全部
- 分子晶体熔沸点一定低于原子晶体?不同类的!
 虹之美1年前2
虹之美1年前2 -
 没有钱的鱼 共回答了24个问题
没有钱的鱼 共回答了24个问题 |采纳率91.7%不同类的就没准了 例如:
分子晶体 水 熔点零度
原子晶体 汞 熔点零下38.8度1年前查看全部
- 问一道简单的化学溶液析出晶体的问题
问一道简单的化学溶液析出晶体的问题
溶液中溶质有硝酸钠和氯化钾,加热蒸发时首先析出的晶体是?
答案是氯化钠,硝酸钠和氯化钾又不反映哪来的氯化钠? yuqile1年前2
yuqile1年前2 -
 无情花 共回答了17个问题
无情花 共回答了17个问题 |采纳率82.4%看一下氯化钠和硝酸钠的溶解度曲线便知
氯化钠曲线很平缓(还是上升的),硝酸钠很陡.即氯化钠的溶解度随温度升高不大,而硝酸钠很大.
所以当加热蒸发,硝酸钠溶解度变大,仍旧溶解;NaCl则因为溶剂被蒸发,所以析出.1年前查看全部
- 晶体(包括离子,原子,分子,金属)发生物理变化(比如固体液化)是不是只克服分子间作用力?
 liaops-1021年前1
liaops-1021年前1 -
 guoting501 共回答了13个问题
guoting501 共回答了13个问题 |采纳率100%只有共价晶体分子才要克服分子间作用力
其他不存在分子结构,离子晶体克服离子键,金属克服金属键,原子晶体克服共价键1年前查看全部
大家在问
- 1英语作文一个便条
- 2己知:a是最小的正整数,b,c是有理数,并且|2+b|+(3a+2c)*(3a+2c )=0.求式子
- 3给病人打点滴(250毫升),每分钟滴的滴数与滴的时间成什么比例
- 41“细胞核内的RNA必须透过膜结构才能进入细胞质基质”对吗?为什么
- 5在长方体ABCD-A1B1C1D1中,AA1=AB=2,AD=1,点F,G分别是AB,CC1的中点,求D1到直线GF的距
- 6请问“药”这个词在英语里读什么?要有单词和音标
- 7已知A为锐角,应用三角函数的定义证明:sinA
- 8白居易在《钱塘湖春行》中借莺燕的活动来传达春天来临的信息并表达自己喜悦之情的诗句是
- 9直线y=ax+1和双曲线3x^2-y^2=1相交于A,B两点,问a为何值时,以AB为直径的圆过坐标原点?
- 10初中作文《我与小兔的亲密接触》
- 11整数集与有理数集的关系谁属于谁呢
- 12这些都是你给我的爱 读后感求一位大侠 帮我写下这篇文章的 读后感 随便你说 只要你能帮忙.
- 13若分式3x分之(x+3)平方为负数,则x的取值范围是,
- 14模仿“暑来寒去”结构的词语模仿“暑来寒去”这个词的结构的词语
- 1521.急 百分百给好评
