不溶于水的白色固体有哪些
 世界无限大2022-10-04 11:39:541条回答
世界无限大2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 hansq 共回答了20个问题
hansq 共回答了20个问题 |采纳率80%- 碳酸钡 BaCO3 不溶于水 白色固体
氢氧化钙 CaOH 微溶 白色固体
硫酸钙 CaSO4 微溶 白色固体
碳酸钙 CaCO3 不溶于水 白色固体
氢氧化镁 Mg(OH)2 不溶于水 白色固体
氢氧化铝 Al(OH)3 不溶于水 白色固体
氢氧化锰 Mn(OH)2 不溶于水 白色固体
碳酸锰 MnCO3 不溶于水 白色固体
氢氧化锌 Zn(OH)2 不溶于水 白色固体
碳酸锌 ZnCO3 不溶于水 白色固体
氢氧化铁 Fe(OH)2 不溶于水 白色固体
碳酸铁 FeCO3 不溶于水 白色固体
碳酸铜 CuCO3 不溶于水 白色固体 - 1年前
相关推荐
- 不溶于水的碱能不能与盐发生反应
 鸾鸟1年前1
鸾鸟1年前1 -
 sadglkjwrlkgrh 共回答了24个问题
sadglkjwrlkgrh 共回答了24个问题 |采纳率91.7%可以的
不一定非是酸式盐
如Zn(OH)2溶于NH4Cl1年前查看全部
- 资料一:木糖醇(化学式为:C5H12O5)是一种甜度相当于蔗糖、易溶于水的白色固体(木糖醇在某些温度下的溶解度分别为:3
资料一:木糖醇(化学式为:C5H12O5)是一种甜度相当于蔗糖、易溶于水的白色固体(木糖醇在某些温度下的溶解度分别为:30℃时70g、50℃时84g、60℃时90g).近年来,市场上木糖醇口香糖正逐渐取代蔗糖口香糖.
资料二:人体口腔中唾液正常的pH在6.6~7.1范围内,其酸性的增强不利于牙齿的健康.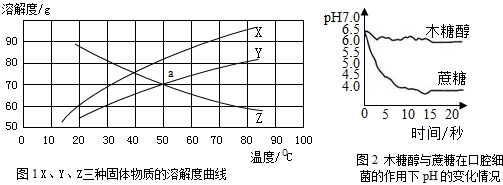
根据以上信息,回答下列问题:
(1)木糖醇属于______(填“高分子化合物”、“有机物”、“无机物”、“氧化物”);具有的物理性质有______.(任写一点)
(2)据图1判断:表示木糖醇溶解度曲线的是______(选填“X”、“Y”、或“Z”),图中a 点表示的含义是______.
(3)70℃时,将X、Y、Z三种物质的饱和溶液进行如下操作:
①均恒温蒸发等质量的水,析出晶体由多到少的顺序为______;
②均降温至50℃,欲使Y和Z溶液中溶质的质量分数相等,则可以采取的一种措施是______.
(4)分析图2 可知:在口腔细菌的作用下,木糖醇分解产物的酸性比蔗糖分解产物的酸性更______(填“强”或“弱”),所以咀嚼木糖醇口香糖比蔗糖口香糖更有利于牙齿的健康. 清清茶香1年前1
清清茶香1年前1 -
 mini_room 共回答了14个问题
mini_room 共回答了14个问题 |采纳率85.7%解题思路:由木糖醇(化学式为:C5H12O5)可以判断是否是有机物;物质的物理性质是指物质的颜色、状态、气味、溶解性、熔沸点、密度等;由木糖醇在某些温度下的溶解度分别为:30℃时70g、50℃时84g、60℃时90g,可以确定表示木糖醇水的溶解度曲线;根据固体物质的溶解度曲线可以:比较不同物质在70℃时的溶解度大小;由YZ两物质的溶解度受温度的变化情况,可以确定降温后欲使Y和Z溶液中溶质的质量分数相等,可以采取的一种措施;溶液的PH越小,酸性越强,PH越大,碱性越强.(1)由木糖醇(化学式为:C5H12O5)可知,木糖醇含有碳元素,故属于有机物;物质的物理性质一般指物质的颜色、状态、气味、溶解性、沸点、熔点等,因此木糖醇的物理性质有:白色、固体、易溶于水、有甜味等,故答案...
点评:
本题考点: 固体溶解度曲线及其作用;酸碱性对生命活动和农作物生长的影响;物质的简单分类.
考点点评: 本题难度一般,主要考查了如何根据图中提供的信息进行正确的判断、固体溶解度曲线所表示的意义,通过本题可以加强学生对固体溶解度的理解,培养学生应用知识解决问题的能力.1年前查看全部
- 有机物A易溶于水,且1molA能跟Na反应生成0.5molH2,但不与NaOH反应,已知A通过如下关系制的C4H8O2的
有机物A易溶于水,且1molA能跟Na反应生成0.5molH2,但不与NaOH反应,已知A通过如下关系制的C4H8O2的酯E,且当D到E时 式量增加28 B是一种烃A→B→C→D→E其中BC间 CDJ间+O2 DE间+A
求ACE三者结构简式和A→B C→D D→E的化学方程式 和反应类型 charesi1年前1
charesi1年前1 -
 328983665 共回答了24个问题
328983665 共回答了24个问题 |采纳率91.7%1molA能跟Na反应生成0.5molH2,但不与NaOH反应,说明A有且只有1个醇羟基.
A通过如下关系制的C4H8O2的酯E,且当D到E时 式量增加28 B是一种烃A→B→C→D→E其中BC间 CDJ间+O2 DE间+A,
当D→E时,和A反应生成的是C4H8O2的酯 式量增加28,B→C,C→D都是和氧气反应,发生的是氧化反应.
说明,ABCDE都是2个碳原子的有机物,且A为乙醇(CH3CH2OH),B为乙烯(CH2=CH2),C为乙醛(CH3CHO),D为乙酸(CH3COOH),E为乙酸乙酯(CH3COOCH2CH3).
ACE三者结构简式分别为CH3CH2OH,CH3CHO,CH3COOCH2CH3
A→B
CH3CH2OH→浓H2SO4,170℃→CH2=CH2↑+H2O,消去反应
C→D
2CH3CHO+O2→催化剂,加热→2CH3COOH,氧化反应
D→E
CH3COOH+CH3CH2OH→浓H2SO4,加热→CH3COOCH2CH3+H2O1年前查看全部
- 红磷燃烧探究空气成分问题,怎么能通过这个实验来判断氮气不溶于水的性质呢,老师讲了,但太快了,
红磷燃烧探究空气成分问题,怎么能通过这个实验来判断氮气不溶于水的性质呢,老师讲了,但太快了,
(也是上述实验)若集气瓶中的水的体积超过容器体积的五分之一,原因可能是
1.止水夹没夹紧
2.点燃红磷后伸入氧气瓶的速度过慢.(答案是正确,但原理是什么呢?
3.下列不能用来检测气密性的是:

 fnagheng1年前1
fnagheng1年前1 -
 xuyunfang 共回答了18个问题
xuyunfang 共回答了18个问题 |采纳率77.8%答:怎样判断氮气不溶于水呢,首先,要在空气大致是由1份氧气4份氮气组成为前提,就是说这个是默认已知条件,并且保证装置的气密性没有问题,还有知道红磷和氧气燃烧的产物只有固体,固体的体积在试验中可以被忽略,接着红磷要足够,能完全消耗完空气中的氧气,就是说试验是在理想状态下进行的,最重要的是试验结果是集气瓶中的水体积只有容积的1/5,那就说明1体积的氧气被全部消耗,并且4体积的氮气不溶于水,如果溶于水,那么集气瓶的水应该超过1/5.
原因2红磷是伸入集气瓶吧?可以这样理解,因为燃烧放出大量的热,慢慢放入红磷,由于热胀冷缩,在这个过程中会有部分的空气在没有盖好盖子前逸跑,等到红磷放好盖好集气瓶的盖子后,氧气被耗掉,瓶内温度逐渐下降,压强变小(比正常下耗掉氧气后的压强更小),所以水的体积会超过1/5.
不能检测的是A 原因是右边出气口没有夹住,夹住的话也可以检验的 B是可以的,这个是课本标准的检测方法,应该不用解析了吧.C也可以,因为从右边加热的话,由于热胀冷缩,气密性好的话,装置内的压强大了,就会把水柱抬高.D也可以,因为右边导气管是夹住的,当气密性好的时候,往长颈漏斗加入一些液体,开始会有一部分液体进去,进去液体也有体积的,它压缩瓶内的空气,当和外面大气压平衡,长颈漏斗的液体就不会再变化,气密性不好的话你往长颈漏斗倒多少液体,就进多少到瓶子里面.
楼主 答案够详细了吧,希望采纳,希望对你有帮助,同时我需要分数,谢谢1年前查看全部
- (2002•广州)下列物质中不溶于水,但能溶于稀硫酸的是( )
(2002•广州)下列物质中不溶于水,但能溶于稀硫酸的是( )
A.银
B.三氧化硫
C.氧化铁
D.醋酸 mengp1年前1
mengp1年前1 -
 静静的睡莲 共回答了18个问题
静静的睡莲 共回答了18个问题 |采纳率83.3%解题思路:不溶于水即是沉淀或不与水反应,溶于硫酸即能与硫酸反应,据此分析即可.不溶于水即是沉淀或不与水反应,溶于硫酸即能与硫酸反应,银不溶于水也不与硫酸反应,醋酸能溶于水,三氧化硫能溶于水并与之反应生成硫酸,只有氧化铁不溶于水,但能与硫酸反应生成硫酸铁的可溶物与水,符合要求.
故选C点评:
本题考点: 酸的化学性质.
考点点评: 此题是对物质性质的考查,解决此题可依据各选项物质的相关性质解决,属基础性知识考查题.1年前查看全部
- 1L标准状况下的HCL气体溶于水形成2L溶液,球该溶液的物质的量浓度.
 cnxmpr1年前3
cnxmpr1年前3 -
 水蓝雅 共回答了19个问题
水蓝雅 共回答了19个问题 |采纳率78.9%标况1L=1/22.4mol
∴浓度c=(1/22.4)/2=1/44.8=0.022mol/L1年前查看全部
- 硫酸是不是以离子形式溶于水?为什么能无限溶解?硫酸溶液是液体溶于水么?
硫酸是不是以离子形式溶于水?为什么能无限溶解?硫酸溶液是液体溶于水么?
那溶质H2SO4是液体分子?,浓它为啥不电离?浓硫酸不导电?
百分之百纯的硫酸没法制得么? 你很xx1年前7
你很xx1年前7 -
 你们ii实力派 共回答了16个问题
你们ii实力派 共回答了16个问题 |采纳率93.8%谁说硫酸和水不能无限溶解了?硫酸和水可以以任意比例互溶(刚刚改答案时顺便看了百度百科,看来我是没记错,真不知道LS诸位怎么学化学的……).
说“硫酸不能无限溶解”请去找一下“溶解”的定义.当然也可以说硫酸“不能无限溶解”,因为严格地说这里用“溶解”也不甚确切.
溶不溶解跟电不电离有关系么?
----
纯净的硫酸是极弱电解质,只能微弱地发生自偶电离(2H2SO4=(可逆)HSO4- + H3SO4+,类似于水2H2O=(可逆)H3O+ + OH-)而导电,但因为离子浓度太低,导电能力可以忽略不计.(剩余的硫酸主要以H2SO4分子形式存在)
浓硫酸中水含量少,硫酸主要以硫酸分子形式存在.
稀硫酸中硫酸完全电离(中学范围的认知,其实H2SO4的2级电离常温下不到30%),主要以H+、SO4(2-)的形式存在(实际上还包括HSO4-,以上全部是水合离子).
至于其中的差别,说穿了,就是H2O分子对H2SO4分子的作用……
----
100%硫酸是可以制得的.只要用SO3溶于浓硫酸中就好了.关键是控制SO3量的问题,一不小心过量了就成了发烟硫酸了(H2SO4中混有SO3等物质).1年前查看全部
- 酸性氧化物一定能溶于水吗?
 lyly19861年前3
lyly19861年前3 -
 lijie121cn 共回答了17个问题
lijie121cn 共回答了17个问题 |采纳率100%二氧化硅、七氧化二锰等都是酸性氧化物,但都不溶于水.1年前查看全部
- 将固体X投入过量的Y中,能生成白色沉淀并放出一种无色气体,该气体能燃烧,不易溶于水,则X和Y分别可能是( )
将固体X投入过量的Y中,能生成白色沉淀并放出一种无色气体,该气体能燃烧,不易溶于水,则X和Y分别可能是( )
A. 钠和氯化铝溶液
B. 铝和烧碱溶液
C. 过氧化钠和氯化亚铁
D. 锌和稀硫酸 晕8761年前2
晕8761年前2 -
 左手握剑 共回答了19个问题
左手握剑 共回答了19个问题 |采纳率89.5%解题思路:根据题意知,固体和Y的溶液能反应,且生成白色不溶物且放出气体,该气体是可燃性气体且不易溶于水,据此分析解答.A.钠和水反应生成氢氧化钠和氢气,氢氧化钠和氯化铝反应生成氢氧化率白色沉淀,生成的氢气能燃烧且不溶于水,所以符合条件,故A正确;
B.铝和氢氧化钠反应生成可溶性的偏铝酸钠和氢气,没有白色沉淀生成,故B错误;
C.过氧化钠和水反应生成氢氧化钠和氧气,氧气不能燃烧,且氢氧化钠和氯化亚铁反应生成灰白色沉淀氢氧化亚铁,氢氧化亚铁被氧气氧化生成氢氧化铁红褐色沉淀,故C错误;
D.锌和稀硫酸反应生成可溶性的硫酸锌和氢气,没有白色沉淀生成,故D错误;
故选A.点评:
本题考点: 钠的化学性质;钠的重要化合物;镁、铝的重要化合物.
考点点评: 本题考查元素化合物的性质,难度不大,根据生成物的溶解性、可燃性等来分析判断即可.1年前查看全部
- 熔化的KcL能导电吗?不是溶于水。
 多吃水果蔬菜1年前1
多吃水果蔬菜1年前1 -
 一帖成名天下知 共回答了17个问题
一帖成名天下知 共回答了17个问题 |采纳率88.2%熔化的KCl能导电1年前查看全部
- 氨气是一种具有强烈刺激性气味的气体,密度比空气小,极易溶于水,其水溶液显碱性,实验室可用浓氨水与生石灰反应来制取氨气.
氨气是一种具有强烈刺激性气味的气体,密度比空气小,极易溶于水,其水溶液显碱性,实验室可用浓氨水与生石灰反应来制取氨气.
(1)请你从图中选择实验室用此方法制取氨气的发生装置.
(2)若用C装置收集氨气,则气体要从 (填“a”或“b”)进入集气瓶.
(3)将石蕊溶液滴加到盛有氨气的集气瓶中,可观察到的现象是什么?
(4)氨气具有强烈刺激性,怎么才能正确闻氨气的气味?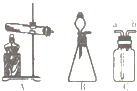
 baci12211年前1
baci12211年前1 -
 蝙蝠狂人 共回答了21个问题
蝙蝠狂人 共回答了21个问题 |采纳率71.4%(1)B;(2)B;(3)石蕊试液变成蓝色;(4)用手在容器口轻轻扇动,让极少量气体飘进鼻孔.
1年前查看全部
- (2012•武汉模拟)二氧化硫是一种无色、有刺激性气味的有毒气体,易溶于水,密度比空气大.实验室常用亚硫酸钠(Na2SO
(2012•武汉模拟)二氧化硫是一种无色、有刺激性气味的有毒气体,易溶于水,密度比空气大.实验室常用亚硫酸钠(Na2SO3)固体与浓硫酸在常温下反应制取二氧化硫.现有如下装置:若在实验室中用上述装置制备并收集一瓶二氧化硫气体,且符合“绿色化学”理念,所选装置的连接顺序(按气体从左到右的方向)是( )

A.①接③
B.①接⑥,⑦接⑤
C.②接⑨,⑧接⑥
D.②接④ maria1969091年前1
maria1969091年前1 -
 静思俊 共回答了15个问题
静思俊 共回答了15个问题 |采纳率80%解题思路:制取装置包括加热和不需加热两种,实验室常用亚硫酸钠(Na2SO3)固体与浓硫酸在常温下反应制取二氧化硫,因此不需要加热;二氧化硫能溶于水,密度比空气的密度大,因此只能用向上排空气法;为了环保,用最后一个装置,二氧化硫的密度比空气的密度大,因此应该从长管进入.二氧化硫污染空气,因此可以用氢氧化钠溶液吸收.A、实验室常用亚硫酸钠(Na2SO3)固体与浓硫酸在常温下反应制取二氧化硫,因此不需要加热;故选项错误;
B、不需要加热,不能用排水法收集,故选项错误;
C、不需要加热,为了环保,用最后一个装置,二氧化硫的密度比空气的密度大,因此应该从长管进入;二氧化硫污染空气,因此可以用氢氧化钠溶液吸收.故选项正确;
D、如果用向上排空气法收集,容易造成污染,故选项错误;
故选C点评:
本题考点: 常用气体的发生装置和收集装置与选取方法;常见气体的检验与除杂方法;绿色化学.
考点点评: 本考点主要考查气体的制取装置和收集装置的选择,同时也考查了气体的收集和吸收.气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关.本考点是中考的重要考点之一,主要出现在实验题中.1年前查看全部
- NO,NO2,O2混合物溶于水!坐等..
NO,NO2,O2混合物溶于水!坐等..
a ml NO ,b ml NO2 ,x ml O2 ,混合于同一试管中且倒插水槽中,在一段时间后,气体全部消失,求x 与 a ,b 的关系 . yz3071年前4
yz3071年前4 -
 noelzhzhmin 共回答了24个问题
noelzhzhmin 共回答了24个问题 |采纳率91.7%如题,使用如下方程式:1)2NO+O2=2NO2
2)4NO2+O2+2H2O=4HNO3
联立1)、2)得:NO+NO2+O2+H2O=2HNO3
即:A:B:X=1:1:11年前查看全部
- 将0.3mol NaCl固体与0.1mol CuSO4•5H2O固体混合溶于水,配成1升混合液.然后
将0.3mol NaCl固体与0.1mol CuSO4•5H2O固体混合溶于水,配成1升混合液.然后取出200ml溶液,用石墨电极,通电一段时间(不考虑水解).
求Cl-正好全部变为氯气逸出时,阴极上产生的气体体积(标准状况下)是多少?
所得溶液的pH为多少(假设溶液体积不变)? zjjkiller1年前1
zjjkiller1年前1 -
 爱似夏花 共回答了29个问题
爱似夏花 共回答了29个问题 |采纳率86.2%解题思路:(1)根据溶液中阴阳离子的放电顺序,判断每一阶段放电的离子,然后写出电解反应的离子方程式;
(2)先确定最后阶段放电的离子,再写出阴极上发生的电极反应式;
(3)先根据题意判断当阴极有气体产生时发生的电解反应,然后计算铜全部析出时剩余的氯离子的物质的量,根据氯离子的物质的量计算阴极上生成气体的体积.根据题意知,取出的溶液中含有的溶质的物质的量分别为:NaCl 0.06mol,CuSO4 0.02mol;溶液中阴阳离子的放电顺序分别为:阳离子放电顺序Cu2+>H+>Na+,阴离子放电顺序为Cl->OH->SO42-,所以,该溶液电解三个阶段分别为:
第一阶段:Cu2+和Cl-放电,生成氯气和铜.阴极电极反应Cu2++2e-=Cu,阳极电极反应2Cl--2e-=Cl2↑;
根据得失电子相等知,铜离子先完全电解,氯离子还剩0.02mol,所以发生第二阶段电解反应;
第二阶段:H+ 和Cl-放电,生成氢气和氯气;
根据得失电子相等知,氯离子完全电解,发生第三阶段反应,
第三阶段:H+ 和OH-放电,生成氢气和氧气.
根据以上分析知,第一阶段的电解反应为Cu2++2Cl-
通电
.
Cu+Cl2
电解的最后阶段,H+ 在阴极上放电,OH-的阳极上放电,分别生成氢气和氧气.
第一阶段根据得失电子相等知,铜离子先完全电解,氯离子还剩0.02mol,所以发生第二阶段电解反应;
当阴极上有气体生成时,发生的电解反应为:
2Cl-+2H2O
通电
.
Cl2↑+H2↑+2OH-
2 22.4L 2
0.02mol 0.224L 0.02mol
阴极上生成氢气0.224L;生成氢氧根离子浓度=[0.02mol/0.2L]=0.1mol/L
溶液pH=13.
答:Cl-正好全部变为氯气逸出时,阴极上产生的气体体积(标准状况下)是 0.224L;所得溶液的pH为13.点评:
本题考点: 电解原理.
考点点评: 本题考查了电解原理的分析判断,解题时注意以下几点:混合溶液中离子的放电顺序.发生电解反应的三个阶段.只有明确知道这些问题才能正确解答本题,题目难度较大.1年前查看全部
- SO2溶于水显酸性,加入氯化钙生成亚硫酸钙,但是亚硫酸钙不是不能在酸性条件下存在吗
SO2溶于水显酸性,加入氯化钙生成亚硫酸钙,但是亚硫酸钙不是不能在酸性条件下存在吗
如题 千鳥流1年前3
千鳥流1年前3 -
 雨水依一 共回答了13个问题
雨水依一 共回答了13个问题 |采纳率76.9%你往二氧化硫里滴入氯化钙不生成沉淀,不反应
原理你自己已经分析出来了,可是你为何还认为能反应1年前查看全部
- Ca(OH)2溶于水后会不会放出大量的热?
 褐色的貓1年前4
褐色的貓1年前4 -
 海的幻想 共回答了21个问题
海的幻想 共回答了21个问题 |采纳率85.7%理论上讲碱性物质溶于水都会放热,所以氢氧化钙溶于水也会放热.但是氢氧化钙是微溶于水的,所以不会发出大量的热.我试过,在试管中溶解根本感觉不到放热.1年前查看全部
- 某一固体物质可能由NaOH AlCl3 FeCl3 SiO2中的几种组成 将一定量的该物质溶于水有沉淀,在逐滴加入5mo
某一固体物质可能由NaOH AlCl3 FeCl3 SiO2中的几种组成 将一定量的该物质溶于水有沉淀,在逐滴加入5mol/L盐酸
 lazy_M1年前1
lazy_M1年前1 -
 ysx3461887 共回答了16个问题
ysx3461887 共回答了16个问题 |采纳率93.8%某一固体物质可能由NaOH AlCl3 MgCl2中的几种组成,溶于水有沉淀,这说明固体中肯定有氢氧化钠,至少含有氯化铝与氯化镁中的一种.
首先分析一下这个图,先看上升的线,其代表随着稀盐酸的加入沉淀量逐渐增加,这说明溶液中有偏铝酸钠.加入20mL5mol/L盐酸,偏铝酸钠完全反应,NaAlO2+HCl+H2O==NaCl+Al(OH)3↓,则偏铝酸钠是0.1mol,氢氧化铝也是0.1mol.
再看水平线,代表随着盐酸的加入沉淀量不变,说明氢氧化钠的量是过量的.还有一开始就有沉淀,那么沉淀肯定是氢氧化镁.则说明原固体是氢氧化钠、氯化铝、氯化镁的混合物.
氢氧化镁是0.1mol,氢氧化钠是0.05mol.
沉淀量最大值为0.1mol氢氧化铝,0.1mol氢氧化镁.两者可消耗HCl0.3mol+0.2mol=0.5mol.
V(HCl)=0.5/5=0.1L=100mL.
则M=30+100=130.1年前查看全部
- 下列几种物质,哪个可以溶于水 A.CuCO3 B.BaSO4 C.AgNO3 D.Mg(OH)2
 yeliucheng1年前4
yeliucheng1年前4 -
 likefgq 共回答了15个问题
likefgq 共回答了15个问题 |采纳率73.3%选 C
A BD 分别是蓝色,白色,白色沉淀
C 是少数可溶的银盐.1年前查看全部
- 复分解反应反应物条件是:当反应物为盐盐或盐碱时反应物必须溶于水.那为什么酸发生复分解反应时不需要溶于水?
 fengxiaohui1年前2
fengxiaohui1年前2 -
 asdf7512 共回答了18个问题
asdf7512 共回答了18个问题 |采纳率94.4%事实上,我们说的酸正常情况下就是酸溶液,而碱的话一般都是固体(一般是其氧化物或氢氧化物)直接溶于水配置而成的1年前查看全部
- 暗绿色固体A不溶于水,将A与NaOH固体共熔得易溶于水的化合物B.将B溶于水后加入H2O2得黄色溶液C.向C中加入稀硫酸
暗绿色固体A不溶于水,将A与NaOH固体共熔得易溶于水的化合物B.将B溶于水后加入H2O2得黄色溶液C.向C中加入稀硫酸至酸性后转化为橙色溶液D.向酸化的D溶液中滴加Na2SO4溶液得绿色溶液E.向E中加入氨水得灰蓝色沉淀F,再加入氯化铵并微热则F溶解得紫红色溶液G.请给出字母所代表的物质并写出相关的反应方程式.
 yuhuat1年前2
yuhuat1年前2 -
 guiwawa0428 共回答了15个问题
guiwawa0428 共回答了15个问题 |采纳率93.3%A:Cr2O3
B:NaCrO2
C:Na2CrO4
D:Na2Cr2O7
E:Cr2(SO4)3
F:Cr(OH)3
G:[Cr(NH3)2(H2O)4]3+1年前查看全部
- 硝酸是什么气体溶于水,为何和金属反应不一定放出氢气?
 kundali1年前3
kundali1年前3 -
 forevernan 共回答了15个问题
forevernan 共回答了15个问题 |采纳率93.3%五氧化二氮,是硝酸酸酐不假,但常温下为白色固体,微溶于水,热水才全溶.融水后生成硝酸.
二氧化氮是红棕色气体,溶水生成硝酸.在无氧气条件下还会生成无色气体一氧化氮,有氧气时生成硝酸.以下为化学式:
4NO2+3O2+2H2O=4HNO3 3NO2+H2O=2HNO3+NO1年前查看全部
- 有机物溶于氢氧化钠哪些不溶于水的有机物会溶于氢氧化钠溶液?有苯吗?
 lnkj1年前2
lnkj1年前2 -
 277597309 共回答了17个问题
277597309 共回答了17个问题 |采纳率94.1%很少有溶的
酒精之类 甲醛之类的 主要是溶解在水中的
苯不溶解1年前查看全部
- 常见的无机酸中,不溶于水的盐类有哪些?
 queric1年前1
queric1年前1 -
 满涯尽是报料人 共回答了18个问题
满涯尽是报料人 共回答了18个问题 |采纳率100%硫酸钡.硫酸铅.氯化铅不溶
氟化钙不溶.碳酸盐除了第一主族和氨盐以外基本不溶
硝酸盐全溶
(有些碳酸盐会双水解,如碳酸铝.碳酸铁,他们一遇水就分解,谈不上溶解度问题.)1年前查看全部
- 糖块溶于水为什么是说明了分子间有间隔而不是分子在做无规则运动?
 广泛反抗1年前7
广泛反抗1年前7 -
 58600 共回答了19个问题
58600 共回答了19个问题 |采纳率94.7%无规则运动,如果他举了一个例子比如多少体积的水喝多少体积的酒精混合,结果体积小于两者融合前体积总和 那就是说明分子间有间隔1年前查看全部
- 4升盐酸溶于水,溶液中氢离子浓度大于NA对吧
 grantcho1年前1
grantcho1年前1 -
 jackoooppp 共回答了16个问题
jackoooppp 共回答了16个问题 |采纳率93.8%根据溶液的电荷守恒:氢离子=氢氧根离子+氯离子,由于氯离子=1mol,OH->0,所以H+>1mol
氢离子浓度大于NA1年前查看全部
- 为什么说液态醋酸溶于水能导点 不是已经是液态溶于水了吗
 ee的过客1年前1
ee的过客1年前1 -
 sgx5216332 共回答了21个问题
sgx5216332 共回答了21个问题 |采纳率95.2%液态醋酸只是醋酸的一种形式,是纯净物,而溶于水后是醋酸溶液,是混合物,能电离出H+和Ac-,所以能导电.1年前查看全部
- 有NaCl和KCl的混合物26.6g,溶于水形成溶液,加入含0.8摩尔硝酸银的溶液200克,充分反应后滤出沉淀,洗涤干燥
有NaCl和KCl的混合物26.6g,溶于水形成溶液,加入含0.8摩尔硝酸银的溶液200克,充分反应后滤出沉淀,洗涤干燥
称其质量为57.4g,求原混合物中NaCll,KCl的物质的量各为多少? 刘tt宇1年前2
刘tt宇1年前2 -
 彝家小妹妹 共回答了10个问题
彝家小妹妹 共回答了10个问题 |采纳率100%NaCl,KCl各有0.2mol.解析如下:
通过AgCl的质量57.4g,可得n(AgCl)=0.4mol,即原混合物中Cl为0.4mol.由于混合物可以写成XCl的形式,所以原混合物总物质的量就是0.4mol.于是我们可以算出该混合物的平均摩尔质量
M=26.6/0.4=66.5g/mol.正巧发现,NaCl和KCl二者摩尔质量的平均数(58.5+74.5)/2=66.5!所以二者物质的量之比就是1:1,各为0.2mol啦!
注:通过平均摩尔质量计算二者比例时,更普适的算法应该是十字交叉,如果楼主不懂,我可以详细解释~
希望对你有所帮助!1年前查看全部
- 化学问题,关于氯气溶于水取一支盛满氯气的试管,将其倒扣在水槽中,静置一段时间后,试管内的液面上升至试管的几分之几处?求原
化学问题,关于氯气溶于水
取一支盛满氯气的试管,将其倒扣在水槽中,静置一段时间后,试管内的液面上升至试管的几分之几处?求原理 svmen1年前3
svmen1年前3 -
 宵寅 共回答了15个问题
宵寅 共回答了15个问题 |采纳率80%氯气的溶解度为1:2,即1体积水能溶解2体积氯气,所以“一段时间”如果足够长,水是可以充满试管的.氯气与水的反应比较微弱,Cl2+H2O=HCl+HClO1年前查看全部
- 关于氯气‘溶于水’的问题既然已经与水发生反应生成了HCl 和 HClO 发生了 为什么还说是 ‘溶于水’呢?
 流星划破天际1年前1
流星划破天际1年前1 -
 kkf3 共回答了16个问题
kkf3 共回答了16个问题 |采纳率62.5%因为新制氯水反应并不充分,仍有大量氯气以分子形式存在于水中.事实上,化学中某元素或某物质只要以1纳米以下的粒子存在于某溶剂中,就视为溶解,如活泼金属和酸反应,由单质变为金属阳离子,金属单质已不存在,但仍描述为“溶于某酸中”1年前查看全部
- 关于酸碱盐的溶解性表关于NO3的老师叫我们只要背K,Na,NH4,与NO3能溶于水,其它的都要,但溶解表上所有阳离子和N
关于酸碱盐的溶解性表
关于NO3的老师叫我们只要背K,Na,NH4,与NO3能溶于水,其它的都要,但溶解表上所有阳离子和NO3结合都易溶,不知道是不是因为初中生只要记NO3这些,还是因为NO3有什么性质? dfhsir1年前1
dfhsir1年前1 -
 游戏人间的猪 共回答了14个问题
游戏人间的猪 共回答了14个问题 |采纳率92.9%溶解性表只需要背不溶于水的物质即可.你们老师说的只记那些是因为你们学的硝酸盐很少,只有列出的那些而已.关于硝酸根的性质,你将在高一第一学期的时候学到.祝你中考顺利!1年前查看全部
- 纯碱样品(少量)溶于水,再加上过量CaCL2反应公式
 gtnygzz1年前2
gtnygzz1年前2 -
 fmanager1911 共回答了19个问题
fmanager1911 共回答了19个问题 |采纳率84.2%Na2CO3 + CaCl2 = CaCO3↓ + 2NaCl1年前查看全部
- CuSO4溶于水时的水溶液为蓝色,那么CuSO4在常温下溶于水是不是不会与水发生反应?
 黄帝1年前1
黄帝1年前1 -
 笑霸天_心问佛 共回答了19个问题
笑霸天_心问佛 共回答了19个问题 |采纳率94.7%先CuSO4在水中全部电离,很少一部分与水发生水解反应,
化学方程式:CuSO4 + 2H2O(可逆) Cu(OH)2 + H2SO4
离子方程式:Cu2+ 2H2O(可逆) Cu(OH)2 +2H+
大部分CuSO4溶于水电离生成Cu2+离子和SO42-离子,所以溶液呈蓝色(即Cu2+颜色)..
只有加CuSO4固体过多,溶液成饱和溶液后,有蓝色晶体析出.
CuSO4+ 5H2O = CuSO4.5H2O1年前查看全部
- 急 室温下,如果将0.1mol/LNH4Cl和0.05mol/L的NaOH全部溶于水,形成混合溶液(假设无损)
急 室温下,如果将0.1mol/LNH4Cl和0.05mol/L的NaOH全部溶于水,形成混合溶液(假设无损)
哪两种粒子的无质量之和等于0.1mol
哪两种粒子的物质量之和比OH-多0.05mol loura琨1年前2
loura琨1年前2 -
 brtq 共回答了20个问题
brtq 共回答了20个问题 |采纳率95%若是各1L溶液混合,则NH3.H2O+NH4+=0.1mol(物料守恒)
[NH4+]+[H+]-[OH-]=0.05MOL(电荷守恒)1年前查看全部
- 溶液1.将氢氧化钠溶于水,溶液温度 ( ),而将硝酸铵溶于水,溶液的温度( ),这是物质溶解时的热现象.2.将氢氧化钠溶
溶液
1.将氢氧化钠溶于水,溶液温度 ( ),而将硝酸铵溶于水,溶液的温度( ),这是物质溶解时的热现象.
2.将氢氧化钠溶于水,溶液温度( ),而将硝酸铵溶于水,溶液的温度( ),这是物质溶解时的热现象.
3.某温度下,某物质的溶解度为25克,则该溶质的饱和溶液中溶质、溶剂、溶液的质量之比为( )
A.1:2:3 B.1:4:5 C.5:3:2 D.2:3:4 ff1231年前2
ff1231年前2 -
 jiashh 共回答了22个问题
jiashh 共回答了22个问题 |采纳率95.5%2升高,降低.3B,溶解度是指该物质在100克水中最多能溶解的质量.本题中溶质为25克,容剂为100克,溶液为125克,三者之比是1:4:51年前查看全部
- Ca(oH)2不是微溶于水吗,为什么还是强碱.那它在水中会有沉淀么
 dsf435dgbf1年前1
dsf435dgbf1年前1 -
 hw198288 共回答了16个问题
hw198288 共回答了16个问题 |采纳率81.3%Ca(oH)2不是微溶于水指的是它的溶解度,与是不是强碱关系不大,它溶解在水中的部分是完全溶解的,所以Ca(oH)2是强碱.它在水中应该没有沉淀,一般所见的沉淀应该是 Ca(oH)2与空气中的CO2接触后产生的CaCO3.1年前查看全部
- 从碳氧键与碳氯键的方面,来分析CH3COCl为什么易溶于水.
 linyueming1年前1
linyueming1年前1 -
 阿柳春 共回答了13个问题
阿柳春 共回答了13个问题 |采纳率100%酰氯会跟水反应,不是键的原因1年前查看全部
- 某化学研究性学习小组的同学将43.75g石灰石(杂质SiO2不参加反应,也不溶于水)放入一定质量的某稀盐酸中,恰好完全反
某化学研究性学习小组的同学将43.75g石灰石(杂质SiO2不参加反应,也不溶于水)放入一定质量的某稀盐酸中,恰好完全反应,过滤(滤液损失不计),得到114g滤液,再向其中加入163.5g水,结果就得到了10%的溶液作为路面保湿剂.计算原稀盐酸中溶质的质量分数.
 jingle0301年前1
jingle0301年前1 -
 zmjmm 共回答了20个问题
zmjmm 共回答了20个问题 |采纳率90%解题思路:根据最后所得的溶液质量以及溶质质量分数可以求出溶质的质量,利用该质量可以利用方程式求出氯化钙的质量,依次为突破口分析解答即可;反应后溶液中溶质氯化钙的质量为(114g+163.5g)×10%=27.75g
设石灰石中碳酸钙的质量是x 反应的氯化氢质量是y 生成二氧化碳的质量是z
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73 11144
xy27.75g z
[100/x=
73
y=
111
27.75g=
44
z]
x=25g y=18.25g z=11g
则加入盐酸的质量为114g+11g-25g=100g,故所采用的盐酸溶质质量分数为:[18.25g/100g]×100%=18.25%
答:盐酸中溶质的质量分数为18.25%.点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
考点点评: 此题是对化学方程式计算的综合考查,解题的关键是对氯化钙的计算和利用质量守恒定律对盐酸溶液的计算;1年前查看全部
- 某温度下,将WgNaOH溶于水,VmL溶液,其密度为bg/mL,该温度下的溶解度为多少?物质的量浓度为多少?
某温度下,将WgNaOH溶于水,VmL溶液,其密度为bg/mL,该温度下的溶解度为多少?物质的量浓度为多少?
若取饱和NaOH溶液0.1VmL,其物质的量浓度为多少?所含的物质的量为多少?若奖溶液稀释至VmL后,其物质的量浓度为多少? 山南水北1年前2
山南水北1年前2 -
 刘琤 共回答了21个问题
刘琤 共回答了21个问题 |采纳率95.2%1.设该温度下的溶解度为xg
溶液的质量为Vbg,溶剂水的质量为Vb-W
W/(Vb-W)=x/100,解得x=100W/(Vb-W)
2.NaOH的物质的量为(W/40)mol,溶液体积为(V/1000)L
物质的量浓度c=(W/40)mol/(V/1000)L=25W/Vmol/L
3.若取饱和NaOH溶液0.1VmL,其物质的量浓度还是为25W/Vmol/L
所含的物质的量为25W/Vmol/L*0.1V/1000L=W/400mol
4.若将溶液稀释至VmL后,其物质的量浓度为
(W/400)mol/(V/1000)L=5W/2Vmol/L1年前查看全部
- 高中化学关于溶液的计算盐溶于水后,会有一部分盐和水结合,而带有结晶水吗?结晶水的质量算进溶剂里吗?
 昱昊炅昊1年前1
昱昊炅昊1年前1 -
 whitecloudno1 共回答了18个问题
whitecloudno1 共回答了18个问题 |采纳率83.3%如果加入的量超过溶解度,有可见盐粒在底部,应将这部分的质量排除在外.溶液质量等于水质量加上溶解的盐的质量.此时未溶盐质量一定,但粒子不断运动.
如果全部溶解,就不存在盐和水结合的现象.1年前查看全部
- 萃取方面1.怎么可以单纯的就结构式来判断是否可以溶于水,是否可以溶于有机溶剂?2.怎么判断使溴水或酸性高锰酸钾溶液退色是
萃取方面
1.怎么可以单纯的就结构式来判断是否可以溶于水,是否可以溶于有机溶剂?
2.怎么判断使溴水或酸性高锰酸钾溶液退色是属于化学反应还是属于萃取? 主战铁杆!1年前5
主战铁杆!1年前5 -
 可品客 共回答了17个问题
可品客 共回答了17个问题 |采纳率94.1%有OH都是可以溶于水的
烃基上碳原子比较小的酸是可以溶于水的,因为羧基占主导地位,羧基亲水,例如乙酸,烃基只含一个C,但烃基上碳原子比较多的酸是不溶于水的,因为烃基占主导地位,烃基是亲油的,这样的酸就不溶于水,而易溶于有机溶剂,例如硬脂酸C17H35COOH,其烃基中C原子达到17个.
烯烃使溴水褪色是因为和溴发生了加成反应,烯烃是高猛酸钾溶液褪色是因为烯烃被高锰酸钾溶液氧化,这些都是发生了化学反应
你只要记清一点,那就是化学反应必需要有新的物质生成,而萃取只是不同溶剂中溶质溶解度的不同将物质进行分离,原来的那个溶质还在那边.
相信我,没错的.1年前查看全部
- 混合物K2SO4,(NH4)2SO4总质量为m克,把混合物溶于水得沉淀 n mol ,则试样中K2SO4的物质的量为(
混合物K2SO4,(NH4)2SO4总质量为m克,把混合物溶于水得沉淀 n mol ,则试样中K2SO4的物质的量为(
混合物K2SO4,(NH4)2SO4总质量为m克,把混合物溶于水得沉淀 n mol ,则试样中K2SO4的物质的量为( )mol (用含m,n的代数式表示). 废物点心161年前1
废物点心161年前1 -
 ihivw 共回答了22个问题
ihivw 共回答了22个问题 |采纳率81.8%K2SO4的分子量为174,(NH4)2SO4的分子量为132.
设有K2SO4 a mol,(NH4)2SO4 b mol
混合物质量即为158a+114b=m g
又沉淀的物质的量为nmol,即SO4为 nmol,也就是a+b=n
联立两个方程得a=(m-132n)/421年前查看全部
- 如果一种物质能和水发生反应 我们说不说它能溶于水?
 Batt1年前1
Batt1年前1 -
 rounu 共回答了26个问题
rounu 共回答了26个问题 |采纳率92.3%溶于水的概念是物质在水中分解成离子,例如普通盐,进水后就分解成钠离子和氯离子,当水蒸发干后就会还原成盐;而和水发生了反应,例如我放了一块钠进水(比较危险),钠块和水反应生成氢氧根,钠离子和氢气,这时候把溶液蒸发干,也不可能把一块钠重新还原出来,这时候剩下的就是氢氧化钠固体了.1年前查看全部
- 金属氧化物和非金属氧化物跟水反应,反应物的条件是什么?怎么才能知道反应的氧化物溶不溶于水?
 sheyue1年前3
sheyue1年前3 -
 新妖妖 共回答了12个问题
新妖妖 共回答了12个问题 |采纳率91.7%1.碱性氧化物+水→碱
多数碱性氧化物不能跟水直接化合.判断某种碱性氧化物能否跟水直接化合,一般的方法是看对应碱的溶解性,对应的碱是可溶的或微溶的,则该碱性氧化物能与水直接化合.如:
对应的碱是难溶的,则该碱性氧化物不能跟水直接化合.如CuO、Fe2O3都不能跟水直接化合.
2.酸性氧化物+水→含氧酸
除SiO2外,大多数酸性氧化物能与水直接化合成含氧酸.如:SO21年前查看全部
- 将含有杂质的固体氯化铜13.5g溶于水,加入足量的硝酸银,的28g沉淀,杂志是什么 A cacl2 B Alcl3 CK
将含有杂质的固体氯化铜13.5g溶于水,加入足量的硝酸银,的28g沉淀,杂志是什么 A cacl2 B Alcl3 CKcl D Fecl
 clxgz1231年前1
clxgz1231年前1 -
 怪怪笨笨 共回答了16个问题
怪怪笨笨 共回答了16个问题 |采纳率93.8%13.5g氯化铜与足量的硝酸银反应可以生成28.7克氯化银沉淀,
现在28g沉淀,小于13.5g
说明杂质中含氯的质量分数小于氯化铜,
所以选择氯化钾.
选择:C1年前查看全部
- ABCDE五种物质转化条件:A单质→(cl2,加热)→B(棕黄色的烟)→(溶于水)→ C(蓝绿色的溶液)→(fe)→AC
ABCDE五种物质转化条件:
A单质→(cl2,加热)→B(棕黄色的烟)→(溶于水)→ C(蓝绿色的溶液)→(fe)→A
C(蓝绿色的溶液)→(naoh溶液)→D(蓝色沉淀)→(加热)→E(黑色固体)→(h2,加热)→A
E(黑色固体)→C(蓝绿色的溶液)
ABCDE各为什么物质 sfmoma1年前2
sfmoma1年前2 -
 xongtao 共回答了19个问题
xongtao 共回答了19个问题 |采纳率94.7%A是Cu,B是CuCl2,C是CuCl2溶液,D是Cu(OH)2,E是CuO1年前查看全部
- 二氧化碳溶于水后也会产生氢离子,二氧化碳是酸吗?下列各组离子属于酸电离产生的是( ) A.H+、NO3-、SO42-
二氧化碳溶于水后也会产生氢离子,二氧化碳是酸吗?下列各组离子属于酸电离产生的是( ) A.H+、NO3-、SO42-
麻烦详细一点.
下列各组离子属于酸电离产生的是( )
A.H+、NO3-、SO42- B.OH-、Ba2+
C.H+、Na+、SO42- D.Na+ 、Ba2+、 Cl- 强飞1年前3
强飞1年前3 -
 妯娌仨人体 共回答了25个问题
妯娌仨人体 共回答了25个问题 |采纳率88%答案选A
二氧化碳溶于水会产生氢离子,CO2+H2O===H2CO3 ,碳酸(H2CO3)是一种二元弱酸,电离常数都很小.氢离子是碳酸产生的.
根据酸的定义--酸:化学上是指在溶液中电离时阳离子完全是氢离子且能使紫色石蕊试液变红的化合物.狭义上也可分为无机酸、有机酸.酸碱质子理论认为:酸是能释放出质子的物质总称为酸.
由此认定二氧化碳不是酸.1年前查看全部
- 七种常见不溶于水的物质
 天狐1363738391年前2
天狐1363738391年前2 -
 绿苔舞梨花 共回答了13个问题
绿苔舞梨花 共回答了13个问题 |采纳率76.9%CaCO3,BaCO3,BaSO4,AgCl,Mg(OH)2,Al(OH)3,Fe(OH)31年前查看全部
- 水被电解后出现有黄绿色东西(能溶解于水),这个能溶于水的东西是什么?
水被电解后出现有黄绿色东西(能溶解于水),这个能溶于水的东西是什么?
我在家做电解水的实验 但是水中出现了有黄绿色东西(能溶解于水),这个能溶于水的东西是什么? 往事27271年前1
往事27271年前1 -
 他的钢琴 共回答了11个问题
他的钢琴 共回答了11个问题 |采纳率81.8%是氯气,黄绿色,有刺激性气味的有毒气体,易溶于水,生成氯化氢(HCl 盐酸) 和次氯化氢(HClO 次氯酸).1年前查看全部
- 某混合液有两种或3种物质溶于水组成,c(K+)=c(Cl-)=1/2c(Na+)=c(SO4 2-),则溶质可能是
某混合液有两种或3种物质溶于水组成,c(K+)=c(Cl-)=1/2c(Na+)=c(SO4 2-),则溶质可能是
A KCl,Na2SO4 B NaCl,Na2SO4 ,KCl C NaCl,Na2SO4 ,K2SO4 D KCl,Na2SO4 ,K2SO4
问下C为什么对 壳轩1年前1
壳轩1年前1 -
 laogoubillsm 共回答了19个问题
laogoubillsm 共回答了19个问题 |采纳率84.2%假设1 mol NaCl,0.5mol Na2SO4 ,0.5mol K2SO4 在1L 水里 符合c(K+)=c(Cl-)=1/2c(Na+)=c(SO4 2-),1年前查看全部
大家在问
- 1太阳灶是利用______镜能够会聚光的性质制成的.使用时,必须将锅放在该镜的______点上.
- 2妈妈买了苹果和梨共66个,重16千克,3个苹果重1千克,6个梨重1千克,妈妈买了苹果和梨各多少千克
- 3遮阳伞与树荫遮阳哪种效果好?实验说明
- 4《淮阴侯列传》 司马迁 “若虽长大,好带刀剑,中情怯耳.”的翻译
- 5英语疑问Would you accept the way______he explained to us.A.in th
- 61.In England,people usually call me Tom _____short.
- 7放学后我们去打篮球吧
- 8怎样用方程解应用题 小明看一本故事书,第一天看了全书的1/9,第二天看了24页,两天
- 9已知a的m次方=3,a的n次方=2,求下列各式的值.1.a的m+1次方 2.a的3m+2n次方
- 10求八年级上册寒假作业的答案.十分急啊.,快点啊 是团结出版社出版的.《精彩寒假》上面有一个女孩和一只布熊坐在长椅上.,.
- 11广东江门市新会区崖门镇英文怎么翻译
- 12全球汽车保有量在迅速增长,截至2011年,全球处于使用状态的汽车数量已突破10亿辆.每辆汽车每年耗油1.8t,汽车内燃机
- 13某混合气体由H 2 、N 2 、CO和CH 4 中的两种组成,将该混合气体点燃后,得到的气体产物依次通过浓H 2 SO
- 14用dijkstra算法计算源点到个结点的最短路径.谢谢亲爱的朋友~
- 15It is true that the living standard of the people ____ in th
