硫酸溶液中硫酸的质量分数与溶液密度有什么关系
 ricky7112022-10-04 11:39:541条回答
ricky7112022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 啤酒瓶子9 共回答了23个问题
啤酒瓶子9 共回答了23个问题 |采纳率82.6%- H2SO4 溶液密度越大 硫酸的质量分数越大
氨水 溶液密度越小 含氨的质量分数越大
这个要求记,可以推导,会假设一些物理量,再用不等式.我不想推,氨水也一样,我给原理,两个方法相互补充.
因为纯的液氨的密度比水小
所以氨水浓度越大 就越接近液氨的密度
所以越小 ,硫酸道理相似.
我给你数据证明.
硫酸溶液的浓度、溶质的质量分数和密度
密度(20℃)g/cm3 H2SO4的质量分数g/100g溶液.物质的量浓度(mol/L) 密度(20℃)g/cm3 H2SO4的质量分数g/100g溶液, 物质的量浓度(mol/L)
1.000 0.2609 0.02660 1.145 20.73 2.420
1.100 14.73 1.652 1.245 33.22 4.216
1.115 16.76 1.905 1.260 35.01 4.498
1.130 18.76 2.161 1.275 36.78 4.781
1.300 39.68 5.259 1.305 40.25 5.356
1.320 41.95 5.646 1.325 42.51 5.743
1.350 45.26 6.229 1.355 45.80 6.327
1.380 48.45 6.817 1.385 48.97 6.915
1.420 52.51 7.603 1.425 53.01 7.702
1.450 55.45 8.198 1.455 55.93 8.297
望能给你帮助. - 1年前
相关推荐
- 双氧水加NaOH再加MnSO4.之后往沉淀中加硫酸再加双氧水 的反应方程式
双氧水加NaOH再加MnSO4.之后往沉淀中加硫酸再加双氧水 的反应方程式
快 omeag1年前1
omeag1年前1 -
 性情小子 共回答了17个问题
性情小子 共回答了17个问题 |采纳率82.4%MnSO4+H2O2+2NaOH=Na2SO4+2H2O+MnO2/
4MnO2+H2O2+2H2SO4=2MnSO4+2HMnO4+2H2O
MnO2实际上是MnMnO4.
MnO4(2-)酸根在稀释的过程中会发生歧化反应,就是自身氧化还原反应,生成Mn2+和MnO4-1年前查看全部
- 已知硫酸的质量分数越大时,其溶液的密度越大;已知98%的浓硫酸的浓度为18.4mol/L,则49%的硫酸溶液的浓度为(
已知硫酸的质量分数越大时,其溶液的密度越大;已知98%的浓硫酸的浓度为18.4mol/L,则49%的硫酸溶液的浓度为( )
A. 9.2mol/L
B. >9.2mol/L
C. <9.2 mol/L
D. 无法确定 rr66zz1年前1
rr66zz1年前1 -
 来自我心-J 共回答了22个问题
来自我心-J 共回答了22个问题 |采纳率86.4%解题思路:设98%硫酸的密度为Ag/mL,49%硫酸的密度为a g/mL,根据c=[1000ρω/M]表示出98%硫酸与49%硫酸的物质的量浓度,再结合硫酸的浓度越大密度越大进行判断.设98%硫酸的密度为Ag/mL,49%硫酸的密度为a g/mL,则:
18.4=[1000A×98%/98],c(49%的硫酸)=[1000a×49%/98],
硫酸的浓度越大密度越大,故A>a,故c(49%的硫酸)<9.2mol/L,
故选C.点评:
本题考点: 物质的量浓度的相关计算;溶液中溶质的质量分数及相关计算.
考点点评: 本题考查物质的量浓度有关计算,难度不大,注意理解掌握物质的量浓度与质量分数之间的关系.1年前查看全部
- 题目为废酸中含有硫酸和盐酸,要就分离和回收,第一步是加氨水,生成了硫酸铵和氯化铵,接下来分离他们
题目为废酸中含有硫酸和盐酸,要就分离和回收,第一步是加氨水,生成了硫酸铵和氯化铵,接下来分离他们
最终分别要得到氯化铵和硫酸铵,提示是用溶解性,我不知道具体的, haifeng5321年前2
haifeng5321年前2 -
 yang_cheng7261 共回答了22个问题
yang_cheng7261 共回答了22个问题 |采纳率81.8%查找一下在不同温度下两种物质的溶解度,找一个合适的温度可以分离出两种物质的晶体!1年前查看全部
- 水培用的肥料,哪里可以买到水培用的纯硝酸钾,磷酸二氢,硫酸,硫酸镁
水培用的肥料,哪里可以买到水培用的纯硝酸钾,磷酸二氢,硫酸,硫酸镁
哪里可以买到水培用的纯硝酸钾,磷酸二氢,硫酸,硫酸镁 怡涵1年前1
怡涵1年前1 -
 醉月寒星 共回答了19个问题
醉月寒星 共回答了19个问题 |采纳率84.2%本地的卖化工类产品的商店,或者网上,我爱菜菜网做水培的大多都是在当地买的1年前查看全部
- 硫酸 盐酸 硝酸 氯酸钾 高锰酸钾 锰酸钾 氯化钠 食盐 氯化钾
硫酸 盐酸 硝酸 氯酸钾 高锰酸钾 锰酸钾 氯化钠 食盐 氯化钾
氯化钙 氯化镁 氯化锌 氯化铝 氯化银 氯化铁 氯化亚铁 氯化铜 氯化亚铜 氯化钡 sp_zy1年前3
sp_zy1年前3 -
 江薇cc 共回答了16个问题
江薇cc 共回答了16个问题 |采纳率87.5%H2SO4
HCl
HNO3
KClO3
KMnO4
K2MnO4
KMnO3
NaCl
NaCl
KCl
CaCl2
MgCl2
ZnCl2
AlCl3
AgCl
FeCl3
FeCl2
CuCl2
CuCl
BaCl2
Cu(OH)2CO31年前查看全部
- 高锰酸钾的硫酸溶液和H2C2O4溶液反应的化学方程式
 yuru551年前1
yuru551年前1 -
 sadfgjaewghrth 共回答了23个问题
sadfgjaewghrth 共回答了23个问题 |采纳率82.6%2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O1年前查看全部
- 向两只烧杯中各加入含有4.9g硫酸的稀硫酸,并将烧杯分置于天平的两个托盘上调节天平使之达到平衡.若向一只烧杯中加入ag金
向两只烧杯中各加入含有4.9g硫酸的稀硫酸,并将烧杯分置于天平的两个托盘上调节天平使之达到平衡.若向一只烧杯中加入ag金属锌,试讨论a的取值范围不同时,需向另一只烧杯中加入多少克金属镁,反应完毕时,天平仍能保持平衡?
十分钟以内答复加20分,二十分钟以内答复10分, 小绵杨1年前6
小绵杨1年前6 -
 暴打美眉 共回答了13个问题
暴打美眉 共回答了13个问题 |采纳率92.3%天平仍保持平衡,说明两边加入金属的质量与放出气体的质量差值相等.
先看两个极限情况,锌刚好反应消耗3.25g,镁刚好反应消耗1.2g.
(1)a>=3.25,硫酸完全反应,放出气体质量相等,所以加入金属质量也相等.
镁的质量为a
(2)a1年前查看全部
- 用碳酸钠标定硫酸时,用甲基红-溴甲酚绿作指示剂,滴定至紫红是煮沸在滴至暗红色,有两个体积,计算时怎么
用碳酸钠标定硫酸时,用甲基红-溴甲酚绿作指示剂,滴定至紫红是煮沸在滴至暗红色,有两个体积,计算时怎么
怎么计算,煮沸的作用是什么, 4ok821年前1
4ok821年前1 -
 xhq007 共回答了16个问题
xhq007 共回答了16个问题 |采纳率93.8%计算的时候以后一个为准,第二个体积是终点
煮沸的用处是加热排除水中溶解的二氧化碳,二氧化碳常温在水中的溶解度约为体积比1:1,会对实验结果造成比较大的误差1年前查看全部
- 氯化氢,硫酸,硝酸都是什么性酸,氧化性还是还原性,为什么
 xinliyi1年前1
xinliyi1年前1 -
 天地随风 共回答了23个问题
天地随风 共回答了23个问题 |采纳率91.3%盐酸是非氧化性酸,只是具有酸的通性,但氯化氢气体具有一定的还原性(-1价的氯化合价可升高),但不强
硫酸分两种情况,稀硫酸具有酸的通性,氧化性却很弱(主要是SO4 2-的氧化性弱),所以是非氧化性酸,而浓硫酸除了具有酸的通性外,由于水的含量极少,因此浓硫酸主要以H2SO4分子的形式存在,而H2SO4分子具有很强的氧化性,所以它是强氧化性酸,与强还原性的物质(如硫化氢等)无法共存,它与金属反应生成最高价态的金属盐,并且可与活动性表中排在H后的铜、汞、银等金属反应
硝酸无论稀浓,都同时具有酸的通性强氧化性,它的氧化性主要来自NO3-离子,也属于强氧化性酸1年前查看全部
- 酸碱和盐的溶解性表的读法~例如:H2SO4(硫酸),HCL(盐酸),HNO3(硝酸) NaOH(氢氧化钠),KOH(氢氧
酸碱和盐的溶解性表的读法~
例如:H2SO4(硫酸),HCL(盐酸),HNO3(硝酸)
NaOH(氢氧化钠),KOH(氢氧化钾),NH4OH(氨水)
Na2CO3(碳酸钠),CuSO4(硫酸铜) ,NH4NO3(硝酸铵) bmx9991年前1
bmx9991年前1 -
 13aizjb 共回答了14个问题
13aizjb 共回答了14个问题 |采纳率92.9%H2CO3【碳酸】.HF【氢氟酸】
CaOH【氢氧化钙】.Cu(OH)2【氢氧化铜】.Fe(OH)2【氢氧化亚铁】.Fe(OH)3【氢氧化铁】.
CaCO3【碳酸钙】.Ca2NO3【硝酸钙】.Na2CO3【碳酸钠】.AgCl【氯化银】1年前查看全部
- 配制0.184mol/L的硫酸时,向1000ml容量瓶中注入10ml18.4mol/LH2SO4,不断振荡,加水至刻度.
配制0.184mol/L的硫酸时,向1000ml容量瓶中注入10ml18.4mol/LH2SO4,不断振荡,加水至刻度.为什么不对?
 业务流程1年前2
业务流程1年前2 -
 tvrynifqp 共回答了12个问题
tvrynifqp 共回答了12个问题 |采纳率75%因为容量瓶是有温度限制的,而浓硫酸稀释时会大量放热,使得容量瓶受热膨胀,导致刻度不准确,因此不能直接在容量瓶里稀释定容,而应该先用蒸馏水在烧杯中稀释浓硫酸后再加入容量瓶定容.1年前查看全部
- 硫酸提纯能不能用电解的方法?还有,我用220VAC直接通入全波整流桥(1N4007×4),导出,我用这个装置电解水,气泡
硫酸提纯能不能用电解的方法?
还有,我用220VAC直接通入全波整流桥(1N4007×4),导出,
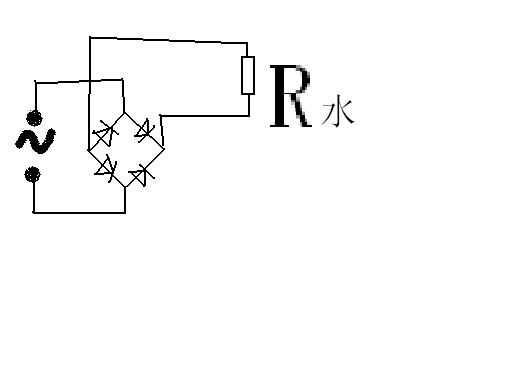
我用这个装置电解水,气泡冒得很厉害(没加任何电解液) 萍儿WP1年前1
萍儿WP1年前1 -
 ikfo 共回答了30个问题
ikfo 共回答了30个问题 |采纳率86.7%硫酸提纯不能用电解的方法1年前查看全部
- 氢硫酸敞放在空气中变浑质的方程式
 yueliangfeizou1年前1
yueliangfeizou1年前1 -
 ornew77 共回答了20个问题
ornew77 共回答了20个问题 |采纳率80%2H2S + O2 = 2S + 2H2O1年前查看全部
- 1).硫酸溶质质量等于溶液质量乘以质量分数,溶液质量等于溶液密度乘以体积.所以:M=1.84g/ml*500ml*98%
1).硫酸溶质质量等于溶液质量乘以质量分数,溶液质量等于溶液密度乘以体积.所以:M=1.84g/ml*500ml*98%=9
 终结者时代1年前1
终结者时代1年前1 -
 cara3011 共回答了12个问题
cara3011 共回答了12个问题 |采纳率91.7%M=1.84g/ml*500ml*98%=1.84×500×0.98=901.6 g1年前查看全部
- 铜锌原电池电解质为什么不能用硫酸?
铜锌原电池电解质为什么不能用硫酸?
rt
将锌和铜用导线连起来,氢离子和锌反应,锌上电子通过导线移向铜,电子在铜那段与H+结合,有什么不可以呢?有好几组,老师没选这项。但我觉得可以。 for_shense1年前4
for_shense1年前4 -
 心铭月情 共回答了18个问题
心铭月情 共回答了18个问题 |采纳率94.4%如果溶液是稀硫酸,
Zn - 2e- = Zn2+,
2 H+ + 2e- = H2↑
溶液中没有Cu2+,怎么会发生反应 Zn + CuSO4 = Cu + ZnSO4呢?
就变成 Zn + 2 H+ = H2↑ + Zn2+ 了1年前查看全部
- 塔式硫酸和铅式硫酸是什么意思塔式硫酸(75%)和铅式硫酸(65%)是什么意思?为什么说塔式硫酸腐蚀性没有铅式硫酸大?
 平常人做平常事1年前1
平常人做平常事1年前1 -
 ashiy 共回答了17个问题
ashiy 共回答了17个问题 |采纳率94.1%应该是指早期工业生产硫酸的两种方式:塔式法和铅室法,参见http://baike.baidu.com/view/4426068.htm和http://baike.baidu.com/view/4191304.htm,铅室法是气相反应,会产生较多酸雾,而且产生的硫酸杂质较多,因此腐蚀性较大.1年前查看全部
- 已知硫酸铜溶液存在大量的铜离子Cu2+呈蓝色,而硫酸跟离子SO42无色.一张浸有硫酸铜溶液的滤纸,滤纸呈现出均匀的蓝色,
已知硫酸铜溶液存在大量的铜离子Cu2+呈蓝色,而硫酸跟离子SO42无色.一张浸有硫酸铜溶液的滤纸,滤纸呈现出均匀的蓝色,通了直流电后,靠近阳极蓝色变浅靠近阴极蓝色变深,为什么会有这颜色变化呢?请用‘同种电荷排斥.异种想吸’的知识进一步解释
 天秤天蝎1年前1
天秤天蝎1年前1 -
 qingqingsuo 共回答了22个问题
qingqingsuo 共回答了22个问题 |采纳率90.9%蓝色的Cu2+带正电被阳极排斥,被阴极吸引,Cu2+逐渐运动到阴极附近,没有颜色的SO42-带负电,被阴极排斥,被阳极吸引,逐渐移动到阳极附近,因此靠近阳极蓝色变浅靠近阴极蓝色变深1年前查看全部
- 把5毫升质量分数为98%的硫酸(密度为1.84克/立方厘米),加入到25毫升水里进行稀释,求所得溶液的质量分数
 kouzi98151年前1
kouzi98151年前1 -
 mklop456 共回答了17个问题
mklop456 共回答了17个问题 |采纳率94.1%5毫升×1.84毫升/厘米3×98%
————————————————————=26.4%
5毫升×1.84克/厘米3+25毫升×1克/厘米31年前查看全部
- 用含FeS2 72%的黄铁矿制硫酸,煅烧时有1.5%的硫烧到损失混入炉渣.二氧化硫转化为三氧化硫的转化率97%,求一吨黄
用含FeS2 72%的黄铁矿制硫酸,煅烧时有1.5%的硫烧到损失混入炉渣.二氧化硫转化为三氧化硫的转化率97%,求一吨黄铁矿可产生98%硫酸多少吨?
 心跳乱了节奏1年前4
心跳乱了节奏1年前4 -
 skchenglong 共回答了20个问题
skchenglong 共回答了20个问题 |采纳率95%就是计算最后进入硫酸的硫的重量,进而换算成硫酸就可以了,因为硫元素是守恒的.
1t FeS2含有FeS2 720kg,FeS2中硫元素的质量分数是64/(64+56)=0.5333,所以S元素的质量就是384kg ,损失1.5%那么还剩下384×0.985=378.24kg,在转换三氧化硫的时候转化率是97%,所以这时候能转化成SO3的S的重量就是378.24×0.97=367kg,好了,现在知道变成硫酸的硫元素的质量,进而计算三氧化硫转化的纯硫酸质量:(367/32)×98=1123kg,因为硫酸是98%,所以再除以0.98,得到硫酸重量是1146.54kg
实际上运用守恒是很简单的,我写得很复杂,因为要介绍思想,如果你很熟悉,可以一步写齐所有算式,这样其中数字运算的约分等等能让计算更加简单,元素守恒、质量守恒、电荷守恒、能量守恒等等的应用有时候会让人视野更加开阔,看问题更宏观全面,简化思考和计算过程,十分有用.无论是做题还是研究,这都是很重要的思想和思考方法.1年前查看全部
- 盐酸的挥发性和硫酸的吸水性分别体现在哪些方面?
 kaoshibaomu21年前3
kaoshibaomu21年前3 -
 三萼 共回答了13个问题
三萼 共回答了13个问题 |采纳率92.3%1.浓盐酸有强挥发性,其中挥发出来的氯化氢会和空气中的水蒸气结合,形成盐酸的小液滴,扩散在空气中.所以盐酸要储存在密封容器当中,否则时间长以后盐酸的质量会逐渐下降,浓度也会下降.
2.浓硫酸吸水性
将一瓶浓硫酸敞口放置在空气中,其质量将增加,密度将减小,浓度降低,体积变大,这是因为浓硫酸具有吸水性.
(1)就硫酸而言,吸水性是浓硫酸的性质,而不是稀硫酸的性质.
(2)吸水性是浓硫酸的物理性质.浓硫酸只能干燥酸性和中性气体.1年前查看全部
- 1mol/L的硫酸和氨水等体积混合后剩下多少
 蜗拉牛1年前2
蜗拉牛1年前2 -
 陆佰88 共回答了25个问题
陆佰88 共回答了25个问题 |采纳率84%根据化学方程式H2SO4+2NH3·H2O=(NH4)2SO4+2H2O可以知道,硫酸有剩余,剩余的物质的量为原来的一半,又由于体积增大到原来的2倍,剩余硫酸的浓度为原来的1/4.1年前查看全部
- 要把200mm密度为10克每立方厘米的60%的硫酸稀释为25%的硫酸溶液 稀释后的溶质质量是多少?
 zytutu1年前2
zytutu1年前2 -
 伊氏石斑鱼 共回答了26个问题
伊氏石斑鱼 共回答了26个问题 |采纳率84.6%你的密度数值肯定有错误,按你的数据应该是200*10*60%/25%=4800克1年前查看全部
- 取3.1克有机物完全燃烧,将燃烧后的产物通过浓硫酸,然后在通过足量的澄清石灰水,测得浓硫酸
取3.1克有机物完全燃烧,将燃烧后的产物通过浓硫酸,然后在通过足量的澄清石灰水,测得浓硫酸
增重2.7克,石灰水中产生10克沉淀.求有机物分子式.它分子中是否存在氧原子?存在氧原子的个数如何求得?有机物答案为C2H6O2 漂漂花1年前1
漂漂花1年前1 -
 vvsong 共回答了14个问题
vvsong 共回答了14个问题 |采纳率92.9%10克沉淀由0.1摩CO2反应产生,则C原子有0.1摩,2.7克是水的质量,即0.15摩H2O,则有0.3摩H原子.C原子加H原子=1.5克,则3.1克有机物中有氧1.6克.即0.1摩.所以C:H:O=0.1:0.3:0.1=2:6:2,则化学式为C2H6O21年前查看全部
- 硫酸 含硫量98% 密度1.84g/mL 体积500mL
硫酸 含硫量98% 密度1.84g/mL 体积500mL
(1)该瓶内含溶质量为多少g
(2)若要配制400g10%的稀硫酸,应取该浓硫酸多少毫升 爱情是游戏1年前2
爱情是游戏1年前2 -
 金牛星 共回答了21个问题
金牛星 共回答了21个问题 |采纳率85.7%(1)1.84*500=9.2g
9.2g*98%=9.016g
(2)400g*10%=40g
40g/1.84g/ml=21.73ml1年前查看全部
- 干式荷电蓄电池加入电解液后可以不经充电直接使用对吗,由于蓄电池电解液中有硫酸所以不会再低温下冻结
干式荷电蓄电池加入电解液后可以不经充电直接使用对吗,由于蓄电池电解液中有硫酸所以不会再低温下冻结
以上说的正确 过弯挂5挡1年前1
过弯挂5挡1年前1 -
 liunani 共回答了12个问题
liunani 共回答了12个问题 |采纳率91.7%不对,新电瓶加完水后,至少充电30分钟再使用.1年前查看全部
- 前处理问题,除锈可以用硫酸,盐酸,磷酸.还可以用什么.可以混合到一起的?
 木头弟ff的爷1年前2
木头弟ff的爷1年前2 -
 tiy819630196 共回答了18个问题
tiy819630196 共回答了18个问题 |采纳率83.3%一般用磷酸,因为盐酸硫酸都会腐蚀设备,但是磷酸经过处理之后会在设备上形成一层保护膜,可以防止金属再次生锈1年前查看全部
- 高二溶液的酸碱度习题若1体积硫酸恰好与10体积pH=11的NaOH溶液完全反应 则两者物质的量浓度纸币为多少
 今生红颜1年前2
今生红颜1年前2 -
 sanweizai 共回答了22个问题
sanweizai 共回答了22个问题 |采纳率100%你看我这个思路可以不啊.我物质的量浓度单位是mol/L,氢离子和氢氧根离子的物质的量是1:1,体积比是1:10,浓度之比就是10:1,硫酸是2元酸,所以硫酸与氢氧化钠的物质的量浓度之比就是5:1了1年前查看全部
- 为什么质量相同的镁锌铁和硫酸反应,如果镁锌过量,铁就一定过量?
 田湾1年前2
田湾1年前2 -
 whoami9412 共回答了14个问题
whoami9412 共回答了14个问题 |采纳率92.9%不对吧,
是分别跟硫酸反应还是放同一烧杯中啊
相同质量的镁锌铁
它们的物质的量 镁>铁>锌 (因为摩尔质量镁1年前查看全部
- 注:“铝与硫酸反应产生硫酸铝和氢气”中的“硫酸”是稀的还是浓的?
注:“铝与硫酸反应产生硫酸铝和氢气”中的“硫酸”是稀的还是浓的?
输入链接也可! acoav0ib1年前1
acoav0ib1年前1 -
 zll054 共回答了17个问题
zll054 共回答了17个问题 |采纳率100%稀的
铝和浓硫酸反应钝化,不产生氢气1年前查看全部
- 碱性高锰酸钾法测COD时,在1:3的硫酸中加入高锰酸钾至微红色,请问微红色是要一直保持吗?
碱性高锰酸钾法测COD时,在1:3的硫酸中加入高锰酸钾至微红色,请问微红色是要一直保持吗?
我配置的1:3的硫酸中加入高锰酸钾刚开始显红色,过段时间后溶液又变成无色了,是什么原因呢? 孤独的孤心1年前1
孤独的孤心1年前1 -
 最爱吃生日蛋糕 共回答了18个问题
最爱吃生日蛋糕 共回答了18个问题 |采纳率100%高锰酸钾加入硫酸中就成为酸性高锰酸钾溶液,有强氧化性,可以与还原性物质反应,然后高锰酸钾溶液就褪色了1年前查看全部
- 1、硫酸的腐蚀性和脱水性有什么区别?
1、硫酸的腐蚀性和脱水性有什么区别?
2、研究酸的通性时为什么用稀的硫酸、盐酸等做实验,而不是浓的? dd热血男儿1年前6
dd热血男儿1年前6 -
 huberthk 共回答了19个问题
huberthk 共回答了19个问题 |采纳率84.2%1浓硫酸的腐蚀性包括它的脱水性,它的脱水性的表现有的是腐蚀.将纸、小木棍、布等放在玻璃片上,用玻璃棒蘸浓硫酸在纸上写字,过一会儿,字迹变黑,用小木棍蘸少量浓硫酸,过一会儿,小木棍变黑.布上滴浓 后,变黑,然后有洞出现.这说明,浓硫酸有强烈的腐蚀性.它能夺取纸张、木材、布料、皮肤(都由含碳、氢、氧等元素的化合物组成)里的水分,(严格地说,浓 能将这些物质中的氢、氧元素按水的组成比脱去,通常叫做脱水作用.)生成黑色的炭.而另一种腐蚀是浓硫酸和物质发生了反应而使得物质改变,这种也叫浓硫酸的腐蚀,而它的本质不是浓硫酸的脱水作用而是发生了化学反应.
2不用浓盐酸是因为有挥发性
不用浓硫酸是因为浓硫酸有强氧化性(高中学),和金属(如Zn)反应生成硫酸锌、水和二氧化硫,而不生成氢气1年前查看全部
- 如何溶解融化在晶坨上的白腊胶?出开硫酸
 ylamy1年前1
ylamy1年前1 -
 决口不提爱你 共回答了24个问题
决口不提爱你 共回答了24个问题 |采纳率91.7%你这胶是灌封上去的吗?是的话用环氧树脂溶解剂可以溶解,你可以去淘宝上问问卖环氧树脂溶解剂的店家,我想你这个用这溶剂可以溶解.1年前查看全部
- 用重洛酸钾法测COD时,加入硫酸硫酸银溶液的作用是什么?
 aa二蛋1年前4
aa二蛋1年前4 -
 生活有我 共回答了9个问题
生活有我 共回答了9个问题 |采纳率88.9%1楼说的去除Cl离子干扰是加入硫酸汞,其原理是先加入的汞离子与Cl离子反应生成稳定的配合物,使其不能跟后面加入的硫酸银反应生成白色的沉淀而干扰滴定时的终点观察.
2楼说得对,加入硫酸银是起催化剂作用,因为样品中的还原性物质成分很复杂,为了让氧化剂重铬酸钾充分与其反应,就以高温回流+催化剂创造反应条件.1年前查看全部
- 貌似是电瓶车里的电瓶,硫酸浓度分别为1.02%,1.05%,1.10%的溶液,水20公斤,需加硫酸多少公斤?
 dingdingdaming1年前1
dingdingdaming1年前1 -
 橱窗后的蚂蚁 共回答了17个问题
橱窗后的蚂蚁 共回答了17个问题 |采纳率94.1%1.02%硫酸需要浓硫酸(98%)0.210公斤
1.05%硫酸需要浓硫酸(98%)0.217公斤
1.10%硫酸需要浓硫酸(98%)0.227公斤1年前查看全部
- 80%硫酸20%磷酸混和溶液的配置方法?
 ponukt391年前1
ponukt391年前1 -
 灯笼果味 共回答了18个问题
灯笼果味 共回答了18个问题 |采纳率83.3%纯硫酸80g
纯磷酸20g
混合即可1年前查看全部
- 含有32g硫元素的硫酸的质量是多少?
 AnotherEnd1年前1
AnotherEnd1年前1 -
 deephouse 共回答了19个问题
deephouse 共回答了19个问题 |采纳率89.5%硫酸H2SO4中S的质量分数=32/98
所以含有32gS的硫酸的质量=32/(32/98)=98g1年前查看全部
- 200mL含H2SO4 98g的硫酸溶液的物质的量浓度是
 xuwei0271年前1
xuwei0271年前1 -
 fuchunjuan 共回答了22个问题
fuchunjuan 共回答了22个问题 |采纳率90.9%n(H2SO4)=98g÷98g/mol=1mol C(H2SO4)=1mol÷0.2L=5mol/L1年前查看全部
- 化学以弱碱和盐制强碱用硫化氢和硫酸铜溶液可以制硫酸,是弱酸制强酸 那么有没有一种弱碱和盐可以制强碱? 可以多举几个例子吗
 鉃麮钫銄1年前1
鉃麮钫銄1年前1 -
 尼克库博 共回答了23个问题
尼克库博 共回答了23个问题 |采纳率82.6%氨是弱碱,甲基化后生成甲胺,是强碱.其他广义的:水,醇等是弱碱,与金属钠反应生成强碱.碳酸氢钠、碳酸氢钾等是较弱的碱,加热生成碱性较强的碳酸盐.氯化钠电解得到氢氧化钠.还有络合的超强碱,也是用一般强碱制的,但碱性更强.1年前查看全部
- 帮我写几个离子方程式,硫酸亚铁中加入经硫酸酸化的双氧水小苏打溶液与烧碱溶液反应氯气通入水中三氯化铁与氢碘酸反应氢氧化钡溶
帮我写几个离子方程式,
硫酸亚铁中加入经硫酸酸化的双氧水
小苏打溶液与烧碱溶液反应
氯气通入水中
三氯化铁与氢碘酸反应
氢氧化钡溶液与稀硫酸的反应
用氨水吸收过量二氧化碳
向漂白粉中通入二氧化碳气体
碳酸氢钠中加入少量氢氧化钡溶液
氨水与硝酸作用
硫化亚铁与稀硝酸作用
氯化铁制备氢氧化铁胶体 Jiang_linyan1年前1
Jiang_linyan1年前1 -
 zhanglia 共回答了23个问题
zhanglia 共回答了23个问题 |采纳率82.6%2Fe2+ + H2O2 + 2H+ = 2Fe3+ + 2H2O
HCO3- + OH- = CO32- + H2O
Cl2 + H2O = Cl- + HClO + H+
2Fe3+ + 2I- = 2Fe2+ +I2↓
OH- + H+ =H2O
CO2 + NH3·H2O = NH4+ + HCO3-
Ca2+ + 2ClO- +H2O + CO2 = CaCO3↓+2HClO
或ClO- + H2O + CO2 = HCO3- + HClO
HCO3- + Ba2+ + OH- = BaCO3↓+H2O
NH3·H2O +H+ =NH4+ + H2O
FeS + 6H+ + 3NO3-=Fe3+ + S + 3NO2↑ + 3H2O
Fe3+ + 3OH- = Fe(OH)31年前查看全部
- 写出下列离子方程式1小苏打溶液加醋酸2溴化亚铁溶液加过量氯气3硫化亚铁加入用硫酸酸化过的氧化氢4电解饱
写出下列离子方程式1小苏打溶液加醋酸2溴化亚铁溶液加过量氯气3硫化亚铁加入用硫酸酸化过的氧化氢4电解饱
和食盐水 elaineqian1年前1
elaineqian1年前1 -
 e403 共回答了16个问题
e403 共回答了16个问题 |采纳率81.3%1、 HCO3- + CH3COOH == CH3COO- + H2O + CO2↑
2、 2Fe2+ + 4Br- + 3Cl2 == 2Fe3+ + 6Cl- + 2Br2
3、 2FeS + 3H2O2 + 6H+ == 2S↓ + 2Fe3+ + 6H2O
4、 2Cl- + 2H2O ==通电== 2OH- + H2↑ + Cl2↑1年前查看全部
- 蓝矾中加农硫酸是吸水还是脱水?
 ycj5251年前1
ycj5251年前1 -
 zhangzhd_2001 共回答了25个问题
zhangzhd_2001 共回答了25个问题 |采纳率80%向蓝矾中加浓硫酸,表现了浓硫酸的吸水性
浓硫酸的吸水作用,指的是浓硫酸分子跟水分子强烈结合,生成一系列稳定的水合物,并放出大量的热;浓硫酸不仅能吸收一般的游离态水(如空气中的水),而且还能吸收某些结晶水合物(如CuSO4·5H2O、Na2CO3·10H2O)中的水.
表现出脱水性时浓硫酸按水分子中氢氧原子数的比(2∶1)夺取被脱水物中的氢原子和氧原子;可被浓硫酸脱水的物质一般为含氢、氧元素的有机物,其中蔗糖、木屑、纸屑和棉花等物质中的有机物,被脱水后生成了黑色的炭(碳化).1年前查看全部
- 100g某硫酸恰好与13g锌完全起反应.试计算这种硫酸中溶质的质量分数.
 老和山1年前1
老和山1年前1 -
 iamcch10 共回答了17个问题
iamcch10 共回答了17个问题 |采纳率82.4%解题思路:根据题意,写出硫酸由锌完全反应的化学方程式,然后根据化学方程式求得硫酸溶液中溶质的质量、溶液的质量;最后由公式溶质的质量分数=
×100%计算硫酸中溶质的质量分数.溶质的质量 溶液的质量 设参加反应的硫酸质量为x.
H2SO4+Zn=ZnSO4+H2↑
98 65
x 13g
[98/65]=[x/13g],解得,x=19.6g. 硫酸中溶质的质量分数=[19.6g/100g]×100%=19.6%;
故答案是:19.6%.点评:
本题考点: 有关溶质质量分数的简单计算;根据化学反应方程式的计算.
考点点评: 本题考查了有关溶质质量分数的简单计算、根据化学反应方程式的计算.注意,本题中,求得是硫酸中溶质的质量分数,而非硫酸锌溶液中溶质硫酸锌的质量分数.1年前查看全部
- 一容器中盛有浓度为45%的硫酸,若再加入16千克水,则浓度变为25%,这个容器内原来含有纯硫酸多少千克?
 北方的河ZY1年前4
北方的河ZY1年前4 -
 登台听雨 共回答了21个问题
登台听雨 共回答了21个问题 |采纳率71.4%解答(一):由于加水前后容器中所含纯硫酸的重量并没有改变,所以我们只需将加水前后容器中所含纯硫酸的量表示出来即可:
设容器中原有溶液x千克:则有
x·45%=(x+16%)·25%
x=20
∴ 容器中所含纯硫酸为20×45%=9(千克)
答:容器中原来含有纯硫酸9千克.
解答(二):设容器内原含有x千克纯硫酸.
依题意有:x÷45%=x÷25%-16
∴ x=9
答:容器内原含有纯硫酸9千克.1年前查看全部
- 1000L的溶液(酸为硫酸),PH为2,加入多少氢氧化钙,使PH变为4,麻烦写出计算公式,谢谢
 feita06191年前3
feita06191年前3 -
 冯蘅 共回答了18个问题
冯蘅 共回答了18个问题 |采纳率77.8%(0.01-0.0001)*1000*74/2=366.3g1年前查看全部
- 硫酸氢氟酸氟化氢铵能腐浊玻璃吗
 jianchi1001年前1
jianchi1001年前1 -
 开始厌烦 共回答了26个问题
开始厌烦 共回答了26个问题 |采纳率88.5%硫酸没事,硫酸就是装在玻璃瓶里的.氢氟酸会腐蚀玻璃,很快,所以要装在塑料瓶里.氟化铵也是能腐蚀玻璃的.1年前查看全部
- 碳酸氢铵与 氢氧化钠 氢氧化钙 铁 铜 硫酸铜 氯化钙 硫酸 盐酸 哪个不反应?
 yxt20031年前1
yxt20031年前1 -
 糊涂一点点 共回答了16个问题
糊涂一点点 共回答了16个问题 |采纳率75%与铜和铁不反应.
与硫酸铜和氯化钙也不反应.1年前查看全部
- 好像磷酸也能制造硫酸吧磷酸+硫酸铜溶液=磷酸铜(沉淀)+硫酸.“必须是强酸才能制弱酸”这话也不完全对!这个实验如果倒过来
好像磷酸也能制造硫酸吧
磷酸+硫酸铜溶液=磷酸铜(沉淀)+硫酸.“必须是强酸才能制弱酸”这话也不完全对!这个实验如果倒过来应该不成立,因为没有沉淀、气体和水生成!我能拿诺化奖啦!
 hong999long1年前1
hong999long1年前1 -
 xjy1979 共回答了18个问题
xjy1979 共回答了18个问题 |采纳率100%点击率低1年前查看全部
- 硫酸工艺中瓷管的作用是增大浓硫酸与三氧化硫的接触面积,有利于三氧化硫的吸收.这该怎么理解?
 xk82397841年前1
xk82397841年前1 -
 tyghbn 共回答了22个问题
tyghbn 共回答了22个问题 |采纳率95.5%三氧化硫与水反应生成硫酸 用瓷管让硫酸表面积增大 与三氧化硫接触面积大 有利于三氧化硫与硫酸中的水反应 有利于三氧化硫的吸收1年前查看全部
- 1.选项B怎么判断是硫酸够金属反应还是金属够硫酸反应?2.选项C有分哪个先与Ba(OH)反应吗?,
1.选项B怎么判断是硫酸够金属反应还是金属够硫酸反应?2.选项C有分哪个先与Ba(OH)反应吗?,
1.选项B怎么判断是硫酸够金属反应还是金属够硫酸反应?
2.选项C有分哪个先与Ba(OH)反应吗?,如果有是酸碱先反应还是金属活动性活泼的先反应?

 浅浅粉红1年前1
浅浅粉红1年前1 -
 yihua0109 共回答了17个问题
yihua0109 共回答了17个问题 |采纳率70.6%1年前查看全部
大家在问
- 1走进初三 作文
- 2把分别标有220v100w和220v60w的两个灯泡串联到220v的电源上,他们的实际功率是多少,
- 3请你用一句话写一写修筑青藏铁路遇到的困难,用上“不但……而且………”
- 450N的压力作用在1平方厘米的面积上所产生的压强为多少Pa?
- 5用细线拴住一个小球在光滑的水平面内做匀速圆周运动,下列描述小球运动的物理量,发生变化的是( )
- 6我真的永远永远爱你英语怎么说
- 7养花阅读答案这一自然段和开头哪一句照应,在文中起什么作用
- 8上午10点影子所指的方向准确点就好
- 9从这两句话中你感受到詹天佑是一个怎样的人?读到这里你有什么话想对他说?
- 10用96多红花和72朵白花做花束.如果每个花束里红花数一样多,白花数也一样多,最多能分几束花正好分完?
- 11物理实验报告分光计波长多少用分光计测量光栅常数里面的波长师多少啊?书上没说.我们用绿光的
- 12she boiled milk before she drank the milk.
- 13英语翻译戴 渊 少 时 游 侠,不 治 行 检,尝 在 江 淮 间 攻 掠 商 旅.陆 机 赴 假 还 洛,辎 重 甚
- 14求对以下这篇文章的评论秋天的风雨 我好想淋雨,好想让雨冲走那段回忆.也许,雨会让我清醒.雨点打在脸上的感觉,可以让人分不
- 15“爸爸只是在向孩子们介绍白杨吗?”这个句子是反问句吗,为什么?