以Y2O3、BaCO3和CuO为原料,可合成一种高温超导物质YBa2CuOx,欲合成0.5mol此超导物质,问:
 少了琪我不习惯2022-10-04 11:39:541条回答
少了琪我不习惯2022-10-04 11:39:541条回答理论上需取Y2O3、BaCO3和CuO的物质的量(mol)分别是多少?

已提交,审核后显示!提交回复
共1条回复
 小猪别放弃 共回答了20个问题
小猪别放弃 共回答了20个问题 |采纳率95%- 没有反应方程式,根据元素守恒即可解题
0.5 mol YBa2CuOx
有 0.5 mol Y 则 Y2O3 需要 0.25 mol
1 mol Ba 则 BaCO3 需要 1 mol
0.5 mol Cu 则 CuO 需要 0.5 mol - 1年前
相关推荐
- 为证实“二氧化碳是光合作用合成有机物必需的原料”,某同学制定了以下的实验方案.
为证实“二氧化碳是光合作用合成有机物必需的原料”,某同学制定了以下的实验方案.
(1)用一适当大小的玻璃罩罩住一株生长正常的盆栽绿色植物和一杯氢氧化钠溶液,密封不漏气.
(2)将上述植物及装置放在暗室中“饥饿”,消耗掉叶片内贮藏的有机物.暗室内装有红色安全灯.
(3)“饥饿”一定时间后,自暗室中取出,照光若干小时,使其充分进行光合作用.
(4)取一叶片,放入盛有酒精的烧杯中,水浴加热,使叶绿素溶于酒精中.
(5)将已脱绿的叶片取出,平铺在一个培养皿内,滴几滴碘液,检测有无葡萄糖生成的蓝色出现.
该实验方案中有几处明显的错误,请指出错误并改正(至少写出两处).
错误一:______.
错误二:______. Frinkey1年前1
Frinkey1年前1 -
 鹅湖秋韵 共回答了23个问题
鹅湖秋韵 共回答了23个问题 |采纳率87%解题思路:对照实验:在探究某种条件对研究对象的影响时,对研究对象进行的除了该条件不同以外,其他条件都相同的实验.根据变量设置一组对照实验,使实验结果具有说服力.一般来说,对实验变量进行处理的,就是实验组.没有处理是的就是对照组.此题考查二氧化碳是光合作用的必需原料的实验的设计能力,以及对实验结果的分析和归纳能力.在研究一种条件对研究对象的影响时,所进行的除了这种条件不同以外,其它条件都相同的实验,叫对照实验;其中不同的条件就是实验变量.对照实验的设计原则是:一组对照实验中只能有一个变量,且只能以所研究的条件为变量,其它条件应相同且适宜.这样便于排除其他条件干扰实验验.因此进行科学探究时,在对照实验中,除了实验变量不同之外,其它因素都相同.
该实验方案中有明显的错误是没有设置对照实验,错误一:应是两组一样的实验装置,其中A组放氢氧化钠溶液,B组不放氢氧化钠溶液,其它实验操作相同.
错误二:步骤(5)经处理后滴碘液,叶片变蓝或不变蓝,是检测有无淀粉生成,因为淀粉有遇碘变蓝色的特性,而不是葡萄糖.
故答案为:应是两组一样的实验装置,其中A组放氢氧化钠溶液,B组不放氢氧化钠溶液,其它实验操作相同;
步骤(5)经处理后滴碘液,叶片变蓝或不变蓝,是检测有无淀粉生成,因为淀粉有遇碘变蓝色的特性,而不是葡萄糖.点评:
本题考点: 探究光合作用的条件、原料和产物.
考点点评: 探究实验设计的两个基本原则:“对照原则”和“控制单一变量原则”,明确淀粉遇碘变蓝色的特性.1年前查看全部
- 用语言描述来证明二氧化碳是绿色植物进行光合作用所必需的原料
用语言描述来证明二氧化碳是绿色植物进行光合作用所必需的原料
用语言描述或画出实验装置图均可 wdty1年前2
wdty1年前2 -
 werewrwqerwe 共回答了18个问题
werewrwqerwe 共回答了18个问题 |采纳率83.3%假设CO2是光合作用必须的原料,设计实验,控制变量:有无CO2
步骤:1.两株植株均事先在阴暗环境下做饥饿处理,24小时后使之前产生的淀粉全部用呼吸作用消耗掉.
2.两棵株植株均用透明袋罩住,光照下至于相同的适于环境下适宜时间,第一株放置NAOH溶液,第二个植株放置和NAOH溶液等量的水.
3.各取叶子,用热酒精去色,滴加碘酒,发现空气中的植物叶子变蓝,即可证明假设是正确的.1年前查看全部
- 十六烷为原料,制取乙烯的系列化学方程式
 幽兰如梦1年前3
幽兰如梦1年前3 -
 西陆蝉声 共回答了21个问题
西陆蝉声 共回答了21个问题 |采纳率90.5%先裂解
C16H34-----高温高压催化剂-----> C8H18+C8H16
进一步裂解
C8H18-----高温高压催化剂----->C4H10+C4H8
再进一步裂解
C4H10-----高温高压催化剂----->C2H4+C2H61年前查看全部
- 某工厂接到任务要用甲乙两种原料生产AB两种产品30件
 kiss汐1年前1
kiss汐1年前1 -
 想想世界 共回答了22个问题
想想世界 共回答了22个问题 |采纳率95.5%这是一道选择题,可采用试探法
若A产品15件,需甲原料4×15=60千克,
B产品30-15=15件,需甲原料2×15=30千克
共需甲原料60+30=90千克大于84千克,不够
若A产品12件,需甲原料4×12=48千克,需乙原料3×12=36千克
B产品30-12=18件,需甲原料2×18=36千克,需乙原料6×18=108千克
共需甲原料48+36=84千克,共需乙原料36+108=144千克
够
因此,本题应选B1年前查看全部
- 以铜,石灰石.盐酸为原料,制备氢氧化铜,其它原料自选,写出该原理的方程式.
 wangdoctor1年前1
wangdoctor1年前1 -
 aabacon 共回答了13个问题
aabacon 共回答了13个问题 |采纳率76.9%Cao+2h2o=(高温)Ca(oh)2+h2
Cu+2hcl=Cucl2+h2
Cucl2+Ca(oh)2=Cu(oh)2+Cacl2
这只是一个简单的置换反应1年前查看全部
- 为证明“二氧化碳是光合作用合成有机物必须的原料”
 靠服了1年前1
靠服了1年前1 -
 可可豆villa 共回答了15个问题
可可豆villa 共回答了15个问题 |采纳率86.7%光合作用(Photosynthesis),即光能合成作用,是植物、藻类和某些细菌,在可见光的照射下,经过光反应和暗反应,利用光合色素,将二氧化碳(或硫化氢)和水转化为有机物,并释放出氧气(或氢气)的生化过程.光合作用是一系列复杂的代谢反应的总和,是生物界赖以生存的基础,也是地球碳氧循环的重要媒介.
光合作用的简单实验
【设计】 光合作用是绿色植物在光下把二氧化碳和水合成有机物(淀粉等),同时放出氧气的过程.本实验应用对比的方法,使学生认识:(1)绿叶能制造淀粉;(2)绿叶必须在光的作用下才能制造出淀粉.
【器材】 天竺葵一盆、烧杯、锥形瓶、酒精灯、三脚架、石棉网、棉絮、镊子、白瓷盘、酒精、碘酒、厚一些的黑纸、曲别针.
【步骤】
1.将天竺葵放在黑暗处一二天,使叶内的淀粉尽可能多地消耗掉.
2.第三天,取出放在黑暗处的天竺葵,选择几片比较大、颜色很绿的叶子,用黑纸将叶的正反面遮盖.黑纸面积约等于叶片面积的二分之一,正反面的黑纸形状要一样,并且要对正,用曲别针夹紧(如图).夹好后,把天竺葵放在阳光下晒4~6小时.
3.上课时,采下一片经遮光处理的叶和另一片未经遮光处理的叶(为了便于区别,可使一片叶带叶柄,另一片叶不带叶柄),放在沸水中煮3分钟,破坏它们的叶肉细胞.
4.把用水煮过的叶子放在装有酒精的锥形瓶中(酒精量不超过瓶内容积的二分之一),瓶口用棉絮堵严.将锥形瓶放在盛着沸水的烧杯中,给酒精隔水加热(如图),使叶绿素溶解在酒精中.待锥形瓶中的绿叶已褪色,变成黄白色时,撤去酒精灯,取出叶片.把叶片用水冲洗后放在白瓷盘中.
5.将叶片展开铺平,用1∶10的碘酒稀释液,均匀地滴在二张叶片上.过一会儿可以观察到:受到阳光照射的叶子全部变成蓝色;经遮光处理过的叶子,它的遮光部分没变蓝,只有周围受光照射的部分变蓝.由此可以说明,绿叶能制造淀粉,绿叶只有在光的照射下才能制造出淀粉.
【注意】
1.碘的浓度过大时,叶片的颜色不显蓝,而显深褐色.对存放时间过久的碘酒,因酒精蒸发使碘的浓度增大,可适当多加一些水稀释.
2.酒精燃点低,一定要在烧杯中隔水加热,千万不要直接用明火加热,以免着火.
光合作用是指绿色植物通过叶绿体,利用光能,把二氧化碳和水转化成储存着能量的有机物,并且释放出氧的过程.我们每时每刻都在吸入光合作用释放的氧.我们每天吃的食物,也都直接或间接地来自光合作用制造的有机物.那么,光合作用是怎样发现的呢?
【分析】
阳光
水+二氧化碳→→氧气+有机物1年前查看全部
- 现有200t含氧化铁80%的赤铁矿,则用这批原料进行炼铁,可以练出纯度为97%的生铁多少
 y2kksam1年前1
y2kksam1年前1 -
 aileen_cn2004 共回答了14个问题
aileen_cn2004 共回答了14个问题 |采纳率92.9%3CO+ Fe2O3 =高温= 2Fe + 3CO2
160 112
200*80% 97%x
160:112=200*80%:97%x
10:7=160:97%x
97%x=112
x=115.51年前查看全部
- 硫酸钡是唯一的无毒的钡盐,工业上以硫酸钡等为原料通过下列流程反应可以制备锌钡白(BaSO4+ZnS)和过氧化氢.(皓矾为
硫酸钡是唯一的无毒的钡盐,工业上以硫酸钡等为原料通过下列流程反应可以制备锌钡白(baso4+zns)和过氧化氢.(皓矾为znso4•7h2o)

(1)上述流程***有7个化学反应,其中有______个属于氧化还原反应.
(2)写出过氧化氢和物质c的电子式:______,______.
(3)写出f、g的化学式:f______、g______.
(4)写出下列化学反应方程式:反应③______.反应⑦______.
(5)取锌钡白固体16.5g溶于100ml 1mol/l的h2so4 溶液中,放出h2s 气体1008ml(已折算成标准状况)
①不计溶液体积变化,所得溶液中氢硫酸的物质的量浓度为______mol/l;
②加热驱尽溶液中h2s 后,为使锌离子刚好完全沉淀,应加入 1mol/l的naoh溶液______ml. fjfcvvf551年前1
fjfcvvf551年前1 -
 didididd 共回答了23个问题
didididd 共回答了23个问题 |采纳率91.3%解题思路:重晶石是BaSO4,黑色单质A通常是碳.由BaSO4和单质碳高温生成气体B,B燃烧生成气体C,可知B是CO,C是CO2.有臭鸡蛋气味的气体E是H2S,而H2S是由D溶于H2O通入CO2所得,则D中含S2-.BaSO4和单质碳高温生成气体CO,同时生成白色固体D,则D是BaS.BaS溶于H2O,与皓矾(ZnSO4•7H2O)反应生成锌钡白(BaSO4和ZnS的混合物).BaS溶于H2O 通入CO2产生H2S,同时生成白色沉淀F,可知F是BaCO3.进一步推出G是BaO,H是BaO2,BaO2与稀H2SO4反应生成BaSO4沉淀和H2O2.
(1)元素化合价在反应前后发生变化的反应属于氧化还原反应;
(2)H2O2属于共价化合物,分子中氧原子与氢原子之间形成1对共用电子对,氧原子之间形成1对共用电子对;
C是CO2,属于共价化合物,分子中碳原子与氧原子之间形成2对共用电子对;
(3)由分析可知,F是BaCO3,G是BaO;
(4)根据上述分析可知各反应中反应物与产物,配平书写方程式;
(5)①锌钡白固体中n(ZnS)=n(BaSO4),计算16.5g锌钡白固体中n(ZnS)=n(BaSO4)=0.05ml,1008mLH2S气体的物质的量为[1.008L/22.4L/mol]=0.045mol,所以溶液中氢硫酸的物质的量为0.05mol-0.045mol=0.005mol,再根据c=[n/V]计算硫化氢的浓度;
②加热驱尽溶液中H2S 后,为使锌离子刚好完全沉淀,形成的溶液为硫酸钠溶液,根据硫酸根守恒可知,n(Na2SO4)=n(H2SO4),由钠离子守恒可知,n(NaOH)=2n(Na2SO4)=2n(H2SO4),再根据V=[n/c]计算.重晶石是BaSO4,黑色单质A通常是碳.由BaSO4和单质碳高温生成气体B,B燃烧生成气体C,可知B是CO,C是CO2.有臭鸡蛋气味的气体E是H2S,而H2S是由D溶于H2O通入CO2所得,则D中含S2-.BaSO4和单质碳高温生成气体CO,同时生成白色固体D,则D是BaS.BaS溶于H2O,与皓矾(ZnSO4•7H2O)反应生成锌钡白(BaSO4和ZnS的混合物).BaS溶于H2O 通入CO2产生H2S,同时生成白色沉淀F,可知F是BaCO3.进一步推出G是BaO,H是BaO2,BaO2与稀H2SO4反应生成BaSO4沉淀和H2O2.
(1)流程中7个化学反应,反应①BaSO4+4C=BaS+4CO↑,碳元素的化合价由0价升高为+2价,硫元素化合价由+6价降低为-2价,属于氧化还原反应;反应②是CO的燃烧,碳元素、氧元素化合价发生变化,属于氧化还原反应;反应③BaS+ZnSO4=ZnS↓+BaSO4↓,各元素化合价未发生变化,属于复分解反应;反应④BaS+H2O+CO2=BaCO3↓+H2S,各元素化合价未发生变化,属于复分解反应;反应⑤为BaCO3
高温
.
Ba+CO2↑,各元素化合价未发生变化,属于分解反应;反应⑥为2BaO+O2
△
.
2BaO2,氧元素化合价发生变化,属于氧化还原反应;反应⑦BaO2+H2SO4=BaSO4↓+H2O2,各元素化合价未发生变化,属于复分解反应.所以7个反应中①②⑥属于氧化还原反应,故答案为:3;
(2)H2O2属于共价化合物,分子中氧原子与氢原子之间形成1对共用电子对,氧原子之间形成1对共用电子对,电子式为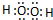 ;
;
C是CO2,属于共价化合物,分子中碳原子与氧原子之间形成2对共用电子对,电子式为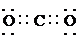 ,
,
故答案为: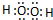 ;
;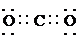 ;
;
(3)由分析可知,F是BaCO3,G是BaO,故答案为:BaCO3;BaO;
(4)由分析可知,反应③:BaS+ZnSO4=ZnS↓+BaSO4↓.反应⑦:BaO2+H2SO4=BaSO4↓+H2O2,
故答案为:BaS+ZnSO4=ZnS↓+BaSO4↓;BaO2+H2SO4=BaSO4↓+H2O2;
(5)①由工艺流程,反应③:BaS+ZnSO4=ZnS↓+BaSO4↓可知,锌钡白固体中n(ZnS)=n(BaSO4),所以n(ZnS)×97g/mol+=n(BaSO4)×233g/mol=16.5g,解得n(ZnS)=n(BaSO4)=0.05ml,1008mLH2S气体的物质的量为[1.008L/22.4L/mol]=0.045mol,所以溶液中氢硫酸的物质的量为0.05mol-0.045mol=0.005mol,溶液中氢硫酸的物质的量浓度为[0.005mol/0.1L]=0.05mol/L,
故答案为:0.05;
②加热驱尽溶液中H2S 后,为使锌离子刚好完全沉淀,形成的溶液为硫酸钠溶液,根据硫酸根守恒可知,n(Na2SO4)=n(H2SO4),由钠离子守恒可知,n(NaOH)=2n(Na2SO4)=2n(H2SO4)=2×0.1L×1mol/L=0.2mol,故需要1mol/L的NaOH溶液体积为[0.2mol/1mol/L]=0.2L=200mL,故答案为:200.点评:
本题考点: 制备实验方案的设计;难溶电解质的溶解平衡及沉淀转化的本质;含硫物质的性质及综合应用.
考点点评: 本题以制备锌钡白和过氧化氢为载体,考查物质推断、氧化还原反应、化学用语、化学计算等,难度中等.是对所学知识的综合运用与能力的考查,需要学生具备扎实的基础知识与综合运用知识、信息进行解决问题的能力.1年前查看全部
- (15分) 铝土矿(主要成分为Al 2 O 3 ,还含有SiO 2 、Fe 2 O 3 )是工业上制备氧化铝的主要原料。
(15分) 铝土矿(主要成分为Al 2 O 3 ,还含有SiO 2 、Fe 2 O 3 )是工业上制备氧化铝的主要原料。工业上提取氧化铝的工艺流程如下:

① 沉淀 A、B的成分分别是 、 ;步骤②中的试剂a是 ;
② 试写出步骤③中发生反应的离子方式 __________ 、
__________ __________ ;
③试写出步骤③中滤液分解反应的方程式____________________________________.
④简述氯化铝溶液经过结晶得到氯化铝晶体的实验条件是 。 风中怪杰1年前1
风中怪杰1年前1 -
 萝卜英子 共回答了17个问题
萝卜英子 共回答了17个问题 |采纳率82.4%(1) ① SiO 2 Fe(OH) 3 NaOH溶液(各2分)
② CO 2 + OH - =HCO 3 - CO 2 + AlO 2 - + 2H 2 O = Al(OH) 3 ↓+ HCO 3 - (各2分)
③ 2NaHCO 3 Na 2 CO 3 + CO 2 ↑ + H 2 O (各2分)
Na 2 CO 3 + CO 2 ↑ + H 2 O (各2分)
④将溶液在较低温度下加热蒸发析出晶体,同时通入氯化氢气体防止水解。(3分)
(1)二氧化硅和盐酸不反应,所以A是二氧化硅。滤液甲中含有铝离子和铁离子,加入过量的氢氧化钠,则生成氢氧化铁沉淀,即B是氢氧化铁。滤液乙中含有偏铝酸钠,通入CO 2 生成氢氧化铝沉淀。
(2)滤液乙中还含有过量的氢氧化钠,所以方程式为CO 2 + OH - =HCO 3 - 、CO 2 + AlO 2 - + 2H 2 O = Al(OH) 3 ↓+ HCO 3 - 。
(3)碳酸氢钠不稳定,受热易分解,方程式为2NaHCO 3 Na 2 CO 3 + CO 2 ↑ + H 2 O。
Na 2 CO 3 + CO 2 ↑ + H 2 O。
(4)由于氯化铝易水解,所以在蒸发浓缩时必须防止水解,因此方法是将溶液在较低温度下加热蒸发析出晶体,同时通入氯化氢气体防止水解。1年前查看全部
- 烃A是一种重要的基本化工原料,用质谱法测得其相对分子质量为28.如图1是以A为原料合成药物中间体E和树脂K的路线.
烃A是一种重要的基本化工原料,用质谱法测得其相对分子质量为28.如图1是以A为原料合成药物中间体E和树脂K的路线.
已知如图2: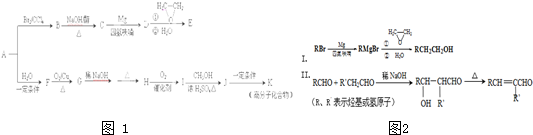
(1)A中官能团的结构简式是______.有机物B的名称______.
(2)B→C的化学方程式为______.B和氢氧化钠的水溶液加热反应所得到的有机产物和乙二酸反应生成高分子化合物,写出生成高分子化合物反应的化学方程式______.
(3)E的分子式为C 4 H 8 O.下列关于E的说法正确的是______(填字母序号).
a.能与金属钠反应 b.分子中4个碳原子一定共平面
c.一定条件下,能与浓氢溴酸反应d.与CH 2 =CHCH 2 OCH 2 CH 3 互为同系物
(4)G→H涉及到的反应类型有______.
(5)I的分子式为C 4 H 6 O 2 ,其结构简式为______.
(6)J→K的化学方程式为______.
(7)写出与E具有相同官能团的所有同分异构体的结构简式:______(不考虑顺反异构,不考虑-OH连在双键碳上的结构). qiuqiucat1年前1
qiuqiucat1年前1 -
 我的名字ww来吧 共回答了10个问题
我的名字ww来吧 共回答了10个问题 |采纳率90%烃A的相对分子质量为28,故A应为CH 2 =CH 2 ,与溴发生加成反应生成B,B为BrCH 2 CH 2 Br,在氢氧化钠醇溶液,加热条件下发生消去反应生成C,结合信息Ⅰ可知C为CH 2 =CHBr,D为CH 2 =CHMgBr,E为CH 2 =CHCH 2 CH 2 OH,A和水发生加成反应生成F为CH 3 CH 2 OH,F催化氧化生成G,故G为CH 3 CHO,由信息Ⅱ可知H为CH 3 CH=CHCHO,H催化氧化生成I,I为CH 3 CH=CHCOOH,与甲醇发生酯化反应生成J,故J为CH 3 CH=CHCOOCH 3 ,J发生加聚反应生成高分子化合物K,故K为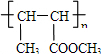
,
(1)由以上分析可知A为CH 2 =CH 2 ,有机物B为BrCH 2 CH 2 Br,含有官能团为溴原子,故答案为:CH 2 =CH 2 ;溴原子;
(2)B为BrCH 2 CH 2 Br,C为CH 2 =CHBr,B生成C的方程式为:BrCH 2 CH 2 Br+NaOH
醇
△ CH 2 =CHBr+NaBr+H 2 O,
B和氢氧化钠的水溶液加热反应所得到HOCH 2 CH 2 OH,与乙二酸反应生成高分子化合物的方程式为:
HOCH 2 CH 2 OH+HOOC-COOH
一定条件

+2(n-1)H 2 O,
故答案为:BrCH 2 CH 2 Br+NaOH
醇
△ CH 2 =CHBr+NaBr+H 2 O;HOCH 2 CH 2 OH+HOOC-COOH
一定条件

+2(n-1)H 2 O;
(3)E为CH 2 =CHCH 2 CH 2 OH,含有C=C,能发生加成反应,含有-OH,能与Na发生反应生成氢气,与CH 2 =CHCH 2 OCH 2 CH 3 结构不同,不是同系物,分子中只有3个C原子在同一个平面上,
故答案为:ac;
(4)由信息Ⅱ可知G→H涉及到的反应类型有加成反应、消去反应,故答案为:加成反应、消去反应;
(5)由以上分析可知I为CH 3 CH=CHCOOH,故答案为:CH 3 CH=CHCOOH;
(6)J为CH 3 CH=CHCOOCH 3 ,含有碳碳双键,可发生加聚反应,反应的方程式为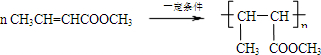
,
故答案为: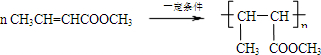
;
(7)E为CH 2 =CHCH 2 CH 2 OH,与E具有相同官能团的所有同分异构体为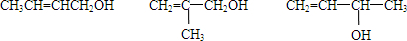
,
故答案为:
.1年前查看全部
- 赤铁矿为原料练铁的化学反应原理(用化学方程式表示)
 syg7894561年前1
syg7894561年前1 -
 yehaomei 共回答了14个问题
yehaomei 共回答了14个问题 |采纳率100%Fe2O3+3CO=2Fe+3CO21年前查看全部
- 一道科学计算题,一储油罐,里面装有某种液体的原料,由于出口阀门封密不严,导致液体向外滴漏.小明为了搞清一昼夜滴漏液体的质
一道科学计算题,
一储油罐,里面装有某种液体的原料,由于出口阀门封密不严,导致液体向外滴漏.小明为了搞清一昼夜滴漏液体的质量,他用天平、秒表、烧杯等仪器做了如下实验:
(1)他用天平称量烧杯的质量为100g
(2)把烧杯放在出口下,开启秒表,在80秒内滴了350滴液体.
(3)将滴有液体的烧杯放在已调好的天平左盘,逐渐在另一个盘中加砝码,当把最小的砝码放入盘中时,指针偏向分度盘的右侧,则下一步的操作是()直到指针指到分度盘的中央时,盘中的砝码及游码的位置如图所示,则80秒共滴液体122.6g
(4)一昼夜(24小时)滴漏的液体质量是多少克?(写出简单的计算过程)最好有ρ=M/V xlg1861年前3
xlg1861年前3 -
 znbird 共回答了19个问题
znbird 共回答了19个问题 |采纳率100%一储油罐,里面装有某种液体的原料,由于出口阀门封密不严,导致液体向外滴漏.小明为了搞清一昼夜滴漏液体的质量,他用天平、秒表、烧杯等仪器做了如下实验:(1)他用天平称量烧杯的质量为100g(2)把烧杯放在出口下,开启秒表,在80秒内滴了350滴液体.(3)将滴有液体的烧杯放在已调好的天平左盘,逐渐在另一个盘中加砝码,当把最小的砝码放入盘中时,指针偏向分度盘的右侧,则下一步的操作是(取出最小砝码,将游码往右移动)直到指针指到分度盘的中央时,盘中的砝码及游码的位置如图所示,则80秒共滴液体122.6g.(4)一昼夜(24小时)滴漏的液体质量是多少克?(写出简单的计算过程)
一昼夜(24小时)滴漏的液体质量=(122.6克-120克)×24×3600秒/80秒=2080克.
答:一昼夜(24小时)滴漏的液体质量是2080克.1年前查看全部
- 英语翻译谁帮我把这几个化学原料翻译成英文:乳液,阻燃剂,色浆,丙烯酸丁酯,甲基丙烯酸甲酯,过硫酸铵、乳化剂,脱离子水
 hwqzju1年前2
hwqzju1年前2 -
 晕倒你不是我的错 共回答了19个问题
晕倒你不是我的错 共回答了19个问题 |采纳率84.2%乳液latex
阻燃剂flame retardant
色浆color sizing
丙烯酸丁酯butyl acrylate
甲基丙烯酸甲酯methyl methacrylate
过硫酸铵ammonium persulfate
乳化剂emulphor
脱离子水deionized wate1年前查看全部
- 工业上以铬铁矿(主要成分FeO•Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7)的主要反应为:
工业上以铬铁矿(主要成分FeO•Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7)的主要反应为:
①4FeO•Cr2O3+8Na2CO3+7O2
8Na2CrO4+2□+8CO2高温 .
②2Na2CrO4+H2SO4=Na2SO4+Na2Cr2O7+H2O
下列说法正确的是( )
A.反应①和②均为氧化还原反应
B.反应①中的氧化剂是O2,还原剂是FeO•Cr2O3
C.□内的物质是Fe3O4
D.生成1 mol Na2Cr2O7,时共转移6 mol电子 亲爱的ミ1年前1
亲爱的ミ1年前1 -
 yyuu852 共回答了11个问题
yyuu852 共回答了11个问题 |采纳率72.7%解题思路:A.有电子转移的化学反应是氧化还原反应,其特征是有元素化合价的升降;
B.得电子化合价降低的反应物是氧化剂,失电子化合价升高的反应物是还原剂;
C.根据元素守恒及原子守恒判断;
D.根据Na2Cr2O7和转移电子之间的关系式计算.A.在反应前后,②中各元素的化合价都不变化,所以不是氧化还原反应,故A错误;
B.反应①氧气得电子化合价降低,所以氧气是氧化剂,FeO•Cr2O3中铁和铬元素化合价都升高,所以FeO•Cr2O3是还原剂,故B正确;
C.根据原子守恒知,□内的物质是Fe2O3,故C错误;
D.反应②中生成1molNa2Cr2O7需要2molNa2CrO4,由反应①可知,参加反应FeO•Cr2O3为1mol,反应中Fe元素化合价由+2价升高为+3价,Cr由+3升高为+6,故生成1molNa2Cr2O7共转移电子的物质的量为1mol×[1+(6-3)]=7mol,故D错误;
故选B.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应基本概念与计算等,难度中等,注意根据化合价理解氧化还原反应.1年前查看全部
- 高中化学氨气是一种重要工业原料,在工农业生产中具有重要的应用. (1)已知:N2(g)+O2(g)===2NO(g);Δ
高中化学
氨气是一种重要工业原料,在工农业生产中具有重要的应用. (1)已知:N2(g)+O2(g)===2NO(g);ΔH=+180.5 kJ·mol-1 4NH3(g)+5O2(g)===4NO(g)+6H2O(g);ΔH=-905 kJ·mol-1 bm 2H2(g)+O2(g)===2H2O(g);ΔH=-483.6 kJ·mol-1 则N2(g)+3H2(g)===2NH3(g);ΔH= . (2)工业合成氨气的反应为N2(g)+3H2(g) 2NH3(g).在一定温度下,将一定量的N2和H2通入 到初始体积为1 L的密闭容器中达到平衡后,单独改变下列条件,能使平衡向正反应方向移动且 平衡常数不变的是 . ①增大压强 ②增大反应物的浓度 ③使用催化剂 ④降低温度 (3)①常温下0.1 mol/L氨水中电离出的c(OH- ) 10-1 mol/L(填写“>”、“<”或“=”); ②将相同体积、pH之和为14的氨水和盐酸混合后,溶液中离子浓度由大到小的顺序为 . (4)用氨水和40 mL 0.5 mol/L硫酸铝溶液来制备一定量的氢氧化铝,该反应的离子方程式 为 .某同学改用2 mol/L的氢氧化钠溶液代替氨水来制备,结果只得到了0.78克的沉淀,其加入的氢氧化钠溶液的体积可能为__________求高人详解(4)答案为15ml或75ml不明白75ml谢
 银座1年前1
银座1年前1 -
 大胖子_ss 共回答了23个问题
大胖子_ss 共回答了23个问题 |采纳率87%最后一问两种情况 第一种情况是加入的碱少量 氢氧根直接与铝离子生成沉淀 第二种情况就是碱过量 先全部生成氢氧化铝 再生成偏铝酸钠 剩余少部分未反应的氢氧化铝1年前查看全部
- 织一种布,100米用原料184千克,用电80度,已知每吨22550元,每度0.5元,挡车工织1米布的报酬是0.38元,问
织一种布,100米用原料184千克,用电80度,已知每吨22550元,每度0.5元,挡车工织1米布的报酬是0.38元,问1米成品布的成本是多少元?若想实现利润30%,那么每米成品布的售价是多少元?
要一步一步的算出来,我才能看懂^_^ 没兜的裤子1年前2
没兜的裤子1年前2 -
 我的星星 共回答了15个问题
我的星星 共回答了15个问题 |采纳率80%1米成本:(184*22550/1000+0.5*80)/100+0.38=41.872
每米售价:41.872*130%=54.43361年前查看全部
- 啤酒发酵过程1.把原料放入沸水中混合的目的?2.在混合物中加入糖的目的?3.为什么要在混合物冷却后才把酵母加进去?4.为
啤酒发酵过程
1.把原料放入沸水中混合的目的?
2.在混合物中加入糖的目的?
3.为什么要在混合物冷却后才把酵母加进去?
4.为什么啤酒至少要搁置21天才可以过滤装瓶,说出一中理由. bbsfx5211年前2
bbsfx5211年前2 -
 vihoo 共回答了18个问题
vihoo 共回答了18个问题 |采纳率94.4%1.防止杂菌进入 这是成功的必要条件(不然会产生别的代谢产物,并且和酵母菌会产生竞争关系,不利于酒的生成和纯净)
2.原料中的糖是作为酵母菌的养料 发生糖到酒精的化学反应:产生酒精和二氧化碳
3.冷却以后的环境(温度)才适合于酵母菌的生存
4.等到无氧状态产生酒精(之前是先有氧让酵母菌大量繁殖,后来是无氧让其无氧呼吸产酒精)1年前查看全部
- 候氏制碱法原料添加顺序,及有关方程式.
候氏制碱法原料添加顺序,及有关方程式.
写出先加什么原料在加什么. maggiekk1年前2
maggiekk1年前2 -
 哈哈哈lala 共回答了20个问题
哈哈哈lala 共回答了20个问题 |采纳率100%氨气与水和二氧化碳反应生成一分子的碳酸氢铵,这是第一步.第二步是:碳酸氢铵与卤化钠反应生成一分子的卤化铵和碳酸氢钠沉淀,碳酸氢钠之所以沉淀是因为他的溶解度很小.
根据 NH4Cl 在常温时的溶解度比 NaCl 大,而在低温下却比 NaCl 溶解度小的原理,在 278K 283K(5 10 ℃ ) 时,向母液中加入食盐细粉,而使 NH4Cl 单独结晶析出供做氮肥.
(1)NH3+H2O+CO2=NH4HCO3(2)NH4HCO3+NaCl=NH4Cl+NaHCO3↓1年前查看全部
- (2009•宝安区模拟)工业碳酸钠由于在生产过程中原料盐和工艺等的原因,常会含有Na2SO4、NaCl中的一种或两种杂质
(2009•宝安区模拟)工业碳酸钠由于在生产过程中原料盐和工艺等的原因,常会含有Na2SO4、NaCl中的一种或两种杂质.现有工业碳酸钠样品,某化学兴趣小组就工业碳酸钠中是否含有这两种杂质进行探究.
实验室有以下的仪器和药品可供使用:
烧杯、试管、玻璃棒、药匙、滴管、酒精灯、试管夹:1.0mol•L-1H2SO4、1.0mol•L-1HNO3、1.0mol•L-1HCl、NaOH稀溶液、0.1mol•L-1AgNO3、0.1mol•L-1BaCl2、0.1mol•LBa(NO3)2、蒸馏水.
以下是实验探究过程:
1)提出假设:
假设1工业碳酸钠中只含有Na2SO4 杂质;
假设2工业碳酸钠中只含有NaCl 杂质;
假设3工业碳酸钠中含有______杂质;
2)基于假设设计实验方案
3)根据实验方案进行实验
请回答:
(1)某同学基于假设1进行了实验:取少许样品于试管中,加适量蒸馏水溶解,向试管中滴入0.1mol•L-1的BaCl2溶液,有白色沉淀产生.他认为样品中含有Na2SO4.请你对他的结论的正确性提出你的观点,并简要说出理由:______.
(2)基于假设3,请你根据你的实验方案,将实验操作和预期的现象及结论填入下表中:(编号不够可以再加)
编号 实验操作 预期现象和结论 ① ______ ______ ② ______ ______ ③ ______ ______  流儿浪1年前1
流儿浪1年前1 -
 为了轩 共回答了22个问题
为了轩 共回答了22个问题 |采纳率86.4%解题思路:1)含有Na2SO4、NaCl中的一种或两种杂质,结合假设1和假设2的内容来确定假设3;
3)(1)碳酸根、硫酸根均可以和钡离子反应生成白色沉淀;
(2)①碳酸钠可以和酸反应生成二氧化碳气体;
②白色且不溶于硝酸的沉淀有硫酸钡和氯化银两种;
③能和硝酸酸化的硝酸银反应生成白色沉淀的是含有氯离子的化合物.1)含有Na2SO4、NaCl中的一种或两种杂质,结合假设1和假设2的内容可知假设3为碳酸钠中含Na2SO4和NaCl杂质,故答案为:Na2SO4和NaCl;
(1)碳酸根、硫酸根均可以和钡离子反应生成白色沉淀,向试管中滴入0.1mol•L-1的BaCl2溶液,有白色沉淀产生,样品中含有碳酸钠或者是Na2SO4,
故答案为:不正确,溶液中含有CO32-,可与BaCl2溶液产生BaCO3沉淀,因此无法确定该沉淀是BaSO4;
(2))①只有碳酸钠可以和酸反应生成二氧化碳气体,可以用硝酸检验是否生成二氧化碳气体来检验碳酸钠的存在;
②向酸化后的试管中加入0.1mol•L-1的Ba(NO3)2 溶液至过量,生成的白色且不溶于硝酸的沉淀是硫酸钡,证明含有硫酸钠;
③能和硝酸酸化的硝酸银反应生成的白色沉淀一定是氯化银,证明含有氯化钠,故答案为:
编号 实验操作 预期现象和结论
① 取少许样品于试管中,加蒸馏水溶解.向试管中加足量的1.0 mol•L-1HNO3.(或加入1.0 mol•L-1HNO3至溶液中不再有气体放为止.) 有气体产生,说明样品中含有Na2CO3.
② 向试管中加入0.1 mol•L的Ba(NO3)2 溶液.若有沉淀产生,则继续加入0.1 mol•LBa(NO3)2至过量. 若有沉淀产生,则含Na2SO4,若没有沉淀产生,则不含Na2SO4.
③ 若②操作无沉淀,则向试管中加入0.1 mol•L-1AgNO3溶液.若②操作中有沉淀,则将试管静置片刻后,取上层清液于另一去试管中,加入0.1 mol•L-1AgNO3溶液. 有沉淀产生,则含NaCl,若无沉淀,则不含NaCl.点评:
本题考点: 物质的检验和鉴别的实验方案设计.
考点点评: 本题考查物质检验、鉴别的实验方案的设计,侧重离子检验及实验探究的考查,注意混合物中一定存在、一定不存在和可能存在的是什么物质,题目难度不大.1年前查看全部
- 由甲苯为原料制苯甲酸甲脂,写出所发生的化学反应方程式、注明反应条件
 Google测试员55571年前4
Google测试员55571年前4 -
 舜间的永远 共回答了20个问题
舜间的永远 共回答了20个问题 |采纳率95%1、甲苯在酸性高锰酸钾(硫酸酸化)的条件下氧化生成苯甲酸钾,锰酸钾,硫酸钾,水
10 C6H5CH3 + 12 KMnO4 + 13 H2SO4 = = 12 MnSO4 + K2SO4 +10 C6H5COOK + 28 H2O
2、将上述反应生成的苯甲酸钾酸化,得到苯甲酸.
2C6H5COOK + H2SO4 == 2C6H5COOH + K2SO4
3、苯甲酸与甲醇在硫酸催化时加热生成苯甲酸甲酯和水.
C6H5COOH + CH3OH ==(H2SO4做催化剂,加热) == C6H5COOCH3 +H2O1年前查看全部
- 光合作用的产物是淀粉,氧气;光合作用的原料之一是二氧化碳,光合作用的条件是光.设计实验证明:
光合作用的产物是淀粉,氧气;光合作用的原料之一是二氧化碳,光合作用的条件是光.设计实验证明:
(1)叶绿体是光合作用的场所.
(2)水是光合作用的原料. 小学毕业生1年前1
小学毕业生1年前1 -
 爱笔静 共回答了17个问题
爱笔静 共回答了17个问题 |采纳率88.2%银边吊兰的例子,绿色部分检验有淀粉银色部分没有,所以(1)
将水用O标记,放出的氧气含有被标记的O,不加水就没氧气1年前查看全部
- (u008•辽宁)海洋是r个巨大的资源库,我们可以从海水中提取食盐,并以此为原料制得具有广泛用途的烧碱.其制取的主要工艺
(u008•辽宁)海洋是r个巨大的资源库,我们可以从海水中提取食盐,并以此为原料制得具有广泛用途的烧碱.其制取的主要工艺流程如下:
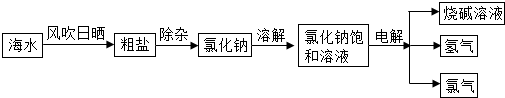
(1)利用风吹日晒可以从海水中提取粗盐,风吹日晒的主要作用是______.
(u)要除去食盐水中混有的少量泥沙,操作方法是______.
(1)写出电解氯化钠溶液的化学方程式umaCl+uHuO
umaOH+Hu↑+Clu↑通电 .umaCl+uHuO.
umaOH+Hu↑+Clu↑通电 .
(他)该化工厂将副产品氢气和氯气加以利用:氢气在氯气中燃烧生成氯化氢,氯化氢溶于水得到盐酸.写出氢气在氯气中燃烧的化学方程式:Hu+Clu
uHCl点燃 .Hu+Clu,通过这个化学反应,你对燃烧的新认识是______.
uHCl点燃 . 轩轩55号1年前1
轩轩55号1年前1 -
 qianj555 共回答了17个问题
qianj555 共回答了17个问题 |采纳率88.2%解题思路:(1)根据晒盐的原理分析即可;
(2)根据混合物分离的方法分析;
(3)根据题意再结合元素守恒分析即可;
(4)根据题目信息与燃烧的概念进行分析即可作答.(r)从海水中提取食盐采用蒸发结晶的方法,风吹日晒是为了加速水分的蒸发,故答案为:蒸发水分;(2)因为泥沙不溶于水,而氯化钠溶于水,所以可以采用过滤的方法滤去泥沙,故答案为:过滤;(五)根据题意:电解氯...
点评:
本题考点: 对海洋资源的合理开发与利用;过滤的原理、方法及其应用;结晶的原理、方法及其应用;书写化学方程式、文字表达式、电离方程式.
考点点评: 可燃物在氧气中可以燃烧,但燃烧不一定需要氧气氧气参加,如:H2+Cl2 点燃 . 2HCl,同学们需要注意!1年前查看全部
- 、“卤块”的主要成分为MgCl2(含Fe2+、Fe3+、Mn2+等杂质离子).若以它为原料,按如下工艺流程图,即
、“卤块”的主要成分为MgCl2(含Fe2+、Fe3+、Mn2+等杂质离子).若以它为原料,按如下工艺流程图,即
生成的第一个沉淀物不应该是 Mn(OH)2↓吗?因为步骤三中的ph=9.8.那这样Y为什么不加碳酸钠而是选氢氧化钠
抱歉,字说太多了我没打上.今天找到这里面有这个题,我懂了、是我答案书上的答案错了,让我纠结了两天. 小网iNet1年前1
小网iNet1年前1 -
 hengo00721 共回答了20个问题
hengo00721 共回答了20个问题 |采纳率85%请把图贴上 题补齐
来自 大科学 团队1年前查看全部
- 以乙炔为原料,合成1,4-二溴-2-丁烯.
 ringding1年前0
ringding1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 以苯为原料用苯为什么不能一步制得1,2-二溴苯
 tiantangzhiwu1年前1
tiantangzhiwu1年前1 -
 hjandy 共回答了18个问题
hjandy 共回答了18个问题 |采纳率94.4%因为先是一溴苯之后 基团不能活化临位 可以理解为 生成邻二溴苯的要求不符合 因而需要利用其他基团 产生临位溴苯之后 再消去辅助的 也就是要多不了1年前查看全部
- 以铁为基本原料两步制取氢氧化铁方程式
 俺是潢川人1年前2
俺是潢川人1年前2 -
 3rdsfiu 共回答了16个问题
3rdsfiu 共回答了16个问题 |采纳率100%2Fe+3Cl2=点燃==2FeCl3
FeCl3+3NaOH===Fe(OH)3+3NaCl1年前查看全部
- 某工厂生产甲乙产品所用的原料都是A,B两种,每生产甲产品1t,需要A原料2t,B原料6t;
某工厂生产甲乙产品所用的原料都是A,B两种,每生产甲产品1t,需要A原料2t,B原料6t;
每生产乙产品1t,需要A原料5t,B原料3t.目前库存A原料10t,B原料18t,
列出满足生产条件的数学关系式
繁森123 ,suiran nishichaoxide,buguodananhenhao lxxlxl1年前1
lxxlxl1年前1 -
 森心新 共回答了20个问题
森心新 共回答了20个问题 |采纳率90%解:
设生产甲产品为X吨,乙产品为Y吨
2X+5Y≤10
6X+3Y≤8
X≥0,Y≥0
之后就用线性规划来画图,就可以了!
满足生产条件的是上面四个式子围成的一个区域!1年前查看全部
- (2014•肇庆二模)生命必需的水在化学中常用作溶剂和原料.
(2014•肇庆二模)生命必需的水在化学中常用作溶剂和原料.
(1)部分地下水含较多______物质称为硬水;酸雨中因含有______导致土壤酸化(填一种化学式);
(2)下列实验均用到水,其中仅作为溶剂的是______(填字母序号)
a.配制0.9%的生理盐水b.生石灰变成熟石灰
(3)下列两组固体物质用水即可鉴别的是______(填字母序号)
a.CuSO4,Na2SO4b.NaCl,Na2SO4
(4)4月11日,兰州法国威立雅自来水公司出厂水及自流沟水中检测出苯含量严重超标.苯的沸点80.10℃,可用煮沸蒸发和吸附过滤的方法清除水中的苯.已知苯的化学式C6H6,其中碳的百分含量是______(精确到0.1%). korla50g1年前1
korla50g1年前1 -
 我是ggvv 共回答了12个问题
我是ggvv 共回答了12个问题 |采纳率91.7%解题思路:根据水中含有钙离子、镁离子的多少可以把水分为硬水和软水,当雨水的pH小于5.6时称为酸雨,海水的主要成分是水,分子能够保持物质的化学性质;
水的用途很广泛;根据物质中某元素的质量分数=[碳元素相对原子质量×原子个数/物质相对分子质量]×100%,分别计算选项中含碳元素的质量分数,即可解答.(1)部分地下水含较多的可溶性钙、镁化合物,这种水属于硬水;二氧化硫、氮氧化物等物质溶解在雨水中,能和水反应生成亚硫酸、硫酸、硝酸等物质,这些物质进入土壤中,能使土壤酸化,硫酸的化学式是H2SO4;
故填:可溶性钙、镁化合物;H2SO4.
(2)配制0.9%的生理盐水时,水作为溶剂,起到溶解氯化钠的作用;生石灰变成熟石灰时,生石灰和水反应生成熟石灰,水是反应物.
故填:a.
(3)硫酸铜溶于水时,溶液是蓝色的,硫酸钠溶于水时,溶液是无色的,硫酸钠和硫酸铜用水就可以鉴别;而氯化钠和硫酸钠溶于水时,溶液都是无色的.
故填:a.
(4)已知苯的化学式C6H6,其中碳的百分含量是[12×6/12×6+1×6]×100%=92.3%.
故答案为:92.3%.点评:
本题考点: 硬水与软水;水的性质和应用;酸雨的产生、危害及防治;酸、碱、盐的鉴别;元素的质量分数计算.
考点点评: 能量之间可以相互转化,这为人类认识自然、改造自然提供了条件,因此能量转化方面的题目是考试热点之一.1年前查看全部
- 以乙醇为原料合成六元环二元酯,先写方程式,再写流程图.
 ming_eagle1年前1
ming_eagle1年前1 -
 cueva 共回答了12个问题
cueva 共回答了12个问题 |采纳率83.3%先用氢氧化钠醇溶液消去反应生成乙烯 再通入溴水加成生成二溴乙烷 再用氢氧化钠水溶液取代生成乙二醇 加强氧化剂就可制出乙二酸 乙二醇与乙二酸酯化就好了1年前查看全部
- 已知R-Cl+H2O =R-OH+HCl(反应条件是NaOH).试以乙醇、浓硫酸、食盐和二氧化锰为主要原料合成二氧六醚
已知R-Cl+H2O =R-OH+HCl(反应条件是NaOH).试以乙醇、浓硫酸、食盐和二氧化锰为主要原料合成二氧六醚 .写出方程式
①______②_______③_______④______⑤____________ fj19687201年前1
fj19687201年前1 -
 绝非等闲 共回答了20个问题
绝非等闲 共回答了20个问题 |采纳率90%1. C2H5OH=C2H4(乙烯)+H2O(浓硫酸催化)
2. 4NaCl+4H2SO4+MnO2=4NaHSO4+MnCl2+2H2O+Cl2
3. C2H4+Cl2=C2H4Cl2
4. C2H4Cl2+2H2O=CH2OHCH2OH(使用已知条件,氢氧化钠催化)
5 CH2OHCH2OH+C2H4Cl2=2HCl+产物(强碱如氢氧化钠催化)
产物应为二氧六环,即含六个碳原子的正六边形(环己烷)1,4位(六边形的两个对角)的2个碳原子被氧原子取代的产物.1年前查看全部
- 行测 的数量关系问题是关于分段计算的问题 答案看不明白 请高人指点一下 某原料供应商对购买其原料的顾客实行如下优惠措施:
行测 的数量关系问题
是关于分段计算的问题 答案看不明白 请高人指点一下
某原料供应商对购买其原料的顾客实行如下优惠措施:1一次购买金额不超过一万元,不予优惠.2一次购买金额超过一万元但不超过3万元 给 九折优惠3一次购买金额超过三万元, 其中三万元九折优惠, 超过三万元的部分八折优惠 .某厂因库容问题 第一次在该供应商出购买原料付款7800元 第二次购买付款26100 如果他一次购买同样数量的 原料 可以少付多少钱 、
答案是 1460
解释是 由题意可知 在 第一次付款的 7800元内 扣除应打九折的(30000*0.9-26100)/0.9=1000 剩下7800-1000=6800应打八折 这样总共可以节约 1000*0.1+6800*0.2=1460
这道题是 ******出版的 2010年 ******考试 行测 第114页的 一道题 若是 有高人指点 万分感谢
 8025MKI1年前1
8025MKI1年前1 -
 caohero 共回答了18个问题
caohero 共回答了18个问题 |采纳率77.8%那个解释弄得太简化了,缺少了一些必要的分析.
第一次付款7800,如果够了10000,需要付款8000
所以第一次付款不足10000,没有打折,那么第一次付款就是7800元.
第二次付款26100,肯定是超过了2万,如果够了3万,至少要付款30000*0.9=27000元,所以第二次付款超过了2万,不到3万,只能打9折.
第二次的货款,打折前为:26100/0.9=29000元
这样两次的总货款,打折前为7800+29000=36800元,超过了3万,超过的部分可以打8折.
综合一下,原来分两次付款,第一次没有打折,第二次打了9折.
一次购买同样数量的原材料,货款有3万打9折,其余的打8折.
这样就是,合并付款,第二次的货款不变,还是应该付26100元,第一次的7800元当中,有一部分打了9折,还有一部分打了8折.
少付的钱,就是第一次的7800元合并付款以后减少的部分.
现在再来看那个解释:
分两次付款的时候,第二次货款就是打了9折的,只需要看看第一次付的7800元中,有多少是打9折的,有多少是打8折的.
打9折的一共3万,打完折以后剩下30000*0.9元
第二次全部货款打完9折以后就是26100元
所以,第一次的7800元当中,打九折的部分,打完折以后就是:
30000*0.9-26100元
打折以前就是:(30000*0.9-26100)/0.9=1000元
也就是说,第一次付款的7800元中,打九折的有1000元,少付1000*0.1元
其余的7800-1000=6800元,打了8折,少付6800*0.2元.
一共少付了:1000*0.1+6800*0.2=1460元
这个砖家的思路不错,但是省略了太多分析,就不太好理解.
常规的解法,刚才算出了两次付款打折前应该是36800元
合并付款:
30000打9折,其余的6800打8折
一共需要:
30000*0.9+6800*0.8=32440元
分开付款,一共付了:
7800+26100=33900元
合并付款可以少付:33900-32440=1460元
看不明白就hi我.1年前查看全部
- 怎么才花费最少?某实验室需购某种化工原料150千克,现在市场上原料按袋出售,有两种包装,一种是每袋45千克,价格为280
怎么才花费最少?
某实验室需购某种化工原料150千克,现在市场上原料按袋出售,有两种包装,一种是每袋45千克,价格为280元;另一种是每袋36千克,价格为240元,在满足需要的条件下,最少要花费多少元?(答案是1000元)
怎么求出来的? shulun04281年前1
shulun04281年前1 -
 关东项羽 共回答了23个问题
关东项羽 共回答了23个问题 |采纳率82.6%第一种x袋,第二种y袋
则需满足45x+36y>=150
求花费S=280x+240y最小值
这里利用的方法是 线性规划分析
通过作图,平移,就可以得出合适的整数点.课本上有这个内容吧
这里只有x=1,y=3满足条件.1年前查看全部
- 二:某工厂用设备A,B及原料生产甲,乙,丙三种产品,已知生产各种产品的消耗,设备及原材料的可用数量及单位产品的利润如表所
二:某工厂用设备A,B及原料生产甲,乙,丙三种产品,已知生产各种产品的消耗,设备及原材料的可用数量及单位产品的利润如表所示
甲 乙 丙 可用数量
设备A(台时)
设备B(台时)
原料(千克) 0.5 0.8 0.6
0.3 0.6 0.4
2 3 2.5 1400
800
5100
单位利润(元) 23 35 30
1.求出利润最大的生产计划
2.由于近期该厂流动资金比较充裕,由此可以增加原料的可用数量,但近期原料供不应求,价格有所上升,每千克原料价格已升至4.5元.问该厂是否应该购买,以增加原料的可用数量.
3.由于甲产品近期供求关系有很大的不稳定性,导致其价格及单位利润会有很大变化,该厂想知道甲产品的单位利润在什么范围内变化时,仍然可以按原来的最优生产计划安排生产若甲产品的单位利润下降为20元,此时该厂的利润有无变化?若无变化,则是如何变化的?
4.若生产单位丙产品的产品的原料消耗由2.5千克下降到2.2千克,最优生产计划有无变化?该厂的利润有无变化?
若设备A的可用数量降至1200台时,则最有生产计划及利润有何变化?、
甲 乙 丙 可用数量
设备A(台时) 0.5 0.8 0.6 1400
设备B(台时) 0.3 0.6 0.4 800
原料(千克) 2 3 2.5 5100
单位利润(元) 23 35 30 rr771年前1
rr771年前1 -
 会变色的鱼 共回答了20个问题
会变色的鱼 共回答了20个问题 |采纳率75%看不太清楚,你那应该是个表格吧
那要好看些1年前查看全部
- 制玻璃的原料有哪些
 miracle_21cn1年前1
miracle_21cn1年前1 -
 qianch 共回答了17个问题
qianch 共回答了17个问题 |采纳率88.2%通常是由砂子、碳酸钠和碳酸钙共熔而制得;也可用硫酸钠和碳的混合物代替碳酸钠来熔制.
其他一些玻璃如钾玻璃,是一种较耐高温、较硬和较耐化学作用的玻璃,可在熔制玻璃时用碳酸钾或硫酸钾部分地代替钠盐而制得,主要用于制造实验室常用的化学容器.燧石玻璃是一种高密度和高折射率玻璃,可在熔制玻璃时用铅代替钠玻璃中的钙而制得,适于制造光学玻璃和雕刻玻璃制品.特硬玻璃热膨胀系数小,耐骤冷骤热,耐高温和抗化学腐蚀,可在熔制玻璃时,减少钠的含量,保持二氧化硅的高含量,并加入12%~15%的三氧化二硼而制得,主要用于制造较高级的化学反应容器.
熔制玻璃时加入少量玻璃着色剂,可制得各种有色玻璃.氧化铜(Ⅱ)或氧化铬(Ⅲ)产生绿色;氧化钴(Ⅱ)产生蓝色;二氧化锰产生紫色;二氧化锡或氟化钙产生乳白色;铀化合物产生黄绿荧光;胶态硒产生红玉色;胶态金产生红、红紫或蓝色;氧化亚铜产生红、绿或蓝色;亚铁化合物产生绿色,量多时为黑色;铁(Ⅲ)化合物产生黄色.制玻璃时,由于原料中含有亚铁的杂质,常使玻璃带绿色,可加入少量二氧化锰或硒,使之变成无色玻璃.
ZWP抄自大百科全书
玻璃由不同的硅酸盐混合而成.普通玻璃又称钠玻璃,是硅酸钠和硅酸钙与过量二氧化硅的混合物.通常是由砂子、碳酸钠和碳酸钙共熔而制得;也可用硫酸钠和碳的混合物代替碳酸钠来熔制.
其他一些玻璃如钾玻璃,是一种较耐高温、较硬和较耐化学作用的玻璃,可在熔制玻璃时用碳酸钾或硫酸钾部分地代替钠盐而制得,主要用于制造实验室常用的化学容器.燧石玻璃是一种高密度和高折射率玻璃,可在熔制玻璃时用铅代替钠玻璃中的钙而制得,适于制造光学玻璃和雕刻玻璃制品.特硬玻璃热膨胀系数小,耐骤冷骤热,耐高温和抗化学腐蚀,可在熔制玻璃时,减少钠的含量,保持二氧化硅的高含量,并加入12%~15%的三氧化二硼而制得,主要用于制造较高级的化学反应容器.
熔制玻璃时加入少量玻璃着色剂,可制得各种有色玻璃.氧化铜(Ⅱ)或氧化铬(Ⅲ)产生绿色;氧化钴(Ⅱ)产生蓝色;二氧化锰产生紫色;二氧化锡或氟化钙产生乳白色;铀化合物产生黄绿荧光;胶态硒产生红玉色;胶态金产生红、红紫或蓝色;氧化亚铜产生红、绿或蓝色;亚铁化合物产生绿色,量多时为黑色;铁(Ⅲ)化合物产生黄色.制玻璃时,由于原料中含有亚铁的杂质,常使玻璃带绿色,可加入少量二氧化锰或硒,使之变成无色玻璃.1年前查看全部
- 某石材厂购进一批石灰石原料,其所含杂质既不溶于水,也不溶于盐酸,高温时也不发生反应.
某石材厂购进一批石灰石原料,其所含杂质既不溶于水,也不溶于盐酸,高温时也不发生反应.
甲乙丙丁四位同学分别取某石灰石样品,并取稀盐酸200g平均分成四份,进行试验,结果如下试验x05
甲 乙 丙x05 丁
加入样品的质量x055x0510x0515x0520
生成CO2的质量x051.76x053.52x054.40x05m
求m的数值 石灰石样品中CaCO3的质量分数 稀盐酸中溶质的质量分数 lipansl1年前1
lipansl1年前1 -
 majic321 共回答了15个问题
majic321 共回答了15个问题 |采纳率93.3%m的数值 4.40
甲乙都是盐酸过量,乙丙是石灰石过量
CaCO3+2HCl=CaCl2+H2O+CO2
100 44
x 3.52g
100/x=44/3.52g
x=8g
石灰石样品中CaCO3的质量分数 8g/10g*100%=80%
CaCO3+2HCl=CaCl2+H2O+CO2
73 44
y 4.4g
73/y=44/4.4g
y=7.3g
稀盐酸中溶质的质量分数 7.3g/50g*100%=14.6%1年前查看全部
- 英语翻译热流道模具与普通流道模具相比,具有注塑效率高、成型塑件质量好并节约原料等优点,随着聚合物工业的发展,热流道技术正
英语翻译
热流道模具与普通流道模具相比,具有注塑效率高、成型塑件质量好并节约原料等优点,随着聚合物工业的发展,热流道技术正不断地发展完善,其应用范围也越来越广泛.热流道是通过加热的办法来保证流道和浇口的塑料保持熔融状态.由于在流道附近或中心设有加热棒和加热圈,从注塑机喷嘴出口到浇口的整个流道都处于高温状态,使热流道模具与普通流道模具相比,具有注塑效率高、成型塑件质量好和节约原料等优点,随着聚合物工业的发展,热流道技术正不断地发展完善,其应用范围也越来越广泛.
热流道是通过加热的办法来保证流道和浇口的塑料保持熔融状态.由于在流道附近或中心设有加热棒和加热圈,从注塑机喷嘴出口到浇口的整个流道都处于高温状态,使流道中的塑料保持熔融,停机后一般不需要打开流道取出凝料,再开机时只需加热流道到所需温度即可.
热流道注射成型法于20世纪50年代问世,经历了一段较长时间地推广以后,其市场占有率逐年上升,80年代中期,美国的热流道模具占注射模具总数的15%~17% ,欧洲为12%~15% ,日本约为10% .但到了90年代,美国生产的塑料注射模具中热流道模具已占40%以上,在大型制品的注射模具中则占90%以上.
未来的时代,将是"移动互联网"的时代,我们本着远大的目标,以及对客户无微不至的服务,所以我们走在了未来发展趋势的前沿.在未来的两个月后,无论你身在何处,只要你在手机上登陆3G浏览器,直接输入关键词"热流道",你就可以轻松的进入我们的主页,搜索我们所有的服务和产品,我们也将随时在线,为您排优解难.同时,我们也可以免费为您提供相应的广告位,让您将自己的产品登上"移动互联网",为您的产品带来更多的机会和知明度.所以,让我们共同携手,为适应未来发展的趋势而提前做好准备. zhaohuashou1年前1
zhaohuashou1年前1 -
 随见飘 共回答了26个问题
随见飘 共回答了26个问题 |采纳率96.2%64961年前查看全部
- 由苯和必要的其他试剂为原料合成4-溴-3-硝基苯乙铜
 ff舞者1年前1
ff舞者1年前1 -
 心魔ww 共回答了8个问题
心魔ww 共回答了8个问题 |采纳率87.5%苯 + CH3COCl ——>苯乙酮
苯乙酮 + Br2(FeBr3催化剂)——> 4-溴苯乙酮
4-溴苯乙酮 + HNO3(H2SO4) ——>4-溴-3-硝基苯乙酮1年前查看全部
- 用淀粉为原料制取B(B是日常生活中有特殊香味的常见有机物,在有些饮料中含有B).
用淀粉为原料制取B(B是日常生活中有特殊香味的常见有机物,在有些饮料中含有B).
若有含淀粉40%的植物果实1kg,经反应制得184kg的B,则淀粉的转化率为____.(提示:转化率=已反应的量/原有的量*100%) chenrui211年前2
chenrui211年前2 -
 AliciaForget 共回答了17个问题
AliciaForget 共回答了17个问题 |采纳率94.1%B是乙醇
[C6H10O5]n+nH2O=nC6H12O6 含淀粉40%的植物果实1kg,生成葡萄糖4000/9kg
C6H12O6=2C2H5OH+2CO2 葡萄糖4000/9kg理论生成乙醇227.16kg,实际生成184kg,则淀粉的转化率为81%1年前查看全部
- 如何以3个碳以下的醇和苯为原料合成正戊醇
 长河落日5201年前0
长河落日5201年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 纺织厂购进由甲、乙两种原料配成的两种材料,已知一种原料按甲:乙=5:4配料,每吨50元;另一种材料按甲:乙=3:2配料,
纺织厂购进由甲、乙两种原料配成的两种材料,已知一种原料按甲:乙=5:4配料,每吨50元;另一种材料按甲:乙=3:2配料,每吨48.6元,甲、乙两种原料的价格各是多少?
 beauva1年前8
beauva1年前8 -
 kyofanhao 共回答了14个问题
kyofanhao 共回答了14个问题 |采纳率100%解题思路:设甲种原料的价格是x元,乙种原料的价格是y元,由一种原料按甲:乙=5:4配料,每吨50元;另一种材料按甲:乙=3:2配料,每吨48.6元;列方程组解决问题.设甲种原料的价格是x元,乙种原料的价格是y元,由题意得
5x+4y=50×(5+4)
3x+2y=48.6×(3+2),
解得
x=36
y=67.5.
答:甲种原料的价格是36元,乙种原料的价格是67.5元.点评:
本题考点: 二元一次方程组的应用.
考点点评: 此题考查二元一次方程组的实际运用,找出等量关系是解决问题的关键.1年前查看全部
- 英语翻译以玉米须为原料,采用机械粉碎法将玉米须制备为5mm左右长短,采用热水浸提和乙醇沉淀的方法制备玉米须多糖.在此过程
英语翻译
以玉米须为原料,采用机械粉碎法将玉米须制备为5mm左右长短,采用热水浸提和乙醇沉淀的方法制备玉米须多糖.在此过程中,将玉米须多糖的提取率作为评价指标,采用单因素及正交试验方法优化提取条件,考察提取过程中浸提的温度、浸提的时间、料液比以及乙醇体积比对多糖提取率的影响.结果表明,当水浴温度为90℃、水浴时间为90min、料液比为1:25、乙醇体积比为3.5:1时,玉米须多糖的提取率最优为0.608%.随之研究了三氯乙酸溶液浓度对玉米须多糖除蛋白效果的影响,用单因素实验方法确定最佳工艺条件,将OD280值作为玉米须多糖除蛋白效果的评价指标,结果为,浓度为3%的三氯乙酸溶液对玉米须多糖除蛋白的效果最好,此时OD280为0.107.然后考察了玉米须多糖对大肠杆菌、芽孢杆菌、霉菌、酵母菌和白色葡萄球菌的抑菌作用,结果表明,玉米须多糖对大肠杆菌、白色葡萄球菌、芽孢杆菌的有较显著抑菌效果,对霉菌的抑菌效果一般,对酵母菌的抑菌效果不显著.
在线翻译的就不要回答了, iwalyng1年前1
iwalyng1年前1 -
 ll版活动ll 共回答了16个问题
ll版活动ll 共回答了16个问题 |采纳率81.3%译文:Take the corn must as raw material, uses the machinery smashing law to have to prepare the corn is about 5mm the length, uses the hot water immersion to raise the method preparation corn which precipitates with the ethyl alcohol to have the polysaccharide.In this process, the corn must the polysaccharide extraction rate take the time, the material fluid which the appraisal target, uses the single factor and the orthogonal testing method optimization extraction condition, in the inspection extraction process soaks which proposes the temperature, soaks raises compares as well as the ethyl alcohol volume compares to the polysaccharide extraction rate influence.The result indicated, when the water bath temperature for 90℃, the water bath time is 90min, the material fluid compared to is 1:25, the ethyl alcohol volume compared to is 3.5:1, the corn must the polysaccharide extraction rate most be superior is 0.608%.Studied the trichloroacetic acid solution concentration along with it to have the polysaccharide to eliminate the protein effect to the corn the influence, with the single factor experimental technique determination best technological conditions, had the polysaccharide to eliminate the OD280 value as the corn the protein effect the appraisal target, the result is, the density was 3% trichloroacetic acid solution must the polysaccharide eliminate the protein to the corn the effect to be best, this time OD280 was 0.107.Then inspected the corn to have the polysaccharide to the backwoods coli, the bud spore bacillus, the mold, the saccharomycetes and staphylococcus albus's bacteriostasis function, finally indicated, the corn must the polysaccharide to the backwoods coli, the staphylococcus albus, the bud spore bacillus have the remarkable bacteriostasis effect, was ordinary to mold's bacteriostasis effect, was not remarkable to saccharomycetes' bacteriostasis effect.
(*^__^*) 嘻嘻……1年前查看全部
- 小明家装修房子,需要某种原料106kg,现在市场上这种原料有甲乙两种包装,甲种每桶35kg,价格为140元,乙种每桶24
小明家装修房子,需要某种原料106kg,现在市场上这种原料有甲乙两种包装,甲种每桶35kg,价格为140元,乙种每桶24kg,价格为120元.在满足需要的条件下,要想花钱最少,应该买两种原料各多少桶?最少要花多少元?(该原料只能整桶卖)
 trecy-841年前2
trecy-841年前2 -
 hyqxq456 共回答了21个问题
hyqxq456 共回答了21个问题 |采纳率81%A方案:甲种3桶,乙种1桶:140*3+120*1=540元 35*3+24=129kg>106kg
B方案:甲种1桶,乙种3桶:140*1+120*3=500元 35*1+24*3=107kg>106kg花钱最少
C方案:甲种2桶,乙种2桶:140*2+120*2=520元 35*2+24*2=118kg>106kg1年前查看全部
- 铅笔芯的原料是铅吗?儿童在使用时不可以用嘴咬铅笔?
 泠之羽1年前1
泠之羽1年前1 -
 monkeyandworld 共回答了10个问题
monkeyandworld 共回答了10个问题 |采纳率100%原料是碳 说什么铅中毒都是假的 这东西当然不可以咬了1年前查看全部
- 制取漂白粉 原料氢氧化钙是否拆开?漂白粉失效的反应中次氯酸钙是否拆开
 蚩蚩211年前4
蚩蚩211年前4 -
 暖暖的青 共回答了11个问题
暖暖的青 共回答了11个问题 |采纳率90.9%不拆,原料是石灰乳不是溶液不拆
次氯酸钙也不拆1年前查看全部
- 急求工作中的一道数学题目进货一批原料A和B,已知A是1825,B是1525.用A材料和B材料去做一种产品,用量比例为1.
急求工作中的一道数学题目
进货一批原料A和B,已知A是1825,B是1525.
用A材料和B材料去做一种产品,用量比例为1.6:1,那麽是当A用完时,B还剩下385.
已知做了一批产品后,A+B还剩下1147.求A和B各剩下多少.
我知道答案是A剩下469.B剩下678,但是我要知道算术过程.请提供过程.
谢谢各位好心热情的人们! w4cc1年前2
w4cc1年前2 -
 阿天来过 共回答了18个问题
阿天来过 共回答了18个问题 |采纳率77.8%设B用了的量为x
则A剩下的量为1825-1.6x
则B剩下的量为1525-x
A+B=1825-1.6x+1525-x=1147
得3350-2.6x=1147
得x=847
则A剩下的量为1825-1.6x=469
则B剩下的量为1525-x=6781年前查看全部
- 某厂将总价值为2000元的甲种原料与总价值为4800元的乙种原料混合,其平均价值比甲种原料每斤少3元,比乙种原料每斤多1
某厂将总价值为2000元的甲种原料与总价值为4800元的乙种原料混合,其平均价值比甲种原料每斤少3元,比乙种原料每斤多1元,问混合后的单价每斤多少元?
 上海帅气qq1年前1
上海帅气qq1年前1 -
 小坏孩儿 共回答了24个问题
小坏孩儿 共回答了24个问题 |采纳率100%解题思路:本题可设混合后的单价每斤x元,因其混合后的平均价值比甲种原料每斤少3元,比乙种原料每斤多1元,则甲种原料每斤(x+3)元,乙种原料每斤(x-1)元,又因混合前后的质量相等,依此列方程求解.设混合后的单价每斤x元,则甲种原料每斤(x+3)元,乙种原料每斤(x-1)元,
根据题意得[2000/x+3+
4800
x−1=
2000+4800
x],
解得x=17,
经检验,x=17是原方程的解.
所以混合后的单价是每斤17元.
答:混合后的单价每斤17元.点评:
本题考点: 分式方程的应用.
考点点评: 此题需用分式方程解决,应注意的是分式方程需验根.1年前查看全部
- 以废硫化碱液和硫磺为原料,合成硫代硫酸钠时,首先要合成二硫化钠,在这一步上有什么关键点,比如温度,浓度等,
 落叶常飞1年前1
落叶常飞1年前1 -
 会tt的_鱼 共回答了21个问题
会tt的_鱼 共回答了21个问题 |采纳率95.2%碱性环境.1年前查看全部
- 温度降低,植物的光合作用为什么减弱?HIV在体内合成DNA的原料?
 idothee1年前3
idothee1年前3 -
 zjnbwhj 共回答了18个问题
zjnbwhj 共回答了18个问题 |采纳率88.9%温度降低使得参与植物光合作用的酶活性降低,从而减弱植物的光合作用.合成DNA的原料是五碳糖,磷酸,碱基(A,T,G,C).1年前查看全部
- 原料水杨酸甲酯,用气相做含量为99%,可是滴定方法,取2ml精密称定,精密加入50ml乙醇制氢氧化钾滴定液,
 东方红太阳红1年前1
东方红太阳红1年前1 -
 owenhu 共回答了19个问题
owenhu 共回答了19个问题 |采纳率94.7%楼主的帖子不完整.是两者结果的比较吗?
滴定方法结果中包含了其他其他酯类,应该比色谱法大
朋友可以到行业内专业的网站进行交流学习!
分析测试百科网这块做得不错,气相、液相、质谱、光谱、药物分析、化学分析、食品分析.这方面的专家比较多,基本上问题都能得到解答,有问题可去那提问,网址百度搜下就有.1年前查看全部
大家在问
- 1范仲淹《岳阳楼记》文中动静结合,描写洞庭湖月夜美景的句子是()从空间角度描写岳阳楼景象的句子是()从时间角度描写岳阳楼景
- 255 22 是中心对称图形吗
- 3沿正方体的三条面对角线将正方体截去一个角,则截取的体积是原体积的—?
- 4五年级上册能力培养与测试第58页第六小题数学题50名同学看表演,票价分5元8元两种共花了340元
- 5—How often _____ she exercise?
- 6立秋下雨万物收处暑下雨万物丢这句谚语是什么意思?
- 7找一首英文歌,男组合.词里有 i‘ve little thought that it would be me that
- 8(2011•成都)如图,已知反比例函数y=kx(k≠0)的图象经过点([1/2],8),直线y=-x+b经过该反比例函数
- 9英语单项Franklin told them all _____to be in britain.A he was ho
- 10问一个英语中谈价钱用法这两句:These caps are 2 dollars.和These caps are 2 do
- 11有什么动词不能单独出现?请问,在英语中,有什么动词单独出现不能表达完整的意思,或者说,这种动词要搭配其它什么词出现表达意
- 12经研究表明,光是一种电磁波,光波和一切波一样也具有波动性.在组成白光的七种单色光中,红光波长最长、频率最低,紫光波长最短
- 13一个小组力有4女生 6男生 从中任 选出一男一女去比赛 概率是多少
- 14小丽同学为了达到学习的目标,合理分配学习、休息和娱乐时间,主动制定学习计划,并付诸行动。表现的是 [
- 15已知任意四边形ABCD,E为AD的中点,F为BC的中点,求证:(都是向量)EF+FE+AB+DC
