氧化还原反应的实质是什么?是电子的得失,电子对的偏移.还是化合价发生变化!
 秋水芦苇2022-10-04 11:39:546条回答
秋水芦苇2022-10-04 11:39:546条回答
已提交,审核后显示!提交回复
共6条回复
 wangmaomao1018 共回答了16个问题
wangmaomao1018 共回答了16个问题 |采纳率81.3%- 是电子的得失,例如Nacl,
也有电子对的偏移,当化合物中部分集合不是离子,电子没有完全脱离.
而化合价的变化,只是外在的反应,例如Fe3O4,就是氧化铁和氧化亚铁的混合物. - 1年前
 阿弥陀佛净土法门 共回答了7个问题
阿弥陀佛净土法门 共回答了7个问题 |采纳率- 是电子的偏移,化合价的变化是区别氧化还原或非氧化还原的东西,不是实质.
- 1年前
 ldy_dc007 共回答了1个问题
ldy_dc007 共回答了1个问题 |采纳率- 是电子的得失.化合价是表象不是本质.电子对偏移是共价键那块的,跟这没啥关系.
- 1年前
 kcea 共回答了6个问题
kcea 共回答了6个问题 |采纳率- 电子的转移(得失或偏移)
- 1年前
 xam330118 共回答了46个问题
xam330118 共回答了46个问题 |采纳率- 实质是电子的得失
- 1年前
 lnlyz 共回答了1个问题
lnlyz 共回答了1个问题 |采纳率- 电子得失
- 1年前
相关推荐
- 在化学反应中,物质所含元素的化合价发生变化的反应就是氧化还原反应.如:反应前后,钠元素、氯元素的化合价发生了变化,该反应
在化学反应中,物质所含元素的化合价发生变化的反应就是氧化还原反应.如:反应前后,钠元素、氯元素的化合价发生了变化,该反应是氧化还原反应.请你仔细阅读表格的内容,回答问题.
(1)请根据物质所含元素的化合价是否发生改变进行分析,表格内列出的化学方程式中属于氧化还原反应的是序号 化学方程式 属于的基本反应类型 1 Fe+S
FeS△ .Combination reaction 2 Cu(OH)2
CuO+H2O△ .Deconpostition reaction 3 H2+CuO
Cu+H2O△ .Displacenent reaction 4 HCl+AgNO3=AgCl↓+HNO3 Double deconposition reaction 1、31、3(填序号).
(2)根据以下要求,写出有碳元素参加反应的化学方程式各一个:
分解反应:H2CO3=CO2↑+H2OH2CO3=CO2↑+H2O;
置换反应:C+2CuO
2Cu+CO2↑高温 .C+2CuO;
2Cu+CO2↑高温 .
化合反应:C+O2
CO2点燃 .C+O2.
CO2点燃 . oyb0021年前0
oyb0021年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 离子反应与氧化还原反应是什么关系
 暴筋女1年前3
暴筋女1年前3 -
 swanye79 共回答了30个问题
swanye79 共回答了30个问题 |采纳率83.3%离子反应中 有氧化还原反应 氧化还原反应中也有离子反应 比如 二价铁和高锰酸钾溶液的反应 是离子反应 也是氧化还原反应 但离子反应也不全是氧化还原反应 比如酸碱中和 主要在于有没有电子得失 有就是氧化还原反应 没有就不是 离子反应就是离子参与的反应1年前查看全部
- 氧化还原反应的先后规律把Zn放到H2SO4和CuSO4混合溶液中,先和Cu离子反应的原因
 步青云6661年前2
步青云6661年前2 -
 ll大不是我的错 共回答了18个问题
ll大不是我的错 共回答了18个问题 |采纳率100%Cu的活动性较弱,H的活动性比Cu强,规律是先“欺负”活动性弱的,所以先和Cu反应.
希望对你有帮助1年前查看全部
- 某种 元素化合价在化学反应前后发生了变化,则该反应为氧化还原反应.据此可判断下列化学反应属于氧化还原反应的有( ) A
某种 元素化合价在化学反应前后发生了变化,则该反应为氧化还原反应.据此可判断下列化学反应属于氧化还原反应的有( ) A.ZnO+H 2 SO 4 =ZnSO 4 +H 2 O B.Fe 2 O 3 +3CO
2Fe+3CO 2高温 . C.Na 2 CO 3 +2HCl=2NaCl+H 2 O+CO 2 ↑ D.CaCO 3
CaO+CO 2 ↑高温 .  地球人全不知道1年前1
地球人全不知道1年前1 -
 蒂中海 共回答了20个问题
蒂中海 共回答了20个问题 |采纳率85%A、该反应的前后各元素化合价不变,故不属于氧化还原反应,故A不符合题意;
B、氧化铁中铁的化合价为+3价,而反应过后单质铁的化合价为0价,铁的化合价由+3价变为了0价,符合氧化还原反应,故B正确;
C、该反应的前后各元素化合价不变,故不属于氧化还原反应,故C不符合题意;
D、属于分解反应,但是反应前后各元素的化合价未改变,故D不符合题意;
故选B1年前查看全部
- 关于氧化还原反应的下列说法中正确的是( )
关于氧化还原反应的下列说法中正确的是( )
A.Cu2+比Fe3+氧化性弱,所以Cu比Fe还原性强
B.原子的氧化性越强,其阴离子的还原性越弱
C.强氧化剂遇到强还原剂一定能发生氧化还原反应
D.浓硝酸与铜反应的还原产物NO2中N的化合价为+4,而稀硝酸与铜反应的还原产物NO中N的化合价为+2,说明稀硝酸的氧化性比浓硝酸的氧化性强 szzxwml1年前1
szzxwml1年前1 -
 我的痘痘没了 共回答了19个问题
我的痘痘没了 共回答了19个问题 |采纳率94.7%解题思路:A、Fe与Cu2+发生置换反应Fe+Cu2+=Cu+Fe2+,还原剂还原性强于还原产物还原性,Cu还原性比Fe弱.
B、原子的氧化性越强,其阴离子不容易失去电子,阴离子还原性越弱.
C、一般强氧化剂遇到强还原剂可以发生氧化还原反应,但同种元素之间必须有之间价态才能发生.
D、氧化性、还原性强弱与得失电子多少没有关系,与得失电子难易程度有关.A、Fe与Cu9+发生置换反应Fe+Cu9+=Cu+Fe9+,还原剂还原性强于还原产物还原性,Cu还原性比Fe弱,故A错误;
B、原子的氧化性越强,其阴离子不容易失去电子,阴离子还原性越弱,故B正确
C、一般强氧化剂遇到强还原剂可以发生氧化还原反应,但同种元素之间必须有之间价态才能发生,如浓硫酸与二氧化硫,故C错误;
下、氧化性、还原性强弱与得失电子多少没有关系,与得失电子难易程度有关,如氯原子的7电子形成氯离子、硫原子的9个电子形成硫离子,氧化性氯气比硫强,故下错误.
故选:B.点评:
本题考点: 氧化还原反应.
考点点评: 考查氧化性、还原性强弱的比较等,难度中等,注意从结构理解氧化性与还原性强弱,掌握氧化性、还原性强弱比较规律.1年前查看全部
- 在化学反应中,物质所含元素化合价的反应就是氧化还原反应。如: 反应前后,钠元素、氯元素的化合价发生了变化,该反应是氧化还
在化学反应中,物质所含元素化合价的反应就是氧化还原反应。如:  反应前后,钠元素、氯元素的化合价发生了变化,该反应是氧化还原反应。请你仔细阅读表格的内容,回答问题。
反应前后,钠元素、氯元素的化合价发生了变化,该反应是氧化还原反应。请你仔细阅读表格的内容,回答问题。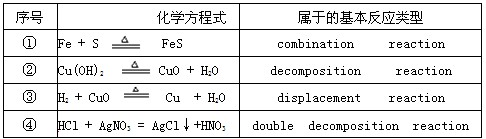
⑴请根据物质所含元素的化合价是否发生改变进行分析,表格内列出的化学方程式中属于氧化还原反应的是____________(填序号)。
⑵根据以下要求,写出有碳元素参加反应的化学方程式各一个:
decomposition reaction :_____________________;
displacement reaction :_________________________;
combination reaction :______________________。 题来读网1年前1
题来读网1年前1 -
 lhx2101 共回答了12个问题
lhx2101 共回答了12个问题 |采纳率100%1年前查看全部
- 钙+硝酸银=硝酸钙+银的氧化还原反应如何写
 tom4011年前1
tom4011年前1 -
 kittycat3 共回答了22个问题
kittycat3 共回答了22个问题 |采纳率90.9%Ca+AgNO3=CaNO3+Ag1年前查看全部
- 下列工业上制备物质的过程中,无氧化还原反应发生的是 A.合成氨 B.从铝土矿中获得铝 C.玻璃制备 D.从海水中获得氯气
 bluelong1年前1
bluelong1年前1 -
 柠檬水88 共回答了18个问题
柠檬水88 共回答了18个问题 |采纳率83.3%C
A 用氮气和氢气反应合成氨气,有化合价变化,是氧化还原反应
B从铝土矿中获得铝,铝元素由+3价变为0价,是氧化还原反应
C玻璃制备是硅酸钠和二氧化硅反应,硅酸钙和二氧化硅反应,不是氧化还原反应
D从海水中获得氯气是电解饱和的食盐水,有化合价变化,是氧化还原反应
故选C。1年前查看全部
- 在蛋白质溶液中加入饱和硫酸铵溶液,析出白色固体为什么不是氧化还原反应?
 we18921年前1
we18921年前1 -
 shu5012 共回答了13个问题
shu5012 共回答了13个问题 |采纳率92.3%不是,这个属于胶体的盐析现象,是物理反应1年前查看全部
- 下列有关氧化还原反应的叙述正确的是( ) A.金属单质在氧化还原反应中只能作还原剂,非金属单质只能作氧化剂 B.化合物
下列有关氧化还原反应的叙述正确的是( ) A.金属单质在氧化还原反应中只能作还原剂,非金属单质只能作氧化剂 B.化合物中某元素处于最高价只能被还原 C.失电子越多的还原剂,其还原性越强 D.某元素在反应中由化合物转化为单质,该元素一定被氧化  qinke20051年前1
qinke20051年前1 -
 xyh95002 共回答了10个问题
xyh95002 共回答了10个问题 |采纳率100%A、金属单质在氧化还原反应中只能作还原剂,非金属单质可能作还原剂也可能作氧化剂也可能既作氧化剂又作还原剂,如:Cl 2 +H 2 O=HCl+HClO,氯气既氧化剂又作还原剂,故A错误;
B、处于最高价态的元素只能得电子不能失电子,所以只有氧化性,故B正确;
C、还原剂的还原性与失电子的难易程度有关,与失电子的多少无关,故C错误;
D、某元素在反应中由化合物转化为单质,该元素可能被氧化也可能被还原,如:2Na 2 O 2 +2H 2 O=4NaOH+O 2 ↑中,氧元素的化合价既有升高的也有降低的,所以氧元素既被氧化又被还原,故D错误;
故选B.1年前查看全部
- 下列各组离子在碱性条件下可以大量共存,而在强酸性条件下能发生氧化还原反应的是( )
下列各组离子在碱性条件下可以大量共存,而在强酸性条件下能发生氧化还原反应的是( )
A. Ca2+、Fe2+、NO3-、Cl-
B. Ba2+、Na+、I-、NO3-
C. Na+、K+、SO42-、SO32-
D. K+、Mg2+、HCO3-、PO43- xia初夏1年前2
xia初夏1年前2 -
 gubobofu 共回答了19个问题
gubobofu 共回答了19个问题 |采纳率94.7%解题思路:A.OH-与Fe2+能结合生成沉淀;
B.碱溶液中该组离子不反应,酸性条件下I-、NO3-能发生氧化还原反应;
C.碱溶液中该组离子不反应,酸性条件下只发生复分解反应;
D.OH-与Mg2+、HCO3-结合生成水和沉淀.A.OH-与Fe2+能结合生成沉淀,则不能共存,故A不选;
B.碱溶液中该组离子不反应,则能共存,且在酸性条件下I-、NO3-能发生氧化还原反应,符合题意,故B选;
C.碱溶液中该组离子不反应,则能共存,但在酸性条件下H+、SO32-发生反应生成水和气体,故C不选;
D.OH-与Mg2+、HCO3-结合生成水和沉淀,则不能共存,故D不选;
故选B.点评:
本题考点: 离子共存问题.
考点点评: 本题考查离子的共存问题,熟悉习题中的信息及离子之间的反应是解答本题的关键,题目难度不大.1年前查看全部
- 下列叙述中,正确的是( )A. 含金属元素的离子不一定都是阳离子B. 在氧化还原反应中,非金属单质一定是氧化剂C. 化
下列叙述中,正确的是( )
A. 含金属元素的离子不一定都是阳离子
B. 在氧化还原反应中,非金属单质一定是氧化剂
C. 化合物变为单质时,化合价变化的元素一定被还原
D. 金属离子被还原一定得到金属单质 tiramisu11241年前5
tiramisu11241年前5 -
 supersever 共回答了24个问题
supersever 共回答了24个问题 |采纳率79.2%解题思路:A.含金属元素的离子也可能为阴离子,如AlO2-等;
B.非金属性单质可作还原剂,如C、H2等;
C.化合物变为单质时,化合价变化的元素可被氧化,也可被还原;
D.金属离子被还原不一定得到单质.A.含金属元素的离子可为简单阳离子或酸根离子,如为酸根离子,则为阴离子,如AlO2-等,故A正确;
B.当非金属单质的元素的化合价为最低价态时,可为还原剂,故B错误;
C.化合物变为单质时,化合价变化的元素可被氧化,也可被还原,如Cu2+→Cu,S2-→S,故C错误;
D.金属离子被还原不一定得到单质,如Fe3+→Fe2+,故D错误.
故选A.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应知识,侧重于常见物质的性质的考查,题目难度不大,注意相关基础知识的积累.1年前查看全部
- 求一份关于守恒法在氧化还原反应应用的偏难的典型习题集
求一份关于守恒法在氧化还原反应应用的偏难的典型习题集
发到我的邮箱 595418225@qq。com z231291年前1
z231291年前1 -
 css43000516 共回答了26个问题
css43000516 共回答了26个问题 |采纳率96.2%来我空间看看1年前查看全部
- 有没有 只 是 分解反应,不 是 氧化还原反应、化合反应、置换反应、复分解反应的方程式?
 xuduoai1年前1
xuduoai1年前1 -
 青丝妖娆 共回答了24个问题
青丝妖娆 共回答了24个问题 |采纳率87.5%有;CaCO3=高温=CaO+CO2(气体).1年前查看全部
- 【化学】从氧化还原反应的角度来看,在实验室制1、H2 2、CO2 3、CL2三个反应中,盐酸的作用?
【化学】从氧化还原反应的角度来看,在实验室制1、H2 2、CO2 3、CL2三个反应中,盐酸的作用?
A互不相同 B1 2相同 C2 3相同 D 123 均相同
说明每个盐酸的作用 life0031年前4
life0031年前4 -
 chenyanger 共回答了22个问题
chenyanger 共回答了22个问题 |采纳率95.5%实验室制H2 Zn+2HCl===ZnCl2+H2 盐酸是氧化剂
实验室制CO2 CaCO3+2HCl===CaCl2+H20+CO2 盐酸就是酸的作用
实验室制Cl2 MnO2+4HCl===MnCl2+2H2O+Cl2 盐酸是还原剂
故答案为:A1年前查看全部
- 几个化学题关于氧化还原反应的 具体讲解的详细点
几个化学题关于氧化还原反应的 具体讲解的详细点
1.某地有甲乙两个工厂排放污水,污水中各含下列8种例子中的4中(两场不含相同的离子):Ag+、Ba+、Fe2+、Na+、Cl-、So4 2-(硫酸根离子)、No3-(硝酸根离子)、OH-.若两场都单独排放会造成严重水污染,如将两场污水按比例混合,沉淀后污水变得无色澄清,溶质主要含有硝酸钠,污染程度大大降低.下列关于污染源的分析,你认为正确的是
A.Na+和No3-(硝酸根离子)来自同一工厂
B.Cl-和No3-(硝酸根离子)一定在同一工厂
C.Ag+和Na+可能在同一工厂
D.So4 2-(硫酸根离子)和OH-一定在同一工厂
在给我说下 氧化还原反应和物质的量之间怎么算 、做题.
比如:稀硝酸和Cu反应的化学方程式为:3Cu+8HNo39(稀)=3Cu(No3)2+2No(气体符号)+4H2o(水)
如果反应中有8.4gHNO3被还原,求:
(1)被氧化的Cu的质量
(2)共消耗硝酸的质量 两鬓已成丝1年前1
两鬓已成丝1年前1 -
 hyey6745 共回答了12个问题
hyey6745 共回答了12个问题 |采纳率83.3%D,
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO+4H2O
如果反应中有8.4gHNO3被还原,
(1)被氧化的Cu的质量=3*64*8.4/2*63=12.8g
(2)共消耗硝酸的质量=12.8*8*63/3*64=33.6g1年前查看全部
- 下列有关叙述,正确的是( ) A.加碘食盐能使淀粉溶液变蓝 B.用电石和水反应制乙炔是氧化还原反应 C.1
下列有关叙述,正确的是()
A.加碘食盐能使淀粉溶液变蓝 B.用电石和水反应制乙炔是氧化还原反应 C.1mol乙酸与足量乙醇在浓硫酸催化下加热,可生成1 mol乙酸乙酯 D.利用电石与水反应制取C 2 H 2 时,可采用CuSO 4 溶液除去杂质气体  缥缈峰zyzz1年前1
缥缈峰zyzz1年前1 -
 wangcal 共回答了14个问题
wangcal 共回答了14个问题 |采纳率85.7%D
A、碘盐中碘以碘酸钠形式存在,不能与淀粉显色;
B、电石与水反应为水解反应;
C、该反应为可逆反应,不可能进行到底;
D、正确,可以除去硫化物。1年前查看全部
- 高一化学氧化还原反应习题课件是那种有很多题的课件,关于氧化还原反应的,
 乌云盖顶1年前3
乌云盖顶1年前3 -
 cgbhg 共回答了18个问题
cgbhg 共回答了18个问题 |采纳率83.3%一、选择题:
1.有关氧化还原反应的叙述正确的是 ( )
A.氧化还原反应的实质是有氧元素的得失
B.氧化还原反应的实质是元素化合价的升降
C.氧化还原反应的实质是电子的转移(得失或偏移)
D.物质所含元素化合价升高的反应是还原反应
2.下列化学反应基本类型中一定是氧化还原反就的是 ( )
A.化合反应 B.分解反应 C.复分解反应 D.置换反应
3.下列哪一个反应表示二氧化硫被还原 ( )
A.SO2+2H2O+Cl2=H2SO4+2HCl B.SO2+H2S=2H2O+3S
C.SO2+2NaOH=Na2SO3+H2O D.SO2+Na2CO3=Na2SO3+CO2↑
4.下列化学方程式中电子转移不正确的是 ( )
5.某元素在化学反应中由化合态变为游离态,则该元素 ( )
A.一定被氧化 B.一定被还原
C.既可能被氧化又可能被还原 D.以上都不是
6.下列反应盐酸作还原剂的是 ( )
A.MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
B.CaCO3+2HCl=CaCl2+CO2↑+H2O
C.2HCl+Zn=ZnCl2+H2↑
D.2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
7.在Fe2O3+3CO 2Fe+2CO2反应中,Fe2O3 ( )
A.在被氧化 B.是氧化剂 C.被还原 D.是还原剂
8.下列变化需要加入还原剂才能实现的是 ( )
A.Na2SO3→SO2 B.HCl→Cl2 C.H2SO4(浓) → SO2 D.SO2→S
9.下列反应属于氧化还原反应,但水既不作氧化剂也不作还原剂的是 ( )
A.CO2+H2O H2CO3 B.2Na2O2+2H2O=4NaOH+O2↑
C.3Fe+4H2O(g) Fe2O4+4H2 D.2Na+2H2O=2NaOH+H2↑
10.在3Cl2+6KOH=5KCl+KClO3+3H2O反应中,还原产物是 ( )
A.KClO3 B.KCl C.KCl+H2O D.H2O
11.在5KCl+KClO3+3H2SO4=3Cl2↑+3K2SO4+3H2O中,被氧化的氯元素与被还原的氯元素的质量比为 ( )
A.1:1 B.5:1 C.1:5 D.3:1
12.根据下列反应,推断盐酸应当具有的性质是 ( )
①Zn+2HCl=ZnCl2+H2↑ ②2HCl+CuO=CuCl2+H2O ③MnO2+4HCl MnCl2+Cl2↑+H2O
A.只有酸性 B.只有氧化性
C.只有还原性 D.有酸性、有氧化性和还原性
13.下面三个方法都可以用来制氯气:
①4HCl(浓)+MnO2 MnCl2+Cl2↑+2H2O ② 4HCl(g)+O2 2Cl2+2H2O(g)2
③2KMnO4+16HCl(浓) =2KCl+2MnCl2+5Cl2↑+8H2O
则三种氧化剂由强到弱的顺序是 ( )
A.O2 MnO2 KMnO4 B.KMnO4 MnO2 O2
C.MnO2 KMnO4 O2 D.O2 KMnO4 MnO2
14.已知M2O7x-+3S2-+14H+=2M3++3S↓+7H2O,则M2O7x-中的M的化合价为 ( )
A.+2 B.+3 C.+4 D.+6
15.11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4反应中,被氧化的P原子与被还原的P原子个数比是 ( )
A.6:5 B.5:6 C.11:5 D.11:6
16.对于反应CaH2+2H2O=Ca(OH)2+2H2↑有下列判断:①H2只是氧化产物,②H2只是还原产物,③H2O是氧化剂,④CaH2中的H元素被还原,⑤此反应中的氧化产物和还原产物的分子个数之比为1:1.上述判断正确的是 ( )
A.①④⑤ B.②④ C.① D.③⑤
17.根据下列反应的化学方程式,判断有关物质的还原性强弱顺序是 ( )
I2+SO2+2H2O=H2SO4+2HI 2FeCl2+Cl2=2FeCl3 2FeCl3+2HI=2FeCl2+2HCl+I2
A.I->Fe2+>Cl->SO2 B.Cl->Fe2+>SO2>I-
C.Fe2+>I->Cl->SO2 D.SO2>I->Fe2+>Cl-
18.G、W、X、Y、Z均为含氯的含氧化合物,我们不了解它们的化学式,但知道它们在一定条件下具有如下的转化关系(未配平):
①G→W+NaCl ②W+H2O X+H2 ③Y+NaOH→G+W+H2O
④Z+NaOH→W+X+H2O这五种化合物中的氯的化合价由低到高的顺序是 ( )
A.W、G、Z、Y、X B.G、Y、W、Z、X
C.G、Y、Z、W、X D.Z、X、G、Y、W
19.同一物质中同一价态的元素部分被氧化,部分被还原的氧化还原反应是( )
A.Cl2+H2O=HCl+HClO B.NH4HCO3 NH3↑+CO2↑+H2O
C.3N02+H2O=2HNO3+NO D.SO2+2H2S=2H2O+3S
20.被称为万能还原剂的NaBH4溶于水并和水反应:NaBH4+2H2O NaBO2+4H2↑下列说法中正确的是(NaBH4中H元素为-1价) ( )
A.NaBH4既是氧化剂又是还原剂 B.NaBH4是还原剂,H2O是氧化剂
C.硼元素被氧化,氢元素被还原 D.被氧化的元素与被还原的元素质量比为1:1
二、填空题
21.下列微粒:Fe、Cl-、H+、F2,其中能得到电子的微粒有 ,该元素的化合价 ,表现出 性,是 剂,具有还原性的微粒是 ,它们在反应中 (填得或失)电子,发生 反应(填氧化或还原),其化合价 .
22.请把符合要求的化学反应方程式的编号填入括号内:
(1)是分解反应又是氧化还原反应的是 ( )
(2)是分解反应不是氧化还原反应的是 ( )
(3)是化合反应又是氧化还原反应的是 ( )
(4)是化合反应不是氧化还原反应的是 ( )
(5)不属于四种基本反应类型的氧化还原反应的是 ( )
A.2KClO3 2KCl+3O2↑B.2Fe+3Cl2 2FeCl3
C.NH4HCO3 NH3↑+H2O+CO2↑ D.CaO+CO2=CaCO3 E.Cl2+H2O=HCl+HClO
23.反应2KMnO4+16HCl=2MnCl2+2KCl+5Cl2↑+8H2O中,氧化剂是 ,还原剂是 ,若生成71gCl2,被氧化的HCl是 g.
24.在下列反应中,氨做氧化剂的是 ,氨做还原剂的是 .
A.3Cl2+8NH3=6NH4Cl+N2 B.2NH3+H2SO4= (NH4)2SO4
C.2NH3+2Na=2NaNH2+H2 D.NH3+NaH=NaNH2+H2
三、简答题
25.在下列化学方程式中,标出电子转移的方向和数目,指出氧化剂和还原剂,氧化产物和还原产物
(1)3S+6KOH K2SO3+K2S+3H2O (2)S+2KNO3+3C K2S+N2+3CO2
氧化剂 还原剂 氧化剂 还原剂
氧化产物 还原产物 氧化产物 还原产物
(3)3Cu+8HNO3 3Cu(NO3)2+2NO+4H2O (4)4FeS2+11O2 2Fe2O3+8SO2
氧化剂 还原剂 氧化剂 还原剂
氧化产物 还原产物 氧化产物 还原产物
四、计算题
26.取含MnO2的软锰矿石27.86g,跟足量浓盐酸反应,制得5.6L氯气(该状态下Cl2密度为3.17g/L)计算: (Mn:55)
(1)这种软锰矿石中MnO2的质量分数?
(2)被氧化的HCl为多少g?
27.在3BrF3+5H2O 9HF+HBrO3+O2↑+Br2反应中,若有5.4gH2O被氧化,求被水还原的BrF3是多少g?
参 考 答 案
一、1.C 2.D 3.B 4.D 5.C 6.AD 7.BC 8.CD 9.B 10.B 11.B 12.D 13.B 14.D 15.A 16.D 17.D 18.B 19.AC 20.BD
二、21.H+、F2,降低,氧化性,氧化,Fe、Cl-,失去,氧化,升高 22.(1)A(2)C(3)B(4)D(5)E 23.KMnO4,HCl,73 24.CD,A
三、25.略
四、26.(1)78.1% (2)18.25g 27.27.4g1年前查看全部
- 有机化学中的氧化还原反应 急!请问取代和加成反应属于氧化还原反应么老师讲只用判断氧或氢原子的得失就可以判断此反应是氧化还
有机化学中的氧化还原反应 急!
请问取代和加成反应属于氧化还原反应么
老师讲只用判断氧或氢原子的得失就可以判断此
反应是氧化还是还原
为什么可以这样?不用考虑电子么?再请问有什么好一点的资料...........推荐下吧 不胜感激!
 米加乐1年前7
米加乐1年前7 -
 猪猪的窝窝 共回答了17个问题
猪猪的窝窝 共回答了17个问题 |采纳率94.1%有机反应中,得氧去氢就是氧化,得氢去氧就是还原.不用考虑电子转移.
加成反应如果是加氢就是还原.如:乙烯加氢变乙烷.1年前查看全部
- 下列反应哪些是氧化还原反应?哪些不是?是氧化还原反应的,指出哪些物质是氧化剂?哪些物质是还原剂?
下列反应哪些是氧化还原反应?哪些不是?是氧化还原反应的,指出哪些物质是氧化剂?哪些物质是还原剂?
(1)H3PO4+2NaOH=NaHP4+2H2O
(2)HgCL2+2NaO=HgO+H2O+2NaCL
(3)Cu+HgCL2=CuCL2+Hg
(4)2FeCL3+SnCL2=2FeCL2+SnCL4
(5)4NH3+5O2=Pt=4NO+6H2O
麻烦各位将化合价的变化,是什么反应写清楚点! javehtp1年前2
javehtp1年前2 -
 wqj1008 共回答了13个问题
wqj1008 共回答了13个问题 |采纳率92.3%判断是不是氧化还原反应要从是否有化合价升降着手,有化合价升降的就是氧化还原反应.而氧化剂的化合价会降低,还原剂的化合价会升高.
1、没有化合价升降,不是氧化还原反应;
2、没有化合价升降,不是氧化还原反应;
3、铜从0价升高到+2价,汞从+2价降低到0价,所以是氧化还原反应,还原剂Cu,氧化剂HgCl2;
4、铁从+3价降低到+2价,锡从+2价升高到+4价,所以是氧化还原反应,其中还原剂SnCl2,氧化剂FeCl3;
5、氮元素从-3价升高到+2价,氧元素从0价降低到-2价,所以是氧化还原反应,其中还原剂NH3;氧化剂O2;1年前查看全部
- 下列过程中,不涉及氧化还原反应的是( ) A.浓硫酸加入蔗糖固体中 B.金属钠放置在空气中变质 C.SO 2 使品红溶
下列过程中,不涉及氧化还原反应的是( ) A.浓硫酸加入蔗糖固体中 B.金属钠放置在空气中变质 C.SO 2 使品红溶液褪色 D.NO 2 形成酸雨  dixq5481年前1
dixq5481年前1 -
 黑皮游 共回答了10个问题
黑皮游 共回答了10个问题 |采纳率100%A.浓硫酸加入蔗糖固体中,浓硫酸使蔗糖发生了脱水反应,该反应中硫元素化合价由+6价变为+4价,所以涉及氧化还原反应,故A错误;
B.钠和氧气反应生成氧化钠,该反应中氧元素化合价由0价变为-2价,所以涉及氧化还原反应,故B错误;
C.二氧化硫使品红溶液褪色,是因为二氧化硫和有色物质反应生成了无色物质,该反应中没有元素化合价变化,所以不涉及氧化还原反应,故C正确;
D.二氧化氮和水反应生成硝酸和一氧化氮,该反应中N元素化合价由+4价变为+5价和+2价,所以有元素化合价变化,涉及氧化还原反应,故D错误;
故选C.1年前查看全部
- 氧化还原反应的一些问题.顺便请讲解一下氧化还原反应、谢谢
氧化还原反应的一些问题.顺便请讲解一下氧化还原反应、谢谢
(2)根据反应过程中物质的得氧和失氧分:氧化反应与还原反应
氧化反应:
还原反应:
(3)根据反应过程中热量的变化分:吸热反应与放热反应
吸热反应:
放热反应:
[练习]判断下列反应所属的类别:
C+O2——
Fe2O3+CO——
MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
[归纳]1.氧化还原反应的定义:
氧化反应:
还原反应:
氧化还原反应:
[思考]为什么化学反应过程中会发生化合价的变化?
_______________________________________________________________
_______________________________________________________________
[归纳]2.氧化还原反应的表观与实质:
表观:
实质:
3.氧化还原反应的判断:
氧化反应:
还原反应:
氧化还原反应:
4.氧化还原反应的有关概念及关系:
[思考]对照上面的反应把下列词语连成两句话(注意词语对应):
氧化剂、还原剂、氧化反应、还原反应、得电子、失电子
电子对偏离、电子对偏向、化合价升高、化合价降低
氧化产物、还原产物、被氧化、被还原、氧化性、还原性
__________________________________________________________________________
____________________________________________________________________________________________________________________________________________________
__________________________________________________________________________
5.氧化还原反应与四大基本类型反应的关系:
[思考]举例说明四大基本反应类型与氧化还原反应的关系:
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
将“化合反应”、“置换反应”、“分解反应”、“复分解反应”与“氧化还原反应”填入下图
[练习]判断下列反应是否是氧化还原反应,若是指出氧化剂、还原剂、氧化产物还原产物
①2Na+Cl2=2NaCl
②Cu2(OH)2CO3——
③H2O+3NO2=2HNO3+NO
④4NH3+5O2=4NO+6H2O
⑤Cu + 2H2SO4(浓)=CuSO4 + SO2 + 2H2O
⑥Cl2 + 2NaOH = NCl + NaClO + H2O
⑦5HCl+KClO3=KCl+3Cl2↑+3H2O
⑧3Cu2S + 16HNO3 = 6Cu(NO3)2 + 3S + 4NO + 8H2O
⑨NO + NO2 + 2NaOH = 2NaNO2 + H2O
⑩3Br2 + 6KOH = 5KBr + KBrO3 + 3H2O 名字还是长才好1年前4
名字还是长才好1年前4 -
 jj_ww 共回答了15个问题
jj_ww 共回答了15个问题 |采纳率86.7%question 2:因为除单质氧外,物质中的氧均为-2价,含有两个电子.一个物质得到氧,即得到电子,被氧化成高价态,发生氧化反应;相反则被还原成低价态,发生还原反应.
question 3:吸热反应:物质需要外界提供热量才可以进行的反应,表观现象为反应物质温度降低或者不变;放热反应:物质反应过程中会放出热量,反应容器会发热.
式1:碳的氧化反应;式2:;式3:锰被还原,氯被氧化的氧化还原反应.
为什么反应会发生化合价的变化?因为物质的结构决定物质的性质,元素最外层电子的多少决定了元素性质的变化.
至于以下的几个式子:反应后化合价降低的物质是氧化剂,反应后化合价升高的物质是还原剂.
question 4:1年前查看全部
- 一道高一的氧化还原反应的化学题,要有过程,速度在线等
一道高一的氧化还原反应的化学题,要有过程,速度在线等
下列变化需加入还原剂的是
A.HCO3→CO2
B.MnO4→Mn2+
C.FeO→Fe3O4
D.H3AlO3→HAlO2
恩
A是HCO3^-
B是MnO4^-
我看错了
过程过程过程过程过程! 极夜sun1年前1
极夜sun1年前1 -
 公平公正在哪 共回答了22个问题
公平公正在哪 共回答了22个问题 |采纳率81.8%化合价降低是被还原
A:应该是HCO3^- 的吧?加H^+
B:化合价降低了,所以需加还原剂
C:Fe3O4 其实应该是是FeO·Fe2O3 ,是FeO部分氧化成Fe2O3,需要的是氧化剂(只是不知道你们现在学到这个没)
D:这个化合价就没有变化啊~只是脱了一份子的H2O1年前查看全部
- 在化学反应前后,物质所含元素化合价发生变化的反应是氧化还原反应,它与化学反应基本类型间的关系如图所示,下列示例中错误的是
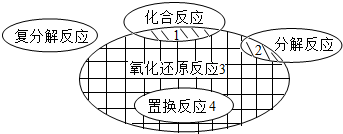 在化学反应前后,物质所含元素化合价发生变化的反应是氧化还原反应,它与化学反应基本类型间的关系如图所示,下列示例中错误的是( )
在化学反应前后,物质所含元素化合价发生变化的反应是氧化还原反应,它与化学反应基本类型间的关系如图所示,下列示例中错误的是( )
A.阴影1:C+O2
CO2点燃 .
B.阴影2:H2CO3═H2O+CO2↑
C.阴影3:3CO+Fe2O3
2Fe+3CO2高温 .
D.阴影4:Fe+CuSO4═FeSO4+Cu jsxxc19861年前1
jsxxc19861年前1 -
 q23w45 共回答了23个问题
q23w45 共回答了23个问题 |采纳率78.3%解题思路:根据图示结合化学反应进行分析解答即可,化合反应是多种物质生成一种物质的化学反应,分解反应是一种物质生成多种物质的化学反应,置换反应是一种单质和一种化合物生成另一种单质和另一种化合物的反应.A、该反应是化合反应,且反应前后碳元素和氧元素的化合价发生了改变,因此是氧化还原反应,故A正确;
B、该反应是分解反应,但是反应前后元素的化合价不变,故不是氧化还原反应,故B错误;
C、该反应是前后铁元素和碳元素的化合价发生了改变,是氧化还原反应,故C正确;
D、该反应是置换反应,且反应前后铁元素和铜元素的化合价发生了改变,属于氧化还原反应,故D正确;
故选B.点评:
本题考点: 氧化反应;还原反应.
考点点评: 本题考查了对常见化学反应的推断,完成此题,可以依据具体的反应结合题干的要求进行.1年前查看全部
- 下列生产、生活中的事例不属于氧化还原反应的是( ) A.金属冶炼 B.燃放鞭炮 C.食物腐败 D.点制豆腐
下列生产、生活中的事例不属于氧化还原反应的是()
A.金属冶炼 B.燃放鞭炮 C.食物腐败 D.点制豆腐  断无魂1年前1
断无魂1年前1 -
 有福不享 共回答了17个问题
有福不享 共回答了17个问题 |采纳率88.2%D
1年前查看全部
- 氧化还原反应在生产、生活中具有广泛的用途,下列生产生活中的事例不属于氧化还原反应的是( )
氧化还原反应在生产、生活中具有广泛的用途,下列生产生活中的事例不属于氧化还原反应的是( )
A. 金属冶炼
B. 燃放鞭炮
C. 食物腐败
D. 用汽油除去油污 rxtxsd1年前1
rxtxsd1年前1 -
 zbsw 共回答了13个问题
zbsw 共回答了13个问题 |采纳率92.3%解题思路:有化合价变化的反应属于氧化还原反应,没有元素的化合价变化的反应不属于氧化还原反应.A、金属冶炼中金属的化合价降低,则发生氧化还原反应,故A不选;
B、燃放鞭炮中涉及燃烧反应,则发生氧化还原反应,故B不选;
C、食物腐败是发生的缓慢氧化反应,氧元素的化合价降低,故C不选;
D、用汽油除去油污没有发生化学变化,是相似相溶原理的应用,故D选;
故选D.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查生活中常见的反应,明确有元素的化合价变化的反应是氧化还原反应,没有新物质生成的变化属于物理变化即可解答.1年前查看全部
- 碳与水的反应C+H2O={高温}H2+CO 这个反映属于那种反应类型啊?那么氧化还原反应就是属于置换反应吗?
 vivian_xj1年前5
vivian_xj1年前5 -
 0505huang 共回答了12个问题
0505huang 共回答了12个问题 |采纳率100%这属于置换反应.因为是一种单质和一种化合物反应生成另一种单质和另一种化合物.置换反应的确属于氧化还原.但是氧化还原的范围更大.置换只是其中的一种.1年前查看全部
- 有单质参加的化合反应一定是氧化还原反应吗
有单质参加的化合反应一定是氧化还原反应吗
列出化学方程式更好
那如果是反应 不指明是化合反应 结果又是怎样的 列下方程式 玉阳1年前3
玉阳1年前3 -
 lg5205215 共回答了22个问题
lg5205215 共回答了22个问题 |采纳率95.5%当然不是 !
同素异形体之间的转换就不是!
例如
3 O2 ==== 2 O3 (氧气放电变臭氧)
4 P ==== P4 (红磷变白磷 条件 隔绝空气加热416)1年前查看全部
- 氧化还原反应生成I2体现I2氧化性吗
 显得十1年前2
显得十1年前2 -
 萤舞 共回答了19个问题
萤舞 共回答了19个问题 |采纳率89.5%I2是生成物,不能体现碘单质任何性质.1年前查看全部
- 氧化还原反应是有元素化合价发生改变的化学反应,氧化还原反应的本质是______.在氧化还原反应中,还原剂______电子
氧化还原反应是有元素化合价发生改变的化学反应,氧化还原反应的本质是______.在氧化还原反应中,还原剂______电子,本身发生______反应.Na2O2中氧元素化合价为-1价,根据氧化还原反应的知识可以推知Na2O2既有______性又有______性.Na2O2和KMnO4的H2SO4溶液反应,生成Na2SO4,MnSO4,K2SO4,O2和水,在这个反应中氧化剂为______,还原剂为______.
 想有个名字1年前1
想有个名字1年前1 -
 memphis_d 共回答了22个问题
memphis_d 共回答了22个问题 |采纳率86.4%解题思路:氧化还原反应的实质为电子转移,还原剂失去电子,被还原;处于中间价态的微粒,既能失去电子也能得到电子;Na2O2和KMnO4的H2SO4溶液反应为5Na2O2+2KMnO4+8H2SO4=5Na2SO4+2MnSO4+K2SO4+5O2↑+8H2O,Mn元素的化合价降低,过氧化钠中O元素的化合价升高,以此来解答.氧化还原反应的实质为电子转移,还原剂失去电子,被还原,发生还原反应;Na2O2中氧元素化合价为-1价,既能失去电子也能得到电子,则既有氧化剂也有还原性;Na2O2和KMnO4的H2SO4溶液反应为5Na2O2+2KMnO4+8H2SO4=5Na2SO4+2MnSO4+K2SO4+5O2↑+8H2O,Mn元素的化合价降低,过氧化钠中O元素的化合价升高,所以氧化剂为KMnO4,还原剂为Na2O2,
故答案为:电子转移;失去;还原;氧化;还原;KMnO4;Na2O2.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念的考查,注意元素化合价与微粒性质的关系,题目难度不大.1年前查看全部
- 下列气体溶于水中发生了氧化还原反应的是( )
下列气体溶于水中发生了氧化还原反应的是( )
A.CO2
B.HCl
C.NO2
D.NH3 简单v好看1年前1
简单v好看1年前1 -
 zzhhzt 共回答了18个问题
zzhhzt 共回答了18个问题 |采纳率72.2%A.CO2和水反应生成碳酸,元素化合价没有发生变化,不是氧化还原反应,故A错误;
B.HCl溶于水,没有发生化学变化,故B错误;
C.NO2与水反应生成硝酸和NO,N元素化合价发生变化,属于氧化还原反应,故C正确;
D.NH3溶于水,元素化合价没有发生变化,不是氧化还原反应,故D错误.
故选C.1年前查看全部
- 氧化还原反应发生的条件是什么啊啊啊啊?
氧化还原反应发生的条件是什么啊啊啊啊?
是不是只要氧化剂氧化性大于氧化产物还原剂还原性大于还原产物就能发生氧化还原反应?
你们答的都不是条件。
例如,Fecl3氧化性比I2强,那么Fecl3溶液是否能使淀粉-KI试纸变蓝?
也就是说,我把Fecl3当成氧化剂,I2当成氧化产物,如果上面条件是对的,那么Fecl3与I-的反应就能进行。
我问题的意思就是这样。 mzwhgxx1年前5
mzwhgxx1年前5 -
 最佳男豬腳 共回答了16个问题
最佳男豬腳 共回答了16个问题 |采纳率93.8%氧化剂氧化性可以把还原剂氧化即可发生氧化还原反应1年前查看全部
- 关于氧化还原反应的化学题过氧化钠和水反应生成氢氧化钠和氧气,在这个反应中,水的作用是什么?是氧化剂还是还原剂?还是什么都
关于氧化还原反应的化学题
过氧化钠和水反应生成氢氧化钠和氧气,在这个反应中,水的作用是什么?是氧化剂还是还原剂?还是什么都不做? 看图1年前3
看图1年前3 -
 fangkangzhen 共回答了12个问题
fangkangzhen 共回答了12个问题 |采纳率83.3%什么都不做.它的反应原理是:过氧化钠和水反应生成双氧水和氢氧化钠,然后双氧水再分解生成氧气1年前查看全部
- 下列类型的反应,一定不属于氧化还原反应的是( ) A.化合反应 B.分解反应 C.置换反应 D.复分解反应
下列类型的反应,一定不属于氧化还原反应的是()
A.化合反应 B.分解反应 C.置换反应 D.复分解反应  ZPL21CN1年前1
ZPL21CN1年前1 -
 甬生甬长 共回答了14个问题
甬生甬长 共回答了14个问题 |采纳率100%D
1年前查看全部
- 在氧化还原反应3S+6KOH=K2SO3+2K2S+3H2O中,氧化剂和还原剂的物质的量之比为( )
在氧化还原反应3S+6KOH=K2SO3+2K2S+3H2O中,氧化剂和还原剂的物质的量之比为( )
A.1:2
B.2:1
C.1:1
D.3:2 zy123zy1年前1
zy123zy1年前1 -
 世界的人 共回答了18个问题
世界的人 共回答了18个问题 |采纳率100%解题思路:在3S+6KOH=K2SO3+2K2S+3H2O反应中,S元素化合价分别由0价升高为+4价,被氧化,降低为-2价,被还原,反应中硫既作氧化剂又作还原剂,根据还原产物与氧化产物的化学计量数进行判断.在3S+6KOH=2K2S+K2SO3+3H2O反应中,硫元素化合价由0价升高为+4价,被氧化,氧化产物为K2SO3,硫元素由0价降低为-2价,被还原,还原产物为K2S,所以硫既作氧化剂又作还原剂,氧化剂被还原生成还原产物,还原剂被氧化生成氧化产物,根据还原产物与氧化产物的化学计量数可知,氧化剂和还原剂的物质的量之比为2:1,
故选B.点评:
本题考点: 氧化还原反应的计算.
考点点评: 本题考查氧化还原反应概念与计算,侧重于学生的分析能力和计算能力的考查,为高频考点,难度不大,根据化合价判断氧化剂与还原剂、还原产物与氧化产物是关键,判断后也可根据电子转移守恒计算氧化剂与还原剂的物质的量之比.1年前查看全部
- CO2与Na2O2反应是氧化还原反应吗?
 derne1年前1
derne1年前1 -
 QQ头头 共回答了20个问题
QQ头头 共回答了20个问题 |采纳率100%是的,产物除了碳酸钠还有氧气1年前查看全部
- 如何在氧化还原反应中判断氧化性还原性的强弱?(高一化学)给我些例题.
 forgxm1年前1
forgxm1年前1 -
 丰富细致 共回答了22个问题
丰富细致 共回答了22个问题 |采纳率95.5%楼下说的怕是不对吧,这个东西只能靠自己一个一个去记 还有就是氧化还原反应中都是强强生成弱弱举个例子
Fe+氢离子===亚铁离子+氢气 铁的还原性比氢气强 氢离子的氧化性比亚铁离子的氧化性强1年前查看全部
- 下列变化中,不属于氧化还原反应的是A.硫磺燃烧B.食物腐败C.菜刀生锈D.生石灰转化为熟石灰
 Yossarian_T1年前1
Yossarian_T1年前1 -
 ericwong39 共回答了20个问题
ericwong39 共回答了20个问题 |采纳率90%D.CaO+H2O=Ca(OH)2没有化合价变化,不属于氧化还原反应.1年前查看全部
- 在氧化还原反应反应中,反应前后元素化合价变化有规律:有的元素化合价升高,有的元素化合价降低.如:H2+CuO
在氧化还原反应反应中,反应前后元素化合价变化有规律:有的元素化合价升高,有的元素化合价降低.如:H2+CuO
Cu+H2O,氢元素的化合价由反应前的0价升高为变化后的+1价,而铜元素的化合价由反应前的+2价降低为变化后的0价.△ .
(1)在反应Fe2O3+3CO
2Fe+3CO2中,化合价升高的元素为______;高温 .
(2)已知钠与水在常温下可发生氧化还原反应.甲、乙两同学对该反应的生成物有不同观点,甲同学认为生成物是氢氧化钠和氢气,乙同学认为生成物是氢氧化钠和氧气.请结合化合价变化的规律写出正确的化学方程式______,该反应的基本类型为______. 爱捷灵1年前1
爱捷灵1年前1 -
 jakinla 共回答了13个问题
jakinla 共回答了13个问题 |采纳率100%解题思路:(1)分析化学反应中各元素的化合价变化可得答案;
(2)根据“同一反应中若有一种元素的化合价升高则一定有另一元素的化合价降低”,那么,金属Na与水反应生成NaOH和另一气体单质;钠元素由0价升高带+1价;水中的氧元素为-2价,如果单质为氧气,不符合题意;故单质则为氢气,那么氢元素由+1价降低到0价,反应物和生成物都知道,可书写化学方程式,并判断反应类型;(1)在反应Fe2O3+3CO
高温
.
2Fe+3CO2中,铁的化合价由+3变到0,氧的化合价未变,碳的化合价由+2变到+4,所以碳元素化合价升高了;
(2)根据:“同一反应中若有一种元素的化合价升高则一定有另一元素的化合价降低”,则金属Na与水反应生成NaOH和另一气体单质,钠元素的化合价升高;水中的氧元素为-2价,如果单质为氧气,不符合题意;故单质则为氢气,那么氢元素由+1价降低到0价,反应物和生成物都知道,故可书写化学方程式2Na+2H2O═2NaOH+H2↑,该反应的特点是单质与化合物反应生成单质与化合物,所以该反应是置换反应;
故答案为:(1)碳;(2)2Na+2H2O═2NaOH+H2↑;置换反应;点评:
本题考点: 氧化反应;有关元素化合价的计算;反应类型的判定;还原反应;书写化学方程式、文字表达式、电离方程式.
考点点评: 了解常见元素及原子团的化合价,根据化合价规律和原则,进行有关元素化合价的计算;根据题目信息,找出反应物和生成物,再利用书写化学方程式的方法及步骤,正确书写化学方程式.1年前查看全部
- 四种基本反应类型与氧化还原反应的关系如图所示,则下列化学反应属于区域2的是( )
四种基本反应类型与氧化还原反应的关系如图所示,则下列化学反应属于区域2的是( )
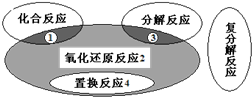
A.Zn+H2SO4=ZnSO4+H2↑
B.H2+Cl2
2HCl点燃 .
C.2KClO3
2KCl+3O2↑MnO2 .△
D.2Cl2+2Ca (OH)2=CaCl2+Ca(ClO)2+2H2O leileilei20081年前1
leileilei20081年前1 -
 碰到神经病了 共回答了19个问题
碰到神经病了 共回答了19个问题 |采纳率100%解题思路:区域2所表示的反应是氧化还原反应,但不是置换反应,不是化合反应,不是分解反应.A、反应是氧化还原反应,也是置换反应,不属于区域2,故A错误;
B、反应是氧化还原反应,是化合反应,不属于区域2,故B错误;
C、反应是氧化还原反应,是分解反应,不属于区域2,故C错误;
D、该反应是氧化还原反应,但不是置换反应,不是化合反应,不是分解反应,属于区域2,故D正确.
故选D.点评:
本题考点: 化学基本反应类型;氧化还原反应.
考点点评: 本题考查学生四大基本反应类型和氧化还原反应之间的关系知识,可以根据所学知识进行回答,难度不大.1年前查看全部
- 详解:什么是氧化还原反应?a.详解氧化反应b.详解还原反应c.什么反应是氧化还原反应d.这种反应的规律e.几个氧化反应方
详解:什么是氧化还原反应?
a.详解氧化反应b.详解还原反应c.什么反应是氧化还原反应d.这种反应的规律e.几个氧化反应方程式和几个还原反应 lehui1年前2
lehui1年前2 -
 0000799787 共回答了24个问题
0000799787 共回答了24个问题 |采纳率91.7%一般判断氧化还原反应通过元素化合价的升降就能判断.
元素化合价升高,该元素组成的物质就是还原剂
元素化合价降低,该元素组成的物质就是氧化剂
比如氢气还原氧化铜生成铜和水,氢元素化合价升高,所以氢气就是还原剂,铜元素化合价降低,氧化铜是氧化剂.还原剂被氧化,氧化剂被还原1年前查看全部
- 关于高一的氧化还原反应.今有三个氧化还原反应:(1)2FeCl3+2KI===2FeCl2+2KCl+I2(2)2FeC
关于高一的氧化还原反应
.今有三个氧化还原反应:
(1)2FeCl3+2KI===2FeCl2+2KCl+I2
(2)2FeCl2+Cl2===2FeCl3
(3)KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O
若某溶液中有Fe2+和I-共存,要氧化除去I-离子而又不影响Fe2+和Cl-可加入的试剂是( )
A、Cl2 B、KMnO4 C、FeCl3 D、HCl
解析:
本题主要考查根据化学方程式进行判断物质氧化性的强弱.
由(1)知:FeCl3具有氧化性,它可以氧化I-;
由(2)知:Cl2具有氧化性,且氧化性Cl2>FeCl3,Cl2可以氧化FeCl2;
由(3)知,KMnO4具有氧化性,且氧化性KMnO4>Cl2,KMnO4可以氧化Cl-,故本题应加入的试剂应为FeCl3,选C.
我的疑问:(1)中不是三价铁的氧化性大于碘单质吗 为什么说是碘离子?还有(3)的双线桥怎么标? shinemidnight1年前1
shinemidnight1年前1 -
 sunsova 共回答了18个问题
sunsova 共回答了18个问题 |采纳率83.3%(1)铁离子将碘离子氧化成了碘单质,而铁离子被碘离子还原成了亚铁离子.要看电子转移的状况,是铁离子将2mol e-转移给了碘离子而不是碘单质.
(2) +7 -1 +2 0
2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O
1.从+7价Mn到Cl2,得10*e-,被还原,还原反应
2..从-1价Cl到+2价Mn,失2*5e-,被氧化,氧化反应1年前查看全部
- 由物质得氧叫氧化,物质失氧叫还原的观点来分析下列化学反应属于氧化还原反应的是( )
由物质得氧叫氧化,物质失氧叫还原的观点来分析下列化学反应属于氧化还原反应的是( )
A.氢气在氧气中燃烧 B.氢气还原氧化铜
C.CO还原Fe2O3 D.石灰石和稀盐酸反应制CO2 紫竹林轩1年前1
紫竹林轩1年前1 -
 son_of_wind 共回答了14个问题
son_of_wind 共回答了14个问题 |采纳率92.9%选A吧,我觉得1年前查看全部
- 在氧化还原反应中什么叫氧化性/还原性、被氧化/被还原、氧化产物/还原产物
在氧化还原反应中什么叫氧化性/还原性、被氧化/被还原、氧化产物/还原产物
和其他氧化还原反应的知识点! 散落的记忆1年前5
散落的记忆1年前5 -
 sunle008 共回答了18个问题
sunle008 共回答了18个问题 |采纳率88.9%反应中得到电子的,化合价降低,就是氧化剂;失去电子,化合价升高,就是还原剂(两者都是反应物)
氧化物被还原,生成还原产物;还原物被氧化,生成氧化产物(是不是像绕口令?去年我也这么被搞糊涂的)1年前查看全部
- 一道高一氧化还原反应题目有三个氧化还原反应,2FeCl3+2kI==2Fecl2+2KCl+I22FeCl2=+Cl2=
一道高一氧化还原反应题目
有三个氧化还原反应,
2FeCl3+2kI==2Fecl2+2KCl+I2
2FeCl2=+Cl2==2FeCl3
2KMnO4+16HCl==2KCl+2MnCL2+5cl2↑+8H2O
若某溶液中有二价铁离子负一价碘离子共存,要氧化负一价碘离子,二又不影响二价铁离子和负一价的氯离子,可加入试剂是
ACL2 BKMnO4 C2FeCL3
D浓盐酸 笨笨的飘飘1年前3
笨笨的飘飘1年前3 -
 yz0127 共回答了14个问题
yz0127 共回答了14个问题 |采纳率100%A.CL2氧化二价铁
2FeCl2+Cl2==2FeCl3
B.KMnO4氧化负一价氯
2KMnO4+16HCl==2KCl+2MnCL2+5cl2↑+8H2O
D.浓盐酸
不能氧化负一价碘
故:选C1年前查看全部
- 不是说氧化还原反应前后化合价升降总数相等吗?那Fe2O3+3CO=2Fe+3CO2不是吧
 kcckxx1年前4
kcckxx1年前4 -
 兰德梅克 共回答了20个问题
兰德梅克 共回答了20个问题 |采纳率90%铁:化合价降低+3到0 2*(3-0)=6
碳:化合价升高+2到+4 3*(4-2)=6
相等的1年前查看全部
- 化学离子共存问题中怎么看离子发生了氧化还原反应?
化学离子共存问题中怎么看离子发生了氧化还原反应?
比如说CLO-离子能氧化S离子 是怎么看出来的? asdsad0uio001年前5
asdsad0uio001年前5 -
 涵玉 共回答了12个问题
涵玉 共回答了12个问题 |采纳率100%要记住一些的
NO3-/H+ 与 Fe2+ S2- I-
MnO4-/H+ 与 Fe2+ S2- I-
ClO- H+ 与S2- I- Fe2+
Fe3+ 与 S2- I-
或者说要记住高中常见的氧化性的离子和还原性的离子
ClO-有强氧化性 S2-还原性1年前查看全部
- 离子共存问题中的氧化还原反应能发生氧化还原反应的离子是不能共存的,『但我不知道怎么判断是否会发生氧化还原反应,怎么判断』
离子共存问题中的氧化还原反应
能发生氧化还原反应的离子是不能共存的,『但我不知道怎么判断是否会发生氧化还原反应,怎么判断』还有是怎么看离子是具有还原性还是氧化性的?求详细解答离子共存中氧化还原反应这一块.(求列出高中化学中会发生氧化还原反应的离子,要详细) sr8k1年前2
sr8k1年前2 -
 男画皮 共回答了22个问题
男画皮 共回答了22个问题 |采纳率90.9%常见的判断氧化性/还原性强弱的方法有:
1.从元素的价态考虑
最高价态——只有氧化性,如Fe3+ H2SO4 KMnO4
最低价态——只有还原性,如金属单质 Cl- S2-
中间价态——既有氧化性有有还原性,如Fe2+ S等
同种元素的价态高,其氧化性较强;价态低,其还原性较强.
2.根据金属活动顺序表判断
金属越活泼,金属单质的还原性越强,其对应离子的氧化性越弱.
单质还原性:按金属活动顺序表的顺序依次减弱.
金属离子氧化性:按金属活动顺序表的顺序依次减弱.(铁指Fe2+)
如氧化性:Ag+ > Hg2+ > Fe3+ > Cu2+ > H+ > Fe2+
3.根据非金属的活泼型判断
非金属性越强,单质的氧化性越强,其对应离子的还原性越弱.
单质氧化性:F2 > Cl2 > Br2 > I2 > S
离子还原性:S2- > I- > Br- > Cl- > F-
4.通过化学反应比较
氧化剂 + 还原剂 → 氧化产物 + 还原产物
氧化性:氧化剂 > 氧化产物
还原剂:还原剂 > 还原产物
5.通过与同一物质反应的产物比较
如:2Fe + 3Cl2 =(点燃) 2FeCl3
3Fe + 2O2 =(点燃) Fe3O4
可得出氧化性Cl2 > O2.
高锰酸根离子、次氯酸根离子、过氧根离子、高铁酸根离子都是强氧化性
硫离子,卤素离子都是青还原性
至于反应的判断,具有氧化性的和具有还原性的一起都会反应
如果一种离子价态还能更高,说明具有还原性,反之亦然1年前查看全部
- 有关氧化还原反应的 氧化还原反应中遵守以强制弱原则 就是氧化性强的做氧化剂 氧化性弱的做还原剂 那
有关氧化还原反应的 氧化还原反应中遵守以强制弱原则 就是氧化性强的做氧化剂 氧化性弱的做还原剂 那
有关氧化还原反应的
氧化还原反应中遵守以强制弱原则 就是氧化性强的做氧化剂 氧化性弱的做还原剂 那过氧化氢与二氧化硫反应反应生成硫酸 为什么它们可以反应啊 还有高中的化学方程式是不是可以自己推出来感到作业中有好多没见过的方程式 请讲的通俗一点 伟大ll手电筒1年前1
伟大ll手电筒1年前1 -
 形只影单的美美 共回答了18个问题
形只影单的美美 共回答了18个问题 |采纳率88.9%等式两边看化合(he)价的变化化合价升高失去电子被氧化是还原剂(绅士养花还原剂)H2O2有较强氧化(也有一定还原性)性,SO2有还原性反应中S+2价做还原剂升高到+6价生成H4SO4 H2O2中两氧合成过氧根离子表现-2价(就当每个-1价)氧化剂降到-2价(你应该是高一吧,高一好生学习吧)1年前查看全部
大家在问
- 1桥梁监理中常用DKxxx+xxx代表,请问具体数值代表什么?
- 2我不是辛迪我是玛丽翻译
- 3谁能告诉我怎么提高英语阅读理解啊!我总是看不懂~
- 4Question: Why is it so hard for some people to apologize aft
- 51.102的2次方-204×2+4(用简便方法计算) 2.若(x-2y)的平方=(x+2y)的平方+m,求m
- 6如图所示,斜面体M始终处于静止状态,当物体m沿斜面下滑时有( )
- 7第(1)题:如果b分之a等于3分之2,且a不等于2,那么,(a+b-5)分之(a-b+1)等于?第(2)题:当b小于0时
- 8根据如图,可判断出下列离子方程式中错误的是( )
- 9今年的杏花,没开就落了 作文
- 10我儿子上初一老师说上新概念 有用么 一周上2节 一册得学一年么 有学英语的么
- 11美术课是报一个小时的好还是两个小时的好
- 12被动语态中sb.should be told to do sth的否定句是在to前加not还是should后加not
- 13--john may l use your car?lwant to go to the library --sure
- 144mol二氧化硫的质量是( )克,其中含有( )mol硫原子,含有( )mol氧原子,在标准状况下的体积是( )升?
- 15掷两枚骰子,两枚点数都是2的可能性是几?


