离子反应与氧化还原反应是什么关系
 暴筋女2022-10-04 11:39:543条回答
暴筋女2022-10-04 11:39:543条回答
已提交,审核后显示!提交回复
共3条回复
 swanye79 共回答了30个问题
swanye79 共回答了30个问题 |采纳率83.3%- 离子反应中 有氧化还原反应 氧化还原反应中也有离子反应 比如 二价铁和高锰酸钾溶液的反应 是离子反应 也是氧化还原反应 但离子反应也不全是氧化还原反应 比如酸碱中和 主要在于有没有电子得失 有就是氧化还原反应 没有就不是 离子反应就是离子参与的反应
- 1年前
 夕夕语 共回答了414个问题
夕夕语 共回答了414个问题 |采纳率- 没有必然的联系。
离子反应可以是氧化还原反应,也可以不是;氧化还原反应可以是离子反应也可以不是。两者的分类标准不一样。 - 1年前
 歌玲3877 共回答了6个问题
歌玲3877 共回答了6个问题 |采纳率- 只要有化合价变化的离子反应就是氧化还原反应
- 1年前
相关推荐
- 什么是离子互换反应?是不是离子反应又叫离子互换反应?
 -董小丹-1年前1
-董小丹-1年前1 -
 loveccing 共回答了16个问题
loveccing 共回答了16个问题 |采纳率93.8%离子互换反应
几种离子在同一种溶液里,若离子之间不能发生反应,就能大量共存,否则,不能大量共存.溶液中的离子之所以发生反应的实质是以降低某种离子浓度为目的,也就是说,离子反应总是向着使某种离子浓度降低的方向进行.判断离子能否大量共存可以从以下四个方面分析:(1)是否能发生复分解反应(生成难溶物、难电离、挥发性物质);(2)是否能发生氧化还原反应;(3)是否发生双水解反应;(4)是否发生络合反应.
例:复分解反应:这类离子反应又叫离子互换反应,其反应条件是:产生深沉,产生气体或产生难电离的物质如:
BaSO4+H2SO4═BaSO4↓+2H2O
Na2CO3+2HCl═2NaCl+CO2↑+2H2O
NH4Cl+NaOH═NH3·H2O+NaCl
这些反应的共同特点是:反应后溶液中自由移动的离子数目减少,因此离子互换反应一般是朝着溶液离子浓度减少的方向进行.但有少数例外,如:
CaCO3+CO2+H2O═Ca(HCO3)
此反应能够进行的原因,是因为生成了难电离的H2CO3与CaCO3反应可生成更难电离的HCO3-化合物.1年前查看全部
- 化学学习疑难有离子参加的氧化还原反应是离子反应,麻烦举例说明
 寒烟醉1年前1
寒烟醉1年前1 -
 haoaiying 共回答了15个问题
haoaiying 共回答了15个问题 |采纳率86.7%有离子参加的化学反应.离子反应的本质是某些离子浓度发生改变.常见离子反应多在水溶液中进行.根据反应原理,离子反应可分为复分解、盐类水解、氧化还原、络合4个类型;也可根据参加反应的微粒,分为离子间、离子与分子...1年前查看全部
- 一个简单的离子反应向含偏铝酸钠和氢氧化镁的溶液里滴加盐酸,氢离子先和偏铝酸根反应还是先和氢氧化镁反应?
 yp快乐飘飘1年前1
yp快乐飘飘1年前1 -
 七泉山 共回答了17个问题
七泉山 共回答了17个问题 |采纳率94.1%氢离子先和偏铝酸根反应,因为偏铝酸根是离子,碱性要比氢氧化镁强.1年前查看全部
- 给出能实现下列离子反应的化学方程式.
给出能实现下列离子反应的化学方程式.
1.BaSO3 + 2H+ =Ba2+ + H2O +SO2 mcjfh197811291年前1
mcjfh197811291年前1 -
 lbh258 共回答了18个问题
lbh258 共回答了18个问题 |采纳率88.9%BaSO3 + 2HCl =BaCl2 + H2O +SO2 ↑1年前查看全部
- 高一化学H2+O2是离子反应吗?
高一化学H2+O2是离子反应吗?
ZN+H2SO4呢? luguanfei1年前5
luguanfei1年前5 -
 何永建 共回答了17个问题
何永建 共回答了17个问题 |采纳率100%H2+O2 不是 这是其气体之间的反应
Zn+H2SO4 是
Zn+2H+=Zn2++H2↑1年前查看全部
- 离子反应关于强电解质,弱电解质,非电解质的分类.人都看晕了,怎么学啊.
 踏雪舞风1年前1
踏雪舞风1年前1 -
 789re 共回答了28个问题
789re 共回答了28个问题 |采纳率89.3%你好,
静下心来慢慢思考
强电解质:
水溶液中完全电离
如强酸强碱、绝大部分易溶盐,以及部分难溶盐在水溶液中的可溶部分(难溶盐不是不溶,是溶解度非常小,但是其溶解在水中的部分也是完全电离的)
例子:H2SO4、HCl(盐酸)、NaOH、KOH、NaCl、MgSO4、BaSO4
弱电解质:
水溶液中部分电离
如弱酸弱碱、某些盐
例子:HAc(乙酸,CH3COOH)、一水合氨NH3.H2O,乙酸铅Pb(Ac2)
强酸强碱
都是强电解质,在水溶液中完全电离
如H2SO4、HCl(盐酸)、NaOH、KOH、Ca(OH)2
非电解质
在水溶液中不电离
包括绝大多数可溶于水的有机物
如乙醇、乙醛、苯酚
补充:
另
全部的气体都是非电解质
包括HCl气体、SO2气体、NH3气体
绝大多数无机化合物也是非电解质,如五氯化磷PCl5、五氧化二磷P2O5
强电解质还包括熔融状态下完全电离的固体化合物
如碱金属氧化物、氢化物,比如氧化钠Na2O、过氧化钠Na2O2、氢化钠NaH
此外,上面说的难溶强电解质,如硫酸钡BaSO4、碳酸钙CaCO3,在熔融状态下也是强电解质
最后
电解质之类的都是基于化合物而言的
金属、石墨这类可导电的东西,白磷、金刚石这些不可导电的东西,都是单质,不是化合物,因此无所谓电解质or非电解质1年前查看全部
- 举例:氧化还原型的离子反应
 z123d1年前1
z123d1年前1 -
 lzh551205 共回答了12个问题
lzh551205 共回答了12个问题 |采纳率91.7%只要反应物或者生成物中出现离子,就是离子反应
只要化合价发生变化,就是氧化还原反应 .两个交差的就是.1年前查看全部
- .离子反应成立的条件.离子反应的条件就是有难溶的物质或难电离的物质或挥发性的物质生成.为什么氯化亚铁溶液中通入氯气:2F
.离子反应成立的条件.
离子反应的条件就是有难溶的物质或难电离的物质或挥发性的物质生成.为什么氯化亚铁溶液中通入氯气:2FeCI2===2Fe3+ +2CI-可以写成离子反应式.目前就是这个问题了. 卢舍那3651年前1
卢舍那3651年前1 -
 heryla 共回答了14个问题
heryla 共回答了14个问题 |采纳率92.9%Cl2比Fe3+氧强 化学上有很多模棱两可如离子共存时
颜色
复分解 气体 沉淀 弱电解质 所谓的离子反应条件
氧化还原 一般考强氧:MO4- Fe3+ NO3-(H+) ClO-
还:S2- I- SO32- Fe2+
字不够1年前查看全部
- 在离子反应中 弱电解质 难溶物 为反应物时可拆吗?
 清枫晓月7092101年前1
清枫晓月7092101年前1 -
 巡城夜叉 共回答了14个问题
巡城夜叉 共回答了14个问题 |采纳率92.9%解析:不可以拆,
在化学反应的离子方程式中,凡是在水溶液中不能完全电离子都不可以拆,只有全部电离的才可以拆.
“氧化物 沉淀 弱酸 弱碱 水 气体 单质 过氧化物(如过氧化钠等)”不管是在反应物还是生成物中均不可以拆.1年前查看全部
- 水解反应时,强酸的H+离子为什么不会和水电离的OH-离子反应?
水解反应时,强酸的H+离子为什么不会和水电离的OH-离子反应?
看来我表达的不是很清楚,我是说水中加入如强酸弱碱盐,酸中的H+离子为什么不会与水中OH发应?而弱碱却能与水中+-H+离子反映? dylion1年前4
dylion1年前4 -
 klashna 共回答了30个问题
klashna 共回答了30个问题 |采纳率93.3%氢氧根和氢离子反应生成水没错,但是任何反应都不能完全把反应物一点不剩得反应掉,一定会剩余一点不能完全反应掉.水中的氢氧根浓度非常低,可以达到不和氢离子反应的要求,所以……1年前查看全部
- 下列反应中,属于离子反应,同时又有颜色变化的氧化还原反应是( )
下列反应中,属于离子反应,同时又有颜色变化的氧化还原反应是( )
A. 氢气和氯气混合点燃
B. 氯化钡溶液与硫酸溶液混合
C. 把铜片放入硫酸汞溶液中
D. 氯化铁溶液与氢氧化钠溶液反应 renzha51年前4
renzha51年前4 -
 foolcatjr 共回答了18个问题
foolcatjr 共回答了18个问题 |采纳率100%解题思路:有离子参加的反应为离子反应,有元素化合价变化的反应为氧化还原反应,并结合离子的颜色来解答.A.没有离子参加,不属于离子反应,故A不选;
B.没有元素化合价的变化,不属于氧化还原反应,故B不选;
C.有离子参加,且元素的化合价变化,属于离子反应和氧化还原反应,生成硫酸铜,溶液为蓝色,故C正确;
D.没有元素的化合价变化,不属于氧化还原反应,故D错误;
故选C.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查离子反应和氧化还原反应,侧重反应类型判断的考查,明确反应中元素的化合价变化及是否有离子参加即可解答,题目难度不大.1年前查看全部
- 既是化合反应又是离子反应的反应
 pxl1191年前1
pxl1191年前1 -
 狸木子 共回答了19个问题
狸木子 共回答了19个问题 |采纳率84.2%碳酸钠+水+二氧化碳=碳酸氢钠1年前查看全部
- H2S是电解质,但为什么在离子反应方程中,不能拆成离子,
 让心碎1年前5
让心碎1年前5 -
 抗战60年H独狼 共回答了18个问题
抗战60年H独狼 共回答了18个问题 |采纳率88.9%因为它是弱电解质.写离子反应时,弱电解质、氧化物、沉淀、气体等都要写化学式.1年前查看全部
- 怎么判断离子反应中离子发生氧化还原反应而不能共存
 stonewang9141年前2
stonewang9141年前2 -
 hustkira 共回答了24个问题
hustkira 共回答了24个问题 |采纳率95.8%氧化性:XO—,XO3—,(卤族元素组成的离子)MnO4—,酸性(Cr2O7)2—,碱性(CrO4)2—,NO3—(有H+情况下有强氧化性),Fe3+
还原性:X—,HSO3—,SO3—,S2—,HS—,Fe2+
其实只需有还原性离子和氧化性离子存在的溶液都不共存.并不一定需要“强”氧化性和“强”还原性.考的最多是溶液中含Fe2+,H+,NO3—,Fe2+会被H+和NO3—共同作用被氧化成Fe3+.
上面的氧化性和还原性的离子可适当记一记.如果你也是高三生,肯定要记完啦.但如果是高一
二的同学可以挑部分常考物质来记就可以了.可买一些练习前有注释的练习册,那上面会有关于这个的详细归纳.你只需记就够了.我们高一时买的是一本叫学海导航的练习册,我们现在备考也在用那本书,还不错,归纳也挺好.1年前查看全部
- 下列有关叙述正确的是: A.四种基本反应类型中,只有置换反应属于氧化还原反应 B.离子反应的结果是自由移动的离子浓度减小
下列有关叙述正确的是:
A.四种基本反应类型中,只有置换反应属于氧化还原反应 B.离子反应的结果是自由移动的离子浓度减小 C.改变影响化学平衡的因素,化学平衡常数可能发生变化 D.Fe(OH) 3 胶体和饱和FeCl 3 溶液都呈红褐色,二者可通过丁达尔效应区分  11PJ1年前1
11PJ1年前1 -
 corainco 共回答了16个问题
corainco 共回答了16个问题 |采纳率81.3%C
1年前查看全部
- 氯气和水反应是离子反应
 纪可爱1年前2
纪可爱1年前2 -
 含霜 共回答了19个问题
含霜 共回答了19个问题 |采纳率94.7%氯气和水反应能生成盐酸和次氯酸也就是Cl2+H2O=HCl+HClO是氧化还原反应,氯气既做氧化剂也做还原剂.1年前查看全部
- 铜与浓硫酸反应是离子反应么? 答案说不是……求权威解释~
铜与浓硫酸反应是离子反应么? 答案说不是……求权威解释~
那生成的CuSO4是不是也不能写成离子? 那一野的风情1年前5
那一野的风情1年前5 -
 coletan 共回答了26个问题
coletan 共回答了26个问题 |采纳率96.2%主要解释一些浓硫酸的问题
稀硫酸没有强氧化性是因为水过多,H2SO4完全电离成了H+和SO42-,硫酸根稳定性很强,几乎没有氧化性
但是浓硫酸H2O少,不会大量电离,主要是以H2SO4分子的形式存在的,硫酸分子稳定性没有很好,氧化性强
所以Cu和浓硫酸反应实际上是Cu和硫酸分子反应
所以不是离子反应
补充,不能的,虽然是离子化合物,虽然产物中有H2O,但是这些H2O马上被H2SO4分子结合生成了H2SO4•H2O了,即CuSO4不能电离,不存在自由移动的离子,当然不能拆分写离子方程式了1年前查看全部
- 关于离子反应的化学问题FeBr2溶液与等物质的量的CL2反应::(2Fe2+)+(2Br- )+(2CL2 ) = (2
关于离子反应的化学问题
FeBr2溶液与等物质的量的CL2反应::(2Fe2+)+(2Br- )+(2CL2 ) = (2Fe3+)+(4CL-)+(Br2)这句话对吗?为什么? xjq200420031年前1
xjq200420031年前1 -
 烟台山mm 共回答了15个问题
烟台山mm 共回答了15个问题 |采纳率93.3%简单点说,假如FeBr2和Cl2各为2mol.(则Br-为4mol)
Cl2是氧化剂,而还原剂有Fe2+ 和Br-两种.
Fe2+ 的还原性比Br-的还原性强,
所以Fe2+ 先与Cl2反应,等Fe2+ 反应完,Br-才会与Cl2反应.
则2 Fe2+ + Cl2 = 2Fe3+ + 2Cl-
2mol 1mol
2Br- + Cl2 = Br2 + 2Cl-
2mol 1mol
两个方程式加起来就是你写的样子了.1年前查看全部
- 能使淀粉碘化钾试纸显蓝色的溶液为什么有强氧化性 会与那些离子反应>
能使淀粉碘化钾试纸显蓝色的溶液为什么有强氧化性 会与那些离子反应>
最好有方程式
那些离子具有较强氧化性? 韩rr时尚服饰1年前2
韩rr时尚服饰1年前2 -
 淘宝天王 共回答了18个问题
淘宝天王 共回答了18个问题 |采纳率77.8%淀粉遇碘单质I2 变蓝
能使淀粉碘化钾试纸变蓝,说明该物质能将-1价碘离子I-氧化成碘单质I2,氧化性强于I2,具有较强的氧化性.
如IO3-,Cl2水等
Cl2+2I-=I2+2Cl-;
IO3-+5I-+6H+=3I2+3H2O1年前查看全部
- 下列反应既属于离子反应,又属于氧化还原反应的是 ( ) A.分解氯酸钾制氧气 B.Zn与CuSO4 溶液的反应 C
 段一心1年前3
段一心1年前3 -
 200140955 共回答了28个问题
200140955 共回答了28个问题 |采纳率100%B
既有电子转移,也在溶液中发生了电离
A是在固体状态下,不行哟1年前查看全部
- 非电解质能否参加离子反应
 桑军1年前1
桑军1年前1 -
 油碟儿 共回答了17个问题
油碟儿 共回答了17个问题 |采纳率88.2%当然可以
比如二氧化碳是非电解质,它可以与氢氧化钠反应就是离子反应1年前查看全部
- 电离,电解质,非电解质,强电解质,弱电解质,离子反应的定义分别是什么?
 sqzhang1年前0
sqzhang1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 1.元素化合物知识网络总结2.碱金属知识网络图3.卤族元素知识网络图4.基本概念总结(1)氧化还原(2)离子反应(3)物
1.元素化合物知识网络总结
2.碱金属知识网络图
3.卤族元素知识网络图
4.基本概念总结
(1)氧化还原
(2)离子反应
(3)物质的量
知道哪个就回答哪个,越全越好!
zpc7844@tom.com OKJKRS1年前3
OKJKRS1年前3 -
 slsg2011 共回答了14个问题
slsg2011 共回答了14个问题 |采纳率64.3%留一个邮箱或QQ我帮你发过来
已经发送,收到给我回个信息1年前查看全部
- 氢氧根离子和碳酸氢根离子反应时,产物会受到阳离子的影响吗?
 1ghwlc1年前2
1ghwlc1年前2 -
 天使泡腾片 共回答了14个问题
天使泡腾片 共回答了14个问题 |采纳率71.4%OH- + HCO3- = H2O + CO32-
很显然这个方程式是强碱制弱碱的原理.
所以如果是Cu(OH)2就不能和碳酸氢根反应,因为Cu(OH)2是沉淀,碱性很弱.1年前查看全部
- 氨气生成氨水的离子反应
 jenny_开心1年前1
jenny_开心1年前1 -
 solo_pl 共回答了18个问题
solo_pl 共回答了18个问题 |采纳率83.3%NH3+H2O====(可逆)NH3·H2O====(可逆)NH4+ +OH-1年前查看全部
- 为什么离子反应中微溶的物质反应写离子,生成却写化合式?
 微名草1年前3
微名草1年前3 -
 慕磊落 共回答了19个问题
慕磊落 共回答了19个问题 |采纳率78.9%比如硫酸钙是微溶物质,硫酸钙与氯化钡之所以能反应,就是因为硫酸钙电离出的硫酸根离子与钡离子反应生成硫酸钡沉淀,所以此时硫酸钙应写离子的形式.硫酸钠与氯化钙之所以能反应,是因为硫酸根离子与钙离子反应生成硫酸钙沉淀,沉淀了当然应写化学式.注意离子反应向某种离子浓度减小的方向进行.1年前查看全部
- 关于离子反应的一些问题离子反应中,如BaCl2与Na2SO4的反应,离子反应是Ba离子与SO4离子的反应 而Cl离子与N
关于离子反应的一些问题
离子反应中,如BaCl2与Na2SO4的反应,离子反应是Ba离子与SO4离子的反应 而Cl离子与Na离子却不反应 可是那NaCl怎么来的啊?化学反应中不是说只要有生成一种沉淀 气体或水就行了吗?和离子反应不是矛盾了吗?希望大家帮下 minihouse11年前5
minihouse11年前5 -
 junhui5211 共回答了18个问题
junhui5211 共回答了18个问题 |采纳率88.9%所谓生成NaCl,只是指氯离子和钠离子在溶液中同时存在而已,并不是说它们发生了反应.在BaCl2与Na2SO4的反应的反应中,离子方程式表明真正发生反应的是钡离子和硫酸根离子,只是由于生成了硫酸钡沉淀,才使溶液变成了氯化钠溶液(恰好完全反应时).这个离子反应也是复分解反应(离子反应不一定是复分解反应),它发生的条件就是化合物交换成分可以生成硫酸钡这种沉淀.因此这是相互关联的,并不矛盾啊.1年前查看全部
- 铁语稀硝酸的两步离子反应是什么(分过量和少量)
 asdwe20071年前1
asdwe20071年前1 -
 青天大老爷 共回答了18个问题
青天大老爷 共回答了18个问题 |采纳率100%Fe遇过量稀生成Fe(NO3)3,少量HNO3生成Fe(NO3)2,因为过量的Fe把Fe(NO3)3还原为Fe(NO3)2了.
Fe(过量)+4H(+)+NO3(稀)(-)=Fe(3+)+NO↑+2H2O
3Fe(不足)+8H(+)+2NO3(稀)(-)=3Fe(2+)+2NO↑+4H2O1年前查看全部
- 化学选修4:发生离子反应的条件之一是生成气体.利用熵判据加以解释,
 那年冬季的雪1年前1
那年冬季的雪1年前1 -
 konglinghao 共回答了23个问题
konglinghao 共回答了23个问题 |采纳率73.9%若离子反应生成了气体,使整个反应体系的混乱程度增加,则这个反应的熵增加,根据熵判据,熵增的反应更易于自发没,所以:发生离子反应的条件之一是生成气体.1年前查看全部
- 两道关于离子反应的化学题1.下列各组物质的稀溶液互相反应,无论前者滴入后者,还是后者滴入前者,反应现象相同,且离子方程式
两道关于离子反应的化学题
1.下列各组物质的稀溶液互相反应,无论前者滴入后者,还是后者滴入前者,反应现象相同,且离子方程式也相同的是
A.Ba(HCO3)2 溶液与Ba(OH)2溶液
B.NaAlO2溶液与稀硫酸溶液
C.Ca(HCO3)2溶液与NaOH溶液
D.氨水与硝酸银溶液
2.某无色溶液中,若加入溴水,溴水褪色,若加入NH4HCO3,固体溶解并产生有刺激性气味的气体,则该溶液中可能大量存在的离子组是
A.Na+ K+ Cl- OH-
B.Na+ Mg2+ S2- ClO-
C.H+ Na+ (SO4)2- NO3-
D.K+ Ca2+ OH- (SO3)2-
A.... 金小强1年前1
金小强1年前1 -
 andyzhou77 共回答了23个问题
andyzhou77 共回答了23个问题 |采纳率87%1、答案:A
解析:
A:反应现象相同,都是产生白色沉淀,方程式相同,都是
Ba2+ +HCO3-+OH-===BaCO3↓+H2O
B:现象不同,方程式也不同,前者滴入后者方程式是AlO2-+4H+===Al3+ +2H2O,开始无沉淀产生
后者滴入前者是AlO2-+H+ +H2O===Al(OH)3↓,开始有沉淀产生
C:现象相同,都是生成白色沉淀.方程式不同,后者滴入前者是Ca2+ +HCO3-+OH-===CaCO3↓+H2O,前者滴入后者是Ca2+ +2HCO3-+2OH-===CaCO3↓+CO32-+2H2O
D:现象不同,前者滴入后者开始有沉淀,后者滴入前者开始无沉淀
2、答案:A
解析:若加入NH4HCO3,固体溶解并产生有刺激性气味的气体,说明有OH-,所以H+不能存在,排除C
B选项硫离子和次氯酸跟不能共存,会发生氧化还原反应
D选择亚硫酸根和钙离子会生成亚硫酸钙沉淀,不能共存
所以选择A1年前查看全部
- 关于高中离子反应中的氧化还原我最近发现离子反应的题中关于共存问题很多涉及到氧化还原反应,比如HCL和Ba(NO3)2不能
关于高中离子反应中的氧化还原
我最近发现离子反应的题中关于共存问题很多涉及到氧化还原反应,比如HCL和Ba(NO3)2不能共存因为HNO3会与CL-发生氧化还原,关于这类题目很难想到啊,怎么学呢?有相关总结吗? chastemoon1年前1
chastemoon1年前1 -
 feng51264 共回答了30个问题
feng51264 共回答了30个问题 |采纳率93.3%其实这类题目,楼主能判断出来有离子反应存在的话,建议按离子考虑而不要按照物质化学式考虑题目.遇到化学式,就把它按照溶解后相应的离子来考虑问题,这样条理容易清晰一些.
另外,最好总结一下常见有氧化性离子的氧化能力大小顺序,还原性离子的还原能力大小顺序进行比较,这是这一类题目的不二方法.
当然,有个别有氧化能力出现变化的离子,不过高中的一般只有NO3-,SO42—,这两种受到H+浓度的影响,这一类题目注意就行了.1年前查看全部
- 下列反应能否进行?是否是离子反应?属于离子反应的写出离子反应方程式
 bjaya1年前0
bjaya1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 离子反应的题某溶液中含有大量Fe2+ Fe3+ Mg2+和NH4+,其中该溶液呈强酸性,则该溶液中可以大量存在的阴离子是
离子反应的题
某溶液中含有大量Fe2+ Fe3+ Mg2+和NH4+,其中该溶液呈强酸性,则该溶液中可以大量存在的阴离子是:
A 硫酸根 B 硝酸根
C 氢氧根 D 碳酸根
答案是A
CD知道肯定错了,问题是为什么硝酸根不行? 0091101年前4
0091101年前4 -
 君君小妞 共回答了20个问题
君君小妞 共回答了20个问题 |采纳率95%硝酸根在强酸条件显强氧化性,可以把Fe2+ 氧化成Fe3+.所以,酸性条件下,硝酸根不能与Fe2+ 大量共存.1年前查看全部
- 离子反应题某无色溶液加入碳酸氢铵能产生气体,则该溶液中一定能大量共存的例子组是:就俩选项有问题C.Na+ K+ SO42
离子反应题
某无色溶液加入碳酸氢铵能产生气体,则该溶液中一定能大量共存的例子组是:
就俩选项有问题
C.Na+ K+ SO42- Cl- D.NH4+ Na+ F- ClO4-
选哪个? fdsafdasfdas1年前2
fdsafdasfdas1年前2 -
 linerl 共回答了13个问题
linerl 共回答了13个问题 |采纳率84.6%某无色溶液加入碳酸氢铵能产生气体
NH4HCO3遇到酸生成CO2,遇碱生成NH3
离子必须是要在酸或碱性条件下都能存在的
C可以
D明显不行原因是NH4+和OH-不能大量存在,因为NH3·H2O是弱电解质1年前查看全部
- 只有离子化合物参加的反应才叫离子反应吗
只有离子化合物参加的反应才叫离子反应吗
为什么氢气还原氧化铜的反应不是离子反应,氧化铜不是离子化合物吗 妖艳的烟花雨1年前1
妖艳的烟花雨1年前1 -
 BK789 共回答了16个问题
BK789 共回答了16个问题 |采纳率87.5%在水溶液中,有离子参加或有离子生成的反应,属于离子反应.(不一定是离子化合物)
氢气还原氧化铜的反应不是在水溶液中进行,不属于离子反应1年前查看全部
- 化学离子反应有固体参与吗做了一个化学题,题目是指出溶液中不是离子反应的方程式.请问像类似于硫酸钡碳酸钙这种沉淀物被溶液里
化学离子反应有固体参与吗
做了一个化学题,题目是指出溶液中不是离子反应的方程式.请问像类似于硫酸钡碳酸钙这种沉淀物被溶液里的物质溶解算是离子反应吗?离子反应到底该理解为离子参与的反应还是有离子在过程或结果中有就算是离子反应? 0592xy1年前3
0592xy1年前3 -
 syheqing 共回答了16个问题
syheqing 共回答了16个问题 |采纳率93.8%有啊.
如铁和硫酸铜反应.
离子方程式:Fe+Cu(2+)=Cu+Fe(2+)1年前查看全部
- 硫酸氢根,碳酸氢根和哪些离子反应
硫酸氢根,碳酸氢根和哪些离子反应
如题`` andy霞201年前1
andy霞201年前1 -
 矛盾2000 共回答了21个问题
矛盾2000 共回答了21个问题 |采纳率90.5%碳酸氢根易与酸或氢离子反应生成CO2与水 硫酸氢根显酸性易与碱性物质反应1年前查看全部
- 在水溶液中或熔融状态下,没有离子参加,有离子生成的反应,是否是离子反应
 daixinjie80101年前2
daixinjie80101年前2 -
 小五ff 共回答了22个问题
小五ff 共回答了22个问题 |采纳率100%首先,离子反应的定义是有离子参加的反应,不仅是反应物中有离子,在生成物中有离子的也属于离子反应.总之,在反应中涉及到离子的,不包括催化剂哦,都是离子反应.离子反应通常在水溶液中进行,当然在熔融状态中也有可能涉及离子反应,要根据离子反应的定义去判断了.1年前查看全部
- 若要证明Ba(OH)2和H2SO4反应是离子反应,该如何证明呢?
 iaiwa1年前1
iaiwa1年前1 -
 泰山626 共回答了17个问题
泰山626 共回答了17个问题 |采纳率94.1%记得好象是把硫酸先放在瓶子里通电接个小灯泡,亮,慢慢倒BA(OH)2,灯泡变慢甚至接近于不亮,再过量倒又变亮吧1年前查看全部
- 写出能实现下列离子反应的化学方程式 2Ag+ + Cu =Cu2+ + 2Ag
写出能实现下列离子反应的化学方程式 2Ag+ + Cu =Cu2+ + 2Ag
写出能实现下列离子反应的化学方程式
2Ag+ + Cu =Cu2+ + 2Ag iamase1年前3
iamase1年前3 -
 hhzec1 共回答了16个问题
hhzec1 共回答了16个问题 |采纳率87.5%2AgNO3 + Cu = Cu(NO3)2 + 2Ag1年前查看全部
- 现代化学传感器技术是研究溶液中离子反应的重要手段,某化学兴趣小组用1.0mol/LNaOH溶液滴定25mL未知浓度的盐酸
现代化学传感器技术是研究溶液中离子反应的重要手段,某化学兴趣小组用1.0mol/LNaOH溶液滴定25mL未知浓度的盐酸溶液,并用电导率传感器测定过程中的电导率,通过数据采集器自动记录测得的电导率并绘制电导率-V曲线,可显示滴定过程中的突跃现象(如图所示).对于突跃现象最合理的解释是______.
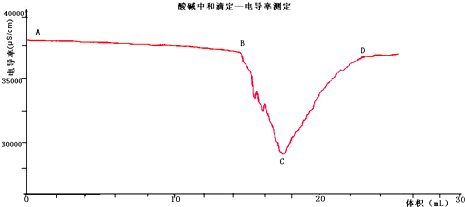
 locat1年前1
locat1年前1 -
 晨香物探 共回答了25个问题
晨香物探 共回答了25个问题 |采纳率96%解题思路:溶液导电率的大小取决于离子浓度的大小,结合酸碱中和滴定中pH突变的原因、酸碱中和的实质对电导率-V曲线分析.溶液导电率的大小取决于离子浓度的大小,离子浓度越大,导电能力越强.当接近终点时,溶液中离子浓度已非常之小,而加入的氢氧化钠溶液的离子浓度并没有变化,二者相比是非常大的,所以加入一滴离子浓度就会改变很大,出现突变的情况,C点为巧好完全中和的时刻,
故答案为:当接近终点时,一滴氢氧化钠溶液引起了离子浓度的突变.点评:
本题考点: 电解质溶液的导电性;中和滴定.
考点点评: 本题考查了溶液导电能力的判断、酸碱中和滴定实验,难度一般,可根据酸碱中和滴定中pH发生突变转移到本题导电率突变上来.1年前查看全部
- 无机反应 求二价铁和碳酸氢根离子反应及三价铁和碳酸氢根离子反应的方程式及分析
 0a11o1年前3
0a11o1年前3 -
 Vicky0127 共回答了18个问题
Vicky0127 共回答了18个问题 |采纳率88.9%Fe2+ +2HCO3- ==Fe(OH)2 沉淀 +2CO2 气体
Fe3+ +3HCO3- ==Fe(OH)3 沉淀+ 3CO2 气体
都是双水解,Fe(OH)2和 Fe(OH)3都是难容沉淀.
而HCO3- 得到不稳定的H2CO3分解成 CO2气体
沉淀和气体都有助于反应的进行.
另外 Fe(OH)2容易被空气氧化,4Fe(OH)2 +O2 + 2H2O===4Fe(OH)31年前查看全部
- 钙离子,氢氧根离子,碳酸氢根离子反应生成碳酸钙沉淀相关化学方程式
 yjzjz1年前1
yjzjz1年前1 -
 yemaoxt19 共回答了25个问题
yemaoxt19 共回答了25个问题 |采纳率80%HCO3- +OH- == CO3 2- + H2O
CO3 2- +Ca 2+ ==CaCO3(沉淀)1年前查看全部
- 向明矾溶液中逐滴加入Ba(OH)2溶液至铝离子刚好沉淀完全时,溶液PH______7(填>、<、=),离子反应总方程式:
向明矾溶液中逐滴加入Ba(OH)2溶液至铝离子刚好沉淀完全时,溶液PH______7(填>、<、=),离子反应总方程式:______
向明矾溶液中逐滴加入Ba(OH)2溶液至硫酸根离子刚好沉淀完全时,溶液PH______7(填>、<、=),离子反应总方程式:______. 雾中de风景1年前1
雾中de风景1年前1 -
 恒思远 共回答了22个问题
恒思远 共回答了22个问题 |采纳率90.9%解题思路:(1)假设明矾的物质的量为1mol,水溶液中Al3+恰好沉淀时,需氢氧根离子3mol,所以明矾与Ba(OH)2的物质的量之比为1:3,进而书写反应的离子方程式,并判断溶液的酸碱性;
(2)假设SO42-的物质的量为2mol,判断完全反应需要其它离子的物质的量,进而书写反应的离子方程式,并判断溶液的酸碱性.明矾的电离方程式为:KAl(SO4)2═K++Al3++2SO42-.
(1)假设明矾的物质的量为1mol,水溶液中含1molAl3+,明矾水溶液中Al3+恰好沉淀时,需氢氧根离子3mol,所以明矾与Ba(OH)2的物质的量之比为1:3,离子反应为2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓,此时溶液呈中性,PH=7,
故答案为:=;2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓;
(2)假设SO42-的物质的量为2mol,则明矾溶液中含有2molSO42-,1molAl3+,向明矾溶液中逐滴加入Ba(OH)2溶液至SO42-刚好沉淀完全时,需要2molBa(OH)2,即加入的Ba2+为2mol,OH-为4mol,生成2molBaSO4,1molAl3+与4molOH-反应生成1molAlO2-,反应的离子方程式为Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O,反应后溶液呈碱性,pH>7,
故答案为:>;Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O.点评:
本题考点: 离子方程式的书写.
考点点评: 本题考查离子反应方程式的书写,明确信息中Al3+恰好沉淀、硫酸根离子完全沉淀是解答本题的关键,题目难度中等.1年前查看全部
- 离子反应是否一定有气体,沉淀或者水生成
 miqiwu1年前2
miqiwu1年前2 -
 qsfhploikmz 共回答了12个问题
qsfhploikmz 共回答了12个问题 |采纳率91.7%水其实可以更广泛地定义为与溶剂混溶同时难于电离的物质,比如醇,醚,等等.1年前查看全部
- 所有的置换反应都是离子反应吗
 姿姿小女人1年前3
姿姿小女人1年前3 -
 不喜欢一个人 共回答了13个问题
不喜欢一个人 共回答了13个问题 |采纳率92.3%不是 所发生的置换反应必须在溶液中发生的才是离子反应 比如:工业上炼铁中的反应:
C+2FeO=2Fe+CO2 就不是离子反应1年前查看全部
- .下列有关H+(aq)+OH-(aq) H2O(l);ΔH=-57.3 kJ/mol的离子反应的说法正确的是 ( )
.下列有关H+(aq)+OH-(aq) H2O(l);ΔH=-57.3 kJ/mol的离子反应的说法正确的是 ( )
下列有关H+(aq)+OH-(aq) H2O(l);ΔH=-57.3 kJ/mol的离子反应的说法正确的是 ( )
A.代表所有的酸碱中和反应
B.反应物一定是强酸与强碱
C.强酸与强碱的中和反应都可以这样表示
D.代表稀的强酸与稀的强碱反应生成1 mol液态水时,放出热量57.3 kJ
答案选D,可是B和C怎么错了? wtowinner1年前3
wtowinner1年前3 -
 leftmad 共回答了21个问题
leftmad 共回答了21个问题 |采纳率85.7%B中若反应物是NaHSO4则不可以 C中若是H2SO4和Ba(OH)2则也不可1年前查看全部
- 关于离子反应的题目在PH=1的溶液中,可以大量共存的离子组是A K+ NA+ (SO4)2- (S2O3)2- B NH
关于离子反应的题目
在PH=1的溶液中,可以大量共存的离子组是
A K+ NA+ (SO4)2- (S2O3)2-
B NH4+ Mg2+ (so4)2- cl-
C Na+ k+ (HCO3)- CL-
D K+ NA+ (ALO2)- NO3-
选什么?
D中ALO2- 要跟什么离子反应 是H+反应吗 122284601年前3
122284601年前3 -
 vatr 共回答了23个问题
vatr 共回答了23个问题 |采纳率100%B
H+ + AlO2- + H2O====Al(oh)3 算式电离 所以不能共存
H+ +(HCO3)-====CO2 + (CO3)2-1年前查看全部
- 高三复习了,求化学“离子反应”的做题方法,如化学式配平的方法,离子共存问题离子方程式咋判断对错
高三复习了,求化学“离子反应”的做题方法,如化学式配平的方法,离子共存问题离子方程式咋判断对错
还有“物质分析”,“条件不同,相同反应物间的反应不同”的问题 容rong1年前1
容rong1年前1 -
 yibing1021 共回答了14个问题
yibing1021 共回答了14个问题 |采纳率85.7%不管离子反应还是方程式配平,都必须满足“两大守恒”,即 电荷(电子)守恒; 物料(元素)守恒;其次还要看是否符合常规逻辑!离子共存问题主要看这些离子间能否相互反映生成“三大类物质”,即 挥发性物质(气体),难溶物(沉淀),弱电解质(水)!其次还要注意前提条件:看清是碱性环境还是酸性环境,碱性时在离子中加HO- ,酸性加H+ 有些常见的共存性问题建议你直接背下来,遇见时直接就可以判定了...
学过的时间久了,好多都记不起了,希望对你有用1年前查看全部
大家在问
- 1时光是记忆的橡皮擦 求对上一句伤感点的句子
- 2在等差数列{an}中,a1=1,am=15,前m项的和Sm=64.(1)求数列{an}的通项公式
- 3第8页,第6页,第32页,第34页的第二题,第36页,第38页的第一题,第24页的第二题.
- 4一幅漫画的启示作文450啊!啊啊啊啊啊啊啊
- 5世界上迁徙路程最远的动物是什么?
- 6什么东西吸水快0.5——1秒左右最好能吸掉80%左右的水,我想让雨伞的水吸掉,就是把雨伞放进一个圆柱形桶里,然后立刻拿出
- 7一个电热器接在220V交流电路上,发热功率为1kW,如果把它接在直流电路中,使其功率也是1kW,直流电路的电压必须是__
- 8请教几个题,七年级下学期生物的人体缺维生素a易患——应多吃——,人体缺维生素b1易—患—,应多吃——,人体缺维生素c易患
- 911分之9减3分之2=多少 7分之4加42分之5=多少
- 10Is that your ruler?(作否定回答)
- 11已知:如图,⊙O1与⊙O2外切于点P,直线AB过点P交⊙O1于A,交⊙O2于B,点C、D分别为⊙O1、⊙O2上的点,且∠
- 12I find _____English is very difficult for me .A spoken B spe
- 13明明上午9时开始做家务.整理房间用了20分钟擦家具比平时多用了5分钟.明明做完这些家务用了多少分
- 14一张长方形纸长30厘米,宽18厘米,要剪成一些正方形纸,不能浪费.正方形的边长最大是多少?
- 15函数y=sinx|sinx|+|cosx|cosx+tanx|tanx|的值域是______.
