铁溶于一定浓度的硝酸溶液时,发生反应的离子方程式为:aFe+bNO3-+cH+=dFe2++fFe3++gNO↑+hNO
 1704480472022-10-04 11:39:541条回答
1704480472022-10-04 11:39:541条回答A.2d+3f=3g+h
B.反应中每消耗5.6 g Fe,转移0.2mol~0.3mol e-
C.HNO3的氧化性大于Fe3+
D.当a不变时,d随着b的增大而增大

已提交,审核后显示!提交回复
共1条回复
 gzwf_1 共回答了23个问题
gzwf_1 共回答了23个问题 |采纳率95.7%- 解题思路:反应中Fe元素化合价分别由0价升高到+2价、+3价,N元素化合价分别由+5价降低到+4价、+2价,结合得失电子守恒和质量守恒解答,氧化还原反应中,氧化剂氧化性大于氧化产物氧化性,以此解答该题.
A.由得失电子可知,N元素化合价降低,Fe元素化合价升高,氧化剂和还原剂得失电子数目相等,表现为化合价升高总数等于降低总数,则有(2-0)d+(3-0)f=(5-2)g+(5-4)h,即2d+3f=3g+h,故A正确;
B.反应中Fe被还原,可生成Fe2+或Fe3+,则0.1molFe失电子的物质的量介于0.2mol~0.3mol,故B正确;
C.反应中HNO3为氧化剂,Fe3+为氧化产物,则HNO3的氧化性大于Fe3+,故C正确;
D.当a不变时,d随着b的增大而减小,硝酸过量时可完全生成Fe3+,故D错误.
故选D.点评:
本题考点: 氧化还原反应的计算;氧化还原反应.
考点点评: 本题考查氧化还原反应,侧重于学生的分析能力和计算能力的考查,为高考常见题型,注意从守恒的角度分析氧化还原反应,难度中等. - 1年前
相关推荐
- 动物的运动依赖于一定的身体结构.下列有关运动系统的结构和功能的叙述正确的是( ) A.骨骼肌的组成包括中间的肌腱和两端
动物的运动依赖于一定的身体结构.下列有关运动系统的结构和功能的叙述正确的是( ) A.骨骼肌的组成包括中间的肌腱和两端的肌腹两部分 B.骨的运动要靠骨骼肌的牵拉 C.所有动物的体内都有骨骼 D.动物的运动只靠运动系统控制来完成  路归人1年前1
路归人1年前1 -
 纷飞狂野 共回答了18个问题
纷飞狂野 共回答了18个问题 |采纳率77.8%A、骨骼肌包括肌腱和肌腹两部分,骨骼肌中间较粗的部分叫肌腹,两端较细的呈乳白色的部分叫肌腱.不符合题意.
肌腱可绕过关节连在不同的骨上.骨骼肌有受刺激而收缩的特性.当骨骼肌受神经传来的刺激收缩时,就会牵动骨绕关节活动,于是躯体就会产生运动.
B、骨骼肌有受刺激而收缩的特性.当骨骼肌受神经传来的刺激收缩时,就会牵动骨绕关节活动,于是躯体就会产生运动.但骨骼肌只能收缩牵拉骨而不能推开骨,因此骨的运动要靠骨骼肌的牵拉,与骨相连的肌肉总是由两组肌肉相互配合活动的.符合题意.
C、有的动物体内有骨骼,如鱼、青蛙等,有的动物体内无骨骼,如蚯蚓、河蚌等.不符合题意.
D、完成任何一个运动都要有神经系统的调节,有骨、骨骼肌、关节的共同参与,多组肌肉的协调作用,才能完成.不符合题意.
故选:B1年前查看全部
- 有几个生物题,1、生物的生存是( )于一定的环境.影响生物的环境因素分为( )和( )两类,前者包括光、空气、水.2、生
有几个生物题,
1、生物的生存是( )于一定的环境.影响生物的环境因素分为( )和( )两类,前者包括光、空气、水.
2、生物因素是指影响生物生活的( ),生物与生物之间最常见的关系有( )关系、( )关系、( )关系.
3、科学探究的一般过程包括( )、( )、( )、( )和( ).设计探究实验的关键是( )和( ). woman21cn1年前1
woman21cn1年前1 -
 dwjyok 共回答了18个问题
dwjyok 共回答了18个问题 |采纳率83.3%1.依赖,非生物因素和生物因素(顺序不能调换).
2.其他生物,捕食,竞争,互利共生
3.提出问题、作出假设、设计实验、实验验证、得出结论;作出假设和设计实验1年前查看全部
- 甲、乙、丙三位同学对氯化镁样品(仅含氯化钠杂质)进行如下检测:各取5.0g样品溶于一定量的水中得到25.0g溶液,再分别
甲、乙、丙三位同学对氯化镁样品(仅含氯化钠杂质)进行如下检测:各取5.0g样品溶于一定量的水中得到25.0g溶液,再分别加入不同质量、相同溶质质量分数的氢氧化钠溶液,反应得到沉淀的实验数据如下表:
试回答下列问题:甲 乙 丙 加入氢氧化钠溶液质量 (g) 20.0 40.0 60.0 反应得到沉淀的质量 (g) 1.45 2.9 2.9
(1)上述实验中,丙丙同学所用的氢氧化钠溶液过量.
(2)求样品中氯化镁的含量.
(3)计算乙同学实验后所得溶液中的氯化钠的质量分数(结果精确到0.1%). 笨拉灯9111年前1
笨拉灯9111年前1 -
 大人133 共回答了16个问题
大人133 共回答了16个问题 |采纳率100%(1)由甲的实验数据可知,加入20.0g氢氧化钠溶液可生成1.45g沉淀;乙实验加入40.0g氢氧化钠溶液得到2.9g沉淀,而丙实验加入60.0g氢氧化钠溶液,得到沉淀质量仍为2.9g,因此可确定丙所用氢氧化钠溶液一定过量,且乙实验中氢氧化钠与氯化镁恰好完全反应;
(2)设生成2.9g氢氧化镁沉淀时,消耗氯化镁的质量为x,同时生成氯化钠的质量为y
MgCl2+2NaOH═Mg(OH)2↓+2NaCl
95 58 117
x 2.9g y
95
58=
x
2.9g x=4.75g
58
117=
2.9g
y y=5.85g
样品中氯化镁的质量分数是:
4.75g
5.0g×100%=95%
(3)乙同学实验后所得溶液中的溶质的质量分数=
5g-4.75g+5.85g
25.0g+40g-2.9g×100%=9.8%
故答为:(2)样品中氯化镁的质量为95%;(3)乙同学实验后所得溶液中的氯化钠的质量分数是9.8%.1年前查看全部
- 甲、乙、丙三位同学对氯化镁样品(仅含氯化钠杂质)进行如下检测:各取5.0g样品溶于一定量的水中得到25.Og溶液,再分别
甲、乙、丙三位同学对氯化镁样品(仅含氯化钠杂质)进行如下检测:各取5.0g样品溶于一定量的水中得到25.Og溶液,再分别加入不同质量,溶质质量分数为10%的氢氧化钠溶液,反应得到沉淀的实验数据如下表:
试回答下列问题:甲 乙 丙 加入氢氧化钠溶液质量 (g) 35.0 40.0 45.0 反应得到沉淀的质量 (g) 2.5 2.9 2.9
(1)上述实验中, 同学所用的氢氧化钠溶液一定过量.
(2)求样品中氯化镁的含量(写出计算过程,结果精确到0.1%,下同).
(3)计算乙同学实验后所得溶液中的氯化钠的质量分数. lookingforid1年前1
lookingforid1年前1 -
 terryfsn 共回答了19个问题
terryfsn 共回答了19个问题 |采纳率94.7%/1年前查看全部
- 人胰蛋白酶作用于一定量的某种物质(底物),温度和pH保持在最适值,生成物量与反应时间关系如下图,请回答下列问题: (1)
人胰蛋白酶作用于一定量的某种物质(底物),温度和pH保持在最适值,生成物量与反应时间关系如下图,请回答下列问题: 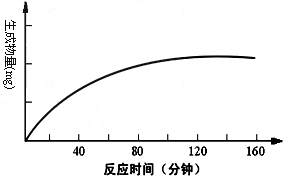
(1)该酶作用的底物是 。
(2)在140分钟后,曲线变成水平,这是因为 。
(3)若增加胰蛋白酶浓度,其他条件不变,请在原图上画出生成物量变化的示意曲线。
(4)若胰蛋白酶浓度和其他条件不变,反应液pH由2逐渐升高到10,则酶催化反应的速度将 ________ ,原因是 。 zyy12341年前1
zyy12341年前1 -
 maodan3322 共回答了22个问题
maodan3322 共回答了22个问题 |采纳率100%1年前查看全部
- 请回答下列有关酶的问题.(1)如图1表示在最适温度和最适pH条件下,人体内某种酶作用于一定量的适宜物质(底物),生成物量
请回答下列有关酶的问题.

(1)如图1表示在最适温度和最适pH条件下,人体内某种酶作用于一定量的适宜物质(底物),生成物量与反应时间的关系.若其他条件不变,将酶的浓度增加一倍,请在图一中画出生成物量变化的曲线.______
(2)如图2中能正确表示胰蛋白酶对底物的分解速度和温度关系的是______.
(3)酶之所以能够加速化学反应的速率是因为它能______.
(4)为探究高温对酶活性的影响,某同学设计了如下实验:
实验过程与结果:
①取两个洁净的试管,分别编号1和2;
②在1号试管中加入2mL 3%新鲜过氧化氢溶液,2号试管中加入1mL 20%新鲜肝脏研磨液.将两只试管分别置于80℃恒温水浴5分钟;
③将2号试管中的肝脏研磨液加入1号管,振荡摇匀,再置于80℃恒温水浴5分钟,结果未观察到气泡产生.
结果分析:推断观察不到气泡产生的两种可能原因:______. yeguozhang1年前1
yeguozhang1年前1 -
 一条会飞的鱼 共回答了15个问题
一条会飞的鱼 共回答了15个问题 |采纳率100%解题思路:此题结合曲图和实验考查影响酶活性的主要因素以及酶促反应的主要原理.酶的活性主要受到温度和pH值的影响,另外酶的浓度和底物的浓度也会影响酶促反应速率,酶促反应的原理使降低化学反应的活化能,据此答题.(1)图1表示在最适温度和最适pH条件下,人体内某种酶作用于一定量的适宜物质(底物),生成物量与反应时间的关系.若其他条件不变,将酶的浓度增加一倍,会使酶促反应速率也随之增加一倍,但是反应的平衡点不变,据此作图.
(2)酶的活性需要适宜的温度,在最适温度条件下,酶的催化活性达到最大值,人体胰蛋白酶的最适温度接近人体温度37℃左右,在此温度催化效率最高,低于最适温度时,酶的催化效率比较低,由此可以看出,符合要求的是C.
(3)酶促反应的原理是降低化学反应的活化能来加快化学反应的进行.
(4)酶的作用需要适宜的温度,没有观察到气泡的产生,可能是因为温度过高,使酶失去了活性导致实验失败;也可能是因为高温条件下过氧化氢已经全部分解,此时由于底物已经消失,也不会观察到预期的实验现象.
故答案为:
(1)
(2)C
(3)降低化学反应的活化能
(4)高温使过氧化氢酶变性,失去活性;高温使底物过氧化氢全部分解完毕.
(或:既有过氧化氢酶变性,又有底物被全部分解)点评:
本题考点: 探究影响酶活性的因素;酶促反应的原理.
考点点评: 此题结合曲线以及实验设计考查酶活性的影响因素以及酶促反应的原理,难度适中,比较综合,意在考查学生对基础知识的理解与综合运用,识图以及作图能力等.1年前查看全部
- 在t℃时,将ag硝酸钾溶于一定量的水中,配成V mL的饱和溶液(密度为ρg/cm3),
在t℃时,将ag硝酸钾溶于一定量的水中,配成V mL的饱和溶液(密度为ρg/cm3),
则:(1)该溶液的质量分数为
(2)t℃时,硝酸钾的溶解度为 我是刘敏1年前1
我是刘敏1年前1 -
 梦也飘摇 共回答了19个问题
梦也飘摇 共回答了19个问题 |采纳率78.9%溶液质量 m = Vρ g
质量分数 ω = a / (Vρ) * 100% = 100a / (Vρ) %
设溶解度为S,根据饱和溶液质量分数与溶解度的关系,ω = S/(100+S)
第一问求得ω = a / (Vρ)
所以有方程 a / (Vρ) = S/(100+S)
解得S = 100a / (Vρ-a) g
即溶解度为 100a / (Vρ-a) g1年前查看全部
- 将KCl和Ca(OH)2混合物1.86g全部溶于一定量水中形成稀溶液,再缓缓通入足量的CO2气体.当生成沉淀的质量刚好最
将KCl和Ca(OH)2混合物1.86g全部溶于一定量水中形成稀溶液,再缓缓通入足量的CO2气体.当生成沉淀的质量刚好最大时,消耗CO2的0.44g.

(1)原混合物中Ca(OH)2的质量为______g;
(2)写出溶液中生成沉淀的质量m(g)与通入CO2的质量M(g)之间的函数表达式
①______;②______;
(3)在图示坐标系上,画出生成沉淀的质量m(g)与通入CO2的质量M(g)的关系曲线. mouse_9991年前1
mouse_9991年前1 -
 hhw23 共回答了17个问题
hhw23 共回答了17个问题 |采纳率94.1%解题思路:(1)根据二氧化碳的质量计算出消耗的氢氧化钙的质量;(2)根据二氧化碳的取值由0到0.44g为变量,设二氧化碳的质量为M,生成沉淀质量m通过方程式写出比例式,求出二者关系,二氧化碳通过量后还能发生另一种化学反应;(3)取极值法求出最大值和最小值,进行连线.(1)设与0.44g二氧化碳反应消耗氢氧化钙的质量为X,生成沉淀质量为Y则:
CO2+Ca(OH)2═CaCO3↓+H2O
44 74 100
0.44g X Y
根据:[44/74=
0.44g
X]解得X=0.74g;根据[44/100=
0.44g
Y]解得Y=1g.
(2)CO2+Ca(OH)2═CaCO3↓+H2O
44 100
M m
根据:[44/100=
M
m]解得m=[100M/44],M的取值为0≤M<0.44;
CaCO3+H2O+CO2═Ca(HCO3)2
100 44
m M
根据:[100/44=
m
M]解得m=[100M/44],但是这是二氧化碳多于0.44g后消耗的碳酸钙的质量关系,所以还剩碳酸钙的质量等于生成碳酸钙最大值1减去消耗的碳酸钙的质量即:m=1-
100(M−0.44)
44或[88−100M/44]或2-(100M/44)
M取值范围:0.44≤M≤0.88
(3)生成碳酸钙最大值是1,再通入二氧化碳碳酸钙就会减少,当通到0.88g二氧化碳碳酸钙正好被消耗完.把0点、1g、0.88三个点连接起来即可.
故答案为:(1)0.74
(2)①0≤M<0.44 m=100M/44
②0.44≤M≤0.88 m=1-
100(M−0.44)
44或[88−100M/44]或2-(100M/44)或其它合理答案
(4)(作图必须完全正确方可得分,见图)
点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 解答本题容易出错的地方是碳酸钙与二氧化碳、水反应生成碳酸氢钙,使沉淀减少.1年前查看全部
- 铁、铝各1mol组成的混合物溶于一定量的盐酸,恰好完全反应后,再加入3mol Na2O2固体使之充分反应,最终
铁、铝各1mol组成的混合物溶于一定量的盐酸,恰好完全反应后,再加入3mol Na2O2固体使之充分反应,最终产物是( )
A.Fe(OH)2、Al(OH)3、NaCl
B.Fe(OH)2、Al(OH)3、NaAlO2、NaCl
C.Fe(OH)3、NaAlO2、NaCl
D.Fe(OH)3、Al(OH)3、NaAlO2、NaCl loveww2411年前1
loveww2411年前1 -
 chukai03 共回答了26个问题
chukai03 共回答了26个问题 |采纳率92.3%解题思路:Fe、Al的混合物与盐酸发生反应:Fe+2HCl=FeCl2+H2↑,2Al+6HCl=2AlCl3+3H2↑,恰好完全反应后,再加入3mol Na2O2固体使之充分反应,因为Na2O2是强氧化剂,而且遇水生成NaOH,所以发生反应:2Na2O2+2H2O=4NaOH+O2↑,FeCl2+2NaOH=Fe(OH)2↓+2NaCl,
于是Fe2+氧化成Fe3+,并沉淀,AlCl3+4NaOH=NaAlO2+3NaCl+2H2O.
3molNa2O2固体可生成6mol氢氧化钠,铁、铝各1mol组成的混合物,溶于一定量的盐酸,恰好完全反应后,
1mol固体铝,最终生成1molNaAlO2,消耗4mol氢氧化钠,剩余2mol氢氧化钠,1mol固体铁,最终生成1molFe(OH)3,所需氢氧化钠2mol,
因 Na2O2是强氧化剂,Fe2+氧化成Fe3+,所以最终产物是Fe(OH)3、NaAlO2、NaCl.Na2O2是强氧化剂,可将Fe2+氧化成Fe3+,3molNa2O2固体溶于水发生:2Na2O2+2H2O=4NaOH+O2↑,生成6mol氢氧化钠.
1mol固体铝,与盐酸发生反应:2Al+6HCl=2AlCl3+3H2↑,生成1molAlCl3,向溶液中再加入3molNa2O2固体,AlCl3与氢氧化钠反应:AlCl3+4NaOH=NaAlO2+3NaCl+2H2O,消耗4mol氢氧化钠,最终生成1molNaAlO2和3molNaCl,剩余2mol氢氧化钠;
1mol固体铁,与盐酸发生反应:Fe+2HCl=FeCl2+H2↑,生成1molFeCl2,向溶液中再加入3molNa2O2固体,AlCl3与氢氧化钠反应:FeCl2+2NaOH=Fe(OH)2↓+2NaCl,消耗2mol氢氧化钠,生成1molFe(OH)2和2molNaCl,Na2O2是强氧化剂,可将Fe2+氧化成Fe3+,氢氧化亚铁在氧气和水的作用下生成氢氧化铁,4Fe(OH)2+O2+2H2O=4Fe(OH)3,所以最终生成1molFe(OH)3和2molNaCl;
综上最终产物是1molNaAlO2、1molFe(OH)3和5molNaCl,
故选C.点评:
本题考点: 铁的化学性质;铝的化学性质.
考点点评: 本题考查混合物铁、铝反应产物的定性判断,掌握铁、铝、过氧化钠的性质并根据方程式确定发生的反应是解题关键,题目难度中等.1年前查看全部
- 铜和镁的合金2.14g完全溶于一定浓度的硝酸,若反应中硝酸被还原为NO2、NO、N2O 三种气体且标准状况下体
铜和镁的合金2.14g完全溶于一定浓度的硝酸,若反应中硝酸被还原为NO2、NO、N2O 三种气体且标准状况下体积均为0.224L,在反应后的溶液中,加入足量的氢氧化钠溶液,生成的沉淀经过滤、洗涤、干燥后称量,质量为( )
A.3.12 g
B.4.18 g
C.4.68 g
D.5.08 g siiisy1年前1
siiisy1年前1 -
 做我想做 共回答了10个问题
做我想做 共回答了10个问题 |采纳率90%解题思路:硝酸被还原为NO2、NO、N2O 三种气体且标准状况下体积均为0.224L,即物质的量均为0.01mol,根据氮元素的化合价变化计算转移电子物质的量.最后沉淀为Cu(OH)2、Mg(OH)2,金属提供的电子的物质的量等于氢氧根离子的物质的量,故最后沉淀质量等于金属的质量加氢氧根离子的质量.硝酸被还原为NO2、NO、N2O 三种气体且标准状况下体积均为0.224L,即物质的量均为[0.224L/22.4L/mol]=0.01mol,所以转移的电子的物质的量为0.01mol×(5-4)+0.01mol×(5-2)+0.01mol×2×(5-1)=0.12mol.
最后沉淀为Cu(OH)2、Mg(OH)2,金属提供的电子的物质的量等于氢氧根离子的物质的量,故最后沉淀质量等于2.14g+0.12mol×17g/mol=4.18g.
故选:B.点评:
本题考点: 有关混合物反应的计算;氧化还原反应的计算.
考点点评: 考查混合物的计算,难度中等,解题关键是判断金属提供的电子的物质的量等于氢氧根离子的物质的量.1年前查看全部
- t度时将ag硝酸钾溶于一定量的水中配成vml的饱和溶液密度p 则溶液的质量分数为? t度时硝酸钾的溶解度、
 xx11291年前1
xx11291年前1 -
 清风163 共回答了18个问题
清风163 共回答了18个问题 |采纳率88.9%溶液的质量为:Vp
硝酸钾的质量分数为:a/Vp
t度时,溶解ag硝酸钾的水的质量为:Vp-a g
溶解度的定义是一定条件下,100g水溶解溶剂的质量
故a/(Vp-a)=x/100
故t度时硝酸钾的溶解度为:100a/(Vp-a) g1年前查看全部
- 甲、乙、丙三位同学对氯化镁样品(仅含氯化钠杂质)进行如下检测:各取5.0 g样品溶于一定量的水中得到25.
 37078531年前3
37078531年前3 -
 pibinmei 共回答了12个问题
pibinmei 共回答了12个问题 |采纳率91.7%MgCl2+2NaOH====Mg(OH)2↓+2NaCl
95 80 58 117
x 4g 2.9g y
设mMgCl2为x,mNaCl为y
x=4.75 y=5.85
m溶液=25g(氯化镁溶液)+40g(氢氧化钠溶液)-2.9g(生成沉淀不算在溶液里)=62.1g
m杂质=5g-mMgCl2=0.25g
mNaCl=5.85g+0.25g=6.1g
NaCl%=6.1g62.1g*100%≈9.8%1年前查看全部
- 将3.9gMg、Al合金溶于一定物质的量浓度的HCl溶液400mL中,刚好完全反应,经检测合金和盐酸都无剩余.
将3.9gMg、Al合金溶于一定物质的量浓度的HCl溶液400mL中,刚好完全反应,经检测合金和盐酸都无剩余.
将3.9gMg、Al合金溶于一定物质的量浓度的HCl溶液400mL中,刚好完全反应,经检测合金和盐酸都无剩余,再向反应后的溶液中加入1mol/L的NaOH溶液生成沉淀.当沉淀量最大时,溶液的总体积刚好为合金溶解时的体积的两倍,假设完全反应(不考虑体积变化)问题略.
这道题的答案我知道但是我不懂,还望高手相助,从文字中可得出沉淀最大值时消耗的氢氧化钠的体积是400mL.疑问在此,为什么是400mL?400mL从何而得? yyq1234651年前3
yyq1234651年前3 -
 肥果 共回答了17个问题
肥果 共回答了17个问题 |采纳率82.4%稀盐酸是一元强酸,NaOH是一元强碱.都是一元的,这点很重要.Mg,Al与盐酸反应生成物你应该清楚,是Mg2+.Al3+.生成的沉淀分别为Mg(OH)2,Al(OH)3.
但是要注意Al(OH)3+OH-=====AlO2-+2H2O
所以当生成沉淀量最大时一定是恰好反应的时刻.由题干知溶液的总体积刚好为合金溶解时的体积的两倍,即反应后体积是HCl的2倍,故是400ml的NaOH.
我们进一步可以得出稀盐酸的物质的量浓度也是1mol/L1年前查看全部
- 生物的生存依赖于一定的环境.生物生存所需要的基本条件是一样的,它们都需要______、______、______和___
生物的生存依赖于一定的环境.生物生存所需要的基本条件是一样的,它们都需要______、______、______和______,还有______和______.
 andy李1年前1
andy李1年前1 -
 夏雨1128 共回答了27个问题
夏雨1128 共回答了27个问题 |采纳率88.9%解题思路:生物生存的环境不仅是指生存的地点,还包括环境中影响生物生活的各种因素叫环境因素,如光、温度、水、空气、土壤等.生物的生存依赖于一定的环境.生物生存所需要的基本条件是一样的,它们都需要营养物质、阳光、空气和水,还有适宜的温度和一定的生存空间.
故答案为:营养物质;阳光;空气;水;适宜的温度;一定的生存空间点评:
本题考点: 生物生存的环境条件.
考点点评: 解答此类题目的关键是知道生物生存的基本条件.1年前查看全部
- 已知单质铁溶于一定浓度的硝酸溶液中反应的离子方程式为:aFe+bNO3-+cH+=dFe2++fFe3++gNO↑+hN
已知单质铁溶于一定浓度的硝酸溶液中反应的离子方程式为:aFe+bNO3-+cH+=dFe2++fFe3++gNO↑+hN2O↑+kH2O(化学计量数均为正整数).若a=12,且铁与硝酸恰好完全反应,则b的取值范围( )
A. 6<b<12
B. 30<b<48
C. 8<b<12
D. 6<b<9 adamsgao1年前3
adamsgao1年前3 -
 幸福一瞬间9 共回答了20个问题
幸福一瞬间9 共回答了20个问题 |采纳率100%解题思路:采用极限法进行分析解答:
当铁失去的电子最少,即铁完全转化为Fe2+,一个硝酸根离子得4个电子,即参加氧化还原反应的硝酸根离子全部被氧化为N2O时,消耗的硝酸最少.
当铁失去的电子最多,即铁完全转化为Fe3+,一个硝酸根离子得3个电子,即参加氧化还原反应的硝酸根离子全部被氧化为NO时,消耗的硝酸最多.当铁失去的电子最少,即铁完全转化为Fe2+,一个硝酸根离子得4个电子,即参加氧化还原反应的硝酸根离子全部被氧化为N2O时,消耗的硝酸最少.
所以该反应方程式为:
4Fe+2NO3-+10H+=4Fe2++N2O↑+5H2O
4 2
12 b
b=6
当铁失去的电子最多,即铁完全转化为Fe3+,一个硝酸根离子得3个电子,即参加氧化还原反应的硝酸根离子全部被氧化为NO时,消耗的硝酸最多.
发生的反应方程式为:
Fe+NO3-+2H+=Fe3++NO↑+H2O
1 1
12 b
b=12
所以b的取值范围为:6<b<12.
故选A.点评:
本题考点: 氧化还原反应的计算.
考点点评: 本题考查了有关氧化还原反应的计算,难度较大,本题中氧化产物和还原产物都是两种,且该方程式中的计量数未知,所以可用极限法进行配平,然后根据铁与硝酸根离子的关系式进行计算.1年前查看全部
- (2012•日照)人体的运动依赖于一定的身体结构,下列有关该结构的叙述不正确的是( )
(2012•日照)人体的运动依赖于一定的身体结构,下列有关该结构的叙述不正确的是( )
A.关节在运动中起支点作用
B.完成一个动作需两组肌肉参与
C.关节包括关节头、关节窝、关节囊
D.骨骼肌的两端附着在不同的骨上 lb352511年前1
lb352511年前1 -
 懵懵懂懂1013 共回答了11个问题
懵懵懂懂1013 共回答了11个问题 |采纳率90.9%解题思路:本题考查骨、关节和骨骼肌的协调配合,人体完成一个运动都要有神经系统的调节,有骨、骨骼肌、关节的共同参与,多组肌肉的协调作用,才能完成.骨的位置的变化产生运动,但是骨本身是不能运动的.骨的运动要靠骨骼肌的牵拉.骨骼肌包括中间较粗的肌腹和两端较细的肌腱(乳白色),同一块骨骼肌的两端肌腱绕过关节连在不同的骨上.骨骼肌有受刺激而收缩的特性,当骨骼肌受神经传来的刺激收缩时,就会牵动骨绕着关节活动,于是躯体就会产生运动.但骨骼肌只能收缩牵拉骨而不能将骨推开,因此与骨相连的肌肉总是由两组肌肉相互配合活动的.在运动中,神经系统起调节作用,骨起杠杆的作用,关节起支点作用,骨骼肌起动力作用.可见,人体完成一个运动都要有神经系统的调节,有骨、骨骼肌、关节的共同参与,多组肌肉的协调作用,才能完成.可见,选项C不符合题意.
故选:C点评:
本题考点: 关节的基本结构和功能;骨骼肌与人体主要的骨骼肌群;骨骼肌在运动中的协作关系.
考点点评: 当骨骼肌受神经传来的兴奋刺激收缩时,就会牵动着它所附着的骨,绕着关节活动,于是躯体就产生了运动.1年前查看全部
- 下列叙述中,错误的是( )A.生物的生存是依赖于一定的环境的B.生物在生存发展中不断适应环境C.生物也影响和改变着环境
下列叙述中,错误的是( )
A.生物的生存是依赖于一定的环境的
B.生物在生存发展中不断适应环境
C.生物也影响和改变着环境
D.生物与环境是有关系的,生物的生存是受环境主宰的 忻思1年前1
忻思1年前1 -
 GNBGA 共回答了20个问题
GNBGA 共回答了20个问题 |采纳率85%解题思路:此题考察的知识点是环境对生物的影响.解答时可以从生物与环境相互影响方面来切入.环境影响生物如沙漠干旱缺水植物稀少,南橘北枳;生物必须适应环境,如寒带生物北极熊耐寒才能生存,河马不耐寒就无法生存;生物影响环境如蚯蚓改良土壤,千里之堤毁于蚁穴,表明生物对环境有影响.
故选:D.点评:
本题考点: 环境对生物的影响;生物对环境的适应;生物对环境的影响.
考点点评: 解答此类题目的关键是理解环境与生物相互影响.1年前查看全部
- 将过氧化钠,盐酸,三氧化二铝 一起溶于一定量水中完全反应后,测得溶液只有Na离子,偏氯酸根离子.氯离子
将过氧化钠,盐酸,三氧化二铝 一起溶于一定量水中完全反应后,测得溶液只有Na离子,偏氯酸根离子.氯离子
将过氧化钠,盐酸,三氧化二铝 一起溶于一定量水中完全反应后,测得溶液中只有钠离子.偏氯酸根离子.氯离子则过氧化钠,盐酸,三氧化二铝的n比不可能是
A.2:2:1 B.3:3:1 C.3:4:1 D.1:1:4
选B,为啥? liyonggb111年前4
liyonggb111年前4 -
 kunpeng830 共回答了21个问题
kunpeng830 共回答了21个问题 |采纳率100%答案:BD.“测得溶液中只有钠离子、偏氯酸根离子、氯离子”说明溶液中只有:NaCI、NaAIO2则n(Na元素)=n(CI元素)+n(AI元素)即,2n(Na2O2)=n(HCI)+2n(AI2O3)根据上述关系判断A:2*2=2+2*1 满足 对B:2*3==3+2*1 不满足...1年前查看全部
- 胰蛋白酶作用于一定量 胰蛋白酶作用于一定量的某种物质(底物),温度保持37℃,pH保持在最适值,生成物量与反应时间关系如
胰蛋白酶作用于一定量
胰蛋白酶作用于一定量的某种物质(底物),温度保持37℃,pH保持在最适值,生成物量与反应时间关系如下图所示,请回答下列问题. 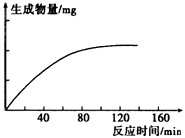
(1)该酶作用的底物是___________.
(2)在140min后,曲线变成水平,这是因为___________________.
(3)若增加胰蛋白酶浓度,其他条件不变,请在原图上画出生成物量变化的示意曲线.
(4)若胰蛋白酶浓度和其他条件不变,反应液pH由2逐渐升高到10,则酶催化反应的速度将_______,原因是____________________.
(5)下图中能正确表示胰蛋白酶对底物的分解速度和温度关系的是____________.
 2473311151年前1
2473311151年前1 -
 qingchenyu 共回答了15个问题
qingchenyu 共回答了15个问题 |采纳率73.3%1年前查看全部
- (2014•上海模拟)某一元弱酸HX的相对分子质量为M,t℃时,将ag HX溶解于一定量的水中恰好形成饱和溶液
(2014•上海模拟)某一元弱酸HX的相对分子质量为M,t℃时,将ag HX溶解于一定量的水中恰好形成饱和溶液V mL,其密度为dg/cm3,其中n(X-)=b mol.关于该溶液的说法错误的是( )
A.溶液中c(H+)-c(OH-)=[1000b/V]
B.物质的量浓度c(HX)=1000[a/MV]mol/L
C.t℃时,溶液中由水电离产生的c(H+)=
mol/L1×10−17V b
D.该温度下饱和溶液中HX的质量分数w%=[a/dV]×100% doriswan1年前1
doriswan1年前1 -
 jw006900 共回答了21个问题
jw006900 共回答了21个问题 |采纳率85.7%解题思路:A.根据电荷守恒计算c(H+)-c(OH-);
B.c(HX)=
=ag Mg/mol 10−3VL
mol/L;a 10−3MV
C.水电离出的c(H+)等于溶液中c(OH-);
D.质量分数=
×100%.溶质的质量 溶液的质量 A.根据电荷守恒计算c(H+)-c(OH-)=c(X-)=[bmol
10−3VL=
1000b/V]mol/L,故A正确;
B.c(HX)=
ag
Mg/mol
10−3VL=[a
10−3MVmol/L,故B正确;
C.水的离子积常数未知导致无法计算氢氧根离子浓度,故C错误;
D.质量分数=
溶质的质量/溶液的质量×100%=
ag
(dV)g×100%=
a
dV]×100%,故D正确;
故选C.点评:
本题考点: 弱电解质在水溶液中的电离平衡;溶液中溶质的质量分数及相关计算.
考点点评: 本题考查了弱电解质的电离及溶液中的各个物理量的计算,根据基本公式结合电荷守恒来分析解答,题目难度不大.1年前查看全部
- (8分)单质铁溶于一定浓度的硝酸中反应的化学方程式如下:
(8分)单质铁溶于一定浓度的硝酸中反应的化学方程式如下:
a Fe+b NO 3 - +c H + ="=d" Fe 2+ +f Fe 3+ +g NO↑+h N 2 O↑+k H 2 O(化学计量数均为正整数)
请你用已掌握的知识研究出下列规律。
(1) c、g、h的关系式是____________________。
(2) b、c、d、f的关系式是_______________________ _ _。
(3) d、f、g、h的关系式是_________________。
(4)若a =12,铁和硝酸恰好完全反应,则b的取值范围是________________。c的取值范围是______________________。 xbcdsfghsdfg1年前1
xbcdsfghsdfg1年前1 -
 共享 共回答了12个问题
共享 共回答了12个问题 |采纳率100%(1) c =" 4g+10h " (2) c-b="2d" +3f (3) 2d +3f ="3g+8h" (4) 6
(1)元素守恒:c="2k " 3b="g+h+k " 即:6b="2g+2h+c" 又:b="g+2h " 故:c = 4g+10h
(2)电荷守恒:c="2d+3f+b" 即:c-b=2d+3f
(3)电子转移守恒;3g+8h="2d+3f"
(4)当Fe→Fe 2+ ,NO 3 - →N 2 O时,b有最小值。b=12×2/4 = 6
当Fe→Fe 3+ ,NO 3 - →NO时,b有最大值。b=12×3/3 =" 12" 故有:6把61年前
91年前查看全部
- 生物的生存依赖于一定的环境.______(判断对错)
 pentiumma1年前1
pentiumma1年前1 -
 dw3ft 共回答了18个问题
dw3ft 共回答了18个问题 |采纳率72.2%解题思路:生物生存的环境不仅是指生存的地点,还包括环境中影响生物生活的各种因素叫环境因素,如光、温度、水、空气、土壤等.生物的生存依赖于一定的环境.生物生存所需要的基本条件是一样的,它们都需要营养物质、阳光、空气和水,还有适宜的温度和一定的生存空间.因此题干的说法正确.
故答案为:√.点评:
本题考点: 环境对生物的影响.
考点点评: 解答此类题目的关键是知道生物生存的基本条件.1年前查看全部
- 室温下将等物质的量的NaCN和HCN溶于一定量水中,再加入适量稀盐酸,调整溶液pH=7.我除了D项其他都不懂
室温下将等物质的量的NaCN和HCN溶于一定量水中,再加入适量稀盐酸,调整溶液pH=7.我除了D项其他都不懂
A.未加入稀盐酸之前[CN-]>[HCN]
B.加稀盐酸后溶液中c(CN-)/ [c(HCN)·c(OH-)]变大
C.加稀盐酸后HCN的电离程度减小,但c(H+)增大
D.pH=7时,溶液中c( Na+)= c(CN-) 冷雨漫步1年前2
冷雨漫步1年前2 -
 餐饮娱乐 共回答了19个问题
餐饮娱乐 共回答了19个问题 |采纳率100%A、解释一:HCN是极弱酸,电离常数数量级是10^-10,CN-水解常数数量级是10^-4,所以其电离程度小于水解,所以当HCN和CN-浓度相同的情况下,CN-水解比HCN电离的多,所以[CN-]<[HCN],A错误.解释二:混合后加入盐酸pH才变为中性,所以原混合溶液显碱性,说明CN-水解大于HCN电离,然后同前面解释.
B、HCN的电离常数K= [CN-]*[H+]/[HCN],而 [H+]=10^-14/[OH-],结果 K= [CN-]*10^-14/([HCN]*[OH-]),因为K是常数,与加不加盐酸无关,所以 [CN-]/([HCN]*[OH-])不会变
C、正确.加盐酸后,HCN电离程度的确减小,同时由于加进来的是强酸,加了好多H+,所以H+浓度增大
D、pH=7,说明H+和OH-浓度相等,而根据电荷守恒[Na+]+[H+]=[OH-]+[CN-]+[Cl-],可知D错误.1年前查看全部
- 学习化学的目的并不在于一定要成为化学家,重要的是善于用化学知识去分析、解决生产生活中的问题.下列有关燃烧与灭火的说法正确
学习化学的目的并不在于一定要成为化学家,重要的是善于用化学知识去分析、解决生产生活中的问题.下列有关燃烧与灭火的说法正确的是( )
A.房屋失火,消防队员用水扑灭是因为降低了可燃物的着火点
B.用灯帽盖灭酒精灯是因为降低了可燃物的温度
C.汽油放置在空气中没有燃烧是因为汽油不是可燃物
D.为防止森林大火蔓延可设置隔离带,其目的是隔离可燃物 游衍_liu1年前1
游衍_liu1年前1 -
 A20011347 共回答了23个问题
A20011347 共回答了23个问题 |采纳率95.7%解题思路:燃烧需要同时满足三个条件:①可燃物、②氧气或空气、③温度要达到着火点;
灭火原理:清除或隔离可燃物、隔绝氧气或空气、使温度降到着火点以下,据此进行分析解答.A、房屋失火,消防队员用水扑灭,水蒸发时吸收热量,可使温度降低到可燃物的着火点以下,从而达到灭火的目的;可燃物的着火点一般是不变的,不能降低可燃物的着火点,故选项说法错误.
B、用灯帽盖灭酒精灯,可以隔绝氧气或空气,从而达到灭火的目的,故选项说法错误.
C、汽油属于易燃物,汽油放置在空气中没有燃烧,是因为温度没有达到着火点,故选项说法错误.
D、为防止森林大火蔓延可设置隔离带,是利用了隔离可燃物达到灭火的目的,故选项说法正确.
故选:D.点评:
本题考点: 灭火的原理和方法;燃烧与燃烧的条件.
考点点评: 本题难度不大,掌握燃烧的条件与灭火的原理并能灵活运用是正确解答此类题的关键.1年前查看全部
- 甲、乙、丙三位同学对氯化镁样品(仅含氯化钠杂质)进行如下检测:各取5.0g样品溶于一定量的水中得到25.0g溶液,再分别
甲、乙、丙三位同学对氯化镁样品(仅含氯化钠杂质)进行如下检测:各取5.0g样品溶于一定量的水中得到25.0g溶液,再分别加入不同质量、溶质质量分数为10%的氢氧化钠溶液,反应得到沉淀的实验数据如下表: 
试回答下列问题:
(1)上述实验中,___________同学所用的氢氧化钠溶液一定过量。
(2)求样品中氯化镁的含量(写出计算过程,结果精确到0.1%,下同)。
(3)计算乙同学实验后所得溶液中的氯化钠的质量分数。 温柔nn11年前1
温柔nn11年前1 -
 清泉漱石 共回答了24个问题
清泉漱石 共回答了24个问题 |采纳率87.5%(1)丙
(2)设生成2.9克Mg(OH) 2 消耗MgCl 2 的质量为x,生成NaCl的质量为y。
MgCl 2 +2NaOH==Mg(OH) 2 ↓ +2NaCl
95 58 117
x 2.9g y
95:58 =x:2.9g
x=4. 75g
117:58=y:2.9g
y=5. 85g
混合物中MgCl 2 的质量分数为:4.75g/5.0g×100%=95. 0%
(3)乙同学实验后溶液中NaCl的质量:5.0g-4. 75g+5.85g=6.1g
乙同学实验后溶液的质量:25.0g+40.0g-2.9g=62.lg
乙同学实验后所得溶液中氯化钠的质量分数:6.lg/62.1g×100%=9. 8%1年前查看全部
- 图A曲线表示最适温度、最适pH条件下,人体唾液淀粉酶作用于一定量的淀粉,生成物量与反应时间的关系图,请回答下列问题:
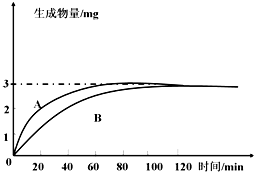 图A曲线表示最适温度、最适pH条件下,人体唾液淀粉酶作用于一定量的淀粉,生成物量与反应时间的关系图,请回答下列问题:
图A曲线表示最适温度、最适pH条件下,人体唾液淀粉酶作用于一定量的淀粉,生成物量与反应时间的关系图,请回答下列问题:
(1)A曲线70分钟后,生成物量不再增加的原因是______.
(2)若将反应液pH由1.8逐渐升至8.0,则唾液淀粉酶的催化速率将______,原因是______.
(3)若将反应温度变为20℃,其它条件不变,生成物量随反应时间变化的曲线为图中B,其原因是______. yangbin10231年前1
yangbin10231年前1 -
 小小二哥 共回答了20个问题
小小二哥 共回答了20个问题 |采纳率95%解题思路:酶是活细胞产生的具有催化作用的有机物,绝大多数是蛋白质,少数是RNA.酶的特性:专一性、高效性、作用条件较温和.影响酶活性的因素:温度、pH等.在最适温度(pH)下,酶的活性最高;当温度(pH)低于最适温度(pH)时,酶的活性随温度(pH)的升高而增强;当温度(pH)高于最适温度(pH)时,酶的活性随温度(pH)的升高而减弱.(1)A曲线70分钟后,生成物量不再增加的原因是淀粉(底物)已经分解完.
(2)若将反应液pH由1.8逐渐升至8.0,则唾液淀粉酶的催化速率将不变,原因是pH=1.8时唾液淀粉酶已经失活,即使PH值上升,酶的活性也不能恢复,
(3)若将反应温度变为20℃,其它条件不变,生成物量随反应时间变化的曲线为图中B,其原因是温度低于或者高于最适温度时,反应速率减慢,到达最大生成物量的时间延长.
故答案为:
(1)淀粉(底物)已经分解完
(2)不变 pH=1.8时唾液淀粉酶已经失活,即使PH值上升,酶的活性也不能恢复
(3)温度低于或者高于最适温度时,反应速率减慢,到达最大生成物量的时间延长点评:
本题考点: 探究影响酶活性的因素.
考点点评: 本题主要考查学生对知识的记忆和理解能力.要注意:①低温和高温时酶的活性都降低,但两者的性质不同.②在过酸或过碱环境中,酶均失去活性而不能恢复.1年前查看全部
- 知单质铁溶于一定浓度的硝酸溶液中反应的离子方程式为Fe+No3- + H+=Fe2+ +Fe3+ +No+N2O+H2O
知单质铁溶于一定浓度的硝酸溶液中反应的离子方程式为Fe+No3- + H+=Fe2+ +Fe3+ +No+N2O+H2O 配平
 k7k8k991年前3
k7k8k991年前3 -
 不过是梦一场 共回答了14个问题
不过是梦一场 共回答了14个问题 |采纳率78.6%不知道NO和N2O的比例不能配平,或者说有无数种配平方式,对于任意一种NO与N2O的比例和Fe2+和Fe3+比例有一个配平方式;
有问题请追问~~1年前查看全部
- 铜和镁的合金2.14g完全溶于一定浓度的硝酸,若反应中硝酸被还原为NO 2 、NO、N 2 O三种气体而且在标准状况下它
铜和镁的合金2.14g完全溶于一定浓度的硝酸,若反应中硝酸被还原为NO 2 、NO、N 2 O三种气体而且在标准状况下它们的体积均为0.224L.在反应后的溶液中,加入足量的氢氧化钠溶液,生成的沉淀经过滤、洗涤、干燥后称量,质量为( ) A.4.18g B.3.12g C.4.68g D.5.08  清风夏远1年前1
清风夏远1年前1 -
 空中游鱼 共回答了20个问题
空中游鱼 共回答了20个问题 |采纳率95%由题意可知,金属Cu、Mg与硝酸反应后再加入足量的氢氧化钠溶液,
最后转化为Cu(OH) 2 、Mg(OH) 2 沉淀,
由+2价金属和金属离子结合氢氧根离子的数目可知,
氢氧根离子的物质的量即为金属失去电子的物质的量,
在金属与硝酸的反应中,硝酸被还原为NO 2 、NO、N 2 O三种气体而且在标准状况下它们的体积均为0.224L,
气体的物质的量为
0.224L
22.4L/mol =0.01mol,
由电子守恒可知,
金属的失电子的物质的量为0.01mol×(5-4)+0.01mol×(5-2)+0.01mol×2×(5-1)=0.12mol,
即OH - 的物质的量为0.12mol,沉淀的质量为2.14g+0.12mol×17g/mol=4.18g,
故选A.1年前查看全部
- 钠与氧化钠的混合物5.4g,溶于一定量的水形成100ml0.2mol/LNaOH溶液求原混合物中钠与氧化钠的物质的量之比
 念军入梦1年前1
念军入梦1年前1 -
 lianglishuijing 共回答了9个问题
lianglishuijing 共回答了9个问题 |采纳率100%设有xmolNa,ymolNa2O
23x+62y=5.4(质量关系)
x+2y=0.02(Na元素守恒)
解得:x=0.1,y=0.05
则 x/y = 2
亲!1年前查看全部
- 胰蛋白酶作用于一定量的某种物质(底物),温度保持37℃,pH保持在最适值,生成物量与反应时间关系如下图.请回答下列问题:
胰蛋白酶作用于一定量的某种物质(底物),温度保持37℃,pH保持在最适值,生成物量与反应时间关系如下图.请回答下列问题:

(1)该酶作用的底物是______________________________________________________.
(2)在140分钟后,曲线变成水平,这是因为___________________________________
(3)若增加胰蛋白酶浓度,其他条件不变,请在原图上画出生成物量变化的示意曲线.
(4)若胰蛋白酶浓度和其他条件不变,反应液pH值由2逐渐升高到10,则酶催化反应的速度将__________________________,原因是__________________________________.
(5)下图中能正确表示胰蛋白酶对底物的分解速度和温度关系的是…………( )


 妖之余孽1年前3
妖之余孽1年前3 -
 有人喜欢蓝81 共回答了20个问题
有人喜欢蓝81 共回答了20个问题 |采纳率95%1,胰蛋白酶可以分解蛋白质,所以底物当然是蛋白质.还有答胰蛋白是不对的,胰蛋白酶只是由胰腺产生.
2,胰蛋白酶作用于一定量的某种物质(底物),酶分解速度很快,一段时间后,底物被全部分解完,生产物的量自然不会再增加.
3,增加酶浓度,反应时间缩短,曲线提前变平.
4,“胰蛋白酶作用于一定量的某种物质(底物),温度保持37℃,pH保持在最适值”,酶反应需要适宜的条件.胰蛋白酶最适PH为8-10,在PH为2时,酶失活,反应无法进行,反应速度为0.
5,‘温度保持37℃’,胰蛋白酶的最适温度为37℃,在30℃时还没有达到它的最大反应速度,所以一直呈上升趋势.1年前查看全部
- 某一元弱酸HX的相对分子质量为M,t℃时,将ag HX溶解于一定量的水中恰好形成饱和溶液V mL,其密度为dg
某一元弱酸HX的相对分子质量为M,t℃时,将ag HX溶解于一定量的水中恰好形成饱和溶液V mL,其密度为dg/cm3,其中n(X-)=b mol.关于该溶液的说法错误的是( )
A. 溶液中c(H+)-c(OH-)=[1000b/V]
B. 物质的量浓度c(HX)=1000[a/MV]mol/L
C. t℃时,溶液中由水电离产生的c(H+)=
mol/L1×10−17V b
D. 该温度下饱和溶液中HX的质量分数w%=[a/dV]×100% yhwjsyh1年前1
yhwjsyh1年前1 -
 w13920005001 共回答了20个问题
w13920005001 共回答了20个问题 |采纳率95%解题思路:A.根据电荷守恒计算c(H+)-c(OH-);
B.c(HX)=
=ag Mg/mol 10−3VL
mol/L;a 10−3MV
C.水电离出的c(H+)等于溶液中c(OH-);
D.质量分数=
×100%.溶质的质量 溶液的质量 A.根据电荷守恒计算c(H+)-c(OH-)=c(X-)=[bmol
10−3VL=
1000b/V]mol/L,故A正确;
B.c(HX)=
ag
Mg/mol
10−3VL=[a
10−3MVmol/L,故B正确;
C.水的离子积常数未知导致无法计算氢氧根离子浓度,故C错误;
D.质量分数=
溶质的质量/溶液的质量×100%=
ag
(dV)g×100%=
a
dV]×100%,故D正确;
故选C.点评:
本题考点: 弱电解质在水溶液中的电离平衡;溶液中溶质的质量分数及相关计算.
考点点评: 本题考查了弱电解质的电离及溶液中的各个物理量的计算,根据基本公式结合电荷守恒来分析解答,题目难度不大.1年前查看全部
- 35.(3分)甲、乙、丙、丁4位同学对氯化镁样品(仅含氯化钠杂质)进行如下检测:各取5.0 g样品溶于一定量的水中得到2
35.(3分)甲、乙、丙、丁4位同学对氯化镁样品(仅含氯化钠杂质)进行如下检测:各取5.0 g样品溶于一定量的水中得到25.0g溶液,再分别加入不同质量、溶质质量分数为10%的氢氧化钠溶液,反应后得到沉淀及有关实验数据如下表:
4位同学的实验
甲
乙
丙
丁
加入氢氧化钠溶液质量 (g)
29.0
34.5
40.0
45.0
反应得到沉淀的质量 (g)
2.1
2.5
2.9
2.9
反应的化学方程式为:MgCl2+2NaOH→Mg(OH)2↓+2NaCl,试回答下列问题:
(3)计算丙同学实验后所得溶液中的氯化钠的质量分数.步骤细致一些 龙变溪1年前1
龙变溪1年前1 -
 tianxinbj 共回答了17个问题
tianxinbj 共回答了17个问题 |采纳率82.4%MgCl2+2NaOH====Mg(OH)2↓+2NaCl
95 80 58 117
x 4g 2.9g y
设mMgCl2为x,mNaCl为y
x=4.75 y=5.85
m溶液=25g(氯化镁溶液)+40g(氢氧化钠溶液)-2.9g(生成沉淀不算在溶液里)=62.1g
m杂质=5g-mMgCl2=0.25g
mNaCl=5.85g+0.25g=6.1g
NaCl%=6.1g62.1g*100%≈9.8%1年前查看全部
- 相对于一定质量的理想气体,是不是保持温度不变,减小体积,压强会增大?
相对于一定质量的理想气体,是不是保持温度不变,减小体积,压强会增大?
根据克拉伯龙方程,似乎是这样,但是同学中有人提出了质疑,似乎还恒有道理 汽水兄弟31年前1
汽水兄弟31年前1 -
 深圳动漫城 共回答了21个问题
深圳动漫城 共回答了21个问题 |采纳率95.2%压强是大量气体分子对器壁碰撞而产生的.它反映了器壁所受大量分子碰撞时所给冲力的统计平均效果.气体的压强正比于单位体积内的分子数和分子的平均平动动能.分子的平均平动动能取决于温度.其实压强增大应该是由于体积减小导致受力面积减小导致的.1年前查看全部
- 生物的生存为什么要依赖于一定的环境
 酒中茶1年前2
酒中茶1年前2 -
 龙哥珍妹 共回答了23个问题
龙哥珍妹 共回答了23个问题 |采纳率82.6%因为生物进行新陈代谢必须和环境之间进行物质和能量的交换.1年前查看全部
- 11.5克金属钠在空气中完全被氧化,生成的白色物质溶于一定量的水中得到250ml溶液,计算:(1
11.5克金属钠在空气中完全被氧化,生成的白色物质溶于一定量的水中得到250ml溶液,计算:(1
白色物质的质量(2)所得溶液物质的量浓度 jonly411年前1
jonly411年前1 -
 xucheng110 共回答了14个问题
xucheng110 共回答了14个问题 |采纳率100%1,在Na空气中氧化生成的是白色Na2O,设生成x克
4Na+O2=2Na2O
92 124
11.5 x
92/11.5=124/x
x=15.5
2,11.5克Na物质的量为11.5/23=0.5mol
根据元素守恒 Na元素守恒,Na—NaOH,生成的NaOH也为0.5mol
形成0.25升溶液
量的浓度为0.5/0.25=2molL-1年前查看全部
- 一道化学题目已知铁溶于一定浓度的硝酸溶液中反应的离子方程式为(系数a-k均为正整数):aFe+bNO3-+cH+===d
一道化学题目
已知铁溶于一定浓度的硝酸溶液中反应的离子方程式为(系数a-k均为正整数):aFe+bNO3-+cH+===dFe2++fFe3++gNO+hN2O+kH2O.则
1b、c、d、f的关系式是____________________
2d、f、g、h的关系式是____________________
3若a=12,且铁和稀硝酸恰好完全反应,则b的取值范围是_______________________ 需要详解、不要网址
 fengwei19851年前1
fengwei19851年前1 -
 望把啊 共回答了23个问题
望把啊 共回答了23个问题 |采纳率91.3%用电荷守恒做,一个铁单质到一个亚铁离子或一个三价铁离子要失去2个或3个电子。一个硝酸根中5价N到一个一氧化氮或一个二氧化氮要得到3个或1个电子,则:1.3b+c=2d+3f 2.2d+3f=3g+2h 3.这个不会1年前查看全部
- 铜和镁的合金2.14g完全溶于一定浓度的硝酸,若反应中硝酸被还原为NO2、NO、N2O 三种气体且标准状况下体
铜和镁的合金2.14g完全溶于一定浓度的硝酸,若反应中硝酸被还原为NO2、NO、N2O 三种气体且标准状况下体积均为0.224L,在反应后的溶液中,加入足量的氢氧化钠溶液,生成的沉淀经过滤、洗涤、干燥后称量,质量为( )
A. 3.12 g
B. 4.18 g
C. 4.68 g
D. 5.08 g 一个现在1年前2
一个现在1年前2 -
 rong706 共回答了26个问题
rong706 共回答了26个问题 |采纳率92.3%解题思路:硝酸被还原为NO2、NO、N2O 三种气体且标准状况下体积均为0.224L,即物质的量均为0.01mol,根据氮元素的化合价变化计算转移电子物质的量.最后沉淀为Cu(OH)2、Mg(OH)2,金属提供的电子的物质的量等于氢氧根离子的物质的量,故最后沉淀质量等于金属的质量加氢氧根离子的质量.硝酸被还原为NO2、NO、N2O 三种气体且标准状况下体积均为0.224L,即物质的量均为[0.224L/22.4L/mol]=0.01mol,所以转移的电子的物质的量为0.01mol×(5-4)+0.01mol×(5-2)+0.01mol×2×(5-1)=0.12mol.
最后沉淀为Cu(OH)2、Mg(OH)2,金属提供的电子的物质的量等于氢氧根离子的物质的量,故最后沉淀质量等于2.14g+0.12mol×17g/mol=4.18g.
故选:B.点评:
本题考点: 有关混合物反应的计算;氧化还原反应的计算.
考点点评: 考查混合物的计算,难度中等,解题关键是判断金属提供的电子的物质的量等于氢氧根离子的物质的量.1年前查看全部
- 将Na2O2、HCl和Al2O3一起溶于一定量的水中,完全反应后,测得所得溶液中只含有Na+、AlO2-、Cl-
将Na2O2、HCl和Al2O3一起溶于一定量的水中,完全反应后,测得所得溶液中只含有Na+、AlO2-、Cl- (不考虑AlO2-的水解和H2O的电离),则Na2O2、HCl、Al2O3的物质的量之比不可能是( )
A. 2:2:1
B. 3:3:1
C. 3:4:1
D. 4:6:1 有一种牵手叫爱情1年前4
有一种牵手叫爱情1年前4 -
 我是风之子 共回答了18个问题
我是风之子 共回答了18个问题 |采纳率83.3%解题思路:令Na2O2、HCl、Al2O3的物质的量分别为x、y、z,所得溶液中只含有Na+、AlO2-、Cl-,根据原子守恒及电荷守恒有:2x=y+2z,将各比例代入满足即可,据此判断.令Na2O2、HCl、Al2O3的物质的量分别为x、y、z,所得溶液中只含有Na+、AlO2-、Cl-(不考虑AlO2-的水解和H2O的电离),根据原子守恒及电荷守恒有:2x=y+2z,
A、Na2O2、HCl、Al2O3的物质的量之比为2:2:1,则2×2=2+2×1,故A正确;
B、Na2O2、HCl、Al2O3的物质的量之比为3:3:1,则2×3≠3+2×1,故B错误;
C、Na2O2、HCl、Al2O3的物质的量之比为3:4:1,则2×3=4+2×1,故C正确;
D、Na2O2、HCl、Al2O3的物质的量之比为4:6:1,则2×4=6+2×1,故D正确.
故选:B.点评:
本题考点: 钠的重要化合物;镁、铝的重要化合物.
考点点评: 本题是一道开放性的题目,考查学生分析和解决问题的能力,运用原子守恒及电荷守恒是解题关键,难度较大.1年前查看全部
- (2010•延庆县一模)甲、乙、丙、丁4位同学对氯化镁样品(仅含氯化钠杂质)进行如下检测:各取5.0g样品溶于一定量的水
(2010•延庆县一模)甲、乙、丙、丁4位同学对氯化镁样品(仅含氯化钠杂质)进行如下检测:各取5.0g样品溶于一定量的水中得到25.0g溶液,再分别加入不同质量、溶质质量分数为10%的氢氧化钠溶液,反应后得到沉淀及有关实验数据如表:
反应的化学方程式为:MgCl2+2NaOH→Mg(OH)2↓+2NaCl,试回答下列问题:4位同学的实验 甲 乙 丙 丁 加入氢氧化钠溶液质量 (g) 29.0 34.5 40.0 45.0 反应得到沉淀的质量 (g) 2.1 2.5 2.9 2.9
(1)恰好完全反应的是丙丙同学的实验.
(2)计算样品中所含氯化镁的质量分数(写出计算过程,结果精确到0.1%,下同).
(3)计算丙同学实验后所得溶液中的氯化钠的质量分数. 乡下蚊子1年前1
乡下蚊子1年前1 -
 th003kg 共回答了17个问题
th003kg 共回答了17个问题 |采纳率94.1%解题思路:(1)根据甲、乙、丙、丁四位同学所加氢氧化钠溶液依次递增的质量关系和生成沉淀的质量关系进行分析.(2)根据氢氧化钠的质量求出氯化镁的质量,再根据氯化镁的质量样品的质量×100%求出样品中氯化镁的质量分数.(3)所得溶液中氯化钠的质量分数=氯化钠的质量所得溶液的质量×100%,所得溶液中氯化钠的质量包括样品中氯化钠的质量(样品的质量-氯化镁的质量)和反应生成的氯化钠的质量(根据氢氧化钠的质量求出),所得溶液的质量=所加的所有物质的总质量-沉淀的质量.(1)根据甲、乙、丙三位同学的实验数据分析可知,这三位同学所加的氢氧化钠已反应完,根据丙、丁两同学的实验数据分析可知,这两个实验中的氯化镁已反应完,则丙同学所做的实验中氯化镁和氢氧化钠恰好完全反应.故答案为:丙
(2)设样品中所含氯化镁的质量为x,生成氯化钠的质量为y,生成氢氧化镁的质量为z.
MgCl2+2NaOH═Mg(OH)2↓+2NaCl
95 80 58 117
x40g×10%z y
=4g
95
x=
80
4g
80
4g=
117
y
80
4g=
58
z
x=4.75g y=5.85gz=2.9g
4.75g
5g×100%=95%
答:样品中氯化镁的质量分数为95%.
(3)
5g−4.75g+5.85g
25g+40g−2.9g×100%=9.8%
答:所得溶液中氯化钠的质量分数为9.8%.点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算;物质组成的综合计算;质量守恒定律及其应用.1年前查看全部
- 在密闭容器中于一定条件下进行如下反应2so2+o2=2so3 当反应达到平衡时通入18o2 再次平衡SO2为什么也有18
在密闭容器中于一定条件下进行如下反应2so2+o2=2so3 当反应达到平衡时通入18o2 再次平衡SO2为什么也有18O
 杨一丫丫1年前1
杨一丫丫1年前1 -
 飘94497722 共回答了18个问题
飘94497722 共回答了18个问题 |采纳率94.4%SO2和氧-18的氧气反应后,生成含有一个氧-18和两个氧-16的SO3.SO3分解时,脱去哪一个氧原子,是随机的,因此有可能脱去氧-16,生成含有氧-18的SO2.1年前查看全部
- 高考化学题,在线等详细解答!1.28g铜完全溶于一定量的浓HNO3中,生成的气体(NO和NO2的混合物)刚好充满500m
高考化学题,在线等详细解答!
1.28g铜完全溶于一定量的浓HNO3中,生成的气体(NO和NO2的混合物)刚好充满500mL的烧瓶,然后将该烧瓶倒置与水中,缓缓通入一定量氧气后容器内刚好充满水,则通入氧气为:
A.0.16g B.0.02g C.0.32g D.0.224g
求详细解答,谢谢!
 kenwxd851年前1
kenwxd851年前1 -
 michaeljiang1974 共回答了20个问题
michaeljiang1974 共回答了20个问题 |采纳率85%选择C硝酸把铜氧化成+2价,生成的氮氧化物得到了铜的电子然后这些氮氧化物通入烧瓶后和氧气重新反应生成了硝酸,氧从0价变成了-2价得到了电子由于氧化还原反应前后电子得失是相等的进过这两步反应,铜失去的电子数和氧...1年前查看全部
- 把50克食盐完全溶于一定量的水中得到质量分数为10%的食盐溶液,所得食盐溶液的质量多少?
把50克食盐完全溶于一定量的水中得到质量分数为10%的食盐溶液,所得食盐溶液的质量多少?
多少克溶质质量分数为20%的糖水中含有蔗糖10克
 dillions1年前1
dillions1年前1 -
 这dd是我的 共回答了21个问题
这dd是我的 共回答了21个问题 |采纳率90.5%50g/10%=500g
10g/20%=50g1年前查看全部
- 如图为某实验者设计的验证银圆(银和铜的合金)完全溶解于一定量的浓硝酸后生成NO2气体中含有NO的实验装置图.常温时,NO
如图为某实验者设计的验证银圆(银和铜的合金)完全溶解于一定量的浓硝酸后生成NO2气体中含有NO的实验装置图.常温时,NO2与N2O4同时存在;在低于0℃时,几乎只有无色的N2O4的晶体存在.

(1)反应前先打开A中的活塞K1,持续通一段时间N2,其理由是______.
(2)若装置中缺B,其后果是______.
(3)反应结束后,打开D中的活塞K2,并通入氧气,D瓶内气体由无色变为红棕色;若通入的是热氧气,则瓶内气体的颜色比以前更深,其原因是______.
(4)C装置的作用是______;E中a仪器所起的作用是______.
(5)已知该银圆的质量为25g,加入75mL 12mol•L-1的浓硝酸.实验结束后,A中烧瓶内溶液中H+的浓度为2mol•L-1(反应中HNO3既无挥发也无分解),溶液体积仍为75mL.
①参加反应的硝酸的物质的量是______.
②为测定该银圆中铜的质量分数,还需进行的主要实验操作是______. charliehc1年前1
charliehc1年前1 -
 海上说梦人 共回答了17个问题
海上说梦人 共回答了17个问题 |采纳率94.1%解题思路:铜银合金与浓硝酸反应生成硝酸铜、硝酸银以及二氧化氮气体,如硝酸浓度降低时可能生成NO,经B浓硫酸干燥后,在C中冷却,NO2完全转化生成N2O4,D中气体通入氧气,如有NO,则可生成红综合的NO2气体,最后用氢氧化钠溶液吸收尾气,防止污染空气,利用A装置中反应后的溶液加入盐酸溶液,生成AgCl沉淀,经过滤、洗涤、干燥后称量可确定银的质量,进而可测得铜的质量分数;
根据n=cV计算原硝酸中硝酸的物质的量,氢离子浓度计算剩余的硝酸的物质的量,二者之差为参加反应的硝酸的物质的量,以此解答该题.(1)NO易于空气中的氧气反应生成NO2,为检验NO的存在,应首先去除装置内的氧气,
故答案为:排除系统内的空气,防止生成的NO被空气中的O2氧化;
(2)本实验目的是验证铜与浓硝酸反应,生成的NO2气体中含有NO,而水与NO2或N2O4反应,生成NO,干扰NO的验证,实验时应对气体进行干燥,
故答案为:无法确认铜与硝酸反应是否生成了NO气体;
(3)反应结束后,打开D部分的活塞k2,并通入氧气,D瓶内气体由无色变为红棕色,发生的反应为2NO+O2═2NO2,红棕色的NO2转化为无色N2O4气体的反应为放热反应,升高温度时,平衡向左移动,NO2的物质的量浓度增大,颜色加深,
故答案为:热的空气使平衡2NO2⇌N2O4向左移动,NO2的物质的量浓度增大,颜色加深;
(4)检验NO是否存在的方法是在NO的容器中通入氧气生成红棕色的NO2气体,为避免NO2气体的干扰,应将NO2全部转化成N2O4晶体,NO2易溶于水,应防止倒吸,
故答案为:NO2全部转化成N2O4晶体,避免在D装置中对NO的验证产生干扰; 防止倒吸;
(5)①原硝酸中硝酸的物质的量为0.075L×12mol/L=0.9mol,反应后氢离子浓度为2mol/L,故剩余的硝酸的物质的量为0.075L×2mol/L=0.15mol,故参加反应的硝酸的物质的量为0.9mol-0.15mol=0.75mol,
故答案为:0.75mol;
②向反应后反应中加入足量的盐酸至不再生成沉淀,过滤、洗涤沉淀、干燥,称量沉淀的质量,根据氯化银沉淀的质量计算银的质量,进而确定铜的质量分数;
故答案为:向反应后反应中加入足量的盐酸至不再生成沉淀,过滤、洗涤沉淀、干燥,称量沉淀的质量.点评:
本题考点: 性质实验方案的设计.
考点点评: 本题考查铜、银与浓硝酸反应,生成的NO2气体中含有NO的验证实验,题目难度中等,做题时注意把握物质的性质,排除物质的相互干扰,利用守恒思想计算.1年前查看全部
- 将0.64gCu全部溶于一定量的浓硝酸中,
将0.64gCu全部溶于一定量的浓硝酸中,
测得气体0.009mol(含一氧化氮、二氧化氮、四氧化二氮),共消耗硝酸0.032mol.将生成的气体与空气混合,再通入NaOH溶液中,氮氧化合物被完全吸收,产物只有NaNO3和水.计算空气中参加反应的央企在标准状况下的体积为_________mol. hellobybbyb1年前1
hellobybbyb1年前1 -
 yunyunader1 共回答了26个问题
yunyunader1 共回答了26个问题 |采纳率92.3%Cu---2e
64g 2mol
0.64g x=0.02mol
所HNO3得到了0.02mol电子变成氮氧化物.
氮氧化物与氧气反应后再与氢氧化钠溶液反应变成硝酸钠和水
所以氮氧化物失去的电子与氧气得到的电子都是0.02mol
O2------------------4e
1mol 4mol
y=0.005mol 0.02mol
空气中参加反应的氧气在标况下的体积:0.05mol*22.4L/mol=0.112L1年前查看全部
- 1.28gCu完全溶于一定量的浓硝酸,生成的气体刚好充满500毫升的烧瓶,然后把烧瓶倒置与水中,
1.28gCu完全溶于一定量的浓硝酸,生成的气体刚好充满500毫升的烧瓶,然后把烧瓶倒置与水中,
缓缓通入一定量的氧气后容器中刚好充满水,则通入的氧气为
A0.16克
B0.02摩尔
C0.32克
D0.224克 janeleexd1年前3
janeleexd1年前3 -
 所谓yy者必看 共回答了21个问题
所谓yy者必看 共回答了21个问题 |采纳率95.2%1.28gCu的物质的量是 0.02mol,转移的电子是0.02mol×2=0.04mol.根据得失电子守恒,铜转移的电子与硝酸反应变成气体转移的电子相等,而通入氧气转移的电子与把气体变成硝酸转移的电子相等,此过程与硝酸变成气体转移的电子又相等,即通入氧气转移的电子与铜反应时转移的电子相等.所以:
设需要O2的物质的量为x.则:
0.02mol×2=4×x
x=0.01mol
氧气的质量为0.01mol×32g每mol=0.32g
故答案选C.
理解请及时采纳!1年前查看全部
- 6.72克铁溶于一定浓度的硝酸溶液中,生成Fe(NO3)3与Fe(NO3)2的混合溶液,同时得到N2O与NO的混合气体.
6.72克铁溶于一定浓度的硝酸溶液中,生成Fe(NO3)3与Fe(NO3)2的混合溶液,同时得到N2O与NO的混合气体.在此过程中,参加反应的HNO3的物质的量可能是()?
A.0.28mol B.0.36mol C.0.42mol D.0.48mol 枫之乐彰1年前1
枫之乐彰1年前1 -
 zxg6908 共回答了18个问题
zxg6908 共回答了18个问题 |采纳率88.9%6.72g铁 即0,12molFe
Fe(NO3)3 Fe:NO3-=1:3 即全部为Fe(NO3)3 HNO3的物质的量为0,36mol
Fe(NO3)2 Fe:NO3-=1:2 即全部为Fe(NO3)2 HNO3的物质的量为0,24mol
现在是混合物 所以介于两者之间 应该选择0.28mol1年前查看全部
- 铜和镁的合金2.14g完全溶于一定浓度的硝酸,若反应中硝酸被还原为NO2、NO、N2O三种气体而且在标准状况下它们的体积
铜和镁的合金2.14g完全溶于一定浓度的硝酸,若反应中硝酸被还原为NO2、NO、N2O三种气体而且在标准状况下它们的体积均为0.224L.在反应后的溶液中,加入足量的氢氧化钠溶液,生成的沉淀经过滤、洗涤、干燥后称量,质量为( )
A.4.18g
B.3.12g
C.4.68g
D.5.08 三生石上的幸福1年前1
三生石上的幸福1年前1 -
 hsf1026 共回答了22个问题
hsf1026 共回答了22个问题 |采纳率95.5%解题思路:由题意可知,最后的沉淀为氢氧化镁和氢氧化铜,则沉淀的质量为金属的质量与氢氧根离子的质量之和;在金属与硝酸的反应中金属的失电子的物质的量等于硝酸中氮元素的得电子的物质的量,并由氢氧化镁和氢氧化铜的化学式可知,氢氧根离子的物质的量等于金属的失电子数.由题意可知,金属Cu、Mg与硝酸反应后再加入足量的氢氧化钠溶液,
最后转化为Cu(OH)2、Mg(OH)2沉淀,
由+2价金属和金属离子结合氢氧根离子的数目可知,
氢氧根离子的物质的量即为金属失去电子的物质的量,
在金属与硝酸的反应中,硝酸被还原为NO2、NO、N2O三种气体而且在标准状况下它们的体积均为0.224L,
气体的物质的量为[0.224L/22.4L/mol]=0.01mol,
由电子守恒可知,
金属的失电子的物质的量为0.01mol×(5-4)+0.01mol×(5-2)+0.01mol×2×(5-1)=0.12mol,
即OH-的物质的量为0.12mol,沉淀的质量为2.14g+0.12mol×17g/mol=4.18g,
故选A.点评:
本题考点: 质量守恒定律;氧化还原反应的电子转移数目计算.
考点点评: 本题较难,考查学生利用氧化还原反应中的电子守恒及利用沉淀的化学式得出转移电子数与氢氧根离子的关系是解答本题的关键.1年前查看全部
- 将 0.64gCu 全部溶于一定量的浓硝酸中,测得生成体积 0.009mol(含 NO NO2 N2O4),共消耗 0.
将 0.64gCu 全部溶于一定量的浓硝酸中,测得生成体积 0.009mol(含 NO NO2 N2O4),共消耗 0.032mol 硝酸,将生成的气体与空气混合,再通 入氢氧化钠溶液中,氮氧化物被完全吸收,产物只有硝酸钠和水.求:空气中参加反应的氧气在标况下的体积
 nfwu1年前2
nfwu1年前2 -
 dpx_005 共回答了16个问题
dpx_005 共回答了16个问题 |采纳率100%Cu---2e
64g 2mol
0.64g x=0.02mol
所HNO3得到了0.02mol电子变成氮氧化物.
氮氧化物与氧气反应后再与氢氧化钠溶液反应变成硝酸钠和水
所以氮氧化物失去的电子与氧气得到的电子都是0.02mol
O2------------------4e
1mol 4mol
y=0.005mol 0.02mol
空气中参加反应的氧气在标况下的体积:0.05mol*22.4L/mol=0.112L1年前查看全部
- 将10.2g的氧化铝溶于一定浓度的500mL的盐酸溶液中,充分反应后,再逐滴加入1mol/L的氢氧化钠溶液,反应过程中生
将10.2g的氧化铝溶于一定浓度的500mL的盐酸溶液中,充分反应后,再逐滴加入1mol/L的氢氧化钠溶液,反应过程中生成沉淀的质量与加入氢氧化钠溶液的体积关系如下图,试计算:
1)最大沉淀的质量.2)当沉淀从最大值到恰好完全消失时,耗用多少毫升的氢氧化钠溶液?)
图在此网址,去掉空格!
h ttp://zhidao.baidu.com/question/122688934.html
觉得那个第二个答案不对. wujun25881年前1
wujun25881年前1 -
 V5840 共回答了24个问题
V5840 共回答了24个问题 |采纳率95.8%这道题很简单的 你一看图就应该知道之前加的HCL是过量的 中和之后 此时溶液中恰好AL3+单独存在 AL3+离子0.2mol AL离子守恒 那么0.2*M(Al(HO)3)=《M(Al2O3)+3M(O)+6》*0.1=15.6g
2.沉淀有0.2mol 因此需要NaHO也是0.2mol 也就是200ml 完了 算了那么复杂做什么?
第一问 看到沉淀就看沉淀是什么 这个题果断是AL(HO)3 根据第一句话可以得到AL3+有0.2mol 则沉淀氢氧化铝就是0.2mol嘛 又看 0.2molAL(HO)3 比0.1molAl2O3多了0.3个氧的质量 0.6个氢的质量 直接口算答案就出来了
第二问更没意思 关键是要看清题 别个问的是从沉淀最多到恰好完全消失 问的是这个过程 1mol氢氧化铝消耗一个氢氧根 1比1嘛 于是就有了三 消耗0.2mol 则200ml 够清楚吧 这种题 不要看过程 不要管变化 始终铝离子守恒 拿到傻算的都是莽夫1年前查看全部
大家在问
- 1只用一种试剂或一种方法,经一步实验就可将O 2 ,H 2 ,CO 2 和空气四种气体区别开来的是 [
- 2我相信她,真是太傻了 翻译
- 3有浓度为20%的盐水300克,与浓度为30%和盐水200克,混合后的浓度.
- 4某商品现在的售价为每件60元,每星期可卖出300件.市场调查放映;如调整价格,每涨价1元,每星期要少卖10
- 5by then可与什么时态连用,怎么解释?求准确回答.
- 6你多久打扫一次房间。用英语怎么说?
- 7读下面的文段,完成练习。 鲸的身子这么大,它们吃什么呢?须鲸主要吃虾和小鱼。它们在海洋里游的时候,张着大嘴,把许多小鱼
- 84.762翻译成英文,求答案,必采纳
- 9(2011•浦口区一模)亚洲面积最广大的气候类型是( )
- 10来到教室,只见同学们和老师正一起朗读古诗文,不由想起两句千古传诵的名句是什么?
- 11弦白话怎么读
- 12礼貌地用英语怎么说
- 13Would you be______do it for me,please?
- 14甲、乙两物体沿同一条平直的公路同向行驶,甲物体以20m/s的速度做匀速直线运动,乙物体以4m/s的速度做匀速直线运动,从
- 15一元二次方程(k+1)X方+2X—1=0有两个不相等实数根则K的取值范围


