知识点abcd是什么意思发的复习材料对知识点有abcd的等级``最难d是不是九很少会考到?
 baiyun001262022-10-04 11:39:541条回答
baiyun001262022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 歌者之舞 共回答了12个问题
歌者之舞 共回答了12个问题 |采纳率66.7%- a基础 以此难度往上升 d是最难的
- 1年前
相关推荐
- 八年级英语第十课单项选择 写清知识点
八年级英语第十课单项选择 写清知识点
I saw a boy ( ) in the stree this morning ,so I went to ask what was the matter
A.cry B.crying C.to cry D.cried
Donot throw rubbish everywhere .you should( )
A.take them away B.take it off C.take it away D.take away it
Letis have it today ,( )?
A.shall I B.will you C.shall we D.do you
 enita1年前2
enita1年前2 -
 户主是我 共回答了11个问题
户主是我 共回答了11个问题 |采纳率100%B.看见某人正在做某事,即看见男孩正在哭.2.C.带走,动词短语中,代词一般放在动词与介词之间 3.C.let's 的反意疑问句,应为shall we1年前查看全部
- 二次函数复习知识点
 盛丹丹1年前2
盛丹丹1年前2 -
 ipodiam 共回答了10个问题
ipodiam 共回答了10个问题 |采纳率90%以方程X+Y=3的解为坐标组成的图形就是一次函数__的图像 二元一次方程的解与相应的一次函数图象上的点___.
因为函数和方程有以上的关系 所以我们就可以用图像法解决__的问题 也可以用方程解决__的问题
函数Y=2X-1上的任意一个点的坐标__方程2X-Y=1 以方程2X-y=1的解的坐标__一次函数Y=2X-1的图像上 所以方程2x-y=1的解为坐标的点组成的图像与一次函数Y=2X-1的图像___1年前查看全部
- 高一化学必修一知识点总结
 ttff1年前1
ttff1年前1 -
 yzh2006 共回答了24个问题
yzh2006 共回答了24个问题 |采纳率100%第一章 从实验学化学
一、常见物质的分离、提纯和鉴别
1.常用的物理方法——根据物质的物理性质上差异来分离.
混合物的物理分离方法
方法 适用范围 主要仪器 注意点 实例
固+液 蒸发 易溶固体与液体分开 酒精灯、蒸发皿、玻璃棒 ①不断搅拌;②最后用余热加热;③液体不超过容积2/3 NaCl(H2O)
固+固 结晶 溶解度差别大的溶质分开 NaCl(NaNO3)
升华 能升华固体与不升华物分开 酒精灯 I2(NaCl)
固+液 过滤 易溶物与难溶物分开 漏斗、烧杯 ①一角、二低、三碰;②沉淀要洗涤;③定量实验要“无损” NaCl(CaCO3)
液+液 萃取 溶质在互不相溶的溶剂里,溶解度的不同,把溶质分离出来 分液漏斗 ①先查漏;②对萃取剂的要求;③使漏斗内外大气相通;④上层液体从上口倒出 从溴水中提取Br2
分液 分离互不相溶液体 分液漏斗 乙酸乙酯与饱和Na2CO3溶液
蒸馏 分离沸点不同混合溶液 蒸馏烧瓶、冷凝管、温度计、牛角管 ①温度计水银球位于支管处;②冷凝水从下口通入;③加碎瓷片 乙醇和水、I2和CCl4
渗析 分离胶体与混在其中的分子、离子 半透膜 更换蒸馏水 淀粉与NaCl
盐析 加入某些盐,使溶质的溶解度降低而析出 烧杯 用固体盐或浓溶液 蛋白质溶液、硬脂酸钠和甘油
气+气 洗气 易溶气与难溶气分开 洗气瓶 长进短出 CO2(HCl)
液化 沸点不同气分开 U形管 常用冰水 NO2(N2O4)
i、蒸发和结晶 蒸发是将溶液浓缩、溶剂气化或溶质以晶体析出的方法.结晶是溶质从溶液中析出晶体的过程,可以用来分离和提纯几种可溶性固体的混合物.结晶的原理是根据混合物中各成分在某种溶剂里的溶解度的不同,通过蒸发减少溶剂或降低温度使溶解度变小,从而使晶体析出.加热蒸发皿使溶液蒸发时、要用玻璃棒不断搅动溶液,防止由于局部温度过高,造成液滴飞溅.当蒸发皿中出现较多的固体时,即停止加热,例如用结晶的方法分离NaCl和KNO3混合物.
ii、蒸馏 蒸馏是提纯或分离沸点不同的液体混合物的方法.用蒸馏原理进行多种混合液体的分离,叫分馏.
操作时要注意:
①在蒸馏烧瓶中放少量碎瓷片,防止液体暴沸.
②温度计水银球的位置应与支管底口下缘位于同一水平线上.
③蒸馏烧瓶中所盛放液体不能超过其容积的2/3,也不能少于l/3.
④冷凝管中冷却水从下口进,从上口出.
⑤加热温度不能超过混合物中沸点最高物质的沸点,例如用分馏的方法进行石油的分馏.
iii、分液和萃取 分液是把两种互不相溶、密度也不相同的液体分离开的方法.萃取是利用溶质在互不相溶的溶剂里的溶解度不同,用一种溶剂把溶质从它与另一种溶剂所组成的溶液中提取出来的方法.选择的萃取剂应符合下列要求:和原溶液中的溶剂互不相溶;对溶质的溶解度要远大于原溶剂,并且溶剂易挥发.
在萃取过程中要注意:
①将要萃取的溶液和萃取溶剂依次从上口倒入分液漏斗,其量不能超过漏斗容积的2/3,塞好塞子进行振荡.
②振荡时右手捏住漏斗上口的颈部,并用食指根部压紧塞子,以左手握住旋塞,同时用手指控制活塞,将漏斗倒转过来用力振荡.
③然后将分液漏斗静置,待液体分层后进行分液,分液时下层液体从漏斗口放出,上层液体从上口倒出.例如用四氯化碳萃取溴水里的溴.
iv、升华 升华是指固态物质吸热后不经过液态直接变成气态的过程.利用某些物质具有升华的特性,将这种物质和其它受热不升华的物质分离开来,例如加热使碘升华,来分离I2和SiO2的混合物.
2、化学方法分离和提纯物质
对物质的分离可一般先用化学方法对物质进行处理,然后再根据混合物的特点用恰当的分离方法(见化学基本操作)进行分离.
用化学方法分离和提纯物质时要注意:
①最好不引入新的杂质;
②不能损耗或减少被提纯物质的质量
③实验操作要简便,不能繁杂.用化学方法除去溶液中的杂质时,要使被分离的物质或离子尽可能除净,需要加入过量的分离试剂,在多步分离过程中,后加的试剂应能够把前面所加入的无关物质或离子除去.
对于无机物溶液常用下列方法进行分离和提纯:
(1)生成沉淀法 (2)生成气体法 (3)氧化还原法 (4)正盐和与酸式盐相互转化法 (5)利用物质的两性除去杂质 (6)离子交换法
常见物质除杂方法
序号 原物 所含杂质 除杂质试剂 主要操作方法
1 N2 O2 灼热的铜丝网 用固体转化气体
2 CO2 H2S CuSO4溶液 洗气
3 CO CO2 NaOH溶液 洗气
4 CO2 CO 灼热CuO 用固体转化气体
5 CO2 HCI 饱和的NaHCO3 洗气
6 H2S HCI 饱和的NaHS 洗气
7 SO2 HCI 饱和的NaHSO3 洗气
8 CI2 HCI 饱和的食盐水 洗气
9 CO2 SO2 饱和的NaHCO3 洗气
10 炭粉 MnO2 浓盐酸(需加热) 过滤
11 MnO2 C -------- 加热灼烧
12 炭粉 CuO 稀酸(如稀盐酸) 过滤
13 AI2O3 Fe2O3 NaOH(过量),CO2 过滤
14 Fe2O3 AI2O3 NaOH溶液 过滤
15 AI2O3 SiO2 盐酸`氨水 过滤
16 SiO2 ZnO HCI溶液 过滤,
17 BaSO4 BaCO3 HCI或稀H2SO4 过滤
18 NaHCO3溶液 Na2CO3 CO2 加酸转化法
19 NaCI溶液 NaHCO3 HCI 加酸转化法
20 FeCI3溶液 FeCI2 CI2 加氧化剂转化法
21 FeCI3溶液 CuCI2 Fe 、CI2 过滤
22 FeCI2溶液 FeCI3 Fe 加还原剂转化法
23 CuO Fe (磁铁) 吸附
24 Fe(OH)3胶体 FeCI3 蒸馏水 渗析
25 CuS FeS 稀盐酸 过滤
26 I2晶体 NaCI -------- 加热升华
27 NaCI晶体 NH4CL -------- 加热分解
28 KNO3晶体 NaCI 蒸馏水 重结晶.
3、物质的鉴别
物质的检验通常有鉴定、鉴别和推断三类,它们的共同点是:依据物质的特殊性质和特征反应,选择适当的试剂和方法,准确观察反应中的明显现象,如颜色的变化、沉淀的生成和溶解、气体的产生和气味、火焰的颜色等,进行判断、推理.
检验类型 鉴别 利用不同物质的性质差异,通过实验,将它们区别开来.
鉴定 根据物质的特性,通过实验,检验出该物质的成分,确定它是否是这种物质.
推断 根据已知实验及现象,分析判断,确定被检的是什么物质,并指出可能存在什么,不可能存在什么.
检验方法 ① 若是固体,一般应先用蒸馏水溶解
② 若同时检验多种物质,应将试管编号
③ 要取少量溶液放在试管中进行实验,绝不能在原试剂瓶中进行检验
④ 叙述顺序应是:实验(操作)→现象→结论→原理(写方程式)
① 常见气体的检验
常见气体 检验方法
氢气 纯净的氢气在空气中燃烧呈淡蓝色火焰,混合空气点燃有爆鸣声,生成物只有水.不是只有氢气才产生爆鸣声;可点燃的气体不一定是氢气
氧气 可使带火星的木条复燃
氯气 黄绿色,能使湿润的碘化钾淀粉试纸变蓝(O3、NO2也能使湿润的碘化钾淀粉试纸变蓝)
氯化氢 无色有刺激性气味的气体.在潮湿的空气中形成白雾,能使湿润的蓝色石蓝试纸变红;用蘸有浓氨水的玻璃棒靠近时冒白烟;将气体通入AgNO3溶液时有白色沉淀生成.
二氧化硫 无色有刺激性气味的气体.能使品红溶液褪色,加热后又显红色.能使酸性高锰酸钾溶液褪色.
硫化氢 无色有具鸡蛋气味的气体.能使Pb(NO3)2或CuSO4溶液产生黑色沉淀,或使湿润的醋酸铅试纸变黑.
氨气 无色有刺激性气味,能使湿润的红色石蕊试纸变蓝,用蘸有浓盐酸的玻璃棒靠近时能生成白烟.
二氧化氮 红棕色气体,通入水中生成无色的溶液并产生无色气体,水溶液显酸性.
一氧化氮 无色气体,在空气中立即变成红棕色
二氧化碳 能使澄清石灰水变浑浊;能使燃着的木条熄灭.SO2气体也能使澄清的石灰水变混浊,N2等气体也能使燃着的木条熄灭.
一氧化碳 可燃烧,火焰呈淡蓝色,燃烧后只生成CO2;能使灼热的CuO由黑色变成红色.
② 几种重要阳离子的检验
(l)H+ 能使紫色石蕊试液或橙色的甲基橙试液变为红色.
(2)Na+、K+ 用焰色反应来检验时,它们的火焰分别呈黄色、浅紫色(通过钴玻片).
(3)Ba2+ 能使稀硫酸或可溶性硫酸盐溶液产生白色BaSO4沉淀,且沉淀不溶于稀硝酸.
(4)Mg2+ 能与NaOH溶液反应生成白色Mg(OH)2沉淀,该沉淀能溶于NH4Cl溶液.
(5)Al3+ 能与适量的NaOH溶液反应生成白色Al(OH)3絮状沉淀,该沉淀能溶于盐酸或过量的NaOH溶液.
(6)Ag+ 能与稀盐酸或可溶性盐酸盐反应,生成白色AgCl沉淀,不溶于稀 HNO3,但溶于氨水,生成〔Ag(NH3)2〕+.
(7)NH4+ 铵盐(或浓溶液)与NaOH浓溶液反应,并加热,放出使湿润的红色石蓝试纸变蓝的有刺激性气味NH3气体.
(8)Fe2+ 能与少量NaOH溶液反应,先生成白色Fe(OH)2沉淀,迅速变成灰绿色,最后变成红褐色Fe(OH)3沉淀.或向亚铁盐的溶液里加入KSCN溶液,不显红色,加入少量新制的氯水后,立即显红色.2Fe2++Cl2=2Fe3++2Cl-
(9) Fe3+ 能与 KSCN溶液反应,变成血红色 Fe(SCN)3溶液,能与 NaOH溶液反应,生成红褐色Fe(OH)3沉淀.
(10)Cu2+ 蓝色水溶液(浓的CuCl2溶液显绿色),能与NaOH溶液反应,生成蓝色的Cu(OH)2沉淀,加热后可转变为黑色的 CuO沉淀.含Cu2+溶液能与Fe、Zn片等反应,在金属片上有红色的铜生成.
③ 几种重要的阴离子的检验
(1)OH- 能使无色酚酞、紫色石蕊、橙色的甲基橙等指示剂分别变为红色、蓝色、黄色.
(2)Cl- 能与硝酸银反应,生成白色的AgCl沉淀,沉淀不溶于稀硝酸,能溶于氨水,生成[Ag(NH3)2]+.
(3)Br- 能与硝酸银反应,生成淡黄色AgBr沉淀,不溶于稀硝酸.
(4)I- 能与硝酸银反应,生成黄色AgI沉淀,不溶于稀硝酸;也能与氯水反应,生成I2,使淀粉溶液变蓝.
(5)SO42- 能与含Ba2+溶液反应,生成白色BaSO4沉淀,不溶于硝酸.
(6)SO32- 浓溶液能与强酸反应,产生无色有刺激性气味的SO2气体,该气体能使品红溶液褪色.能与BaCl2溶液反应,生成白色BaSO3沉淀,该沉淀溶于盐酸,生成无色有刺激性气味的SO2气体.
(7)S2- 能与Pb(NO3)2溶液反应,生成黑色的PbS沉淀.
(8)CO32- 能与BaCl2溶液反应,生成白色的BaCO3沉淀,该沉淀溶于硝酸(或盐酸),生成无色无味、能使澄清石灰水变浑浊的CO2气体.
(9)HCO3- 取含HCO3-盐溶液煮沸,放出无色无味CO2气体,气体能使澄清石灰水变浑浊或向HCO3-盐酸溶液里加入稀MgSO4溶液,无现象,加热煮沸,有白色沉淀 MgCO3生成,同时放出 CO2气体.
(10)PO43- 含磷酸根的中性溶液,能与AgNO3反应,生成黄色Ag3PO4沉淀,该沉淀溶于硝酸.
(11)NO3- 浓溶液或晶体中加入铜片、浓硫酸加热,放出红棕色气体.
二、常见事故的处理
事故 处理方法
酒精及其它易燃有机物小面积失火 立即用湿布扑盖
钠、磷等失火 迅速用砂覆盖
少量酸(或碱)滴到桌上 立即用湿布擦净,再用水冲洗
较多量酸(或碱)流到桌上 立即用适量NaHCO3溶液(或稀HAC)作用,后用水冲洗
酸沾到皮肤或衣物上 先用抹布擦试,后用水冲洗,再用NaHCO3稀溶液冲洗
碱液沾到皮肤上 先用较多水冲洗,再用硼酸溶液洗
酸、碱溅在眼中 立即用水反复冲洗,并不断眨眼
苯酚沾到皮肤上 用酒精擦洗后用水冲洗
白磷沾到皮肤上 用CuSO4溶液洗伤口,后用稀KMnO4溶液湿敷
溴滴到皮肤上 应立即擦去,再用稀酒精等无毒有机溶济洗去,后涂硼酸、凡士林
误食重金属盐 应立即口服蛋清或生牛奶
汞滴落在桌上或地上 应立即撒上硫粉
三、化学计量
①物质的量
定义:表示一定数目微粒的集合体 符号n 单位 摩尔 符号 mol
阿伏加德罗常数:0.012kgC-12中所含有的碳原子数.用NA表示. 约为6.02x1023
微粒与物质的量
公式:n=
②摩尔质量:单位物质的量的物质所具有的质量 用M表示 单位:g/mol 数值上等于该物质的分子量
质量与物质的量
公式:n=
③物质的体积决定:①微粒的数目②微粒的大小③微粒间的距离
微粒的数目一定 固体液体主要决定②微粒的大小
气体主要决定③微粒间的距离
体积与物质的量
公式:n=
标准状况下 ,1mol任何气体的体积都约为22.4L
④阿伏加德罗定律:同温同压下, 相同体积的任何气体都含有相同的分子数
⑤物质的量浓度:单位体积溶液中所含溶质B的物质的量.符号CB 单位:mol/l
公式:CB=nB/V nB=CB×V V=nB/CB
溶液稀释规律 C(浓)×V(浓)=C(稀)×V(稀)
⑥ 溶液的配置
(l)配制溶质质量分数一定的溶液
计算:算出所需溶质和水的质量.把水的质量换算成体积.如溶质是液体时,要算出液体的体积.
称量:用天平称取固体溶质的质量;用量简量取所需液体、水的体积.
溶将固体或液体溶质倒入烧杯里,加入所需的水,用玻璃棒搅拌使溶质完全溶解.
(2)配制一定物质的量浓度的溶液 (配制前要检查容量瓶是否漏水)
计算:算出固体溶质的质量或液体溶质的体积.
称量:用托盘天平称取固体溶质质量,用量简量取所需液体溶质的体积.
溶将固体或液体溶质倒入烧杯中,加入适量的蒸馏水(约为所配溶液体积的1/6),用玻璃棒搅拌使之溶解,冷却到室温后,将溶液引流注入容量瓶里.
洗涤(转移):用适量蒸馏水将烧杯及玻璃棒洗涤2-3次,将洗涤液注入容量瓶.振荡,使溶液混合均匀.
定容:继续往容量瓶中小心地加水,直到液面接近刻度2-3mm处,改用胶头滴管加水,使溶液凹面恰好与刻度相切.把容量瓶盖紧,再振荡摇匀.
5、过滤 过滤是除去溶液里混有不溶于溶剂的杂质的方法.
过滤时应注意:①一贴:将滤纸折叠好放入漏斗,加少量蒸馏水润湿,使滤纸紧贴漏斗内壁.
②二低:滤纸边缘应略低于漏斗边缘,加入漏斗中液体的液面应略低于滤纸的边缘.
③三靠:向漏斗中倾倒液体时,烧杯的夹嘴应与玻璃棒接触;玻璃棒的底端应和过滤器有三层滤纸处轻轻接触;漏斗颈的末端应与接受器的内壁相接触,例如用过滤法除去粗食盐中少量的泥沙.
第二章 化学物质及其变化
一、物质的分类 金属:Na、Mg、Al
单质
非金属:S、O、N
酸性氧化物:SO3、SO2、P2O5等
氧化物 碱性氧化物:Na2O、CaO、Fe2O3
氧化物:Al2O3等
纯 盐氧化物:CO、NO等
净 含氧酸:HNO3、H2SO4等
物 按酸根分
无氧酸:HCl
强酸:HNO3、H2SO4 、HCl
酸 按强弱分
弱酸:H2CO3、HClO、CH3COOH
化 一元酸:HCl、HNO3
合 按电离出的H+数分 二元酸:H2SO4、H2SO3
物 多元酸:H3PO4
强碱:NaOH、Ba(OH)2
物 按强弱分
质 弱碱:NH3•H2O、Fe(OH)3
碱
一元碱:NaOH、
按电离出的HO-数分 二元碱:Ba(OH)2
多元碱:Fe(OH)3
正盐:Na2CO3
盐 酸式盐:NaHCO3
碱式盐:Cu2(OH)2CO3
溶液:NaCl溶液、稀H2SO4等
混 悬浊液:泥水混合物等
合 乳浊液:油水混合物
物 胶体:Fe(OH)3胶体、淀粉溶液、烟、雾、有色玻璃等
二、分散系相关概念
1. 分散系:一种物质(或几种物质)以粒子形式分散到另一种物质里所形成的混合物,统称为分散系.
2. 分散质:分散系中分散成粒子的物质.
3. 分散剂:分散质分散在其中的物质.
4、分散系的分类:当分散剂是水或其他液体时,如果按照分散质粒子的大小来分类,可以把分散系分为:溶液、胶体和浊液.分散质粒子直径小于1nm的分散系叫溶液,在1nm-100nm之间的分散系称为胶体,而分散质粒子直径大于100nm的分散系叫做浊液.
下面比较几种分散系的不同:
分散系 溶 液 胶 体 浊 液
分散质的直径 <1nm(粒子直径小于10-9m) 1nm-100nm(粒子直径在10-9 ~ 10-7m) >100nm(粒子直径大于10-7m)
分散质粒子 单个小分子或离子 许多小分子集合体或高分子 巨大数目的分子集合体
实例 溶液酒精、氯化钠等 淀粉胶体、氢氧化铁胶体等 石灰乳、油水等
性
质 外观 均一、透明 均一、透明 不均一、不透明
稳定性 稳定 较稳定 不稳定
能否透过滤纸 能 能 不能
能否透过半透膜 能 不能 不能
鉴别 无丁达尔效应 有丁达尔效应 静置分层
注意:三种分散系的本质区别:分散质粒子的大小不同.
三、胶体
1、胶体的定义:分散质粒子直径大小在10-9~10-7m之间的分散系.
2、胶体的分类:
①. 根据分散质微粒组成的状况分类:
如: 胶体胶粒是由许多 等小分子聚集一起形成的微粒,其直径在1nm~100nm之间,这样的胶体叫粒子胶体. 又如:淀粉属高分子化合物,其单个分子的直径在1nm~100nm范围之内,这样的胶体叫分子胶体.
②. 根据分散剂的状态划分:
如:烟、云、雾等的分散剂为气体,这样的胶体叫做气溶胶;AgI溶胶、 溶胶、 溶胶,其分散剂为水,分散剂为液体的胶体叫做液溶胶;有色玻璃、烟水晶均以固体为分散剂,这样的胶体叫做固溶胶.
3、胶体的制备
A. 物理方法
① 机械法:利用机械磨碎法将固体颗粒直接磨成胶粒的大小
② 溶解法:利用高分子化合物分散在合适的溶剂中形成胶体,如蛋白质溶于水,淀粉溶于水、聚乙烯熔于某有机溶剂等.
B. 化学方法
① 水解促进法:FeCl3+3H2O(沸)= (胶体)+3HCl
② 复分解反应法:KI+AgNO3=AgI(胶体)+KNO3 Na2SiO3+2HCl=H2SiO3(胶体)+2NaCl
思考:若上述两种反应物的量均为大量,则可观察到什么现象?如何表达对应的两个反应方程式?提示:KI+AgNO3=AgI↓+KNO3(黄色↓)Na2SiO3+2HCl=H2SiO3↓+2NaCl(白色↓)
4、胶体的性质:
① 丁达尔效应——丁达尔效应是粒子对光散射作用的结果,是一种物理现象.丁达尔现象产生的原因,是因为胶体微粒直径大小恰当,当光照射胶粒上时,胶粒将光从各个方面全部反射,胶粒即成一小光源(这一现象叫光的散射),故可明显地看到由无数小光源形成的光亮“通路”.当光照在比较大或小的颗粒或微粒上则无此现象,只发生反射或将光全部吸收的现象,而以溶液和浊液无丁达尔现象,所以丁达尔效应常用于鉴别胶体和其他分散系.
② 布朗运动——在胶体中,由于胶粒在各个方向所受的力不能相互平衡而产生的无规则的运动,称为布朗运动.是胶体稳定的原因之一.
③ 电泳——在外加电场的作用下,胶体的微粒在分散剂里向阴极(或阳极)作定向移动的现象.胶体具有稳定性的重要原因是同一种胶粒带有同种电荷,相互排斥,另外,胶粒在分散力作用下作不停的无规则运动,使其受重力的影响有较大减弱,两者都使其不易聚集,从而使胶体较稳定.
说明:A、电泳现象表明胶粒带电荷,但胶体都是电中性的.胶粒带电的原因:胶体中单个胶粒的体积小,因而胶体中胶粒的表面积大,因而具备吸附能力.有的胶体中的胶粒吸附溶液中的阳离子而带正电;有的则吸附阴离子而带负电胶体的提纯,可采用渗析法来提纯胶体.使分子或离子通过半透膜从胶体里分离出去的操作方法叫渗析法.其原理是胶体粒子不能透过半透膜,而分子和离子可以透过半透膜.但胶体粒子可以透过滤纸,故不能用滤纸提纯胶体.
B、在此要熟悉常见胶体的胶粒所带电性,便于判断和分析一些实际问题.
带正电的胶粒胶体:金属氢氧化物如 、 胶体、金属氧化物.
带负电的胶粒胶体:非金属氧化物、金属硫化物As2S3胶体、硅酸胶体、土壤胶体
特殊:AgI胶粒随着AgNO3和KI相对量不同,而可带正电或负电.若KI过量,则AgI胶粒吸附较多I-而带负电;若AgNO3过量,则因吸附较多Ag+而带正电.当然,胶体中胶粒带电的电荷种类可能与其他因素有关.
C、同种胶体的胶粒带相同的电荷.
D、固溶胶不发生电泳现象.凡是胶粒带电荷的液溶胶,通常都可发生电泳现象.气溶胶在高压电的条件也能发生电泳现象.
胶体根据分散质微粒组成可分为粒子胶体(如 胶体,AgI胶体等)和分子胶体[如淀粉溶液,蛋白质溶液(习惯仍称其溶液,其实分散质微粒直径已达胶体范围),只有粒子胶体的胶粒带电荷,故可产生电泳现象.整个胶体仍呈电中性,所以在外电场作用下作定向移动的是胶粒而非胶体.
④聚沉——胶体分散系中,分散系微粒相互聚集而下沉的现象称为胶体的聚沉.能促使溶胶聚沉的外因有加电解质(酸、碱及盐)、加热、溶胶浓度增大、加胶粒带相反电荷的胶体等.有时胶体在凝聚时,会连同分散剂一道凝结成冻状物质,这种冻状物质叫凝胶.
胶体稳定存在的原因:(1)胶粒小,可被溶剂分子冲击不停地运动,不易下沉或上浮(2)胶粒带同性电荷,同性排斥,不易聚大,因而不下沉或上浮
胶体凝聚的方法:
(1)加入电解质:电解质电离出的阴、阳离子与胶粒所带的电荷发生电性中和,使胶粒间的排斥力下降,胶粒相互结合,导致颗粒直径>10-7m,从而沉降.
能力:离子电荷数,离子半径
阳离子使带负电荷胶粒的胶体凝聚的能力顺序为:Al3+>Fe3+>H+>Mg2+>Na+
阴离子使带正电荷胶粒的胶体凝聚的能力顺序为:SO42->NO3->Cl-
(2)加入带异性电荷胶粒的胶体:(3)加热、光照或射线等:加热可加快胶粒运动速率,增大胶粒之间的碰撞机会.如蛋白质溶液加热,较长时间光照都可使其凝聚甚至变性.
5、胶体的应用
胶体的知识在生活、生产和科研等方面有着重要用途,如常见的有:
① 盐卤点豆腐:将盐卤( )或石膏( )溶液加入豆浆中,使豆腐中的蛋白质和水等物质一起凝聚形成凝胶.
② 肥皂的制取分离 ③ 明矾、 溶液净水④ FeCl3溶液用于伤口止血 ⑤ 江河入海口形成的沙洲⑥ 水泥硬化 ⑦冶金厂大量烟尘用高压电除去⑧ 土壤胶体中离子的吸附和交换过程,保肥作用
⑨ 硅胶的制备: 含水4%的 叫硅胶
⑩ 用同一钢笔灌不同牌号墨水易发生堵塞
四、离子反应
1、电离 ( ionization )
电离:电解质溶于水或受热熔化时解离成自由离子的过程.
酸、碱、盐的水溶液可以导电,说明他们可以电离出自由移动的离子.不仅如此,酸、碱、盐等在熔融状态下也能电离而导电,于是我们依据这个性质把能够在水溶液里或熔融状态下能导电的化合物统称为电解质.
2、电离方程式
H2SO4 = 2H+ + SO42- HCl = H+ + Cl- HNO3 = H+ + NO3-
硫酸在水中电离生成了两个氢离子和一个硫酸根离子.盐酸,电离出一个氢离子和一个氯离子.硝酸则电离出一个氢离子和一个硝酸根离子.电离时生成的阳离子全部都是氢离子的化合物我们就称之为酸.从电离的角度,我们可以对酸的本质有一个新的认识.那碱还有盐又应怎么来定义呢?
电离时生成的阴离子全部都是氢氧根离子的化合物叫做碱.
电离时生成的金属阳离子(或NH4+)和酸根阴离子的化合物叫做盐.
书写下列物质的电离方程式:KCl、NaHSO4、NaHCO3
KCl == K+ + Cl― NaHSO4 == Na+ + H+ +SO42― NaHCO3 == Na+ + HCO3―
这里大家要特别注意,碳酸是一种弱酸,弱酸的酸式盐如碳酸氢钠在水溶液中主要是电离出钠离子还有碳酸氢根离子;而硫酸是强酸,其酸式盐就在水中则完全电离出钠离子,氢离子还有硫酸根离子.
〔小结〕注意:1、 HCO3-、OH-、SO42-等原子团不能拆开
2、HSO4―在水溶液中拆开写,在熔融状态下不拆开写.
3、电解质与非电解质
①电解质:在水溶液里或熔化状态下能够导电的化合物,如酸、碱、盐等.
②非电解质:在水溶液里和熔融状态下都不导电的化合物,如蔗糖、酒精等.
小结
(1)、能够导电的物质不一定全是电解质.
(2)、电解质必须在水溶液里或熔化状态下才能有自由移动的离子.
(3)、电解质和非电解质都是化合物,单质既不是电解也不是非电解质.
(4)、溶于水或熔化状态;注意:“或”字
(5)、溶于水和熔化状态两各条件只需满足其中之一,溶于水不是指和水反应;
(6)、化合物,电解质和非电解质,对于不是化合物的物质既不是电解质也不是非电解质.
4、电解质与电解质溶液的区别:
电解质是纯净物,电解质溶液是混合物.无论电解质还是非电解质的导电都是指本身,而不是说只要在水溶液或者是熔化能导电就是电解质.5、强电解质:在水溶液里全部电离成离子的电解质.
6、弱电解质:在水溶液里只有一部分分子电离成离子的电解质.
强、弱电解质对比
强电解质 弱电解质
物质结构 离子化合物,某些共价化合物 某些共价化合物
电离程度 完全 部分
溶液时微粒 水合离子 分子、水合离子
导电性 强 弱
物质类别实例 大多数盐类、强酸、强碱 弱酸、弱碱、水
8、离子方程式的书写• 第一步:写(基础) 写出正确的化学方程式
第二步:拆(关键) 把易溶、易电离的物质拆成离子形式(难溶、难电离的以及气体等仍用化学式表示) 第三步:删(途径)
删去两边不参加反应的离子第四步:查(保证)检查(质量守恒、电荷守恒)
※离子方程式的书写注意事项:
1.非电解质、弱电解质、难溶于水的物质,气体在反应物、生成物中出现,均写成化学式或分式.2.固体间的反应,即使是电解质,也写成化学式或分子式.
3.氧化物在反应物中、生成物中均写成化学式或分子式.4.浓H2SO4作为反应物和固体反应时,浓H2SO4写成化学式.5金属、非金属单质,无论在反应物、生成物中均写成化学式.微溶物作为反应物时,处于澄清溶液中时写成离子形式;处于浊液或固体时写成化学式.1年前查看全部
- 初一上册数学第四章知识点,快9点半之前就要.
 雨风共舞1年前3
雨风共舞1年前3 -
 psmlrjp 共回答了13个问题
psmlrjp 共回答了13个问题 |采纳率84.6%立体图形,平面图形,点线面体,直线射线线段,角平分线,余角补角,方位角..还蛮多的.1年前查看全部
- 高一理科没听,差到一种地步了.基础知识都不会,马上放暑假了.这几天我一个人在家边看练习边看书,碰到知识点该记的该背的就用
高一理科没听,差到一种地步了.基础知识都不会,马上放暑假了.这几天我一个人在家边看练习边看书,碰到知识点该记的该背的就用本子记下来背,还准备找老师一对一从头补一遍,
 kattybarry1年前1
kattybarry1年前1 -
 Google测试员413 共回答了24个问题
Google测试员413 共回答了24个问题 |采纳率95.8%你好:化学很多的知识点都是需要背的,但是学到有机化学后要学会类比,就是记住一个反应区类推其他的反应.化学还是在理科中比较重要的,还是需要补补的,不补到后面是有点听不懂的
希望对你有帮助
满意请采纳,O(∩_∩)O谢谢
欢迎追问O(∩_∩)O~1年前查看全部
- 求初中英语的语法知识 句子结构 重要词组单词 知识点什么的 最好有列句
求初中英语的语法知识 句子结构 重要词组单词 知识点什么的 最好有列句
英语书是仁爱的 鼠你唯一1年前2
鼠你唯一1年前2 -
 9monkey18 共回答了11个问题
9monkey18 共回答了11个问题 |采纳率90.9%1.欣赏;享受;喜爱[+v-ing]
I enjoyed reading these books very much.
我很喜欢读这些书.
Tom doesn't enjoy going to school.
汤姆不喜欢上学.
I very much enjoyed the party.
我非常喜欢这次聚会.
I enjoy songs such as this one.
我欣赏像这首一样的歌.
2.【书】享有(利益、权利、声誉等)
We enjoy free medical care.
我们享受免费医疗.
I enjoy good health.
我身体很健康.
3.使过得快活;使得到乐趣[+oneself]
Are you enjoying yourself?
你玩得高兴吗? .
Quiet quiet美音:['kwaɪət]英音:['kwaiət]
quiet的中文翻译
词典解释
形容词 a.
1. 安静的;轻声的;沉默的
Be quiet!
安静!
2. 宁静的,安定的;平静的
The sea was quiet before the storm struck.
暴风雨来袭前海面很平静.
3. 秘密的,不公开的
4. 文静的,温和的
He was a quiet man who didn't let small things upset him.
他是个性格平和的人,从不为小事生气.
5. (衣服、颜色等)素净的1年前查看全部
- 初一上册英语的知识点(如语法、词汇之类的)哪位大侠有比较详细的概括
 pieser1年前1
pieser1年前1 -
 lp003736 共回答了15个问题
lp003736 共回答了15个问题 |采纳率80%初一上册英语知识点:
【知识梳理】
I. 重点短语
1. Sit down2. on duty3. in English4. have a seat5. at home6. look like7. look at
8. have a look9. come on10. at work11. at school12. put on13. look after
14. get up15. go shopping
II. 重要句型
1. help sb. do sth.2. What about…?3. Let’s do sth.4. It’s time to do sth.
5. It’s time for …6. What’s…? It is…/ It’s…7. Where is…? It’s….
8. How old are you? I’m….9. What class are you in? I’m in….
10. Welcome to….11. What’s …plus…? It’s….12. I think…
13. Who’s this? This is….14. What can you see? I can see….
15. There is (are) ….16. What colour is it (are they)? It’s (They’re)…
17. Whose …is this? It’s….18. What time is it? It’s….
III. 交际用语
1. Good morning, Miss/Mr….2. Hello! Hi!
3. Nice to meet you. Nice to meet you, too.
4. How are you? I’m fine, thank you/thanks. And you?
5. See you. See you later.6. Thank you! You’re welcome.7. Goodbye! Bye!
8. What’s your name? My name is ….9. Here you are. This way, please.
10. Who’s on duty today?11. Let’s do.12. Let me see.
IV. 重要语法
1. 动词be的用法;
2. 人称代词和物主代词的用法;
3. 名词的单复数和所有格的用法;
4. 冠词的基本用法;
5. There be句型的用法.
【名师讲解】
1. in/on
在表示空间位置时,in表示在某个空间的范围以内,on表示在某一个物体的表面之上.例如:
There is a bird in the tree. 树上有只鸟.
There is a picture on the wall. 墙上有张图.
2. this/that/these/those
(1)this常常用来指在时间、地点上更接近讲话人的人和事,these是this的复数形式.that常常用来指在时间、地点上离讲话人更远一点的人和事,those时that的复数形式.例如:
You look in this box and I’ll look in that one over there.你看看这个盒子,我去看那边的那个盒子.
I want this car, not that car. 我想要这辆小汽车,不是那一辆.
Take these books to his room, please. 请把这些书拿到他房间去.
This is mine; that’s yours. 这个是我的,那个是你的.
These are apples; those are oranges. 这些是苹果,那些是橘子.
(2)在打电话的用语中,this常常指的是我,that常常指的是对方.例如:
This is Mary speaking. Who’s that? 我是玛丽.你是谁?
3. There be/ have
There be "有",其确切含意为"某处或某时存在某人或某物."其结构是:There be + 某人或某物 + 表示地点或时间的状语.There be 后面的名词实际上是主语,be 动词的形式要和主语在数上保持一致,be动词后面的名词是单数或不可数名词时用is,名词是复数时用are.例如:
(1) There is a big bottle of coke on the table. 桌上有一大瓶子可乐.
(2) There is a doll in the box. 那个盒子里有个娃娃.
(3) There are many apples on the tree. 那树上有许多苹果.
总之,There be结构强调的是一种客观存在的"有".have表示"拥有,占有,具有",即:某人有某物(sb. have / has sth.).主语一般是名词或代词,与主语是所属关系.例如:
(4) I have two brothers and one sister.我有两个兄弟,一个姐姐.
(5) That house has four rooms.那所房子有四个房间.
4. look/ see/ watch
(1)look 表示“看、瞧”,着重指认真看,强调看的动作,表示有意识地注意看,但不一定看到,以提醒对方注意.,如:
Look! The children are playing computer games. 瞧!孩子们在玩电脑游戏.
Look! What’s that over there? 看!那边那个是什么?
单独使用是不及物动词,如强调看某人/物,其后接介词at,才能带宾语,如:
He’s looking at me.他正在看着我.
(2)see强调“看”的结果,着重的是look这个动作的结果,意思是“看到”,see是及物动词,后面能直接跟宾语.如:
What can you see in the picture? 你能在图上看到什么?
Look at the blackboard. What did you see on it?看黑板!你看到了什么?
(3)watch“观看,注视”,侧重于场面,表示全神贯注地观看、观察或注视某事务的活动,强调过程,常用于“看电视、看足球、看演出”等.如:
Yesterday we watched a football match on TV.昨天我们从电视上看了一场足球比赛.
4. put on/ / in
put on意为“穿上,戴上”.主要指“穿上”这一动作, 后面接表示服装、鞋帽的名词.
in 是介词,表示“穿着”强调状态.在句中可以做定语、标语和状语.如:
It’s cold outside, put on your coat. 外面冷,穿上你的外衣.
He puts on his hat and goes out. 他戴上帽子,走了出去.
The woman in a white blouse is John’s mother.穿白色衬衣的那个妇女是John的妈妈.
5. house/ home/family
house :“房子”,指居住的建筑物; Home: “家”,指一个人同家人共同经常居住的地方; Family: “家庭“,“家庭成员”.例如:
Please come to my house this afternoon. 今天下午请到我家来.
He is not at home. 他不在家.
My family all get up early. 我们全家都起得很早.
6. fine, nice, good, well
四者都可用作形容词表示"好"之意,但前三者既可作表语又可作定语,而后者仅用作表语.主要区别在于:
(1) fine指物时表示的是质量上的"精细",形容人时表示的是"身体健康",也
可以用来指"天气晴朗".例如:
Your parents are very fine. 你父母身体很健康.
That's a fine machine. 那是一台很好的机器.
It's a fine day for a walk today. 今天是散步的好时候.
(2)nice主要侧重于人或物的外表,有"美好","漂亮"的意思,也可用于问候或赞扬别人.例如:
Lucy looks nice. 露西看上去很漂亮.
These coats are very nice. 那些裙子很好看.
Nice to meet you. 见到你很高兴.
It's very nice of you. 你真好.
(3)good形容人时指"品德好",形容物时指"质量好",是表示人或物各方面都好的普通用语.例如:
Her son is a good student. 她儿子是一个好学生.
The red car is very good. 那辆红色小汽车很好.
(4)well只可用来形容人的"身体好",但不能作定语,它也能用作副词作状语,多放在所修饰的动词之后.例如:
I'm very well, thanks. 我身体很好,谢谢.
My friends sing well. 我的朋友们歌唱得好.
【考点扫描】
中考考点在本单元主要集中在:
1. 动词be的用法;
2. 人称代词和物主代词的用法;
3. 名词的单复数和所有格的用法;
4. 冠词的基本用法;
5. There be句型的用法.
6. 本单元学过的词汇、短语和句型;
7. 本单元学过的日常交际用语.
考试形式可以是单项填空、完型填空、短文填空、完成句子.1年前查看全部
- 怎样提高英语阅读理解(初中)?我认为,1多看多做,每做一篇终结一个知识点,几个词汇,这对于完形填空是好的.2还要有粗读,
怎样提高英语阅读理解(初中)?
我认为,
1多看多做,每做一篇终结一个知识点,几个词汇,这对于完形填空是好的.
2还要有粗读,样样都精读不好,无论对应试教育还是素质教育来说,都不好.
我有什么不好想法尽管提出来! _qmkk_223yf0c_921年前1
_qmkk_223yf0c_921年前1 -
 sevenacid 共回答了15个问题
sevenacid 共回答了15个问题 |采纳率86.7%既然是阅读理解,第一就是要积累词汇量,第二就要多读,培养自己的语感,其次要养成良好的阅读习惯,比如阅读速度啊,注意力一定要集中才能提高阅读速度,读完第一遍之后整篇文章要在心里有个底,在做后面的题遇到不清楚的地方便可以轻易找到问题所在的地方以节省时间.平常自己在练习的时候,就要限定每片文章的阅读时间,训练自己的速度,才能在考试中做到不慌不忙,胸有成竹.还有要学会放弃,在读第一遍的时候,有些不明白的地方要迅速扫过去,不要耿耿于怀,浪费时间.1年前查看全部
- 人教版八年级上英语全部知识点、语法
 秀水玫灵1年前3
秀水玫灵1年前3 -
 sistem1 共回答了26个问题
sistem1 共回答了26个问题 |采纳率92.3%1.形容词和副词的比较级
(1) 一般在形容词或副词后+er
older taller longer stronger, etc
(2) 多音节词前+more
more interesting, etc.
(3) 双写最后一个字母,再+er
bigger fatter, etc.
(4) 把y变i,再+er
heavier, earlier
(5) 不规则变化:
well-better, much/many-more, etc.
2.祈使句:
Sit down please
Don’t sit down, please.
3. there be 结构
肯定句: There is a …
There are …
一般疑问句:Is there …? Yes, there is./ No, there isn’t.
Are there…? Yes, there are. /No, there aren’t.
否定句: There isn’t …. There aren’t….
4.一般现在时:通常用 “usually, often, every day, sometimes”.
形式:
肯定句:
I go to school on foot every day.
She goes to school on foot every day.
5.现在进行时:形式: be + verb +ing
eg: I am(not) doing my homework.
You/We/They are(not) reading.
He/She/It is(not) eating.
动词 —ing 的形式
Most verbs +ing walk—walking
Verbs ending in e -e + ing come—coming
Short verbs ending in a vowel + a consonant run –running swim—swimming
6.
重点的句型:
1.How many + 复数名词 + are there ...?
此句型是一个特殊疑问句,意思是"在.有多少.?"多用来对可数名词的数量提问.How many 后面要接可数名词的复数形式.如:
How many apples are there on the table? 桌子上有多少个苹果?
2.. What about ...?
此句型意思是".怎么样?"、".呢?",通常用来询问情况或征求意见、看法等.其中的about是介词,后面可接名词、代词或动词等.如:
What about that computer? 那台电脑怎么样?
My gloves are red. What about theirs? 我的手套是红色的,他们的呢?
What about playing games after school? 放学后做游戏怎么样?
3. What time is it?/What's the time?
英语中,常用这两个句型来询问现在的时间,意思是"什么时间了?"或"几点了?"其答语一般用"It's + 时间."其中的it指代时间,翻译时可不译,常在句尾加上please,以表示委婉的语气.如:
What time is it, please? 请问现在几点了?
-It's about a quarter past ten. 大约十点十五分.
4. What colour + be + 主语?
询问某物的颜色,一般用以What colour 开头的特殊疑问句,其答语通常用"It's/They're + 表示颜色的形容词".如:
-What colour is her blouse? 她的衬衫是什么颜色的?
-It's light blue. 是浅蓝色的.
5.Whose + 名词 + be + 其它?/Whose + be + 名词?
英语中常用这两个句型来询问某事物属谁所有.如:
Whose cup is that? 那是谁的杯子?
Whose are these photos? 这些照片是谁的?
6. It's time for + sth. /It's time to do sth. / It's time for sb. to do sth.
这个结构意思都是"该做某事了","到做某事的时候了".如:
It's time for school. 到上学的时候了.
It's time to have supper. 该吃晚饭了.
7. 选择疑问句:选择疑问句是用or连接询问的两部分,以供选择,答案必须是完整的句子或其省略形式,不能用Yes或No回答
一般提出两种或两种以上的可能,问对方选择哪一种.其结构可用一般疑问句,也可用特殊疑问句.供选择的两部分用or连接,前者读升调,后者读降调.
e.g. Will you go there by bus or by train?
What would you like, coffee or tea?
How many pens do you have, one or two?
选择疑问句的答语必须是完整的句子或其省略式,不能答yes或no.
e.g. Do you go to school by bus or by bike?
By bus.
Which would you like, tea or coffee? Coffee.
一般疑问句演化来的选择疑问句
e.g. Is it right or wrong?
Were you or he there?
Are they reading, chatting or watching TV?
特殊疑问句演化来的选择疑问句
e.g. Which do you like better, coffee or milk?
What color is it, red, blue or yellow?
Where are you going, to the classroom or to the library?
or not构成的选择疑问句
e.g. Do you want to buy it or not?
Are you ready or not
8.另外,“to be + going + 动词不定式”这个特殊的结构可表示在未来即将要进行的动作.
例:He is going to tell me tomorrow - 他将在明天告诉我.
练习题:
There are ____ water in the bottle.(B)瓶子里有一点水
There are ____ water in the bottle.(A)瓶子里没水了
There are ____ students in the classroom.(D)教室里有几个学生
There are ____ students in the classroom(C)教室里没有学生
There are ____ apples on the trees.(D)有几个苹果长在树上
选项统一为
A、little B、a little C、few D、a few
3. Of course,every one of us_1__to make friends like food---they are useful to us,and they can help us when we are _2__need._3__you can make as many friends of this kind as possible.
(1) A.want B.will want C.wants
(2) A.in B.on C.for D.of
(3) A.And B.But C.So D.Because
答案:CAC
4.Twenty minutes later,John_1__a tree.His leg was broken,and it hurt _2__.
Mr smith _3__to mend the chair.then he_4__himself with a hammer.
(1) A.fell over B.fell from C.fell down D.fell on
(2) A.all the day B.all day C.whole day D.all days
(3) A.starts B.started C.was starting
(4) A.damaged B.knocked C.hit D.cut
答案:BABC1年前查看全部
- 有一个知识点不清楚.1.大脑皮层产生的渴觉 和 下丘脑水盐平衡有感觉 这两个感觉不是一个意思吗?不是都在说感觉吗?2.而
有一个知识点不清楚.
1.大脑皮层产生的渴觉 和 下丘脑水盐平衡有感觉 这两个感觉不是一个意思吗?不是都在说感觉吗?
2.而反射弧中,结构破坏对功能的影响里面,破坏感受器,会没感觉没效应,这里的没感觉是指什么? 务午cc1年前2
务午cc1年前2 -
 无所求_kqy 共回答了24个问题
无所求_kqy 共回答了24个问题 |采纳率79.2%产生渴觉是意识,只有下丘脑感受到体液中水盐不平衡了,通知了大脑皮层,你才知道渴了,如果切断下丘脑和大脑皮层的神经连接,你就感觉不到了渴了
破坏了感受器,就无法产生神经刺激,神经冲动无法到达大脑,也可以说,如果你没看见,你就不知道出现了什么刺激,比如,破坏了膝跳反射的感受器,锤子敲上去,你的小腿就不会跳,因为刺激无法传递到下丘脑,你的大脑认为根本就没有敲你的小腿1年前查看全部
- 求小学数学的分数方面知识点?
 爱上布达拉1年前1
爱上布达拉1年前1 -
 linxingliang 共回答了25个问题
linxingliang 共回答了25个问题 |采纳率100%人教版五年级数学下册
一、 分数的意义和性质
1 分数的意义
2真分数和假分数
3 分数的基本性质.
4 最大公约数和最小公倍数
5 约分.通分
6 分数和小数的互化
二、分数的加减
1 分数加法和减法的意义.
加法:把两个数合并成一个数的运算.
减法:已知两个加数的和与其中一个加数,求另一个加数的运算.
2计算方法与歩骤
(1) 同分母分数加法,减法
方法:分母不变.分子相加减
(2) 异分母分数加.减
方法:先通分,后加减.
(3) 分数加减混合运算
① 不带括号的,从左到右顺序计算
② 带括号的,先做括号里的,再做括号外的
(4) 简便运算
整数加法交换律,结合律对于分数加法同样适用
1年前查看全部
- 数学大神围观,回答这些问题1.问题是什么 2.涉及知识点。3.分析过程 4.解答 5.点评。
数学大神围观,回答这些问题1.问题是什么 2.涉及知识点。3.分析过程 4.解答 5.点评。
数学大神围观,回答这些问题1.问题是什么 2.涉及知识点。3.分析过程4.解答5.点评。并且解答以下问题
 fourteeny1年前0
fourteeny1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 统计学相关知识总结,每个知识点都找十条,比如统计学十大事件,十大公式,诸如此类,共要十个十.
统计学相关知识总结,每个知识点都找十条,比如统计学十大事件,十大公式,诸如此类,共要十个十.
只要是与统计有关的,什么都可以,十个图啊,十个重要理论啊,十个名词啊,十个专用说法啊,都可以 ,跪求专家总结. zhangjie19991年前1
zhangjie19991年前1 -
 wl0708 共回答了16个问题
wl0708 共回答了16个问题 |采纳率93.8%统计学十个基本概念:总体、样本、变量、资料、误差、频率、概率、抽样、同质、变异计量资料统计描述指标十个:算数均数、几何均数、中位数、百分位数、极差、四分位数间距、方差、标准差、变异系数、正态分布统计图...1年前查看全部
- 求这个英语句子里的知识点(从句意分析),语法,时态,结构
求这个英语句子里的知识点(从句意分析),语法,时态,结构
One dream is not always enough,especially for a person who loves and cares for his people. 该起什么名字呢1年前1
该起什么名字呢1年前1 -
 娃哈哈cloh 共回答了15个问题
娃哈哈cloh 共回答了15个问题 |采纳率93.3%这句子意思是,一个梦想并不够,尤其是对于那些深爱和关心自己身边的人来说.
全句是一般现在时态.
One dream is not always enough,明显主系表.主语One dream,表语 enough,表示足够的.
especially for a person who loves and cares for his people.who 引导的是定语从句.补充说明a person是什么样的person呢,是loves and cares for his people的人.
One dream is not always enough for a person who loves and cares for his people,这样改也是对的.1年前查看全部
- 新目标八年级下英语重点语法与知识点
新目标八年级下英语重点语法与知识点
格式最好是 get onalong well with sb 这种 最好分类单元
翻译 candy77271年前1
candy77271年前1 -
 在路上1981 共回答了12个问题
在路上1981 共回答了12个问题 |采纳率91.7%知识点:
1. 形容词,副词的比较等级考查热点透视:
a) 表示A与B在程度上相同时,“as+形容词或副词的原级+as”结构.表示A不如B时,可用“not as/so+形容词或副词的原级+as”结构.
b) 表示A比B在程度上“更…..”时,可用“形容词或副词的比较级+than”结构
c) 表示三者或三者以上的比较,其中一个在程度上“最…..”时,常用“the+形容词或副词的最高级”结构,后面可带“of/in的短语”来说明比较的范围.(注意:副词的最高级在句中常省略“the”.)
d) 在形容词或副词的比较级前,可以用“a little,even,far,much,still”的等词语来修饰,以加强语气.
e) 表示“越来越….”时,常用“形容词或副词的比较级+and+形容词或副词的比较级”结构,但要注意,对于多音节和部分双音节形容词,副词而言,若要表达此意时,要用“more and more+形容词或副词的原级“结构.
f) 在表示“其中最….之一“的含义时,常使用 “one of+the+形容词最高级形式+名词复数”结构,其中的定冠词the不可以省略.
g) 如果强调“两者中比较…的(一个)”的意思时,可使用“the+形容词比较级+其它”结构.
h) 表示“越….越….”,可使用“the+形容词或副词的比较级,the+形容词或副词的比较级”结构.
2 .一般将来时
a) 一般将来时的构成:由助动词shall或will加动词原形构成,shall用于第一人称.在口语中,will在名词或代词后常简略为’ll,will not常简略为won’t.这个时态的肯定,否定和疑问结构可表示如下:
肯定句
否定句
疑问句
I (We)shall(will) go.
You(He,She,They) will go.
I(We)shall(will) not go.
You(He,She,They)will not go.
Shall I(we) go?
Will you (he,she,they) go?
用”be going to +动词原形”也可表示将来时,表示将要发生的事,打算或决定要做的事.
b)一般将来时的用法:1)表示将要发生的动作或情况;2) 不以人的意志为转移,肯定要发生的事情.The day after tomorrow will be National Day.后天是国庆日.
3.in/after:in是指以现在时间为起点的“在一段时间以后”.也可以表示“在将来多少时间之内”,句子中的谓语动词要用一般将来时态;after常指以过去时间为起点的“一段时间之后”,所以它与过去时态连用.当after指某个特定的未来时刻或日期之后,或指以将来某一时间为起点的若干时间之后时,它可以与将来时态连用.
4.more,less,fewer的用法区别:more为many,much的比较级,意为“更多”,可修饰可数与不可数名词.Less是little的比较级,意为“更好,较少”,修饰不可数名词.Fewer是few的比较级,意为“更少”,修饰可数名词复数.
【注意】few,little表示否定“几乎没有”.a few,a little表示肯定“一点,几个”.
5.would like sth意思为“想要某物“; would like to do意思为”想要做某事“.回答would like句型的一般疑问句时,其肯定回答为 “Yes,please.”;否定回答“No,thanks”或 “I’d like /love to,but….”
6.Such作形容词,意思是“如此的”“这样的”,修饰各种名词.
Ø Such这样的.如It is such bad weather.天气如此恶劣.1年前查看全部
- 有没有高中地理必修1知识点
 音绝空尘1年前1
音绝空尘1年前1 -
 洪兴 共回答了16个问题
洪兴 共回答了16个问题 |采纳率87.5%【第一章 宇宙中的地球】
1、天体系统的级别:总星系——银河系(河外星系)——太阳系——地月系
2、地球上生命存在的条件:①稳定的太阳光照条件②比较安全的宇宙环境③因为日地距离适中,地表温度适宜(平均气温为15度)④因为地球的质量和体积适中,地球能吸引大气形成大气层(氮、氧为主)⑤形成并存在液态水
3、太阳活动对地球的影响:
(1)太阳活动的标志:黑子、耀斑
(2)影响:影响电离层,干扰无线电短波通讯;产生“磁暴”现象和“极光”现象;影响地球气候.
4、地球自转的地理意义:
①昼夜交替:昼半球和夜半球的分界线——晨昏线(圈)——与赤道的交点的时间分别是6时和18时——太阳高度是0度——晨昏圈所在的平面与太阳光线垂直;
②地方时差:东早西晚,经度每隔15度相差1小时.
③沿地表水平运动物体的偏移:赤道上不偏,北半球右偏、南半球左偏.偏向力随纬度的增大而增大.
5、地球公转的地理意义:
(1)昼夜长短的变化:
①北半球夏半年,太阳直射北半球,北半球各纬度昼长夜短,纬度越高,昼越长夜越短.夏至日——北半球各纬度的昼长达到一年中的最大值,北极圈及其以北的地区,出现极昼现象.②北半球冬半年,太阳直射南半球,北半球各纬度夜长昼短,纬度越高,夜越长昼越短.冬至日——北半球各纬度的昼长达到一年中的最小值,北极圈及其以北的地区,出现极夜现象.③春分日和秋分日,太阳直射赤道,全球各地昼夜等长,各为12小时.
④赤道全年昼夜平分.南半球的情况与北半球的相反.
(2)正午太阳高度的变化:
同一时刻,正午太阳高度由太阳直射点向南北两侧递减,夏至日,太阳直射北回归线,正午太阳高度由北回归线向南北两侧递减,此时北回归线及其以北各纬度达到一年中的最大值,南半球各纬度达最小值.冬至日,太阳直射南回归线,正午太阳高度由南回归线向南北两侧递减,此时南回归线及其以南各纬度达到一年中的最大值,北半球各纬度达最小值.春分日和秋分日,太阳直射赤道,正午太阳高度自赤道向两极递减.
(3)四季的变化(昼夜长短和正午太阳高度随着季节而变化,使太阳辐射具有季节变化的规律,形成了四季)北半球季节的划分:3、4、5月为春季,6、7、8为夏季,9、10、11为秋季,12、1、2为冬季.
6、地球的圈层结构以地表为界分为内部圈层和外部圈层.
(1)地球内部的圈层根据地震波(纵波、横波)的特点划分为地壳、地幔、地核三个圈层.地壳物质主要由岩石(岩浆岩、沉积岩、变质岩)组成,上地幔的软流层是岩浆的源地,地核主要由铁镍物质组成.
(2)外部圈层:大气圈、水圈和生物圈.
【第二章 自然地理环境中的物质运动和能量交换】
1、岩石分三大类:①岩浆岩(岩浆上升冷却凝固而成)②沉积岩(岩石在外力的风化、侵蚀、搬运、堆积、固结成岩作用下形成)③变质岩(变质作用).从岩浆到形成各种岩石,三大类岩石可以相互转化,又到新岩浆的产生,这一运动变化过程,构成了地壳物质循环.
2、地表形态变化的内外力因素(地质作用):
(1)内力作用——能量来自地球本身,主要是地球内部热能,它表现为地壳运动、岩浆活动、变质作用.造成地表高低不平.地质构造的类型有褶皱(背斜和向斜)和断层(地垒和地堑).
(2)外力作用——能量来自地球外部,主要是太阳能和重力.使高低不平的地表趋向平坦.表现为风化、侵蚀、搬运、堆积、固结成岩作用.流水侵蚀地貌(V型谷)、堆积地貌(冲积扇、冲积平原和三角洲);风蚀地貌(风蚀洼地、蘑菇)、风积地貌(沙丘).
3、六大板块名称:亚欧板块、非洲板块、印度洋板块、太平洋板块、美洲板块、南极洲板块.一般说来,板块内部,地壳比较稳定,两个板块之间的交界处,是地壳比较活动的地带,火山、地震也多集中分布在板块的交界处.生长边界——板块张裂处,常形成裂谷、海洋.消亡边界——板块碰撞处,常形成山脉、海沟.
4、大气受热过程:太阳辐射(短波)、大气削弱、地面增温、地面辐射(长波)、大气增温、大气辐射(长波)、大气逆辐射(保温作用)
(1)大气对太阳辐射的削弱作用:①吸收作用:具有选择性,臭氧吸收紫外线,水汽和二氧化碳吸收红外线.对可见光吸收的很少.②反射作用:云层和颗粒较大的尘埃.云层的反射作用最显著.③散射作用:空气分子或微小尘埃,使一部分太阳辐射不能到达地面.
(2)大气对地面的保温作用:大气吸收地面辐射并产生大气逆辐射(射向地面的大气辐射),把部分热量归还给地面,云层越厚大气逆辐射越强.
5、全球近地面有7 个气压带(高低压相间分布),6 个风带.
(1)低纬度环流:
①赤道低压带:因为热力作用形成,气流辐合上升,易成云致雨,形成多雨带.常年受其控制形成热带雨林气候(亚马孙平原、刚果盆地、东南亚的马来群岛)
②副热带高压带:因为动力作用而形成,气流在30度纬度上空聚积而下沉,形成少雨带(东亚季风区除外),常年受其控制的地区形成热带沙漠气候(北非的撒哈拉水沙漠、西亚的沙漠、北美美国西部的沙漠、南美智利、秘鲁西部的沙漠、澳大利亚大沙漠)
③信风带:由副高吹向赤道低压的气流,在北半球右偏成东北信风,在南半球左偏成东南信风.
(2)中纬度环流:
④副极地低压带:由来自低纬的暖气流与来自高纬的冷气流相遇运动上升而形成.形成温带多雨带.
⑤中纬西风带:由副高吹向副极地低压带的气流,在北半球右偏成西南风,在南半球左偏成西北风,习惯上叫西风,受其常年控制的地区,在大陆西岸形成温带海洋性气候.(欧洲西部、北美西部如加拿大的温哥华附近、南美南端的安第斯山西侧、澳大利亚南端及塔斯马尼亚岛、新西兰等)
(3)高纬环流:
⑥极地高压带:因为热力作用而形成,冷空气下沉,形成少雨带.不过极地因为气温低,蒸发更少,所以极地属于降水量大于蒸发量的地区,为湿润地区.
⑦极地东风带:由极地高压带吹向副极地低压带的气流,在地转偏向力作用下,北半球右偏成东北风,南半球左偏成东南风.
(4)气压带和风带的移动:△移动的原因:随太阳直射点的移动而动.△移动方向:就北半球而言,大致是夏季北移,冬季南移.
(5)单一气压带或风带作用形成的气候类型:热带雨林气候(赤道低气压带)、热带沙漠气候(副热带高气压带)、温带海洋性气候(中纬西风带).
(6)气压带、风带移动形成的气候类型:热带草原气候(夏季受赤道低气压带控制,冬季受低纬信风带控制)、地中海气候(夏季受副热带高气压带控制,冬季受中纬西风带控制).
6、常见的天气系统:锋面系统(冷锋、暖锋、准静止锋)、气旋(低压)和反气旋(高压)、锋面气旋.气旋是低压,低压系统在实际大气中常会出现沿中心向一定方向延伸出的低压槽,在低压槽上形成了锋面系统.锋面与气旋是一个整体(高压系统是没有的).
7、水循环
(1)类型:海陆间大循环(大循环)、陆地循环(水量很少)、海洋循环(水量最大)
(2)各环节的名称:蒸发、降水、水汽输送、地表径流、地下径流、下渗、植物蒸腾
(3)意义:它使陆地水不断得到补充、更新,使水资源得以再生;塑造地表形态;联系四大圈层.
8、洋流:
(1)类型:按成因分风海流、密度流、补偿流;按性质分暖流和寒流.
(2)分布:△中低纬度——以副热带为中心的大洋环流,北半球顺时针流动(与半球反气旋方向一致),南半球逆时针方向流动(与南半球反气旋方向一致).△中高纬度(主要指北半球)——以副极地为中心的大洋环流.△南半球西风漂流,世界最强大的寒流.△北印度洋的季风洋流——夏季由西向东流,冬季由东向西流(夏顺冬逆).
(3)影响:①对气候的影响:暖流起到增温、增湿作用(西欧海洋性气候的形成,得益于北大西洋暖流);寒流起到降温、减湿作用(澳大利亚西海岸的维多利亚沙漠、秘鲁太平洋沿岸的阿塔卡马沙漠的形成都与沿岸的西澳大利亚寒流和秘鲁寒流有关)
②对海洋生物的影响——渔场的分布:寒暖流交汇处,给鱼类带来了丰富多样的饵料.
△北海道渔场——日本暖流与千岛寒流的交汇处.△纽芬兰渔场——拉布拉多寒流与墨西哥湾暖流的交汇处.△北海渔场——北大西洋暖流与高纬南下的冷海水交汇形成.△秘鲁渔场——上升补偿流使深层海水上泛,带来深海的硅酸盐类,使浮游生物大量繁殖,浮游生物又是鱼类的饵料.
③对海洋污染的影响:有利于污染物的扩散,加快净化速度;但也使污染物的范围扩大.
④对海洋运输事业的影响:顺流——航行速度快;逆流——航行速度慢.
【第三章 地理环境的整体性和区域差异】
1、地理环境包括自然地理环境和人文地理环境.自然地理要素包括气候、水文、地貌、生物、土壤等要素.
(1)气候的变化使地球上的水圈、岩石圈、生物圈等圈层得以不断改造,生物对地理环境的作用,归根结底是由于绿色植物能够进行光合作用.
(2)生物在地理环境形成中的作用:联系有机界与无机界,促使化学元素迁移;改造大气圈,使原始大气逐渐演化为现在大气;改造水圈,影响水体成分;改造岩石圈,促进岩石的风化和土壤的形成,使地理环境发生了深刻的变化.
环境创造了生物,生物又创造了现在的环境.所以生物是地理环境的生物,同时又是地理环境的塑造者
(3)地理环境各要素相互联系、相互制约和相互渗透,构成了地理环境的整体性.举例:我国西北内陆——由于距海远,海洋潮湿气流难以到达,形成干旱的大陆性气候——河流不发育,多为内流河——气候干燥,流水作用微弱,物理风化和风力作用显著,形成大片戈壁和沙漠,植被稀少,土壤发育差,有机质含量少.
2、地理环境的地域分异规律:
(1)从赤道到两极的地域分异(纬度地带性):受太阳辐射从赤道向两极递减的影响——自然带沿着纬度变化(南北)的方向作有规律的更替,这种分异是以热量为基础的.例如:赤道附近是热带雨林带,其两侧随纬度升高,是热带草原带、热带荒漠带.
(2)从沿海向内陆的地域分异(经度地带性):受海陆分布的影响,自然景观和自然带从沿海向大陆内部产生的有规律的地域分异,这种分异是以水分为基础的.例如:中纬度地区(特别是北半球中纬度地区)从沿海到内陆出现:森林带—草原带—荒漠带
(3)山地的垂直地域分异:在高山地区,随着海拔高度的变化,从山麓到山顶的水热状况差异很大,从而形成了垂直自然带.举例:赤道附近的高山,从山麓到山顶看到的自然带类似于从赤道到两极的水平自然带.
【第四章 自然环境对人类活动的影响】
1、聚落的形成与地理环境的关系,可从形态上反映出来:平原地区,地形比较完整、开阔、平坦,聚落呈圆形或不规则的多边形,规模较大;山区聚落沿河谷或在比较开阔的低地分布.例如:我国的汾河、渭河谷地城市的分布.世界上的大城市多数位于平原上.平原地区的区位优势:地势平坦,土壤肥沃,便于农耕,且有利于交通联系和节省建筑投资.也有的平原不适宜城市的发展.例如:热带地区,低地闷热,城市多分布在高原上,最著名的是巴西,其城市不是分布在亚马孙平原,而是巴西高原.
2、地形对交通线路分布的影响:公路选线避开不利地形,地形平坦地区的交通线网密度较大(造价低、工程量小),山地、丘陵地区的密度较小(造价高、工程量大).
3、全球气候变暖对农业生产有利方面:高纬度地区升温幅度最大,作物生长期延长,产量增加;对农业生产不有利方面:中纬度半湿润半干旱区,若降水量不变,增温将加速陆地蒸发,使土壤中水分减少,导致作物产量下降.对工业生产也有一定的影响,温度升高将减少高纬度地区供暖的能源消耗,明显增加低纬度地区制冷的能源消耗.
4、自然资源的定义:人类直接从自然界获得,并用于生产和生活的物质和能量.它包括气候资源、土地资源、水资源、生物资源、矿产资源.自然资源是人类文明和社会进步的物质基础.举例:能源利用对生产力的发展有巨大推动作用.△柴草为主要能源——社会生产力水平很低,△18世纪,煤炭为主要能源——社会生产力大幅提高,△20世纪50年代以后,石油为主要能源——极大地促进了生产的发展.
5、常见的自然灾害有水灾、旱灾、台风、暴雨、寒潮、沙尘暴、暴风雪、地震、火山、滑坡和泥石流.了解它们发生的主要原因及危害.1年前查看全部
- 本人高三生物知识点背得还算是可以,就是一做题就错,二三十分,
本人高三生物知识点背得还算是可以,就是一做题就错,二三十分,
每次做题时就好象没学过生物似的知识全用不上,完全不知怎么做,怎么办啊 我爱大饼_停1年前4
我爱大饼_停1年前4 -
 notchanger 共回答了14个问题
notchanger 共回答了14个问题 |采纳率92.9%学习不是光背知识点就可以的,还要融会贯通.拿一些题典之类的来看,看别人怎么分析的,在看在题中考的是哪些知识点,一一对应起来,慢慢的就会觉得会了.1年前查看全部
- 化学溶液的PH的计算知识点
 伊觅1年前2
伊觅1年前2 -
 唯一_Melo 共回答了18个问题
唯一_Melo 共回答了18个问题 |采纳率88.9%一、溶液的酸碱性及 pH 的值
1.pH 的定义:pH=-lg[H+] 注意: (1) 25℃时:PH +POH==14 (2)PH 的适用范围:CH+ (10-14 ,1),即 PH 常温下的范围为(0 ,14) 注意:任意水溶液中[H+]≠0,但 pH 可为 0,此时[H+]=1mol/L,一般[H+]>1mol/L 时,pH<0,故直接 用[H+]表示. 2. pH 的测定:pH 试纸、pH 计. pH 试纸: (1)只能读整数 (2)使用方法:用玻棒沾取待测试液于 pH 试纸中部,立即与标准比色卡进行 比色,以半分钟的颜色变化为标准. (3)pH 试纸事先不能润湿 3.pH 的计算:关键: (1)有反应的先考虑反应 (忽略体积变化)可能情况有三种: — ①若酸和碱恰好中和. 即 nH+=nOH ,pH=7. ②若酸过量,求出过量的[H+],再求 pH 值. — ③若碱过量,求出过量的[OH ],求出 pOH 后求 pH 值. (2)对单一酸溶液:找 CH+求 PH; 对单一碱溶液:先找氢氧根离子浓度再求氢离子浓度再转化为 PH 4.溶液呈的酸碱性的判断问题: — (1)绝对标准:取决于溶液中[H+]、[OH ]的相对大小. (2)25℃时:以 pH==7 为标准. 二、盐的水 1.水解规律:有盐想水解,有弱才水解, 越弱越水解,双弱双水解 谁强显谁性,等强显中性,双弱具体定.(取决于生成弱酸弱碱 相对强弱) (如 NH4CN 碱性 CH3COONH4 中性 (NH4)2SO3 酸性
2.注意: (1)盐的水解为中和反应的逆反应,但进行的程度很小,一般不超过 10℅.且为吸热过程. (2)盐的水解不一定影响溶液的 PH.如 CH3COONH4 个.
( (
(3)一般单一弱离子的水解程度很小,写可逆号且无气体或沉淀符号;而双水解则反之.且多元弱酸根的
水解与多元弱酸的电离相似都是分步进行的.已第一级为主. (4)弱酸的酸式盐有水解和电离两种趋势,一般以水解为主,但 NaHSO3 、NaH2PO4 溶液除外. (5)常用盐的水解知识判断溶液中离子浓度的大小和种类. 3.关于离子的共存问题: (1)有气体生成: (2)有沉淀生成: (3)有弱电解质生成: (4)发生氧化还原反应的微粒: (5)发生双水解的微粒(6)形成配合物的微粒: 注意:要特别注意理解间接告诉溶液人酸碱性的条件.如(!)与 Al 反应产生 H2 的溶液(可以是 H+/OH-) (2)常温下由水电离的 CH+ ==10-12<10-7,为外加了酸、碱的溶液. 三、盐类水解原理的应用 1.判断或解释盐溶液的酸碱性 例如:①正盐 KX、KY、KZ 的溶液物质的量浓度相同,其 pH 值分别为 7、8、9,则 HX、HY、HZ 的酸同条件下,测得①NaHCO3 ②CH3COONa ③NaAlO2 三种溶液的 pH 值相同.那实验么它们的物质 的量浓度由大到小的顺序是. 因为电离程度 CH3COOH>HAlO2 所以水解程度 NaAlO2>NaHCO3>CH3COON2 在相同条件下,要使三 种溶液 pH 值相同,只有浓度②>①>③ 2.分析盐溶液中微粒种类. 例如 Na2S 和 NaHS 溶液溶液含有的微粒种类相同,它们是 Na+、S2 、HS 、H2S、OH 、H+、H2O,但 微粒浓度大小关系不同. 3.比较盐溶液中离子浓度间的大小关系. 4.判断加热浓缩至盐干溶液能否得到同溶质固体. 注意: (1)加热易挥发性酸的盐溶液不能得到相应的溶质. (2)加热浓缩至盐干溶液能否得到同溶质固体还是水解产物主要由产物中的强电解质决定,若生成的 强电解质难挥发就能得到相应的溶质,反之不能. (3)制 Al2S3 只能是在干态下制得. 例.①碳酸钾与水溶液蒸干得到固体物质是原因是. ②KAl(SO4)2 溶液蒸干得到的固体物质是,原因是. ③碳酸钡溶液蒸干得到的固体物质是,原因是. ④亚硫酸钠溶液蒸干得到的固体物质是,原因是. ⑤氯化铝溶液蒸干得到的固体物质是,原因是. ⑥ 盐 酸 与 硫酸 各 1mol/L 的 混 合 酸 10mL, 加 热 浓 缩 至 1mL, 最 后 的 溶 液 为 , 原因是 . 5.某些盐溶液的配制、保存 在配制 FeCl3、AlCl3、CuCl2、SnCl2 等溶液时为防止水解,常先将盐溶于少量相应的酸中,再加蒸馏 水稀释到所需浓度. Na2SiO3、Na2CO3、NH4F 等不能贮存磨口玻璃塞的试剂瓶中,因 Na2SiO3、Na2CO3 水解呈碱性,产生较 多 OH ,NH4F 水解产生 HF,OH 、HF 均能腐蚀玻璃. 6.某些离子间因发生又水解而在溶液中不大量共存,如 ①Al3+与 S2 、HS 、CO32 、HCO3 、AlO2,SiO32 、ClO 、C6H5O 等不共存 ②Fe3 与 CO32 、HCO3 、AlO2 、ClO 等不共存 ③NH4+与 ClO 、SiO32 、AlO2 等不共存 7.泡沫灭火器内反应原理. NaHCO3 和 Al2(SO4)3 混合可发生双水解反应: 2HCO3 +Al3+==Al(OH3)↓+3CO2↑ 生成的 CO2 将胶状 Al(OH)3 吹出可形成泡沫 8.制备胶体或解释某些盐有净水作用 FeCl3、Kal2(SO4)2·12H2O 等可作净水剂. 原因:Fe3+、Al3+水解产生少量胶状的 Fe(OH)3、Al(OH)3,结构疏松、表面积大、吸附能力强,故它 们能吸附水中悬浮的小颗粒而沉降,从而起到净水的作用.
9.某些化学肥料不能混合使用 如铵态 (NH4+) 氮肥、 过磷酸钙[含 Ca(HPO4)2]均不能与草木灰 (主要成分 K2CO3) 混合使用.2NH4+ +CO32==2NH3↑+CO2↑+H2O
Ca2++2H2PO4 +2CO32 == CaHPO4↓+2HCO3 +HPO42 难溶物,不能被值物吸收
10.热的纯碱液去油污效果好. 产生的[OH ]较大, 而油污中的油脂在碱性较强的条件下, 水解受到促进, 加热能促进纯碱 Na2CO3 水解, 故热的比不冷的效果好. 11.在 NH4Cl 溶液中加入 Mg 粉,为何有 H2 放出? NH4++H2O NH3·H2O+H+ Mg+2H+===Mg2++H2↑ 12.除杂 例:除去 MgCl2 溶液中的 Fe3+可在加热搅拌条件下,加入足量 MgO 或 MgCO3 或 Mg(OH)2,搅拌充分 反应,后过滤除去. 13、三大守恒及其应用: (常用于比较离子浓度的大小) (1) .电荷守恒: (2) .物料守恒(原子守恒) : (3) .质子守恒: 注意:三大守恒的识别:
—
典型练习: 典型练习:
1、在 0.1mol/L 的 Na2S 溶液中,下列关系不正确的是( A.[S ] +[HS ] +[H2S] =
2-
)
2-
1 2
[Na ]
+
B.[Na ] +[H ] = 2[S ] +[HS ] +[OH ] D.[HS ] + 2[H2S] +[H ] = [OH ]
+ -
+
+
C.[NaHS] + 2[H2S] = [NaOH] A. [H ]> [SO4 ]> [NH4 ]> [OH ] C. [H ][OH ] = 1×10
+ -14 + 2+ -
2、25℃时,在 NH4HSO4 稀溶液中,离子浓度关系(假定 HSO4 在水中完全电离),不正确的是( B. [H ] + [ NH4 ] = 2 [SO4 ] +[OH ] D. [ NH4 ] = [H ]=[SO4 ]
+ 12 + + 2+ + 2-
)
3、常温下,0.1mol/L 的一元酸 HA 溶液的 pH=2,0.1mol/L 的一元碱 BOH 的溶液中[OH ]/[H ]=10 ,将此两种 溶液等体积混合后,所得溶液中离子浓度大小关系正确的是 A.[OH ] > [H ]>[B ]>[A ] C.[H ] [A ]> [H ] C.[M ] > [A ] > [OH ]> [H ] 断中一定正确的是( A.[A ]≤[M ] C. [A ]≥[M ]
+ + + + + + + + + + + -
B.[OH ] < [H ] [H ]= [OH ] ) B.[M ] > [A ] >[H ]> [OH ] D.[M ]+[H ]=[A ]+[OH ]
+ + + + + + -
-
+
-
+
4、等体积等浓度的 MOH 强碱溶液和 HA 弱酸溶液混合后,混合液中有关离子浓度应满足的关系是(
5、某一元酸(HA)溶液中,加入一定量的一种强碱(MOH)溶液后,恰好完全反应,则反应后溶液的下列判 ) B.若 MA 不水解,则[OH ]<[A ] D. 若 MA 水解,则[OH ]>[A ] )
+ -
6、100mL 0.1mol/L 醋酸与 50mL 0.2mol/L NaOH 溶液混合,在所得溶液中( A.[Na ] > [Ac ] >[OH ] > [H ] C. [Na ] > [Ac ] > [H ]= [OH ]
+ + -
B. [Na ] > [Ac ] > [H ] > [OH ] D. [Na ] = [Ac ] >[OH ] > [H ]
第 3 页 共 4 页
+ +
+
-
+
-
7、0.05mol/L H2SO4 和 0.1mol/L CH3COONa 溶液等体积混合后,离子浓度关系正确的是( )
汉马工作室——高考化学辅导资料
A、[Na ] = [SO4 ] >[H ] > [OH ] C、2[Na ]= [SO4 ]>[CH3COO ]>[OH ] 子数由多到少的顺序是( A.②①③④
+ + + 2-
+
2-
+
-
B、[Na ] > [SO4 ]>[CH3COO ]> [H ] D、[Na ] = 2[SO4 ] >[H ] >[CH3COO ]
+ 2+ -
+
2-
-
+
8、下列物质各取 0.1mol:①KCl ②Mg(OH)2 ③Na2CO3 ④MgSO4 .分别在 1L 水中充分搅拌后,所得溶液中阴离 )
C.③①④②
+ + -
B.③①②④
+ -
D.②③①④ )
+ -
9、pH=2 的盐酸与 pH=12 的氨水等体积混合后,溶液中离子浓度大小顺序正确的是( A.[Cl ] >[NH4 ] >[OH ]>[H ] C.[Cl ] >[NH4 ] >[H ]>[OH ]
+
B.[NH4 ] >[Cl ] > [OH ]> [H ] D.[NH4 ] >[Cl ] > [H ]> [OH ] ) HY + H3O
+ 2+ + + +
10、某酸的酸式盐 NaHY 在水溶液中,HY 的电离程度小于其水解程度.有关的叙述正确的是( A.H2Y 在电离时为:H2Y + H2O B.在该盐的溶液中,离子浓度为: [Na ]>[Y ]>[HY ]>[OH ]>[H ] C 在该盐的溶液中,离子浓度为: [Na ]>[HY ]>[Y ]>[OH ]>[H ] D.HY 水解方程式为:HY + H2O A.溶液总体积为 2VL C.溶液中[R ]+[OH ] = [Na ]+[H ] (
+ 2+ + 2+
H 3O + Y
+
2-
11、pH=3 的二元弱酸 H2R 溶液与 VLpH=11 的 NaOH 溶液混合后,混合液的 pH=7.下列判断正确的是( B.溶液中[R ]>[Na ]>[H ]= [OH ] D.溶液中 2[R ] + [HR ] = [Na ]
-1 2+ 2+ + -
)
12、(04 江苏)草酸是二元弱酸,草酸氢钾溶液呈酸性.在 O.1mol•L KHC2O4 溶液中,下列关系正确的是 ) A.c(K )+c(H )=c(HC2O4 )+c(OH )+c(C2O4 ) C.c(C2O4 )>c(H2C2O4) 的是(
+ 2+ 2-
B.c(HC2O4 )+c(C2O4 )=0.1 mol•L
+ -
-
2-
-1 2-
D.c(K )=c(H2C2O4)+c(HC2O4 )+c(C2O4 )
13、已知 100mL 0.5mol/L 的盐酸吸收 2.24L(标准状况)氨气,所得溶液的 pH>7.下列浓度大小的顺序正确 )
-
A.[NH4 ] > [Cl ] >[ NH3•H2O] C. [ NH3•H2O] > [NH4 ] > [Cl ] 溶液中,离子浓度之间的关系正确的是( A. [Cl ]>[NH4 ] >[H ]>[OH ] C. [H ]+[Cl ]=[NH4 ]+2[ NH3•H2O]+[OH ] ( ) A.[Na ]>[OH ]>[CO3 ]>[H ]>[HCO3 ] C. [Na ]>[CO3 ]>[HCO3 ]>[H ]>[OH ] A.[Na ]>[Ac ]>[NO3 ]>[H ]> [OH ] B. [Na ]>[Ac ]>[H ] >[NO3 ]> [OH ]
+ + + + + 2+ + 2+ + + + + + -
B. [Cl ] >[NH4 ]>[ NH3•H2O] D. [Cl ] >[NH4 ]=[ NH3•H2O] ) B. [Cl ] =[NH4 ] >[OH ] >[H ] D. [H ]+[NH4 ]= [Cl ]
+ + + + +
-
+
14、在 NH4Cl 溶液中含有多种分子和离子.100mL0.1mol/L 的盐酸与 50mL 0.2mol/L 的氨水混合,在所得的
15、在 1L 0.3mol/L 的 NaOH 溶液中通入标准状况下的二氧化碳 4.48L,完全反应后,则下列关系式正确的是 B. [Na ]>[HCO3 ]>[CO3 ]>[OH ]>[H ] D. [Na ]+[H ]=2[CO3 ]+[OH ]+[HCO3 ] )
+ + 2+ 2+
16、将等体积的 0.4mol/L NaAc 和 0.2mol/L HNO3 溶液混合,则混合液中下列关系正确的是(
C.将混合溶液加水稀释过程中,[H ]/[Ac ]的比值变小 D.将混合溶液稀释 10 倍以后,溶液的 pH 接近于 7,[NO3 ]=10 mol/L 17、混合相同物质的量浓度的 200mLBa(OH)2 溶液和 150mL NaHCO3 溶液,最终所得溶液中各离子物质的量浓度 大小顺序是(
2+ 2+ 10 -11
+
-
)
+ + -
A.[OH ]>[Ba ]> [Na ] = [HCO3 ] C. [OH ]>[Ba ]>[Na ]>[CO3 ]
2-
B. [Na ]>[OH ]>[Ba ]> [HCO3 ] D. [OH ]>[Na ]>[Ba ]>[CO3 ]
+ 2+ 2-
+
-
2+
-1年前查看全部
- 求化学必修2复习知识点
 elijah3141年前1
elijah3141年前1 -
 A20012940 共回答了17个问题
A20012940 共回答了17个问题 |采纳率100%第一章 物质结构 元素周期律
1.原子结构:如:的质子数与质量数,中子数,电子数之间的关系
2.元素周期表和周期律
(1)元素周期表的结构
A.周期序数=电子层数
B.原子序数=质子数
C.主族序数=最外层电子数=元素的最高正价数
D.主族非金属元素的负化合价数=8-主族序数
E.周期表结构
(2)元素周期律(重点)
A.元素的金属性和非金属性强弱的比较(难点)
a.单质与水或酸反应置换氢的难易或与氢化合的难易及气态氢化物的稳定性
b.最高价氧化物的水化物的碱性或酸性强弱
c.单质的还原性或氧化性的强弱
(注意:单质与相应离子的性质的变化规律相反)
B.元素性质随周期和族的变化规律
a.同一周期,从左到右,元素的金属性逐渐变弱
b.同一周期,从左到右,元素的非金属性逐渐增强
c.同一主族,从上到下,元素的金属性逐渐增强
d.同一主族,从上到下,元素的非金属性逐渐减弱
C.第三周期元素的变化规律和碱金属族和卤族元素的变化规律(包括物理、化学性质)
D.微粒半径大小的比较规律:
a.原子与原子 b.原子与其离子 c.电子层结构相同的离子
(3)元素周期律的应用(重难点)
A.“位,构,性”三者之间的关系
a.原子结构决定元素在元素周期表中的位置
b.原子结构决定元素的化学性质
c.以位置推测原子结构和元素性质
B.预测新元素及其性质
3.化学键(重点)
(1)离子键:
A.相关概念:
B.离子化合物:大多数盐、强碱、典型金属氧化物
C.离子化合物形成过程的电子式的表示(难点)
(AB,A2B,AB2,NaOH,Na2O2,NH4Cl,O22-,NH4+)
(2)共价键:
A.相关概念:
B.共价化合物:只有非金属的化合物(除了铵盐)
C.共价化合物形成过程的电子式的表示(难点)
(NH3,CH4,CO2,HClO,H2O2)
D 极性键与非极性键
(3)化学键的概念和化学反应的本质:
第二章 化学反应与能量
1.化学能与热能
(1)化学反应中能量变化的主要原因:化学键的断裂和形成
(2)化学反应吸收能量或放出能量的决定因素:反应物和生成物的总能量的相对大小
a.吸热反应:反应物的总能量小于生成物的总能量
b.放热反应:反应物的总能量大于生成物的总能量
(3)化学反应的一大特征:化学反应的过程中总是伴随着能量变化,通常表现为热量变化
练习:
氢气在氧气中燃烧产生蓝色火焰,在反应中,破坏1molH-H键消耗的能量为Q1kJ,破坏1molO = O键消耗的能量为Q2kJ,形成1molH-O键释放的能量为Q3kJ.下列关系式中正确的是( B )
A.2Q1+Q2>4Q3 B.2Q1+Q21年前查看全部
- 初二物理上册并联和串联的知识点对不起,我是新手2010年12月2日21点12分建
 蕴籍无上清凉1年前3
蕴籍无上清凉1年前3 -
 暂时林森_yy 共回答了26个问题
暂时林森_yy 共回答了26个问题 |采纳率88.5%判断电路的连接通常用电流流向法.既若电流顺序通过每个用电器而不分流,则用电器是串联;若电流通过用电器时前、后分岔,即,通过每个用电器的电流都是总电流的一部分,则这些用电器是并联.在判断电路连接时,通常会出现用一根导线把电路两点间连接起来的情况,在初中阶段可以忽略导线的电阻,所以可以把一根导线连接起来的两点看成一点,所以有时用“节点”的方法来判断电路的连接是很方便的.
电阻的串联有以下几个特点:(指R1,R2串联,串得越多,电阻越大)
①电流:I=I1=I2(串联电路中各处的电流相等)
②电压:U=U1 U2(总电压等于各处电压之和)
③ 电阻:R=R1 R2(总电阻等于各电阻之和)如果n个等值电阻串联,则有R总=nR
④ 分压作用:=;计算U1,U2,可用:;
⑤ 比例关系:电流:I1:I2=1:1
电阻的并联有以下几个特点:(指R1,R2并联,并得越多,电阻越小)
①电流:I=I1 I2(干路电流等于各支路电流之和)
②电压:U=U1=U2(干路电压等于各支路电压)
③电阻:(总电阻的倒数等于各电阻的倒数和)如果n个等值电阻并联,则有R总=R
④分流作用:;计算I1,I2可用1年前查看全部
- 初三的酸碱盐的共性 与初三上册化学知识点
 ydm19741年前1
ydm19741年前1 -
 香奈儿- 共回答了14个问题
香奈儿- 共回答了14个问题 |采纳率85.7%那个...貌似木有共性的说1年前查看全部
- 求高中数学必修1和必修5的知识点归纳阿,
求高中数学必修1和必修5的知识点归纳阿,
归纳不要太细了,不要太多了,好人一生平安. 长孙落樱1年前2
长孙落樱1年前2 -
 火凤凰1218 共回答了19个问题
火凤凰1218 共回答了19个问题 |采纳率89.5%集合(并集,交集,补集)
函数(指数,对数,幂函数),函数应用
解三角形(正弦定理,余弦定理)
数列(等差数列,等比数列)
不等式1年前查看全部
- 高中化学必修一知识点大纲以及考点
 记忆中逃避1年前1
记忆中逃避1年前1 -
 伤得很深 共回答了21个问题
伤得很深 共回答了21个问题 |采纳率85.7%小风制作
必修1全册基本内容梳理
从实验学化学
一、化学实验安全
1、(1)做有毒气体的实验时,应在通风厨中进行,并注意对尾气进行适当处理(吸收或点燃等).进行易燃易爆气体的实验时应注意验纯,尾气应燃烧掉或作适当处理.
(2)烫伤宜找医生处理.
(3)浓酸撒在实验台上,先用Na2CO3 (或NaHCO3)中和,后用水冲擦干净.浓酸沾在皮肤上,宜先用干抹布拭去,再用水冲净.浓酸溅在眼中应先用稀NaHCO3溶液淋洗,然后请医生处理.
(4)浓碱撒在实验台上,先用稀醋酸中和,然后用水冲擦干净.浓碱沾在皮肤上,宜先用大量水冲洗,再涂上硼酸溶液.浓碱溅在眼中,用水洗净后再用硼酸溶液淋洗.
(5)钠、磷等失火宜用沙土扑盖.
(6)酒精及其他易燃有机物小面积失火,应迅速用湿抹布扑盖.
二.混合物的分离和提纯
分离和提纯的方法 分离的物质 应注意的事项 应用举例
过滤 用于固液混合的分离 一贴、二低、三靠 如粗盐的提纯
蒸馏 提纯或分离沸点不同的液体混合物 防止液体暴沸,温度计水银球的位置,如石油的蒸馏中冷凝管中水的流向 如石油的蒸馏
萃取 利用溶质在互不相溶的溶剂里的溶解度不同,用一种溶剂把溶质从它与另一种溶剂所组成的溶液中提取出来的方法 选择的萃取剂应符合下列要求:和原溶液中的溶剂互不相溶;对溶质的溶解度要远大于原溶剂 用四氯化碳萃取溴水里的溴、碘
分液 分离互不相溶的液体 打开上端活塞或使活塞上的凹槽与漏斗上的水孔,使漏斗内外空气相通.打开活塞,使下层液体慢慢流出,及时关闭活塞,上层液体由上端倒出 如用四氯化碳萃取溴水里的溴、碘后再分液
蒸发和结晶 用来分离和提纯几种可溶性固体的混合物 加热蒸发皿使溶液蒸发时,要用玻璃棒不断搅动溶液;当蒸发皿中出现较多的固体时,即停止加热 分离NaCl和KNO3混合物
三、离子检验
离子 所加试剂 现象 离子方程式
Cl- AgNO3、稀HNO3 产生白色沉淀 Cl-+Ag+=AgCl↓
SO42- 稀HCl、BaCl2 白色沉淀 SO42-+Ba2+=BaSO4↓
四.除杂
注意事项:为了使杂质除尽,加入的试剂不能是“适量”,而应是“过量”;但过量的试剂必须在后续操作中便于除去.
五、物质的量的单位――摩尔
1.物质的量(n)是表示含有一定数目粒子的集体的物理量.
2.摩尔(mol): 把含有6.02 ×1023个粒子的任何粒子集体计量为1摩尔.
3.阿伏加德罗常数:把6.02 X1023mol-1叫作阿伏加德罗常数.
4.物质的量 = 物质所含微粒数目/阿伏加德罗常数 n =N/NA
5.摩尔质量(M)(1) 定义:单位物质的量的物质所具有的质量叫摩尔质量.(2)单位:g/mol 或 g..mol-1(3) 数值:等于该粒子的相对原子质量或相对分子质量.
6.物质的量=物质的质量/摩尔质量 ( n = m/M )
六、气体摩尔体积
1.气体摩尔体积(Vm)(1)定义:单位物质的量的气体所占的体积叫做气体摩尔体积.(2)单位:L/mol
2.物质的量=气体的体积/气体摩尔体积n=V/Vm
3.标准状况下, Vm = 22.4 L/mol
七、物质的量在化学实验中的应用
1.物质的量浓度.
二、物质的化学变化
氧化还原反应中概念及其相互关系如下:
失去电子——化合价升高——被氧化(发生氧化反应)——是还原剂(有还原性)
得到电子——化合价降低——被还原(发生还原反应)——是氧化剂(有氧化性)
金属及其化合物
一、
金属活动性Na>Mg>Al>Fe.
二、金属一般比较活泼,容易与O2反应而生成氧化物,可以与酸溶液反应而生成H2,特别活泼的如Na等可以与H2O发生反应置换出H2,特殊金属如Al可以与碱溶液反应而得到H2.
三、
A12O3为两性氧化物,Al(OH)3为两性氢氧化物,都既可以与强酸反应生成盐和水,也可以与强碱反应生成盐和水.
五、Na2CO3和NaHCO3比较
碳酸钠 碳酸氢钠
俗名 纯碱或苏打 小苏打
色态 白色晶体 细小白色晶体
水溶性 易溶于水,溶液呈碱性使酚酞变红 易溶于水(但比Na2CO3溶解度小)溶液呈碱性(酚酞变浅红)
热稳定性 较稳定,受热难分解 受热易分解
2NaHCO3 Na2CO3+CO2↑+H2O
与酸反应 CO32—+H+ H CO3—
H CO3—+H+ CO2↑+H2O
H CO3—+H+ CO2↑+H2O
相同条件下放出CO2的速度NaHCO3比Na2CO3快
与碱反应 Na2CO3+Ca(OH)2 CaCO3↓+2NaOH
反应实质:CO32—与金属阳离子的复分解反应 NaHCO3+NaOH Na2CO3+H2O
反应实质:H CO3—+OH- H2O+CO32—
与H2O和CO2的反应 Na2CO3+CO2+H2O 2NaHCO3
CO32—+H2O+CO2 H CO3—
不反应
与盐反应 CaCl2+Na2CO3 CaCO3↓+2NaCl
Ca2++CO32— CaCO3↓
不反应
主要用途 玻璃、造纸、制皂、洗涤 发酵、医药、灭火器
转化关系
六、.合金:
一、硅元素:
二、二氧化硅(SiO2)
天
三、硅酸(H2SiO3)
四、硅单质
五、氯元素:位于第三周期第ⅦA族,原子结构: 容易得到一个电子形成
氯离子Cl-,为典型的非金属元素,在自然界中以化合态存在.
六、氯气
物理性质:黄绿色气体,有刺激性气味、可溶于水、加压和降温条件下可变为液态(液氯)和固态.
制法:MnO2+4HCl (浓) MnCl2+2H2O+Cl2
闻法:用手在瓶口轻轻扇动,使少量氯气进入鼻孔.
化学性质:很活泼,有毒,有氧化性, 能与大多数金属化合生成金属氯化物(盐).也能与非金属反应:
七、氯离子的检验
使用硝酸银溶液,并用稀硝酸排除干扰离子(CO32-、SO32-)
HCl+AgNO3 == AgCl ↓+HNO3
NaCl+AgNO3 == AgCl ↓+NaNO3
Na2CO3+2AgNO3 ==Ag2CO?3 ↓+2NaNO3
Ag2CO?3+2HNO3 == 2AgNO3+CO2 ↑+H2O
Cl-+Ag+ == AgCl ↓
八、二氧化硫
制法(形成):硫黄或含硫的燃料燃烧得到(硫俗称硫磺,是黄色粉末)
S+O2 ===(点燃) SO2
物理性质:无色、刺激性气味、容易液化,易溶于水(1:40体积比)
化学性质:有毒,溶于水与水反应生成亚硫酸H2SO3,形成的溶液酸性,有漂白作用,遇热会变回原来颜色.这是因为H2SO3不稳定,会分解回水和SO2
十、大气污染
SO2 、NO2溶于雨水形成酸雨.防治措施:
① 从燃料燃烧入手.
② 从立法管理入手.
③从能源利用和开发入手.
④从废气回收利用,化害为利入手.
(2SO2+O2 2SO3 SO3+H2O= H2SO4)
十一、硫酸
物理性质:无色粘稠油状液体,不挥发,沸点高,密度比水大.
化学性质:具有酸的通性,浓硫酸具有脱水性、吸水性和强氧化性.是强氧化剂.
C12H22O11 2NO(无色、不溶于水的气体,有毒)
2NO+O2===2NO2(红棕色、刺激性气味、溶于水气体,有毒)
3NO2+H2O===2HNO3+NO,所以可以用水除去NO中的NO2
两条关系式:4NO+3O2+2H2O==4HNO3,4NO2+O2+2H2O==4HNO3
Ⅱ、氨气(NH3)
a、物理性质:无色、刺激性气味,密度小于空气,极易溶于水(1∶700),易液化,汽化时吸收大量的热,所以常用作制冷剂
b、分子结构:分子式——NH3,电子式—— ,结构式——H—N—H
c、化学性质:
①与水反应:NH3+H2O NH3•H2O(一水合氨) NH4++OH-,所以氨水溶液显碱性
②与氯化氢反应:NH3+HCl==NH4Cl,现象:产生白烟
d、氨气制备:原理:铵盐和碱共热产生氨气
方程式:2NH4Cl+Ca(OH)2===2NH3↑+2H2O+CaCl2
装置:和氧气的制备装置一样
收集:向下排空气法(不能用排水法,因为氨气极易溶于水)
(注意:收集试管口有一团棉花,防止空气对流,减缓排气速度,收集较纯净氨气)
验证氨气是否收集满:用湿润的红色石蕊试纸靠近试管口,若试纸变蓝说明收集满
干燥:碱石灰(CaO和NaOH的混合物)
Ⅲ、铵盐
a、定义:铵根离子(NH4+)和酸根离子(如Cl-、SO42-、CO32-)形成的化合物,如NH4Cl,NH4HCO3等
b、物理性质:都是晶体,都易溶于水
c、化学性质:
①加热分NH4Cl===NH3↑+HCl↑,NH4HCO3===NH3↑+CO2↑+H2O
②与碱反应:铵盐与碱共热可产生刺激性气味并能使湿润红色石蕊试纸变蓝的气体即氨气,故可以用来检验铵根离子的存在,如:NH4NO3+NaOH===NH3↑+H2O+NaCl,离子方程式为:NH4++OH-===NH3↑+H2O,是实验室检验铵根离子的原理.
d、NH4+的检验:NH4++OH-===NH3↑+H2O.操作方法是向溶液中加入氢氧化钠溶液并加热,用湿润的红色石蕊试纸靠近试管口,观察是否变蓝,如若变蓝则说明有铵根离子的存在.
20、硝酸
①物理性质:无色、易挥发、刺激性气味的液体.浓硝酸因为挥发HNO3产生“发烟”现象,故叫做发烟硝酸
②化学性质:a、酸的通性:和碱,和碱性氧化物反应生成盐和水
b、不稳定性:4HNO3=== 4NO2↑+2H2O+O2↑,由于HNO3分解产生的NO2溶于水,所以久置的硝酸会显黄色,只需向其中通入空气即可消除黄色
c、强氧化性:ⅰ、与金属反应:3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O
Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O
常温下Al、Fe遇浓硝酸会发生钝化,所以可以用铝制或铁制的容器储存浓硝酸
ⅱ、与非金属反应:C+4HNO3(浓)===CO2↑+4NO2↑+2H2O
d、王水:浓盐酸和浓硝酸按照体积比3:1混合而成,可以溶解一些不能溶解在硝酸中的金属如Pt、Au等
21、元素周期表和元素周期律
①原子组成:
原子核 中子 原子不带电:中子不带电,质子带正电荷,电子带负电荷
原子组成 质子 质子数==原子序数==核电荷数==核外电子数
核外电子 相对原子质量==质量数
②原子表示方法:
A:质量数 Z:质子数 N:中子数 A=Z+N
决定元素种类的因素是质子数多少,确定了质子数就可以确定它是什么元素
③同位素:质子数相同而中子数不同的原子互称为同位素,如:16O和18O,12C和14C,35Cl和37Cl
④电子数和质子数关系:不带电微粒:电子数==质子数
带正电微粒:电子数==质子数—电荷数
带负电微粒:电子数==质子数+电荷数
⑤1—18号元素(请按下图表示记忆)
H He
Li Be B C N O F Ne
Na Mg Al Si P S Cl Ar
⑥元素周期表结构
短周期(第1、2、3周期,元素种类分别为2、8、8)
元 周期(7个横行) 长周期(第4、5、6周期,元素种类分别为18、18、32)
素 不完全周期(第7周期,元素种类为26,若排满为32)
周 主族(7个)(ⅠA—ⅦA)
期 族(18个纵行,16个族) 副族(7个)(ⅠB—ⅦB)
表 0族(稀有气体族:He、Ne、Ar、Kr、Xe、Rn)
Ⅷ族(3列)
⑦元素在周期表中的位置:周期数==电子层数,主族族序数==最外层电子数==最高正化合价
⑧元素周期律:
从左到右:原子序数逐渐增加,原子半径逐渐减小,得电子能力逐渐增强(失电子能力逐渐减弱),非金属性逐渐增强(金属性逐渐减弱)
从上到下:原子序数逐渐增加,原子半径逐渐增大,失电子能力逐渐增强(得电子能力逐渐减弱),金属性逐渐增强(非金属性逐渐减弱)
所以在周期表中,非金属性最强的是F,金属性最强的是Fr (自然界中是Cs,因为Fr是放射性元素)
判断金属性强弱的四条依据:
a、与酸或水反应的剧烈程度以及释放出氢气的难易程度,越剧烈则越容易释放出H2,金属性越强
b、最高价氧化物对应水化物的碱性强弱,碱性越强,金属性越强
c、金属单质间的相互置换(如:Fe+CuSO4==FeSO4+Cu)
d、原电池的正负极(负极活泼性>正极)
判断非金属性强弱的三条依据:
a、与H2结合的难易程度以及生成气态氢化物的稳定性,越易结合则越稳定,非金属性越强
b、最高价氧化物对应水化物的酸性强弱,酸性越强,非金属性越强
c、非金属单质间的相互置换(如:Cl2+H2S==2HCl+S↓)
注意:“相互证明”——由依据可以证明强弱,由强弱可以推出依据
⑨化学键:原子之间强烈的相互作用
共价键 极性键
化学键 非极性键
离子键
共价键:原子之间通过共用电子对的形式形成的化学键,一般由非金属元素与非金属元素间形成.
非极性键:相同的非金属原子之间,A—A型,如:H2,Cl2,O2,N2中存在非极性键
极性键:不同的非金属原子之间,A—B型,如:NH3,HCl,H2O,CO2中存在极性键
离子键:原子之间通过得失电子形成的化学键,一般由活泼的金属(ⅠA、ⅡA)与活泼的非金属元素(ⅥA、ⅦA)间形成,如:NaCl,MgO,KOH,Na2O2,NaNO3中存在离子键
注:有NH4+离子的一定是形成了离子键;AlCl3中没有离子键,是典型的共价键
共价化合物:仅仅由共价键形成的化合物,如:HCl,H2SO4,CO2,H2O等
离子化合物:存在离子键的化合物,如:NaCl,Mg(NO3)2,KBr,NaOH,NH4Cl
常见物质或离子的检验方法
物质(离子) 方法及现象
Cl- 先用硝酸酸化,然后加入硝酸银溶液,生成不溶于硝酸的白色沉淀
SO42- 先加盐酸酸化,然后加入氯化钡溶液,生成不溶于硝酸的白色沉淀
CO32- 加入硝酸钡溶液,生成白色沉淀,该沉淀可溶于硝酸(或盐酸),并生成无色无味、能使澄清石灰水变浑浊的气体(CO2)
Al3+ 加入NaOH溶液产生白色沉淀,继续加入NaOH溶液,沉淀消失
Fe3+(★) 加入KSCN溶液,溶液立即变为血红色
NH4+(★) 与NaOH溶液共热,放出使湿润的红色石蕊试纸变蓝的刺激性气味的气体(NH3)
Na+ 焰色反应呈黄色
K+ 焰色反应呈浅紫色(透过蓝色钴玻璃)
I2 遇淀粉溶液可使淀粉溶液变蓝
蛋白质 灼烧,有烧焦的羽毛气味1年前查看全部
- 初三英语上册1-6单元知识点 不要提供书 要现成的
 唇间ss1年前1
唇间ss1年前1 -
 秋50702 共回答了14个问题
秋50702 共回答了14个问题 |采纳率100%动词不定式 一. 定义: 动词不定式是非谓语动词的一种,它没有人称和数的变化,在句子中不能独立作谓语,但它仍保持动词的特点,既可以有自己的宾语和状语.同时动词不定式又具有名词、形容词、副词的特征,在句...1年前查看全部
- 初中7上地理第一章第一节知识点
 禾星1年前1
禾星1年前1 -
 杨帆791015 共回答了21个问题
杨帆791015 共回答了21个问题 |采纳率85.7%形状 不规则的球体 证据 登高望远
海边看船
月食
环球航行
卫星照片
大小 表面积 〖5.1×10〗^8 km^2
赤道周长 40000km,
平均半径 6371km
地图 三要素 比例尺,图例,指向标
地球仪 描述地球大致形状的正球体1年前查看全部
- 初中7上地理第3章第1节知识点
 哈挖把1年前1
哈挖把1年前1 -
 anthea0307 共回答了13个问题
anthea0307 共回答了13个问题 |采纳率76.9%定义 天气是一个地方短时间的阴晴、风雨、冷热等的大气状况.
特点 1.时间短(24小时或48小时)
2.处于不断变化之中.
3.同时、不同地区有较大区别
天气预报 卫星云图 绿色表示陆地,蓝色表示海洋,白色表示云雨区.
常见天气符号 识别常用天气符号(特殊天气的符号和风向标),能看懂简单的天气图,进行正确的天气预报.1年前查看全部
- 求初三上册期末化学必考知识点不要提纲,要侧重点
 紫烟轻雾1111年前1
紫烟轻雾1111年前1 -
 carslanshop 共回答了17个问题
carslanshop 共回答了17个问题 |采纳率88.2%水的分解,靠具体的操作过程,及实验结论.
质量守恒定律,考哪些方面变化,那些不变.
氯化钠的提纯.具体的操作.
二氧化碳的制法,也是具体操作.1年前查看全部
- 英语非谓语动词知识点 求教!首先我想说:我看到这道题并不知道这是考察固定词组,我只分析出来这是考察“非谓语动词” 然后
英语非谓语动词知识点 求教!

首先我想说:我看到这道题并不知道这是考察固定词组,我只分析出来这是考察“非谓语动词” 然后就用,动词不定式知识来写 因为:to+动词原形 是表示将来 先于主句谓语发生 然后我发现,放到句子里 翻译不出来
 小rr1年前2
小rr1年前2 -
 timberfu 共回答了25个问题
timberfu 共回答了25个问题 |采纳率88%to+动词原形 是表示将来.
to name just a few 仅列举几例.(言外之意语境是:还有很多这样的例子将来列举,但限于篇幅与时间,就列举到此为止.所以要用不定式to.1年前查看全部
- 正多边形和圆的知识点
 czywindy1年前1
czywindy1年前1 -
 冷啊啊 共回答了11个问题
冷啊啊 共回答了11个问题 |采纳率100%中心(外接圆和内接圆的圆心);外接圆半径R;中心角=360°∕n
边心距r(内切圆半径)
1.弧长计算
半径为R的圆中,圆心角n°的弧长是l=nπR∕180
2.扇形面积计算
半径为R的圆中,圆心角为n°的扇形的面积是S扇形=n πR ²∕360
半径为R的圆中,弧长l为的扇形的面积是S扇形=½lR
3,圆锥侧面积与全面积计算
母线为l 底面圆半径为r的圆锥的侧面积是S侧=½(2πr)=πrl
母线为l,底面圆半径为r的圆锥的全面积是S全=S侧+S底=πrl+πr²
这是我们老师总结的1年前查看全部
- 谁能告诉我有关变速的一些知识点 我都没学过啊
 himeinv1年前3
himeinv1年前3 -
 li68126 共回答了15个问题
li68126 共回答了15个问题 |采纳率93.3%速度是有方向的,以前进方向为正,那么改变量为4-(-3)=7m/s.
不懂的可以问我,1年前查看全部
- 初二物理的知识点(包括物理概念、规律、公式)
初二物理的知识点(包括物理概念、规律、公式)
八年级1—10章知识点 我就要叫贝贝1年前1
我就要叫贝贝1年前1 -
 benben_feng 共回答了17个问题
benben_feng 共回答了17个问题 |采纳率94.1%(一) 声现象 1.声音的发生:一切正在发声的物体都在振动,振动停止,发声也就停止.声音是由物体的振动产生的,但并不是所有的振动都会发出声音.2.声音的传播:声音的传播需要介质,真空不能传声(1)声音要靠一切气体,液体、固体作媒介传播出去,这些作为传播媒介的物质称为介质.登上月球的宇航员即使面对面交谈,也需要靠无线电,那就是因为月球上没有空气,真空不能传声(2)声间在不同介质中传播速度不同 3.回声:声音在传播过程中,遇到障碍物被反射回来人再次听到的声音叫回声(1) 区别回声与原声的条件:回声到达人的耳朵比原声晚0.1秒以上.(2) 低于0.1秒时,则反射回来的声间只能使原声加强.(3) 利用回声可测海深或发声体距障碍物有多运 4.音调:声音的高低叫音调,它是由发声体振动频率决定的,频率越大,音调越高.5.响度:声音的大小叫响度,响度跟发声体振动的振幅大小有关,还跟声源到人耳的距离远近有关 6.音色:不同发声体所发出的声音的品质叫音色 7.噪声及来源从物理角度看,噪声是指发声体做无规则地杂乱无章振动时发出的声音.从环保角度看,凡是妨碍人们正常休息、学习和工作的声音都属于噪声.8.声音等级的划分人们用分贝来划分声音的等级,30dB—40dB是较理想的安静环境,超过50dB就会影响睡眠,70dB以上会干扰谈话,影响工作效率,长期生活在90dB以上的噪声环境中,会影响听力.9.噪声减弱的途径:可以在声源处、传播过程中和人耳处减弱1年前查看全部
- 求10道混合算和10道解方程最好要融入多个知识点,混合算要有简便方法
 8婆婆1年前0
8婆婆1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 八年级下册数学月考 冀教版主要都考关于那些知识,明天要月考了,我们的数学老师,唉,所以,哪位好心人士知道都考哪些知识点,
八年级下册数学月考 冀教版
主要都考关于那些知识,明天要月考了,我们的数学老师,唉,所以,哪位好心人士知道都考哪些知识点,我的书是河北冀教版的
 cfj5211年前1
cfj5211年前1 -
 xian20020806 共回答了13个问题
xian20020806 共回答了13个问题 |采纳率100%八年级第二次月考试题
班级:_____姓名:__________考号:__________
一、选择题:(每题3分,共30分)
1.已知2x=3y,则下列比例式成立的是( )
A. B. C. D.
2.在中华经典美文阅读中,小明同学发现自己的一本书的宽与长之比为黄金比.已知这本书的长为20cm,则它的宽约为( )
A.12.36cm B.13.6cm C.32.36cm D.7.64cm
3.如图所示:△ABC中,DE∥BC,AD=5,BD=10,AE=3.则CE的值为( )
A.9 B.6 C.3 D.4
4. 手工制作课上,小红利用一些花布的边角料,剪裁后装饰手工画,下面四个图案是她剪裁出的空心不等边三角形、等边三角形、正方形、矩形花边,其中,每个图案花边的宽度都相等,那么,每个图案中花边的内外边缘所围成的几何图形不一定相似的是( )
A. B. C. D.
5. 下列命题中,正确的为( )
A.锐角三角形都相似 B.直角三角形都相似
C.等腰三角形都相似 D.等边三角形都相似
6. 如图所示,给出下列条件:①∠B=∠ACD;②∠ADC=∠ACB;③ ;④ =AD•AB.其中单独能够判定△ABC∽△ACD的个数为( )
A.1 B.2 C.3 D.4
7. 如图,每个小正方形边长均为1,则下列图中的三角形与左图中△ABC相似的是( )
A. B. C. D.
8. 如图,△ABC与△DEF是位似图形,位似比为2:3,已知AB=4,则DE的长等于( )
A.6 B.5 C.9 D.
9. 如图,已知AB∥CD,AD与BC相交于点P,AB=4,CD=7,AD=10,则AP=( )
A. B. C. D.
10. 如图,等边△ABC的边长为3,P为BC上一点,且BP=1,D为AC上一点,若∠APD=60°,则CD的长为( )
A. B. C. D.
二、填空题:(每题3分,共18分)
11.在比例尺是1:8000的某城市的地图上,A、B两所学校的距离是25cm,则它们的实际距离是__________米.
12.已知 ,则 _________.
13.四条线段a、b、c、d成比例,其中a=3cm,d=4cm,c=6cm,则b= ________cm.
14. 四边形ABCD∽四边形EFGH,∠A=70°,∠F=108°,∠G=92′,则∠D=________ .
15. 高6m的旗杆在水平地面上的影子长4m,同一时刻附近有一建筑物的影子长20米,则该建筑物的高为 __________.
16. 如果两个相似三角形对应高分别是2cm、3cm,那么这两个相似三角形的面积比是 ________.
请将选择题和填空题的答案填在表格和横线上,否则不得分.
题号12345678910
选项
11._______________12. _______________13. ______________
14. ______________15. _______________16. ______________
三、解答题:(第17、18题各6分;第19、20、21、22、23题各8分)
17. 若 ,且3x+2y-z=14,求x,y,z的值.
18.如图,把矩形ABCD对折,折痕为MN,矩形DMNC与矩形ABCD相似,已知AB=4.
(1)求AD的长;(2)求矩形DMNC与矩形ABCD的相似比.
19. 如图,已知E是矩形ABCD的边CD上一点,BF⊥AE于F,试说明:△ABF∽△EAD.
20.赵亮同学想利用影长测量学校旗杆的高度,如图,他在某一时刻立1米长的标杆测得其影长为1.2米,同时旗杆的投影一部分在地面上,另一部分在某一建筑的墙上,分别测得其长度为9.6米和2米,求学校旗杆的高度.
21. 九年级(1)班课外活动小组利用标杆测量学校旗杆的高度,已知标杆高度CD=3m,标杆与旗杆的水平距离BD=15m,人的眼睛与地面的高度EF=1.6m,人与标杆CD的水平距离DF=2m,求旗杆AB的高度.
22.如图,△ABC是三角形余料,边BC为120厘米,BC上的高AD为80厘米,要把它加工成正方形零件,使正方形一边FM在BC边上,其余两个顶点E、N分别在AB、AC上,求这个正方形的边长.
23.如图,在钝角三角形ABC中,AB=6cm,AC=12cm,动点D从A点出发到B点止,动点E从C点出发到A点止.点D运动的速度为1cm/秒,点E运动的速度为2cm/秒.如果两点同时运动,那么当以点A、D、E为顶点的三角形与△ABC相似时,运动的时间是多少?1年前查看全部
- 求初高中政治的一个知识点忘了是高中的还是初中学的了,当时老师举了一个例子——今天你踏进了一条小河,第二天你再一次踏进这条
求初高中政治的一个知识点
忘了是高中的还是初中学的了,当时老师举了一个例子——今天你踏进了一条小河,第二天你再一次踏进这条小河,这条小河和昨天的小河是同一个,但又不是同一个(大概意思),请问这是哪个知识点?
 poohwen1年前1
poohwen1年前1 -
 cmjsdkfoasudpoi 共回答了14个问题
cmjsdkfoasudpoi 共回答了14个问题 |采纳率78.6%发展的观点.
运动是绝对的,静止是相对的.1年前查看全部
- 初三杠杆 知识点细总 或 是典型题 ,谢谢了阿,这块总是弄不好.
 lixianzhong1年前1
lixianzhong1年前1 -
 一直爱糊糊 共回答了13个问题
一直爱糊糊 共回答了13个问题 |采纳率76.9%现成的东东对学习者不一定是好事,应该自己学会总结1年前查看全部
- 求杠杆与浮力的知识点,规律及经验的归纳!
求杠杆与浮力的知识点,规律及经验的归纳!
尤其是难点与重点知识,有什么窍门也行! dongying5461年前2
dongying5461年前2 -
 luoyucai 共回答了23个问题
luoyucai 共回答了23个问题 |采纳率87%一、杠杆
(1)杠杆的基本概念
一根在力的作用下能绕着固定点转动的硬棒就叫杠杆.
杠杆的五个术语:①支点:杠杆绕着转动的点(o);②动力:使杠杆转动的力(F1);③阻力:阻碍杠杆转动的力(F2); ④动力臂:从支点到动力的作用线的距离(L1);⑤阻力臂:从支点到阻力作用线的距离(L2).
(2)杠杆平衡的条件
动力×动力臂=阻力×阻力臂,这个平衡条件也就是阿基米德发现的杠杆原理.
(3)三种杠杆:
①省力杠杆:L1>L2,平衡时F11年前查看全部
- 明天要教一群小朋友英语啦,但不知道有哪些知识点,请问有经验的老师告知,具体情况如下:江苏省盐城市初一英语重要知识点(越全
明天要教一群小朋友英语啦,但不知道有哪些知识点,请问有经验的老师告知,具体情况如下:江苏省盐城市初一英语重要知识点(越全越好哦!呵呵)好的另加分!
2条注意点:
1不知道市与市之间教的内容是否相同啊,
2小孩从三年级开始学英语,所以还是有英语基础的啊 dillar1年前1
dillar1年前1 -
 homeng527 共回答了15个问题
homeng527 共回答了15个问题 |采纳率93.3%要是上初中的话!最好先把英标教会了!教会了之后教单词就容易了!
其他的要从课文中讲知识点!
由单词到用法,再到短语,再到句子!单词,短语要全部过关,句子要能默写上最好.
课文能背诵的话很好,背不上的话,要能熟读,简单复述!
然后再讲语法,开始不要讲的太多,要循序渐进!1年前查看全部
- 幂函数 有关知识点(幂函数 是否包括指数函数和对数函数)
 zqhejiang1年前3
zqhejiang1年前3 -
 宠坏你 共回答了13个问题
宠坏你 共回答了13个问题 |采纳率92.3%一般地,形如y=x^a(a为常数)的函数,即以底数为自变量幂为因变量,指数为常量的函数称为幂函数.
而指数函数的一般形式为y=a^x(a>0且≠1) (x∈R).它是初等函数中的一种.它是定义在实数域上的单调、下凸、无上界的可微正值函数.
一般地,函数y=log(a)X,(其中a是常数,a>0且a不等于1)叫做对数函数 它实际上就是指数函数的反函数,可表示为x=a^y.因此指数函数里对于a的规定,同样适用于对数函数.
所以幂函数不是指数函数也不是对数函数
很高兴为您解答1年前查看全部
- 描写方法对情节发展的作用(不要一堆,主要答题知识点)
描写方法对情节发展的作用(不要一堆,主要答题知识点)
很着急呀,可以加分哦加到30都行哦 青衣青衣1年前1
青衣青衣1年前1 -
 性虎 共回答了16个问题
性虎 共回答了16个问题 |采纳率93.8%拟人:使句子更生动
比喻:使人有联想的作用
不知准不准1年前查看全部
- 知识点太长记不住怎么办?
 randywoo1年前2
randywoo1年前2 -
 qunfa001 共回答了11个问题
qunfa001 共回答了11个问题 |采纳率100%理解记忆,一般很长的那些,应该是大题的部分,如果是我,大题的部分一般我都是以理解基础之上的记忆.1年前查看全部
- 初一年级上学期语文所有知识点 要每课的重点问题和回答,课文中心…… 一定要全!
初一年级上学期语文所有知识点 要每课的重点问题和回答,课文中心…… 一定要全!
一定要在20日前给我会给分
最晚在这个周五 erin_t1年前1
erin_t1年前1 -
 蛋蛋9527 共回答了27个问题
蛋蛋9527 共回答了27个问题 |采纳率96.3%请登录新世纪教育信息中心 这里有初一年级上学期语文所有知识点 要每课的重点问题和回答,课文中心等 有不明白的还能在线提问有老师解答 详细了解请登陆 学海知心小站 或者百度Hi我1年前查看全部
- 高一生物必修一第一单元知识点
 欣呓1年前1
欣呓1年前1 -
 taya395 共回答了14个问题
taya395 共回答了14个问题 |采纳率92.9%一、细胞是生物体结构和功能的基本单位
生命活动离不开细胞,即使病毒没有细胞结构,也只有寄生在活细胞内才能生存.
二、生命系统的结构层次
细胞→组织→器官→系统→个体→种群→群落→生态系统→生物圈
细胞是地球上最基本的生命系统.
三、观察细胞——显微镜的使用
1.显微镜的结构:
镜 目镜:目镜越长,放大倍数越小
头 物镜:带螺纹,物镜越长,放大倍数越大
光学结构 反 平面:视野变暗
光
镜 凹面:视野变亮
准焦螺旋:使镜筒上升或下降
机械结构 转换器:更换物镜
光圈:调节视野亮度
2.操作流程:
低倍镜下找到清晰物象→将要放大的物象移到视野中央→转动转化器换高倍镜→调节细准焦螺旋至物象清晰
3.注意事项:
先低后高;高倍镜下只能调节细准焦螺旋.
四、原核细胞与真核细胞
原核细胞 真核细胞
细胞大小 较小(2μm~8μm) 较大(10μm~100μm)
细胞壁 主要成分是肽聚糖 主要成分是纤维素和果胶
细胞膜 磷脂双分子层和蛋白质构成 磷脂双分子层和蛋白质构成
细胞器 无叶绿体、线粒体、高尔基体、内质网等复杂细胞器,有核糖体 含有线粒体等复杂的细胞器
细胞核 无成形细胞核,无核膜,但有拟核;DNA不与蛋白质结合形成染色体 有成形的细胞核,有核膜;具有染色体
代表生物 细菌、蓝藻、支原体、放线菌等 真菌、动物、植物等
最主要的区别就是是否有核膜包被的细胞核.
五、细胞学说
细胞学说是由德国科学家施莱登和施旺共同提出的,内容可概括为:
1.细胞是有机体.一切动植物都是由细胞发育而来,并由细胞和细胞产物所构成;
2.每个细胞作为一个相对独立的基本单位,既有它们“自己的”生命,又与其他细胞协调地集合,构成生命的整体,按共同的规律发育,有共同的生命过程;
3.新的细胞可以由老的细胞产生.1年前查看全部
- 请你帮我找一下初三上的物态变化的知识点行么?
 窗台上的草1年前2
窗台上的草1年前2 -
 shiyu80521 共回答了21个问题
shiyu80521 共回答了21个问题 |采纳率90.5%物态变化
一、 温度计
温度:物体的冷热程度叫温度
摄氏温度:把冰水混合物的温度规定为0度,把1标准大气压下沸水的温度规定为100度.
温度计
(1) 原理:液体的热胀冷缩的性质制成的
(2) 构造:玻璃壳、毛细管、玻璃泡、刻度及液体
(3) 使用:使用温度计以前,要注意观察量程和认清分度值
使用温度计做到以下三点:
① 温度计与待测物体充分接触;
② 待示数稳定后再读数;
③ 读数时,视线要与液面上表面相平,温度计仍与待测物体紧密接触.
体温计,实验温度计,寒暑表的主要区别:
构 造 量程 分度值 用 法
体温计玻璃泡 35—42℃ 0.1℃ ① 离人读数上方有细管
② 用前需甩
实验温度计 —20—110℃ 1℃ 不能离开被测物读数,不能甩 .
寒暑表 —30 —50℃ 1℃ 同上
二、 熔化和凝固
熔化:物质从固态变成液态叫熔化,熔化要吸热.
凝固:物质从液态变成固态叫凝固,凝固要放热.
固体的分类:晶体和非晶体.
熔点:晶体都有一定的熔化温度,叫熔点.
凝固点:晶体者有一定的凝固温度,叫凝固点.
同一种物质的凝固点跟它的迷熔点相同
三、 汽化和液化
汽化:物质从液态变为气态叫汽化;汽化有两种不同的方式:蒸发和沸腾,这两种方式都要吸热.
蒸发:(1) 定义:蒸发是液体在任何温度下都能发生的,并且只在液体表面发生的较缓慢的汽化现象.
(2) 影响蒸发快慢的因素:液体温度高低,液体表面积大小,液体表面空气流动的快慢.
(3)液体蒸发吸热,有致冷作用.
沸腾:(1) 定义:沸腾是在一定温度下,在液体内部和表面同时进行的剧烈的汽化现象.(2) 液体沸腾的条件:①温度达到沸点②继续吸收热量.
沸点:液体沸腾时的温度.
水沸腾时现象:剧烈的汽化现象,大量的气泡上升、变大,到水面破裂,里面的水蒸气散发到空气中.虽继续加热,它的温度不变.
液化:物质从气态变成液态的现象.液化放热.
液化的方法:1、降低温度(都可液化).2、压缩体积.
液化的好处:体积缩小,便于储存和运输.
四、 升华和凝华
升华:物质从固态直接变成气态叫升华.
例子:冬天冰冻的衣服干了,灯丝变细,卫生球变小.
凝华;物质由气态直接变成固态的现象.
例子:霜,树挂、窗花
升华吸热,凝华放热.1年前查看全部
- 要有每课的内容归纳,知识点归纳,排版要好.
 旭阳不朽1年前2
旭阳不朽1年前2 -
 drwolf1999 共回答了16个问题
drwolf1999 共回答了16个问题 |采纳率100%不感兴趣,给你排好用处也不大嘛,如果真想归纳的话,介绍个本人用过的笨办法,自己翻书,把同一年的事情记在一起,一定按照时间顺序!一个月一个月排,虽然量大,但记录的过程中等于复习了一遍,整理完了的话,1年前查看全部
- 初三不懂的知识点1.等质量的Na2CO3和NaHCO3与过量的稀盐酸分别反应,谁生成CO2速度快?谁生成得多?2.为什么
初三不懂的知识点
1.等质量的Na2CO3和NaHCO3与过量的稀盐酸分别反应,谁生成CO2速度快?谁生成得多?
2.为什么在通电螺线管中放入铁芯就能增强它的磁性?
3.求有关于“要成大器就得耐得住时间”的名言有什么
4.光是将自来水煮沸能使它软化吗?
5.“at weekends"和"at the weekend"有什么区别?
6.名名言和警句有什么区别?
用心帮忙者我对他感激不尽) xuhuiyao1年前2
xuhuiyao1年前2 -
 为三留一手 共回答了19个问题
为三留一手 共回答了19个问题 |采纳率89.5%1.Na2Co3+2HCL==2NaCl+H2O+CO2↑
NaHCO3+HCl==NaCl+H2O+CO2↑都是几个分子就生成几个二氧化碳分子,速度一样快,根据相对分子质量推导,相对分子质量较小的碳酸氢钠能生成CO2分子更多
2.相当于一个电磁铁
3.故天将降大任于是人也必先苦其心志劳其筋骨饿其体肤空乏其身行拂乱其所为,所以动心忍性增益其所不能.(这比较经典的)
4.煮沸法能减少大部分水中所含的钙、镁离子化合物,相当于软化了,实验室用的是蒸馏法
5.第一个是经常性动作,第二个特指某一周
6.名言就是很有名的人说过的很有道理的话,警句可以作为自身的一些座右铭之类的,警醒自己.1年前查看全部
- 求了,不用初三学的知识点跟我解行不?我真看不懂!
求了,不用初三学的知识点跟我解行不?我真看不懂!
如图,某幼儿园为了加强安全管理,决定将园内的滑滑板的倾角由45°降为30°,已知AB=5米,点D、B、C在同一水平地面上.
(1)求改善滑滑板会加长多少;
(2)若滑滑板的正前方有3米长的空地就能保证安全,原滑滑板的前方有6米长的空地,象这样改善是否可行?说明理由.
 google测试员20091年前5
google测试员20091年前5 -
 玉婷525 共回答了21个问题
玉婷525 共回答了21个问题 |采纳率95.2%和刚才那道题差不多的啊
(1)
原来的滑梯为Rt△ABC
AC=5,∠ACB=90°,∠ABC=45°
原来的滑板长AB=5√2
改善后的滑梯为Rt△ACD
AC=5,∠ACD=90°,∠ADC=30°
30°所对直角边等于斜边的一半
所以,改善后的滑板长AD=2AC=10米
滑板增加=10-5√2=5(2-√2) ≈2.93米
所以,改善滑板会加长2.93米
(2)
原滑滑板的前方有6米长的空地,正前方有3米长的空地就能保证安全,
所以,增加的长度BD≤6-3=3米
原来的滑梯为Rt△ABC
AC=5∠ACB=90°,∠ABC=45°
BC=AC=5
改善后的滑梯为Rt△ACD
AC=5,∠ACD=90°,∠ADC=30°
CD=5√3米
增加的长度=BD=CD-CB=5(√3-1)≈3.66米
因为,3.66>3
所以,象这样改善不可行1年前查看全部
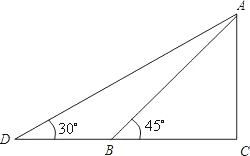
- 空间向量在立体几何中的应用 知识点?
 我是嘟嘟宝贝1年前1
我是嘟嘟宝贝1年前1 -
 luochuangzhong 共回答了20个问题
luochuangzhong 共回答了20个问题 |采纳率85%关于空间向量在立体几何中的应用问题,其中最主要的计算都是围绕平面的法向量展开的.在绝大部分题目中,空间向量是作为数学工具来解决两类问题:一、垂直问题,尤其是线面垂直问题(面面垂直基本类似);二、角度问题,主要讲二面角的平面角通过两个平面法向量所称的角来进行转化(线面角与此类似).而立体几何中的平行问题一般是用基本定理来进行解决的.
平面法向量的基本概念.法向量是指与已知平面垂直的向量,它可以根据选取的坐标不同有无数多个,但一般取其中较为方便计算的.
平面法向量的基本计算.根据图形建立合适的坐标系,设出已知平面的法向量为n(x,y,z),在已知平面内寻找两条相交直线a,b,并用向量表示它们.由于法向量垂直于平面,则必然垂直这两条直线,利用垂直向量点乘为零列出方程组.由于有三个未知数x,y,z,一般是设其中一个为特殊值,求出另外两个(前面说过,法向量有无数多个,我们只需算出其中一个即可).
平面法向量的基本应用.在求出法向量后,如要证明线面垂直,只需证明要证明的直线平行于该平面的法向量;如要证明面面垂直,只需证明两个平面的法向量垂直;如要求直线和平面所成的角,只需求出直线和法向量所成的角(利用向量点乘公式求出这个家教的余弦值,它和所求的线面角互余);如要求二面角大小,只需求出两个平面的法向量所成的角(同样利用点乘公式求出这个角的余弦值,它和所求的二面角的平面角相等或互补,然后只需简单判断二面角是锐角还是钝角即可).参考资料:新东方1年前查看全部
- 七年级地理下册撒哈拉以南的非洲人教版知识点
 ricoe1年前1
ricoe1年前1 -
 兔狗 共回答了20个问题
兔狗 共回答了20个问题 |采纳率90%第三节 撒哈拉以南的非洲
1、世界上最大沙漠撒哈拉沙漠以南的非洲地区,大部分位于热带,90%以上是黑种人,有“黑非洲”之称.居民集中在几内亚湾沿岸和刚果盆地.
2、由于殖民主义的长期占领和掠夺,该地大多国家形成了“单一商品经济”,出口价格低廉的初级产品,进口价格昂贵的工业制成品,在国际贸易中处于不利地位.
3、非洲自然增长率在各大洲中居首位,人口众多.加上气候全年高温,降水干湿两季分明,农业生产落后,居民经常忍饥挨饿.
4、非洲气候主要为热带雨林气候、热带草原气候、热带沙漠气候,分布特点为:以赤道为中心,南北对称分布.
5、主要地形区:
A索马里半岛 B刚果河 C刚果盆地
D埃塞俄比亚高原 E马达加斯加岛
F几内亚湾 G撒哈拉沙漠 H好望角
I东非高原 附近有东非大裂谷 J南非高原1年前查看全部
大家在问
- 1(2006•成都二模)一个画家有14个棱长为1m的正方体,他在地面上把它们摆成如图的形状,然后他把露出的表面都涂上颜色,
- 2英语翻译我只想我起来的时候第一眼看到的是你
- 3求y=e^2x/x^2的微分
- 4让我告诉你 作文
- 5若abc=1,则[a/ab+a+1]+[b/bc+b+1]+[c/ca+c+1]的值为______.
- 6已知角A的顶点与原点重合,始边与x轴的正半轴重合,终边在直线y=2x上,则cosA=?
- 7When I was a little child, Father told me the earth ___ roun
- 8课改版六年级上学期第11册作文就是“当你心中只有自己的时候,你可能把麻烦留给了自己;当你心中想着他人的时候,可能他人也在
- 9籍籍无名和薄有虚名的含义,谁能给我讲下 籍籍无名和薄有虚名的意思,所有的分都给你我想知道更深层的含义,可以举例说明~
- 10牙齿和下颌骨的连接属于什么连接?
- 11函数f(x)=tanx,则f'(x)=
- 12(2011•淮安)下列图象不能正确反映其对应操作中各量变化关系的是( )
- 13下面的动物能飞吗?用“一定”、“不可能”和“可能”说一说.
- 14A+B=明 ; 3A=晶 2B=( ) ; 10A=( ) 15A=( ) ; 20A+B=( )
- 15“比喻只顾眼前利益,而不顾后虑”是什么成语的意思?
