用0.1000mol/L-1NaOH标准溶液滴定0.10mol/L-1H3PO4
 4983223802022-10-04 11:39:541条回答
4983223802022-10-04 11:39:541条回答混合溶液时,可能有()个滴定突跃?
已知H3PO4的Ka1=7.5*10-3 Ka2=6.2*10-8 Ka32.2*10-13
什么是滴定突跃?这个怎么看?
具体到这个题应该怎么做呢?

已提交,审核后显示!提交回复
共1条回复
 star075 共回答了24个问题
star075 共回答了24个问题 |采纳率79.2%- 分析化学中,在化学计量点前后±0.1%(滴定分析允许误差)范围内,溶液参数将发生急剧变化,这种参数(如酸碱滴定中的pH)的突然改变就是滴定突跃,突跃所在的范围称为突跃范围.
比如氢氧化钠滴盐酸,当两个都是0.1时,滴定突跃是4.3到9.7,当两个都是0.01时,突跃范围就是5.3到8.7. - 1年前
相关推荐
- 常温下,用 0.1000mol/LNaOH溶液滴定 20.00mL0.1000mol/LCH 3 C
常温下,用 0.1000mol/LNaOH溶液滴定 20.00mL0.1000mol/LCH 3 COOH溶液所得滴定曲线如下图.下列说法正确的是( ) A.滴定过程中可能出现:C(CH 3 COOH)>C(CH 3 COO - )>C(H + )>C(Na + )>C(OH - ) B.点①所示溶液中:C(CH 3 COO - )+C(OH - )=C(CH 3 COOH)+C(H + ) C.点②所示溶液中:C(Na + )=C(CH 3 COOH)+C(CH 3 COO - ) D.点③所示溶液中:C(Na +) >C(OH - )>C(CH 3 COO - )>C(H + ) 
 settv03211年前1
settv03211年前1 -
 口径155 共回答了20个问题
口径155 共回答了20个问题 |采纳率90%A、当CH 3 COOH较多,滴入的碱较少时,生成CH 3 COONa少量,溶液中CH 3 COOH浓度远大于CH 3 COONa浓度,可能出现c(CH 3 COOH)>c(CH 3 COO - )>c(H + )>c(Na + )>c(OH - ),故A正确;
B、由图象可知,点①反应后溶液是CH 3 COONa与CH 3 COOH物质的量之比为1:1的混合物,溶液呈酸性,CH 3 COOH电离程度大于CH 3 COO - 的水解程度,故c(Na + )>c(CH 3 COOH),由电荷守恒可知:c(CH 3 COO - )+c(OH - )=c(Na + )+c(H + ),所以c(CH 3 COO - )+c(OH - )>c(CH 3 COOH)+c(H + ),故B错误;
C、由图象可知,点②pH=7,即c(H + )=c(OH - ),由电荷守恒知:c(Na + )+c(H + )=c(CH 3 COO - )+c(OH - ),故c(Na + )=c(CH 3 COO - ),故C错误;
D、由图象可知,点③说明两溶液恰好完全反应生成CH 3 COONa,因CH 3 COO - 水解,溶液呈碱性,所以c(OH - )>c(H + ),且程度较小,c(Na + )>c(CH 3 COO - )>c(OH - )>c(H + ),故D错误.
故选:A.1年前查看全部
- (1/2)若向三份等体积0.1000mol/LNaOH溶液中分别加入①稀醋酸,②浓硫酸,③稀硝酸至恰好完全反应,则上..
(1/2)若向三份等体积0.1000mol/LNaOH溶液中分别加入①稀醋酸,②浓硫酸,③稀硝酸至恰好完全反应,则上...
(1/2)若向三份等体积0.1000mol/LNaOH溶液中分别加入①稀醋酸,②浓硫酸,③稀硝酸至恰好完全反应,则上述过程中的焓变△H1、△H2 aa我还要1年前2
aa我还要1年前2 -
 chenyiman 共回答了29个问题
chenyiman 共回答了29个问题 |采纳率93.1%△H1>△H3>△H2
因为中和反应放热,所以都小于0,而①稀醋酸放热最少(部分生成的热被吸收用于醋酸电离),②浓硫酸放热最多(浓硫酸溶于水也会放热),③稀硝酸居中(就是普通中和热).1年前查看全部
- GB/T5750.7耗氧量的测定,高锰酸钾浓度要求为0.1000mol/L,可我标定出来的结果超过0.100mol/L,
GB/T5750.7耗氧量的测定,高锰酸钾浓度要求为0.1000mol/L,可我标定出来的结果超过0.100mol/L,应该如何校
我标定出来的高锰酸钾浓度为0.112mol/L,应如何校正使其浓度为0.1000mol/L. zgh401年前3
zgh401年前3 -
 254010182 共回答了15个问题
254010182 共回答了15个问题 |采纳率80%按c1v1=c2v2
假设你有500mL浓度为0.112mol/L的高锰酸钾,需要加蒸馏水x毫升,则
500X0.112=(500+x)×0.100
x=60mL
所以,在500毫升原溶液中准确加入60.00mL蒸馏水就可以了.1年前查看全部
- 常温下,用0.1000mol/LNaOH溶液滴定20.00mL0.1000mol/L CH3COOH溶液所得滴
常温下,用0.1000mol/LNaOH溶液滴定20.00mL0.1000mol/L CH3COOH溶液所得滴定曲线如图.下列说法正确的是( )
 A. 点①所示溶液中:c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+)
A. 点①所示溶液中:c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+)
B. 点②所示溶液中:c(Na+)=c(CH3COOH)+c(CH3COO-)
C. 点③所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
D. 滴定过程中可能出现:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)>c(Na+) watts1年前1
watts1年前1 -
 江西财大招生 共回答了16个问题
江西财大招生 共回答了16个问题 |采纳率87.5%解题思路:根据点①反应后溶液是CH3COONa与CH3COOH物质的量之比为1:1的混合物,溶液呈酸性,说明CH3COOH电离程度大于CH3COO-的水解程度,故c(Na+)>c(CH3COOH),
由电荷守恒可知:c(CH3COO-)+c(OH-)=c(Na+)+c(H+),所以c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+);点②pH=7,即c(H+)=c(OH-),c(Na+)=c(CH3COO-);
点③体积相同,则恰好完全反应生成CH3COONa,利用盐的水解来分析溶液呈碱性,则c(Na+)>c(CH3COO-)>c(OH-)>c(H+);在滴定中当加入碱比较少时,可能出现c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-)的情况.A、点①反应后溶液是CH3COONa与CH3COOH物质的量之比为1:1的混合物,CH3COOH电离程度大于CH3COO-的水解程度,故c(Na+)>c(CH3COOH),由电荷守恒可知:
c(CH3COO-)+c(OH-)=c(Na+)+c(H+),所以c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+),故A正确;
B、点②pH=7,即c(H+)=c(OH-),由电荷守恒知:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),故c(Na+)=c(CH3COO-),故B错误;
C、点③说明两溶液恰好完全反应生成CH3COONa,因CH3COO-水解,且程度较小,c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故C错误;
D、当CH3COOH较多,滴入的碱较少时,则生成CH3COONa少量,可能出现c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-),只有加碱,就会存在c(Na+)>c(OH-),故D错误;
故选A.点评:
本题考点: 酸碱混合时的定性判断及有关ph的计算.
考点点评: 本题考查NaOH与CH3COOH的反应,涉及盐类的水解和溶液离子浓度的大小比较,注意利用电荷守恒的角度做题,选项D为易错点,加NaOH与酸反应则c(Na+)>c(OH-),题目难度中等.1年前查看全部
- 用0.1000mol/L的标准NaOH溶液测定未知的HCl溶液
 绕指柔3211年前1
绕指柔3211年前1 -
 zmzhong 共回答了18个问题
zmzhong 共回答了18个问题 |采纳率94.4%根据酸碱中和,25mlHCl溶液,用标准氢氧化钠溶液滴定 根据消耗的氢氧化钠,即可计算HCl溶液的浓度`1年前查看全部
- 25℃时,用浓度为0.1000 mol·L - 1 的NaOH溶液滴定20.00 mL浓度均为0.1000 mol·L
25℃时,用浓度为0.1000 mol·L - 1 的NaOH溶液滴定20.00 mL浓度均为0.1000 mol·L - 1 的三种酸HX、HY、HZ,滴定曲线如下图所示。下列说法正确的是

A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:HZ<HY<HX B.根据滴定曲线,可得 K a (HY)≈10 - 5 C.将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时: c (X - )> c (Y - )> c (OH - )> c (H + ) D.HY与HZ混合,达到平衡时: c (H + )= 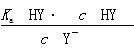 + c (Z - )+ c (OH - )
+ c (Z - )+ c (OH - ) ff皇族1年前1
ff皇族1年前1 -
 starjk 共回答了15个问题
starjk 共回答了15个问题 |采纳率86.7%B
根据中和滴定曲线先判断HX、HY和HZ的酸性强弱,再运用电离平衡、水解平衡知识分析、解决相关问题。
由图像可知,当 V (NaOH)=0(即未滴加NaOH)时,等浓度的三种酸溶液的pH大小顺序为HX>HY>HZ,则酸性强弱顺序为HX<HY<HZ,相同条件下三种酸溶液的导电能力顺序为HX<HY<HZ,A项错。当 V (NaOH)=10 mL时,HY溶液中 c (H + )=10 - 5 mol·L - 1 , c (OH - )=10 - 9 mol·L - 1 , c (Na + )=×0.1000 mol·L - 1 ,据电荷守恒得 c (H + )+ c (Na + )= c (OH - )+ c (Y - ),即10 - 5 mol·L - 1 +×0.1000 mol·L - 1 =10 - 9 mol·L - 1 + c (Y - ),则有 c (Y - )≈×0.1000 mol·L - 1 , c (HY)=×0.1000 mol·L - 1 -×0.1000 mol·L - 1 =×0.1000 mol·L - 1 ,那么 K a (HY)=[ c (Y - )· c (H + )]/ c (HY)=(×0.1000 mol·L - 1 ×10 - 5 mol·L - 1 )/(×0.1000 mol·L - 1 )=10 - 5 ,B项正确。HX的酸性比HY的弱,滴定至HX恰好完全反应时,HY也完全反应,此时溶液中的溶质为NaX和NaY,X - 的水解程度比Y - 的水解程度大,则有 c (Y - )> c (X - ),C项错。HY和HZ混合,达到平衡时,据电荷守恒有 c (H + )= c (Y - )+ c (Z - )+ c (OH - );对于弱酸HY来说, K a (HY)=[ c (H + )· c (Y - )]/ c (HY),则有 c (Y - )=[ K a (HY)· c (HY)]/ c (H + ),故 c (H + )=[ K a (HY)· c (HY)]/ c (H + )+ c (Z - )+ c (OH - ),D项错。1年前查看全部
- (2012•天津模拟)常温下,用0.1000mol/L NaOH溶液分别滴定20.00mL 0.10
 (2012•天津模拟)常温下,用0.1000mol/L NaOH溶液分别滴定20.00mL 0.1000mol/L 盐酸和20.00mL 0.1000mol/L 醋酸溶液,得到2条滴定曲线,如图所示.若以HA表示酸,下列说法正确的是( )
(2012•天津模拟)常温下,用0.1000mol/L NaOH溶液分别滴定20.00mL 0.1000mol/L 盐酸和20.00mL 0.1000mol/L 醋酸溶液,得到2条滴定曲线,如图所示.若以HA表示酸,下列说法正确的是( )
A.滴定盐酸的曲线是图2
B.达到B、D状态时,两溶液中离子浓度均为 c(Na+)=c(A-)
C.达到B、E状态时,反应消耗的n(CH3COOH)>n(HCl)
D.当0 mL<V(NaOH)<20.00 mL时,对应混合溶液中各离子浓度由大到小的顺序均为 c(A-)>c(Na+)>c(H+)>c(OH-) 清仪欣1年前1
清仪欣1年前1 -
 321054 共回答了23个问题
321054 共回答了23个问题 |采纳率91.3%解题思路:A、根据盐酸和醋酸在滴定开始时的pH来判断;
B、根据溶液中的电荷守恒来判断;
C、根据酸和碱反应的化学方程式来计算回答;
D、根据氢氧化钠和醋酸以及盐酸反应的原理来回答.A、滴定开始时0.1000mol/L盐酸pH=1,0.1000mol/L醋酸pH>1,所以滴定盐酸的曲线是图1,故A错误;
B、达到B、D状态时,溶液是中性的,此时c(H+)=c(OH-),根据电荷守恒,则两溶液中离子浓度均为 c(Na+)=c(A-),故B正确;
C、达到B、E状态时,消耗的氢氧化钠物质的量是相等的,根据反应原理:HCl~NaOH,CH3COOH~NaOH,反应消耗的
n(CH3COOH)=n(HCl),故C错误;
D、当0 mL<V(NaOH)<20.00 mL时,酸相对于碱来说是过量的,所得溶液是生成的盐和酸的混合物,假设当加入的氢氧化钠极少量时,生成了极少量的钠盐(氯化钠或是醋酸钠),剩余大量的酸,此时c(A-)>c(H+)>c(Na+)>c(OH-),故D错误.
故选B.点评:
本题考点: 酸碱混合时的定性判断及有关ph的计算;弱电解质在水溶液中的电离平衡;离子浓度大小的比较.
考点点评: 本题考查NaOH与CH3COOH、盐酸的反应,涉及盐类的水解和溶液离子浓度的大小比较知识,注意利用电荷守恒的角度做题.1年前查看全部
- 用0.1000mol.L-NaOH溶液滴定20.00ml0.1000mol/L HCOOH溶液,计算化学计量点时pH和p
用0.1000mol.L-NaOH溶液滴定20.00ml0.1000mol/L HCOOH溶液,计算化学计量点时pH和pH突跃范围(已知甲酸Ka=1.8×10-4)
 ljy513201年前1
ljy513201年前1 -
 烂番茄19个 共回答了12个问题
烂番茄19个 共回答了12个问题 |采纳率91.7%答:
【1】突越范围 pH = 6.74 - 9.7 的计算:
1、计量点前(19,98 ml):pH = pKa + lg[(19.98/0.02)] = 3.74+3 = 6.74
2、计量点前(20,02 ml):pH = 14 - pOH = 14- (20.02-20.00/40.02)
=14 - 4.3 = 9.70
【2】化学计量点时pH = 8.22的计算:
pH =14 -pOH = 14 - p(CKa)^0.5p = 14 - p[(0.05x5.6x10^-11)^0.5] = 14 - 5.78 = 8.221年前查看全部
- 常温下,用0.1000 mol/L NaOH溶液分别滴定20. 00 mL
常温下,用0.1000 mol/L NaOH溶液分别滴定20. 00 mL 0.1000 mol/L 盐酸和20. 00 mL 0.1000 mol/L 醋酸溶液,得到2条滴定曲线,如下图所示。下列说法正确的是(A - 表示Cl - 或
CH 3 COO - ) [ ]
[ ]A.滴定盐酸的曲线是图2
B.达到B、D状态时,两溶液中离子浓度均为 c(Na + ) = c(A - )
C.达到B、E状态时,反应消耗的n(CH 3 COOH)>n(HCl)
D.当0 mL<V(NaOH)<20. 00 mL时,对应混合溶液中各离子浓度由大到小的顺序均为
c(A - ) >c(Na + )>c(H + )>c(OH - ) 今生不言爱1年前1
今生不言爱1年前1 -
 爱情正在dd去 共回答了23个问题
爱情正在dd去 共回答了23个问题 |采纳率95.7%B1年前查看全部
- 称取0.5185g含有水溶性氯化物的样品,用0.1000mol/L AgNO3标准溶液滴定,消耗了44.20mL,求样品
称取0.5185g含有水溶性氯化物的样品,用0.1000mol/L AgNO3标准溶液滴定,消耗了44.20mL,求样品中氯化物的质
量分数(以%表示) 自怜的影子1年前1
自怜的影子1年前1 -
 变电所ye 共回答了11个问题
变电所ye 共回答了11个问题 |采纳率100%消耗的AgNO3物质的量=0.1000*44.20*10(-3)=4.420*10(-3).
则氯离子的物质的量=银离子的物质的量=4.420*10(-3).
水溶性氯化物有氯化钾、氯化钠、氯化镁等等,题中并未明确指出,因为无法解答.只能算出样品中氯离子的含量.1年前查看全部
- 重铬酸钾0.1000mol/L,对FeSo4滴定,需要用多少g/ml FeSo4化学式量是151.8
 山中百合花1年前3
山中百合花1年前3 -
 米米396 共回答了17个问题
米米396 共回答了17个问题 |采纳率88.2%1mol的重铬酸钾可以氧化6mol的FeSO4,一般滴定量控制在25ml以内,那么,FeSO4量控制在0.6mol/L,也就是,0.1g/ml左右比较好~1年前查看全部
- x=-0.1100, y=-0.1000, 求x+y
x=-0.1100, y=-0.1000, 求x+y
计算机组成原理题目 蟑螂不rr我rr1年前0
蟑螂不rr我rr1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- (2011•奉贤区一模)常温下,用 0.1000mol/LNaOH溶液滴定 20.00mL0.100
 (2011•奉贤区一模)常温下,用 0.1000mol/LNaOH溶液滴定 20.00mL0.1000mol/LCH3COOH溶液所得滴定曲线如下图.下列说法正确的是( )
(2011•奉贤区一模)常温下,用 0.1000mol/LNaOH溶液滴定 20.00mL0.1000mol/LCH3COOH溶液所得滴定曲线如下图.下列说法正确的是( )
A.滴定过程中可能出现:C(CH3COOH)>C(CH3COO-)>C(H+)>C(Na+)>C(OH-)
B.点①所示溶液中:C(CH3COO-)+C(OH-)=C(CH3COOH)+C(H+)
C.点②所示溶液中:C(Na+)=C(CH3COOH)+C(CH3COO-)
D.点③所示溶液中:C(Na+)>C(OH-)>C(CH3COO-)>C(H+) yanzhebin1年前1
yanzhebin1年前1 -
 玲琳 共回答了21个问题
玲琳 共回答了21个问题 |采纳率95.2%解题思路:A、当CH3COOH较多,滴入的碱较少时,生成CH3COONa少量,溶液中CH3COOH浓度远大于CH3COONa浓度,可能出现.
B、由电荷守恒可知:c(CH3COO-)+c(OH-)=c(Na+)+c(H+),由图象可知,点①反应后溶液是CH3COONa与CH3COOH物质的量之比为1:1的混合物,溶液呈酸性,说明CH3COOH电离程度大于CH3COO-的水解程度,故c(Na+)>c(CH3COOH),据此判断.
C、由电荷守恒可知:c(CH3COO-)+c(OH-)=c(Na+)+c(H+),由图象可知,点②pH=7,即c(H+)=c(OH-),据此判断;
D、由图象可知,点③体积相同,则恰好完全反应生成CH3COONa,利用盐的水解来分析溶液呈碱性,则c(Na+)>c(CH3COO-)>c(OH-)>c(H+).A、当CH3COOH较多,滴入的碱较少时,生成CH3COONa少量,溶液中CH3COOH浓度远大于CH3COONa浓度,可能出现c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-),故A正确;
B、由图象可知,点①反应后溶液是CH3COONa与CH3COOH物质的量之比为1:1的混合物,溶液呈酸性,CH3COOH电离程度大于CH3COO-的水解程度,故c(Na+)>c(CH3COOH),由电荷守恒可知:c(CH3COO-)+c(OH-)=c(Na+)+c(H+),所以c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+),故B错误;
C、由图象可知,点②pH=7,即c(H+)=c(OH-),由电荷守恒知:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),故c(Na+)=c(CH3COO-),故C错误;
D、由图象可知,点③说明两溶液恰好完全反应生成CH3COONa,因CH3COO-水解,溶液呈碱性,所以c(OH-)>c(H+),且程度较小,c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故D错误.
故选:A.点评:
本题考点: 酸碱混合时的定性判断及有关ph的计算;离子浓度大小的比较.
考点点评: 以NaOH滴定CH3COOH的滴定曲线为载体,考查盐类的水解、溶液离子浓度的大小比较等,难度中等,注意离子浓度大小比较中电荷守恒、质子恒等式、物料守恒等量关系式的利用.1年前查看全部
- 某弱酸的pKa=9.21,现有其共轭碱NaA溶液20.00ml浓度为0.1000mol/l,当用0.1000mol/l的
某弱酸的pKa=9.21,现有其共轭碱NaA溶液20.00ml浓度为0.1000mol/l,当用0.1000mol/l的HCL去滴定,求滴定突越范围
 habo1101年前1
habo1101年前1 -
 78105 共回答了19个问题
78105 共回答了19个问题 |采纳率89.5%当滴入量在化学计量点前的0.1%时,体系是HA和A-形成的缓冲溶液,此时HA浓度=5×10的-2次方mol/L,A-浓度=5×10的-5次方mol/L,pH=pKa+lg(A-浓度/HA浓度)=6.21,当滴入量在化学计量点后的0.1%时,体系是HCl和HA的混合溶液,pH主要由盐酸决定,此时氢离子浓度=5×10的-5次方mol/L,pH=4.3,所以突跃范围为4.3--6.2.1年前查看全部
- 称取1.250 g 纯一元弱酸HA,溶于适量水后稀至50.00 mL,然后用0.1000 mol/L NaOH 溶液进行
称取1.250 g 纯一元弱酸HA,溶于适量水后稀至50.00 mL,然后用0.1000 mol/L NaOH 溶液进行电位滴定,从滴定曲线查出滴定至化学计量点时,NaOH溶液用量为37.10 mL.
求一元弱酸HA的摩尔质量
答案是这样的M(HA)=1.250×100 /(0.100×37.10) = 336.9 (g/mol)
分子上的100是什么意思?分母不用换算成把37.10ml换算成3.710×10*-2L吗? go_try1年前0
go_try1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 是否可以用0.1000mol/L HCL标准溶液滴定0.1000mol/LNA2S溶液!
是否可以用0.1000mol/L HCL标准溶液滴定0.1000mol/LNA2S溶液!
如果可以,请问有几个滴定终点,并且请计算滴定到达化学计量点是溶液的PH值和滴定突跃范围,并选择适合的指示剂(已知25℃ H2S的PKa1=7.05,PKa2=11.95) NA2S溶液可以取20.00ml进行计算 ziran1581年前1
ziran1581年前1 -
 天知道zqh 共回答了26个问题
天知道zqh 共回答了26个问题 |采纳率92.3%溶液的pH> 7,即,为了达到化学计量点完全,反应,然后溶质醋酸钠的溶液,弱酸是强碱,碱性水解,溶液> 7的pH值1年前查看全部
- 实验题:实验室用固体烧碱配制500mL0.1000mol/L的NaOH溶液.(1)需称量______g烧碱,应放在___
实验题:
实验室用固体烧碱配制500mL0.1000mol/L的NaOH溶液.
(1)需称量______g烧碱,应放在______(填仪器名称)中称量
(2)配制过程中,一定不需要的仪器(填写代号)______
a、烧杯 b、量筒 c、玻璃棒 d、1000mL容量瓶e、漏斗 f、胶头滴管
(3)根据实验需要和(2)所列仪器判断,完成实验还缺少的仪器是______,______,______.
(4)步骤B通常称为转移,步骤A通常称为______
(5)将上述实验步骤A到F按实验过程先后次序排列______
(6)在容量瓶中确定溶液体积的过程中,最后加入少量水的操作是______. 爱-无-罪1年前1
爱-无-罪1年前1 -
 想念蜜兔 共回答了19个问题
想念蜜兔 共回答了19个问题 |采纳率89.5%解题思路:(1)根据n=cV和m=nM来计算;由于氢氧化钠易潮解,故放在烧杯里称量;
(2)根据配制步骤是计算、称量、溶解、洗涤、定容、摇匀、装瓶来分析需要的和不需要的仪器;
(3)根据配制步骤是计算、称量、溶解、洗涤、定容、摇匀、装瓶来分析需要的仪器;
(4)根据图示可知步骤A为定容;
(5)根据配制步骤是计算、称量、溶解、洗涤、定容、摇匀、装瓶来排序;
(6)根据定容操作来分析.(1)根据n=cV可知需要的NaOH的物质的量n=0.5L×0.1000mol/L=0.05mol,质量m=nM=0.05mol×40g/mol=2.0g;由于氢氧化钠易潮解,故放在烧杯里称量;故答案为:2.0、烧杯;
(2)操作步骤有计算、称量、溶解、移液、洗涤移液、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解(可用量筒量取水加入烧杯),并用玻璃棒搅拌,加速溶解.冷却后转移到500mL容量瓶中,并用玻璃棒引流,洗涤烧杯、玻璃棒2-3次,并将洗涤液移入容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.所以所需仪器有托盘天平、药匙、烧杯、玻璃棒、500mL容量瓶、胶头滴管,故一定不需要的是1000ml容量瓶和漏斗,故答案为:de;
(3)根据(2)的分析可知,还缺少500ml容量瓶、托盘天平和药匙,故答案为:500ml容量瓶、托盘天平、药匙;
(4)根据图示可知步骤A为定容,故答案为:定容;
(5)配制步骤是计算、称量、溶解、洗涤、定容、摇匀、装瓶,可知实验步骤的先后次序为:C、B、D、F、A、E,故答案为:C、B、D、F、A、E;
(6)定容的过程中加入少量水的操作是用胶头滴管进行定容的操作,具体方法为:用胶头滴管滴加蒸馏水至溶液的凹液面正好与刻度线相切,故答案为:用胶头滴管滴加蒸馏水至溶液的凹液面正好与刻度线相切.点评:
本题考点: 配制一定物质的量浓度的溶液.
考点点评: 本题考查了一定物质的量浓度溶液的配制过程中的计算和误差分析,属于基础型题目,难度不大.1年前查看全部
- 0.1000mol/l溶液naoh滴定20.00mol0.1000mol/lhac溶液.计算滴定前溶液的ph和化学计量点
0.1000mol/l溶液naoh滴定20.00mol0.1000mol/lhac溶液.计算滴定前溶液的ph和化学计量点时的ph
 留住你的香味1年前1
留住你的香味1年前1 -
 好人1983 共回答了18个问题
好人1983 共回答了18个问题 |采纳率94.4%NaOH + HAc = NaAc + H2O
1、滴定前为0.1000mol/lHAc溶液,HAc是一元弱酸,Ka=1.8*10-5
由于c*Ka=0.1*1.8*10-5=1.8*10-6>20Kw,且c/Ka>500,所以可用最简式计算H+浓度.
[H+]=根号下(c*Ka)=根号下(1.8*10-6)=1.34*10-3(mol/L)
PH=-lg[H+]=2.87
2、化学计量点是指二者恰好完全反应,此时溶液为NaAc溶液,这是一个强碱弱酸盐,此时Ac-是一元弱碱,发生Ac- + H2O = HAc + OH-(中间为可逆号).一元弱碱的计算公式同一元弱酸,只是把公式中的H+换成OH-,把Ka换成Kb.
在此Ac-的浓度c=0.1000/2=0.05000mol/L(因为加入氢氧化钠后体积增大一倍),
Kb=Kw/Ka=10-14/(1.8*10-6)=5.6*10-9
因为c*Kb=0.05000*5.6*10-9=2.8*10-10>20Kw,且c/Kb>500
所以用最简式[OH-]=根号下(c*Kb)=根号下(2.8*10-10)=2.8*10-10=1.67*10-5
POH=-lg[OH-]=-lg(1.67*10-5)=4.77 PH=14-POH=9.231年前查看全部
- 某学生用0.1000 mol·L - 1 标准氢氧化钠溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
某学生用0.1000 mol·L - 1 标准氢氧化钠溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
A.取20.00 mL待测盐酸溶液注入洁净的锥形瓶中,并加入2-3滴酚酞试液
B.用标准氢氧化钠溶液润洗滴定管2-3次
C.把盛有标准氢氧化钠溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液
D.取标准氢氧化钠溶液注入碱式滴定管至“0”刻度以上2-3mL处
E.调节液面至“0”或“0”刻度以下,记下读数,为3.10mL
F.把锥形瓶放在滴定管的下面,用标准NaOH溶液滴定至终点并记下滴定管的读数。回答下列问题: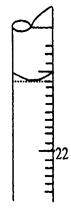
(1)正确的操作顺序是:B、 、F(填序号);
(2)上述B步骤操作的目的是 ;
(3)上述A步骤操作之前,若先用待测溶液润洗锥形瓶,则对滴定结果的影响
是 (填“偏大”或“偏小”或“无影响”);
(4)判断到达滴定终点的实验现象是 ;
(5)若滴定结束时,滴定管液面如图所示,则终点读数为 mL。
(6)根据读数计算出该待测液的浓度为 。 cujfbu1年前1
cujfbu1年前1 -
 fzlin 共回答了12个问题
fzlin 共回答了12个问题 |采纳率91.7%(1)D C E A (2)防止滴定管内壁附着的水将标准溶液稀释而带来误差
(3)偏大 (4)溶液由无色变为浅红色,且半分钟内不褪色
(5)21.10 (6)0.09000mol·L -1
1年前查看全部
- 准确量取25.00ml 0.1000mol/L碘酸钾标准溶液,于250mL碘量瓶中,加入75mL新煮沸冷却的水,加3g碘
准确量取25.00ml 0.1000mol/L碘酸钾标准溶液,于250mL碘量瓶中,加入75mL新煮沸冷却的水,加3g碘化钾及10mL冰乙酸溶液,摇匀后,暗处放置3min,用待标定的0.1mol/L硫代硫酸钠标准溶液滴定析出的碘,至淡黄色.加入1mL 0.5%淀粉溶液,呈蓝色.再继续滴定至蓝色刚刚褪去,即为终点.记录所有硫代硫酸钠溶液体积为24.80mL.求硫代硫酸钠标准溶液的浓度.
 lixe19731年前1
lixe19731年前1 -
 5618076 共回答了17个问题
5618076 共回答了17个问题 |采纳率82.4%抛去细枝末节,看清楚主要的反应过程和计量关系.这是一道关于碘量法的题.碘酸钾(A表示)与碘化钾(B表示)反应生成单质碘(C);硫代硫酸钠(D)与碘反应生成碘离子(E)和连四硫酸根(F).好了,开始解题,我直接用电子...1年前查看全部
- 常温时,用0.1000mol/L NaOH 滴定 25.00mL 0.1000m
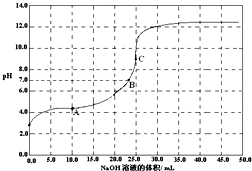 常温时,用0.1000mol/L NaOH 滴定 25.00mL 0.1000mol/L某一元酸HX,滴定过程中pH 变化曲线如图所示.下列说法正确的是( )
常温时,用0.1000mol/L NaOH 滴定 25.00mL 0.1000mol/L某一元酸HX,滴定过程中pH 变化曲线如图所示.下列说法正确的是( )
A.滴定前,酸中c(H+) 等于碱中c(OH-)
B.在A点,c(Na+)>c(X-)>c(HX)>c(H+)>c(OH-)
C.在B点,两者恰好完全反应
D.在C点,c(X-)+c(HX)=0.05 mol/L sunwei33401年前1
sunwei33401年前1 -
 爱里的ii 共回答了15个问题
爱里的ii 共回答了15个问题 |采纳率86.7%解题思路:A.0.1000mol/L某一元酸HX,其2<pH<4,为弱酸,c(H+)<0.1000mol/L,而NaOH为强碱,c(OH-)=0.1000mol/L;
B.在A点,显酸性,碱不足,则溶液中的溶质为HX和NaX;
C.在B点,pH=7,加入的NaOH溶液的体积小于25.00mL,溶质为HX和NaX;
D.C点,溶液的总体积为50.00mL,结合物料守恒分析.A.0.1000mol/L某一元酸HX,其2<pH<4,为弱酸,c(H+)<0.1000mol/L,而NaOH为强碱,c(OH-)=0.1000mol/L,则滴定前,酸中c(H+) 不等于碱中c(OH-),故A错误;
B.在A点,显酸性,碱不足,则溶液中的溶质为HX和NaX,结合量的关系可知c(HX)>c(X-)>c(Na+)>c(H+)>c(OH-),故B错误;
C.在B点,pH=7,加入的NaOH溶液的体积小于25.00mL,溶质为HX和NaX,显然碱不足,没有恰好完全反应,故C错误;
D.C点,溶液的总体积为50.00mL,由物料守恒可知c(X-)+c(HX)=[0.1000mol/L×0.025L/0.05L]=0.05mol/L,故D正确;
故选D.点评:
本题考点: 酸碱混合时的定性判断及有关ph的计算.
考点点评: 本题考查酸碱混合溶液中的定性判断,明确图中各点发生的化学反应及溶液中的溶质是解答本题的关键,注意物料守恒的应用及量的关系,题目难度中等.1年前查看全部
- 怎么配制500ml,PH=6.85浓度为0.1000mol/L的磷酸缓冲液
 hanaminc1年前1
hanaminc1年前1 -
 风筝与风000 共回答了16个问题
风筝与风000 共回答了16个问题 |采纳率87.5%直接买标准的磷酸二氢钠来配制就可以了,这样配出来的就是6.85
常见的用来校正酸度计的溶液1年前查看全部
- 以下是几种酸碱指示剂的变色范围:①甲基橙3.4.4,②甲基红4.6.2,③酚酞8.10.现用0.1000 mol·L-1
以下是几种酸碱指示剂的变色范围:①甲基橙3.4.4,②甲基红4.6.2,③酚酞8.10.现用0.1000 mol·L-1 NaOH溶液滴定浓度相近的甲酸时,上述指示剂
[ ]
A.
都可以用
B.
只能用③
C.
可以用①或②
D.
可以用②或③ psh11920081年前3
psh11920081年前3 -
 古币 共回答了17个问题
古币 共回答了17个问题 |采纳率88.2%应选B.即强碱滴定弱酸必须用酚酞,因为
1、从视角角度考虑,心理学研究证明:当溶液颜色由浅变深时易被观察到,反之则不易察觉,从而造成滴过量,产生误差.因此一般:
① 强酸滴定强碱时,应选甲基橙(或甲基红),因为滴定终点时溶液颜色由黄色→橙色;
② 强碱滴定强酸时,应选酚酞,因为滴定终点时溶液颜色由无色→红色;上面两种情况指示剂也可以互换.
③ 强酸滴定弱碱时必须选用甲基橙(或甲基红);
④ 强碱滴定弱酸时,必须选用酚酞.
2、从滴定准确度上看,例如,用0.1mol.L_1 NaOH滴定20ml 0.1mol.L_1左右的HCOOH溶液,当二者恰好中和时,因为产物为水解呈碱性的NaCOOH ,其PH=9.7左右,用酚酞作指示剂,当PH>8时,溶液由无色→红色,为终点.这时NaOH还差一点,此时的误差更小.若选甲基橙,则终点与指示剂的变色点相差太远,误差会很大,且不符合视觉要求.所以强碱滴定弱酸时,必须选用酚酞.1年前查看全部
- 某同学利用下图装置,用0.1000mol/L的氢氧化钾溶液测定某未知浓度的盐酸溶液的物质的量浓度,,其操作可分解为如下几
某同学利用下图装置,用0.1000mol/L的氢氧化钾溶液测定某未知浓度的盐酸溶液的物质的量浓度,,其操作可分解为如下几步:
E. 移取20.00mL待测盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞A.用标准溶液润洗滴定管2~3次 B.取标准KOH溶液注入碱式滴定管至刻度0以上2~3cm C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液 D.调节液面至0或0以下刻度,记下读数
F. 把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,并记下滴定管液面的刻度读数。
G.把锥形瓶里的溶液倒掉,用蒸馏水把锥形瓶洗涤干净。按上述操作重复一次,并记下滴定前后液面刻度的读数。
就此实验完成填空:
(1)上图所示是 常用的仪器,(填实验名称)。图中A是 (填仪器名称)
(2)判断到达滴定终点的实验现象是:___ ____
(3)上述E步骤操作之前,先用蒸馏水润洗锥形瓶,则对滴定结果的影响是
(填“偏高”、 “ 偏低”或“无影响”)。
(4)重复做该实验4次。所得实验数据如下表:
请你确定盐酸的物质的量浓度为 mol/L实验次数 c(KOH)/mol·L -1 B中起点刻度 B中终点刻度 V(HCl)/ml 1 0.1000 0 24.95 25.00 2 0.1000 0 24.96 25.00 3 0.1000 0 24.50 25.00 4 0.1000 0 24.94 25.00  lisa1132360731年前1
lisa1132360731年前1 -
 西城剑客 共回答了18个问题
西城剑客 共回答了18个问题 |采纳率94.4%(1)酸碱中和滴定(2分) 酸式滴定管(2分)
(2)溶液由无色变为红色并在半分钟内不褪色(2分)
(3)无影响 (2分) (4) 0.09980 mol/L(2分)
1年前查看全部
- 称纯碱样品4.850g,溶解后定容至250mL,取出25.00mL,用C(AgNO3)=0.1000mol/L的标准溶液
称纯碱样品4.850g,溶解后定容至250mL,取出25.00mL,用C(AgNO3)=0.1000mol/L的标准溶液滴定至终点,
消耗9.50mL,计算纯碱中NaCL的百分含量.(NaCL摩尔质量58.5 g / mol) na山na水na狗1年前1
na山na水na狗1年前1 -
 我想回到从前OK 共回答了18个问题
我想回到从前OK 共回答了18个问题 |采纳率83.3%NaCl + AgNO3 = AgCl (沉淀)+ NaNO3
1 1
X 0.1000x0.009500
X=9.500x10^-4 mol/L
纯碱中NaCL的百分含量=58.5X9.500x10^-4/4.850(25.00/250.0)=11.46%1年前查看全部
- 常温下,用0.1000mol/LNaOH溶液滴定20.00mL0.1000mol/L CH3COOH溶液所得滴
常温下,用0.1000mol/LNaOH溶液滴定20.00mL0.1000mol/L CH3COOH溶液所得滴定曲线如图.下列说法正确的是( )
 A. 点①所示溶液中:c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+)
A. 点①所示溶液中:c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+)
B. 点②所示溶液中:c(Na+)=c(CH3COOH)+c(CH3COO-)
C. 点③所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
D. 滴定过程中可能出现:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)>c(Na+) 半點咖啡1年前1
半點咖啡1年前1 -
 电子科技ww 共回答了21个问题
电子科技ww 共回答了21个问题 |采纳率90.5%解题思路:根据点①反应后溶液是CH3COONa与CH3COOH物质的量之比为1:1的混合物,溶液呈酸性,说明CH3COOH电离程度大于CH3COO-的水解程度,故c(Na+)>c(CH3COOH),
由电荷守恒可知:c(CH3COO-)+c(OH-)=c(Na+)+c(H+),所以c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+);点②pH=7,即c(H+)=c(OH-),c(Na+)=c(CH3COO-);
点③体积相同,则恰好完全反应生成CH3COONa,利用盐的水解来分析溶液呈碱性,则c(Na+)>c(CH3COO-)>c(OH-)>c(H+);在滴定中当加入碱比较少时,可能出现c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-)的情况.A、点①反应后溶液是CH3COONa与CH3COOH物质的量之比为1:1的混合物,CH3COOH电离程度大于CH3COO-的水解程度,故c(Na+)>c(CH3COOH),由电荷守恒可知:
c(CH3COO-)+c(OH-)=c(Na+)+c(H+),所以c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+),故A正确;
B、点②pH=7,即c(H+)=c(OH-),由电荷守恒知:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),故c(Na+)=c(CH3COO-),故B错误;
C、点③说明两溶液恰好完全反应生成CH3COONa,因CH3COO-水解,且程度较小,c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故C错误;
D、当CH3COOH较多,滴入的碱较少时,则生成CH3COONa少量,可能出现c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-),只有加碱,就会存在c(Na+)>c(OH-),故D错误;
故选A.点评:
本题考点: 酸碱混合时的定性判断及有关ph的计算.
考点点评: 本题考查NaOH与CH3COOH的反应,涉及盐类的水解和溶液离子浓度的大小比较,注意利用电荷守恒的角度做题,选项D为易错点,加NaOH与酸反应则c(Na+)>c(OH-),题目难度中等.1年前查看全部
- [1/(0.1000)^2]+[1/(0.5000)^2]的计算结果保留几位有效数字?
 阿笨猫2号1年前1
阿笨猫2号1年前1 -
 可想你了 共回答了25个问题
可想你了 共回答了25个问题 |采纳率76%4位1年前查看全部
- 将含有杂质的4.0g 氢氧化钠固体配成1000mL 溶液取20.00mL 装入锥形瓶中用0.1000mol/L 盐酸滴定
将含有杂质的4.0g 氢氧化钠固体配成1000mL 溶液取20.00mL 装入锥形瓶中用0.1000mol/L 盐酸滴定甲基橙作指示剂 消耗盐酸19.00mL则该氢氧化钠中含的杂质可能是
A.Na2O B.Na2CO3 C.NaHCO3 D.Ca(OH)2
可能和不可能都要 泪眼看穿1年前1
泪眼看穿1年前1 -
 mmnn 共回答了25个问题
mmnn 共回答了25个问题 |采纳率96%本题选BC
【解析】
如果是4g不含杂质的NaOH配置成1000ml溶液,则,其浓度为4÷40÷1=0.1mol/L
NaOH + HCl~
1 1
0.1×0.02 a
那么a=0.02=20ml ,既如果是纯净的NaOH配成的溶液,其消耗盐酸的体积应为20ml
也就是说,每 4g消耗3.65gHCl
现在,因为NaOH含有杂质,所以消耗体积为19ml
说明,每4g杂质消耗的HCl质量小于3.65g
所以,消耗HCl的体积才会比纯NaOH溶液消耗的体积小.
所以,只要计算出消耗HCl更少的物质,既是可能存在的杂质.
Na2O 2HCl
62 73
4 b ===> b=4.7 既每4g Na2O消耗HCl 4.7g
Na2CO3 2HCl
106 73
4 c ===> c=2.75 既每4g Na2CO3消耗HCl 2.75g
NaHCO3 HCl
84 36.5
4 d ====> d=1.74 既每4g NaHCO3消耗HCl 1.74g
Ca(OH)2 2HCl
74 73
4 e ====>e=3.95 既每4g NCa(OH)2消耗HCl 3.95g
从计算结果来看,如果杂质是Na2O或Ca(OH)2,则消耗的HCl更多,最终滴定的结果应大于20ml
也就是说,杂质可能是 Na2CO3和NaHCO3~1年前查看全部
- 配制0.1000mol/L重铬酸钾溶液,主要使用哪些量器
 历史长河1年前2
历史长河1年前2 -
 smilehou 共回答了20个问题
smilehou 共回答了20个问题 |采纳率85%电子分析天平 烧杯 容量瓶1年前查看全部
- 用0.1000mol/L的NaOH溶液滴定0.1000mol/L的HCl和0.5000mol/L的NH4Cl混合溶液中的
用0.1000mol/L的NaOH溶液滴定0.1000mol/L的HCl和0.5000mol/L的NH4Cl混合溶液中的盐酸,合适的指示剂是:
A.甲基红 B.甲基橙 C.中性红 D.酚酞
请说明原因.
哪位高手知道这题怎么计算?急用! 三秋桂子1年前1
三秋桂子1年前1 -
 shabi2011 共回答了23个问题
shabi2011 共回答了23个问题 |采纳率82.6%AB
因为含有NH4Cl,所以滴定终点的PH呈酸性,要用酸性时呈中间色的指示剂.1年前查看全部
- 在20.00ml的HCL溶液(0.1000mol/L)中,加入19.50mlNaOH(0.1500mol/L),计算溶液
在20.00ml的HCL溶液(0.1000mol/L)中,加入19.50mlNaOH(0.1500mol/L),计算溶液的PH为多少?
2.为标定HCL滴定液的浓度,称取基准物质Na2CO30.1520g,用去HCL溶液25.20ml,求HCL溶液的浓度. sherwin_zx1年前1
sherwin_zx1年前1 -
 276863040 共回答了22个问题
276863040 共回答了22个问题 |采纳率90.9%1)[OH-]=(0.1500*19.50-0.1000*20.00)/[(20.00+19.50)/1000]=2.34*10^-5mol/L
POH=-log(2.34*10^-5)=4.63
PH=9.37
2)Na2CO3 + 2HCI ——2NaCI + CO2 + H2O
比例:1 2
0.1520/105.99 C*25.20/1000
计算得C=0.1138mol/L
105.99是Na2CO3的摩尔质量1年前查看全部
- 有效数字的保留问题用返滴定法测定某酸,为了保证测定的准确度,加入足够过量的40.00 mL 0.1000 mol/L N
有效数字的保留问题
用返滴定法测定某酸,为了保证测定的准确度,加入足够过量的40.00 mL 0.1000 mol/L NaOH 溶液,再用浓度详尽的HCl 返滴定,消耗39.10 mL,分析结果合理的为 ( ) (A) 10% (B) 10.1% (C) 10.12% (D)10.121%我觉得选C,可答案选B,这是为什么? TomD1年前1
TomD1年前1 -
 Office系列办 共回答了15个问题
Office系列办 共回答了15个问题 |采纳率93.3%这个题目考察的是你对有效数字与误关系的认识:尽管使用氢氧化钠溶液的数量都具有4位有效数字,但是,它只是消耗了40.00-39.10=0.90ml,它只有两位有效数字!所以后面的结果(剩余的计算都是乘法了)只能保留两位有效数字.
计算结果为10.121,大于并非常接近1.0000,故可保留增一位,最后保留三位有效数字是正确的.
你保留四位(10.12)是毫无道理和完全错误的!1年前查看全部
- (2014•四川模拟)一定体积的KMnO4溶液恰好能氧化一定质量的KHC2O4•H2C2O4•2H2O.若用0.1000
(2014•四川模拟)一定体积的KMnO4溶液恰好能氧化一定质量的KHC2O4•H2C2O4•2H2O.若用0.1000mol•L-1的NaOH溶液中和相同质量的KHC2O4•H2C2O4•2H2O,所需NaOH溶液的体积恰好为KMnO4溶液的3倍,则KMnO4溶液的浓度(mol•L-1)为( )
提示:①H2C2O4是二元弱酸②10[KHC2O4•H2C2O4]+8KMnO4+17H2SO4=8MnSO4+9K2SO4+40CO2↑+32H2O.
A.0.0089
B.0.0020
C.0.0800
D.0.2400 baobaoma1年前1
baobaoma1年前1 -
 kingshui 共回答了19个问题
kingshui 共回答了19个问题 |采纳率100%解题思路:两反应中KHC2O4•H2C2O4•2H2O的物质的量相同,令其物质的量为1mol,H2C2O4是二元弱酸,所以1molKHC2O4•H2C2O4•2H2O可以中和氢氧化钠3mol,根据V=[n/c]计算氢氧化钠溶液的体积,进而计算高锰酸钾溶液的体积,由方程式10[KHC2O4•H2C2O4]+8KMnO4+17H2SO4=8MnSO4+9K2SO4+40CO2↑+32H2O计算1molKHC2O4•H2C2O4反应需要KMnO4的物质的量,最后根据c=[n/V]计算高锰酸钾溶液的浓度.两反应中KHC2O4•H2C2O4•2H2O的物质的量相同,令其物质的量为1mol,H2C2O4是二元弱酸,
所以1molKHC2O4•H2C2O4•2H2O可以中和氢氧化钠3mol,恰好中需要氢氧化钠溶液的体积为[3mol/0.1mol/L]=30L,
所以高锰酸钾溶液的体积为30L×[1/3]=10L,由方程式10[KHC2O4•H2C2O4]+8KMnO4+17H2SO4=8MnSO4+9K2SO4+40CO2↑+32H2O
可知1molKHC2O4•H2C2O4反应需要KMnO4的物质的量为[8/10]×1mol=0.8mol,
所以高锰酸钾溶液的浓度为[0.8mol/10L]=0.08mol/L.
故选:C.点评:
本题考点: 化学方程式的有关计算.
考点点评: 考查物质的量浓度计算、根据方程式的计算,浓度中等,判断恰好发生中和反应氢氧化钠与KHC2O4•H2C2O4•2H2O关系是关键,注意假设法的运用.1年前查看全部
- 常温下,用0.1000mol/L NaOH溶液滴定20.00mL 0.1000mol/L
 常温下,用0.1000mol/L NaOH溶液滴定20.00mL 0.1000mol/L HCl溶液,滴定曲线如图所示下列说法不正确的是( )
常温下,用0.1000mol/L NaOH溶液滴定20.00mL 0.1000mol/L HCl溶液,滴定曲线如图所示下列说法不正确的是( )
A.a=20.00
B.滴定过程中,可能存在:c(Cl-)>c(H+)>c(Na+)>c(OH-)
C.若用酚酞作指示剂,当滴定到溶液明显由无色变为红色时停止滴定
D.若将盐酸换成同浓度的醋酸,则滴定到pH=7时,a>20.00 萍水相逢莉1年前1
萍水相逢莉1年前1 -
 tt1878 共回答了20个问题
tt1878 共回答了20个问题 |采纳率100%解题思路:A、根据NaOH和HCl恰好反应时生成强酸强碱盐,溶液呈中性;
B、根据滴定过程酸过量来分析;
C、根据滴定终点的判断方法;
D、NaOH和醋酸恰好反应时生成强碱弱酸盐,溶液呈碱性,若要呈中性,则醋酸过量.A、NaOH和HCl恰好反应时,消耗20mlNaOH溶液,生成强酸强碱盐,溶液呈中性,故A正确;
B、滴定过程酸过量时,c(Cl-)>c(H+)>c(Na+)>c(OH-),故B正确;
C、用酚酞作指示剂进行中和滴定时,当溶液由无色变为红色时,且30秒内不褪色,停止滴定,故C错误;
D、NaOH和醋酸恰好反应时生成强碱弱酸盐,溶液呈碱性,所以滴定到pH=7时,a<20.00,故D错误;
故选CD.点评:
本题考点: 中和滴定.
考点点评: 本题考查了常见的实验操作,注意过程的分析,难度不大,应注意相关知识的积累.1年前查看全部
- 关于电解质溶液的三大守恒问题 常温下,用0.1000mol/LNaOH溶液滴定20.00ml0.1000mol/LCH3
关于电解质溶液的三大守恒问题
常温下,用0.1000mol/LNaOH溶液滴定20.00ml0.1000mol/LCH3COOH溶液所得滴定曲线
所加NaOH溶液10ml,此时4 快乐傻宝贝1年前1
快乐傻宝贝1年前1 -
 疾风888 共回答了20个问题
疾风888 共回答了20个问题 |采纳率90%溶液中含有的溶质____CH3COOH CH3COONa____
电荷守恒:_c(H+) +c(Na+)=c(OH-)+c(CH3COO-)
物料守恒 c(CH3COOH)+c(CH3COO-)=0.1000mol/L
质子守恒:无
所加NaOH溶液20ml,此时PH>7
溶液中含有的溶质____CH3COONa______________
电荷守恒:c(H+) +c(Na+)=c(OH-)+c(CH3COO-)
物料守恒:c(Na+)=c(CH3COOH)+c(CH3COO-)
质子守恒:c(H+)+C(CH3COOH)=C(OH-)1年前查看全部
- 用0.1000mol/LNaOH溶液滴定0.1000mol/L甲酸溶液,化学计量点的PH值是多少?应选什么指示剂?
 xiedanlove31年前1
xiedanlove31年前1 -
 邪舞冷冷 共回答了9个问题
邪舞冷冷 共回答了9个问题 |采纳率100%化学计量点的pH应该高于7,因为甲酸钠是碱性的
应该用碱性的指示剂,有点忘了1年前查看全部
- 用0.1000mol/LNaOH标准溶液滴定20.00mL0.1000mol/LHAc溶液,达到化学计量点时,其溶液的p
用0.1000mol/LNaOH标准溶液滴定20.00mL0.1000mol/LHAc溶液,达到化学计量点时,其溶液的pH().
 luckyjoyce1年前3
luckyjoyce1年前3 -
 明天该做什么 共回答了31个问题
明天该做什么 共回答了31个问题 |采纳率90.3%溶液的pH>7,达到化学计量点即中和反应完全进行,此时溶液中的溶质为NaAc,是强碱弱酸盐,水解呈碱性,所以溶液的pH>71年前查看全部
- 实验室用固体烧碱配制500ml 0.1000mol/L的NaOH溶液.
实验室用固体烧碱配制500ml 0.1000mol/L的NaOH溶液.
1. 需称量____________g烧碱,应放在__________(填仪器名称)中称量
2. 在容量瓶中确定溶液体积的过程中,最后加入少量水的做法是________________ 苹果的叶子1年前2
苹果的叶子1年前2 -
 Y易水寒Y 共回答了21个问题
Y易水寒Y 共回答了21个问题 |采纳率90.5%500ml=0.5l 0.1mol/lx0.5l=0.05mol
烧碱的质量= 0.05molx40g/mol=2.0g,
托盘天平
用胶头滴管加水至凹液面最低处与刻度线水平时停止加水1年前查看全部
- 今有硫酸和硫酸铵的混合溶液,浓度均为0.050摩尔每升,欲用0.1000摩尔每升氢氧化钠溶液滴定,试问:能否准
 430dupeng1年前2
430dupeng1年前2 -
 cf453759340c21b4 共回答了20个问题
cf453759340c21b4 共回答了20个问题 |采纳率95%不能准确测定1年前查看全部
- 比如说在醋酸的总酸含量测定中,滴定的NAOH为0.1000 那么我计算得到的结果也应有四位小数 是计算结果和题干给出数据
比如说在醋酸的总酸含量测定中,滴定的NAOH为0.1000 那么我计算得到的结果也应有四位小数 是计算结果和题干给出数据的有效位数一致 还是 保留的小数位数一致 呢
 Ailun81年前3
Ailun81年前3 -
 风行者1 共回答了23个问题
风行者1 共回答了23个问题 |采纳率78.3%正常情况是有效数字保持一致1年前查看全部
- 预测定某NaOH溶液的物质的量浓度,可用0.1000mol/L HCl标准溶液进行中和滴定(用酚酞作指示剂).
预测定某NaOH溶液的物质的量浓度,可用0.1000mol/L HCl标准溶液进行中和滴定(用酚酞作指示剂).
以下操作造成测定结果偏高的是:
A.配制待测溶液的氢氧化钠中混有Na2CO3杂质
B.滴定终点读数时,俯视滴定管的刻度,其他操作均正确
C.盛装待测液的锥形瓶用蒸馏水润洗后,在用待测液润洗
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
E.未用标准液润洗酸式滴定管 6f4540f0170f0f1b1年前4
6f4540f0170f0f1b1年前4 -
 myempirelb 共回答了21个问题
myempirelb 共回答了21个问题 |采纳率85.7%A、同等质量的氢氧化钠与碳酸钠,碳酸钠消耗的盐酸少,因此结果偏低
B、俯视度数,导致读数偏小,因此结果偏低
C、用待测液润洗将导致锥形瓶中的待测液实际体积偏大,因此结果偏高
D、将导致盐酸体积读数偏高,因此结果偏高
E、未用标准液润洗滴定管,将导致标准液溶液降低,结果就是滴定读数偏高,也就是结果偏高
选CDE1年前查看全部
- 7.某碱液25.00 mL,以0.1000 mol/L HCl标准溶液滴定至酚酞褪色,用去15.28 mL,再加甲基橙继
7.某碱液25.00 mL,以0.1000 mol/L HCl标准溶液滴定至酚酞褪色,用去15.28 mL,再加甲基橙继续滴定,又消
HCl6.50 mL,此碱液的组成是( )
A.NaOH+NaHCO3 B.NaOH+Na2CO3 C.NaHCO3 D.Na2CO3 JasonPiao1年前1
JasonPiao1年前1 -
 大白鲨一号 共回答了13个问题
大白鲨一号 共回答了13个问题 |采纳率84.6%答案 B1年前查看全部
- 用0.1000摩尔每升NAOH溶液滴定0.10摩尔每升
用0.1000摩尔每升NAOH溶液滴定0.10摩尔每升
H2C2O4溶液,应选择的指示剂为?
溴甲酚绿 甲基红 酚酞 中性红 诃池上作一词1年前1
诃池上作一词1年前1 -
 魔鬼11 共回答了18个问题
魔鬼11 共回答了18个问题 |采纳率77.8%pH=5.12
故 溴甲酚绿为指示剂.1年前查看全部
- (2012•安庆二模)常温下,用 0.1000mol/L NaOH 溶液分别滴定
 (2012•安庆二模)常温下,用 0.1000mol/L NaOH 溶液分别滴定 20.00mL 0.1000mol/L HA 溶液(滴定曲线见图1)和20.00mL 0.1000mol/L HB溶液(滴定曲线见图2).下列说法正确的是( )
(2012•安庆二模)常温下,用 0.1000mol/L NaOH 溶液分别滴定 20.00mL 0.1000mol/L HA 溶液(滴定曲线见图1)和20.00mL 0.1000mol/L HB溶液(滴定曲线见图2).下列说法正确的是( )
A.图1可以表示NaOH滴定醋酸的曲线
B.图1中B点状态时,溶液中有:c(Na+)=c(A-)
C.达到B、E状态时,反应消耗的n(HA)<n(HB)
D.当0mL<V(NaOH)<20.00mL时,对应混合溶液中各离子浓度由大到小的顺序均为c(A-)>c(Na+)>c(H+)>c(OH-) tangtang3231年前1
tangtang3231年前1 -
 jeremyway 共回答了23个问题
jeremyway 共回答了23个问题 |采纳率100%解题思路:A.根据初始酸溶液中氢离子浓度和酸浓度的关系判断酸性强弱;
B.根据溶液的酸碱性及电荷守恒判断;
C.根据图知,B和E状态消耗酸的物质的量相等;
D.当0mL<V(NaOH)<20.00mL时,酸过量,溶液呈酸性,根据酸和盐物质的量的相对大小及电荷守恒判断.A.根据图知,HA未加氢氧化钠溶液时pH=1,HA的浓度是0.1mol/L,所以HA是完全电离,为强酸,HB的初始浓度是0.1mol/L,pH>1,说明HB部分电离为弱酸,故A错误;
B.图1B点状态,二者恰好反应生成盐和水,溶液呈中性,则c(H-)=c(OH-),盐为强酸强碱盐,根据电荷守恒得c(A-)+c(OH-)=c(Na+)+c(H+),所以c(Na+)=c(A-),故B正确;
C.达到B、E状态时,根据图中横坐标知,n(HA)=n(HB),故C错误;
D.当0mL<V(NaOH)<20.00mL时,酸过量,溶液呈酸性,所以c(H+)>c(OH-),如果氢氧化钠的量很少,则溶液中c(H+)>c(Na+),如果氢氧化钠的量为HA的一半,则c(Na+)=c(H+),如果氢氧化钠的量较多时,则c(Na+)>c(H+),故D错误;
故选:B.点评:
本题考点: 酸碱混合时的定性判断及有关ph的计算;离子浓度大小的比较.
考点点评: 本题考查了酸碱混合溶液定性判断,先根据酸溶液初始pH判断酸性强弱,再结合电荷守恒及溶液的酸碱性分析,易错选项是D,采用极限的方法分析解答,难度中等.1年前查看全部
- 常温下,用0.1000 mol/L NaOH溶液分别滴定20.00 mL 0.1000 mol/L 盐酸和20.00 m
常温下,用0.1000 mol/L NaOH溶液分别滴定20.00 mL 0.1000 mol/L 盐酸和20.00 mL 0.1000 mol/L 醋酸溶液,得到2条滴定曲线,如下图所示。 若以HA表示酸,下列说法正确的是 
[ ]
A.滴定盐酸的曲线是图2
B.达到B、D状态时,两溶液中离子浓度均为c(Na + ) = c(A - )
C.达到B、E状态时,反应消耗的n(CH 3 COOH)>n(HCl)
D.当0 mL< V(NaOH) <20. 00 mL时,对应混合溶液中各离子浓度由大到小的顺序均为 c(A - ) >c(Na + )> c(H + ) > c(OH - ) piledriver1年前1
piledriver1年前1 -
 第四天的心情 共回答了18个问题
第四天的心情 共回答了18个问题 |采纳率94.4%B1年前查看全部
- 在用0.1000mol/LNaOH溶液测定食醋总酸含量的实验中,下列说法正确的是( )
在用0.1000mol/LNaOH溶液测定食醋总酸含量的实验中,下列说法正确的是( )
A.碱式滴定管没有润洗会使测定含量偏低
B.用移液管移取一定体积食醋时,应将移液管垂直放入稍倾斜的容器中,并将尖嘴贴紧容器
C.该实验应用甲基橙作指示剂
D.如果氢氧化钠溶液滴加过量,只能重新实验 rr的rr1年前1
rr的rr1年前1 -
 usagichen 共回答了23个问题
usagichen 共回答了23个问题 |采纳率91.3%解题思路:A.碱式滴定管没有润洗,标准液的浓度偏小;
B.移液时,应将移液管垂直放入稍倾斜的容器中,并将尖嘴贴紧容器;
C.根据盐类的水解考虑溶液的酸碱性,然后根据指示剂的变色范围与酸碱中和后的越接近越好,且变色明显(终点变为红色),溶液颜色的变化由浅到深容易观察,而由深变浅则不易观察;
D.可向锥形瓶中加入定量的醋酸,重新滴定.A.碱式滴定管没有润洗,标准液的浓度偏小,消耗标准液体积增大,浓度偏高,故A错误;
B.移液管移液时,应将移液管垂直放入稍倾斜的容器中,并将尖嘴贴紧容器,故B正确;
C.用0.1000mol/LNaOH溶液滴和CH3COOH溶液反应恰好完全时,生成了CH3COONa,CH3COONa溶液中醋酸根离子部分水解,溶液呈碱性,根据指示剂的变色范围可知,应选择碱性范围内变色的指示剂,即酚酞,不能选用甲基橙和甲基红,故C错误;
D.氢氧化钠过量,可向锥形瓶中加入定量的醋酸,重新滴定,故D错误.
故选B.点评:
本题考点: 化学实验方案的评价;中和滴定.
考点点评: 本题考查化学实验方案的评价,主要考查中和滴定,C为易错点,注意指示剂的选择方法,题目难度中等.1年前查看全部
- (1)常温下,用0.1000mol/LNaOH浴液分别滴定20.00mL0.1000mol/LHCl溶液和20.00mL
(1)常温下,用0.1000mol/LNaOH浴液分别滴定20.00mL0.1000mol/LHCl溶液和20.00mL 0.1000mol/LCH3COOH溶液,得到2条滴定曲线,如图所示.

①由A、C点判断,滴定HCl溶液的曲线是______(填“图1”或“图2”);
②a=______mL;
③c(Na+)=c(CH3COO-)的点是______(填B、D或E);
④E点对应离子浓度由大到小的顺序为______.
(2)Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)⇌Cr3+(aq)+3OH-(aq)常温下,Cr(OH)3的溶度积Kap=c(Cr3+)•c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至______. hardlystop1年前1
hardlystop1年前1 -
 我是谁哈 共回答了17个问题
我是谁哈 共回答了17个问题 |采纳率94.1%解题思路:(1)①氯化氢是强电解质,醋酸是弱电解质,等浓度的盐酸和醋酸,醋酸的pH大于盐酸;
②根据图1知,在盐酸溶液中,pH=7时,盐酸和氢氧化钠的物质的量相等;
③根据电荷守恒判断;
④根据溶液的酸碱性及电荷守恒判断离子浓度大小;
(2)根据溶度积常数及铬离子浓度计算溶液中氢氧根离子浓度,再根据水的离子积常数计算氢离子浓度,从而得出溶液的pH.(1)①氯化氢是强电解质,醋酸是弱电解质,等浓度的盐酸和醋酸,醋酸的pH大于盐酸,根据图象知,未加氢氧化钠溶液时,图1的PH小于图2,所以图1是盐酸,故答案为:图1;
②根据图1知,在盐酸溶液中,pH=7时,盐酸和氢氧化钠的物质的量相等,盐酸和氢氧化钠的物质的量浓度相等,要使其物质的量相等,则体积必须相等,所以a=20mL,故答案为:20mL;
③溶液中存在电荷守恒c(Na+)+c(H+)=c(OH-)+c(CH3COO-),因为c(Na+)=c(CH3COO-),所以c(H+)=c(OH-),则溶液呈中性,为D点,故答案为:D;
④溶液呈碱性,c(H+)<c(OH-),溶液中存在电荷守恒c(Na+)+c(H+)=c(OH-)+c(CH3COO-),所以则c(Na+)>c(CH3COO-),溶液是盐溶液,所以c(CH3COO-)>c(OH-),则溶液中离子浓度大小顺序是:c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故答案为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+);
(2)根据溶度积常数得溶液中c(OH-)=
3
Ksp
c(Cr3+)
=
3
10−32
10−5
mol/L=10-9 mol/L,则溶液中氢离子浓度=
10−14
10−9mol/L=10-5 mol/L,则溶液的pH=5,
故答案为:5.点评:
本题考点: 酸碱混合时的定性判断及有关ph的计算.
考点点评: 本题考查了酸碱混合溶液定性判断及溶度积常数的计算等知识点,明确弱电解质电离特点结合电荷守恒来分析解答即可,难度中等.1年前查看全部
- 常温下,用 0.1000mol/LNaOH溶液滴定 20.00mL0.1000mol/LHA溶液所得滴定曲线如图.下列说
常温下,用 0.1000mol/LNaOH溶液滴定 20.00mL0.1000mol/LHA溶液所得滴定曲线如图.下列说法不正确的是(
 常温下,用 0.1000mol/LNaOH溶液滴定 20.00mL0.1000mol/LHA溶液所得滴定曲线如图.下列说法不正确的是( )
常温下,用 0.1000mol/LNaOH溶液滴定 20.00mL0.1000mol/LHA溶液所得滴定曲线如图.下列说法不正确的是( )
A.滴定过程中可能出现:c(Na+)>c(A-)>c(H+)>c(OH-)
B.点①所示溶液中:c(A-)+c(HA)=2c(Na+)
C.点②所示溶液中:c(Na+)=c(A-)
D.点③所示溶液中:c(OH-)=c(HA)+c(H+)
 omar_fermat1年前1
omar_fermat1年前1 -
 填鸭狂吐 共回答了20个问题
填鸭狂吐 共回答了20个问题 |采纳率95%A.若c(Na+)>c(A-)>c(H+)>c(OH-),阳离子电荷总数大于阴离子电荷总数,违反电荷守恒,故A错误;
B.点①所示溶液中,为等量的醋酸和醋酸钠溶液,物料守恒为2c(Na+)=c(CH3COO-)+c(CH3COOH),故B正确;
C.②为中性溶液,则c(H+)=c(OH-),电荷守恒得c(OH-)+c(CH3COO-)=c(Na+)+c(H+),所以c(Na+)=c(A-),故C正确;
D.点③所示溶液,恰好反应生成盐,但盐是强碱弱酸盐,根据质子守恒得c(OH-)=c(HA)+c(H+),故D正确;
故选A.1年前查看全部
- 请问我想配制0.1000mol/l的盐酸标准溶液,需要吸取多少毫升分析纯盐酸呢,具体计算步骤是怎么样的呢?谢
 最爱小凡1年前2
最爱小凡1年前2 -
 付出就会有回报 共回答了19个问题
付出就会有回报 共回答了19个问题 |采纳率89.5%9ml加水至1000ml
这个不能用计算来算的,配的只是大概,还是要标定.用无水碳酸钠进行标定1年前查看全部
大家在问
- 1判断题。(正确的在括号里打“√”,错误的打“×”)(8分)
- 2一件风衣400元,现提价百分之10,在降价百分之10,现价与原价比,比原价低,还是高?
- 3一道立体几何题呃从平面a外一点P引斜线段PA和PB,它们与a分别成45度和30度角,则角APB的最大值是________
- 4在比例尺是1:500000的图纸上量得甲、乙两地间距离是14厘米,这两地实际距离是( )千米。
- 5用数字和化学符号填空:(1)氧原子______;(2)2个镁离子______;(3)3个水分子______;(4)-1价
- 6下列有关基因工程的叙述中,正确的是 [ ] A.限制性核酸内切酶只在获得
- 7已知函数f(x),对任意正整数x,y都有f(x+y)=f(x)^f(y),且f(1)=1/2,令Sn=f(1)+f(2)
- 8山中杂诗最后一句为什么说云从窗里飞出来?
- 9请问,电子商务服务产品的概念、基本特征分别是什么?写论文用的
- 10溶液标定的操作过程和应注意的事项是什么 给个文字型的标准答案~再给个出处
- 11英语地址翻译 河北省 三河市 燕郊经济开发区 世纪名苑小区
- 12在平直公路上有甲、乙两辆车,甲车在乙车前方10m处,两车同时向同一方向运动,甲车以10m/s的速度做匀速直线运动,乙车从
- 13年轻人躺在病床上(扩句)
- 14在利用自由落体“验证机械能守恒定律”的实验中:
- 15two persons are standing on a hill,and one is the father of
