电离平衡常数?电离和水解的区别是?气体的平衡常数K和溶液的电离平衡有点混 溶液的电离平衡常数怎么算
 lwzbest2022-10-04 11:39:541条回答
lwzbest2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 marzo2006 共回答了18个问题
marzo2006 共回答了18个问题 |采纳率94.4%- 对于一般可逆反应aA + b B ======可逆==== gG + hH平衡时K=( (G)^g * (H)^h )/( (A)^a * (B)^b )其中(G)(H)等表示 物质G、H的浓度 K是平衡常数上述:在一定温度下,可逆反应达到平衡时,生成物浓度幂的连乘积与反应物浓度幂的连乘积之比,是一个常数,幂指数为化学计量数改变温度,K的值会发生变化. 水解 水解是一种化工单元过程,是利用水将物质分解形成新的物质的过程.
物质与水发生的导致物质发生分解的反应(不一定是复分解反应)
(也可以说是物质是否与水中的氢离子或者是氢氧根离子发生反应)
由弱酸根或弱碱离子组成的盐类的水解有两种情况:
① 弱酸根与水中的H+ 结合成弱酸,溶液呈碱性,如乙酸钠的水溶液:
CH3COO- + H2O ←═→ CH3COOH + OH-
② 弱碱离子与水中的OH- 结合,溶液呈酸性,如氯化铵水溶液:
NH4+ + H2O ←═→ NH3·H2O + H+
生成弱酸(或碱)的酸(或碱)性愈弱,则弱酸根(或弱碱离子)的水解倾向愈强.
例如,硼酸钠的水解倾向强于乙酸钠,溶液浓度相同时,前者的pH值更大.
弱酸弱碱盐溶液的酸碱性取决于弱酸根[1]和弱碱离子水解倾向的强弱.
例如,碳酸氢铵中弱酸根的水解倾向比弱碱离子强,溶液呈碱性;
氟化铵中弱碱离子的水解倾向强,溶液呈酸性;
若两者的水解倾向相同,则溶液呈中性,这是个别情况,如乙酸铵.
弱酸弱碱盐的水解与相应强酸弱碱盐或强碱弱酸盐的水解相比,
弱酸弱碱盐的水解度大,溶液的pH更接近7(常温下).
如0.10 mol/L的Na2CO3的水解度为4.2%,pH为11.6,
而同一浓度的(NH4)2CO3的水解度为92%,pH为9.3.
酯、多糖、蛋白质等与水作用生成较简单的物质,也是水
CH3COOC2H5 + H2O ─→ CH3COOH + C2H5OH
(C6H10O5)n + nH2O ─→ nC6H12O6
某些能水解的盐被当作酸(如硫酸铝)或碱(如碳酸钠)来使用.
正盐
正盐分四类:
一、强酸强碱盐不发生水解,因为它们电离出来的阴、阳离子不能破坏水的电离平衡,所以呈中性.
二、强酸弱碱盐,我们把弱碱部分叫弱阳,弱碱离子能把持着从水中电离出来的氢氧根离子,破坏了水的电离平衡,使得水的电离正向移动,结果溶液中的氢离子浓度大于氢氧根离子浓度,使水溶液呈酸性.
三、强碱弱酸盐,我们把弱酸部分叫弱阴,同理弱阴把持着从水中电离出来的氢离子,使得溶液中氢氧根离子浓度大于氢离子浓度,使溶液呈碱性.
四、弱酸弱碱盐,弱酸部分把持氢,弱碱部分把持氢氧根,生成两种弱电解质,再比较它们的电离常数Ka、Kb值的大小(而不是水解度的大小),在一温度下,弱电解质的电离常数(又叫电离平衡常数)是一个定值,这一比较就可得出此盐呈什么性了,谁强呈谁性,电离常数是以10为底的负对数,谁负得少谁就大.总之一句话,盐溶液中的阴、阳离子把持着从水中电离出来的氢离子或氢氧根离子能生成弱电解质的反应叫盐类的水解.还有有机物类中的水解,例如酯类的水解,是酯和水反应(在无机酸或碱的条件下)生成对应羧酸和醇的反应叫酯的水解,还有卤代烃的碱性水解,溴乙烷和氢氧化钠水溶液反应生成乙醇和溴化钠叫卤烷的水解,还有蛋白质的水解,最终产物为氨基酸等等.
水解反应
(1)含弱酸阴离子、弱碱阳离子的盐的水解,例如:Fe3++3H2O=Fe(OH)3+3H+,CO32-+H2O=HCO3-+OH-
(2)金属氮化物的水解,例如:Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑
(3)金属硫化物的水解,例如:Al2S3+6H2O=2Al(OH)3↓+3H2S↑
(4)金属碳化物的水解,例如:CaC2+2H2O=Ca(OH)2+C2H2↑
(5)非金属卤化物的水解,例如:PCl3+3H2O=H3PO3+3HCl
此类反应多为水分子攻击卤原子,但也有例外,如NCl3水
NCl3+3H2O=NH3+3HClO
该反应为水分子攻击氮原子
取代反应(水解反应)(有机反应)
1.卤代烃在强碱水溶液中水解,例如:CH3CH2-Cl+H-OH—△→NaOH
CH3CH2OH+HCl
2.醇钠的水解,例如:CH3CH2ONa+H2O=CH3CH2OH+NaOH
3.酯在酸、碱水溶液中水解,例如:CH3COOCH2CH3+H2O—△H+orOH-→CH3COOH+CH3CH2OH
4.二糖、多糖的水解,例如淀粉的水(C6H10O5)n+nH2O→nC6H12O6(葡萄糖)
5.二肽、多肽的水解,例如H2NCH2CONHCH2COOH+H2O→2H2NCH2COOH
6.亚胺的水解 ArCH=N-Ph—H20 H+ →ArCHO+PhNH2
电离通常包含物理过程和化学过程.物理过程就是溶解.化学过程不是化学变化.化学变化除了旧键的断裂还要有新键的生成.所以电离不是化学变化.而化学过程指的是在溶剂分子(如水分子)作用下,电解质中原有的一部分化学键断裂.有的电离过程断裂的化学键是离子键,如氯化钠等大多数盐类的电离,氢氧化钠等大多数碱的电离.也有的电离过程断裂的是共价键,如硫酸的电离,氯化氢的电离,等等.
电离有完全电离和不完全电离之分.强电解质在水溶液中是完全电离的,如硫酸、氯化钠、氢氧化钠等.弱电解质在水溶液中呈现不完全电离状态,如氯化汞的电离,硫化氢的电离等. - 1年前
相关推荐
- 关于化学平衡常数、电离平衡常数、水的离子积常数和溶解平衡常数,下列说法正确的是( ) A.四种平衡常数都是一个比值,没
关于化学平衡常数、电离平衡常数、水的离子积常数和溶解平衡常数,下列说法正确的是( ) A.四种平衡常数都是一个比值,没有单位 B.四种平衡常数都是温度的函数,温度升高其值都增大 C.一个化学反应的平衡常数与物质的计量数无关 D.对于同类型反应,化学平衡常数K的大小反映了化学反应可能进行的程度  ncyd1191年前1
ncyd1191年前1 -
 chenhcen86 共回答了19个问题
chenhcen86 共回答了19个问题 |采纳率84.2%A、化学平衡常数、电离平衡常数、水的离子积常数和溶解平衡常数都是一个比值,但是有的含有单位,故A错误;
B、平衡常数都是温度的函数,随温度变化做相应的变化,电离平衡常数、水的离子积常数和溶解平衡常数温度升高其值都增大,但是化学平衡常数随温度的变化和反应的吸放热情况有关,故B错误;
C、一个化学反应的平衡常数与物质的计量数有关,故C错误;
D、对于同类型反应,化学平衡常数K的意义可以反映化学反应可能进行的程度,故D正确.
故选D.1年前查看全部
- 化学平衡常数(K)、弱酸的电离平衡常数(K a )、难溶物的溶度积常数(K sp )是判断物质性质或变化的重要的平衡常数
化学平衡常数(K)、弱酸的电离平衡常数(K a )、难溶物的溶度积常数(K sp )是判断物质性质或变化的重要的平衡常数。下列关于这些常数的说法中,正确的是( )
A.平衡常数的大小与温度、浓度、压强、催化剂等有关 B.当温度升高时,弱酸的电离平衡常数K a 变小 C.K sp (AgCl)>K sp (AgI),由此可以判断AgCl(s)+I - (aq)=AgI(s)+Cl - (aq)能够发生 D.K a (HCN) a (CH 3 COOH),说明物质的量浓度相同时,氢氰酸的酸性比醋酸强  shui_he1年前1
shui_he1年前1 -
 小木船1 共回答了17个问题
小木船1 共回答了17个问题 |采纳率88.2%C
平衡常数的大小只与温度有关,A项错误;弱酸的电离平衡为吸热反应,升高温度,电离平衡常数增大,B项错误;电离平衡常数越大,其电离能力越强,酸性越强,D项错误1年前查看全部
- 已知25℃时有关弱酸的电离平衡常数:
已知25℃时有关弱酸的电离平衡常数:
根据上述电离常数分析,下列表述不正确的是( )弱酸化学式 CH 3 COOH HCN H 2 CO 3 电离平衡常数(25℃) 1.8×l0 -5 4.9×l0 -10 K 1 =4.3×l0 -7
K 2 =5.6×l0 -11A.25℃时,等物质的量浓度的各溶液pH关系为:pH(Na 2 CO 3 )>pH(NaCN)>pH(NaHCO 3 )>pH(CH 3 COONa) B.a mol/L HCN溶液与b mol/L NaOH溶液等体积混合后,所得溶液中c(Na + )=c(CN - ),则a一定大于b C.2 NaCN+H 2 O+CO 2 =2 HCN+Na 2 CO 3 D.2CH 3 COOH+Na 2 CO 3 →2 CH 3 COONa+H 2 O+CO 2 ↑  我垂tt的新郎1年前1
我垂tt的新郎1年前1 -
 woaitanhui365 共回答了20个问题
woaitanhui365 共回答了20个问题 |采纳率95%A、由电离常数Ka的关系可知,1.8×10 -5 >4.3×l0 -7 >.9×10 -10 >5.6×10 -11 ,则酸性CH 3 COOH>H 2 CO 3 >HCN>HCO 3 - ,显然等浓度时Na 2 CO 3 的水解程度最大,其溶液的pH最大,则等物质的量浓度的各溶液pH关系为pH(Na 2 CO 3 )>pH(NaCN)>pH(NaHCO 3 )>pH(CH 3 COONa),故A正确.
B、等体积混合,若a=b恰好完全反应,因CN - 的水解溶液中存在c(Na + )>c(CN - ),a<b时溶液中存在c(Na + )>c(CN - ),a>b时,所得溶液中可以存在,c(Na + )≤c(CN - ),故B正确;
C、碳酸酸性大于HCN,HCN的酸性和碳酸钠反应生成碳酸氢钠;选项中的反应2 NaCN+H 2 O+CO 2 =2HCN+Na 2 CO 3 不符合反应原理,故C错误;
D、醋酸酸性大于碳酸,反应2CH 3 COOH+Na 2 CO 3 →2 CH 3 COONa+H 2 O+CO 2 ↑符合要求,故D正确;
故选C.1年前查看全部
- 下列关于化学平衡常数(K),电离平衡常数(Ka或Kb),水解平衡常数(Kh),沉淀溶解平衡常数(Ksp),水的离子积常数
下列关于化学平衡常数(K),电离平衡常数(Ka或Kb),水解平衡常数(Kh),沉淀溶解平衡常数(Ksp),水的离子积常数(Kw)的叙述中错误的是( )
A.K值越大,正反应进行的程度越大,一般地说,K>105时,该反应进行得就基本完全了
B.比较Ksp与离子积Qc的相对大小,可判断难溶电解质在给定条件下沉淀能否生成或溶解
C.K、Ka或Kb、Kh、Ksp、Kw都与温度有关,温度越高,常数值越大
D.弱酸HA的Ka与NaA的Kh、水的离子积常数Kw三者间的关系可表示为:Kw=Ka•Kh lunest1年前1
lunest1年前1 -
 不服就干 共回答了19个问题
不服就干 共回答了19个问题 |采纳率94.7%解题思路:A.K值越大,反应物的转化率越大、生成物的量越大;
B.根据Ksp与离子积Qc的相对大小确定难溶物是否产生或溶解;
C.平衡常数只有温度有关,与浓度无关;
D.Kw=c(H+).c(OH-)=
.c(H+).c(A−) c(HA)
.c(OH−).c(HA) c(A−) A.K值越大,反应物的转化率越大、生成物的量越大,正反应进行的程度越大,一般地说,K>105时,该反应进行得就基本完全了,故A正确;
B.根据Ksp与离子积Qc的相对大小确定难溶物是否产生或溶解,如果Ksp>Qc,则难溶物没有沉淀生成,如果Ksp=Qc,则溶液恰好饱和,如果Ksp<Qc,则有沉淀生成,故B正确;
C.平衡常数只有温度有关,与浓度无关,如果化学反应正反应是放热反应,升高温度化学平衡常数减小,故C错误;
D.Kw=c(H+).c(OH-)=
c(H+).c(A−)
c(HA).
c(OH−).c(HA)
c(A−)=Ka•Kh,故D正确;
故选C.点评:
本题考点: 化学平衡常数的含义.
考点点评: 本题考查了平衡常数的有关知识,知道平衡常数的含义、表达式,平衡常数只与温度有关,弱电解质的电离平衡常数与溶液酸碱性无关、溶液浓度无关,为易错点.1年前查看全部
- 电离常数中水的浓度问题为什么在化学平衡常数时,说对于固体和纯液体浓度认为是1.水也认为是1电离平衡常数类似于化学平衡常数
电离常数中水的浓度问题
为什么在化学平衡常数时,说对于固体和纯液体浓度认为是1.水也认为是1
电离平衡常数类似于化学平衡常数,而在电离平衡时,则认为水的浓度是55.6mol/L,这是为什么?
我也问过一些人但是他们解释中都有些强加给我的观点,让我无法理解透彻.
化学平衡常数的计算,是生成物与反应物的浓度系数次幂之比,本来就是浓度呀,跟质量分数有什么关系呀?
化学平衡常数计算里,固体和纯液体的浓度是常数,并且都看成是1,这是在资料里说过的,原因不详。电离平衡常数计算里,水这个纯液体就不是1了。纠结! baobao11081年前4
baobao11081年前4 -
 克里桑斯美美菊花 共回答了21个问题
克里桑斯美美菊花 共回答了21个问题 |采纳率71.4%老生常谈的是一种理解方法,就是水作为溶剂时,或者其它的液体作为溶剂时,它们的浓度是不会变化的,是一个常数,所以可以归到K里面,因此在表达式中就不再出现它们的浓度了.
如,CH3COOH + H2O H3O+ + CH3COO-
平衡常数,K=[H3O+][CH3COO-]/[CH3COOH][H2O]
但是,由于平衡研究的都是稀溶液,H2O作为溶剂,相当于1L溶液,就是1L水,就是1000mL,就是1000g,就是55.6mol,即H2O的浓度几乎没有变化,一直是55.6mol/L,所以是一个常数.
所以,K*[H2O]=[H3O+][CH3COO-]/[CH3COOH]=Ka
实际上,对于平衡常数K,应当是另一种理解.
高中的平衡常数,是浓度的系数次幂的乘积,所以,从高中的K的定义可以发现K是有单位的,而且单位会与方程式的前后系数之差有关系,是(mol/L)^n,n是生成物的系数之和减去反应物的系数之和.
但是,若是这样的话,那么K就没有一定的原则了,就没法比较了.
所以,K的实际意义是标准平衡常数,是物质的浓度除以标准浓度c.后的数值,再系数次幂的乘积,从这个角度看,K就都是没有单位的了,或者单位是1.
K=([H3O+]/c.)([CH3COO-]/c.)/([CH3COOH]/c.)
c.=1mol/L
所以,H2O等溶剂也有浓度,但是它们的浓度在反应的前后几乎没有变化,是一个常数,所以被归到了K中.1年前查看全部
- 下列关于化学平衡常数(K),电离平衡常数(K a 或K b ),水解平衡常数(K h ),沉淀溶解平衡常数(K sp )
下列关于化学平衡常数(K),电离平衡常数(K a 或K b ),水解平衡常数(K h ),沉淀溶解平衡常数(K sp ),水的离子积常数(K w )的叙述中错误的是
A.K值越大,正反应进行的程度越大,一般地说,K>10 5 时,该反应进行得就基本完全了 B.比较K sp 与离子积Q c 的相对大小,可判断难溶电解质在给定条件下沉淀能否生成或溶解 C.K、K a 或K b 、K h 、K sp 、K w 都与温度有关,温度越高,常数值越大 D.弱酸HA的K a 与NaA的K h 、水的离子积常数K w 三者间的关系可表示为:K w =K a ·K h  Premo_light1年前1
Premo_light1年前1 -
 mailinda5201314 共回答了20个问题
mailinda5201314 共回答了20个问题 |采纳率100%C
1年前查看全部
- 已知25℃时有关弱酸的电离平衡常数:则下列有关说法正确的是( )
已知25℃时有关弱酸的电离平衡常数:则下列有关说法正确的是( )
弱酸化学式 CH3COOH HCN H2CO3 电离平衡常数(25℃) 1.8×10-5 4.9×l0-10 K1=4.3×10-7K2=5.6×10-11
A. 等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa)
B. a mol•L-1 HCN溶液与b mol•L-1NaOH溶液等体积混合后,溶液中c(Na+)>c(CN-),则a一定小于b
C. 冰醋酸中逐滴加水,则溶液的导电性、n(H+)、pH均先增大后减小
D. NaHCO3和Na2CO3混合溶液中,存在c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) 吉它心弦1年前1
吉它心弦1年前1 -
 lsc随梦飘零 共回答了15个问题
lsc随梦飘零 共回答了15个问题 |采纳率93.3%解题思路:A、利用酸的电离常数比较酸性的强弱,再利用盐中酸根离子对应的酸越弱,其水解程度越大来分析.
B、等体积混合,若a=b恰好完全反应,因CN-的水解溶液中c(Na+)>c(CN-).
C、冰醋酸中逐滴加水电离程度一直在增大,pH也是增大且无限接近中性溶液的pH.
D、利用电荷守恒来分析.A、由电离常数Ka的关系可知,1.8×10-5>4.9×10-10>5.6×10-11,则酸性CH3COOH>HCN>HCO3-,显然等浓度时Na2CO3的水解程度最大,其溶液的pH最大,则等物质的量浓度的各溶液pH关系为pH(Na2CO3)>pH(NaCN)>pH(CH3COONa),故A错误.
B、等体积混合,若a=b恰好完全反应,因CN-的水解溶液中存在c(Na+)>c(CN-),a<b时溶液中存在c(Na+)>c(CN-),即所得溶液中c(Na+)>c(CN-)时a≤b,故B错误;
C、冰醋酸中逐滴加水,电离产生的离子浓度增大,导电性增大,但随水的量增大,浓度变小,导电性减小,而在加水的过程中电离程度、pH一直在增大,故C错误;
D、因溶液不显电性,则所有阳离子带的电荷总数等于阴离子带的负电荷总数,即c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-),故D正确;
故选D.点评:
本题考点: 弱电解质在水溶液中的电离平衡;盐类水解的应用;酸碱混合时的定性判断及有关ph的计算.
考点点评: 本题考查盐类水解、弱电解质的电离及溶液中离子浓度的关系,明确溶液中的溶质及酸性强弱的比较、电荷守恒是解答本题的关键,A是学生解答的易错点.1年前查看全部
- 25度下醋酸的电离平衡常数为1.75*10的-5次幂,若醋酸的平衡浓度为0.01mol/L,平衡时氢离子浓度为?
25度下醋酸的电离平衡常数为1.75*10的-5次幂,若醋酸的平衡浓度为0.01mol/L,平衡时氢离子浓度为?
明天收 winnylfy1年前1
winnylfy1年前1 -
 荒芜的城市 共回答了23个问题
荒芜的城市 共回答了23个问题 |采纳率95.7%4.2*10的-21年前查看全部
- 如图,原来PH都为2 加水稀释相同的倍数,PH变化如图,那么他们两个的电离平衡常数怎么比较
如图,原来PH都为2 加水稀释相同的倍数,PH变化如图,那么他们两个的电离平衡常数怎么比较
如图,原来PH都为2
加水稀释相同的倍数,PH变化如图,那么他们两个的电离平衡常数怎么比较?原理?

 潘多拉的绿番茄1年前1
潘多拉的绿番茄1年前1 -
 DK8999 共回答了18个问题
DK8999 共回答了18个问题 |采纳率94.4%醋酸的小,稀释相同倍数,PH变化快的酸性较强,电离平衡常数就大1年前查看全部
- 电离平衡常数怎么算?
 食指7111年前1
食指7111年前1 -
 luckyjane35 共回答了19个问题
luckyjane35 共回答了19个问题 |采纳率94.7%弱电解质在一定条件下电离达到平衡时,溶液中电离所生成的各种离子浓度以其在化学方程式中的计量为幂的乘积,跟溶液中未电离分子的浓度以其在化学方程式中的计量为幂的乘积的比值,即溶液中的电离出来的各离子浓度乘积(c(A+)*c(B-))与溶液中未电离的电解质分子浓度(c(AB))的比值是一个常数,叫做该弱电解质的电离平衡常数.这个常数叫电离平衡常数,简称电离常数.1年前查看全部
- 电离平衡常数和水解平衡常数的关系
电离平衡常数和水解平衡常数的关系
二者之间有定量的关系么? 个ss3331年前1
个ss3331年前1 -
 秋风过雁 共回答了20个问题
秋风过雁 共回答了20个问题 |采纳率100%(1)HAc H+ + Ac-
Ka==[H+][Ac-]/[HAc]---[HAc]==[H+][Ac-]/Ka
(2)Ac- + H2O HAc + OH-
Kh==[HAc][OH-]/[Ac-]
(3)将[HAc]==[H+][Ac-]/Ka 代入 Kh==[HAc][OH-]/[Ac-]
(4)Kh==[H+][Ac-][OH-]/[Ka][Ac-]
Kh==Kw/Ka1年前查看全部
- 为什么电离平衡常数只与温度有关?比如加水稀释HAc溶液,虽促进了HAc的电离,但是溶液中的各种离子都变稀了,可为什么电离
为什么电离平衡常数只与温度有关?比如加水稀释HAc溶液,虽促进了HAc的电离,但是溶液中的各种离子都变稀了,可为什么电离平衡常数却不变?可以用HAc进行举例.
 小李一寒1年前2
小李一寒1年前2 -
 slang868 共回答了22个问题
slang868 共回答了22个问题 |采纳率90.9%电离平衡常数跟化学平衡常数是一个道理,只跟温度有关.
单从表面上看不出浓度(压强)对平衡常数的影响,要推导平衡常数,需要用到热力学的知识.
你确定要我推一次?1年前查看全部
- 25度,醋酸的电离平衡常数为10负五次方,则PH=3的醋酸溶液的量浓度约为0.1mol/l 为什么是对的
 纪末小丫1年前1
纪末小丫1年前1 -
 baishgtjf 共回答了18个问题
baishgtjf 共回答了18个问题 |采纳率88.9%由平衡:
HAc = H+ + Ac-
C 0 0
C-x ≈C x x
x ^2/C = Ka
10^-3*10^-3 / 10^-5 = C
C = 0.11年前查看全部
- 醋酸的电离平衡常数是多少?18度的时候
 这次拼了1年前1
这次拼了1年前1 -
 mediaec 共回答了14个问题
mediaec 共回答了14个问题 |采纳率100%1.72*1o的-5次方1年前查看全部
- 溶液的酸碱度会影响弱酸的电离平衡常数么
 张扬13141年前1
张扬13141年前1 -
 zwinr128 共回答了22个问题
zwinr128 共回答了22个问题 |采纳率77.3%不会,因为电离平衡常数仅仅是受温度影响,它只跟温度有关.1年前查看全部
- 弱电解质稀释后的电离平衡常数如何变?
 练练不忘1年前2
练练不忘1年前2 -
 l1863 共回答了20个问题
l1863 共回答了20个问题 |采纳率90%所有的平衡常数都只与温度有关,稀释后电离平衡常数不变.由于稀释促进电离,但溶液体积增大,所有各微粒的浓度都要减小,浓度幂之积的比值不变,平衡常数不变.1年前查看全部
- 电离平衡常数为何不可以表示弱电解质的相对强弱
 adnmh1年前3
adnmh1年前3 -
 怀远PP王 共回答了16个问题
怀远PP王 共回答了16个问题 |采纳率100%电离平衡常数可以表示弱电解质的相对强弱的.1年前查看全部
- 醋酸溶液的电离平衡常数是1.6×10^-5则1摩尔每升的醋酸钠溶液中氢氧根离子的浓度是多少
 diance57941年前1
diance57941年前1 -
 你情我不愿 共回答了10个问题
你情我不愿 共回答了10个问题 |采纳率100%1.6×10^-5mol1年前查看全部
- 等体积氨水与盐酸混合,使PH=7,则铵根离子浓度与氯离子浓度谁大,电离平衡常数怎么求?
 zergtzg11年前4
zergtzg11年前4 -
 wildandcrane 共回答了16个问题
wildandcrane 共回答了16个问题 |采纳率93.8%等体积氨水与盐酸混合,使PH=7 ,如果是等浓度的话,PH1年前查看全部
- 电离平衡常数大小与盐对应的ph只有酸对应的电离平很常数如何比较盐的ph
 tititom1年前1
tititom1年前1 -
 emilechang 共回答了15个问题
emilechang 共回答了15个问题 |采纳率93.3%如果是相同浓度的NaA和NaB,若K(HA)>K(HB)那么PH值NaA1年前查看全部
- 关于电离平衡常数和电离度区别!为什么说电离平衡常数不能判断电解质相对强弱而电离度可以,他们不都受温
 aa真髓1年前1
aa真髓1年前1 -
 oneday100 共回答了14个问题
oneday100 共回答了14个问题 |采纳率78.6%电离度和平衡常数都与温度有关,用来判断电解质的相对强弱的本质是看相同浓度时发生电离反应的转化率,即电离度.
1、电离度越大,说明电离得越多,电解质的酸性(或碱性就越强).
2、电离平衡常数
电离平衡常数在物质类型是一样的时候,也可以用来判断电解质的相对强弱,比如:
HAc 与HF比较,电解质类型均为1:1型,反应:
-----------HAc- = H+ + Ac-
初:C 0 0
平衡:C- x x x
x^2 / (C-x) = K(HAc)
电离度 = x / C
HF与上式一样,也可得到:电离度= x / C
x^2 / (C-x) = K(HF)
因为K表现出与电离度的一致性,二者式子相似,K越大,则x越大,电离度就越大,所以可以直接用K来比较电离的程度的强弱.
但是,对于不同类型的电解质,比如HF 与H2S比较,前者为1:1型,后者为2:1型,当写出平衡反应时,电离出求x的公式不一样,即H2S要考虑二步电离的H+,而HF只需要考虑一步,所以二者的电离度所求公式是不同的.
3、结论
相同浓度下,用电离度可以直接判断电解质的相对强弱,用平衡常数只有在电解质类型相同时可以直接判断;对于电解质类型不同的二种物质,只有利用K值计算得到了电离度以后,再根据电离度的数据进行判断.1年前查看全部
- 如果一个溶液中有一种二元酸电离,第一步是完全电离,第二步是部分,已知部分电离平衡常数,那么我在求解这道题时我想列出电离平
如果一个溶液中有一种二元酸电离,第一步是完全电离,第二步是部分,已知部分电离平衡常数,那么我在求解这道题时我想列出电离平衡常数表达式,这时我应该用溶液中的氢离子溶度还是部分电离出的氢离子溶度?
 musicmysoul1年前1
musicmysoul1年前1 -
 心随凝动 共回答了12个问题
心随凝动 共回答了12个问题 |采纳率91.7%当然是溶液中总得电离氢离子浓度1年前查看全部
- 醋酸电离平衡常数问题向醋酸溶液中加盐酸,求此时醋酸电离平衡常数时用到的氢离子浓度要算此时溶液的氢离子浓度还是单单醋酸电离
醋酸电离平衡常数问题
向醋酸溶液中加盐酸,求此时醋酸电离平衡常数时用到的氢离子浓度要算此时溶液的氢离子浓度还是单单醋酸电离的氢的浓度 7mild1年前1
7mild1年前1 -
 zwb443 共回答了15个问题
zwb443 共回答了15个问题 |采纳率86.7%要用此时溶液的氢离子浓度 因为加盐酸抑制了醋酸的电离1年前查看全部
- 温度越高为什么醋酸的电离平衡常数越小?
 烧包先生1年前2
烧包先生1年前2 -
 梦的精灵 共回答了12个问题
梦的精灵 共回答了12个问题 |采纳率100%电离平衡常数与温度的关系主要取决于电离过程是放热还是吸热过程.如是放热,则温度越高,电离平衡常数越小;如是吸热,则相反.酸碱的电离过程是放热,故温度越高电离平衡常数就越小.
其实电离过程中是放热还是吸热,主要看能量变化,电解质中断键从稳定到不稳定,能量由小变大,是吸热过程,而以形成水合离子成键则是由不稳定到稳定,能量由大变小,则是放热过程.1年前查看全部
- 化学平衡常数,电离平衡常数,溶度积都只与温度有关吗?
 球神不败佛1年前3
球神不败佛1年前3 -
 mwd223 共回答了17个问题
mwd223 共回答了17个问题 |采纳率100%对1年前查看全部
- 弱电解质的电离平衡常数的定义:在一定条件下电离达到平衡时,溶液中电离所生成的各种离子浓度以其在化学方程式中的计量为幂的乘
弱电解质的电离平衡常数的定义:在一定条件下电离达到平衡时,溶液中电离所生成的各种离子浓度以其在化学方程式中的计量为幂的乘积,跟溶液中未电离分子的浓度以其在化学方程式中的计量为幂的乘积的比值.但我们常见的没有幂次方,请举出用浓度的幂指数次方表示的弱电解质的电离平衡常数表达式.
 guol11201年前3
guol11201年前3 -
 身后风尘 共回答了21个问题
身后风尘 共回答了21个问题 |采纳率90.5%Fe(OH)3≒(可逆符号)Fe3+ +3OH-
其中OH浓度要加3方
一般 多元碱的电离有浓度的幂指数次方1年前查看全部
- 电离平衡常数、酸度系数和电负性有没有联系?
电离平衡常数、酸度系数和电负性有没有联系?
我知道酸度系数Pka=-lgKa.(不确定有没写错)
例如Cl的电负性大,I的小,那么HCl的酸度系数就比HI大.想知道这两个物理量有没有公式来联系? 君如过眼烟云1年前1
君如过眼烟云1年前1 -
 nihaohuaiy 共回答了11个问题
nihaohuaiy 共回答了11个问题 |采纳率100%氢化物的酸性没有关系,最高价含氧酸就有关系.除F,O以外电负性越大pKa越小,即酸性越强.1年前查看全部
- 硫氰化铁的电离平衡常数
 liangjl1年前1
liangjl1年前1 -
 ruichunmei3 共回答了14个问题
ruichunmei3 共回答了14个问题 |采纳率92.9%[Fe(SCN)2]+的稳定常数Kf=2.29E3,比较大,1/Kf也就是平衡常数,等于4.37E-4
一般情况认为是完全反应的.1年前查看全部
- 不同温度下碳酸的解离常数我是想求不同温度压力下饱和二氧化碳水溶液的pH值,所以,想要知道不同温度下碳酸的电离平衡常数,有
不同温度下碳酸的解离常数
我是想求不同温度压力下饱和二氧化碳水溶液的pH值,所以,想要知道不同温度下碳酸的电离平衡常数,有没有相关数据啊? yifeill1年前2
yifeill1年前2 -
 hopewell111 共回答了18个问题
hopewell111 共回答了18个问题 |采纳率88.9%碳酸电离平衡常数,物理化学书上有一部分.另外一部分查一下《化工工艺设计手册》.计算方法在物理化学书上有介绍.1年前查看全部
- 12.已知下面三个数据:①7.2×10-4、②2.6×10-4、③4.9×10-10分别是三种酸的电离平衡常数,若已知这
12.已知下面三个数据:①7.2×10-4、②2.6×10-4、③4.9×10-10分别是三种酸的电离平衡常数,若已知这三种酸可发生如下反应:NaCN+HNO2==HCN+NaNO2
NaNO2+HF==HCN+NaF NaNO2+HF==HNO2+NaF
由此可判断下列叙述中正确的是( )
A.HF的电离常数是① B.HNO2的电离常数是①
C.HCN的电离常数是② D.HNO2的电离常数是③ 梅森_那是北呀1年前1
梅森_那是北呀1年前1 -
 sjmed 共回答了21个问题
sjmed 共回答了21个问题 |采纳率81%电离常数越大,酸性越强.故②>①>③,又根据化学式NaCN+HNO2==HCN+NaNO2,知道HNO2酸性强于HCN,NaNO2+HF==HNO2+NaF 知道HF强于HNO2.即HF>HNO2>HCN.根据对应关系知正确答案是B,HNO2的电离常数是①.1年前查看全部
- 将0.1mol/L 的HAc和等浓度的HCN等体积混合,试求该混合溶液的AC-浓度和CN-浓度.两溶质的电离平衡常数已知
将0.1mol/L 的HAc和等浓度的HCN等体积混合,试求该混合溶液的AC-浓度和CN-浓度.两溶质的电离平衡常数已知
H浓度怎么算啊? maruko08111年前2
maruko08111年前2 -
 雷老 共回答了19个问题
雷老 共回答了19个问题 |采纳率89.5%假设1升+1升:
一、假设电离相互不干扰时的
列电离方程式: HAc==H++Ac- HCN==H++CN-
平衡时( mol) 0. 1-a a a 0. 1-b b b
根据Ka值可求得a和b的值.
二、列出受抑制时的电离的计算式
列电离方程式: HAc == H+ + Ac- HCN == H+ + CN-
平衡时( mol) 0. 1-a+x a-x a-x 0. 1-b+y b-y b-y
再次利用Ka(HAc)和Ka(HCN)求出x和y即可.
(注:要是已知c(H+)则本题就相当简单了.)1年前查看全部
- 电离平衡常数和酸性强弱的关系
 520silence1年前2
520silence1年前2 -
 清风幽茶 共回答了14个问题
清风幽茶 共回答了14个问题 |采纳率57.1%在高中化学的范畴里,只有弱酸,酸式盐及其相应的离子(还有NH4+)的电离平衡常数会对其酸性强弱有影响.
如醋酸的电离平衡:HAc==H+ + Ac-
其电离平衡常数K=c(H+)*c(Ac-)/c(HAc) K越大,说明化学平衡越往右移动,说明溶液更酸.而只有温度影响到K.如温度上升HAc的电离会更充分,K会更大(实质是这个电离反应是个吸热反应)
但对于酸式盐则不同.
NaHSO4==Na+ + H+ + SO4(2-) 虽是酸式盐,但 HSO4- 会完全电离成 H+ 和SO4(2-) 其酸性与K完全无关(H2SO4是强电解质).
但 NaHCO3 中 HCO3-既可电离,也可水解(H2CO3是弱电解质)
电离:HCO3- == H+ + CO3(2-) HCO3- + H2O== H2CO3 + OH-
对此你不知道这一对竞争的反应那个占优势,但若测pH你会发现NaHCO3显酸性,说明水解更强.若你查H2CO3电离,与HCO3-的K,你会发现水解更强.
又如H3PO4是弱电解质:Na3PO4当然是碱性,Na2HPO4你大概也能猜出来水解大于电离是碱性(的确是的),但NaH2PO4则为酸性(电离就强于水解)
所以要具体问题具体分析.你自己看着办吧1年前查看全部
- (1)25℃时,部分弱酸的电离平衡常数如下表:
 (1)25℃时,部分弱酸的电离平衡常数如下表:
(1)25℃时,部分弱酸的电离平衡常数如下表:
①HCOONa溶液呈______性(填“酸”、“碱”或“中”),其原因是______弱酸 HCOOH HCN H2CO3 电离平衡常数 Ki=1.7×10-4 Ki=4.9×10-10 Ki1=4.3×10-7
Ki2=5.6×10-11
(用离子方程式表示).
②在测定c(H+)相等的盐酸和HCOOH溶液的pH时,某同学先用蒸馏水润湿pH试纸,然后用洁净干燥的玻璃棒蘸取试样进行检测,用此法误差较大的是______(填“盐酸”或“HCOOH”),原因是______.
③将少量CO2通入NaCN溶液中,它们是否能反应(若能,写出反应的离子方程式;若不能,直接填“否”)______.
(2)某温度下的溶液中,c(H+)=10x mol/L,c(OH-)=10y mol/L.x与y的关系如图所示:
①M、N点对应的温度分别是T1、T2,则T1______T2(填“>”、“=”或“<”).
②T2时,水的离子积常数Kw=______,pH=9的NaOH溶液中,由水电离产生的c(H+)=______mol/L. dfw9981年前1
dfw9981年前1 -
 只看不评 共回答了23个问题
只看不评 共回答了23个问题 |采纳率95.7%解题思路:(1)①HCOOH为弱酸,则HCOONa溶液水解呈碱性;
②弱酸稀释时促进电离,用湿润的pH试纸测量时误差较小;
③根据酸性的强弱判断;
(2)①根据水的电离为吸热过程,升高温度促进电离,离子积常数增大判断;
②T2时,水的离子积常数Kw=10-12,结合Kw=c(H+)×c(H+)计算.(1)①HCOOH为弱酸,则HCOONa溶液水解呈碱性,水解的离子方程式为HCOO-+H2O⇌HCOOH+OH-,故答案为:碱;HCOO-+H2O⇌HCOOH+OH-;
②醋酸是弱电解质,氯化氢是强电解质,因为醋酸中存在电离平衡,盐酸中不存在电离平衡,加水稀释促进醋酸电离,所以加等体积的水稀释等pH的醋酸和盐酸,稀释后的醋酸溶液中C(H+)大于盐酸溶液中C(H+),pH值变化小;
故答案为:盐酸;盐酸是强酸酸稀释时pH值变化大,醋酸是弱酸稀释时电离平衡正向移动,pH值变化小;
③因酸性H2CO3>HCN>HCO3-,则将少量CO2通入NaCN溶液中,发生:CO2+H2O+CN-=HCO3-+HCN,故答案为:CO2+H2O+CN-=HCO3-+HCN;
(2)①M点时,Kw=10-16,N点水的离子积常数Kw=10-12,水的电离为吸热过程,升高温度促进电离,离子积常数增大,故答案为:<;
②由图象可知,T2时,水的离子积常数Kw=10-12,pH=9的NaOH溶液中,c(H+)=10-9mol/L,则由水电离产生的c(H+)=10-9mol/L.
故答案为:10-12;10-9.点评:
本题考点: 酸碱混合时的定性判断及有关ph的计算;弱电解质在水溶液中的电离平衡.
考点点评: 本题考查弱电解质的强弱与水解的关系,并利用电离与水解来分析溶液中的离子的浓度的关系,学生应明确电离平衡常数的应用来解答.1年前查看全部
- 电离平衡常数是衡量弱电解质电离程度强弱的物理量.已知:
电离平衡常数是衡量弱电解质电离程度强弱的物理量.已知:
在25℃条件下,下列有关说法正确的是( )化学式 电离常数(25℃) C6H5OH K=1.1×10-10 CH3COOH K=1.74×10-5 H2CO3 K1=4.2×10-7;K2=5.6×10-11
A.0.1mol/L的各溶液的pH关系为:pH(C6H5OH)>pH(Na2CO3)>pH(CH3COONa)
B.NaHCO3溶液中,c(OH-)=2c(H2CO3)+c(H+)+c(CO32-)
C.amol/L醋酸溶液与bmol/LNaOH溶液等体积混合,所得溶液中c(Na+)>c(CH3COO-),则a一定小于或等于b
D.向苯酚钠溶液中通入少量CO2后的溶液:c(C6H5O-)+c(C6H5OH)=c(Na+) 3063345481年前1
3063345481年前1 -
 xiaojiabizi 共回答了17个问题
xiaojiabizi 共回答了17个问题 |采纳率76.5%解题思路:A、根据盐的水解规律:越弱越水解来回答;
B、根据溶液中的质子守恒知识来回答判断;
C、醋酸和氢氧化钠溶液之间反应生成醋酸钠和水,如果是c(Na+)>c(CH3COO-),则溶液显示碱性;
D、根据溶液的物料守恒来回答.A、根据表中数据知道各个酸酸性强弱顺序是:醋酸>苯酚>碳酸氢根,所以水解程度:CH3COO-<C6H5O-<CO32-,碱性顺序是:CH3COONa<C6H5OH<Na2CO3,故A错误;
B、NaHCO3溶液中存在质子守恒:c(OH-)=2c(H2CO3)+c(H+)+c(HCO32-),故B错误;
C、amol/L醋酸溶液与bmol/LNaOH溶液等体积混合,所得溶液中c(Na+)>c(CH3COO-),则溶液显示碱性,则a可能小于或等于或大于b,故C错误;
D、向苯酚钠溶液中通入少量CO2后的溶液,由苯酚酸根离子与钠离子的关系可知,存在关系:c(C6H5O-)+c(C6H5OH)=c(Na+),故D正确.
故选D.点评:
本题考点: 弱电解质在水溶液中的电离平衡.
考点点评: 本题考查学生溶液中的离子浓度之间的关系以及守恒思想等方面的知识,综合性强,难度不大.1年前查看全部
- (16分)I、(1)三种弱酸HA、H 2 B、HC,电离平衡常数的数值为1.8×10 -5 、5.6×10 -11 、4
(16分)I、(1)三种弱酸HA、H 2 B、HC,电离平衡常数的数值为1.8×10 -5 、5.6×10 -11 、4.9×10 -10 、4.3×10 -7 (数据顺序已打乱),已知三种酸和它们的盐之间能发生以下反应:①HA + HB - (少量)=A _ + H 2 B ,②H 2 B(少量) + C - = HB _ + HC ,③HA(少量) + C - =A _ + HC 。则三种酸对应的电离平衡常数分别为(请填空)
(2)常温下0.1mol/LCH 3 COOH溶液加水稀释过程,下列表达式数据一定变小是:_______HA H 2 B HC Ka Ka1 Ka2 Ka3 Ka4 数值
A c(H + ) B c(H + )/c(CH 3 COOH) C c(H + )·c(OH - )
Dc(OH - )/(H + )体积为10mLpH=2醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化如图:则HX电离平衡常数_____(填大于、等于或小于)醋酸平衡常数;理由是___________________________
II、工业废水中常含有一定量的Cr 2 O 7 2- 和CrO 4 2- ,它们会对人体及生态系统产生很大的伤害,必须进行处理。还原沉淀法是常用的一种方法。
(1)转化过程中存在平衡2CrO 4 2- + 2H + Cr 2 O 7 2- + H 2 O能说明反应到达平衡状态的是
Cr 2 O 7 2- + H 2 O能说明反应到达平衡状态的是
A.CrO 4 2- 和Cr 2 O 7 2- 的浓度相同 B.2ν(Cr 2 O 7 2- )=ν(CrO 4 2- )
C.溶液的pH值保持不变 D.溶液颜色保持不变
(2)若1L转化后所得溶液中含铬元素质量为28.6g,CrO 4 2- 有10/11转化为Cr 2 O 7 2- (已知铬元素相对原子质量为52)。①转化后所得溶液中c(Cr 2 O 7 2- )=
②已知:常温下该反应的平衡常数K=10 14 ,上述转化后所得溶液的pH为
(3)还原过程中的离子反应方程式
(4)若常温下Ksp(Cr(OH) 3 )=10 -32 ,要使c(Cr 3+ )降至10 -5 mol/L,溶液的pH应调至 tclheyujun1年前1
tclheyujun1年前1 -
 快乐017 共回答了25个问题
快乐017 共回答了25个问题 |采纳率92%27.(16分)I、(1)(2分,错一个扣1分,扣完为止)
HA
H 2 B
HC
Ka
Ka1
Ka2
Ka3
Ka4
数值1年前查看全部
- 下表是几种弱电解质的电离平衡常数、难溶电解质的溶度积Ksp(25℃).
下表是几种弱电解质的电离平衡常数、难溶电解质的溶度积Ksp(25℃).
回答下列问题:电解质 平衡方程式 平衡常数K Ksp CH3COOH CH3COOH⇌CH3COO-+H+ 1.76×10-5 H2CO3 H2CO3⇌H++HCO3-
HCO3-⇌H++CO32-K1=4.31×10-7
K2=5.61×10-11C6H5OH C6H5OH⇌C6H5O-+H+ 1.1×10-10 H3PO4 H3PO4⇌H++H2PO4-
H2PO4-⇌H++HPO42-
HPO42-⇌H++PO43-K1=7.52×10-3
K2=6.23×10-8
K3=2.20×10-13NH3•H2O NH3•H2O⇌NH4++OH- 1.76×10-5 BaSO4 BaSO4⇌Ba2++SO42- 1.07×10-10 BaCO3 BaCO3⇌Ba2++CO32- 2.58×10-9
(1)由上表分析,若①CH3COOH ②HCO3-③C6H5OH ④H2PO4-均可看作酸,则它们酸性由强到弱的顺序为______(须填编号);
(2)写出C6H5OH与Na3PO4反应的离子方程式:______;
(3)25℃时,将等体积等浓度的醋酸和氨水混合,混合液中:c(CH3COO-)______c(NH4+);(填“>”、“=”或“<”)
(4)25℃时,向10ml 0.01mol/L苯酚溶液中滴加Vml 0.01mol/L氨水,混合溶液中粒子浓度关系正确的是______;
A.若混合液pH>7,则V≥10
B.若混合液pH<7,则c(NH4+)>c(C6H5O-)>c(H+)>c(OH-)
C.V=10时,混合液中水的电离程度小于10ml 0.01mol/L苯酚溶液中水的电离程度
D.V=5时,2c(NH3•H2O)+2c(NH4+)=c(C6H5O-)+c(C6H5OH)
(5)水解反应是典型的可逆反应.水解反应的化学平衡常数称为水解常数(用Kh表示),类比化学平衡常数的定义,请写出Na2CO3第一步水解反应的水解常数的表达式Kh=c(HCO3−).c(OH−) c(CO32−) Kh=.c(HCO3−).c(OH−) c(CO32−) 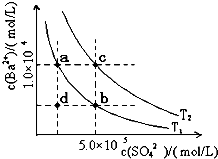
(6)Ⅰ.如图所示,有T1、T2两种温度下两条BaSO4在水中的沉淀溶解平衡曲线,回答下列问题:
①T1______T2(填>、=、<),T2温度时Ksp(BaSO4)=______;
②讨论T1温度时BaSO4的沉淀溶解平衡曲线,下列说法正确的是______
A.加入Na2SO4可使溶液由a点变为b点
B.在T1曲线上方区域(不含曲线)任意一点时,均有BaSO4沉淀生成
C.蒸发溶剂可能使溶液由d点变为曲线上a、b之间的某一点(不含a、b)
D.升温可使溶液由b点变为d点
Ⅱ.现有0.2mol的BaSO4沉淀,每次用1L饱和Na2CO3溶液(浓度为1.7mol/L)处理.若使BaSO4中的SO42-全部转化到溶液中,需要反复处理______次.[提示:BaSO4(s)+CO32-(aq)⇌BaCO3(s)+SO42- (aq)]. 11_241年前1
11_241年前1 -
 red_apple3 共回答了12个问题
red_apple3 共回答了12个问题 |采纳率100%解题思路:(1)同一温度下,酸的电离常数越大其酸性越强,根据酸的电离常数确定酸性强弱;
(2)苯酚的电离平衡常数大于磷酸的第三步电离平衡常数,而小于第二步电离平衡常数,则苯酚和磷酸钠反应生成苯酚钠和磷酸一氢钠;
(3)25℃时,醋酸和一水合氨的电离平衡常数相等,则等浓度等体积的醋酸和一水合氨混合,溶液呈中性;
(4)相同温度下,一水合氨的电离程度大于苯酚,则苯酚铵溶液呈碱性,
A.如果溶液呈碱性,溶液中的溶质为苯酚铵或苯酚铵和一水合氨或苯酚铵和苯酚;
B.如果溶液呈酸性,溶液中的溶质为苯酚和苯酚铵混;
C.含有弱根离子的盐促进水电离;
D.任何电解质溶液中都遵循物料守恒;
(5)Kh=
;c(HCO3−).c(OH−) c(CO32−)
(6)I.①升高温度促进难溶物溶解;Ksp(BaSO4)=c(Ba2+).c(SO42-);
②A.硫酸钠抑制硫酸钡电离;
B.在T1曲线上方区域(不含曲线)为过饱和溶液;
C.蒸发溶剂,增大溶液中溶质的浓度,温度不变,溶度积常数不变;
D.升温增大溶质的溶解,溶液中钡离子、硫酸根离子浓度都增大;
II.根据化学方程式和化学平衡常数进行计算.(1)同一温度下,酸的电离常数越大其酸性越强,根据这几种酸的电离平衡常数知,它们的酸性强弱顺序是:①④③②,故答案为:①④③②;
(2)苯酚的电离平衡常数大于磷酸的第三步电离平衡常数,而小于第二步电离平衡常数,则苯酚和磷酸钠反应生成苯酚钠和磷酸一氢钠,离子方程式为:C6H5OH+PO43-=C6H5O-+HPO42-,故答案为:C6H5OH+PO43-=C6H5O-+HPO42-;
(3)25℃时,醋酸和一水合氨的电离平衡常数相等,则等浓度等体积的醋酸和一水合氨混合,溶液呈中性,则c(H+)=c(OH-),溶液中存在电荷守恒,根据电荷守恒得(H+)+(NH4+)=c(OH-)+c(CH3COO-),所以得(NH4+)=c(CH3COO-),故答案为:=;
(4)相同温度下,一水合氨的电离程度大于苯酚,则苯酚铵溶液呈碱性,
A.如果溶液呈碱性,溶液中的溶质为苯酚铵或苯酚铵和一水合氨,苯酚和氨水的浓度相等,要使溶液呈碱性,苯酚的体积小于或等于或大于氨水体积都可能使混合溶液呈碱性,故A错误;
B.若混合液pH<7,溶液中的溶质为苯酚和苯酚铵,pH<7,则c(H+)>c(OH-),溶液中电荷守恒,根据电荷守恒得c(H+)+c(NH4+)=c(C6H5O-)+c(OH-),所以c(C6H5O-)>c(NH4+),故B错误;
C.含有弱根离子的盐促进水电离,酸抑制水电离,所以苯酚铵促进水电离,苯酚抑制水电离,故C错误;
D.任何电解质溶液中都遵循物料守恒,根据物料守恒得V=5时,2c(NH3•H2O)+2c(NH4+)=c(C6H5O-)+c(C6H5OH),故D正确;
故选D;
(5)Kh=
c(HCO3−).c(OH−)
c(CO32−),故答案为:Kh=
c(HCO3−).c(OH−)
c(CO32−);
(6)Ⅰ.①升高温度促进难溶物溶解,根据图象知T2的溶度积常数大于T1,所以T1<T2;Ksp(BaSO4)=c(Ba2+).c(SO42-)=1.0×10-4×5.0×10-5=5×10-9,;
故答案为:T1<T2;5.0×10-9;
②A.硫酸钠抑制硫酸钡电离,硫酸根离子浓度增大,导致溶液中钡离子浓度减小,所以可以使溶液由a点变为b点,故A正确;
B.在T1曲线上方区域(不含曲线)为过饱和溶液,所以有晶体析出,故B正确;
C.蒸发溶剂,增大溶液中溶质的浓度,温度不变,溶度积常数不变,所以蒸发溶剂可能使溶液由d点变为曲线上a、b之间的某一点(不含a、b),故C正确;
D.升温增大溶质的溶解,溶液中钡离子、硫酸根离子浓度都增大,故D错误;
故选ABC;
Ⅱ.设每次用1.00L 2.0 mol•L-1饱和Na2CO3溶液能处理xmol BaSO4,
BaSO4 +CO32-=BaCO3 +SO42
(2.0-x)mol•L-1 x mol•L-1
根据K=
c(SO42−)
c(CO32−)=[x/2.0−x]=0.042
解得:x=0.081,处理次数=[0.2mol/0.081mol]=2.5,所以至少处理3次;
故答案为:3次.点评:
本题考点: 难溶电解质的溶解平衡及沉淀转化的本质;弱电解质在水溶液中的电离平衡.
考点点评: 本题考查了难溶电解质的溶解平衡及弱电解质的电离,正确理解溶度积曲线是解本题关键,结合溶度积常数来分析解答,难度中等.1年前查看全部
- 根据电离平衡常数判断离子方程式的正误
根据电离平衡常数判断离子方程式的正误
已知碳酸、亚硫酸、次氯酸的平衡常数如下:
下列方程式正确的是:
A NaClO溶液中通入少量CO2:2ClO-+CO2+H2O=2HClO+CO3 2-
B Na2CO3溶液中通入少量SO2:2CO3 2- +SO2+H2O=2HCO3- +SO3 2-
C NaHCO3溶液中通入少量SO2:2HCO3- +SO2 = CO2 +SO3 2- +H2O
D NaClO溶液中通入少量SO2:2ClO- +SO2 +H2O =2HClO +SO3 2-
我主要不清楚的是,如何根据电离平衡常数判断生成物?
A 中的CO3 2- 应该为 HCO3-
C中的SO3 2- 应该为 HSO3 -
这个是怎么凭借K值看出来的?拿HSO3-和HCO3-的K值和谁比较出来的?

 绿荳蔸1年前1
绿荳蔸1年前1 -
 saradeng 共回答了16个问题
saradeng 共回答了16个问题 |采纳率100%根据K值我们可以直接对比酸性:由强到弱
H2SO3 ,H2CO3 ,HSO3—,HClO,HCO3—,根据由强酸制弱酸,确定产物.关键是理解K1、K2的含义,当H2CO3 = HCO3- + H+ ,该电离常数为K1;
HCO3- = CO32- + H+ 该电离常数为K2.
反之,由酸电离得到的另一个酸根离子即为碱.碱性的强弱顺序,根据一强对应一弱:
CO32- ,ClO-,SO32-,HCO3-,HSO3 -,根据由强酸制弱酸,确定产物.1年前查看全部
- 已知室温时,0.1mol/L某一元酸HA的电离平衡常数约为1×10^-7,下列叙述错误的是
已知室温时,0.1mol/L某一元酸HA的电离平衡常数约为1×10^-7,下列叙述错误的是
A.该溶液的pH=4
B、此溶液中,HA约有0.1%发生电离
C、加水稀释,HA的电离平衡向右移动,HA的电力平衡常数增大
D.该溶液中,由HA电离出的c(H+)约为水电离出的c(H+)的106倍 好过份呀1年前1
好过份呀1年前1 -
 fancy97 共回答了16个问题
fancy97 共回答了16个问题 |采纳率87.5%电离常数很小…………[H+]是氢离子物质的量浓度的意思
K=([H+]x[A-])/[HA]
由于电离部分很少,所以[HA]几乎不变,还是0.1mol/L
但是电离强度比水大多了,水的Kw=1x10^-14,很小
所以忽略水的电离,[H+]和[A-]近似相等,所以算出pH=4,A正确
具体大学算法(一元弱酸pH):(c为弱酸初始浓度) cKa>20Kw且c/Ka>500时,忽略水的电离造成的氢离子浓度变化,忽略弱酸电离造成HA浓度变化,[H+]=根号(cKa)
若100%电离,pH=1,氢离子浓度差1000倍,所以HA只有0.1%电离,B正确
C错误,平衡常数只和温度有关,加水平衡移动是改变了个物质浓度,平衡常数不变的
D正确,HA电离出的H+约为10^-4mol/L,抑制水的电离,水电离的氢氧跟只有10^-10mol/L
水电离的氢离子和氢氧跟离子一样多,所以确实差了10^6倍1年前查看全部
- 关于电离平衡常数常温下,氨水和盐酸等体积混合,氨水为amol/l,盐酸为0.01mol/l, 最后c=c(cl-),也就
关于电离平衡常数
常温下,氨水和盐酸等体积混合,氨水为amol/l,盐酸为0.01mol/l, 最后c=c(cl-),也就是说溶液处于中性,怎么用a表示氨水的电离平衡常数,答案是(10的-9次方)除以(a-0.01),怎么算? 乖乖兔88551年前1
乖乖兔88551年前1 -
 你们都是我的女人 共回答了19个问题
你们都是我的女人 共回答了19个问题 |采纳率94.7%平衡时c(NH4+)=c(Cl-)可知反应以后的溶液是中性的.
铵根离子浓度等于氯离子的0.01mol/L.
氢氧根离子浓度是10^-7mol/L.
[NH3.H2O](反应后)=[NH3.H2O](开始)-[NH4+]=(a-0.01)mol/L.
所以,Kb=10^-9/(a-0.01).1年前查看全部
- 电离平衡常数大的酸溶液中[H+]一定比电力平衡常数小的酸中大,
 ysdboco1年前1
ysdboco1年前1 -
 gzeysmk 共回答了16个问题
gzeysmk 共回答了16个问题 |采纳率87.5%不对,还要看酸的物质的量.假如强酸的物质的量很少,可能电离出的H+反而比弱酸少1年前查看全部
- 已知电离平衡常数:H2Co3>HClO>HCO3-,氧化性:HClO>Cl2>BR2>Fe3+>I2.
已知电离平衡常数:H2Co3>HClO>HCO3-,氧化性:HClO>Cl2>BR2>Fe3+>I2.
向NaclO溶液中通入少量的CO2的离子方程式:2ClO-+CO2+H2o=2HClO+CO32-
能使pH试纸显深红色的溶液中,Fe3+ Cl- Ba2+ Br-能大量共存
怎么用已知条件去解这两个问题 西郊1年前1
西郊1年前1 -
 66gxylcs 共回答了15个问题
66gxylcs 共回答了15个问题 |采纳率93.3%1.电离平衡常数:H2Co3>HClO>HCO3- HClO酸性不如H2Co3,强酸置弱酸.
2.氧化性:HClO>Cl2>BR2>Fe3+>I2.能使pH试纸显深红色说明溶液是强酸性,Fe3+ Cl- Ba2+ Br不会产生沉淀,可以共存.1年前查看全部
- 25℃时,弱酸的电离平衡常数如右表,下列说法正确的是( ) 弱酸 CH3COOH HCN H2CO3 K 1.8×10-
25℃时,弱酸的电离平衡常数如右表,下列说法正确的是( ) 弱酸 CH3COOH HCN H2CO3 K 1.8×10-5 4.9×
25℃时,弱酸的电离平衡常数如右表,下列说法正确的是( )
弱酸
CH3COOH
HCN
H2CO3
K
1.8×10-5
4.9×10-10
K1=4.3×10-7 K2=5.6×10-11
A.等物质的量浓度溶液pH关系:pH(NaCN)> pH(Na2CO3)> pH(CH3COONa)
B.amol/L HCN与bmol/L NaOH溶液等体积混合后所得溶液中c(Na+)>c(CN-),则a一定小于b
C.往冰醋酸中逐滴加水,溶液导电能力先增大,后减小
D.NaHCO3和Na2CO3的混合液中:c(Na+)+c(H+)=c(OH-)+c(HCO-3)+c(CO32-)
25℃时,弱酸的电离平衡常数如右表,下列说法正确的是( )
A.等物质的量浓度溶液pH关系: pH(NaCN)> pH(Na2CO3)> pH(CH3COONa)
B.amol/L HCN与bmol/L NaOH溶液等体积混合后所得溶液中c(Na+)>c(CN-),则a一定小于b
C.往冰醋酸中逐滴加水,溶液导电能力先增大,后减小
D.NaHCO3和Na2CO3的混合液中:c(Na+)+c(H+)=c(OH-)+c(HCO-3)+c(CO32-)
 铁君1年前3
铁君1年前3 -
 我爱米汤 共回答了25个问题
我爱米汤 共回答了25个问题 |采纳率100%A.H2CO3二级电离比HCN弱,所以Na2CO3水解更强,应该是PH(Na2CO3)>PH(NaCN)>PH(CH3COONa)
B.溶液中有[Na+]+[H+]=[CN-]+[OH-].[Na+]>[CN-]只能说明溶液是碱性的,当a=b时HCN与NaOH完全反应成NaCN,溶液也呈碱性.
C.正确,加水后冰醋酸先逐渐电离,到达顶点后逐渐稀释.
D.CO32-带两负电荷,所以应为c(Na+)+c(H+)=c(OH-)+c(HCO-3)+2c(CO32-)1年前查看全部
- 已知两种弱酸HA、HB的电离平衡常数K a (HA)>K a (HB)。下列有关说法正确的是
已知两种弱酸HA、HB的电离平衡常数K a (HA)>K a (HB)。下列有关说法正确的是
A.等温浓度均为0.1 mol·L -1 的HA、HB溶液中,其溶液的pH大小为:pH(HA)>pH(HB)
B.在0.1mol·L -1 的NaA溶液中各离子浓度关系为:c(Na + )>c(A - )>c(OH - )>c(H + )
C.等体积pH相同的HA、HB溶液,分别加入等浓度的NaOH溶液,恰好完全反应消耗的NaOH溶液体积HA比HB多
D.等温浓度均为0.1 mol·L -1 的NaA、NaB溶液中,其溶液的pH大小为:pH(NaA)>pH(NaB) shasha0851年前1
shasha0851年前1 -
 yiyi10524 共回答了22个问题
yiyi10524 共回答了22个问题 |采纳率100%B
电离平衡常数越大,酸越强,相应的钠盐水解程度就小,所以AD不正确,B正确.pH相同时,HB的浓度大,则消耗的氢氧化钠多,C不正确。答案选B。1年前查看全部
- 怎么样通过电离平衡常数判断生成物,进而写出方程式?比如第三问
 小陪1年前1
小陪1年前1 -
 清水馨 共回答了15个问题
清水馨 共回答了15个问题 |采纳率73.3%根据电离平衡常数判断电离难易 强电解质制取若电解质 强酸制取弱酸1年前查看全部
- 关于化学反应原理的一些总结1、关于化学方程式什么情况下要标物质的状态,要全,就高中2、关于电离平衡常数,水解平衡常数,化
关于化学反应原理的一些总结
1、关于化学方程式什么情况下要标物质的状态,要全,就高中2、关于电离平衡常数,水解平衡常数,化学平衡常数,溶解平衡常数等的公式,只要高中要用的平衡常数公式3、关于电离度,水解度,溶解度等是不是只和温度有关4、这些公式不是是都要背的?
化学平衡是指什么?我怎么只记得只要热化学方程式和溶解平衡第3回答有问题,电离平衡常数公式和水解都不同 yanbei3121年前4
yanbei3121年前4 -
 9909077 共回答了17个问题
9909077 共回答了17个问题 |采纳率100%1、首先化学公式可以用背的,但是最好是在理解基础上,比如可以从它的表示意义理解,或者从单位的推导来得到.2、需要注明物质状态的一般是在热化学方程式,化学平衡、速率计算时候3、平衡常数的公式斗一样的道理:生成物...1年前查看全部
- 弱酸的二级电离为什么比一级电离平衡常数小
弱酸的二级电离为什么比一级电离平衡常数小
RT,平衡常数不是只与温度有关么,很多人说一级电离电离出的H+会抑制二级电离,但是电离出的H+为什么会影响平衡常数?H+多了只能表明另一个电离出的产物会减少丫.
另附一个问题,原电池是不是只要金属性有差异就行了.也就是说锌和铁放在氯化钠溶液里面也是可以形成原电池的吗?因为习题没有这种原电池,故问问.
PS:答得好可以加分,反正我的分多的用不完. 让我坚强991年前2
让我坚强991年前2 -
 lovecoco1982 共回答了15个问题
lovecoco1982 共回答了15个问题 |采纳率93.3%以H2S为例:
一级电离 H2S == H+ + HS-
二级电离 HS- == H+ + S2-
可以看出一级电离需克服H+和HS-之间的引力,二级电离需要克服H+和S2-之间的引力.很显然,H+和S2-之间引力更大,因为S2-带两个单位负电荷,所以二级电离更困难,平衡常数更小.
只要构成原电池的两种金属活动性不同,电极电势就不同,可构成原电池.锌和铁插入NaCl溶液连上导线可以形成原电池.1年前查看全部
- 部分弱酸的电离平衡常数如下表: 弱酸 HCOOH HCN H2CO3 电离平衡常数(25℃) Ki=1.77×10-4
部分弱酸的电离平衡常数如下表:
下列选项错误的是( )弱酸 HCOOH HCN H2CO3 电离平衡常数
(25℃)Ki=1.77×10-4 Ki=4.9×10-10 Ki1=4.3×10-7
Ki2=5.6×10-11
A.2CN-+H2O+CO2→2HCN+CO32-
B.2HCOOH+CO32-→2HCOO-+H2O+CO2↑
C.中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者
D.等体积、等浓度的HCOONa和NaCN溶液中所含离子总数前者大于后者 maxing901511年前1
maxing901511年前1 -
 zz客甲 共回答了23个问题
zz客甲 共回答了23个问题 |采纳率82.6%解题思路:弱酸的电离平衡常数越大,其酸性越强,等pH的弱酸溶液,酸性越强的酸其物质的量浓度越小,弱酸根离子水解程度越小,结合强酸能和弱酸盐反应制取弱酸分析解答.酸的电离平衡常数HCOOH>H2CO3>HCN>HCO3-,则酸根离子水解程度CO32->CN->HCO3->HCOO-,
A.酸的电离平衡常数越大,酸的酸性越强,强酸能够制取弱酸,所以二者反应生成HCN和HCO3-,离子方程式为CN-+H2O+CO2═HCN+HCO3-,故A错误;
B.酸性强弱顺序是HCOOH>H2CO3>HCN>HCO3-,强酸能和弱酸盐反应生成弱酸,所以反应方程式为2HCOOH+CO32-=2HCOO-+H2O+CO2↑,故B正确;
C.等pH、等体积的HCOOH和HCN,n(HCN)>n(HCOOH),中和酸需要碱的物质的量与酸的物质的量、酸的元数成正比,所以中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者,故C正确;
D.根据电荷守恒,c(HCOO-)+c(OH-)=c(Na+)+c(H+),c(CN-)+c(OH-)=c(Na+)+c(H+),即离子总数是n(Na+ )+n(H+)的2倍,而NaCN的水解程度大,即NaCN溶液中的c(OH-)大,c(H+)小,c(Na+)相同,所以甲酸钠中离子浓度大,故D正确.
故选A.点评:
本题考点: 弱电解质在水溶液中的电离平衡.
考点点评: 本题考查了弱电解质的电离,明确弱电解质电离平衡常数与酸性强弱、酸根离子的水解程度的关系是解本题关系,再结合强酸制取弱酸、酸碱中和反应来分析解答,易错选项是D,注意从电荷守恒的角度解答该题.1年前查看全部
- 2010浙江理综化学26题 第(2)问计算HF的电离平衡常数应怎样选点来进行计算? 答案是3.5*10(-4) 26.
2010浙江理综化学26题 第(2)问计算HF的电离平衡常数应怎样选点来进行计算? 答案是3.5*10(-4) 26. (15分)已知:
①25℃时弱电解质电离平衡常数:Ka(CH3COOH)= ,Ka(HSCN)=0.13;难溶电解质的溶度积学数:Kap(CaF2)=
②25℃时, mol•L-1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如下图所示:
请根据以下信息回答下旬问题:
(1)25℃时,将20mL 0.10 mol•L-1 CH3COOH溶液和20mL 0.10 mol•L-1HSCN溶液分别与20mL 0.10 mol•L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)变化的示意图为:
反映初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是 ,反应结束后所得两溶液中,c(CH3COO-) c(SCN-)(填“>”、“<”或“=”)
(2)25℃时,H+、HF电离平衡常数的数值Ka ,列式并说明得出该常数的理由 .
(3) mol•L-1HF溶液与 mol•L-1 CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),通过列式计算说明是否有沉淀产生.
我没有多少财富值,给不了积分,但希望大家帮帮忙啊!谢谢
 白色钢琴1年前1
白色钢琴1年前1 -
 ruth_violet 共回答了19个问题
ruth_violet 共回答了19个问题 |采纳率100%选择[F-]=[HF]计算1年前查看全部
- 1.25摄氏度时,醋酸的起始浓度是0.010mol/L,则平衡时的溶液的ph是多少?(电离平衡常数1.76乘以10的负五
1.25摄氏度时,醋酸的起始浓度是0.010mol/L,则平衡时的溶液的ph是多少?(电离平衡常数1.76乘以10的负五次方).
2.浓度都是0.1mol/L的溶液①氨水②盐酸③氯化铵溶液,为什么铵根离子的浓度是③>①?答案说氨水是弱电解质,氯化铵是强电解质,但是氯化铵不是会水解么?我怎么知道哪个浓度高啊?还有,①③的混合溶液为什么是碱性的啊
3.25摄氏度时,在氢氧化镁悬浊液中加入氟化钠溶液,氢氧化镁不可能转化成氟化镁,已知氢氧化镁溶度积常数是5.61乘以10的负12次方,氟化镁的溶度积常数是7.42乘以10的负11次方.为什么这句话是错的 clearfeng1年前1
clearfeng1年前1 -
 不乖girl 共回答了11个问题
不乖girl 共回答了11个问题 |采纳率90.9%(1)pH=3.38 公式 C(H+)=(CHAc*KHAc)1/2
(2)氯化铵数强电解质,在水溶液中会把铵根离子全部解离出来,而电离和水解的程度都是很小的,所以氯化铵大于氨水,混合后会显碱性.
(3)当氟化钠的浓度大到一定程度时,氢氧化镁会转化为氟化镁.(工业上就是用碳酸钠的饱和溶液开溶解硫酸钡的).1年前查看全部
大家在问
- 1已知 根号a+b-1 与(a-2b+3)²互为相反数,求a²+b²+8/9的平方根
- 2老师的话语像春雨一样滋润我的心田,使我不由得想起了杜甫的两句诗
- 3若a小于b,b小于0 0小于c.则|a+c|+|b+c|-|b-a|等于多少?化简
- 4用于竖直方向成a=30度 斜向右上汗 大小为F的推力把一个重量为G的木块压在粗糙竖直墙上保持静止 求墙对木块
- 5请写出以下反应的离子方程式:1.盐酸和氢氧化钠 2.硝酸和氢氧化钾 3.硫酸和氢氧化钠 4.硫化亚铁和盐酸 5.硫酸铜和
- 6写数要分级吗?
- 7如图,把方格纸中的△ABC平移,使点D平移到点D′的位置
- 8花房里有三种花,月季花的盆数占总数的百分之12.5,茉莉花比月季花多36盆,其余12盆是兰花.花房里共有多
- 9负a3次方成a平方是多少
- 10(2005•丰宁县模拟)已知:如图,在梯形ABCD中,AD∥BC,AB=DC,AD<BC,且P在AD上满足∠BPC=∠A
- 11管理舌前2/3味觉的神经
- 12用98%的硫酸配制10%的硫酸150ml,计算需加水多少毫升?
- 13相得益彩的意思 急
- 14我爱看书 作文
- 15用四舍五入法把数—0.02009(精确到万分位)用科学计数法表示为?
