必修二英语 learning tip 翻译啊
 3931749832022-10-04 11:39:541条回答
3931749832022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 ajmjy 共回答了11个问题
ajmjy 共回答了11个问题 |采纳率81.8%- go to a museum and look at some real cultural relics .read the information that is provided forthe visitors .learn as much as you can about the history of your hometown or city.then if you have time you can work as a guide for visitors to the museum. you can also help foreign visitors by explaining things in english. to do this well ,you need to learn more english .it will not only give you a chance of practising your english but also of developing an insterest in history at thesame time
- 1年前
相关推荐
- 高二语文必修五归去来兮辞下一篇是什么
 喜欢红色的人1年前2
喜欢红色的人1年前2 -
 窗前亦有千竿竹 共回答了18个问题
窗前亦有千竿竹 共回答了18个问题 |采纳率88.9%藤王阁序--王勃,然后是逍遥游、陈情表.
刚翻的书,望采纳.1年前查看全部
- 语文必修五鸿门宴课后练习答案,
 畅想郑和1年前1
畅想郑和1年前1 -
 恐龙公主 共回答了20个问题
恐龙公主 共回答了20个问题 |采纳率95%不如因善遇之 因:趁机 项王即日因留沛公与饮 因:于是 因击沛公于坐 因:趁机
如不能举如恐不胜 如:好像 沛公起如厕 如:往,到
举所佩玉珏 举:举起 如不能举:尽
五.1.驻扎 名词活用作动词 2.称王 名词活用作动词 3.友善,交好 形容词活用作动词
4.连夜 名词作状语 5.使……活下来 使动用法 6.像对待兄长一样 名词作状语
7.登记 名词活用作动词 8.带着,使……从 名词使动用法
9.像鸟张开翅膀一样 名词作状语 10.通“纳“,接纳 11.对人用刑,泛指处罚 名词活用作动词
12.取道 名词活用作动词1年前查看全部
- 人教A版高一数学必修二132页练习题1题、习题4.2 A组第2题怎么做、
人教A版高一数学必修二132页练习题1题、习题4.2 A组第2题怎么做、
(,.,. Oo淡然oO1年前1
Oo淡然oO1年前1 -
 ycm4725 共回答了22个问题
ycm4725 共回答了22个问题 |采纳率77.3%圆心为(0,0)用点到距离公式得到圆心到真线的距离为10所以直线与圆相切(也是相交)然后用圆的方程和直线的方程就可以解出交点 交点没有算自己算吧1年前查看全部
- 人教B版高中数学必修三关于总体密度曲线这样解释:设想样本容量不断增大,分组的组距不断缩小,则频率分布直方图实际上越来越接
人教B版高中数学必修三关于总体密度曲线这样解释:设想样本容量不断增大,分组的组距不断缩小,则频率分布直方图实际上越来越接近于总体的分布,它可以用一条光滑曲线y=f(x)来描绘,这条光滑的曲线叫做总体密度曲线.但问题是随着组距越来越小,假设一组组距小到0.0000001,落在这一小组内的数据如果为0怎么办?那这样的线就不是光滑的曲线了
 冰婕婕1年前2
冰婕婕1年前2 -
 123886 共回答了20个问题
123886 共回答了20个问题 |采纳率90%组距越小的前提是样本容量不断增大.我的理解是这段话主要是为说明对密度曲线得来的一种理解方式以及密度曲线的意义(如正态分布的密度曲线).而如此解释是因为高中段定积分知识的极限基础没有.毕竟密度曲线跟分布函数是导数与积分的关系.1年前查看全部
- 高中化学必修一二有什么实验
 zhangjieya1年前1
zhangjieya1年前1 -
 战神巴蒂_hh 共回答了14个问题
战神巴蒂_hh 共回答了14个问题 |采纳率85.7%1粗盐的提纯 2蒸馏 3萃取分液 4一定物质的量浓度的溶液的配制 5制Fe(OH)3胶体 6焰色反应 7Fe2+,Fe3+的检验 8制氯水和漂白粉 9Cl-的检验 10SO2性质的实验 11喷泉实验 12硫酸的性质的实验 13Ba(OH)2*8H2O+NH4Cl的实验(必修二P34)14甲烷的性质实验 15制乙烯 16乙烯的性质实验 17苯的取代 18乙酸乙酯的制备 19铝热反应 20...1年前查看全部
- 青海西宁市金版新学案高一的各科必修在哪里买啊?(团结出版社的)急急急
青海西宁市金版新学案高一的各科必修在哪里买啊?(团结出版社的)急急急
语文、英语必修1、2;数学必修1、4;物理必修1;历史、***、生物、地理、化学必修一;
 卑贱的vv1年前2
卑贱的vv1年前2 -
 溪桥流水 共回答了26个问题
溪桥流水 共回答了26个问题 |采纳率100%我也用的那个,
水世界,就体育馆的那个书店有卖的。
新华书点应该也有的.1年前查看全部
- (高中英语必修二)问题求讲解 题如下:
(高中英语必修二)问题求讲解 题如下:
( B )1.-We just saw John at the bookstore.
-That' s strange;I didn't think he ___back until tomorrow.
A.will come B.was to come C.is coming D.is to come
( D)2.Oil ,____there are several types ,is used for many purpose by countries all over the world.
A.which B.in which C.by which D.of which
( A )3.I like the telecision programme____educate and entertain.
A.designed to B.designed for C.is designed to D.is designed for
( B )4.The employee you have been thinking highly ____dishonest.
A.of proving B.of proves C.of to prove D.of being proved lf_wcl1年前1
lf_wcl1年前1 -
 BOBOサクラ 共回答了19个问题
BOBOサクラ 共回答了19个问题 |采纳率89.5%1.主句时态是过去时,所以从句的时态也应该是过去时,选B
2.中间是个which引导的定语从句,注意短语的搭配,types of 所以选D
3.句子后部分是修饰telecision programme的定语.这里是过去分词作定语.排除CD
另外根据句子的意思应该选A(还是基于对to和for这两个介词的基本理解,to更表示往,给,对...;而for更侧重于为,替.请理解.)
4.you have been thinking highly of是个定语从句,修饰主语The employee ,句子还缺少谓语,应该选个谓语动词,故选B
希望我的回答有所帮助1年前查看全部
- 高中必修1语文劝学原文、2009至2010年的哦
 潮流情1年前1
潮流情1年前1 -
 gracybb 共回答了18个问题
gracybb 共回答了18个问题 |采纳率94.4%【原文】
君子曰:学不可以已.
青,取之于蓝而青于蓝;冰,水为之而寒于水.木直中绳,輮以为轮,其曲中规;虽有槁暴,不复挺者,輮使之然也.故木受绳则直,金就砺则利,君子博学而日参省乎己,则知明而行无过矣.
吾尝终日而思矣,不如须臾之所学也;吾尝跂而望矣,不如登高之博见也.登高而招,臂非加长也,而见者远;顺风而呼,声非加疾也,而闻者彰.假舆马者,非利足也,而致千里;假舟楫者,非能水也,而绝江河.君子生非异也,善假于物也.
积土成山,风雨兴焉;积水成渊,蛟龙生焉;积善成德,而神明自得,圣心备焉.故不积跬步,无以至千里;不积小流,无以成江海.骐骥一跃,不能十步;驽马十驾,功在不舍.锲而舍之,朽木不折;锲而不舍,金石可镂.蚓无爪牙之利,筋骨之强,上食埃土,下饮黄泉,用心一也.蟹六跪而二螯,非蛇鳝之穴无可寄托者,用心躁也.1年前查看全部
- 2014步步高必修一第三章 章末检测相互作用答案
 steven1975_qd1年前1
steven1975_qd1年前1 -
 82650zqxas 共回答了18个问题
82650zqxas 共回答了18个问题 |采纳率94.4%直接去书店.答案拿手机拍下来就行1年前查看全部
- 有没有高中地理必修1知识点
 音绝空尘1年前1
音绝空尘1年前1 -
 洪兴 共回答了16个问题
洪兴 共回答了16个问题 |采纳率87.5%【第一章 宇宙中的地球】
1、天体系统的级别:总星系——银河系(河外星系)——太阳系——地月系
2、地球上生命存在的条件:①稳定的太阳光照条件②比较安全的宇宙环境③因为日地距离适中,地表温度适宜(平均气温为15度)④因为地球的质量和体积适中,地球能吸引大气形成大气层(氮、氧为主)⑤形成并存在液态水
3、太阳活动对地球的影响:
(1)太阳活动的标志:黑子、耀斑
(2)影响:影响电离层,干扰无线电短波通讯;产生“磁暴”现象和“极光”现象;影响地球气候.
4、地球自转的地理意义:
①昼夜交替:昼半球和夜半球的分界线——晨昏线(圈)——与赤道的交点的时间分别是6时和18时——太阳高度是0度——晨昏圈所在的平面与太阳光线垂直;
②地方时差:东早西晚,经度每隔15度相差1小时.
③沿地表水平运动物体的偏移:赤道上不偏,北半球右偏、南半球左偏.偏向力随纬度的增大而增大.
5、地球公转的地理意义:
(1)昼夜长短的变化:
①北半球夏半年,太阳直射北半球,北半球各纬度昼长夜短,纬度越高,昼越长夜越短.夏至日——北半球各纬度的昼长达到一年中的最大值,北极圈及其以北的地区,出现极昼现象.②北半球冬半年,太阳直射南半球,北半球各纬度夜长昼短,纬度越高,夜越长昼越短.冬至日——北半球各纬度的昼长达到一年中的最小值,北极圈及其以北的地区,出现极夜现象.③春分日和秋分日,太阳直射赤道,全球各地昼夜等长,各为12小时.
④赤道全年昼夜平分.南半球的情况与北半球的相反.
(2)正午太阳高度的变化:
同一时刻,正午太阳高度由太阳直射点向南北两侧递减,夏至日,太阳直射北回归线,正午太阳高度由北回归线向南北两侧递减,此时北回归线及其以北各纬度达到一年中的最大值,南半球各纬度达最小值.冬至日,太阳直射南回归线,正午太阳高度由南回归线向南北两侧递减,此时南回归线及其以南各纬度达到一年中的最大值,北半球各纬度达最小值.春分日和秋分日,太阳直射赤道,正午太阳高度自赤道向两极递减.
(3)四季的变化(昼夜长短和正午太阳高度随着季节而变化,使太阳辐射具有季节变化的规律,形成了四季)北半球季节的划分:3、4、5月为春季,6、7、8为夏季,9、10、11为秋季,12、1、2为冬季.
6、地球的圈层结构以地表为界分为内部圈层和外部圈层.
(1)地球内部的圈层根据地震波(纵波、横波)的特点划分为地壳、地幔、地核三个圈层.地壳物质主要由岩石(岩浆岩、沉积岩、变质岩)组成,上地幔的软流层是岩浆的源地,地核主要由铁镍物质组成.
(2)外部圈层:大气圈、水圈和生物圈.
【第二章 自然地理环境中的物质运动和能量交换】
1、岩石分三大类:①岩浆岩(岩浆上升冷却凝固而成)②沉积岩(岩石在外力的风化、侵蚀、搬运、堆积、固结成岩作用下形成)③变质岩(变质作用).从岩浆到形成各种岩石,三大类岩石可以相互转化,又到新岩浆的产生,这一运动变化过程,构成了地壳物质循环.
2、地表形态变化的内外力因素(地质作用):
(1)内力作用——能量来自地球本身,主要是地球内部热能,它表现为地壳运动、岩浆活动、变质作用.造成地表高低不平.地质构造的类型有褶皱(背斜和向斜)和断层(地垒和地堑).
(2)外力作用——能量来自地球外部,主要是太阳能和重力.使高低不平的地表趋向平坦.表现为风化、侵蚀、搬运、堆积、固结成岩作用.流水侵蚀地貌(V型谷)、堆积地貌(冲积扇、冲积平原和三角洲);风蚀地貌(风蚀洼地、蘑菇)、风积地貌(沙丘).
3、六大板块名称:亚欧板块、非洲板块、印度洋板块、太平洋板块、美洲板块、南极洲板块.一般说来,板块内部,地壳比较稳定,两个板块之间的交界处,是地壳比较活动的地带,火山、地震也多集中分布在板块的交界处.生长边界——板块张裂处,常形成裂谷、海洋.消亡边界——板块碰撞处,常形成山脉、海沟.
4、大气受热过程:太阳辐射(短波)、大气削弱、地面增温、地面辐射(长波)、大气增温、大气辐射(长波)、大气逆辐射(保温作用)
(1)大气对太阳辐射的削弱作用:①吸收作用:具有选择性,臭氧吸收紫外线,水汽和二氧化碳吸收红外线.对可见光吸收的很少.②反射作用:云层和颗粒较大的尘埃.云层的反射作用最显著.③散射作用:空气分子或微小尘埃,使一部分太阳辐射不能到达地面.
(2)大气对地面的保温作用:大气吸收地面辐射并产生大气逆辐射(射向地面的大气辐射),把部分热量归还给地面,云层越厚大气逆辐射越强.
5、全球近地面有7 个气压带(高低压相间分布),6 个风带.
(1)低纬度环流:
①赤道低压带:因为热力作用形成,气流辐合上升,易成云致雨,形成多雨带.常年受其控制形成热带雨林气候(亚马孙平原、刚果盆地、东南亚的马来群岛)
②副热带高压带:因为动力作用而形成,气流在30度纬度上空聚积而下沉,形成少雨带(东亚季风区除外),常年受其控制的地区形成热带沙漠气候(北非的撒哈拉水沙漠、西亚的沙漠、北美美国西部的沙漠、南美智利、秘鲁西部的沙漠、澳大利亚大沙漠)
③信风带:由副高吹向赤道低压的气流,在北半球右偏成东北信风,在南半球左偏成东南信风.
(2)中纬度环流:
④副极地低压带:由来自低纬的暖气流与来自高纬的冷气流相遇运动上升而形成.形成温带多雨带.
⑤中纬西风带:由副高吹向副极地低压带的气流,在北半球右偏成西南风,在南半球左偏成西北风,习惯上叫西风,受其常年控制的地区,在大陆西岸形成温带海洋性气候.(欧洲西部、北美西部如加拿大的温哥华附近、南美南端的安第斯山西侧、澳大利亚南端及塔斯马尼亚岛、新西兰等)
(3)高纬环流:
⑥极地高压带:因为热力作用而形成,冷空气下沉,形成少雨带.不过极地因为气温低,蒸发更少,所以极地属于降水量大于蒸发量的地区,为湿润地区.
⑦极地东风带:由极地高压带吹向副极地低压带的气流,在地转偏向力作用下,北半球右偏成东北风,南半球左偏成东南风.
(4)气压带和风带的移动:△移动的原因:随太阳直射点的移动而动.△移动方向:就北半球而言,大致是夏季北移,冬季南移.
(5)单一气压带或风带作用形成的气候类型:热带雨林气候(赤道低气压带)、热带沙漠气候(副热带高气压带)、温带海洋性气候(中纬西风带).
(6)气压带、风带移动形成的气候类型:热带草原气候(夏季受赤道低气压带控制,冬季受低纬信风带控制)、地中海气候(夏季受副热带高气压带控制,冬季受中纬西风带控制).
6、常见的天气系统:锋面系统(冷锋、暖锋、准静止锋)、气旋(低压)和反气旋(高压)、锋面气旋.气旋是低压,低压系统在实际大气中常会出现沿中心向一定方向延伸出的低压槽,在低压槽上形成了锋面系统.锋面与气旋是一个整体(高压系统是没有的).
7、水循环
(1)类型:海陆间大循环(大循环)、陆地循环(水量很少)、海洋循环(水量最大)
(2)各环节的名称:蒸发、降水、水汽输送、地表径流、地下径流、下渗、植物蒸腾
(3)意义:它使陆地水不断得到补充、更新,使水资源得以再生;塑造地表形态;联系四大圈层.
8、洋流:
(1)类型:按成因分风海流、密度流、补偿流;按性质分暖流和寒流.
(2)分布:△中低纬度——以副热带为中心的大洋环流,北半球顺时针流动(与半球反气旋方向一致),南半球逆时针方向流动(与南半球反气旋方向一致).△中高纬度(主要指北半球)——以副极地为中心的大洋环流.△南半球西风漂流,世界最强大的寒流.△北印度洋的季风洋流——夏季由西向东流,冬季由东向西流(夏顺冬逆).
(3)影响:①对气候的影响:暖流起到增温、增湿作用(西欧海洋性气候的形成,得益于北大西洋暖流);寒流起到降温、减湿作用(澳大利亚西海岸的维多利亚沙漠、秘鲁太平洋沿岸的阿塔卡马沙漠的形成都与沿岸的西澳大利亚寒流和秘鲁寒流有关)
②对海洋生物的影响——渔场的分布:寒暖流交汇处,给鱼类带来了丰富多样的饵料.
△北海道渔场——日本暖流与千岛寒流的交汇处.△纽芬兰渔场——拉布拉多寒流与墨西哥湾暖流的交汇处.△北海渔场——北大西洋暖流与高纬南下的冷海水交汇形成.△秘鲁渔场——上升补偿流使深层海水上泛,带来深海的硅酸盐类,使浮游生物大量繁殖,浮游生物又是鱼类的饵料.
③对海洋污染的影响:有利于污染物的扩散,加快净化速度;但也使污染物的范围扩大.
④对海洋运输事业的影响:顺流——航行速度快;逆流——航行速度慢.
【第三章 地理环境的整体性和区域差异】
1、地理环境包括自然地理环境和人文地理环境.自然地理要素包括气候、水文、地貌、生物、土壤等要素.
(1)气候的变化使地球上的水圈、岩石圈、生物圈等圈层得以不断改造,生物对地理环境的作用,归根结底是由于绿色植物能够进行光合作用.
(2)生物在地理环境形成中的作用:联系有机界与无机界,促使化学元素迁移;改造大气圈,使原始大气逐渐演化为现在大气;改造水圈,影响水体成分;改造岩石圈,促进岩石的风化和土壤的形成,使地理环境发生了深刻的变化.
环境创造了生物,生物又创造了现在的环境.所以生物是地理环境的生物,同时又是地理环境的塑造者
(3)地理环境各要素相互联系、相互制约和相互渗透,构成了地理环境的整体性.举例:我国西北内陆——由于距海远,海洋潮湿气流难以到达,形成干旱的大陆性气候——河流不发育,多为内流河——气候干燥,流水作用微弱,物理风化和风力作用显著,形成大片戈壁和沙漠,植被稀少,土壤发育差,有机质含量少.
2、地理环境的地域分异规律:
(1)从赤道到两极的地域分异(纬度地带性):受太阳辐射从赤道向两极递减的影响——自然带沿着纬度变化(南北)的方向作有规律的更替,这种分异是以热量为基础的.例如:赤道附近是热带雨林带,其两侧随纬度升高,是热带草原带、热带荒漠带.
(2)从沿海向内陆的地域分异(经度地带性):受海陆分布的影响,自然景观和自然带从沿海向大陆内部产生的有规律的地域分异,这种分异是以水分为基础的.例如:中纬度地区(特别是北半球中纬度地区)从沿海到内陆出现:森林带—草原带—荒漠带
(3)山地的垂直地域分异:在高山地区,随着海拔高度的变化,从山麓到山顶的水热状况差异很大,从而形成了垂直自然带.举例:赤道附近的高山,从山麓到山顶看到的自然带类似于从赤道到两极的水平自然带.
【第四章 自然环境对人类活动的影响】
1、聚落的形成与地理环境的关系,可从形态上反映出来:平原地区,地形比较完整、开阔、平坦,聚落呈圆形或不规则的多边形,规模较大;山区聚落沿河谷或在比较开阔的低地分布.例如:我国的汾河、渭河谷地城市的分布.世界上的大城市多数位于平原上.平原地区的区位优势:地势平坦,土壤肥沃,便于农耕,且有利于交通联系和节省建筑投资.也有的平原不适宜城市的发展.例如:热带地区,低地闷热,城市多分布在高原上,最著名的是巴西,其城市不是分布在亚马孙平原,而是巴西高原.
2、地形对交通线路分布的影响:公路选线避开不利地形,地形平坦地区的交通线网密度较大(造价低、工程量小),山地、丘陵地区的密度较小(造价高、工程量大).
3、全球气候变暖对农业生产有利方面:高纬度地区升温幅度最大,作物生长期延长,产量增加;对农业生产不有利方面:中纬度半湿润半干旱区,若降水量不变,增温将加速陆地蒸发,使土壤中水分减少,导致作物产量下降.对工业生产也有一定的影响,温度升高将减少高纬度地区供暖的能源消耗,明显增加低纬度地区制冷的能源消耗.
4、自然资源的定义:人类直接从自然界获得,并用于生产和生活的物质和能量.它包括气候资源、土地资源、水资源、生物资源、矿产资源.自然资源是人类文明和社会进步的物质基础.举例:能源利用对生产力的发展有巨大推动作用.△柴草为主要能源——社会生产力水平很低,△18世纪,煤炭为主要能源——社会生产力大幅提高,△20世纪50年代以后,石油为主要能源——极大地促进了生产的发展.
5、常见的自然灾害有水灾、旱灾、台风、暴雨、寒潮、沙尘暴、暴风雪、地震、火山、滑坡和泥石流.了解它们发生的主要原因及危害.1年前查看全部
- 高中生物必修一第一章第一节知识重点
 鬼龙的rr1年前2
鬼龙的rr1年前2 -
 jingde 共回答了18个问题
jingde 共回答了18个问题 |采纳率88.9%第一章 走进细胞
第一节 从生物圈到细胞
1.细胞是生物体结构的基本单位[病毒〈非细胞生物,由蛋白质和核酸组成〉-不具有细胞结构,必须寄生在细胞内才能生活和繁殖].
2.生命系统的结构层次:
细胞〈最基本的生态系统〉:神经细胞、心肌细胞、上皮细胞
组织:神经组织、肌肉组织、上皮组织
器官:脑、脊髓、心脏、小肠、皮肤
系统(植物无系统):神经系统、循环系统、消化系统
个体(单细胞生物无组织、器官、系统)
种群〈某区域同种生物所有个体〉
群落〈某区域所有生物〉
生态系统〈生物群落+环境〉
生物圈(地球只有一个生物圈)
第二节 细胞的多样性和统一性
1.真核细胞[植物、动物、真菌(酵母菌、霉菌、食用菌)]和原核细胞[异养生物-细菌、自养生物-蓝藻(颤藻、蓝球藻、念珠藻、发菜)]:
相同点:都有细胞膜、细胞质、核物质(DNA)
不同点:真核细胞-有典型的细胞核;原核细胞-细胞核未成形,只有拟核
{如何判断细菌:凡是“菌”字前面有“杆”“球”“螺旋”“弧”字都是细菌}
2.细胞学说的建立:
〈英〉虎克:发现、命名细胞
〈荷兰〉列文虎克:观察细菌、红细胞、精子
〈德〉施莱登、施旺:细胞是构成动植物的基本单位
〈德〉魏尔肖:细胞通过分裂产生新细胞
3.显微镜的使用.1年前查看全部
- 高一必修课本上关于求直线方程的问题.
高一必修课本上关于求直线方程的问题.
已知△ABC的顶点A(5,1),AB边上的中线CM所在直线方程为2x-y-5=0,AC边上的高BH所在直线方程为X-2Y-5=0.
(1)求点C的坐标
(2)求直线BC的方程
嗯,第一问我做出来了是C(4,3)
but,我不会第二问, 芭乐困困1年前2
芭乐困困1年前2 -
 qihang123 共回答了19个问题
qihang123 共回答了19个问题 |采纳率100%根据直线BH解析式,设B(a,a/2-5/2)
由坐标中点公式求得M(a/2+5/2,a/4-3/4)
将M点坐标代入直线CM解析式中
解得a=-1
则B(-1,-3)
求得直线BC的方程为6x-5y-9=01年前查看全部
- 必修文言文重点语句
 佛哭了1年前1
佛哭了1年前1 -
 新兔八哥 共回答了19个问题
新兔八哥 共回答了19个问题 |采纳率89.5%讳疾忌医《扁鹊见蔡桓公》
君臣固守以窥周室《过秦论》
文王拘而演周易,孔子厄而作春秋
孔子曰“苛政猛于虎也”1年前查看全部
- 高一化学必修1自学摩尔的一些疑惑点(求这一章学得好的朋友帮忙解决下)
高一化学必修1自学摩尔的一些疑惑点(求这一章学得好的朋友帮忙解决下)
明天上化学课就开始学摩尔了,今天晚上预习了一下,有以下几个疑惑点:
物质的量只是单纯的指一定数目粒子的集合体吗?我就是有点疑惑,物质的量如果是指一定数目粒子的集合体,那么就不包括这些集合体的质量、体积、形状之类的了?是不是单纯就指一个整体?
2. 如果物质的量只是单纯的只一定数目粒子的集合体,那么摩尔作为物质的量的单位又表示什么呢?举个例子,操场上有一群人,单纯的指这些人,那么用一个单位来作为这群人的单位,表示的是什么意义,这里也有点不懂.
3.阿伏伽德罗常数中,1mol粒子集体所含的粒子数与0.012kg12c中所含的碳原子数相同,这里的1mol粒子集合体是指所有的粒子集合体吗?比如我说1mol氧分子 和1mol水分子和1mol氧原子 三者的粒子集合体数目相同吗?
4.结合以上问题,课本上说物质的量(n)和微观粒子数(n)通过桥梁——阿伏伽德罗常数(n a)联系着.它们之间存在的关系:n=n/n a,这个疑惑必须得解决以上3个问题我才会懂, n如果单纯的只表示粒子集合体的话,用微观粒子数除以阿伏伽德罗常数得出来的n有什么意义?就好比操场上100个人除以常数(这里常数任意定,比如200,表示一群人中所含的人数与某群人中所含的人数相同,设为200),这样除出来得到的是这一群人,我不明白这样算有什么意义?得到的物质的量(n) 用摩尔表示***什么含义呢?
 随随便便_的qq1年前1
随随便便_的qq1年前1 -
 依燕娇兰 共回答了27个问题
依燕娇兰 共回答了27个问题 |采纳率92.6%1、物质的量就是指数量,相当于“个”这个单位的上一级,就像克与千克
2、摩尔就相当于“队”或者连、排什么的(随你啦)
3、一样的哦,都是NA个
4、mol的存在意义只是为了化学计算的方便,相当于“份”的一个存在,比如说一份氢氧化钠和一份盐酸,就可以用1molNaOH+1molHCl方便的表示,如果用质量的话你在计算的时候必须要除来乘去的
NaOH+HCl=NaCl+H2O
23 36.5 40 18
23g 36.5g X Y
如果要求氯化钠的质量,你必须这么来
23g/23*40
我们把23g/23这个过程用物质的量来表示了,物质的量表示这个式子的商
就变成了1*40=40g
(例子举得不是很好,弄点复杂的计算就可以看出优越性了)1年前查看全部
- 物理必修一二重点知识
 galaxyok1年前1
galaxyok1年前1 -
 le9901 共回答了20个问题
le9901 共回答了20个问题 |采纳率90%你直接在百度里面搜索相关章节的学案,学案就是对应章节的辅导,一般的学案都推荐《高中物理基础知识手册》(一册在手 知识全有)高中物理全辅导梳理.1年前查看全部
- 求化学必修2复习知识点
 elijah3141年前1
elijah3141年前1 -
 A20012940 共回答了17个问题
A20012940 共回答了17个问题 |采纳率100%第一章 物质结构 元素周期律
1.原子结构:如:的质子数与质量数,中子数,电子数之间的关系
2.元素周期表和周期律
(1)元素周期表的结构
A.周期序数=电子层数
B.原子序数=质子数
C.主族序数=最外层电子数=元素的最高正价数
D.主族非金属元素的负化合价数=8-主族序数
E.周期表结构
(2)元素周期律(重点)
A.元素的金属性和非金属性强弱的比较(难点)
a.单质与水或酸反应置换氢的难易或与氢化合的难易及气态氢化物的稳定性
b.最高价氧化物的水化物的碱性或酸性强弱
c.单质的还原性或氧化性的强弱
(注意:单质与相应离子的性质的变化规律相反)
B.元素性质随周期和族的变化规律
a.同一周期,从左到右,元素的金属性逐渐变弱
b.同一周期,从左到右,元素的非金属性逐渐增强
c.同一主族,从上到下,元素的金属性逐渐增强
d.同一主族,从上到下,元素的非金属性逐渐减弱
C.第三周期元素的变化规律和碱金属族和卤族元素的变化规律(包括物理、化学性质)
D.微粒半径大小的比较规律:
a.原子与原子 b.原子与其离子 c.电子层结构相同的离子
(3)元素周期律的应用(重难点)
A.“位,构,性”三者之间的关系
a.原子结构决定元素在元素周期表中的位置
b.原子结构决定元素的化学性质
c.以位置推测原子结构和元素性质
B.预测新元素及其性质
3.化学键(重点)
(1)离子键:
A.相关概念:
B.离子化合物:大多数盐、强碱、典型金属氧化物
C.离子化合物形成过程的电子式的表示(难点)
(AB,A2B,AB2,NaOH,Na2O2,NH4Cl,O22-,NH4+)
(2)共价键:
A.相关概念:
B.共价化合物:只有非金属的化合物(除了铵盐)
C.共价化合物形成过程的电子式的表示(难点)
(NH3,CH4,CO2,HClO,H2O2)
D 极性键与非极性键
(3)化学键的概念和化学反应的本质:
第二章 化学反应与能量
1.化学能与热能
(1)化学反应中能量变化的主要原因:化学键的断裂和形成
(2)化学反应吸收能量或放出能量的决定因素:反应物和生成物的总能量的相对大小
a.吸热反应:反应物的总能量小于生成物的总能量
b.放热反应:反应物的总能量大于生成物的总能量
(3)化学反应的一大特征:化学反应的过程中总是伴随着能量变化,通常表现为热量变化
练习:
氢气在氧气中燃烧产生蓝色火焰,在反应中,破坏1molH-H键消耗的能量为Q1kJ,破坏1molO = O键消耗的能量为Q2kJ,形成1molH-O键释放的能量为Q3kJ.下列关系式中正确的是( B )
A.2Q1+Q2>4Q3 B.2Q1+Q21年前查看全部
- 高一化学必修一第一章怎么计算5克的CH4的电子数,质子数,分子数,原子数.
 -evenline-1年前1
-evenline-1年前1 -
 ss男爵 共回答了14个问题
ss男爵 共回答了14个问题 |采纳率85.7%CH4的相对分子质量为16 5gCH4的物质的量为 n=m/M=5/16=0.3125mol CH4的总电子数为 6+1*4=10(电子数和质子数=序号数) 所以电子数为 0.3125*10=3.125mol 质子数和电子数一样 0.3125*10=3.125MOL 分子数 一个CH4就是一个CH4分子 所以分子数=物质的量 为0.3125mol 原子数 一个CH4有1个C原子和4个H 总有5个原子 所以原子数为 0.3125*5=1.5625mol1年前查看全部
- 高一必修一 数学 定义域 函数 什么之类的
高一必修一 数学 定义域 函数 什么之类的
(1)若f(x)=1-x^2 求f(1-x)^2
(2)若f(x)=x^2求f(x+1/x) yanye52601年前1
yanye52601年前1 -
 发信息ss 共回答了15个问题
发信息ss 共回答了15个问题 |采纳率80%题目:已知f(x+1)的定义域为[-2,3],求f(2x-1)的定义域.
原理:若已知函数f(x)定义域为a1年前查看全部
- 有谁可以帮我总结一下高一必修一的化学 人教版的
 谁让我这么帅1年前1
谁让我这么帅1年前1 -
 js_hyxht 共回答了25个问题
js_hyxht 共回答了25个问题 |采纳率92%化合反应
1、镁在空气中燃烧:2Mg + O2 点燃 2MgO
2、铁在氧气中燃烧:3Fe + 2O2 点燃 Fe3O4
3、铝在空气中燃烧:4Al + 3O2 点燃 2Al2O3
4、氢气在空气中燃烧:2H2 + O2 点燃 2H2O
5、红磷在空气中燃烧:4P + 5O2 点燃 2P2O5
6、硫粉在空气中燃烧: S + O2 点燃 SO2
7、碳在氧气中充分燃烧:C + O2 点燃 CO2
8、碳在氧气中不充分燃烧:2C + O2 点燃 2CO
9、二氧化碳通过灼热碳层: C + CO2 高温 2CO
10、一氧化碳在氧气中燃烧:2CO + O2 点燃 2CO2
11、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2 + H2O === H2CO3
12、生石灰溶于水:CaO + H2O === Ca(OH)2
13、无水硫酸铜作干燥剂:CuSO4 + 5H2O ==== CuSO4?5H2O
14、钠在氯气中燃烧:2Na + Cl2点燃 2NaCl
分解反应
15、实验室用双氧水制氧气:2H2O2 MnO2 2H2O+ O2↑
16、加热高锰酸钾:2KMnO4 加热 K2MnO4 + MnO2 + O2↑
17、水在直流电的作用下分2H2O 通电 2H2↑+ O2 ↑
18、碳酸不稳定而分H2CO3 === H2O + CO2↑
19、高温煅烧石灰石(二氧化碳工业制法):CaCO3 高温 CaO + CO2↑
置换反应
20、铁和硫酸铜溶液反应:Fe + CuSO4 == FeSO4 + Cu
21、锌和稀硫酸反应(实验室制氢气):Zn + H2SO4 == ZnSO4 + H2↑
22、镁和稀盐酸反应:Mg+ 2HCl === MgCl2 + H2↑
23、氢气还原氧化铜:H2 + CuO 加热 Cu + H2O
24、木炭还原氧化铜:C+ 2CuO 高温 2Cu + CO2↑
25、甲烷在空气中燃烧:CH4 + 2O2 点燃 CO2 + 2H2O
26、水蒸气通过灼热碳层:H2O + C 高温 H2 + CO
27、焦炭还原氧化铁:3C+ 2Fe2O3 高温 4Fe + 3CO2↑
其他
28、氢氧化钠溶液与硫酸铜溶液反应:2NaOH + CuSO4 == Cu(OH)2↓ + Na2SO4
29、甲烷在空气中燃烧:CH4 + 2O2 点燃 CO2 + 2H2O
30、酒精在空气中燃烧:C2H5OH + 3O2 点燃 2CO2 + 3H2O
31、一氧化碳还原氧化铜:CO+ CuO 加热 Cu + CO2
32、一氧化碳还原氧化铁:3CO+ Fe2O3 高温 2Fe + 3CO2
33、二氧化碳通过澄清石灰水(检验二氧化碳):Ca(OH)2 + CO2 ==== CaCO3 ↓+ H2O
34、氢氧化钠和二氧化碳反应(除去二氧化碳):2NaOH + CO2 ==== Na2CO3 + H2O
35、石灰石(或大理石)与稀盐酸反应(二氧化碳的实验室制法):CaCO3 + 2HCl === CaCl2 + H2O + CO2↑
36、碳酸钠与浓盐酸反应(泡沫灭火器的原理): Na2CO3 + 2HCl === 2NaCl + H2O + CO2↑
一. 物质与氧气的反应:
(1)单质与氧气的反应:
1. 镁在空气中燃烧:2Mg + O2 点燃 2MgO
2. 铁在氧气中燃烧:3Fe + 2O2 点燃 Fe3O4
3. 铜在空气中受热:2Cu + O2 加热 2CuO
4. 铝在空气中燃烧:4Al + 3O2 点燃 2Al2O3
5. 氢气中空气中燃烧:2H2 + O2 点燃 2H2O
6. 红磷在空气中燃烧:4P + 5O2 点燃 2P2O5
7. 硫粉在空气中燃烧: S + O2 点燃 SO2
8. 碳在氧气中充分燃烧:C + O2 点燃 CO2
9. 碳在氧气中不充分燃烧:2C + O2 点燃 2CO
(2)化合物与氧气的反应:
10. 一氧化碳在氧气中燃烧:2CO + O2 点燃 2CO2
11. 甲烷在空气中燃烧:CH4 + 2O2 点燃 CO2 + 2H2O
12. 酒精在空气中燃烧:C2H5OH + 3O2 点燃 2CO2 + 3H2O
二.几个分解反应:
13. 水在直流电的作用下分2H2O 通电 2H2↑+ O2 ↑
14. 加热碱式碳酸铜:Cu2(OH)2CO3 加热 2CuO + H2O + CO2↑
15. 加热氯酸钾(有少量的二氧化锰):2KClO3 ==== 2KCl + 3O2 ↑
16. 加热高锰酸钾:2KMnO4 加热 K2MnO4 + MnO2 + O2↑
17. 碳酸不稳定而分H2CO3 === H2O + CO2↑
18. 高温煅烧石灰石:CaCO3 高温 CaO + CO2↑
三.几个氧化还原反应:
19. 氢气还原氧化铜:H2 + CuO 加热 Cu + H2O
20. 木炭还原氧化铜:C+ 2CuO 高温 2Cu + CO2↑
21. 焦炭还原氧化铁:3C+ 2Fe2O3 高温 4Fe + 3CO2↑
22. 焦炭还原四氧化三铁:2C+ Fe3O4 高温 3Fe + 2CO2↑
23. 一氧化碳还原氧化铜:CO+ CuO 加热 Cu + CO2
24. 一氧化碳还原氧化铁:3CO+ Fe2O3 高温 2Fe + 3CO2
25. 一氧化碳还原四氧化三铁:4CO+ Fe3O4 高温 3Fe + 4CO2
四.单质、氧化物、酸、碱、盐的相互关系
(1)金属单质 + 酸 -------- 盐 + 氢气 (置换反应)
26. 锌和稀硫酸Zn + H2SO4 = ZnSO4 + H2↑
27. 铁和稀硫酸Fe + H2SO4 = FeSO4 + H2↑
28. 镁和稀硫酸Mg + H2SO4 = MgSO4 + H2↑
29. 铝和稀硫酸2Al +3H2SO4 = Al2(SO4)3 +3H2↑
30. 锌和稀盐酸Zn + 2HCl === ZnCl2 + H2↑
31. 铁和稀盐酸Fe + 2HCl === FeCl2 + H2↑
32. 镁和稀盐酸Mg+ 2HCl === MgCl2 + H2↑
33. 铝和稀盐酸2Al + 6HCl == 2AlCl3 + 3H2↑
(2)金属单质 + 盐(溶液) ------- 另一种金属 + 另一种盐
34. 铁和硫酸铜溶液反应:Fe + CuSO4 === FeSO4 + Cu
35. 锌和硫酸铜溶液反应:Zn + CuSO4 === ZnSO4 + Cu
36. 铜和硝酸汞溶液反应:Cu + Hg(NO3)2 === Cu(NO3)2 + Hg
(3)碱性氧化物 +酸 -------- 盐 + 水
37. 氧化铁和稀盐酸反应:Fe2O3 + 6HCl === 2FeCl3 + 3H2O
38. 氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 === Fe2(SO4)3 + 3H2O
39. 氧化铜和稀盐酸反应:CuO + 2HCl ==== CuCl2 + H2O
40. 氧化铜和稀硫酸反应:CuO + H2SO4 ==== CuSO4 + H2O
41. 氧化镁和稀硫酸反应:MgO + H2SO4 ==== MgSO4 + H2O
42. 氧化钙和稀盐酸反应:CaO + 2HCl ==== CaCl2 + H2O
(4)酸性氧化物 +碱 -------- 盐 + 水
43.苛性钠暴露在空气中变质:2NaOH + CO2 ==== Na2CO3 + H2O
44.苛性钠吸收二氧化硫气体:2NaOH + SO2 ==== Na2SO3 + H2O
45.苛性钠吸收三氧化硫气体:2NaOH + SO3 ==== Na2SO4 + H2O
46.消石灰放在空气中变质:Ca(OH)2 + CO2 ==== CaCO3 ↓+ H2O
47. 消石灰吸收二氧化硫:Ca(OH)2 + SO2 ==== CaSO3 ↓+ H2O
(5)酸 + 碱 -------- 盐 + 水
48.盐酸和烧碱起反应:HCl + NaOH ==== NaCl +H2O
49. 盐酸和氢氧化钾反应:HCl + KOH ==== KCl +H2O
50.盐酸和氢氧化铜反应:2HCl + Cu(OH)2 ==== CuCl2 + 2H2O
51. 盐酸和氢氧化钙反应:2HCl + Ca(OH)2 ==== CaCl2 + 2H2O
52. 盐酸和氢氧化铁反应:3HCl + Fe(OH)3 ==== FeCl3 + 3H2O
53.氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 ==== AlCl3 + 3H2O
54.硫酸和烧碱反应:H2SO4 + 2NaOH ==== Na2SO4 + 2H2O
55.硫酸和氢氧化钾反应:H2SO4 + 2KOH ==== K2SO4 + 2H2O
56.硫酸和氢氧化铜反应:H2SO4 + Cu(OH)2 ==== CuSO4 + 2H2O
57. 硫酸和氢氧化铁反应:3H2SO4 + 2Fe(OH)3==== Fe2(SO4)3 + 6H2O
58. 硝酸和烧碱反应:HNO3+ NaOH ==== NaNO3 +H2O
(6)酸 + 盐 -------- 另一种酸 + 另一种盐
59.大理石与稀盐酸反应:CaCO3 + 2HCl === CaCl2 + H2O + CO2↑
60.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl === 2NaCl + H2O + CO2↑
61.碳酸镁与稀盐酸反应: MgCO3 + 2HCl === MgCl2 + H2O + CO2↑
62.盐酸和硝酸银溶液反应:HCl + AgNO3 === AgCl↓ + HNO3
63.硫酸和碳酸钠反应:Na2CO3 + H2SO4 === Na2SO4 + H2O + CO2↑
64.硫酸和氯化钡溶液反应:H2SO4 + BaCl2 ==== BaSO4 ↓+ 2HCl
(7)碱 + 盐 -------- 另一种碱 + 另一种盐
65.氢氧化钠与硫酸铜:2NaOH + CuSO4 ==== Cu(OH)2↓ + Na2SO4
66.氢氧化钠与氯化铁:3NaOH + FeCl3 ==== Fe(OH)3↓ + 3NaCl
67.氢氧化钠与氯化镁:2NaOH + MgCl2 ==== Mg(OH)2↓ + 2NaCl
68. 氢氧化钠与氯化铜:2NaOH + CuCl2 ==== Cu(OH)2↓ + 2NaCl
69. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 === CaCO3↓+ 2NaOH
(8)盐 + 盐 ----- 两种新盐
70.氯化钠溶液和硝酸银溶液:NaCl + AgNO3 ==== AgCl↓ + NaNO3
71.硫酸钠和氯化钡:Na2SO4 + BaCl2 ==== BaSO4↓ + 2NaCl
五.其它反应:
72.二氧化碳溶解于水:CO2 + H2O === H2CO3
73.生石灰溶于水:CaO + H2O === Ca(OH)2
74.氧化钠溶于水:Na2O + H2O ==== 2NaOH
75.三氧化硫溶于水:SO3 + H2O ==== H2SO4
76.硫酸铜晶体受热分CuSO4?5H2O 加热 CuSO4 + 5H2O
77.无水硫酸铜作干燥剂:CuSO4 + 5H2O ==== CuSO4?5H2
化学方程式 反应现象 应用
2Mg+O2点燃或Δ2MgO 剧烈燃烧.耀眼白光.生成白色固体.放热.产生大量白烟 白色信号弹
2Hg+O2点燃或Δ2HgO 银白液体、生成红色固体 拉瓦锡实验
2Cu+O2点燃或Δ2CuO 红色金属变为黑色固体
4Al+3O2点燃或Δ2Al2O3 银白金属变为白色固体
3Fe+2O2点燃Fe3O4 剧烈燃烧、火星四射、生成黑色固体、放热 4Fe + 3O2高温2Fe2O3
C+O2 点燃CO2 剧烈燃烧、白光、放热、使石灰水变浑浊
S+O2 点燃SO2 剧烈燃烧、放热、刺激味气体、空气中淡蓝色火焰.氧气中蓝紫色火焰
2H2+O2 点燃2H2O 淡蓝火焰、放热、生成使无水CuSO4变蓝的液体(水) 高能燃料
4P+5O2 点燃2P2O5 剧烈燃烧、大量白烟、放热、生成白色固体 证明空气中氧气含量
CH4+2O2点燃2H2O+CO2 蓝色火焰、放热、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水) 甲烷和天然气的燃烧
2C2H2+5O2点燃2H2O+4CO2 蓝色火焰、放热、黑烟、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水) 氧炔焰、焊接切割金属
2KClO3MnO2 Δ2KCl +3O2↑ 生成使带火星的木条复燃的气体 实验室制备氧气
2KMnO4Δ K2MnO4+MnO2+O2↑ 紫色变为黑色、生成使带火星木条复燃的气体 实验室制备氧气
2HgOΔ2Hg+O2↑ 红色变为银白、生成使带火星木条复燃的气体 拉瓦锡实验
2H2O通电2H2↑+O2↑ 水通电分解为氢气和氧气 电解水
Cu2(OH)2CO3Δ2CuO+H2O+CO2↑ 绿色变黑色、试管壁有液体、使石灰水变浑浊气体 铜绿加热
NH4HCO3ΔNH3↑+ H2O +CO2↑ 白色固体消失、管壁有液体、使石灰水变浑浊气体 碳酸氢铵长期暴露空气中会消失
Zn+H2SO4=ZnSO4+H2↑ 有大量气泡产生、锌粒逐渐溶解 实验室制备氢气
Fe+H2SO4=FeSO4+H2↑ 有大量气泡产生、金属颗粒逐渐溶解
Mg+H2SO4 =MgSO4+H2↑ 有大量气泡产生、金属颗粒逐渐溶解
2Al+3H2SO4=Al2(SO4)3+3H2↑ 有大量气泡产生、金属颗粒逐渐溶解
Fe2O3+3H2 Δ 2Fe+3H2O 红色逐渐变为银白色、试管壁有液体 冶炼金属、利用氢气的还原性
Fe3O4+4H2 Δ3Fe+4H2O 黑色逐渐变为银白色、试管壁有液体 冶炼金属、利用氢气的还原性
WO3+3H2Δ W +3H2O 冶炼金属钨、利用氢气的还原性
MoO3+3H2 ΔMo +3H2O 冶炼金属钼、利用氢气的还原性
2Na+Cl2Δ或点燃2NaCl 剧烈燃烧、黄色火焰 离子化合物的形成、
H2+Cl2 点燃或光照 2HCl 点燃苍白色火焰、瓶口白雾 共价化合物的形成、制备盐酸
CuSO4+2NaOH=Cu(OH)2↓+Na2SO4 蓝色沉淀生成、上部为澄清溶液 质量守恒定律实验
2C +O2点燃2CO 煤炉中常见反应、空气污染物之一、煤气中毒原因
2C O+O2点燃2CO2 蓝色火焰 煤气燃烧
C + CuO 高温2Cu+ CO2↑ 黑色逐渐变为红色、产生使澄清石灰水变浑浊的气体 冶炼金属
2Fe2O3+3C 高温4Fe+ 3CO2↑ 冶炼金属
Fe3O4+2C高温3Fe + 2CO2↑ 冶炼金属
C + CO2 高温2CO
CO2 + H2O = H2CO3 碳酸使石蕊变红 证明碳酸的酸性
H2CO3 ΔCO2↑+ H2O 石蕊红色褪去
Ca(OH)2+CO2= CaCO3↓+ H2O 澄清石灰水变浑浊 应用CO2检验和石灰浆粉刷墙壁
CaCO3+H2O+CO2 = Ca(HCO3)2 白色沉淀逐渐溶解 溶洞的形成,石头的风化
Ca(HCO3)2Δ CaCO3↓+H2O+CO2↑ 白色沉淀、产生使澄清石灰水变浑浊的气体 水垢形成.钟乳石的形成
2NaHCO3ΔNa2CO3+H2O+CO2↑ 产生使澄清石灰水变浑浊的气体 小苏打蒸馒头
CaCO3 高温 CaO+ CO2↑ 工业制备二氧化碳和生石灰
CaCO3+2HCl=CaCl2+ H2O+CO2↑ 固体逐渐溶解、有使澄清石灰水变浑浊的气体 实验室制备二氧化碳、除水垢
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑ 固体逐渐溶解、有使澄清石灰水变浑浊的气体 泡沫灭火器原理
Na2CO3+2HCl=2NaCl+ H2O+CO2↑ 固体逐渐溶解、有使澄清石灰水变浑浊的气体 泡沫灭火器原理
MgCO3+2HCl=MgCl2+H2O+CO2↑ 固体逐渐溶解、有使澄清石灰水变浑浊的气体
CuO +COΔ Cu + CO2 黑色逐渐变红色,产生使澄清石灰水变浑浊的气体 冶炼金属
Fe2O3+3CO高温 2Fe+3CO2 冶炼金属原理
Fe3O4+4CO高温 3Fe+4CO2 冶炼金属原理
WO3+3CO高温 W+3CO2 冶炼金属原理
CH3COOH+NaOH=CH3COONa+H2O
2CH3OH+3O2点燃2CO2+4H2O
C2H5OH+3O2点燃2CO2+3H2O 蓝色火焰、产生使石灰水变浑浊的气体、放热 酒精的燃烧
Fe+CuSO4=Cu+FeSO4 银白色金属表面覆盖一层红色物质 湿法炼铜、镀铜
Mg+FeSO4= Fe+ MgSO4 溶液由浅绿色变为无色 Cu+Hg(NO3)2=Hg+ Cu (NO3)2
Cu+2AgNO3=2Ag+ Cu(NO3)2 红色金属表面覆盖一层银白色物质 镀银
Zn+CuSO4= Cu+ZnSO4 青白色金属表面覆盖一层红色物质 镀铜
Fe2O3+6HCl=2FeCl3+3H2O 铁锈溶解、溶液呈黄色 铁器除锈
Al2O3+6HCl=2AlCl3+3H2O 白色固体溶解
Na2O+2HCl=2NaCl+H2O 白色固体溶解
CuO+2HCl=CuCl2+H2O 黑色固体溶解、溶液呈蓝色
ZnO+2HCl=ZnCl2+ H2O 白色固体溶解
MgO+2HCl=MgCl2+ H2O 白色固体溶解
CaO+2HCl=CaCl2+ H2O 白色固体溶解
NaOH+HCl=NaCl+ H2O 白色固体溶解
Cu(OH)2+2HCl=CuCl2+2H2O 蓝色固体溶解
Mg(OH)2+2HCl=MgCl2+2H2O 白色固体溶解
Al(OH)3+3HCl=AlCl3+3H2O 白色固体溶解 胃舒平治疗胃酸过多
Fe(OH)3+3HCl=FeCl3+3H2O 红褐色沉淀溶解、溶液呈黄色
Ca(OH)2+2HCl=CaCl2+2H2O
HCl+AgNO3= AgCl↓+HNO3 生成白色沉淀、不溶解于稀硝酸 检验Cl—的原理
Fe2O3+3H2SO4= Fe2(SO4)3+3H2O 铁锈溶解、溶液呈黄色 铁器除锈
Al2O3+3H2SO4= Al2(SO4)3+3H2O 白色固体溶解
CuO+H2SO4=CuSO4+H2O 黑色固体溶解、溶液呈蓝色
ZnO+H2SO4=ZnSO4+H2O 白色固体溶解
MgO+H2SO4=MgSO4+H2O 白色固体溶解
2NaOH+H2SO4=Na2SO4+2H2O
Cu(OH)2+H2SO4=CuSO4+2H2O 蓝色固体溶解
Ca(OH)2+H2SO4=CaSO4+2H2O
Mg(OH)2+H2SO4=MgSO4+2H2O 白色固体溶解
2Al(OH)3+3H2SO4=Al2(SO4)3+3H2O 白色固体溶解
2Fe(OH)3+3H2SO4=Fe2(SO4)3+3H2O 红褐色沉淀溶解、溶液呈黄色
Ba(OH)2+ H2SO4=BaSO4↓+2H2O 生成白色沉淀、不溶解于稀硝酸 检验SO42—的原理
BaCl2+ H2SO4=BaSO4↓+2HCl 生成白色沉淀、不溶解于稀硝酸 检验SO42—的原理
Ba(NO3)2+H2SO4=BaSO4↓+2HNO3 生成白色沉淀、不溶解于稀硝酸 检验SO42—的原理
Na2O+2HNO3=2NaNO3+H2O 白色固体溶解
CuO+2HNO3=Cu(NO3)2+H2O 黑色固体溶解、溶液呈蓝色
ZnO+2HNO3=Zn(NO3)2+ H2O 白色固体溶解
MgO+2HNO3=Mg(NO3)2+ H2O 白色固体溶解
CaO+2HNO3=Ca(NO3)2+ H2O 白色固体溶解
NaOH+HNO3=NaNO3+ H2O
Cu(OH)2+2HNO3=Cu(NO3)2+2H2O 蓝色固体溶解
Mg(OH)2+2HNO3=Mg(NO3)2+2H2O 白色固体溶解
Al(OH)3+3HNO3=Al(NO3)3+3H2O 白色固体溶解
Ca(OH)2+2HNO3=Ca(NO3)2+2H2O
Fe(OH)3+3HNO3=Fe(NO3)3+3H2O 红褐色沉淀溶解、溶液呈黄色
3NaOH + H3PO4=3H2O + Na3PO4
3NH3+H3PO4=(NH4)3PO4
2NaOH+CO2=Na2CO3+ H2O 吸收CO、O2、H2中的CO2、
2NaOH+SO2=Na2SO3+ H2O 2NaOH+SO3=Na2SO4+ H2O 处理硫酸工厂的尾气(SO2)
FeCl3+3NaOH=Fe(OH)3↓+3NaCl 溶液黄色褪去、有红褐色沉淀生成
AlCl3+3NaOH=Al(OH)3↓+3NaCl 有白色沉淀生成
MgCl2+2NaOH = Mg(OH)2↓+2NaCl
CuCl2+2NaOH = Cu(OH)2↓+2NaCl 溶液蓝色褪去、有蓝色沉淀生成
CaO+ H2O = Ca(OH)2 白色块状固体变为粉末、 生石灰制备石灰浆
Ca(OH)2+SO2=CaSO3↓+ H2O 有白色沉淀生成 初中一般不用
Ca(OH)2+Na2CO3=CaCO3↓+2NaOH 有白色沉淀生成 工业制烧碱、实验室制少量烧碱
Ba(OH)2+Na2CO3=BaCO3↓+2NaOH 有白色沉淀生成
Ca(OH)2+K2CO3=CaCO3↓ +2KOH 有白色沉淀生成
CuSO4+5H2O= CuSO4?H2O 蓝色晶体变为白色粉末
CuSO4?H2OΔ CuSO4+5H2O 白色粉末变为蓝色 检验物质中是否含有水
AgNO3+NaCl = AgCl↓+Na NO3 白色不溶解于稀硝酸的沉淀(其他氯化物类似反应) 应用于检验溶液中的氯离子
BaCl2 + Na2SO4 = BaSO4↓+2NaCl 白色不溶解于稀硝酸的沉淀(其他硫酸盐类似反应) 应用于检验硫酸根离子
CaCl2+Na2CO3= CaCO3↓+2NaCl 有白色沉淀生成
MgCl2+Ba(OH)2=BaCl2+Mg(OH)2↓ 有白色沉淀生成
CaCO3+2HCl=CaCl2+H2O+CO2 ↑
MgCO3+2HCl= MgCl2+H2O+ CO2 ↑
NH4NO3+NaOH=NaNO3+NH3↑+H2O 生成使湿润石蕊试纸变蓝色的气体 应用于检验溶液中的铵根离子
NH4Cl+ KOH= KCl+NH3↑+H2O 生成使湿润石蕊试纸变蓝色的气体1年前查看全部
- 必修一函数的表示某批发商批发某种商品的单价P(单位:元/千克)与一次性批发数量Q之间函数的图像
必修一函数的表示某批发商批发某种商品的单价P(单位:元/千克)与一次性批发数量Q之间函数的图像
如图:某批发商批发某种商品的单价P(单位:
元/千克)与一次性批发数量Q(单位:千克)之
间函数的图像,一零售商仅有现金2700元,他最
多可购买这种商品 千克(不考虑运输费等其他费用).
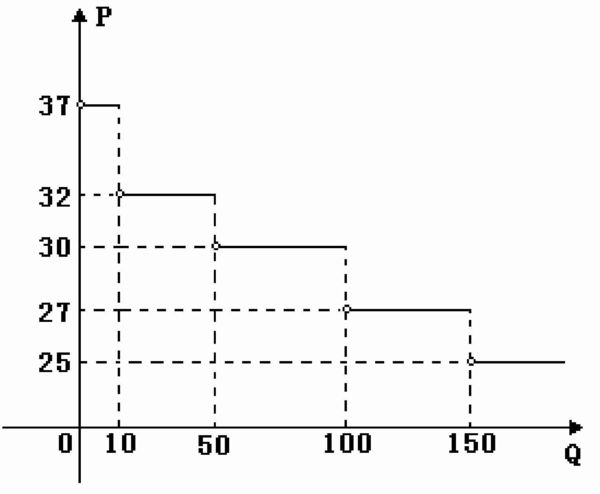
求详解 天嘻1年前2
天嘻1年前2 -
 nightwatcher22 共回答了16个问题
nightwatcher22 共回答了16个问题 |采纳率93.8%当Q>150时,P=25,
∵2700÷25=108<150
∴P≥27
∵此时Q=2700÷27=100
∴P>27
当P=30时,Q=2700÷30=90∈﹙50,100]
∴符合题意
故填901年前查看全部
- 高中必修1物理 位移问题,如图,400M的操场,三个运动员ABC,跑完一圈,哪一个位移最大?.是A还是C啊?
高中必修1物理 位移问题,如图,400M的操场,三个运动员ABC,跑完一圈,哪一个位移最大?.是A还是C啊?
老师说是C ,为什么啊?终点相同 A的位移不是0吗? C的位移得是复数啊.那得C>A啊..谁能解释下,讲解下,终点都是A 那边的
 珍酷儿1年前1
珍酷儿1年前1 -
 不要忘了初衷 共回答了20个问题
不要忘了初衷 共回答了20个问题 |采纳率100%你得再看一哈物理课本,这两天我也正学这呢,位移是矢量,大小and方向分开,问题中位移最大说的是大小,乃个(-)是方向,你现在在看看是不是c?
还有把位移跟路程分开,这都是很容易混淆的.孩子,加油,支持你,奋斗吧!1年前查看全部
- 普通高中课程标准实验教科书英语(必修)1和2重庆大学出版社 的听力可以发给我吗?非常感谢
普通高中课程标准实验教科书英语(必修)1和2重庆大学出版社 的听力可以发给我吗?非常感谢
邮箱664528721@qq.com 红眠1年前1
红眠1年前1 -
 杰vLF 共回答了18个问题
杰vLF 共回答了18个问题 |采纳率88.9%电子版的很少,只有去买配套的了.1年前查看全部
- 必修二物理.互成角度的两个变速直线运动的合运动为什么是曲线
 koala20001年前1
koala20001年前1 -
 iamwujie 共回答了17个问题
iamwujie 共回答了17个问题 |采纳率94.1%从运动学来讲:物体运动的轨迹和速度的变化(加速度)有关.
本题的条件不全,只给了一点的分速度,无法确定运动轨迹,可能是直线,或曲线.
假如是选择题,可以回答是曲线,直线是曲率为0的特殊曲线.
举一个是直线的特殊例子:(匀变速运动中的直线运动)
设:分速度为V1,V2,合速度为V;对应的分加速度为a1,a2,合加速度为a.
当V和a的方向相同或相反时,则物体运动轨迹是直线.
V和a方向相同时,物体沿V的方向做直线运动,V逐渐增大;
V和a方向相反时,物体沿V的方向做直线运动,V逐渐减小至0,然后物体向V的反方向运动.
两者的运动轨迹都是直线.1年前查看全部
- 求高中数学必修1和必修5的知识点归纳阿,
求高中数学必修1和必修5的知识点归纳阿,
归纳不要太细了,不要太多了,好人一生平安. 长孙落樱1年前2
长孙落樱1年前2 -
 火凤凰1218 共回答了19个问题
火凤凰1218 共回答了19个问题 |采纳率89.5%集合(并集,交集,补集)
函数(指数,对数,幂函数),函数应用
解三角形(正弦定理,余弦定理)
数列(等差数列,等比数列)
不等式1年前查看全部
- 急求高一物理必修一第二章问题
 Lara 慧1年前1
Lara 慧1年前1 -
 ds112 共回答了13个问题
ds112 共回答了13个问题 |采纳率92.3%一个滑雪的人,从85m长的山坡上匀变速直线滑下.初速度1.8m/s^,末速度5.0m/s^,他通过山坡需多久1年前查看全部
- 高中化学必修一知识点大纲以及考点
 记忆中逃避1年前1
记忆中逃避1年前1 -
 伤得很深 共回答了21个问题
伤得很深 共回答了21个问题 |采纳率85.7%小风制作
必修1全册基本内容梳理
从实验学化学
一、化学实验安全
1、(1)做有毒气体的实验时,应在通风厨中进行,并注意对尾气进行适当处理(吸收或点燃等).进行易燃易爆气体的实验时应注意验纯,尾气应燃烧掉或作适当处理.
(2)烫伤宜找医生处理.
(3)浓酸撒在实验台上,先用Na2CO3 (或NaHCO3)中和,后用水冲擦干净.浓酸沾在皮肤上,宜先用干抹布拭去,再用水冲净.浓酸溅在眼中应先用稀NaHCO3溶液淋洗,然后请医生处理.
(4)浓碱撒在实验台上,先用稀醋酸中和,然后用水冲擦干净.浓碱沾在皮肤上,宜先用大量水冲洗,再涂上硼酸溶液.浓碱溅在眼中,用水洗净后再用硼酸溶液淋洗.
(5)钠、磷等失火宜用沙土扑盖.
(6)酒精及其他易燃有机物小面积失火,应迅速用湿抹布扑盖.
二.混合物的分离和提纯
分离和提纯的方法 分离的物质 应注意的事项 应用举例
过滤 用于固液混合的分离 一贴、二低、三靠 如粗盐的提纯
蒸馏 提纯或分离沸点不同的液体混合物 防止液体暴沸,温度计水银球的位置,如石油的蒸馏中冷凝管中水的流向 如石油的蒸馏
萃取 利用溶质在互不相溶的溶剂里的溶解度不同,用一种溶剂把溶质从它与另一种溶剂所组成的溶液中提取出来的方法 选择的萃取剂应符合下列要求:和原溶液中的溶剂互不相溶;对溶质的溶解度要远大于原溶剂 用四氯化碳萃取溴水里的溴、碘
分液 分离互不相溶的液体 打开上端活塞或使活塞上的凹槽与漏斗上的水孔,使漏斗内外空气相通.打开活塞,使下层液体慢慢流出,及时关闭活塞,上层液体由上端倒出 如用四氯化碳萃取溴水里的溴、碘后再分液
蒸发和结晶 用来分离和提纯几种可溶性固体的混合物 加热蒸发皿使溶液蒸发时,要用玻璃棒不断搅动溶液;当蒸发皿中出现较多的固体时,即停止加热 分离NaCl和KNO3混合物
三、离子检验
离子 所加试剂 现象 离子方程式
Cl- AgNO3、稀HNO3 产生白色沉淀 Cl-+Ag+=AgCl↓
SO42- 稀HCl、BaCl2 白色沉淀 SO42-+Ba2+=BaSO4↓
四.除杂
注意事项:为了使杂质除尽,加入的试剂不能是“适量”,而应是“过量”;但过量的试剂必须在后续操作中便于除去.
五、物质的量的单位――摩尔
1.物质的量(n)是表示含有一定数目粒子的集体的物理量.
2.摩尔(mol): 把含有6.02 ×1023个粒子的任何粒子集体计量为1摩尔.
3.阿伏加德罗常数:把6.02 X1023mol-1叫作阿伏加德罗常数.
4.物质的量 = 物质所含微粒数目/阿伏加德罗常数 n =N/NA
5.摩尔质量(M)(1) 定义:单位物质的量的物质所具有的质量叫摩尔质量.(2)单位:g/mol 或 g..mol-1(3) 数值:等于该粒子的相对原子质量或相对分子质量.
6.物质的量=物质的质量/摩尔质量 ( n = m/M )
六、气体摩尔体积
1.气体摩尔体积(Vm)(1)定义:单位物质的量的气体所占的体积叫做气体摩尔体积.(2)单位:L/mol
2.物质的量=气体的体积/气体摩尔体积n=V/Vm
3.标准状况下, Vm = 22.4 L/mol
七、物质的量在化学实验中的应用
1.物质的量浓度.
二、物质的化学变化
氧化还原反应中概念及其相互关系如下:
失去电子——化合价升高——被氧化(发生氧化反应)——是还原剂(有还原性)
得到电子——化合价降低——被还原(发生还原反应)——是氧化剂(有氧化性)
金属及其化合物
一、
金属活动性Na>Mg>Al>Fe.
二、金属一般比较活泼,容易与O2反应而生成氧化物,可以与酸溶液反应而生成H2,特别活泼的如Na等可以与H2O发生反应置换出H2,特殊金属如Al可以与碱溶液反应而得到H2.
三、
A12O3为两性氧化物,Al(OH)3为两性氢氧化物,都既可以与强酸反应生成盐和水,也可以与强碱反应生成盐和水.
五、Na2CO3和NaHCO3比较
碳酸钠 碳酸氢钠
俗名 纯碱或苏打 小苏打
色态 白色晶体 细小白色晶体
水溶性 易溶于水,溶液呈碱性使酚酞变红 易溶于水(但比Na2CO3溶解度小)溶液呈碱性(酚酞变浅红)
热稳定性 较稳定,受热难分解 受热易分解
2NaHCO3 Na2CO3+CO2↑+H2O
与酸反应 CO32—+H+ H CO3—
H CO3—+H+ CO2↑+H2O
H CO3—+H+ CO2↑+H2O
相同条件下放出CO2的速度NaHCO3比Na2CO3快
与碱反应 Na2CO3+Ca(OH)2 CaCO3↓+2NaOH
反应实质:CO32—与金属阳离子的复分解反应 NaHCO3+NaOH Na2CO3+H2O
反应实质:H CO3—+OH- H2O+CO32—
与H2O和CO2的反应 Na2CO3+CO2+H2O 2NaHCO3
CO32—+H2O+CO2 H CO3—
不反应
与盐反应 CaCl2+Na2CO3 CaCO3↓+2NaCl
Ca2++CO32— CaCO3↓
不反应
主要用途 玻璃、造纸、制皂、洗涤 发酵、医药、灭火器
转化关系
六、.合金:
一、硅元素:
二、二氧化硅(SiO2)
天
三、硅酸(H2SiO3)
四、硅单质
五、氯元素:位于第三周期第ⅦA族,原子结构: 容易得到一个电子形成
氯离子Cl-,为典型的非金属元素,在自然界中以化合态存在.
六、氯气
物理性质:黄绿色气体,有刺激性气味、可溶于水、加压和降温条件下可变为液态(液氯)和固态.
制法:MnO2+4HCl (浓) MnCl2+2H2O+Cl2
闻法:用手在瓶口轻轻扇动,使少量氯气进入鼻孔.
化学性质:很活泼,有毒,有氧化性, 能与大多数金属化合生成金属氯化物(盐).也能与非金属反应:
七、氯离子的检验
使用硝酸银溶液,并用稀硝酸排除干扰离子(CO32-、SO32-)
HCl+AgNO3 == AgCl ↓+HNO3
NaCl+AgNO3 == AgCl ↓+NaNO3
Na2CO3+2AgNO3 ==Ag2CO?3 ↓+2NaNO3
Ag2CO?3+2HNO3 == 2AgNO3+CO2 ↑+H2O
Cl-+Ag+ == AgCl ↓
八、二氧化硫
制法(形成):硫黄或含硫的燃料燃烧得到(硫俗称硫磺,是黄色粉末)
S+O2 ===(点燃) SO2
物理性质:无色、刺激性气味、容易液化,易溶于水(1:40体积比)
化学性质:有毒,溶于水与水反应生成亚硫酸H2SO3,形成的溶液酸性,有漂白作用,遇热会变回原来颜色.这是因为H2SO3不稳定,会分解回水和SO2
十、大气污染
SO2 、NO2溶于雨水形成酸雨.防治措施:
① 从燃料燃烧入手.
② 从立法管理入手.
③从能源利用和开发入手.
④从废气回收利用,化害为利入手.
(2SO2+O2 2SO3 SO3+H2O= H2SO4)
十一、硫酸
物理性质:无色粘稠油状液体,不挥发,沸点高,密度比水大.
化学性质:具有酸的通性,浓硫酸具有脱水性、吸水性和强氧化性.是强氧化剂.
C12H22O11 2NO(无色、不溶于水的气体,有毒)
2NO+O2===2NO2(红棕色、刺激性气味、溶于水气体,有毒)
3NO2+H2O===2HNO3+NO,所以可以用水除去NO中的NO2
两条关系式:4NO+3O2+2H2O==4HNO3,4NO2+O2+2H2O==4HNO3
Ⅱ、氨气(NH3)
a、物理性质:无色、刺激性气味,密度小于空气,极易溶于水(1∶700),易液化,汽化时吸收大量的热,所以常用作制冷剂
b、分子结构:分子式——NH3,电子式—— ,结构式——H—N—H
c、化学性质:
①与水反应:NH3+H2O NH3•H2O(一水合氨) NH4++OH-,所以氨水溶液显碱性
②与氯化氢反应:NH3+HCl==NH4Cl,现象:产生白烟
d、氨气制备:原理:铵盐和碱共热产生氨气
方程式:2NH4Cl+Ca(OH)2===2NH3↑+2H2O+CaCl2
装置:和氧气的制备装置一样
收集:向下排空气法(不能用排水法,因为氨气极易溶于水)
(注意:收集试管口有一团棉花,防止空气对流,减缓排气速度,收集较纯净氨气)
验证氨气是否收集满:用湿润的红色石蕊试纸靠近试管口,若试纸变蓝说明收集满
干燥:碱石灰(CaO和NaOH的混合物)
Ⅲ、铵盐
a、定义:铵根离子(NH4+)和酸根离子(如Cl-、SO42-、CO32-)形成的化合物,如NH4Cl,NH4HCO3等
b、物理性质:都是晶体,都易溶于水
c、化学性质:
①加热分NH4Cl===NH3↑+HCl↑,NH4HCO3===NH3↑+CO2↑+H2O
②与碱反应:铵盐与碱共热可产生刺激性气味并能使湿润红色石蕊试纸变蓝的气体即氨气,故可以用来检验铵根离子的存在,如:NH4NO3+NaOH===NH3↑+H2O+NaCl,离子方程式为:NH4++OH-===NH3↑+H2O,是实验室检验铵根离子的原理.
d、NH4+的检验:NH4++OH-===NH3↑+H2O.操作方法是向溶液中加入氢氧化钠溶液并加热,用湿润的红色石蕊试纸靠近试管口,观察是否变蓝,如若变蓝则说明有铵根离子的存在.
20、硝酸
①物理性质:无色、易挥发、刺激性气味的液体.浓硝酸因为挥发HNO3产生“发烟”现象,故叫做发烟硝酸
②化学性质:a、酸的通性:和碱,和碱性氧化物反应生成盐和水
b、不稳定性:4HNO3=== 4NO2↑+2H2O+O2↑,由于HNO3分解产生的NO2溶于水,所以久置的硝酸会显黄色,只需向其中通入空气即可消除黄色
c、强氧化性:ⅰ、与金属反应:3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O
Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O
常温下Al、Fe遇浓硝酸会发生钝化,所以可以用铝制或铁制的容器储存浓硝酸
ⅱ、与非金属反应:C+4HNO3(浓)===CO2↑+4NO2↑+2H2O
d、王水:浓盐酸和浓硝酸按照体积比3:1混合而成,可以溶解一些不能溶解在硝酸中的金属如Pt、Au等
21、元素周期表和元素周期律
①原子组成:
原子核 中子 原子不带电:中子不带电,质子带正电荷,电子带负电荷
原子组成 质子 质子数==原子序数==核电荷数==核外电子数
核外电子 相对原子质量==质量数
②原子表示方法:
A:质量数 Z:质子数 N:中子数 A=Z+N
决定元素种类的因素是质子数多少,确定了质子数就可以确定它是什么元素
③同位素:质子数相同而中子数不同的原子互称为同位素,如:16O和18O,12C和14C,35Cl和37Cl
④电子数和质子数关系:不带电微粒:电子数==质子数
带正电微粒:电子数==质子数—电荷数
带负电微粒:电子数==质子数+电荷数
⑤1—18号元素(请按下图表示记忆)
H He
Li Be B C N O F Ne
Na Mg Al Si P S Cl Ar
⑥元素周期表结构
短周期(第1、2、3周期,元素种类分别为2、8、8)
元 周期(7个横行) 长周期(第4、5、6周期,元素种类分别为18、18、32)
素 不完全周期(第7周期,元素种类为26,若排满为32)
周 主族(7个)(ⅠA—ⅦA)
期 族(18个纵行,16个族) 副族(7个)(ⅠB—ⅦB)
表 0族(稀有气体族:He、Ne、Ar、Kr、Xe、Rn)
Ⅷ族(3列)
⑦元素在周期表中的位置:周期数==电子层数,主族族序数==最外层电子数==最高正化合价
⑧元素周期律:
从左到右:原子序数逐渐增加,原子半径逐渐减小,得电子能力逐渐增强(失电子能力逐渐减弱),非金属性逐渐增强(金属性逐渐减弱)
从上到下:原子序数逐渐增加,原子半径逐渐增大,失电子能力逐渐增强(得电子能力逐渐减弱),金属性逐渐增强(非金属性逐渐减弱)
所以在周期表中,非金属性最强的是F,金属性最强的是Fr (自然界中是Cs,因为Fr是放射性元素)
判断金属性强弱的四条依据:
a、与酸或水反应的剧烈程度以及释放出氢气的难易程度,越剧烈则越容易释放出H2,金属性越强
b、最高价氧化物对应水化物的碱性强弱,碱性越强,金属性越强
c、金属单质间的相互置换(如:Fe+CuSO4==FeSO4+Cu)
d、原电池的正负极(负极活泼性>正极)
判断非金属性强弱的三条依据:
a、与H2结合的难易程度以及生成气态氢化物的稳定性,越易结合则越稳定,非金属性越强
b、最高价氧化物对应水化物的酸性强弱,酸性越强,非金属性越强
c、非金属单质间的相互置换(如:Cl2+H2S==2HCl+S↓)
注意:“相互证明”——由依据可以证明强弱,由强弱可以推出依据
⑨化学键:原子之间强烈的相互作用
共价键 极性键
化学键 非极性键
离子键
共价键:原子之间通过共用电子对的形式形成的化学键,一般由非金属元素与非金属元素间形成.
非极性键:相同的非金属原子之间,A—A型,如:H2,Cl2,O2,N2中存在非极性键
极性键:不同的非金属原子之间,A—B型,如:NH3,HCl,H2O,CO2中存在极性键
离子键:原子之间通过得失电子形成的化学键,一般由活泼的金属(ⅠA、ⅡA)与活泼的非金属元素(ⅥA、ⅦA)间形成,如:NaCl,MgO,KOH,Na2O2,NaNO3中存在离子键
注:有NH4+离子的一定是形成了离子键;AlCl3中没有离子键,是典型的共价键
共价化合物:仅仅由共价键形成的化合物,如:HCl,H2SO4,CO2,H2O等
离子化合物:存在离子键的化合物,如:NaCl,Mg(NO3)2,KBr,NaOH,NH4Cl
常见物质或离子的检验方法
物质(离子) 方法及现象
Cl- 先用硝酸酸化,然后加入硝酸银溶液,生成不溶于硝酸的白色沉淀
SO42- 先加盐酸酸化,然后加入氯化钡溶液,生成不溶于硝酸的白色沉淀
CO32- 加入硝酸钡溶液,生成白色沉淀,该沉淀可溶于硝酸(或盐酸),并生成无色无味、能使澄清石灰水变浑浊的气体(CO2)
Al3+ 加入NaOH溶液产生白色沉淀,继续加入NaOH溶液,沉淀消失
Fe3+(★) 加入KSCN溶液,溶液立即变为血红色
NH4+(★) 与NaOH溶液共热,放出使湿润的红色石蕊试纸变蓝的刺激性气味的气体(NH3)
Na+ 焰色反应呈黄色
K+ 焰色反应呈浅紫色(透过蓝色钴玻璃)
I2 遇淀粉溶液可使淀粉溶液变蓝
蛋白质 灼烧,有烧焦的羽毛气味1年前查看全部
- 高一必修4数学公式EG倍角公式等等
高一必修4数学公式EG倍角公式等等
如题 ww独醉161年前1
ww独醉161年前1 -
 颜舜 共回答了15个问题
颜舜 共回答了15个问题 |采纳率100%两角和公式
sin(A+B) = sinAcosB+cosAsinB
sin(A-B) = sinAcosB-cosAsinB
cos(A+B) = cosAcosB-sinAsinB
cos(A-B) = cosAcosB+sinAsinB
tan(A+B) = (tanA+tanB)/(1-tanAtanB)
tan(A-B) = (tanA-tanB)/(1+tanAtanB)
cot(A+B) = (cotAcotB-1)/(cotB+cotA)
cot(A-B) = (cotAcotB+1)/(cotB-cotA)
[编辑本段]倍角公式
Sin2A=2SinA?CosA
Cos2A=CosA^2-SinA^2=1-2SinA^2=2CosA^2-1
tan2A=2tanA/1-tanA^2
[编辑本段]三倍角公式
tan3a = tan a · tan(π/3+a)· tan(π/3-a)
[编辑本段]半角公式
[编辑本段]和差化积
sin(a)+sin(b) = 2sin[(a+b)/2]cos[(a-b)/2]
sin(a)-sin(b) = 2cos[(a+b)/2]sin[(a-b)/2]
cos(a)+cos(b) = 2cos[(a+b)/2]cos[(a-b)/2]
cos(a)-cos(b) = -2sin[(a+b)/2]sin[(a-b)/2]
tanA+tanB=sin(A+B)/cosAcosB
[编辑本段]积化和差
sin(a)sin(b) = -1/2*[cos(a+b)-cos(a-b)]
cos(a)cos(b) = 1/2*[cos(a+b)+cos(a-b)]
sin(a)cos(b) = 1/2*[sin(a+b)+sin(a-b)]
cos(a)sin(b) = 1/2*[sin(a+b)-sin(a-b)]
[编辑本段]诱导公式
sin(-a) = -sin(a)
cos(-a) = cos(a)
sin(π/2-a) = cos(a)1年前查看全部
- 今年招远一中高一语文必修三第二课
 houndfish1年前1
houndfish1年前1 -
 xiaweiwei123 共回答了16个问题
xiaweiwei123 共回答了16个问题 |采纳率93.8%http://www.***.com/tongbujiaocheng/gzywtbja/yjbgzhjiaoan/200911/142550.html 看看这个行不行.其实你应该告诉我们你的课本是那种版本地.1年前查看全部
- 高二必修四三角函数.已知函数f(x)=2-cos^2x+2sinxcosx-3sin^x.求f(x)最小正周期.当x属于
高二必修四三角函数.
已知函数f(x)=2-cos^2x+2sinxcosx-3sin^x.求f(x)最小正周期.当x属于〔四分之派,二分之派〕、求f(x)值域. 口口棉花糖1年前3
口口棉花糖1年前3 -
 最爱最爱小ll 共回答了22个问题
最爱最爱小ll 共回答了22个问题 |采纳率90.9%f(x)=2-1+sin2x-2sin²x=sin2x+cos2x+1=√2sin(2x+π/4)+1
x+π/4∈(π/2,3π/4),f(x)∈(2,√2+1) ,最小正周期是π1年前查看全部
- 高中必修4向量有关问题已知向量OB=(2,0),OC=(2,2),CA=(√2cosa,√2sina),求OA与OB的夹
高中必修4向量有关问题
已知向量OB=(2,0),OC=(2,2),CA=(√2cosa,√2sina),求OA与OB的夹角范围. 东方布1年前1
东方布1年前1 -
 飘0909 共回答了27个问题
飘0909 共回答了27个问题 |采纳率85.2%将坐标原点从O平移至C(2,2)
那么 CB=OB-OC=(0,-2)
在新坐标系中,点A的轨迹是以C为圆心,半径为2的圆,而B点落在新Y轴的负半轴上
所以 OA与OB的夹角为
90+a (01年前查看全部
- 高中生物新人教版必修一 p50是什么内容,照张图发上来
 jj20061年前0
jj20061年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 生物高一必修2中减数分裂哪一个时期比较重要?
 plantid11年前2
plantid11年前2 -
 up2uxc 共回答了11个问题
up2uxc 共回答了11个问题 |采纳率90.9%都很重要,要记住每个是细胞发生了那些变化.1年前查看全部
- 跪求人教版高中英语必修四课文录音
 ye9bo1年前1
ye9bo1年前1 -
 小菱形 共回答了18个问题
小菱形 共回答了18个问题 |采纳率94.4%发件人:
我自己的邮箱
时 间:
2012年7月8日(星期天) 下午4:05
附件(1 个)
18天后过期)
发送状态:投递成功
英语必修4.rar (45.77M)1年前查看全部
- 北京师范大学出版社高中必修5英语单词,求快,高一上学期的英语单词啊,北京师范大学出版社的啊,
 moli191年前1
moli191年前1 -
 meini888 共回答了21个问题
meini888 共回答了21个问题 |采纳率90.5%已发送.AKJF HWJKLEF AWELF LWEHFWHFJHUVYIUWRYWIEUYRIEHKJSEH KJA HSLEKJ HKSJFE LEJH LFJW LEJ HWLKEJF HWLKEJFA FHLJ WHELJKF HAWJKLF HLWJKEHF1年前查看全部
- 苏教版高一语文必修3,4的作文素材各个单元的,各两篇
 zhaikaijun1年前1
zhaikaijun1年前1 -
 佬李废刀 共回答了12个问题
佬李废刀 共回答了12个问题 |采纳率83.3%你的动脑子1年前查看全部
- 有关生物选修三生态系统+必修二基因的表达的问题
有关生物选修三生态系统+必修二基因的表达的问题
华南虎处于“能量金字塔”的顶层,与其它营养级相比,华南虎同化的能量最小,这些能量的去向包括:未被利用的能量、_________的能量和_________的能量.
答案是:呼吸作用消耗;被分解者利用
我想问的是:为什么不可以答呼吸作用消耗;传递给下一营养级
是不是因为题中给出华南虎是能量金字塔的顶层,没有下一营养级了?
若在mRNA中插入一个碱基,则可能导致肽链的长度和_______发生改变.
答案是:氨基酸的序列
那可不可以答种类的改变或者是氨基酸排列次序的改变,我自己的答案是根据蛋白质分子的多样性这个方面答的,不知靠谱不?
请专家指点!OrZ ……答好了会加分!我是高三的,需要细致的回答! 橘子与树1年前5
橘子与树1年前5 -
 dadaxiong1978 共回答了19个问题
dadaxiong1978 共回答了19个问题 |采纳率89.5%嗯,因为题目已经告诉你 华南虎处于“能量金字塔”的顶层 所以没有下一个营养级
氨基酸排列次序的改变 这个比较靠谱;答种类的改变则太广泛了
而变为蛋白质分子的多样性,个人认为不太好,因为加入碱基后会不会形成蛋白质都是个问题1年前查看全部
- 生物必修二的一些疑问 特别高手进 最好是老师
生物必修二的一些疑问 特别高手进 最好是老师
1.碱基的排列顺序决定了dna的多样性是决定了生物体的多样性还是同种生物间的多样性请分析一下 2.精子和卵细胞的多样性与性状状基因是什么关系
 Leagar1年前1
Leagar1年前1 -
 大容 共回答了12个问题
大容 共回答了12个问题 |采纳率100%1碱基的排列顺序既决定生物的多样性也能决定同种生物间的多样性.当碱基的数目不同或碱基碱基的数目相同但各种碱基的数目不同时,肯定不是同种生物,此时决定的是生物体的多样性即物种的多样性.对同种生物而言,不同的个体的DNA分子的碱基排列顺序也是不同的.
2、精子和卵细胞的多样性决定了受精卵具有多样性,从分子水平上说也就是形成了不同基因型的受精卵,进而表现出不同的性状.1年前查看全部
- 数学必修五3 8 13 18的通项公式
 花开的午后1年前4
花开的午后1年前4 -
 flrs79 共回答了21个问题
flrs79 共回答了21个问题 |采纳率95.2%一次加5
所以an=-2+5n1年前查看全部
- 高二英语必修五 单词音标不用英文
 余遇海豚1年前1
余遇海豚1年前1 -
 zwqmy 共回答了19个问题
zwqmy 共回答了19个问题 |采纳率89.5%我有书,给你照下来可以吗 追问: = = 我也有书我就是想要书里的 音标 全部抄出来然后打印来‘默写, 回答: 你有书,那你就抄下来吧,我初中也抄过单词,然后默写呢 追问: = = 就不想抄而且自己字不好看抄了可能自己看不懂,O(∩_∩)O 回答: 额,那你是想让别人给你抄?然后给你发过去? 追问: = = 也可以打在 word文档 发给我 不过我觉得这两种基本不会实现 只是来碰碰运气 回答: 有书的基本都是高二三的学生,谁会 有时间给你 抄,没书的自然就不行了,所以学习要靠自己,你要是真想学习,想 背单词 ,找父母或同学考你不就行了,想学习的话总会有办法的.你要是觉得我说的对,请采纳,写这么多也挺累的1年前查看全部
- 谁有高一数人教实验B版学必修4第3章的:三角恒等变换的 总结和复习.
 scyangli1年前2
scyangli1年前2 -
 yellowtooth2 共回答了12个问题
yellowtooth2 共回答了12个问题 |采纳率91.7%同角三角函数的基本关系式
倒数关系:
商的关系:
平方关系:
tanα ·cotα=1
sinα ·cscα=1
cosα ·secα=1
sinα/cosα=tanα=secα/cscα
cosα/sinα=cotα=cscα/secα
sin2α+cos2α=1
1+tan2α=sec2α
1+cot2α=csc2α
诱导公式
sin(-α)=-sinα
cos(-α)=cosα tan(-α)=-tanα
cot(-α)=-cotα
sin(π/2-α)=cosα
cos(π/2-α)=sinα
tan(π/2-α)=cotα
cot(π/2-α)=tanα
sin(π/2+α)=cosα
cos(π/2+α)=-sinα
tan(π/2+α)=-cotα
cot(π/2+α)=-tanα
sin(π-α)=sinα
cos(π-α)=-cosα
tan(π-α)=-tanα
cot(π-α)=-cotα
sin(π+α)=-sinα
cos(π+α)=-cosα
tan(π+α)=tanα
cot(π+α)=cotα
sin(3π/2-α)=-cosα
cos(3π/2-α)=-sinα
tan(3π/2-α)=cotα
cot(3π/2-α)=tanα
sin(3π/2+α)=-cosα
cos(3π/2+α)=sinα
tan(3π/2+α)=-cotα
cot(3π/2+α)=-tanα
sin(2π-α)=-sinα
cos(2π-α)=cosα
tan(2π-α)=-tanα
cot(2π-α)=-cotα
sin(2kπ+α)=sinα
cos(2kπ+α)=cosα
tan(2kπ+α)=tanα
cot(2kπ+α)=cotα
(其中k∈Z)
两角和与差的三角函数公式
万能公式
sin(α+β)=sinαcosβ+cosαsinβ
sin(α-β)=sinαcosβ-cosαsinβ
cos(α+β)=cosαcosβ-sinαsinβ
cos(α-β)=cosαcosβ+sinαsinβ
tanα+tanβ
tan(α+β)=——————
1-tanα ·tanβ
tanα-tanβ
tan(α-β)=——————
1+tanα ·tanβ
2tan(α/2)
sinα=——————
1+tan2(α/2)
1-tan2(α/2)
cosα=——————
1+tan2(α/2)
2tan(α/2)
tanα=——————
1-tan2(α/2)
半角的正弦、余弦和正切公式
三角函数的降幂公式
二倍角的正弦、余弦和正切公式
三倍角的正弦、余弦和正切公式
sin2α=2sinαcosα
cos2α=cos2α-sin2α=2cos2α-1=1-2sin2α
2tanα
tan2α=—————
1-tan2α
sin3α=3sinα-4sin3α
cos3α=4cos3α-3cosα
3tanα-tan3α
tan3α=——————
1-3tan2α
三角函数的和差化积公式
三角函数的积化和差公式
α+β α-β
sinα+sinβ=2sin—--·cos—-—
2 2
α+β α-β
sinα-sinβ=2cos—--·sin—-—
2 2
α+β α-β
cosα+cosβ=2cos—--·cos—-—
2 2
α+β α-β
cosα-cosβ=-2sin—--·sin—-—
2 2 1
sinα ·cosβ=-[sin(α+β)+sin(α-β)]
2
1
cosα ·sinβ=-[sin(α+β)-sin(α-β)]
2
1
cosα ·cosβ=-[cos(α+β)+cos(α-β)]
2
1
sinα ·sinβ=- -[cos(α+β)-cos(α-β)]
2
化asinα ±bcosα为一个角的一个三角函数的形式(辅助角的三角函数的公式1年前查看全部
- 高中必修一函数测试题 已知函数 f(x)=x^2+2(a-1)x+2 在区间(-∞,4]上是减函数,则实数a的取值范围是
高中必修一函数测试题
已知函数 f(x)=x^2+2(a-1)x+2 在区间(-∞,4]上是减函数,则实数a的取值范围是( )
A a≤-3 B a≥-3 C a≤5 D a≥3 若真19821年前6
若真19821年前6 -
 linying126 共回答了17个问题
linying126 共回答了17个问题 |采纳率88.2%函数f(x)=x^2+2(a-1)x+2的对称轴x=1-a,
又函数在区间(-∞,4]上是减函数,可得1-a≥4,得a≤-3.
故选A≤-31年前查看全部
- 数学必修五的公式的应用 就有些解题思路书上没有 遇到哪一类题该用哪种方法之类的 解题思路
数学必修五的公式的应用 就有些解题思路书上没有 遇到哪一类题该用哪种方法之类的 解题思路
我太抓狂了 HELP ME 文昌烧鸭1年前1
文昌烧鸭1年前1 -
 peterhot 共回答了23个问题
peterhot 共回答了23个问题 |采纳率95.7%一、做题不在多,在于精,做完一道题并不意味着结束,可以自己对题目内容进行适当的变化,然后再进一步思考.例如把答案变成已知条件,把已知条件变成问题.这样变化多了,有助于自己把握住思考的本质.
二、对于一些定理,千万不要满足于知道这个东西,而是争取用我们过去已学过的知识去把它推导出来,有兴趣的话,可以设想你面前有一个小听众,你要把这个定理的推导过程讲给他听,要他听得明白,听的高兴.通过这样的训练,我想你对抽象概念的思考会上一个层面.
三、最重要的,去享受解题的乐趣,如果之前基础没打好,很多题目做不出来没关系,去找老师或者其他家教,让他们出一些更基础的题目,慢慢地你就会感觉到自己解题成功的快乐了.
最后,祝你学习顺利1年前查看全部
- 化学必修一什么是电解质,是不是所有酸碱盐和金属氧化物都是电解质
 shjclj1年前1
shjclj1年前1 -
 pku_sg 共回答了15个问题
pku_sg 共回答了15个问题 |采纳率86.7%强电解质和弱电解质 导电的性质与溶解度无关,强电解质一般有:强酸强碱,大多数正盐,如:硫酸 氢氧化钠 硫酸铜;弱电解质一般有:(溶解的部分在水中只能部分电离的化合物)弱酸,弱碱,如;醋酸 一水合氨(NH3·H2O),以及少数盐,如:醋酸铅、氯化汞.另外,水是极弱电解质.请注意:氨气不是电解质(非电解质),但是液氨可以是.氨水是混合物,也不是电解质(不能纳入电解质范畴).上面所说的是一水合氨.再如氯气水溶液能导电的原因是:氯气与水作用,生成HCl和HClO,而HCl和HClO都是电解质,在水溶液中可以发生电离产生阴阳离子使溶液能导电.其中HCl可以完全电离,是强电解质,HClO只能部分电离,是弱电解质.编辑本段电解质的判断 电解质是指在水溶液中或熔融状态下能够导电的化合物,例如酸、碱和盐等.凡在上述情况下不能导电的化合物叫非电解质,例如蔗糖、酒精等.能导电的不一定是电解质,判断某化合物是否是电解质,不能只凭它在水溶液中导电与否,还需要进一步考察其晶体结构和化学键的性质等因素.例如,判断硫酸钡、碳酸钙和氢氧化铁是否为电解质.硫酸钡难溶于水,溶液中离子浓度很小,其水溶液不导电,似乎为非电解质.但熔融的硫酸钡却可以导电.因此,硫酸钡是电解质.碳酸钙和硫酸钡具有相类似的情况,也是电解质.从结构看,对其他难溶盐,只要是离子型化合物或强极性共价型化合物,尽管难溶,但溶的那部分是完全电离的,所以也是电解质.因为溶解是绝对的,不溶是相对的.没有绝对不溶的物质.氢氧化铁的情况则比较复杂,Fe3+与OH-之间的化学键带有共价性质,它的溶解度比硫酸钡还要小;而溶于水的部分,其中少部分又有可能形成胶体,其余亦能电离成离子.但氢氧化铁也是电解质.判断氧化物是否为电解质,也要作具体分析.非金属氧化物,如SO2、SO3、P2O5、CO2等,它们是共价型化合物,液态时不导电,所以不是电解质.有些氧化物在水溶液中即便能导电,但也不是电解质.因为这些氧化物与水反应生成了新的能导电的物质,溶液中导电的不是原氧化物,如SO2本身不能电离,而它和水反应,生成亚硫酸,亚硫酸为电解质.金属氧化物,如Na2O,MgO,CaO,Al2O3等是离子化合物,它们在熔融状态下能够导电,因此是电解质.可见,电解质包括离子型或强极性共价型化合物;非电解质包括弱极性或非极性共价型化合物.电解质水溶液能够导电,是因电解质可以离解成离子.至于物质在水中能否电离,是由其结构决定的.因此,由物质结构识别电解质与非电解质是问题的本质.另外,有些能导电的物质,如所有的金属既不是电解质,也不是非电解质.因它们并不是能导电的化合物,而是单质,不符合电解质的定义,例如,硫酸钡虽然是难溶物质,但是溶解的成分在水中是完全电离,所以硫酸钡是强电解质.编辑本段电解 电能转变为化学能的过程.即使直流电通过电解槽,在电极-溶液界面上进行电化学反应的过程 .例如,水的电解,电解槽中阴极为铁板,阳极为镍板 ,电解液为氢氧化钠溶液.通电时,在外电场的作用下,电解液中的正、负离子分别向阴 、阳极迁移 ,离子在电极 - 溶液界面上进行电化学反应.在阴极上进行还原反应.水的电解就是在外电场作用下将水分解为H2(g)和O2(g).电解是一种非常强有力的促进氧化还原反应的手段,许多很难进行的氧化还原反应,都可以通过电解来实现.例如:可将熔融的氟化物在阳极上氧化成单质氟,熔融的锂盐在阴极上还原成金属锂.电解工业在国民经济中具有重要作用,许多有色金属和稀有金属的冶炼及金属的精炼,基本化工产品的制备,还有电镀、电抛光、阳极氧化等,都是通过电解实现的.1年前查看全部
- 请告诉我人教版高一物理必修一P19第四题(有一个列车时刻表的一道题)的答案
 好假的ID1年前2
好假的ID1年前2 -
 wht016 共回答了29个问题
wht016 共回答了29个问题 |采纳率89.7%(1)时间3.9h,路程350km,平均速度89.7km/h
(2)时间1.35h,路程178km,平均速度132km/h
(3)在站内,瞬时速度为01年前查看全部
- 高一生物必修一第一单元知识点
 欣呓1年前1
欣呓1年前1 -
 taya395 共回答了14个问题
taya395 共回答了14个问题 |采纳率92.9%一、细胞是生物体结构和功能的基本单位
生命活动离不开细胞,即使病毒没有细胞结构,也只有寄生在活细胞内才能生存.
二、生命系统的结构层次
细胞→组织→器官→系统→个体→种群→群落→生态系统→生物圈
细胞是地球上最基本的生命系统.
三、观察细胞——显微镜的使用
1.显微镜的结构:
镜 目镜:目镜越长,放大倍数越小
头 物镜:带螺纹,物镜越长,放大倍数越大
光学结构 反 平面:视野变暗
光
镜 凹面:视野变亮
准焦螺旋:使镜筒上升或下降
机械结构 转换器:更换物镜
光圈:调节视野亮度
2.操作流程:
低倍镜下找到清晰物象→将要放大的物象移到视野中央→转动转化器换高倍镜→调节细准焦螺旋至物象清晰
3.注意事项:
先低后高;高倍镜下只能调节细准焦螺旋.
四、原核细胞与真核细胞
原核细胞 真核细胞
细胞大小 较小(2μm~8μm) 较大(10μm~100μm)
细胞壁 主要成分是肽聚糖 主要成分是纤维素和果胶
细胞膜 磷脂双分子层和蛋白质构成 磷脂双分子层和蛋白质构成
细胞器 无叶绿体、线粒体、高尔基体、内质网等复杂细胞器,有核糖体 含有线粒体等复杂的细胞器
细胞核 无成形细胞核,无核膜,但有拟核;DNA不与蛋白质结合形成染色体 有成形的细胞核,有核膜;具有染色体
代表生物 细菌、蓝藻、支原体、放线菌等 真菌、动物、植物等
最主要的区别就是是否有核膜包被的细胞核.
五、细胞学说
细胞学说是由德国科学家施莱登和施旺共同提出的,内容可概括为:
1.细胞是有机体.一切动植物都是由细胞发育而来,并由细胞和细胞产物所构成;
2.每个细胞作为一个相对独立的基本单位,既有它们“自己的”生命,又与其他细胞协调地集合,构成生命的整体,按共同的规律发育,有共同的生命过程;
3.新的细胞可以由老的细胞产生.1年前查看全部
- 人民教育出版社高一英语必修1第五页的第2小题
 清昔-1年前1
清昔-1年前1 -
 fsellenluo 共回答了10个问题
fsellenluo 共回答了10个问题 |采纳率100%Answerkey for Exercise 2:
1 Anne said that she did not know theaddress of her new home.
2 Anne told her father that she had gottired of looking at nature through dirty curtains and dusty windows.
3 The girl said that she needed to pack upher things in the suitcase very quickly.
4 Her father asked her why she chose/hadchosen her diary and old letters.
5 “Are you very hot with so many clotheson?” Mother asked/said to her.
6 “What else have you hidden under youovercoat?” Margot asked her.
7 “When shall we go back home?” Anne askedher father.
8 “Why did you talk so much to that boy?”Father asked Anne.1年前查看全部
- 高一数学必修1函数f(x0)是什么意思?
 流泪的观音1年前2
流泪的观音1年前2 -
 梦中惊倩 共回答了21个问题
梦中惊倩 共回答了21个问题 |采纳率95.2%你这样问的很笼统,也很不好回答.
这个f(x)就好比y,比如f(x)=1/x于y=1/x,一个意思.
你说的f(xo)么,只是x换成了xo,就成了f(xo)=1/xo,自变量换了罢了.如果f(xo)=1/xo+1/x,那么这个函数的自变量是xo,而不是x
这样理解就可以了.1年前查看全部
- 高一地理必修2的一个选择题关于人类面临的主要环境问题 地面沉降对地区可能造成的影响有
高一地理必修2的一个选择题关于人类面临的主要环境问题 地面沉降对地区可能造成的影响有
A导致地下排污管破坏,市区出现污水外溢这句话对吗,为什么 vv20051年前3
vv20051年前3 -
 kkonghui 共回答了15个问题
kkonghui 共回答了15个问题 |采纳率93.3%我觉得是对的,因为地面沉降就表现为地面塌陷,在城市里,地下埋着纵横交错的地下污水管道,地面陷下去了,强度大的时候就会压断水管的,输水中断,污水自然就外溢了……1年前查看全部
- 关于必修一的生物实验题.36.下列关于“检测生物组织中的糖类、脂肪和蛋白质”实验操作步骤的叙述中,正确的是 ( )A.用
关于必修一的生物实验题.
36.下列关于“检测生物组织中的糖类、脂肪和蛋白质”实验操作步骤的叙述中,正确的是 ( )
A.用于检测可溶性还原糖的斐林试剂的甲液和乙液,可直接用于蛋白质的鉴定
B.脂肪的检测需要用显微镜才能看到被染成橘黄色的脂肪微粒.
C.检测可溶性还原糖时,要加入斐林试剂 甲液摇匀后,再加入乙液
D.用于检测蛋白质的双缩脲试剂的 A 液与B液要混合均匀后,再加入含样品的试管中,且必须现混现用
选什么?为什么?求详解 OrionLee1年前2
OrionLee1年前2 -
 liugw0000 共回答了15个问题
liugw0000 共回答了15个问题 |采纳率93.3%本道题答案选择B.原因如下:
A:斐林试剂甲液与双缩脲试剂的A液一样,但是斐林试剂乙液的浓度(0.05g/ml的CuSO4溶液)与双缩脲试剂的B液(0.01g/ml的CuSO4溶液)不一样,所以必须将斐林试剂的乙液稀释后才能用于检测蛋白质.
B:肉眼无法看到细胞内的脂肪颗粒
C:检测可溶性还原糖时应该使斐林试剂甲乙液等量混合均匀后再注入试管中.
D:使用双缩脲试剂时应该先加入双缩脲试剂A液1ml,摇匀,再注入双缩脲试剂B液4滴,摇匀.
双缩脲试剂和斐林试剂的使用一般都是现配现用.以上解释够清楚了吧?其实这些内容可以在人教版的生物必修一的第18-19页找出答案.1年前查看全部
大家在问
- 1我是一位女性,为什么我的身份证末尾数是奇数?请回答.
- 2一个物体在空气中测得它的重力为78.4N,浸在水中测得重力为68.6N,问:
- 3一个关于__________的记忆 作文
- 4扬去掉偏旁是什么字怎么组词呀? 感谢哦,因为我字典上也查不到这个字呢.
- 5报刊杂志上描写夏天的好诗
- 6我父母每天晚上看电视英语怎么说
- 7翻译英文 许多优秀人才在各行业做出突出贡献
- 8白居易子 ,自号 ,马致远号 ,朝,
- 9数列求和的三种特殊求法求例题 与 裂项相消的那种.错位相减那些.3种.-
- 10有三个颜色不同的茶杯,当把杯盖和杯子随机搭配时,颜色搭配正确的概率时多少
- 11已知p(x,y)是圆x^2+(Y-3)^2=1上的动点,定点A(2,0),B(-2,0),则PA*PB最大值是
- 12—It took me ten years to build up my business, and it almost
- 13级数∑[(-1)^(n-1)](x^n/n)的收敛区间,和函数
- 14He comes from America.变否定句、一般疑问句和提问
- 15—Tom is very stupid. He fails in every exam.
