氧化还原反应中Mn7+什么时候到Mn2+ 什么时候到Mno2
 琼海蜘蛛人2022-10-04 11:39:542条回答
琼海蜘蛛人2022-10-04 11:39:542条回答
已提交,审核后显示!提交回复
共2条回复
 lol999 共回答了20个问题
lol999 共回答了20个问题 |采纳率90%- MnO4-在酸性条件下通常直接被还原到Mn2+,在碱性条件下才被还原成MnO2.碱性条件下二价锰其实是以Mn(OH)2形式存在.至于PH达到具体何值为两个反应分界点,没有人考过,老师自己出题也不会给人钻空子,偏强调弱酸情况下MnO4-怎么反应的
- 1年前
 linkxp 共回答了12个问题
linkxp 共回答了12个问题 |采纳率- MnO4-溶液为酸性时得Mn2+ ,中性时得Mno2,碱性时得MnO42-
- 1年前
相关推荐
- 氧化还原反应定义是什么
 依然洋溢1年前2
依然洋溢1年前2 -
 skula019 共回答了17个问题
skula019 共回答了17个问题 |采纳率70.6%氧化还原反应是在反应前后元素的氧化数具有相应的升降变化的化学反应.在反应过程中有元素化合价变化的化学反应叫做氧化还原反应.1年前查看全部
- 氧化还原反应中,氧化剂的氧化性一定比还原剂强吗?
 foxd3021年前1
foxd3021年前1 -
 ytmfdht 共回答了17个问题
ytmfdht 共回答了17个问题 |采纳率100%这是一定的!氧化还原反应嘛!它既然是作为氧化剂,它主要就是表现出它的氧化性,那么它的氧化性就肯定强咯,同理还原剂就表现出还原性!那么氧化剂的氧化性就一定比还原剂强!这也是氧化还原反应的基础!1年前查看全部
- 氧化还原反应同种元素化合价只接近不交叉
 JIADE1年前2
JIADE1年前2 -
 chenyuw 共回答了17个问题
chenyuw 共回答了17个问题 |采纳率88.2%就是原来高价的反应后仍然是较高价1年前查看全部
- 氧化还原反应中,生成物中是否存在一个元素既有最高价态又有最低价态的情况?有的话请举下例子.
 我也有泪水1年前3
我也有泪水1年前3 -
 woshazi 共回答了18个问题
woshazi 共回答了18个问题 |采纳率94.4%3H2S+H2SO4=4S+4H2O1年前查看全部
- 氧化还原反应和离子反应的关系是什么?请详细说明.
 旭日东升john1年前2
旭日东升john1年前2 -
 SSix 共回答了17个问题
SSix 共回答了17个问题 |采纳率94.1%问题错的1年前查看全部
- 氧化还原反应中电子转移多少mol是什么意思?
 ttav1年前3
ttav1年前3 -
 天上星1 共回答了28个问题
天上星1 共回答了28个问题 |采纳率82.1%化学计算以mol为单位,一个方程式代表发生了1mol方程式,各个参与的化学物都反应的相应的摩尔数量.电子转移是指某一化学物化合价升降总数,列如,2H2+o2=2H2o的反应,氢氧元素的化合价都发生了变化,气宗H由0价变成正1价,4个氢原子4个电子,根据电荷守恒,氧原子得到了4个电子,两个氧原子变成-2价.所以,氧化还原反应的转移电子数目是指失去了多少电子或者得到了多少电子,上述例子中,氧化还原共转移了4个电子,切记不可二者相加1年前查看全部
- 氧化还原反应是放热反应吗
 chjy78111261年前3
chjy78111261年前3 -
 买单王子 共回答了17个问题
买单王子 共回答了17个问题 |采纳率94.1%大部分的是放热的,例如燃烧就是氧化反应,原因就是反应物的能量高于生成物的能量,而且,一般的化合反应都是放热的,但是有的不放热,例如一氧化碳与氧气在高温条件下生成碳和二氧化碳就是吸热反应1年前查看全部
- 氧化还原反应是不是反应前后的所有元素的化合价都要变化
氧化还原反应是不是反应前后的所有元素的化合价都要变化
请给几个例子 羽毛飘飘飞1年前3
羽毛飘飘飞1年前3 -
 xckdfui 共回答了18个问题
xckdfui 共回答了18个问题 |采纳率94.4%一不定的,单质间的化合反应中,全部生成单质的分解反应中,所有元素的化合价都变
其它反应中一般只有部分元素化合价变化,如置换反应中,只有单质元素的化合价变化,氢气还原氧化铜时,只有铜元素和氢元素的化合价变化,氧元素的化合价不变1年前查看全部
- 氧化还原反应中是不是化合价升高的就是失去电子的?降低的是得到?
 ww小小熊1年前2
ww小小熊1年前2 -
 mazuivv 共回答了22个问题
mazuivv 共回答了22个问题 |采纳率81.8%对1年前查看全部
- 氧化还原反应到底有什么用?如何判别一个物质它是氧化剂还是还原剂?
氧化还原反应到底有什么用?如何判别一个物质它是氧化剂还是还原剂?
非常感谢! 我随风笑1年前4
我随风笑1年前4 -
 ID被封了 共回答了15个问题
ID被封了 共回答了15个问题 |采纳率100%不是有没用的问题.
这种反映是最基本的反应.
判别一种物质是氧化剂还是还原剂要看它里面元素的化学价是升了还是降了.
升价的是还原剂,降价的是氧化剂.
但是一种物质如果有元素升价又有元素降价,它就既是还原剂又是氧化剂1年前查看全部
- 氧化还原判定的计算化合价问题例如co2 这样的化合价我会c是+4价要换到化学方程式里 根本问题就是要是2AgNo3计算N
氧化还原判定的计算化合价问题
例如co2 这样的化合价我会c是+4价
要换到化学方程式里 根本问题就是要是2AgNo3计算N的化合价 就是要问那个2的分子数算不算进化合价里?到底是+5价还是+11价呢?
一做那样要写出电子转移个数和判断氧化剂还原剂的一看到方程式化合物前面的个数就蒙住了,初中的知识我忘记了.麻烦解答下, yuki199010011年前3
yuki199010011年前3 -
 老吉他 共回答了11个问题
老吉他 共回答了11个问题 |采纳率90.9%2AgNo3计算N的化合价 物质中计算元素的化合价,那个2的分子数不算进化合价里 所以是+5价 化合价前后变化的总数时要乘以2即+10价1年前查看全部
- 氧化还原反应中要标明电子转移的方向和数目应使用“单线桥”还是“双线桥”呢?
 远走高飞lion1年前1
远走高飞lion1年前1 -
 尤利卡 共回答了17个问题
尤利卡 共回答了17个问题 |采纳率88.2%单线桥,双线桥都可以用
个人认为双线桥容易理解(针对同一元素的化合价变化.电子得失;写的时候箭头跨过中间的等号,反应物to生成物)
单线桥是不同元素间电子的转移(箭头是在反应物那边的,不跨过去;箭头由失电子的元素to得电子元素)1年前查看全部
- 氧化还原反应配平法不要复制的哦,尤其是系数问题,弄不懂.拿这个举例子10Cl2 + 10Ca(OH)2 = 7CaCl2
氧化还原反应配平法
不要复制的哦,尤其是系数问题,弄不懂.
拿这个举例子
10Cl2 + 10Ca(OH)2 = 7CaCl2 + Ca(ClO3)2 + 2Ca(ClO)2 + 10H2O 一二人1年前2
一二人1年前2 -
 piggystone 共回答了18个问题
piggystone 共回答了18个问题 |采纳率88.9%10Cl2 + 10Ca(OH)2 = 7CaCl2 + Ca(ClO3)2 + 2Ca(ClO)2 + 10H2O
化合价升:Cl 0---+1 升1*2 =2
Cl 0----+5升5*2=10 共升12 所以在 Ca(ClO3)2 ,Ca(ClO)2前各配1
化合价降:Cl 0------ -1 降1*2=2 所以在CaCl2前配6
再根据原子守恒在Cl2前配8,Ca(OH)2,H2O前配8
8Cl2 + 8Ca(OH)2 = 6CaCl2 + Ca(ClO3)2 + Ca(ClO)2 + 8H2O1年前查看全部
- 氧化还原反应 单线桥 用不用标出变价元素
氧化还原反应 单线桥 用不用标出变价元素
课本中的Na+Cl==的那个没有标出Na和Cl的化合价 但是双向桥的都标了化合价 请问到底用不用标化合价 桃花樱花1年前6
桃花樱花1年前6 -
 zhangyouda 共回答了24个问题
zhangyouda 共回答了24个问题 |采纳率91.7%可以不用标.如果是初学者建议标上,可以便于以后学习方程式的配平.1年前查看全部
- 氧化还原反应中 “归中而不交叉”是什么?
 人见人爱的猪1年前1
人见人爱的猪1年前1 -
 啊盐 共回答了25个问题
啊盐 共回答了25个问题 |采纳率72%氧化还原反应中 “归中而不交叉”是指同一种元素不同价态之间发生氧化还原反应时,高价态的元素化合价降低,低价态的元素化合价升高,其结果最终只能达到其化合价相同,而不能出现交叉.例如-1价的Cl与+7价的
Cl之间发生氧化还原反应,假如-1价的Cl氧化成+1价,则+7价的Cl的还原价态只能是+5、+3、+1,而不能是0价.若还原产物是+1价,则为归中.若还原产物是0价,则为交叉,故不能.假如是不同元素之间的氧化还原反应则没这个规则了.1年前查看全部
- 氧化还原反应中易变价的元素有什么呀?不易变价的呢?尽量全一点,
 灌水8881年前1
灌水8881年前1 -
 小盅 共回答了11个问题
小盅 共回答了11个问题 |采纳率90.9%常见的氧化剂还原剂呗
(1)典型的非金属单质如F2、O2、Cl2、Br2、I2、S等(其氧化性强弱与非金属活动性基本一致).
(2)含有变价元素的高价化合物,如KMnO4 KClO3 H2SO4 HNO3 MnO2 等.
(3)金属阳离子如:Fe3+、Cu2+、(H+)(在金属与酸、盐溶液的置换反应,如反应Fe+CuSO4=FeSO4+Cu中,实质上是Cu2+离子氧化Fe原子,Cu2+作氧化剂,Fe是还原剂)
常见的还原剂是在化学反应中易失电子被氧化的物质.
(1)典型的金属单质如:K、Ca、 Na、Mg等(其还原性强弱与金属活动性基本一致)
(2)某些非金属单质及其化合物如:H2、C、CO.
(3)有变价元素的最低价态化合物如:H2S、HI、HBr、HC
(4)非金属阴离子如:S2-、I-、Br-、Cl-
还有就是 高价氧化低价还 中间价态两边转1年前查看全部
- 关於过氧化物氧化还原反应的机理由於过氧化物大多具有强氧化性,如过氧化氢、过而硫酸盐等.尤其是过二硫酸盐,具有比高锰酸钾还
关於过氧化物氧化还原反应的机理
由於过氧化物大多具有强氧化性,如过氧化氢、过而硫酸盐等.尤其是过二硫酸盐,具有比高锰酸钾还强的氧化性.而过二硫酸根离子的还原产物是两个硫酸根离子,那麽这是否可以证明过氧化物的强氧化性实际上是来自于过氧键均裂所产生的自由基? 消然1年前1
消然1年前1 -
 coolcoffeecup 共回答了18个问题
coolcoffeecup 共回答了18个问题 |采纳率88.9%其实你自己就已给出答案了.
氧自由基、过氧自由基的氧化性都很强.1年前查看全部
- 氧化还原反应:若只氧化了,算不算氧化还原反应?
氧化还原反应:若只氧化了,算不算氧化还原反应?
若只氧化了,算不算氧化还原反应?
若只还原了,算不算氧化还原反应? sonic911年前3
sonic911年前3 -
 niub0 共回答了20个问题
niub0 共回答了20个问题 |采纳率95%氧化和还原必定同时发生1年前查看全部
- 氧化还原反应里的.【我会追加分的.】
氧化还原反应里的.【我会追加分的.】
把氯气通入氨水中,发生下述反应3Cl2+8NH3=6NH4Cl+N2,发生化学反应的氯气和氨气的分子数之比是 ,转移电子总数是 背氧化的氨气与发生反应的氨的质量比是
重要的是过程.我要学会怎么做. 红尘有你20081年前2
红尘有你20081年前2 -
 cxvcx111 共回答了16个问题
cxvcx111 共回答了16个问题 |采纳率93.8%3Cl2+8NH3=6NH4Cl+N2
发生化学反应的氯气和氨气的分子数之比是3:8
3CL2中6个CL由0价变为-1价 降低6价
8个NH3中只有2个NH3中的N由-3价变为0价 升高6价
所以转移电子总数是6个
背氧化的氨气 升高为的2个
发生反应的氨 总共的8个
2:8=1:41年前查看全部
- 氧化还原反应都是放热反应么?
 非常毛毛虫1年前1
非常毛毛虫1年前1 -
 正常登录 共回答了16个问题
正常登录 共回答了16个问题 |采纳率81.3%这种反应可以理解成由两个半反应构成,即氧化反应和还原反应.
复分解反应都不是氧化还原反应
置换反应都是氧化还原反应
有单质参加的化合反应一定是氧化还原反应(部分除外)
有单质生成的分解反应一定是氧化还原反应(部分除外,如次氟酸分2HFO==2HF+O2,化合价没有变化)
另外要注意,有单质参加反应的化学反应不一定是氧化还原反应,如氧气生成臭氧概念反应的本质是化合价有变化,即电子有转移.氧化数升高,即失电子的半反应是氧化反应;氧化数降低,得电子的反应是还原反应.化合价升高的物质还原对方,自身被氧化,因此叫还原剂,其产物叫氧化产物;化合价降低的物质氧化对方,自身被还原,因此叫氧化剂,其产物叫还原产物.即:
还原剂 + 氧化剂 ---> 氧化产物 + 还原产物
一般来说,同一反应中还原产物的还原性比还原剂弱,氧化产物的氧化性比氧化剂弱,这就是所谓“强还原剂制弱还原剂,强氧化剂制弱氧化剂”.凡例氢气与氯气的化合反应1年前查看全部
- 氧化还原反应中游参加的只是物质中的元素吗?
氧化还原反应中游参加的只是物质中的元素吗?
比如这个方程式:
3CL2+8NH3=6NH4CL+N2
当有160.5gNH4CL生成时,被氧化的氨气是多少克?
只有两个N被氧化,那么计算的时候要怎么在8NH3下面代入分子质量呢?
光代两个N的质量还是两个N+24个H?或者是其他的? 郑里1年前1
郑里1年前1 -
 我变我变我变变变 共回答了16个问题
我变我变我变变变 共回答了16个问题 |采纳率93.8%当然是以一个整体参加的,计算时要代入的是氨气1年前查看全部
- 氧化还原反应知识的学习,为我们研究化学物质和化学反应提供了新的视角.
氧化还原反应知识的学习,为我们研究化学物质和化学反应提供了新的视角.
(1)在氧化还原反应中,氧化剂______电子,发生______反应.
(2)理论上,处于最低价态的元素通常具有______性,在氧化还原反应中常作______剂.
(3)下列物质在氧化还原反应中,常作还原剂的有______;常作氧化剂的有______(均填序号).
①KMnO4②铝③氯水④FeCl3⑤一氧化碳⑥Na2S
(4)钠与水反应的化学方程式为______.
铁与水反应的化学方程式为______;在该反应中,若消耗3molFe,则转移的电子为______ mol.
事实证明,钠的还原性比铁的还原性(填“强”或“弱”)______. sushahui1年前1
sushahui1年前1 -
 smokedfish 共回答了19个问题
smokedfish 共回答了19个问题 |采纳率94.7%解题思路:(1)氧化还原反应中,氧化剂得电子被还原;
(2)处于最低价态的元素,能失去电子,化合价升高;
(3)元素处于高价态时具有氧化性,作氧化剂;处于较低价态时具有还原性,作还原剂;
(4)金属与水反应中,金属作还原剂,失去电子,由不同金属与水反应的程度可比较金属的还原性.(1)在氧化还原反应中,氧化剂得电子被还原,发生还原反应,故答案为:得;还原;
(2)因处于最低价态的元素,能失去电子,化合价升高,则具有还原性,常作还原剂,故答案为:还原;还原;
(3)②中Al为0价,⑤中C为+2价,⑥中S为-2价,均能失去电子,则可作还原剂,而①中Mn为+7价,③为Cl为0,④中Fe为+3价,均能得电子,常作氧化剂,
故答案为:②⑤⑥;①③④;
(4)钠与水的反应为2Na+2H2O=2NaOH+H2↑,而铁与水蒸气反应为3Fe+4H2O(g)
高温
.
Fe3O4+4H2,由电子守恒可知,得失电子数目相同,3molFe反应时生成4molH2,
转移的电子为4mol×2×(1-0)=8mol,Na与水反应剧烈,且反应在常温下就能发生,则钠的还原性比铁的强,
故答案为:2Na+2H2O=2NaOH+H2↑;3Fe+4H2O(g)
高温
.
Fe3O4+4H2;8;强.点评:
本题考点: 氧化还原反应;氧化还原反应的电子转移数目计算.
考点点评: 本题考查氧化还原反应,明确氧化还原反应中的基本概念、元素的化合价与物质的性质的关系即可解答,注意铁与水的反应条件及产物为解答的易错点,题目难度不大.1年前查看全部
- 氧化还原反应中的电子转移数目怎样确定啊?
 我不在意你绝迹1年前1
我不在意你绝迹1年前1 -
 xiebing123 共回答了18个问题
xiebing123 共回答了18个问题 |采纳率83.3%所有失去或得到电子之和! 快速配平氧化还原反应
氧化还原反应的配平是正确书写氧化还原反应方程式的重要步骤,它是中学化学教学中要培养学生的一项基本技能,同时氧化还原反应的配平也一直是高考考查的热点.考查氧化还原反应配平的试题,一般其难度都不低,因此,掌握较好的解题方法,快速、准确地进行配平是解决这类问题的关键.下面介绍两种简单、通用、快速、准确的配平方法.
一、电子守恒法
1、配平原理
发生氧化还原反应时,还原剂失去电子、氧化剂得到电子.因为整个过程的本质好比是还原剂把电子给了氧化剂,在这一失一得之间,电子守恒.故根据还原剂失去电子的数目和氧化剂得到电子的数目相等,结合二者化合价的改变情况,可以分别把氧化剂、还原剂的计量数计算出来,这样整个氧化还原反应就顺利配平了.
2、方法和步骤
①标出发生变化的元素的化合价,并确定氧化还原反应的配平方向.
在配平时,需要确定先写方程式那边物质的计量数.有时先写出方程式左边反应物的计量数,有时先写出方程式右边生成物的计量数.一般遵循这样的原则:
自身氧化还原反应→ 先配平生成物的计量数;
部分氧化还原反应 → 先配平生成物的计量数;
一般的氧化还原反应→既可先配平生成物的计量数,也可先配平反应物的计量数.
②列出化合价升降的变化情况.当升高或降低的元素不止一种时,需要根据不同元素的原子个数比,将化合价变化的数值进行叠加.
③根据电子守恒配平化合价变化的物质的计量数.
④根据质量守恒配平剩余物质的计量数.最终并根据质量守恒检查配平无误.
二、待定系数法
1、配平原理
质量守恒定律告诉我们,在发生化学反应时,反应体系的各个物质的每一种元素的原子在反应前后个数相等.通过设出未知数(如x、y、z等均大于零)把所有物质的计量数配平,再根据每一种元素的原子个数前后相等列出方程式,解方程式(组).计量数有相同的未知数,可以通过约分约掉.
2、方法和步骤
对于氧化还原反应,先把元素化合价变化较多的物质的计量数用未知数表示出来,再利用质量守恒吧其他物质的计量数也配平出来,最终每一个物质的计量数都配平出来后,根据某些元素的守恒,列方程解答.
快速配平七步法:
步骤一:分析化合价升降
步骤二:交换升降价数的系数
步骤三:过桥(双线桥)
步骤四:找到没有参加氧化还原反应的元素,并加入系数中.除(氧、氢)
步骤五:配平氢
步骤六:检查氧是否平 步骤七:完善(加反应条件、加等号、加上下箭头、约公约数)1年前查看全部
- 氧化还原反应中概念间的基本关系(1)失电子→_______→_______→_______→被氧化→_______(2)
氧化还原反应中概念间的基本关系
(1)失电子→_______→_______→_______→被氧化→_______
(2)_______→_______→_______→氧化剂→_______→_______ xungjie1年前2
xungjie1年前2 -
 小园春尽 共回答了20个问题
小园春尽 共回答了20个问题 |采纳率90%(1)失电子→___化合价升高____→___还原性____→___还原剂____→被氧化→___氧化产物____
(2)___得电子____→___化合价下降____→___氧化性____→氧化剂→___被还原____→___还原产物____1年前查看全部
- 氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于阴影部分的是
 solofly19821年前2
solofly19821年前2 -
 迟遇林 共回答了12个问题
迟遇林 共回答了12个问题 |采纳率83.3%选择 D
阴影部分表示:不是化合反应,不是分解反应,也不是置换反应的氧化还原反应
A、置换反应
B、分解反应
C、化合反应
D、正确.不是化合反应,不是分解反应,也不是置换反应,是氧化还原反应1年前查看全部
- 氧化还原反应我知道化合价升高是还原剂,化合价降低是氧化剂.就是在具体的化学方程式中不知道怎么看,有的时候还有酸根什么之类
氧化还原反应我知道化合价升高是还原剂,化合价降低是氧化剂.就是在具体的化学方程式中不知道怎么看,有的时候还有酸根什么之类的就更糊涂了.还望有一些好的方法提供.
不是太会氧化还原反应的配平,不知道有没有什么好诀窍、怎样计算电子转移个数这块比较混、
还有就是离子方程式,做了一些习题感觉有些和初中学的离子共存还是有差别的.有些地方很不一样感觉很怪.就是想问下怎样才能正确书写离子方程式,有什么秘诀.,
还有一个很疑惑就是:BaCo3 溶于硝酸,和Ba(HCo3)2溶液与盐酸,的离子方程式为什么不一样,同样都是H离子和碳酸根离子,H离子和碳酸氢根离子不共存,为什么离子方程式会不一样,一个是BaCo3+H 离子.一个是HCo3 +H 离子.我看到又好多,是同种离子不共存但是离子方程式不一样的.再比如CaCo3+Hcl和Na2Co3+HCL我觉得都是H离子和碳酸根离子不共存.为什么这两个的离子方程式不一样呢.
真的麻烦您帮我解答一下. 风信子_171年前1
风信子_171年前1 -
 不写作业 共回答了16个问题
不写作业 共回答了16个问题 |采纳率87.5%氧化还原反应中一般酸根的各元素的化合价不变,但如果SO32-被氧化到SO42-则其中的S元素化合价由+4价变为+6价,其他的还有亚硝酸根NO2-到硝酸根NO3-同理.
氧化还原反应的配平参考这里:http://baike.baidu.com/view/30896.html#14
离子方程式参考这里:http://baike.baidu.com/view/529175.htm#3
BaCO3和Ba(HCO3)2前者是碳酸根,后者是碳酸氢根,所以离子方程式就不一样
CaCO3难溶于水,所以离子方程式书写时不拆,即直接写CaCO3,而Na2CO3易溶于水,发生电离,电离出CO32-,所以拆开写,写CO32-,所以两者离子方程式不一样.1年前查看全部
- 氧化还原反应属于有机反应类型吗?
氧化还原反应属于有机反应类型吗?
那氧化反应与还原反应是有机反应类型吗? zz0071年前3
zz0071年前3 -
 barbarbar 共回答了13个问题
barbarbar 共回答了13个问题 |采纳率84.6%氧化还原反应有广义和狭义:
1.广义:广义的氧化还原反应包括有机反应‘而不是氧化还原反应属于有机反应
2.狭义:狭义的氧化还原反应应该拆开才属于有机反应,即有机反应中的氧化反应和还原反应,其中氧化反应是加氧去氢,其中还原反应是去氢加氧1年前查看全部
- 氧化还原反应,还原反应,氧化反应三者区别
 134804254221年前2
134804254221年前2 -
 Cherry_liyun 共回答了17个问题
Cherry_liyun 共回答了17个问题 |采纳率94.1%氧化与还原是一对形影不离的兄弟,有氧化就会有还原,尼说的氧化反应或者还原反应其实根本就是错误的表述,没有单纯的氧化或者还原.
给尼据个很简单的例子吧
2H2+o2=2H2o,其中氢气是还原计被氧化,化合价升高(0->1)氧气是氧化剂被还原,化合价降低(0->(-2))1年前查看全部
- 氧化还原反应中,水既作氧化剂又作还原剂的反应?
 ltjdcy1年前3
ltjdcy1年前3 -
 玻璃杯321 共回答了19个问题
玻璃杯321 共回答了19个问题 |采纳率89.5%水的电解
2H2O=2H2+O2
在这个反应中水既作氧化剂又作还原剂1年前查看全部
- 氧化还原反应中,生成物元素化合价既没有升高,也没有降低,是氧化产物还是还原产物?
氧化还原反应中,生成物元素化合价既没有升高,也没有降低,是氧化产物还是还原产物?
3 ( N H 4 ) 2 S O 4 = 3 S O 2 ↑ + 6 H 2 O + N 2 ↑ + 4 N H 3 ↑其中氨气和水的化合价没发生变化,那么它是氧化产物还是还原产物? easonfans1年前3
easonfans1年前3 -
 悠悠214 共回答了27个问题
悠悠214 共回答了27个问题 |采纳率92.6%这个反应就不是氧化还原反应.在氧化还原反应中,有元素化合价升高,则必有元素化合价下降.否则不满足得失电荷守恒的规律.当然,可能是同一种元素化合价有升高也有降低,这是可以的.
有个别特殊情况:歧化反应,归中反应
与这个类似:在KClO3中,一部分氯(Ⅴ)被氧化为氯(Ⅶ)(ClO2);另一部分被还原为氯(I)(Cl).发生歧化反应的原因是由于该元素具有高低不同的氧化态,可以在适宜的条件下同时向较高和较低的氧化态转化 在氯酸溶液中Cl一部分被还原为Cl(+4价),一部分被氧化为Cl(+7价)3HClO3=HClO4+2ClO2+H2O (参考氯酸)是个歧化反应1年前查看全部
- 氧化还原反应所有口诀所有的,记清概念
 浪人我是1年前1
浪人我是1年前1 -
 Google测试员4434 共回答了16个问题
Google测试员4434 共回答了16个问题 |采纳率81.3%升失氧,降得还,若是剂正相反
升失氧:化合价升高的是发生氧化反应
降得还:化合价降低的是发生还原反应
若是剂正相反:化合价升高的元素所对应的物质为还原剂,化合价降低的元素所对应的物质为氧化剂1年前查看全部
- 氧化还原里有一句规律是“单质的氧化性越强离子的还原性越弱”,怎么不都比氧化性呢,如果这样说“单质的氧化性越强离子的还原性
氧化还原里有一句规律是“单质的氧化性越强离子的还原性越弱”,怎么不都比氧化性呢,如果这样说“单质的氧化性越强离子的还原性越强”可以吗
 tt家的小少爷1年前3
tt家的小少爷1年前3 -
 gisele75 共回答了20个问题
gisele75 共回答了20个问题 |采纳率90%“单质的氧化性越强离子的还原性越弱”是因为单质有氧化性本身被还原成了离子,因此这个离子只有还原性,你最后一句话是不是打错了,应该是“单质的氧化性越弱离子的还原性越强”1年前查看全部
- 氧化还原反应规律中 化合价不交叉规律什么意思
 独占丘比特1年前2
独占丘比特1年前2 -
 405685892 共回答了19个问题
405685892 共回答了19个问题 |采纳率100%不同价态的同种元素间发生氧化还原反应,其结果是两种价态只能相互靠近或最多达到相同的价态,而决不会出现高价态变低、低价态变高的交叉现象.
例如:C+CO2=2CO 反应物中C元素分别为0和+4价,而生成物中只含有一种+2价的C元素,不能也不可能生成比0价小或比+4价大的价态.同理,SO2+2H2S=3S↓+2H2O 也一样.
不知道你能不能看的懂
氧化还原反应在高中化学中算是很难的了,加油,好好学1年前查看全部
- 氧化还原反应一定要有氧化物和还原物吗
 hsw66651年前3
hsw66651年前3 -
 yes88996 共回答了22个问题
yes88996 共回答了22个问题 |采纳率90.9%是的,氧化还原反应就要有电子的得失(转移),必须有化合价升降,依据升失还原剂,降得氧化剂来判断,要是氧化还原反应,就必须要有氧化物和还原物,1年前查看全部
- 氧化还原反应中一些化合价的变化有一些有些难以理解譬如NaH+H2O+NaOH+H2这里的变价元素是H,正确的是H2O的两
氧化还原反应中一些化合价的变化
有一些有些难以理解譬如
NaH+H2O+NaOH+H2
这里的变价元素是H,正确的是H2O的两个+1H变为了H2的O价H,NaH的-1H变为了NaOH的+1H,可为什么不可以是H2O中的一个H没变价,另一个变为了H2的,而NaH中的一个H也变为了H2的呢,这里的变价存在什么规则吗 piaolingye1191年前4
piaolingye1191年前4 -
 yaya_yy 共回答了18个问题
yaya_yy 共回答了18个问题 |采纳率100%你这个问题貌似问反了吧.你前面说的正确的那个是错误的.后面那个你的疑问才是正确的啊.这个关系到H离子周围电子所处层级问题.高中的物理还是化学书上有说,你去找找看哈.1年前查看全部
- 氧化还原反应中这个化合价的变化到底是指什么?
氧化还原反应中这个化合价的变化到底是指什么?
RT 有些元素只有一种化合价 像在反应:FeS + 2HCl=FeCl2 +H2S 中HCl 反应前H是+1 Cl+1 反应后还是没变啊?我觉得怪怪的 好不爽 我要疯了 fjkobi1年前2
fjkobi1年前2 -
 langrenking 共回答了20个问题
langrenking 共回答了20个问题 |采纳率95%复分解反应 不改变化合价 就想你和你朋友换个妻子一样.1年前查看全部
- 氧化还原反应中电子发生转移的数目
氧化还原反应中电子发生转移的数目
比如2KCLO3=KCL+302中0以及CL转移的数目怎么求 S49523291年前1
S49523291年前1 -
 白果冻2 共回答了22个问题
白果冻2 共回答了22个问题 |采纳率81.8%KCLO3中Cl带+5价,而KCl中Cl带-1价,2个KCLO3不就是转移得到了12mol电子么?另外可以通过氧元素来求,在KCLO3氧元素是-2价,而氧气中是0价,3个氧气分子有6个氧原子,不就是失去了12mol电子么?1年前查看全部
- 氧化还原反应和置换反应什么关系,和其他三大基本反映呢?
 疏影横斜lee1年前0
疏影横斜lee1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 氧化还原反应方程式的配平
 冷雪LENGXUE1年前5
冷雪LENGXUE1年前5 -
 fgs212gd 共回答了14个问题
fgs212gd 共回答了14个问题 |采纳率78.6%首先,搞清楚谁失电子谁得电子;然后,再搞清楚几个原子失几个原子得.
例如:
-(NH4)2PtCl6= - Pt+ - NH4Cl+ - HCl+ - N2↑
①标出各元素化合价,对比方程式前后同种元素化合价的变化.
②经过对比,不难发现:N的化合价由—3价变为0价,因此失三个电子:Pt的化合价由+4价变为0价,所以得四个电子.
③要将此方程式配平,需要得失电子数相等.N2(分子)由两个N(原子)构成,且由②知N(原子)失三个电子,所以N2(分子)失3×2=6个电子;在方程式中只有一个Pt原子得电子,所以由②知Pt得4个电子.求得6和4的最小公倍数为12,则Pt的系数为3(4×3=12),N2的系数为2(6×2=12).可得:-(NH4)2PtCl6= 3 Pt+ - NH4Cl+ - HCl+ 2 N2↑
④根据质量守恒定律,进一步配平其他系数(后面的初中就学过了,我就不废话了).
最终得:3(NH4)2PtCl6= 3 Pt+ 2 NH4Cl+ 16 HCl+ 2 N2↑1年前查看全部
- 氧化还原反应中化合价无变化的是什么反应
 我and你1年前1
我and你1年前1 -
 郁闷的mm 共回答了22个问题
郁闷的mm 共回答了22个问题 |采纳率81.8%既然是氧化还原反应一定有化合价变化
氧化剂 得电子 化合价降低 被还原 发生还原反应
还原剂 失电子 化合价升高 被氧化 发生氧化反应1年前查看全部
- 氧化还原反应中,已知还原性:I—>Fe2+>Br—
氧化还原反应中,已知还原性:I—>Fe2+>Br—
①在FeI2溶液中通入少量Cl2
②在FeI2溶液中通入过量Cl2
③在FeBr2溶液中通入少量Cl2
④在FeBr2溶液中通入过量Cl2
⑤当FeBr2溶液中有一半Br—变成Br2时 峰回路也转1年前1
峰回路也转1年前1 -
 dwq876 共回答了11个问题
dwq876 共回答了11个问题 |采纳率81.8%方程式吗?
先和还原性强的反应,所以1、Cl2+2I-=I2+2Cl-
2、都被氧化了,所以2Fe2++Cl2=2Fe3++2Cl-,再把1中的方程式和这个相加,就是2的总反应式,实际上2可以看作是1的下一步反应,就是氯气把碘离子都氧化完了,接着氧化二价铁离子;
3、先氧化二价铁离子,同2中的方程式,
4、都被氧化了,把二价铁离子氧化完了,氧化溴离子,所以,2中的方程式加上Cl2+2Br-=Br2+2Cl-就是总反应式了
5、一半变成溴单质,就是说二价铁离子已经被氧化完了,1molFe2+需要0.5molCl2,1molFe2+对应2molBr-,有一半被氧化就说明,1molBr-被氧化,需要0.5molCl2,所以方程式为
2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-,注意反应方程式中各离子的物质的量关系就行了
一定要写离子方程式,写化学方程式很麻烦的,而且高考题中也只是要求写出离子方程式,甚至是能选出正确答案就可以了.
有不明白的,还可以再联系我,我是重点高中的化学老师哦!1年前查看全部
- 氧化还原反应请问想用双线桥法来表示2FeCl2+Cl2==2FeCl3中电子的转移,应该在哪两种元素之间画箭头?
 xiamoliq1年前3
xiamoliq1年前3 -
 dongyong4150 共回答了26个问题
dongyong4150 共回答了26个问题 |采纳率100%2个Fe2+失2e-变成2个Fe3+
Cl2得2e-变成2个Cl-1年前查看全部
- 氧化还原反应电子转移物质的量的计算
氧化还原反应电子转移物质的量的计算
方程式为 3Cu2O+14HNO3═2NO↑+6Cu(NO3)2+7H2O
反应中若产生0.2mol气体,则转移的电子的物质的量是______mol.
不知道亲们可不可以说的详细一点、、、 还可以吗1年前2
还可以吗1年前2 -
 重楼x 共回答了20个问题
重楼x 共回答了20个问题 |采纳率100%要从硝酸生成一氧化氮,要从+5价降价为+2价 生成1摩尔的一氧化氮转移3摩电子,那么生成0.2摩的一氧化氮气体 ,电子转移0.6摩
注意,不是所有氮元素的化合价都降低的,还有一部分化合价没有变化.
我们只找变化那一部分1年前查看全部
- 氧化还原反应在生产、生活中具有广泛的用途,下列生产生活中的事例不属于氧化还原反应的是( )
氧化还原反应在生产、生活中具有广泛的用途,下列生产生活中的事例不属于氧化还原反应的是( )
A. 金属冶炼
B. 燃放鞭炮
C. 食物腐败
D. 用汽油除去油污 rxtxsd1年前1
rxtxsd1年前1 -
 zbsw 共回答了13个问题
zbsw 共回答了13个问题 |采纳率92.3%解题思路:有化合价变化的反应属于氧化还原反应,没有元素的化合价变化的反应不属于氧化还原反应.A、金属冶炼中金属的化合价降低,则发生氧化还原反应,故A不选;
B、燃放鞭炮中涉及燃烧反应,则发生氧化还原反应,故B不选;
C、食物腐败是发生的缓慢氧化反应,氧元素的化合价降低,故C不选;
D、用汽油除去油污没有发生化学变化,是相似相溶原理的应用,故D选;
故选D.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查生活中常见的反应,明确有元素的化合价变化的反应是氧化还原反应,没有新物质生成的变化属于物理变化即可解答.1年前查看全部
- 氧化还原反应是有元素化合价发生改变的化学反应,氧化还原反应的本质是______.在氧化还原反应中,还原剂______电子
氧化还原反应是有元素化合价发生改变的化学反应,氧化还原反应的本质是______.在氧化还原反应中,还原剂______电子,本身发生______反应.Na2O2中氧元素化合价为-1价,根据氧化还原反应的知识可以推知Na2O2既有______性又有______性.Na2O2和KMnO4的H2SO4溶液反应,生成Na2SO4,MnSO4,K2SO4,O2和水,在这个反应中氧化剂为______,还原剂为______.
 想有个名字1年前1
想有个名字1年前1 -
 memphis_d 共回答了22个问题
memphis_d 共回答了22个问题 |采纳率86.4%解题思路:氧化还原反应的实质为电子转移,还原剂失去电子,被还原;处于中间价态的微粒,既能失去电子也能得到电子;Na2O2和KMnO4的H2SO4溶液反应为5Na2O2+2KMnO4+8H2SO4=5Na2SO4+2MnSO4+K2SO4+5O2↑+8H2O,Mn元素的化合价降低,过氧化钠中O元素的化合价升高,以此来解答.氧化还原反应的实质为电子转移,还原剂失去电子,被还原,发生还原反应;Na2O2中氧元素化合价为-1价,既能失去电子也能得到电子,则既有氧化剂也有还原性;Na2O2和KMnO4的H2SO4溶液反应为5Na2O2+2KMnO4+8H2SO4=5Na2SO4+2MnSO4+K2SO4+5O2↑+8H2O,Mn元素的化合价降低,过氧化钠中O元素的化合价升高,所以氧化剂为KMnO4,还原剂为Na2O2,
故答案为:电子转移;失去;还原;氧化;还原;KMnO4;Na2O2.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念的考查,注意元素化合价与微粒性质的关系,题目难度不大.1年前查看全部
- 氧化还原反应与四种基本反应类型的关系如下图所示,则下列化学反应属于区域3的是
氧化还原反应与四种基本反应类型的关系如下图所示,则下列化学反应属于区域3的是
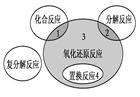
A.4Fe(OH) 2 +O 2 +2H 2 O=4Fe(OH) 3 B.2KMnO 4  K 2 MnO 4 +MnO 2 +O 2 ↑
K 2 MnO 4 +MnO 2 +O 2 ↑C.4NH 3 +5O 2  4NO+6H 2 O
4NO+6H 2 OD.Fe+CuSO 4 =FeSO 4 +Cu  艾上木子1年前1
艾上木子1年前1 -
 草马束木 共回答了17个问题
草马束木 共回答了17个问题 |采纳率82.4%C
1年前查看全部
- 氧化还原反应 元素化合价升降总数相等 这句话怎么理解
氧化还原反应 元素化合价升降总数相等 这句话怎么理解
请先说说:H2O中 我们说氢的化合价应为+1还是+2?
然后请从下面两个例子分析:一:3CO+ Fe2O3 =高温= 2Fe + 3CO2 碳酸素由+2到+4 铁元素由+3到+2 那么氧元素呢?
二:2Al+6HCl=2AlCl3+3H2 (具体说明三种元素化合价是怎么变化的)
我们说AlCl3中 Cl元素的化合价是-1还是-3呢? 只影无心1年前1
只影无心1年前1 -
 飞龙11 共回答了23个问题
飞龙11 共回答了23个问题 |采纳率91.3%从电子得失或偏移数量去理解较容易,升价数:失电子或电子偏离自己数.
化合结是元素的化合价,不能从原子个数去分析.氯元素化合阶是负一价,三个氯原子可得到3个电子.1年前查看全部
- 氧化还原反应方程式如何配平?求教配平方法,像复杂一点的P+CuSO4+H2O---Cu3P(Cu为+1价)+H3PO4+
氧化还原反应方程式如何配平?
求教配平方法,
像复杂一点的P+CuSO4+H2O---Cu3P(Cu为+1价)+H3PO4+H2SO4怎样来配?
能教一下方程式配平的一些重要方法吗,除了观察法.一些复杂的方程式该用什么方法来配? yongling32351年前1
yongling32351年前1 -
 良震 共回答了17个问题
良震 共回答了17个问题 |采纳率94.1%一、配平原则
由于在氧化还原反应里存在着电子的转移,因此元素的化合价必然有升有降,我们把化合价能升高的元素或含该元素的物质称还原剂;反之称为氧化剂.由氧化还原反应的知识我们不难得出配平原则:还原剂失电子总数=氧化剂的电子总数,即还原剂(元素)化合价升高的总价数=氧化剂(元素)化合价降低的总价数.
二、氧化还原反应方程式配平的一般方法与步骤
1、一般方法:从左向右配.
2、步骤:标变价、找变化、求总数、配系数.即
⑴ 标出变化元素化合价的始态和终态;
⑵ 始态 终态 变化的总价数 = 变化 × 系数
注:假设以上变化均以正价表示,其中(b-a)×(d-c) 为最小公倍数.
⑶ 将 上的系数,分别填在还原剂和氧化剂化学式的前面作为系数;
⑷ 用观察法配平其它元素;
⑸ 检查配平后的方程式是否符合质量守恒定律(离子方程式还要看是否符合电荷守恒)
例1、 C + HNO3(浓)- NO2 + CO2 + H2O
分析:⑴标变价
C(0) + HN(+5)O3(浓)- N(+4)O2 + C(+4)O2 + H2O
⑵ 找变化
始态 终态 变化的总价数 = 变化 × 系数
⑶ 求总数
1 × 4 = 4
⑷ 配系数
C 的系数为 1 HNO3的系数为 4 ,用观察法将其它系数配平
后,经检查满足质量守恒定律.配平后的化学方程式为:
C + 4 HNO3(浓)= 4 NO2 + CO2 + 2 H2O
三、氧化还原反应配平的特殊技巧.
1、从右向左配平法
例2、Cu + HNO3(浓)- Cu(NO3)2 + NO2 + H2O
分析:由于HNO3在反应中有两个作用即酸性和氧化性,因此如按照一般的方法从左向右配的话比较麻烦,但如采用从右向左配平法的方法,这个问题显得很简单.
不同之处:配系数时只需将 中的系数先写在对应产物化学式之前,其它步骤相同.
始态 终态 变化的总价数 = 变化 × 系数
Cu + 4 HNO3(浓)= Cu(NO3)2 +2 NO2 + 2H2O
总结使用范围:此法最适用于某些物质(如硝酸、浓硫酸的反应)部分参加氧化还原反应的类型.
2、整体总价法(零价法)
适用范围:在氧化还原反应中,一种反应物中有两种或两种以上的元素化合价发生变化或几种不同物质中的元素化合价经变化后同存在于一种产物中.
技巧:把该物质当成一个“整体”来考虑.
例3、FeS2 + O2 — Fe2O3 + SO2
分析:在FeS2 中Fe的化合价由+2变到+3,S的化合价由-1变到+4,即同一种物质中有两种元素的化合价同时在改变,我们可以用整体总价法,把FeS2当成一个“整体”来考虑.
故 4FeS2 +11 O2 =2 Fe2O3 +8 SO2
3、歧化归一法
适用范围:同种元素之间的歧化反应或归一反应.
技巧:第三种价态元素之前的系数等于另两种元素价态的差值与该价态原子数目的比值.
例4、Cl2 + KOH — KCl + KClO + H2O
分析:在氧化还原反应中,电子转移只发生在氯元素之间,属于歧化反应.
0 -1 +5
Cl2 + KOH — KCl + KClO3 + H2O
Cl2 的系数为6/2=3 KCl的系数为5 KClO3的系数为1
故 3Cl2 + 6KOH = 5KCl + KClO3 +3 H2O
4、判断未知物
顾名思义,在一个氧化还原反应中缺少反应物或生成物.
技巧:一般是把反应物和生成物中的所有原子进行比较,通过观察增加或减少了哪种元素:
①若增加的元素是除H、O以外的非金属,未知物一般是相应的酸;
②若增加的元素是金属,未知物一般是相应的碱;
③若反应前后经部分配平后发现两边氢、氧原子不平衡,则未知物是水.
例5、KMnO4 + KNO2 + — MnSO4 + K2SO4 + KNO3 + H2O
分析:经比较发现,生成物中增加了S元素,则未知物是H2SO4 ,其它步骤同上略.
2KMnO4 + 5KNO2 + 3 H2SO4 = 2MnSO4 + K2SO4 + 5KNO3 + 3H2O
5、单质后配法
适用范围:反应物或生成物中有单质参加或单质生成,如有机物的燃烧
都可用此法.
技巧:把游离态的那种元素放在最后来配.
例6、FeS2 + O2 — Fe2O3 + SO2
分析:反应物中有单质O2 ,我们可以把O元素放在最后来配.首先假定
Fe2O3的系数为1,则FeS2 的系数为2,那么SO2的系数为4,因此O2的系数为11/2,然后把每种物质前的系数都扩大2倍,即可配平.
4FeS2 +11 O2 =2 Fe2O3 +8 SO2
6、待定系数法
技巧:将各种物质的系数分别设为不同的未知数,然后根据质量守恒定律列方程求解最后配平.
7、加合法
技巧:把某个复杂的反应看成是某几个反应的叠加而成.
例7、Na2O2 + H2O — NaOH + O2
分析:我们可把这个反应看成是以下两个反应的叠加:
Na2O2 + 2H2O = 2NaOH + H2O2 ①
2H2O2 = 2H2O + O2 ②
把①× 2+ ② ,最后我们得到:2Na2O2 +2 H2O = 4NaOH + O2
总结:从以上示例我们发现,对于同一氧化还原反应,有时可采用不同的方法来配平,也有时用几种方法综合应用.总之,只要我们能掌握以上技巧,配平氧化还原反应方程式会易如反掌.
P+CuSO4+H2O---Cu3P+H3PO4+H2SO4
P 化合价变化:0----〉-1(Cu3P中)
0---〉+5
Cu2+变化 :+2----〉+1
化合价升高的是P 0---〉+5
降低的:P与Cu
可见: 生成一个Cu3P 总共降低 6价
生成一个H3PO4升高 5 价
可知Cu3P 与H3PO4系数比应该是5:6
初步得到: P+CuSO4+H2O==5Cu3P+6H3PO4+H2SO4
再由观察法配出: 9P+15CuSO4+24H2O===5Cu3P+6H3PO4+15H2SO41年前查看全部
- 氧化还原反应和非氧化还原反应有先后顺序吗
氧化还原反应和非氧化还原反应有先后顺序吗
比如说 Fe Fe2O3 Cuo 与HCI反应的先后顺序是怎样的?
还是根本没有顺序同时进行? 海漂一男1年前2
海漂一男1年前2 -
 xyfkid 共回答了22个问题
xyfkid 共回答了22个问题 |采纳率86.4%其实这个完全不用考虑啊,首先你要列出来谁和谁能反应.比如你的列子.毫无疑问,CUO肯定最后,因为反应了也会被铁置换出来.然后是Fe和Fe2O3,反应可以算是同步的.如果是带锈的铁片的话,肯定是三氧化二铁然后再是铁,如果是三氧化二铁和铁片一起放的话会同时反应的,如果盐酸超量,那么最后才会和氧化铜反应.记住啊,能置换的最后才反应,因为即使反应了也会被置换出来1年前查看全部
大家在问
- 1this kind of phone is___(fashion)at this time i sleep with t
- 2小红在实验室做“观察水的沸腾”实验时(如图),记录的实验数据如下表:
- 3如果我能在做一次小学生 作文
- 4一个质量是60kg的人从墙上跳下,以7m/s的速度着地,与地面接触0.1s停下来,地面对他的作用力多大?
- 5用括号内所给动词的适当形式填空。(5分,每空1分。)
- 6一定温度下,将2molA、2molB、2molC的气体混合物充入一体积不变的密闭容器中,充分反应后恢复到起始温度,测得容
- 7拉面中的数学,王师傅先把面团搓成1.6米长的圆柱形面棍,对折,再拉长到1.6米,,这样对折8次,再拉长到1.6米,就做成
- 8已知a(a-1)-(a的平方-b)=5,求2分之a的平方+b的平方-ab的值
- 9中国汉字博大精深,自然也无奇不有,让我们翻译下下面的文字吧!
- 102克氢气所占体积约为22.4L判断正确的是.A 加热前后一样多 B 加热前消耗的多
- 11如图,在三角形ABC中,∠BAC=120°,以BC为边向形外做等边三角形BCD,把三角形ABD绕着点D按顺时针方向旋转6
- 12Do you want some milk?对吗
- 131、函数y=sinx-cosx的值域是?周期是?奇偶性?
- 14为什么在四个冲程内燃机中减少废气带走的热量可以大大提高热机的效率?
- 15在比例尺是1比2000000的地图上,量的甲城到乙城的距离是32cm.如果一辆汽车以每小时64km的速度从甲城开往乙城,
