碳酸钙、盐酸、氯化钙、碳酸的化学表达式怎么写?
 Madmarine2022-10-04 11:39:543条回答
Madmarine2022-10-04 11:39:543条回答谁能帮忙写几个九年级上化学常见的类似于这个的化学表达式.

已提交,审核后显示!提交回复
共3条回复
 高山飞瀑 共回答了24个问题
高山飞瀑 共回答了24个问题 |采纳率95.8%- 化学表达式就是化学式吧
依次为
CaCO3
HCL
CaCL2
H2CO3
先熟悉元素周期表和化合价 然后按名字写就行了
举几个例子
检举
氧气 O2
氢气 H2
氮气 N2
氯气 Cl2
氧化镁 MgO
二氧化碳 CO2
氯化氢 HCl
氢氧化钠NaOH
碳酸钙 CaCO3
硫酸铜 CuSO4
硝酸银 AgNO3
氯化钠 NaCl
氯化铝 AlCl3
碳酸氢钠 NaHCO3
碳酸氢铵 NH4HCO3
高锰酸钾 KMnO4
二氧化锰 MnO2
甲烷 CH4
乙醇 /酒精 C2H5OH
水(一氧化二氢) H2O
铁Fe
碳酸钠Na2CO3
双氧水H2O2
铜Cu
碳酸根(CO3)硫酸根(SO4) 硝酸根(NO3) 氢氧根(OH) 铵(ǎn)根(NH4)
氢气 碳 氮气 氧气 磷 硫 氯气 (非金属单质)
H2 C N2 O2 P S Cl2
钠 镁 铝 钾 钙 铁 锌 铜 钡 钨 汞 (金属单质)
Na Mg Al K Ga Fe Zn Cu Ba W Hg
水 一氧化碳 二氧化碳 五氧化二磷 氧化钠 二氧化氮 二氧化硅
H2O CO CO2 P2O5 Na2O NO2 SiO2
二氧化硫 三氧化硫 一氧化氮 氧化镁 氧化铜 氧化钡 氧化亚铜
SO2 SO3 NO MgO CuO BaO Cu2O
氧化亚铁 三氧化二铁(铁红) 四氧化三铁 三氧化二铝 三氧化钨
FeO Fe2O3 Fe3O4 Al2O3 WO3
氧化银 氧化铅 二氧化锰 (常见氧化物)
Ag2O PbO MnO2
氯化钾 氯化钠(食盐) 氯化镁 氯化钙 氯化铜 氯化锌 氯化钡 氯化铝
KCl NaCl MgCl2 CaCl2 CuCl2 ZnCl2 BaCl2 AlCl3
氯化亚铁 氯化铁 氯化银 (氯化物/盐酸盐)
FeCl2 FeCl3 AgCl
硫酸 盐酸 硝酸 磷酸 硫化氢 溴化氢 碳酸 (常见的酸)
H2SO4 HCl HNO3 H3PO4 H2S HBr H2CO3
硫酸铜 硫酸钡 硫酸钙 硫酸钾 硫酸镁 硫酸亚铁 硫酸铁
CuSO4 BaSO4 CaSO4 KSO4 MgSO4 FeSO4 Fe2 (SO4)3
硫酸铝 硫酸氢钠 硫酸氢钾 亚硫酸钠 硝酸钠 硝酸钾 硝酸银
Al2(SO4)3 NaHSO4 KHSO4 NaSO3 NaNO3 KNO3 AgNO3
硝酸镁 硝酸铜 硝酸钙 亚硝酸钠 碳酸钠 碳酸钙 碳酸镁
MgNO3 Cu(NO3)2 Ca(NO3)2 NaNO3 Na2CO3 CaCO3 MgCO3
碳酸钾 (常见的盐)
K2CO3
氢氧化钠 氢氧化钙 氢氧化钡 氢氧化镁 氢氧化铜 氢氧化钾 氢氧化铝
NaOH Ca(OH)2 Ba(OH)2 Mg(OH)2 Cu(OH)2 KOH Al(OH)3
氢氧化铁 氢氧化亚铁(常见的碱)
Fe(OH)3 Fe(OH)2
甲烷 乙炔 甲醇 乙醇 乙酸 (常见有机物)
CH4 C2H2 CH3OH C2H5OH CH3COOH
碱式碳酸铜 石膏 熟石膏 明矾 绿矾
Cu2(OH)2CO3 CaSO4?2H2O 2 CaSO4?H2O KAl(SO4)2?12H2O FeSO4?7H2O
蓝矾 碳酸钠晶体 (常见结晶水合物)
CuSO4?5H2O Na2CO3?10H2O
尿素 硝酸铵 硫酸铵 碳酸氢铵 磷酸二氢钾 (常见化肥)
CO(NH2)2 NH4NO3 (NH4)2SO4 NH4HCO3 KH2PO4
沉淀:
红褐色絮状沉淀--------Fe(OH)3
浅绿色沉淀------------Fe(OH)2
蓝色絮状沉淀----------Cu(OH)2
白色沉淀--------------CaCO3,BaCO3,AgCl,BaSO4,(其中BaSO4、AgCl是不溶于 HNO3的白色沉淀,CaCO3 BaCO3是溶于HNO3 的白色沉淀),Mg(OH)2.
淡黄色沉淀(水溶液中)----S
微溶于水------------Ca(OH)2,CaSO4
初中化学方程式汇总
一、 氧气的性质:
(1)单质与氧气的反应:(化合反应)
1. 镁在空气中燃烧:2Mg + O2 点燃 2MgO
2. 铁在氧气中燃烧:3Fe + 2O2 点燃 Fe3O4
3. 铜在空气中受热:2Cu + O2 加热 2CuO
4. 铝在空气中燃烧:4Al + 3O2 点燃 2Al2O3
5. 氢气中空气中燃烧:2H2 + O2 点燃 2H2O
6. 红磷在空气中燃烧(研究空气组成的实验):4P + 5O2 点燃 2P2O5
7. 硫粉在空气中燃烧: S + O2 点燃 SO2
8. 碳在氧气中充分燃烧:C + O2 点燃 CO2
9. 碳在氧气中不充分燃烧:2C + O2 点燃 2CO
(2)化合物与氧气的反应:
10. 一氧化碳在氧气中燃烧:2CO + O2 点燃 2CO2
11. 甲烷在空气中燃烧:CH4 + 2O2 点燃 CO2 + 2H2O
12. 酒精在空气中燃烧:C2H5OH + 3O2 点燃 2CO2 + 3H2O
(3)氧气的来源:
13.玻义耳研究空气的成分实验 2HgO 加热 Hg+ O2 ↑
14.加热高锰酸钾:2KMnO4 加热 K2MnO4 + MnO2 + O2↑(实验室制氧气原理1)
15.过氧化氢在二氧化锰作催化剂条件下分解反应: H2O2 MnO22H2O+ O2 ↑(实验室制氧气原理2)
二、自然界中的水:
16.水在直流电的作用下分解(研究水的组成实验):2H2O 通电 2H2↑+ O2 ↑
17.生石灰溶于水:CaO + H2O == Ca(OH)2
18.二氧化碳可溶于水: H2O + CO2==H2CO3
三、质量守恒定律:
19.镁在空气中燃烧:2Mg + O2 点燃 2MgO
20.铁和硫酸铜溶液反应:Fe + CuSO4 === FeSO4 + Cu
21.氢气还原氧化铜:H2 + CuO 加热 Cu + H2O
22. 镁还原氧化铜:Mg + CuO 加热 Cu + MgO
四、碳和碳的氧化物:
(1)碳的化学性质
23. 碳在氧气中充分燃烧:C + O2 点燃 CO2
24.木炭还原氧化铜:C+ 2CuO 高温 2Cu + CO2↑
25. 焦炭还原氧化铁:3C+ 2Fe2O3 高温 4Fe + 3CO2↑
(2)煤炉中发生的三个反应:(几个化合反应)
26.煤炉的底层:C + O2 点燃 CO2
27.煤炉的中层:CO2 + C 高温 2CO
28.煤炉的上部蓝色火焰的产生:2CO + O2 点燃 2CO2
(3)二氧化碳的制法与性质:
29.大理石与稀盐酸反应(实验室制二氧化碳):
CaCO3 + 2HCl == CaCl2 + H2O + CO2↑
30.碳酸不稳定而分H2CO3 == H2O + CO2↑
31.二氧化碳可溶于水: H2O + CO2== H2CO3
32.高温煅烧石灰石(工业制二氧化碳):CaCO3 高温 CaO + CO2↑
33.石灰水与二氧化碳反应(鉴别二氧化碳):
Ca(OH)2 + CO2 === CaCO3 ↓+ H2O
(4)一氧化碳的性质:
34.一氧化碳还原氧化铜:CO+ CuO 加热 Cu + CO2
35.一氧化碳的可燃性:2CO + O2 点燃 2CO2
其它反应:
36.碳酸钠与稀盐酸反应(灭火器的原理):
Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑
五、燃料及其利用:
37.甲烷在空气中燃烧:CH4 + 2O2 点燃 CO2 + 2H2O
38.酒精在空气中燃烧:C2H5OH + 3O2 点燃 2CO2 + 3H2O
39. 氢气中空气中燃烧:2H2 + O2 点燃 2H2O
六、金属
(1)金属与氧气反应:
40. 镁在空气中燃烧:2Mg + O2 点燃 2MgO
41. 铁在氧气中燃烧:3Fe + 2O2 点燃 Fe3O4
42. 铜在空气中受热:2Cu + O2 加热 2CuO
43. 铝在空气中形成氧化膜:4Al + 3O2 = 2Al2O3
(2)金属单质 + 酸 -------- 盐 + 氢气 (置换反应)
44. 锌和稀硫酸Zn + H2SO4 = ZnSO4 + H2↑
45. 铁和稀硫酸Fe + H2SO4 = FeSO4 + H2↑
46. 镁和稀硫酸Mg + H2SO4 = MgSO4 + H2↑
47. 铝和稀硫酸2Al +3H2SO4 = Al2(SO4)3 +3 H2↑
48. 锌和稀盐酸Zn + 2HCl == ZnCl2 + H2↑
49. 铁和稀盐酸Fe + 2HCl == FeCl2 + H2↑
50. 镁和稀盐酸Mg+ 2HCl == MgCl2 + H2↑
51.铝和稀盐酸2Al + 6HCl == 2AlCl3 + 3 H2↑
(3)金属单质 + 盐(溶液) ------- 新金属 + 新盐
52. 铁和硫酸铜溶液反应:Fe + CuSO4 == FeSO4 + Cu
53. 锌和硫酸铜溶液反应:Zn + CuSO4 ==ZnSO4 + Cu
54. 铜和硝酸汞溶液反应:Cu + Hg(NO3)2 == Cu(NO3)2 + Hg
(3)金属铁的治炼原理:
55.3CO+ 2Fe2O3 高温 4Fe + 3CO2↑
七、酸、碱、盐
1、酸的化学性质
(1)酸 + 金属 -------- 盐 + 氢气(见上)
(2)酸 + 金属氧化物-------- 盐 + 水
56. 氧化铁和稀盐酸反应:Fe2O3 + 6HCl ==2FeCl3 + 3H2O
57. 氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 == Fe2(SO4)3 + 3H2O
58. 氧化铜和稀盐酸反应:CuO + 2HCl ==CuCl2 + H2O
59. 氧化铜和稀硫酸反应:CuO + H2SO4 == CuSO4 + H2O
(3)酸 + 碱 -------- 盐 + 水(中和反应)
60.盐酸和烧碱起反应:HCl + NaOH == NaCl +H2O
61. 盐酸和氢氧化钙反应:2HCl + Ca(OH)2 == CaCl2 + 2H2O
62. 氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 == AlCl3 + 3H2O
63. 硫酸和烧碱反应:H2SO4 + 2NaOH == Na2SO4 + 2H2O
(4)酸 + 盐 -------- 另一种酸 + 另一种盐
64.大理石与稀盐酸反应:CaCO3 + 2HCl == CaCl2 + H2O + CO2↑
65.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑
66.碳酸氢钠与稀盐酸反应:NaHCO3 + HCl== NaCl + H2O + CO2↑
67. 硫酸和氯化钡溶液反应:H2SO4 + BaCl2 == BaSO4 ↓+ 2HCl
2、碱的化学性质
(1) 碱 + 非金属氧化物 -------- 盐 + 水
68.苛性钠暴露在空气中变质:2NaOH + CO2 == Na2CO3 + H2O
69.苛性钠吸收二氧化硫气体:2NaOH + SO2 == Na2SO3 + H2O
70.苛性钠吸收三氧化硫气体:2NaOH + SO3 == Na2SO4 + H2O
71.消石灰放在空气中变质:Ca(OH)2 + CO2 == CaCO3 ↓+ H2O
72. 消石灰吸收二氧化硫:Ca(OH)2 + SO2 == CaSO3 ↓+ H2O
(2)碱 + 酸-------- 盐 + 水(中和反应,方程式见上)
(3)碱 + 盐 -------- 另一种碱 + 另一种盐
73. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 == CaCO3↓+ 2NaOH
3、盐的化学性质
(1)盐(溶液) + 金属单质------- 另一种金属 + 另一种盐
74. 铁和硫酸铜溶液反应:Fe + CuSO4 == FeSO4 + Cu
(2)盐 + 酸-------- 另一种酸 + 另一种盐
75.碳酸钠与稀盐酸反应: Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑
碳酸氢钠与稀盐酸反应:NaHCO3 + HCl== NaCl + H2O + CO2↑
(3)盐 + 碱 -------- 另一种碱 + 另一种盐
76. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 == CaCO3↓+ 2NaOH
(4)盐 + 盐 ----- 两种新盐
77.氯化钠溶液和硝酸银溶液:NaCl + AgNO3 == AgCl↓ + NaNO3
78.硫酸钠和氯化钡:Na2SO4 + BaCl2 == BaSO4↓ + 2NaCl
一、物质的学名、俗名及化学式
⑴金刚石、石墨:C⑵水银、汞:Hg (3)生石灰、氧化钙:CaO(4)干冰(固体二氧化碳):CO2 (5)盐酸、氢氯酸:HCl(6)亚硫酸:H2SO3 (7)氢硫酸:H2S (8)熟石灰、消石灰:Ca(OH)2 (9)苛性钠、火碱、烧碱:NaOH (10)纯碱:Na2CO3 碳酸钠晶体、纯碱晶体:Na2CO3?10H2O (11)碳酸氢钠、酸式碳酸钠:NaHCO3 (也叫小苏打) (12)胆矾、蓝矾、硫酸铜晶体:CuSO4?5H2O (13)铜绿、孔雀石:Cu2(OH)2CO3(分解生成三种氧化物的物质) (14)甲醇:CH3OH 有毒、失明、死亡 (15)酒精、乙醇:C2H5OH (16)醋酸、乙酸(16.6℃冰醋酸)CH3COOH(CH3COO- 醋酸根离子) 具有酸的通性 (17)氨气:NH3 (碱性气体) (18)氨水、一水合氨:NH3?H2O(为常见的碱,具有碱的通性,是一种不含金属离子的碱) (19)亚硝酸钠:NaNO2 (工业用盐、有毒)
其他的可以再问我 - 1年前
 maliyu4000 共回答了9个问题
maliyu4000 共回答了9个问题 |采纳率- 分别是CaCO₃,HCl,CaCl2,H2CO3
l - 1年前
 zhuxiaoguai 共回答了7个问题
zhuxiaoguai 共回答了7个问题 |采纳率- CaCO3,HCL,CaCL2.H2CO3
注意化合价就会写了 - 1年前
相关推荐
- 在“熟石灰、石墨、碳酸钙、聚乙烯、生石灰”中,选用适当的物质填空.
在“熟石灰、石墨、碳酸钙、聚乙烯、生石灰”中,选用适当的物质填空.
(1)用于改良酸性土壤的是______;
(2)用作补钙剂的是______;
(3)常用包装食品的塑料是______;
(4)用作电池中电极的是______;
(5)常用作食品干燥剂的是______. 寞小寞1年前1
寞小寞1年前1 -
 枫是风 共回答了20个问题
枫是风 共回答了20个问题 |采纳率95%解题思路:根据物质的性质分析,熟石灰呈碱性,可以改良酸性土壤,石墨具有良好的导电性,碳酸钙中含有钙元素,聚乙烯无毒,常用来制作塑料袋,生石灰能吸收水,和水反应生成氢氧化钙.(1),因为熟石灰具有碱性,常用于改良酸性土壤,故填:熟石灰;(2)碳酸钙和胃液中的盐酸反应,转变成可溶性的钙离子,用作补钙剂,故填:碳酸钙;(3)聚乙烯对人体无害,常用包装食品的塑料,故填:聚乙烯;(4...
点评:
本题考点: 碳单质的物理性质及用途;酸碱盐的应用;塑料及其应用.
考点点评: 熟悉个物质的性质是解答此类题目的关键,物质的性质决定用途,因此要对物质的性质加强理解,多做知识储备,做到学以致用.1年前查看全部
- 如何能得到与钙离子等量且纯净的碳酸钙
 翱翔的海鸥1年前1
翱翔的海鸥1年前1 -
 缘起缘灭zby 共回答了17个问题
缘起缘灭zby 共回答了17个问题 |采纳率94.1%在纯净石灰水中鼓入纯净二氧化碳.1年前查看全部
- 第三问答案说是碳酸钙和氢氧化钙 怎么有氢氧化钙?
 dedebao1年前1
dedebao1年前1 -
 tian1194 共回答了16个问题
tian1194 共回答了16个问题 |采纳率93.8%因为氢氧化钠溶液中加入氯化钙后,溶液中有四种离子,钙离子,氯离子,氢氧根离子,钠离子,而氢氧化钙是微溶于水的,所以可能存在如果钙和氢氧根离子浓度大,就容易生成微溶于水的氢氧化钙,1年前查看全部
- 氧化钙中含有碳酸钙可以用什么物质除去呀
氧化钙中含有碳酸钙可以用什么物质除去呀
不可以加热,用什么试剂呀, hufei_2001_21年前2
hufei_2001_21年前2 -
 whc0813 共回答了15个问题
whc0813 共回答了15个问题 |采纳率86.7%煅烧
CaCO3=(煅烧)CaO+CO21年前查看全部
- 已知一种钙片,其中碳酸钙(CaCO3)的质量分数为75%,求钙的质量分数
 疯青羊15651年前0
疯青羊15651年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 某钙片主要成分碳酸钙,其碳酸含量为80%,现需要补充钙元素4g需要吃钙片多少?
 polybear1年前4
polybear1年前4 -
 piaoer5757 共回答了20个问题
piaoer5757 共回答了20个问题 |采纳率95%CaCO3------Ca
100 40
x*80% 4g
100/40=x*80%/4g
x=12.5g1年前查看全部
- 过量二氧化碳通入碳酸钙的水溶液生成碳酸氢钙,求离子方程式
 zhdshzh1年前3
zhdshzh1年前3 -
 tianxianl 共回答了16个问题
tianxianl 共回答了16个问题 |采纳率93.8%co2+Co3(2-)+H2o--》2HCo3(-)1年前查看全部
- 下列叙述正确的是A只有含有钙离子,镁离子的水都属于硬水 B软水中不含和含较少的钙离子和镁离子 C水垢的成分是碳酸钙和碳酸
下列叙述正确的是
A只有含有钙离子,镁离子的水都属于硬水
B软水中不含和含较少的钙离子和镁离子
C水垢的成分是碳酸钙和碳酸镁
D用明矾净化后的水一定是软水 隐子小雪1年前1
隐子小雪1年前1 -
 气候暗暗 共回答了17个问题
气候暗暗 共回答了17个问题 |采纳率94.1%A还有别的离子;
B对;
C水垢的主要成分是碳酸钙和碳酸镁
D用明矾净化后的水一定是硬水1年前查看全部
- .“点石成金”用质量守恒定律解释.(石——石灰石的主要成分是碳酸钙CaCO3.金——Au)
.“点石成金”用质量守恒定律解释.(石——石灰石的主要成分是碳酸钙CaCO3.金——Au)
2.某化合物的质量是4.6克,在空气中燃烧生成了8.8克二氧化碳和5.4克水,求化合物中各元素的质量. tthh1年前5
tthh1年前5 -
 haohwrao 共回答了23个问题
haohwrao 共回答了23个问题 |采纳率82.6%点石成金从理论上说绝对可能.1年前查看全部
- 用盐酸和碳酸钙制取CO2的化学方程式.
用盐酸和碳酸钙制取CO2的化学方程式.
急. 狂笑30秒1年前3
狂笑30秒1年前3 -
 我是笨笨SA 共回答了21个问题
我是笨笨SA 共回答了21个问题 |采纳率95.2%CaCO3+2HCl=CaCl2+ H2O +CO2↑1年前查看全部
- 为测定石灰石中碳酸钙的纯度,取一定质量的石灰石(杂质不溶于水,也不与酸反应)高温煅烧一段时间后得78g固体向其中加入40
为测定石灰石中碳酸钙的纯度,取一定质量的石灰石(杂质不溶于水,也不与酸反应)高温煅烧一段时间后得78g固体向其中加入400g质量分数为14.6%的稀盐酸充分反应后发现固体质量不再减少,过滤得一定质量的中性溶液和20g不溶物(滤渣),则原石灰石样品中碳酸钙的纯度为( )
A. 50%
B. 75%
C. 80%
D. 90% 闹静静1年前1
闹静静1年前1 -
 生命痕迹 共回答了14个问题
生命痕迹 共回答了14个问题 |采纳率100%解题思路:石灰石高温锻烧,碳酸钙分解生成氧化钙和二氧化碳,锻烧后固体与盐酸反应,碳酸钙与盐酸反应生成氯化钙、水、二氧化碳而氧化钙与盐酸生成氯化钙和水,且反应后溶液呈中性,说明恰好完全反应,因此,反应后所得溶液一定是氯化钙,其中钙元素质量即石灰石中碳酸钙中钙元素的质量、氯元素质量即所加盐酸中氯元素质量;利用氯化钙中氯元素与钙元素质量关系,可由盐酸中所含氯元素质量求得碳酸钙中钙元素质量,进而计算出碳酸钙的质量,最终根据题意完成原石灰石样品中碳酸钙的纯度的计算.400g质量分数为14.6%的稀盐酸中所含氯元素质量=400g×14.6%×[35.5/36.5]×100%=56.8g
氯化钙中钙元素与氯元素质量比=40:(35.5×2)=40:71,则氯化钙中氯元素质量为56.8g时钙元素质量=[56.8g/71×40=32g
石灰石中碳酸钙的质量=32g÷
40
100]×100%=80g
原石灰石样品中碳酸钙的纯度=[80g/80g+20g]×100%=80%
故选C.点评:
本题考点: 根据化学反应方程式的计算;含杂质物质的化学反应的有关计算.
考点点评: 根据化学变化前后元素质量不变,通过氯化钙中氯元素与钙元素质量关系,建立盐酸与碳酸钙的质量关系,这是解答本题的技巧所在.1年前查看全部
- 石灰石制备碳酸钙不要石灰石.生石灰.石灰水.碳酸钙的.
 starww1年前1
starww1年前1 -
 苏有菜 共回答了14个问题
苏有菜 共回答了14个问题 |采纳率92.9%石灰石加盐酸溶解再加入过量的碳酸钠过滤浓缩干燥即可1年前查看全部
- 煅烧50t含碳酸钙85%的石灰石能得多少二氧化碳
煅烧50t含碳酸钙85%的石灰石能得多少二氧化碳
要花学式和计算过程 荒废二十年1年前3
荒废二十年1年前3 -
 MARGARITA_ICE 共回答了19个问题
MARGARITA_ICE 共回答了19个问题 |采纳率100%50*85%=42.5T
CaCO3=高温=CaO+CO2↑ 碳酸钙分子量 100.09 二氧化碳分子量44.01
42.5*44.1/100.09=18.7t
可以得到18.7吨二氧化碳1年前查看全部
- 实验室有一包白色固体,可能含有无水硫酸铜、硫酸钠、碳酸钙、氯化钡、氯化钾中的一种或几种.现做如下实验:
实验室有一包白色固体,可能含有无水硫酸铜、硫酸钠、碳酸钙、氯化钡、氯化钾中的一种或几种.现做如下实验:
a.取少量白色固体加足量的水溶解,过滤得沉淀和无色溶液.
b.向所得的沉淀中加入足量的稀硝酸,沉淀有部分溶解,并有气体产生,再过滤,滤液无色.回答下列问题:
(1)仅根据第一步实验现象的描述,你认为白色固体中无水硫酸铜______.(选填“存在”、“不存在”或“不能确定”).
(2)根据两步实验的现象,你认为该白色固体中一定不含有的物质是______,不能确定是否含有的物质是______,沉淀有部分溶解的化学反应方程式是______. shinezd1年前4
shinezd1年前4 -
 剑入萧空 共回答了19个问题
剑入萧空 共回答了19个问题 |采纳率94.7%解题思路:a、固体溶于水得无色溶液和生成沉淀,可能是碳酸钙也可能是硫酸钠和氯化钡混合反应生成的硫酸钡,或者是碳酸铜(以碱式碳酸铜形式存在,为蓝色的).
b、沉淀部分溶于稀硝酸,肯定碳酸钙和硫酸钡二种沉淀都有,也就肯定了硫酸钠和氯化钡的存在.氯化钾没有提到,也没法确定.a、固体溶于水得无色溶液和生成沉淀,可能是碳酸钙也可能是硫酸钠和氯化钡混合反应生成的硫酸钡,(Na2SO4+BaCl2=BaSO4↓+2NaCl)或者是碳酸铜(以碱式碳酸铜形式存在,为蓝色的).所以不能确定是否存在硫酸铜
b、沉淀部分溶于稀硝酸,肯定碳酸钙和硫酸钡二种沉淀都有,硫酸钡不溶于硝酸,碳酸钙溶于硝酸(CaCO3+2HNO3=CO2↑+H2O+Ca(NO3)2),也就肯定了硫酸钠和氯化钡的存在.氯化钾没有提到,也没法确定.
故填:
(1)不能确定;
(2)硫酸铜;氯化钾;CaCO3+2HNO3=CO2↑+H2O+Ca(NO3)2点评:
本题考点: 酸、碱、盐的鉴别;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题是混合物组成推断题,要善于抓住“题眼”,如本题中的无色溶液,部分溶于硝酸,依此为突破口,逐一进行肯定与否定.1年前查看全部
- 如何鉴定碳酸钙?写出实验步骤,实验现象,实验结论,化学方程式.
 hlesw1年前4
hlesw1年前4 -
 鱼zys 共回答了22个问题
鱼zys 共回答了22个问题 |采纳率100%CACO3+2HCL=CACL2+CO2+H2O
碳酸钙加盐酸生成二氧化碳气体、将二氧化碳气体通入澄清石灰水中生成碳酸钙沉淀、证明是碳酸钙
CA(OH)2+CO2=CACO3+H2O1年前查看全部
- 实验装置如图,B中的固体物质可能是碳酸钙或锌或两者的混合物,D中的黑色粉末可能是炭粉或氧化铜或两者的混合物,向A中加入稀
实验装置如图,B中的固体物质可能是碳酸钙或锌或两者的混合物,D中的黑色粉末可能是炭粉或氧化铜或两者的混合物,向A中加入稀盐酸,点燃酒精灯(或对D加强热),根据实验现象回答:
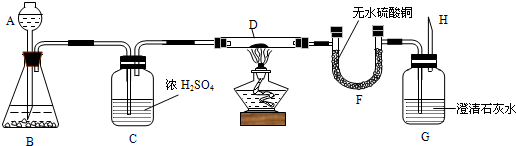
(1)如果G中出现白色浑浊,H处导出的气体不可燃,U型管中的白色硫酸铜无明显现象,则在B中反应的方程式______,D中放入的粉末是______.
(2)如果U型管中的无水硫酸铜变为蓝色,G中的石灰水仍澄清,H处导出的气体可以点燃,则B中反应的方程式______,D中放入的粉末是______.
(3)如果U型管中的无水硫酸铜变为蓝色,G中的石灰水变浑浊,H处导出的气体可以点燃,则B和D中的固体物质分别可能是:(有几种填几种,可以不填满)
B中①______,D中①______
B中②______,D中②______
B中③______,D中③______. 加3分1年前1
加3分1年前1 -
 clppcb 共回答了22个问题
clppcb 共回答了22个问题 |采纳率95.5%解题思路:(1)根据G中出现白色浑浊,H处导出的气体不可燃,U型管中的白色硫酸铜无明显现象,可知产物有二氧化碳,没有可燃性气体及水的产生进行分析;
(2)根据U型管中的无水硫酸铜变为蓝色,G中的石灰水仍澄清,H处导出的气体可以点燃,可知有水和可燃性气体的产生,没有二氧化碳的产生进行解答;
(3)根据U型管中的无水硫酸铜变为蓝色,G中的石灰水变浑浊,H处导出的气体可以点燃,说明有水、二氧化碳和可燃性气体的产生进行解答.(1)实验现象G中出现白色浑浊,说明有二氧化碳生成;U型管中的白色硫酸铜无明显现象,H处导出的气体不可燃,说明没有水生成,即没有氢气,装置B中盛放的固体物质应是碳酸钙,而没有金属锌,反应的方程式为:2HCl+CaCO3=CaCl2+CO2↑+H2O;装置D玻璃管内盛放的黑色粉末是氧化铜;
(2)装置G中的石灰水仍澄清可知没有二氧化碳生成;U型管中的无水硫酸铜变为蓝色,说明有水的生成,因而有氢气产生,因而装置B盛放的固体物质是锌,其中发生反应的化学方程式是:2HCl+Zn=ZnCl2+H2↑;装置D玻璃管内盛放的黑色粉末是氧化铜;
(3)U型管中的无水硫酸铜变为蓝色,说明有水生成,则水是氢气和氧化铜反应生成的,说明装置B中一定含有锌,装置D玻璃管内一定含有氧化铜;G中的石灰水变浑浊,可能是碳酸钙和盐酸反应产生的,也可能是碳和氧化铜反应产生的;因此,若B中没有碳酸钙,则D中一定含有碳;若B中含有碳酸钙,则D中可能含有碳;故可能的组合是:①Zn;CuO、C;②Zn、CaCO3;CuO;③Zn、CaCO3;CuO、C.
故答案为:(1)2HCl+CaCO3=CaCl2+CO2↑+H2O; 氧化铜;
(2)2HCl+Zn=ZnCl2+H2↑; 氧化铜;
(3)①Zn;CuO、C;②Zn、CaCO3;CuO;③Zn、CaCO3;CuO、C.点评:
本题考点: 物质的鉴别、推断;酸的化学性质;碳的化学性质;书写化学方程式、文字表达式、电离方程式;氢气的化学性质与燃烧实验.
考点点评: 此题是一道实验探究综合题,解题的关键是对根据实验的现象及实验目的原理结合物质的性质据此分析,得出结论,难度较大.1年前查看全部
- 溶解碳酸钙、碳酸钡沉淀时,为什么不用盐酸
 w_wq_sz_gd1年前4
w_wq_sz_gd1年前4 -
 怀念家爵兄 共回答了14个问题
怀念家爵兄 共回答了14个问题 |采纳率92.9%醋酸的最大的好处是醋酸盐都是于水的 不会因为你加入了醋酸根产生了新的沉淀源
肯定不能用的是 磷 酸 和 硫 酸 (这个是废话)
硝 酸 一般也不用 比较危险 各种的危险 不赘述了 害怕过不了审核
如果你拿到的白色沉淀的成分比较复杂 比如可能含有亚汞离子 银离子钙离子钡离子 铅离子等 用醋酸的好处是 如果是碳酸盐的话 那么他们就通通融掉了…… 而且不生成沉淀 不影响下一步的鉴别1年前查看全部
- 现有一包固体粉末,其中可能含有碳酸钙、硫酸钠、碳酸钠、硫酸铜与氯化钠,进行如下实验1溶于水得无色...
现有一包固体粉末,其中可能含有碳酸钙、硫酸钠、碳酸钠、硫酸铜与氯化钠,进行如下实验1溶于水得无色...
现有一包固体粉末,其中可能含有碳酸钙、硫酸钠、碳酸钠、硫酸铜与氯化钠,进行如下实验1溶于水得无色溶液,2向溶液中加氯化钡溶液生成白色沉淀,在加盐酸沉淀消失,跟据上述实验现象推断(1)一定不存在的物质有?(2)一定存在的物质有?(3)可能存在的物质有 liuge0141年前5
liuge0141年前5 -
 rainmanp 共回答了21个问题
rainmanp 共回答了21个问题 |采纳率81%溶于水得无色溶液,没有碳酸钙(沉淀)和硫酸铜(蓝色)
加氯化钡生成白色沉淀,加盐酸沉淀消失,沉淀是BaCO3,没有硫酸根.有碳酸钠,无硫酸钠.
一定有碳酸钠,一定无碳酸钙、硫酸铜与硫酸钠,可能有氯化钠1年前查看全部
- 下列化学反应的离子方程式正确的是( ) A.碳酸钙溶解于醋酸:CaCO 3 +2H + =Ca 2+ +CO 2 ↑+
下列化学反应的离子方程式正确的是( ) A.碳酸钙溶解于醋酸:CaCO 3 +2H + =Ca 2+ +CO 2 ↑+H 2 O B.Fe 3 O 4 溶解于稀硝酸中:Fe 3 O 4 +8H + =3Fe 3+ +4H 2 O C.用烧碱溶液吸收氯气:Cl 2 +2OH - =Cl - +ClO - +H 2 O D.石灰乳与MgCl 2 溶液反应:Mg 2+ +Ca(OH) 2 =Ca 2+ +Mg(OH) 2  happywtq1年前1
happywtq1年前1 -
 热情沙漠001 共回答了27个问题
热情沙漠001 共回答了27个问题 |采纳率96.3%A、碳酸钙溶解于醋酸:CaCO 3 +2CH 3 COOH=Ca 2+ +2CH 3 COO - +CO 2 ↑+H 2 O,故A错误;
B、Fe 3 O 4 溶解于稀硝酸中:3Fe 3 O 4 +NO 3 - +28H + =9Fe 3+ +14H 2 O+NO↑,故B错误;
C、用烧碱溶液吸收氯气的离子方程式为:Cl 2 +2OH - =Cl - +ClO - +H 2 O,故C正确;
D、石灰乳与MgCl 2 溶液反应石灰乳是悬浊液写成化学式:Mg 2+ +Ca(OH) 2 =Ca 2+ +Mg(OH) 2 ,故D正确;
故选CD.1年前查看全部
- 过量碳酸氢钠和氢氧化钙反应为什么生成碳酸钙,碳酸钠和水?碳酸氢根到哪里去了啊?
过量碳酸氢钠和氢氧化钙反应为什么生成碳酸钙,碳酸钠和水?碳酸氢根到哪里去了啊?
如题 阿弥陀佛538801年前4
阿弥陀佛538801年前4 -
 nstk33 共回答了21个问题
nstk33 共回答了21个问题 |采纳率85.7%写离子方程式吧,有助于理解,实质是碳酸氢根与钙离子,氢氧根的反应,过量的碳酸氢钠,也就是过量碳酸氢根,碳酸氢根与氢氧根反应生成水和碳酸根,碳酸根又与钙离子结合生成碳酸钙.当然由于碳酸氢钠过量,最后还会剩余碳酸氢根,不过化学反应式中不写出未参加反应的物质.你应该是高中吧.初中的话这题可能有难度 .
祝好1年前查看全部
- 请用所学化学知识解释下列原理.(1)碳酸钙、碳酸钠均能与稀盐酸反应生成CO2,是因为碳酸钙、碳酸钠中均含______(写
请用所学化学知识解释下列原理.
(1)碳酸钙、碳酸钠均能与稀盐酸反应生成co2,是因为碳酸钙、碳酸钠中均含______(写离子符号).
(2)合成纤维和羊毛是两种重要的衣服成分,它们可以用______法区别.
(3)***南海海底埋藏着丰富的“可燃冰”,“可燃冰”主要为甲烷的水合物,是未来重要的能源甲烷燃烧时,放出大量的热,反应的化学方程式为ch4+2o2
co2+2h2o点燃 .ch4+2o2.
co2+2h2o点燃 .
(4)现有以下四种物质:镁,氧化铜,稀盐酸,氢氧化铜等能两两反应的化学方程式:______、______. 扒灰老鼠1年前1
扒灰老鼠1年前1 -
 jungboo 共回答了14个问题
jungboo 共回答了14个问题 |采纳率92.9%解题思路:(1)根据碳酸盐都能与稀盐酸反应生成CO2分析.
(2)灼烧蛋白质时,能够产生烧焦羽毛的气味.
(3)根据甲烷燃烧的现象和化学方程式的书写考虑本题.
(4)根据镁和盐酸反应会生成氢气进行分析,根据金属氧化物和酸生成盐和水来分析,根据酸碱会发生中和反应生成盐和水进行分析.(1)碳酸盐与酸都能反应是因为都含有碳酸根离子;2H++CO32-═H2O+CO2↑;根据离子的表示方法:在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.故答案为:CO32-.
(2)羊毛的主要成分是蛋白质,灼烧时能够产生烧焦羽毛的气味,而灼烧合成纤维时不产生这种气味.
(3)甲烷燃烧时,发出明亮蓝色火焰,反应物是甲烷和氧气,生成物是二氧化碳和水,用观察法配平即可,反应条件是点燃写在等号的上边.故其化学方程式为:CH4+2O2
点燃
.
CO2+2H2O.
(4)镁和盐酸反应生成氯化镁和氢气,故其化学方程式为:Mg+2HCl=MgCl2+H2↑,
氧化铜和盐酸反应生成氯化铜和水,故其化学方程式为:CuO+2HCl=CuCl2+H2O,
氢氧化铜和硫酸反应生成硫酸铜和水,故其化学方程式为:Cu(OH)2+2HCl=CuCl2+2H2O,
故答案为:
(1)CO32-.
(2)灼烧.
(3)CH4+2O2
点燃
.
CO2+2H2O.
(4)Mg+2HCl=MgCl2+H2↑,CuO+2HCl=CuCl2+H2O,点评:
本题考点: 盐的化学性质;书写化学方程式、文字表达式、电离方程式;棉纤维、羊毛纤维和合成纤维的鉴别.
考点点评: 本题主要考查了微观粒子、化学方程式的书写等方面的内容.完成此题,可以依据已有的知识进行.1年前查看全部
- 碳酸钙与二氧化硅的反应 是不是复分解反应
 慢慢雨衣1年前1
慢慢雨衣1年前1 -
 晶姑娘 共回答了21个问题
晶姑娘 共回答了21个问题 |采纳率85.7%是复分解反应CaCO3+SiO2=CaSio3+CO2
但是有一点要声明,一般的复分解反应是强酸制弱酸,而这个是弱酸制强酸.因为这个反应的条件是高温,是高沸点酸制低沸点酸.1年前查看全部
- 为什么由碳酸钙分解高温下自发进行,可推导出该反应吸热
 能吃有错吗1年前2
能吃有错吗1年前2 -
 stonezhezhe 共回答了19个问题
stonezhezhe 共回答了19个问题 |采纳率94.7%反应能否自发进行是根据ΔG是否小于0判断的,而ΔG=H-TS,H为焓变,吸热大于0,吸热小于0,T(K)为温度,分解反应熵变大于0.在低温时,碳酸钙不分解,即G大于0,而TS是大于0的,因此H大于0,该反应吸热.并不是由于该反应在高温时自发进行而推导出这一结论的1年前查看全部
- 碳酸钙与盐酸反应产生气泡是什么过量 碳酸钙与盐酸反应产生气泡是什么过量
 咸鱼排骨1年前4
咸鱼排骨1年前4 -
 loong0917 共回答了18个问题
loong0917 共回答了18个问题 |采纳率94.4%碳酸钙与盐酸反应产生气泡是盐酸过量:CaCO3+2HCL=CaCl2+H2O+CO2
碳酸钙与盐酸反应不产生气泡是碳酸钙过量:
CaCO3+H+=CaHCO31年前查看全部
- 某兴 趣小组在实验室进行了“酸的性质”实验,使用过的试剂有:a铁、b氧化铁、c盐酸、d氢氧化钠和e碳酸钙,实验
某兴 趣小组在实验室进行了“酸的性质”实验,使用过的试剂有:a铁、b氧化铁、c盐酸、d氢氧化钠和e碳酸钙,实验结束后将废物全部倒入废液缸中。
①测定废液的pH=1,说明废液呈__________性。若将废液直接 倒入用大理石制成的水斗中会造成危害,原因用化学方程式表示_____________。
②上述提供的5种试剂在废液中不可能存在的是______________(填编号)。
③废液中的溶质最多可能有___________种。
④该兴趣小组用含0.02摩尔HCl的盐酸恰好中和20克的氢氧化钠溶液。
Ⅰ.计算20克氢氧化钠溶液中氢氧化钠的物质的量(根据化学方程式计算)。___________
Ⅱ.计算20克氢氧化钠溶液中溶质质量分数为____________。 king88f1年前0
king88f1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 初中化学中有俗名的物质有哪些?比如说碳酸钙(CaCO3)就是石灰石.大理石
 mercymercy1年前2
mercymercy1年前2 -
 554546027 共回答了16个问题
554546027 共回答了16个问题 |采纳率81.3%氢氧化钠:火碱烧碱苛性钠碳酸氢钠:小苏打碳酸钠:苏打,纯碱硫代硫酸钠:大苏打,海波乙酸:醋酸固态二氧化碳:干冰过氧化氢:双氧水Hg:水银应该就这么多了吧1年前查看全部
- 某矿石样品中可能含有碳酸钙、二氧化硅、氧化铝、氧化镁等化合物,
某矿石样品中可能含有碳酸钙、二氧化硅、氧化铝、氧化镁等化合物,
经测定各元素质量分数的模型如图甲,由此可推测,该样品中不可能含有的化合物是 .
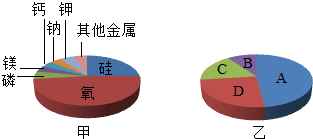
某矿石样品中吭含有碳酸钙、二氧化钙,氧化铝、氧化镁等化合物. 糗gg你1年前1
糗gg你1年前1 -
 haogui123456 共回答了17个问题
haogui123456 共回答了17个问题 |采纳率88.2%一定没有碳酸钙
因为这图里根本就没有碳元素的质量分数
没有碳元素怎么会有碳酸钙呢.1年前查看全部
- 氧化镁,氧气,二氧化碳,水,钙,氢氧化钙,氯化钠,碳酸钙,氯化氢
氧化镁,氧气,二氧化碳,水,钙,氢氧化钙,氯化钠,碳酸钙,氯化氢
哪些属于金属单质_____________
哪些是所含氧元素的存在状态为游离态的物质______-- fuliangfuliang1年前1
fuliangfuliang1年前1 -
 金星vince 共回答了17个问题
金星vince 共回答了17个问题 |采纳率94.1%金属单质:钙
氧元素游离态即氧单质:氧气1年前查看全部
- 有下列大种盐的固体粉末:氯化钠、氯化铁、硝酸银、硝酸钠、碳酸钙,从中分别取样,两两混合为一组,加入蒸馏水,能够e到无色透
有下列大种盐的固体粉末:氯化钠、氯化铁、硝酸银、硝酸钠、碳酸钙,从中分别取样,两两混合为一组,加入蒸馏水,能够e到无色透明溶液的,最多有( )
A. 2组
B. 3组
C. 4组
D. 5组 gy8efhsb1年前1
gy8efhsb1年前1 -
 亦霖 共回答了14个问题
亦霖 共回答了14个问题 |采纳率107.1%解题思路:若物质之间相互交换成分,能结合成沉淀的则不能得到透明的溶液;本题还要注意能得到无色透明溶液,不能含有明显有颜色的铜离子、铁离子和亚铁离子等.物质加到水中得到无色澄清溶液,说明彼此之间不能生成沉淀,且不存在有色离子.
氯化铁加入蒸馏水形成g溶液呈黄色,不能形成无色透明溶液;氯化钠与硝酸银溶液反应生成氯化银白色沉淀,碳酸钙不溶于水,加入蒸馏水,均能够得到无色透明溶液.
氯化钠与硝酸钠、硝酸银与硝酸钠之间不反应,符合无色透明g要求.
故选:v.点评:
本题考点: 离子或物质的共存问题.
考点点评: 本题难度不是很大,对于能否得到无色透明的溶液,要注意彼此之间不能生成沉淀,还要注意特定离子的颜色.1年前查看全部
- 碳酸钙和乳酸的化学反应式如题
 丁小小的独孤剑1年前2
丁小小的独孤剑1年前2 -
 qujiad 共回答了20个问题
qujiad 共回答了20个问题 |采纳率100%2CH3CH(OH)COOH +CaCO3=(CH3CH(OH)COO)2Ca+CO2+H2O
CO2要标向上的箭头~1年前查看全部
- 将一定量碳酸钙高温一段时间后,再将固体剩余物投入到300g8.76%的稀盐酸中,充分反后,可生成4.84g二氧化碳,且溶
将一定量碳酸钙高温一段时间后,再将固体剩余物投入到300g8.76%的稀盐酸中,充分反后,可生成4.84g二氧化碳,且溶液中只含一种溶质.
求1固体剩余物中钙元素的质量分数
2生成溶液中溶质的质量分数 世事难两全1年前1
世事难两全1年前1 -
 我的等待1 共回答了16个问题
我的等待1 共回答了16个问题 |采纳率75%1、57.6%
2、12.48%1年前查看全部
- 碳酸钙和二氧化碳的反应类型是什么
 我该怎么办1231年前1
我该怎么办1231年前1 -
 pb1984 共回答了12个问题
pb1984 共回答了12个问题 |采纳率66.7%2碳酸钙+水+二氧化碳=2碳酸氢钙 化合反应1年前查看全部
- 为什么不溶性盐可以溶于酸比如碳酸钙
 mirnda07061年前5
mirnda07061年前5 -
 娃哈哈adm 共回答了12个问题
娃哈哈adm 共回答了12个问题 |采纳率100%因为和酸发生了反应!
比如碳酸钙是难溶于水的,但是和盐酸反应生成气体,生成的盐是溶于水的,因此看到的现象就是在酸中溶解了
CaCO3+2HCl==CaCl2+H2O+CO21年前查看全部
- 碳酸钙属于电解质还是非电解质
 yoking56711年前1
yoking56711年前1 -
 woodyyaohui 共回答了23个问题
woodyyaohui 共回答了23个问题 |采纳率82.6%都是的
虽然碳酸钙是难溶的,但是它溶解的那一小部分是完全电离的,依然属于强电解质
碳酸钙难溶于水,碳酸钙是弱电解质
碳酸钙在水中的溶解度很小,水溶液也几乎不导电,但因为溶于水中的碳酸钙发生了完全电离,因此碳酸钙也是强电解质.电解质的强弱与其水溶性没有必然的联系,溶解度大的不一定是强电解质,如醋酸在水中溶解度很大,但是弱电解质,溶解度小的不一定是弱电解质,碳酸钙、硫酸钡、氯化银等在水中的溶解度都很小,但它们都是强电解质.1年前查看全部
- 向水中加入碳酸钙粉末能得到溶液吗?若能,那么该溶液是无色溶液吗?
 一品鲜1年前1
一品鲜1年前1 -
 danceing82 共回答了14个问题
danceing82 共回答了14个问题 |采纳率100%主要看你的碳酸钙的量加多少了,因为碳酸钙也有溶解度的,只是较小而已,如果是微量则行,超过一定量则不能为溶液1年前查看全部
- 如图所示,一只鸡蛋放在烧杯底部(鸡蛋壳的主要成分是碳酸钙),若向烧杯中加入下列物质,其中能反复使鸡蛋浮起来又沉下去的是(
如图所示,一只鸡蛋放在烧杯底部(鸡蛋壳的主要成分是碳酸钙),若向烧杯中加入下列物质,其中能反复使鸡蛋浮起来又沉下去的是( )
 A. 酒精
A. 酒精
B. 植物油
C. 食盐
D. 盐酸 冷月凝泪1年前1
冷月凝泪1年前1 -
 icelove 共回答了19个问题
icelove 共回答了19个问题 |采纳率84.2%解题思路:碳酸钙能与盐酸反应生成二氧化碳气体,气体的存在能影响鸡蛋所受的浮力.鸡蛋壳的主要成分是碳酸钙,碳酸钙能与盐酸反应生成二氧化碳气体,生成的二氧化碳气体附在蛋壳表面,使鸡蛋受的浮力增大,会上浮,气体聚成大气泡离开蛋壳,则所受的浮力减小,会下降,故选D.
点评:
本题考点: 碳酸钠、碳酸氢钠与碳酸钙;酸的化学性质.
考点点评: 本题结合物理知识考查了碳酸钙与酸的反应,完成此题,可以依据已有的知识进行.1年前查看全部
- 某碳酸钙与碳酸氢钙的混合物跟足量盐酸 消耗H+和产生CO2的物质的量之比为5:4 该混合物中碳酸钙与碳酸氢钙
某碳酸钙与碳酸氢钙的混合物跟足量盐酸 消耗H+和产生CO2的物质的量之比为5:4 该混合物中碳酸钙与碳酸氢钙
的物质的量之比是多少 SIYUE8402051年前1
SIYUE8402051年前1 -
 lyjchly 共回答了22个问题
lyjchly 共回答了22个问题 |采纳率86.4%解设该混合物中含碳酸钙与碳酸氢钙的物质的量分别为X、Y
CaCO3 + 2HCl =CaCl2 + H2O + CO2↑
1 2 1
X 2X X
Ca(HCO3)2 + 2HCl =CaCl2 + 2H2O + 2CO2↑
1 2 2
Y 2Y 2Y
则(2X+2Y):(X+2Y)=5:4
X:Y=2:3
答:该混合物中含碳酸钙与碳酸氢钙的物质的量之比为2:31年前查看全部
- 实验室需要22g二氧化碳,现用含碳酸钙90.00%的石灰石与足量的稀盐酸反应
实验室需要22g二氧化碳,现用含碳酸钙90.00%的石灰石与足量的稀盐酸反应
实验室需要22g(标准状况)二氧化碳,现用含碳酸钙90.0%的石灰石与足量的稀盐酸反应(该石灰石中的杂质不与稀盐酸反应).问
(1)至少需要含碳酸钙90.0%的石灰石多少克?
(2)生成的氯化钙的物质的量是多少? 封361年前1
封361年前1 -
 漱芳斋呀 共回答了21个问题
漱芳斋呀 共回答了21个问题 |采纳率90.5%22gCO2是0.5mol,对应0.5mol的C原子完全来源于CaCO3,每个碳酸钙分子含有1个C
所以需要0.5mol碳酸钙,即50g,需要石灰石50/90%=55.6g
同理,消耗了0.5mol碳酸钙,里面的钙为0.5mol,且全部转化为CaCl2,所以氯化钙的物质的量为0.5mol1年前查看全部
- 实验室中需要标准状况下11.2升的二氧化碳,现在含碳酸钙99%的石灰石与250毫升足量的稀盐酸反应,该石灰石中的杂质不与
实验室中需要标准状况下11.2升的二氧化碳,现在含碳酸钙99%的石灰石与250毫升足量的稀盐酸反应,该石灰石中的杂质不与盐酸反应,问至少需要含碳酸钙90%的石灰石多少克?
 170355411年前4
170355411年前4 -
 装靓宝宝 共回答了18个问题
装靓宝宝 共回答了18个问题 |采纳率94.4%11.2 L 0.5 mol
CaCO3 + 2 H+ = Ca2+ + H2O + CO2(气体)
0.5 mol 0.5 mol
0.5 mol / 90% * 100 g/mol = 55.6 g
答案:55.6g1年前查看全部
- 用高锰酸钾,氧化铜,碳酸钙,氢氧化钙,氯化钡能做什么实验
 morpheus121年前1
morpheus121年前1 -
 uaka 共回答了32个问题
uaka 共回答了32个问题 |采纳率87.5%高锰酸钾加热制氧,氯化钡和氢氧化钙反应制取氢氧化钡1年前查看全部
- 钙是维持人体正常功能所必需的元素 如图 取一片钙 放入盛有10g稀盐酸的烧杯中 其中碳酸钙跟稀盐酸恰好完全反应 (其他成
钙是维持人体正常功能所必需的元素 如图 取一片钙 放入盛有10g稀盐酸的烧杯中 其中碳酸钙跟稀盐酸恰好完全反应 (其他成分不与稀盐酸反应) 烧杯内物质的质量为11.34g
1 每片钙中含碳酸钙的质量(答案:1.5g)
2服用这种该片每人每天摄入钙元素的质量(答案:12g)
why .

 昊昊0101年前1
昊昊0101年前1 -
 Cindy猫 共回答了27个问题
Cindy猫 共回答了27个问题 |采纳率85.2%CaCO3+2HCl=CaCl2+H2O+CO2
100 44
x 10+2-11.34=0.66g
x=100*0.66/44=1.5g
1 每片钙中含碳酸钙的质量=1.5g
2 服用这种该片每人每天摄入CaCO3的质量=2*4*1.5=12g1年前查看全部
- 水垢是由氢氧化镁和碳酸钙为主要成分组成的混合物,要证明水垢中含有碳酸钙,则所需要的化学试剂是( )
水垢是由氢氧化镁和碳酸钙为主要成分组成的混合物,要证明水垢中含有碳酸钙,则所需要的化学试剂是( )
A. 石灰水和氧气
B. 盐酸和石灰水
C. 二氧化碳和水
D. 生石灰和水 flybirdjessie1年前1
flybirdjessie1年前1 -
 潇洒清弈 共回答了19个问题
潇洒清弈 共回答了19个问题 |采纳率89.5%解题思路:碳酸钙属于碳酸盐,可以与酸反应生成能使澄清石灰水变浑浊的二氧化碳气体.碳酸钙可以与盐酸反应生成二氧化碳气体,生成的二氧化碳气体能使澄清石灰水变浑浊,所以要证明水垢中含有碳酸钙,可以使用盐酸和石灰水,分析选项,故选B.
点评:
本题考点: 证明碳酸盐.
考点点评: 本题考查了碳酸盐的检验,检验碳酸盐通常使用酸和澄清石灰水.1年前查看全部
- 除杂:铁(铝);SIO2(碳酸钙);二氧化碳(盐酸);碳酸氢钠(碳酸钠);碳酸钠(碳酸氢钠).
 appleiizfy1年前3
appleiizfy1年前3 -
 czm1688 共回答了29个问题
czm1688 共回答了29个问题 |采纳率93.1%NaOH 盐酸 AgNO3 CO2 固态下加热1年前查看全部
- 1000t含碳酸钙80%的石灰石煅烧后得到的二氧化碳,通入澄清的石灰水中,得到的沉淀质量是多少?
 yingyi0091年前2
yingyi0091年前2 -
 lyf19851006 共回答了19个问题
lyf19851006 共回答了19个问题 |采纳率100%如果按照通入澄清石灰水的CO2全部跟石灰水反应并且没有再次溶解的话,其实就是等于1000x80%=800t,因为煅烧:CaCO3=CaO+CO2,与石灰水:CO2+Ca(OH)2=CaCO3+H2O,也就是一个CaCO3生成一个CO2,一个CO2再与石灰水反应,生成一个CaCO3,所以不变.
不过实际情况不是这样,CaCO3煅烧是不能全部生成CO2和CaO,是可逆反应,还有CO2与澄清石灰水反应也不是这么简单是两个过程CO2+Ca(OH)2=CaCO3+H2O,CaCO3+CO2+H2O=Ca(HCO3)2,那会使得CaCO3沉淀减少,如果想求得较准确的值,还需要知道澄清石灰水的物质百分比,和其他一些数据.1年前查看全部
- 25g大理石与100g稀盐酸恰好反应生成4.48L二氧化碳(已知二氧化碳的密度为1.964g/L) (1)大理石中碳酸钙
25g大理石与100g稀盐酸恰好反应生成4.48L二氧化碳(已知二氧化碳的密度为1.964g/L) (1)大理石中碳酸钙的质量分数 (2)稀盐酸的质量分数 (3)反应后溶液溶质质量分数
 bbdbbzh1年前1
bbdbbzh1年前1 -
 heli198 共回答了21个问题
heli198 共回答了21个问题 |采纳率85.7%m(CO2)=ρV =1.964g/L*4.48L=8.8g(约)
CaCO3+2HCl==CaCl2+H2O+CO2↑
100 73 111 44
x y z 8.8
解得x=20g y=14.6g z=22.2g
(1)大理石中碳酸钙的质量分数=20/25*100%=80%
(2)稀盐酸的质量分数=14.6/100*100%=14.6%
(3)反应后溶液溶质质量分数=22.2/(100+20-8.8)*100%=20%(约)1年前查看全部
- 我们老师说氢离子不可以和碳酸根离子、氢氧离子、碳酸氢根离子共存 但为什么检验氢离子的时候可以加碳酸钙
 红楼阁1年前1
红楼阁1年前1 -
 guanai 共回答了17个问题
guanai 共回答了17个问题 |采纳率82.4%氢离子不可以和碳酸根离子、氢氧离子、碳酸氢根离子共存是因为氢离子和它们都会发生反应,分别生成水和二氧化碳、水、水和二氧化碳(此处生成物与碳酸根生成数量不一样).
而检验氢离子,一般情况下就是检验溶液是否是酸性,除了弱酸和某些中强酸,浓度足够的情况下其他酸都可以与碳酸钙发生反应,并生成二氧化碳(有明显现象——气泡)、水以及相应的盐.所以,可以用碳酸钙检验氢离子的存在与否.
另外,检验就是需要发生肉眼可观的化学变化现象,以证明这种东西的存在,这就要考虑到什么不能共存,选择不能共存又会发生明显化学反应现象的药品进行混合,才能证明啊1年前查看全部
- 取含有80g碳酸钙的石灰石与足量的稀盐酸反应,可得到二氧化碳多少克?这些气体在标准状况下的体积是多少升?(已知:标准状况
取含有80g碳酸钙的石灰石与足量的稀盐酸反应,可得到二氧化碳多少克?这些气体在标准状况下的体积是多少升?(已知:标准状况下CO2的密度为1.977g/L)
 吧啦咕噜嗒1年前2
吧啦咕噜嗒1年前2 -
 吮指鸡块 共回答了19个问题
吮指鸡块 共回答了19个问题 |采纳率73.7%解题思路:碳酸钙与盐酸反应,生成氯化钙、水和二氧化碳,由于200g碳酸钙完全反应,可利用碳酸钙的质量根据反应的化学方程式,计算生成气体二氧化碳的质量;
利用V=[m/ρ],根据二氧化碳质量计算出标准状况下气体的体积.设生成二氧化碳的质量为x
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
80g x
[100/80g=
44
x]
x=35.2g
标准状况下CO2的体积V=[35.2g/1.977g/L]=17.8L
答:可生成二氧化碳气体35.2g;在标准状况下体积为17.8L.
故答案为:35.2g;17.8L.点评:
本题考点: ["根据化学反应方程式的计算"]
考点点评: 本题是根据反应的化学方程式进行的基础计算,需要注意正确的书写格式及完整的步骤,特别是还需要使用质量与体积的关系式计算出气体的体积.1年前查看全部
- 质量守恒一定用混合物么 今年全国人大和政协会议使用了一种含碳酸钙的“石头纸”:为测定其中碳酸钙的含量,课外活动小组的同学
质量守恒一定用混合物么
今年全国人大和政协会议使用了一种含碳酸钙的“石头纸”:为测定其中碳酸钙的含量,课外活动小组的同学称取50g碎纸样品,分别在5只烧杯中进行了实验.实验数据见下表(假设纸张其他成分不溶解也不反应):
烧杯① 烧杯② 烧杯③ 烧杯④ 烧杯⑤
加入样品质量/g 10 10 10 10 10
加入稀盐酸质量/g 10 20 30 40 50
生成气体的质量/g 0.88 1.76 2.64 x 3.52
(1)表中X的值为3.52g
(2)样品中碳酸钙的质量分数
(3)烧杯④中物质充分反应后所得溶液质量为
44.48g
第三题中为什么不用混合物的质量即10g+40g-3.52g?而是用碳酸钙再去求出实际参加反映的质量?为什么稀盐酸用的却是混合物的质量?
质量守恒不就是反应前混合物的质量-反应后混合物的质量吗?求详解.
. hn7311年前1
hn7311年前1 -
 gy2000 共回答了18个问题
gy2000 共回答了18个问题 |采纳率83.3%他问的溶液质量,碳酸钙如果没有反应完就不存在于这个溶液体系1年前查看全部
- 怎么检验氯化钙,碳酸钙,纯碱里面有食盐?
 dd猪八戒1681年前1
dd猪八戒1681年前1 -
 chrisfl 共回答了8个问题
chrisfl 共回答了8个问题 |采纳率100%检验氯化钙里面的食盐的方法:采用焰色反应,钠盐的焰色反应为黄色,钙盐的焰色反应为砖红色. 检验碳酸钙里面的食盐的方法:取混合物加水溶解后,过滤,滤走不溶于水的碳酸钙,然后取滤液,先滴入硝酸银溶液,接着滴...1年前查看全部
大家在问
- 1碳酸钙转化为氯化钙一定要加盐酸吗?
- 2碳酸钙与盐酸反应生成的氯化钙是以什么形式存在
- 3比和比例的区别及关联同上,
- 4非金属离子一定是阴离子对吗?除了铵根和氢离子
- 5英语翻译翻译英文你在想什么?
- 6只想知道你在想什么?翻译英文 帮忙翻译下.
- 7某校学生以8千米每时的速度行进,老师让一名走在队尾的同学到对首通知事情,然后返回对尾,这位同学的速度是12千米每时,从队
- 8证明cl比br的单质氧化性强 加了氯水之后为什么还要加四氯化碳
- 9环己烷羧酸会与氢氧化钠反应生成环己烷羧酸钠吗?
- 10有机反应中羧酸钠如何变回羧酸求大神帮助
- 11求:六氟硅酸锂的(物理/化学)性质 以及生产工艺 急用 救救救救!
- 12养殖厂的黑兔只数是白兔的3倍,白兔比黑兔少14只,白兔黑土各多少只?(用方程
- 13已知两圆方程,求其两交点所在直线
- 14已知两个圆的方程求交点怎么求?
- 15高等数学第一章判断题1、若对于任意的X,恒有f(x+2)=-f(x),则f(x)不一定是周期函数.2、若对于区间(a,b
