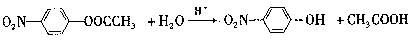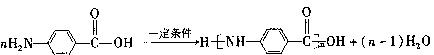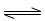汞蒸气有毒,如汞不慎洒在桌面上,应立即洒一些
 zhonghuamin2022-10-04 11:39:541条回答
zhonghuamin2022-10-04 11:39:541条回答硫磺
纯碱
烧碱
细沙

已提交,审核后显示!提交回复
共1条回复
 dou2 共回答了18个问题
dou2 共回答了18个问题 |采纳率100%- A
反应生成HgS - 1年前
相关推荐
- 烃的计算某烃的蒸气对氢气的相对密度为43,取21.5g此烃与过量氧气反应,将其生成物通过浓硫酸,浓硫酸的质量增加31.5
烃的计算
某烃的蒸气对氢气的相对密度为43,取21.5g此烃与过量氧气反应,将其生成物通过浓硫酸,浓硫酸的质量增加31.5g,再通过NaOH溶液,NaOH溶液质量增加66g.求此烃的分子式
要详细的过程 4299201年前3
4299201年前3 -
 李恒慧 共回答了15个问题
李恒慧 共回答了15个问题 |采纳率93.3%某烃的蒸气对氢气的相对密度为43所以分子量为43*2=86取21.5g此烃与过量氧气反应,将其生成物通过浓硫酸,浓硫酸的质量增加31.5g,再通过NaOH溶液,NaOH溶液质量增加66g也就是说21.5g烃燃烧得到H2O 31.5g,CO2 66g因此86g...1年前查看全部
- 5g碘固体加热得到5g碘蒸气符合质量守恒定律吗,理由是什么
5g碘固体加热得到5g碘蒸气符合质量守恒定律吗,理由是什么
铜片在酒精灯上加热后质量增加符合质量守恒定律吗,理由是什么
电解水的实验中收集到的氢气和氧气的质量总和略小雨分解的水的质量符合质量守恒定律吗,理由是什么 **的世界1年前1
**的世界1年前1 -
 wonderyan 共回答了16个问题
wonderyan 共回答了16个问题 |采纳率81.3%5g碘固体加热得到5g碘蒸气——不符合质量守恒定律,理由是——质量守恒定律只用于化学变化,而该 变化是物理变化
铜片在酒精灯上加热后质量增加——是符合质量守恒定律的,理由是——有空气中的氧气参加了反应,所以生成物的质量等于参加反应的铜与氧气的质量,而大于铜的质量
电解水的实验中收集到的氢气和氧气的质量总和略小于分解的水的——是质量符合质量守恒定律的,理由是——生成的氢气与氧气有少量溶于水中了,你没有进行称量1年前查看全部
- 某烃中碳与氢元素质量比为12:1,该烃蒸气的密度是相同条件下氢气的39倍,则该烃的分子式是?...
某烃中碳与氢元素质量比为12:1,该烃蒸气的密度是相同条件下氢气的39倍,则该烃的分子式是?...
某烃中碳与氢元素质量比为12:1,该烃蒸气的密度是相同条件下氢气的39倍,则该烃的分子式是? wangsuw1年前1
wangsuw1年前1 -
 苏佑慧 共回答了14个问题
苏佑慧 共回答了14个问题 |采纳率85.7%C6H6,该烃蒸气的密度是相同条件下氢气的39倍得其分子量是78,某烃中碳与氢元素质量比为12:1,得碳氢比为1:1;13x=78,x=6,即有6个碳(氢)原子.1年前查看全部
- 教,然后,应该,蒸气,英文翻译'
 georgeflew1年前1
georgeflew1年前1 -
 冉然井喷超能量 共回答了16个问题
冉然井喷超能量 共回答了16个问题 |采纳率93.8%teach,then,should,vapo1年前查看全部
- 有一种能反映出空气中水蒸气含量的装置叫做干湿泡温度计如图所示.它有两个相同的温度计并列制成的,其中一个温度计被湿布包起来
 有一种能反映出空气中水蒸气含量的装置叫做干湿泡温度计如图所示.它有两个相同的温度计并列制成的,其中一个温度计被湿布包起来了.两个温度计的读数不一样,______温度计的读数显示当时的室温.乙温度计的读数较______,这是由于湿布中的水在______时要吸热.在一定温度下,两个温度计读数差别越小,表示空气中的水蒸气含量越______.(填“多”或“少”)
有一种能反映出空气中水蒸气含量的装置叫做干湿泡温度计如图所示.它有两个相同的温度计并列制成的,其中一个温度计被湿布包起来了.两个温度计的读数不一样,______温度计的读数显示当时的室温.乙温度计的读数较______,这是由于湿布中的水在______时要吸热.在一定温度下,两个温度计读数差别越小,表示空气中的水蒸气含量越______.(填“多”或“少”)  singtiger1年前1
singtiger1年前1 -
 007lyt 共回答了23个问题
007lyt 共回答了23个问题 |采纳率87%解题思路:蒸发是在任何温度下都能够进行的汽化现象,汽化要吸热.干湿泡温度计测空气中水蒸气含量的大致原理:干泡温度计放置在空气中,显示的是空气的正常温度;湿泡温度计下端包着湿布,湿布上的水分蒸发吸热,因此湿泡温度计的示数比干泡温度计的示数低;在一定温度下,两个温度计读数的差别越小,表示空气中的水蒸气越多.
故答案为:甲;低;蒸发;多.点评:
本题考点: 汽化及汽化吸热的特点.
考点点评: 本题主要考查学生对:蒸发吸热在生活中的应用的了解和掌握,是一道基础题.1年前查看全部
- 甲烷和溴蒸气反应 是否能褪色?甲烷和溴蒸气反应是否能褪色?
 麦芽糖手枪1年前3
麦芽糖手枪1年前3 -
 破碎的风铃 共回答了16个问题
破碎的风铃 共回答了16个问题 |采纳率81.3%不能,
因为这是气体和气体反应
根据碰撞学说,Br2浓度足够大才能发生有效碰撞.
只能颜色减弱,不能消失1年前查看全部
- 一定条件下,在某恒压容器中发生如下反应:CO(g)+2H2=CH3OH(g),若开始时只充入1molCH3OH的蒸气,达
一定条件下,在某恒压容器中发生如下反应:CO(g)+2H2=CH3OH(g),若开始时只充入1molCH3OH的蒸气,达到平衡时,混合物的压强比起始时增大了70% :若开始后充入2mol的CO和4MOL的H2的混合气体,达到平衡时CO的转化率为(65% )
先写分析过程,在写计算过程.. wrh5861年前2
wrh5861年前2 -
 998599 共回答了22个问题
998599 共回答了22个问题 |采纳率100%首先,两种情况下的CO的物质的量分数是一样的.
第一种情况下的总物质的量为1MOL,达到平衡后,总物质的量为1.7MOL,
由此可算出有0.35MOL的CH3OH参与了反应,并生成了0.35MOL的CO.
所以,第二种情况中CO的物质的量分数为0.35/1.7 再设第二种情况下的CO有X MOL参加了反应.再列出等式即可求出答案.1年前查看全部
- (14分) 有机物A 1 和A 2 分别和浓硫酸在一定温度下共热只生成烃B,B的蒸气密度是同温同压下H 2 密度的59倍
(14分)
 有机物A 1 和A 2 分别和浓硫酸在一定温度下共热只生成烃B,B的蒸气密度是同温同压下H 2 密度的59倍,在催化剂存在下,1mol B可以和4mol H 2 发生加成反应,B的一元硝化产物有三种(同种类型)。有关物质之间的转化关系(其中F的分子式为C 9 H 10 O 3 )如下:
有机物A 1 和A 2 分别和浓硫酸在一定温度下共热只生成烃B,B的蒸气密度是同温同压下H 2 密度的59倍,在催化剂存在下,1mol B可以和4mol H 2 发生加成反应,B的一元硝化产物有三种(同种类型)。有关物质之间的转化关系(其中F的分子式为C 9 H 10 O 3 )如下:
请回答下列问题:
(1) 反应① ~ ⑥中属于取代反应的是:_______________。
(2) 写出A 2 和F两物质的结构简式:A 2 ______________;F_____________________。
(3) 写出③、④两步反应的化学方程式:
_______________________________________________________________。
_______________________________________________________________。
(4) 化合物E有多种同分异构体,其中属于酯类且具有两个对位侧链的同分异构体的结构简式:
。 大cc先生1年前1
大cc先生1年前1 -
 hellostar 共回答了22个问题
hellostar 共回答了22个问题 |采纳率86.4%(14分) 有机物A 1 和A 2 分别和浓硫酸在一定温度下共热只生成烃B,B的蒸气密度是同温同压下H 2 密度的59倍,在催化剂存在下,1mol B可以和4mol H 2 发生加成反应,B的一元硝化产物有三种(同种类型)。有关物质之间的转化关系(其中F的分子式为C 9 H 10 O 3 )如下:
有机物A 1 和A 2 分别和浓硫酸在一定温度下共热只生成烃B,B的蒸气密度是同温同压下H 2 密度的59倍,在催化剂存在下,1mol B可以和4mol H 2 发生加成反应,B的一元硝化产物有三种(同种类型)。有关物质之间的转化关系(其中F的分子式为C 9 H 10 O 3 )如下: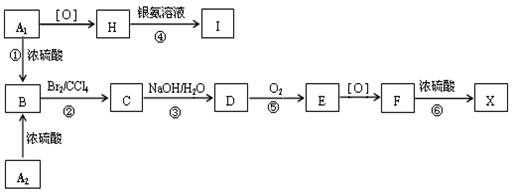
请回答下列问题:
(1) 反应① ~ ⑥中属于取代反应的是:_______________。
(2) 写出A 2 和F两物质的结构简式:A 2 ______________;F_____________________。
(3) 写出③、④两步反应的化学方程式:
_______________________________________________________________。
_______________________________________________________________。
(4) 化合物E有多种同分异构体,其中属于酯类且具有两个对位侧链的同分异构体的结构简式:
。
(1)③⑥;
(2)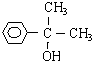 、
、 ;
;
(3) ;
;
(4)


<>1年前查看全部
- (2013•湛江一模)春季,湛江经常出现了“回南天”现象.地面、墙壁全是湿的.这主要是空气中水蒸气的遇冷发生物态变化时(
(2013•湛江一模)春季,湛江经常出现了“回南天”现象.地面、墙壁全是湿的.这主要是空气中水蒸气的遇冷发生物态变化时( )
A.凝固
B.熔化
C.汽化
D.液化 ziyege1年前1
ziyege1年前1 -
 dany_wang 共回答了15个问题
dany_wang 共回答了15个问题 |采纳率86.7%解题思路:物质由气态变成液态的现象叫做液化,水蒸气液化形成小水滴.“回南天”现象,是空气中的水蒸气遇到温度较低的地面、墙壁凝结成小水滴,属于液化现象.
故选D.点评:
本题考点: 液化及液化现象.
考点点评: 本题考查了生活中的液化现象,注重了物理和生活的联系,是中考常见题型.1年前查看全部
- NO2和溴蒸气都呈红棕色,用水可鉴别NO2和溴蒸气?
 幽然雨庭1年前1
幽然雨庭1年前1 -
 HanSonWoo 共回答了18个问题
HanSonWoo 共回答了18个问题 |采纳率94.4%你好:
可以的!二氧化氮遇水,发生3NO2 + H2O = 2HNO3 + NO,气体的红棕色消失溴蒸气遇水,溶解一部分,得到橙色溶液
如果满意记得采纳哦!
求好评!
(*^__^*) 嘻嘻……1年前查看全部
- 苯能和溴蒸气光照下发生取代反应么
 a36688521年前1
a36688521年前1 -
 c6cce 共回答了17个问题
c6cce 共回答了17个问题 |采纳率82.4%不可以,必须有催化剂与溴单质接触.苯与卤素取代反应的机理与烷烃取代反应不同.首先,卤素分子在催化剂作用下发生极化,极化分子的正极原子可在与苯环上的一个氢原子发生取代反应;极化分子的负极原子与被取代下来的氢原子结合成卤化氢分子.这种取代反应称为亲电取代反应.1年前查看全部
- (1)某烃A的蒸气密度是同条件下氢气密度的64倍,则 A的分子式可能为______,若A中含有6个甲基,但不可
(1)某烃A的蒸气密度是同条件下氢气密度的64倍,则 A的分子式可能为______,若A中含有6个甲基,但不可能是烯烃与氢气的加成产物,则A的结构简式为______;
(2)已知1mol烃B中所含电子总数为42NA,且C、H两种元素的质量比为5:1,则其分子式为______,它有______种同分异构体,在它的同分异构体中,沸点最高的是______(写结构简式);一氯代物只有一种的是______ (写习惯名称). anletitbe1年前1
anletitbe1年前1 -
 leejinger 共回答了12个问题
leejinger 共回答了12个问题 |采纳率91.7%解题思路:(1)根据气体的密度之比等于摩尔质量之比确定烷烃A的摩尔质量;根据烷烃的通式求出分子式,然后根据要求书写A的结构简式;
(2)C、H两种元素的质量比为5:1,则C、H两种元素的物质的量比为[5/12]:[1/1]=5:12,可知该烃的实验式为:C5H12,由于C已达饱和结构,所以实验式即为该烃的分子式;写出同分异构体,有3种同分异构体,分别为正戊烷、异戊烷、新戊烷.支链越多,沸点越低,沸点最高的为正戊烷,一氯代物只有一种的是新戊烷.(1)因气体的密度之比等于摩尔质量之比,烃A蒸气的摩尔质量为2g/mol×64=128g/mol,若为烷烃,则12n+2n+2=128,解得n=9,所以烷烃A的分子式为C9H20,若为芳香烃,12个氢用1个碳代替,分子式变为C10H8;若A不可能是氢气与烯烃加成的产物,说明A中两个C间不可能存在C=C键,C只能构成4个键因此得到A的结构简式:
(CH3)3CCH2C(CH3)3,故答案为:C9H20或C10H8;(CH3)3CCH2C(CH3)3;
(2)C、H两种元素的质量比为5:1,则C、H两种元素的物质的量比为[5/12]:[1/1]=5:12,可知该烃的实验式为:C5H12,电子总数为42(由于C已达饱和结构)所以实验式即为该烃的分子式;B的分子式为C5H12,有3种同分异构体,分别为正戊烷、异戊烷、新戊烷.支链越多,沸点越低,沸点最高的为正戊烷,一氯代物只有一种的是新戊烷.
故答案为:C5H12;3;CH3CH2CH2CH2CH3; 新戊烷或.点评:
本题考点: 有机物实验式和分子式的确定;有机物的推断.
考点点评: 本题考查了有机物分子结构的确定方法,要求学生具有分析和解决问题的能力,难度较大.确定B关键是求出实验式,可根据C4价或烃所含电子数来确定分子式.1年前查看全部
- 硫蒸气有橙色、无色、红棕色等颜色,他们都是硫的不同单质,所含硫原子的数目不同,
硫蒸气有橙色、无色、红棕色等颜色,他们都是硫的不同单质,所含硫原子的数目不同,
可用Sx表示.对着三种蒸气的测定结果如下:
1)橙色硫蒸气的质量是相同状时等体积空气的8.8倍,则它的化学式为_____.
2)无色蒸气对氢气的相对密度是64,则它的化学式为_____.
3)红棕色蒸气的密度是8.57g/L(S.T.P),则它的化学式为_____. 要饭在qq1年前1
要饭在qq1年前1 -
 fect1998 共回答了22个问题
fect1998 共回答了22个问题 |采纳率81.8%S8
S4
S61年前查看全部
- 贮气袋中存有有色气体,可能是NO2、CH4、CO2、HCl、NH3、Br2蒸气等气体中的几种,进行以下操作:①通少许于水
贮气袋中存有有色气体,可能是NO2、CH4、CO2、HCl、NH3、Br2蒸气等气体中的几种,进行以下操作:①通少许于水中,得无色溶液;②通少许于AgNO3溶液中,有沉淀产生;③通少许于澄清石灰水中,无浑浊现象;④通过装有水的洗气瓶中,导出的气体再通入澄清石灰水,产生浑浊.
则:由①可判断,一定存在______;一定不存在______.
由②可判断,一定存在______;一定不存在______.
由③、④可判断,一定存在______;可能存在的是______. 沈建雄1年前3
沈建雄1年前3 -
 HLL987417 共回答了17个问题
HLL987417 共回答了17个问题 |采纳率94.1%解题思路:贮气袋中存有有色气体,所以含有有颜色的气体;根据①知该气体中不存在溶于水生成有颜色溶液的气体;根据②知,存在能和硝酸银反应生成沉淀的气体氯化氢,一定不存在与氯化氢反应的气体;根据③、④实验现象判断含有与澄清石灰水反应生成沉淀的气体;根据实验现象分析判断即可.NO2、Br2蒸气是红棕色,根据题意知,该气体中可能含有NO2或Br2蒸气;溴溶于水所得溴水溶液呈橙色,根据①现象知,该气体中不存在溴蒸汽,存在二氧化氮;根据②实验现象知,该气体中存在氯化氢气体,氯化氢和氨气极易反应生成氯化铵固体,所以一定不存在氨气;根据实验③、④知,该气体中存在与澄清石灰水反应生成沉淀的二氧化碳气体;根据所有实验现象无法确定是否含有甲烷.
故答案为:NO2; Br2; HCl; NH3; HCl、CO2; CH4.点评:
本题考点: 常见气体的检验.
考点点评: 本题考查学生常见气体的检验和性质,是一道气体的鉴别题目,难度不大.注意根据实验现象、气体的性质判断可能存在的气体.1年前查看全部
- 1825年科学家发现一种新的有机物,并且测得它由C、H两种元素组成,C%=92.3%,其蒸气的密度是同温同压下H2的39
1825年科学家发现一种新的有机物,并且测得它由C、H两种元素组成,C%=92.3%,其蒸气的密度是同温同压下H2的39倍,你能算出其分子式吗?
 ivanxwl1年前4
ivanxwl1年前4 -
 guoh2002 共回答了20个问题
guoh2002 共回答了20个问题 |采纳率100%根据题意得:C%=92.3% H%=1-92.3%=7.7%
原子个数C:H=(92.3%/12):(7.7%/1)=1:1
最简式为CH 式量=13
有机物蒸气的密度是同温同压下H2的39倍,则它的相对分子质量=39*2=78(CH)n=78
78/13=6 n=6
分子式为C6H61年前查看全部
- 碘固体为什么不经液态就直接升华成碘蒸气?
 山楂来吧来吧1年前3
山楂来吧来吧1年前3 -
 hlq9999 共回答了23个问题
hlq9999 共回答了23个问题 |采纳率100%因为碘的升华点和熔点比较接近,
碘的蒸气压是随着温度升高而急剧增加的.碘的熔点是112.7 ℃,碘的三相点是114.15 ℃,这时蒸气压为11.9 kPa.在三相点O,固态、液态、气态的碘共存.显然,三相点的蒸气压越高,固态物质的升华越容易.通常在敞口容器中加热碘的固体,由于碘的蒸气不断逸出,达不到11.9 kPa的气压,固态的碘不经熔化而直接升华.如要得到液态碘,就要创造蒸气压超过11.9 kPa的条件.把足量的碘放在细口蒸馏瓶中加热,就可以得到液态碘.我们在一般碘升华的实验中,如果加热比较快,碘的蒸气比较浓,又没有及时冷凝,所以不经液态就直接升华了.1年前查看全部
- 碘固体和碘蒸气遇到淀粉都变蓝,
 byla26746001年前3
byla26746001年前3 -
 无数次 共回答了14个问题
无数次 共回答了14个问题 |采纳率92.9%这个题目从“相同分子的化学性质相同”的角度回答.
碘固体和碘蒸气是同一物质的不同形态,都是由碘分子构成的.由于相同分子的化学性质相同,所以二者遇到淀粉,都能使淀粉变蓝.1年前查看全部
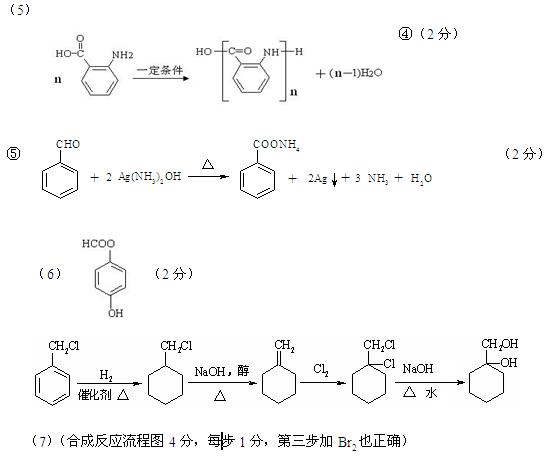
- (18分)某芳香烃X是一种重要的有机化工原料,它的蒸气密度是同温同压下氢气密度的46倍。研究部门以它为初始原料设计出如下
(18分)某芳香烃X是一种重要的有机化工原料,它的蒸气密度是同温同压下氢气密度的46倍。研究部门以它为初始原料设计出如下转化关系图(部分产物、合成路线、反应条件略去)。其中A是一氯代物,H是一种功能高分子,链节组成为C 7 H 5 NO。
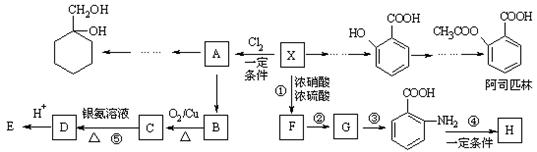
已知:
Ⅰ
Ⅱ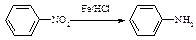 (苯胺,易被氧化)
(苯胺,易被氧化)
请根据所学知识与本题所给信息回答下列问题:
(1)X的分子式是 ;
(2)物质G在核磁共振氢谱中能呈现 种峰,峰面积之比为 ;
(3)阿司匹林分子结构中所含官能团的名称是 ;
(4)写出反应②、③的反应类型 , ;
(5)写出反应④和⑤的化学方程式:
④ ;⑤ ;
(6) (水杨酸)有多种同分异构体,写出符合下列条件的结构简式 。
(水杨酸)有多种同分异构体,写出符合下列条件的结构简式 。
①属于芳香族化合物,且属于酯类;②遇FeCl 3 溶液显紫色;
③苯环上有两个取代基,且苯环上的一氯代物只有两种。
(7)请用合成反应流程图表示出由 和其他无机物合成
和其他无机物合成 最合理的方案(不超过4步)。例:
最合理的方案(不超过4步)。例: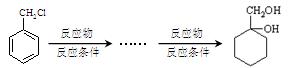
 6311013931年前1
6311013931年前1 -
 g_robin 共回答了14个问题
g_robin 共回答了14个问题 |采纳率92.9%1年前查看全部
- 热原质可被高压蒸气灭菌破坏对吗
 ShenghuoFox1年前1
ShenghuoFox1年前1 -
 liuwei822 共回答了19个问题
liuwei822 共回答了19个问题 |采纳率100%热原质(pyrogen)即菌体中的脂多糖,大多是革兰氏阴性菌产生的.注入人或动物体内能引起发热反应,故名热原质.热原质耐高热,高压蒸汽灭菌(121℃,20’)不能使其破坏,加热(180℃ 4h;250℃45';650℃1')才使热原质失去作用.热原质可通过一般细菌滤器,但没有挥发性,所以,除去热原质最好的方法是蒸馏.药液、水等被细菌污染后,即使高压灭菌或经滤过除菌仍可有热原质存在,输注机体后可引起严重发热反应.生物制品或注射液制成后除去热原质比较困难,所以,必须使用无热原质水制备.1年前查看全部
- 0.1mol/L NaCl 0.1mol/L H2SO4 0.1mol/LC6H12O6 哪个蒸气压更大?为什么
0.1mol/L NaCl 0.1mol/L H2SO4 0.1mol/LC6H12O6 哪个蒸气压更大?为什么
详细的说明一下
 若晨3211年前1
若晨3211年前1 -
 心情数 共回答了23个问题
心情数 共回答了23个问题 |采纳率100%0.1mol/LC6H12O6 ,因是非电解质,等体积溶液中溶质的微粒最少,蒸汽压下降得少,即蒸气压更大
请关注拉乌尔定律
蒸汽压下降
△P=P* × xB
xB表示溶质粒子的摩尔分数,浓度都为0.1moL/L,即1L溶液,溶剂一样多,溶质微粒的物质的量越大,蒸汽压下降越多
0.1mol NaCl有0.2mol 离子
0.1mol H2SO4有0.3mol 离子
0.1molC6H12O6 只有0.1mol分子1年前查看全部
- 为什么可以用AgNO3溶液,CCl4溶液,水洗法鉴别NO2和溴蒸气?
 stigerwsk1年前1
stigerwsk1年前1 -
 overlordkill 共回答了13个问题
overlordkill 共回答了13个问题 |采纳率92.3%溴蒸汽通到硝酸银溶液里会出现黄色沉淀.1年前查看全部
- 某有机物的蒸气密度是相同状态下甲烷密度的3.625倍.把1.16g该有机物在氧气中充分燃烧,将生成的气体混合物通过足量碱
某有机物的蒸气密度是相同状态下甲烷密度的3.625倍.把1.16g该有机物在氧气中充分燃烧,将生成的气体混合物通过足量碱石灰,碱石灰增重3.72g,又知生 成水和二氧化碳的物质的量比为1:1,试求此有机物的分子式.
 天使之吻啊1年前1
天使之吻啊1年前1 -
 althars 共回答了17个问题
althars 共回答了17个问题 |采纳率88.2%C3H6O1年前查看全部
- 请问乙醇胺和羧甲基纤维素钠起反应不?和三聚磷酸钠起反应不?和甲醛起反应不?和丙三醇起反应不?在常温情况下,它会挥发成蒸气
请问乙醇胺和羧甲基纤维素钠起反应不?和三聚磷酸钠起反应不?和甲醛起反应不?和丙三醇起反应不?在常温情况下,它会挥发成蒸气吗?懂的请指教,路人勿扰.
 无牌行医1年前2
无牌行医1年前2 -
 sadfkhwajeghkj 共回答了15个问题
sadfkhwajeghkj 共回答了15个问题 |采纳率93.3%乙醇胺和羧甲基纤维素钠不起反应,和三聚也不起反应回为它们的水溶液都成弱碱性,常温情况下不会和甲醛和丙三醇反应,但若有催化剂改变条件会发生脱水缩合反应.在常温下不会挥发的.1年前查看全部
- 列举两三个事实来说明空气中也含水蒸气
列举两三个事实来说明空气中也含水蒸气
设计一个实验或列举两三个事实来说明空气中也含有水蒸气.
另问一问题:
当集气瓶内充满氧气时,要使集气瓶内充有尽可能多的氧气,应如何操作? 正版江南1年前1
正版江南1年前1 -
 Lisazeng 共回答了21个问题
Lisazeng 共回答了21个问题 |采纳率85.7%1、饼干露置在空气中一段时间会受潮
冬天的早晨,窗户上会结一层冰花
2、增大压强(不过问得有些奇怪,你是不是没说清楚呀?从来没见过这样的题目)1年前查看全部
- (20分)某芳香族化合物A的分子中含有C、H、O、N四种元素,相同状况下,其蒸气的密度氢气密度的68.5倍。现以苯为原料
(20分)
某芳香族化合物A的分子中含有C、H、O、N四种元素,相同状况下,其蒸气的密度氢气密度的68.5倍。现以苯为原料合成A,并最终制得F(一种染料中间体),转化关系如下:(一些非主要产物已略去)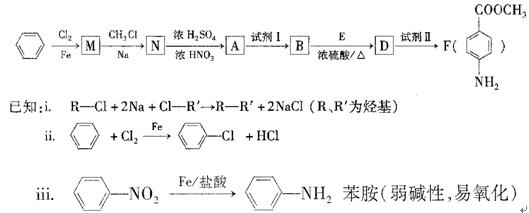
请回答下列问题:
(1)写出A的分子式 ;A的结构简式 。
(2)N—A的反应类型是 。
(3)①上述转化中试剂I和试剂Ⅱ分别是:试剂I ;试剂Ⅱ (选填字母)。
a.KMnO 4 (H + ) b.Fe/盐酸 c.NaOH溶液
②若上述转化中物质A依次与试剂II、试剂I、化合物E(浓硫酸/△)作用,能否得到F,为什么? 。
(4)用核磁共振氢谱可以证明化合物E中含有 种处于不同化学环境的氢。
(5)写出同时 符合下列要求的两种D的同分异构体的结构简式一。
符合下列要求的两种D的同分异构体的结构简式一。
①属于芳香族化合物,分子中有两个:互为对位的取代基,其中一个取代基是硝基;
②分子中含有 结构。
结构。
(6)有一种D的同分异构体W,在酸性条件下水解后,可得到一种能与FeCl,溶液发生显色反应的产物,写出W在酸性条件下水解的化学方程式
(7)F的水解反应如下:
化合物H在一定条件下经缩聚反应可制得高分子纤维,广泛用于通讯、导弹、宇航等领域。请写出该缩聚反应的化学方程式 。 linlinyu_qin1年前1
linlinyu_qin1年前1 -
 漫山飘叶 共回答了19个问题
漫山飘叶 共回答了19个问题 |采纳率89.5%1年前查看全部
- 某烃含碳92.3%,已知280 ml烃蒸气的质量是0.975g(换算到标态),求该烃的分子量和分子式.
 mm2291年前1
mm2291年前1 -
 cmmzawl 共回答了17个问题
cmmzawl 共回答了17个问题 |采纳率82.4%0.28/22.4=0.0125mol
分子量(摩尔质量)=0.975÷0.0125=78
含碳量92.3%,则碳氢比1:1,
故分子式C6H61年前查看全部
- 灯管中含有汞蒸气该怎么样科学的处理
 枯涩的rr1年前1
枯涩的rr1年前1 -
 amyh800 共回答了23个问题
amyh800 共回答了23个问题 |采纳率87%将灯管置于低温环境致其液化或固化,打破后撒上硫磺粉放置一段时间,汞与硫能在常态下生成稳定的固态化合物.感觉这应该是从环境保护角度考虑的,处理报废物品.1年前查看全部
- (2009•宿迁二模)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
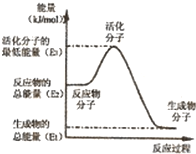 (2009•宿迁二模)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
(2009•宿迁二模)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H1=49.0kJ•mol-1
②CH3OH(g)+[1/2]O2(g)=CO2(g)+2H2(g)△H2=-192.9KJ•mol-1
下列说法正确的是( )
A.根据②推知:在25℃,101kPa时,1molCH3OH(g)燃烧生成CO2和H2O(l)放出的热量应大于192.9kJ
B.反应②中的能量变化如图所示,则△H2=E1-E3
C.H2燃烧能放出大量的热,故CH30H转变成H2的过程必须吸收能量
D.CH30H的燃烧热△H=-192.9kJ•mol-1 梨花压倒菊花1年前1
梨花压倒菊花1年前1 -
 晓之林 共回答了11个问题
晓之林 共回答了11个问题 |采纳率100%解题思路:A、根据物质的能量大小与物质的状态关系来判断;
B、根据△H=生成物总能量-反应物总能量来判断;
C、根据已知的甲醇转化为氢气能量变化分析;
D、利用盖斯定律分析.A、同物质的量的同种物质,气态能量最高,其次液态能量,固态能量最低,由②推知反应:CH3OH(l)+[1/2]O2(g)=CO2(g)+2H2(g)的△H>-192.9kJ•mol-1,故A正确;
B、在反应②中,由图示△H=生成物总能量-反应物总能量=E1-E2,故B错误;
C、由已知可知,反应②为放热反应,故C错误;
D、根据盖斯定律将,②×3-①×2可得:CH3OH(g)+[3/2]O2(g)=CO2(g)+2H2O(l)△H=-192.9kJ/mol×3-49kJ/mol×2=-676.7kJ/mol,所以甲醇的燃烧热为676.7kJ/mol,故D错误;
故选A.点评:
本题考点: 化学能与热能的相互转化.
考点点评: 本题考查化学能与热能的相互转化以及反应热的计算.注意在比较反应热大小时要带符号比较.1年前查看全部
- 有关H2密度某液态烃10.6g完全燃烧后生成17.92L(标准状况)CO2和9gH2O,该有机物蒸气密度是相同状况下H2
有关H2密度
某液态烃10.6g完全燃烧后生成17.92L(标准状况)CO2和9gH2O,该有机物蒸气密度是相同状况下H2密度的53倍,此烃分子式为____.
答案是C8H10 我写的C4H5
我知道就在蒸汽密度那出现问题
请问它给个H2蒸汽密度是什么意思?怎么进行计算? xmas661年前1
xmas661年前1 -
 qweqws 共回答了25个问题
qweqws 共回答了25个问题 |采纳率88%该有机物蒸气密度是相同状况下H2密度的53倍
即相对分子质量是氢气的53倍,即1061年前查看全部
- 用300摄氏度的蒸气去处理污水,3吨水要多久才能蒸发完
 zyp6681年前3
zyp6681年前3 -
 pouytt 共回答了21个问题
pouytt 共回答了21个问题 |采纳率90.5%最多1小时1年前查看全部
- 用碘蒸气使指纹出现的现象应用了什么科学道理?
 灭害灵0071年前1
灭害灵0071年前1 -
 perfectfish 共回答了13个问题
perfectfish 共回答了13个问题 |采纳率92.3%碘蒸气法:用碘蒸气熏,由于碘能溶解在指纹印上的油脂之中,而能显示指纹.这种方法能检测出数月之前的指纹.1年前查看全部
- 在横线上填上物态变化的名称,并指出是吸热还是放热.(1)冬天口中呼出的“白气”( )( )热(2)碘蒸气变
在横线上填上物态变化的名称,并指出是吸热还是放热.(1)冬天口中呼出的“白气”( )( )热(2)碘蒸气变
3冰雪融化4用铁水铸造的机器零件5装在盘里的酒精少了5卫生球消失了
分别写出物态变化的名称,并指出是吸热还是放热谢谢了 csf1081年前4
csf1081年前4 -
 的澄 共回答了16个问题
的澄 共回答了16个问题 |采纳率100%在横线上填上物态变化的名称,并指出是吸热还是放热.(1)冬天口中呼出的“白气”( 液化)(放 )热(2)碘蒸气变 成碘,这是凝华,也是放热1年前查看全部
- 如何判断 在100 ℃,101325 Pa下,1mol水全部向真空容器气化为100 ℃,101325 Pa的蒸气,是否可
如何判断
在100 ℃,101325 Pa下,1mol水全部向真空容器气化为100 ℃,101325 Pa的蒸气,是否可逆?为什么?它的 deltaG 等于 0 萌芽小子1年前2
萌芽小子1年前2 -
 阳光在屋顶 共回答了25个问题
阳光在屋顶 共回答了25个问题 |采纳率84%吉布斯自由能改变量-ΔG=-(G2-G1)>=W非,上述反应在等温等压下进行,不做非体积功,即W非=0,可知ΔG0,即ΔG>0,这与前面的结论矛盾,所以这个过程不能自发的进行.它必须从外界吸热才行.1年前查看全部
- 400K、1.01×105 Pa时,2L烃A的蒸气能在V L氧气中完全燃烧,反应后体积增至(V+4)
400K、1.01×105 Pa时,2L烃A的蒸气能在V L氧气中完全燃烧,反应后体积增至(V+4)L(体积在同前的条件下测定).请回答:
(1)烃A在组成上应满足的条件是______.
(2)当V=15时,该烃可能的分子式为______.
(3)若A在常温常压下为气态,V的取值范围是______. missing_missy1年前0
missing_missy1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 某烃的含氧衍生物A能发生如下图所示的变化。已知A的蒸气密度是相同条件下H 2 的88倍,C的所有碳原子在同一平面上,J分
某烃的含氧衍生物A能发生如下图所示的变化。已知A的蒸气密度是相同条件下H 2 的88倍,C的所有碳原子在同一平面上,J分子中所有碳原子在一条直线上,H遇FeCl 3 溶液显紫色。
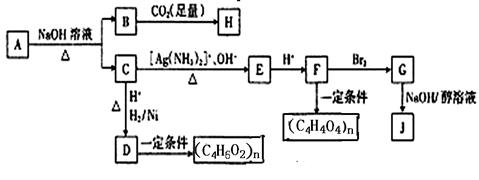
(1)A分子中含有的官能团有 。
A→B+C的反应方程式为 。
(2)写出由B生成H的反应方程式为 。
(3)由D生成(C 4 H 6 O 2 )n的反应类型为 。由G到J的反应类型为 。
(4)G的结构简式为 ,
(5)A的同分异构体甚多,满足下列条件的A的所有同分异构体有 种(不考虑立体异构)。
①含苯环;②含羧基;③含醛基;④含碳碳双键。 ourlives1年前1
ourlives1年前1 -
 路灯迷路 共回答了18个问题
路灯迷路 共回答了18个问题 |采纳率94.4%1年前查看全部
- 水煤气的主要成分是CO、H2,还含有少量的CO2和H2O蒸气.如图所示装置设计一个实验,以证明水煤气中含有CO和H2.试
水煤气的主要成分是CO、H2,还含有少量的CO2和H2O蒸气.如图所示装置设计一个实验,以证明水煤气中含有CO和H2.试回答:
(1)连接上述各装置的正确顺序是(将甲、乙、丙、丁、戊填入方框内):
水煤气→______→______→______→______→______(点燃尾气)
(2)气体经过丙、丁、戊装置时,都应从______进入,从______导出.(填“长导管”或“短导管”)
(3)各装置的作用是: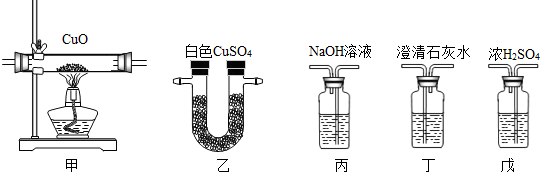
①甲装置______.
②乙装置______.
③丙装置______.
④丁装置______.
⑤戊装置______. 烟花肆意1年前1
烟花肆意1年前1 -
 代叁个表 共回答了16个问题
代叁个表 共回答了16个问题 |采纳率87.5%解题思路:(1)由于水煤气中原来就混有CO2和H2O,所以必须先把它们除去,以排除干扰.除去CO2的试液有NaOH溶液和Ca(OH)2饱和溶液(石灰水),其中,NaOH易溶于水,溶液较浓,而Ca(OH)2的溶解度很小,其饱和溶液仍是很稀的溶液,所以用NaOH溶液吸收CO2,而用石灰水检验CO2.吸收H2O的试剂有浓H2SO4和无水CuSO4,其中浓H2SO4的吸水性比无水CuSO4强,所以用浓H2SO4吸收H2O,而用无水CuSO4检验H2O.据此确定连接顺序;
(2)气体通过洗气瓶时要长进短出;
(3)①CO、H2通过时可分别生成二氧化碳和水;
②无水硫酸铜遇水变蓝,可用来检验水的存在;
③氢氧化钠溶液可吸二氧化碳;
④澄清石灰水可用来检验二氧化碳的生成;
⑤浓硫酸用作干燥剂,可用来吸收水分.1.(1)确定装置顺序:由于混合气在通过NaOH溶液时会带出少量水分,所以应先除去CO2,再除去H2O,然后使除去CO2和H2O后的气体通过灼热的CuO.反应后生成的混合气体,先通过无水
CuSO4验证H2O的生成,再通过澄清的石灰水验证CO2的生成.如果先通过石灰水,由于会带出少量水分而干扰水的检验.所以装置顺序应为:丙、戊、甲、乙、丁.故答案为:丙戊甲乙丁
(2)连接各装置时要注意,气体通过洗气瓶时应由长导管进入,短导管导出.故答案为:长导管、短导管;
(3)①CO、H2通过时可分别生成二氧化碳和水,就是说,把CO氧化为CO2,把H2氧化为H2O,以证明水煤气中含有CO和H2.故答案为:把CO氧化为CO2,把H2氧化为H2O;
②无水硫酸铜遇水变蓝,如果无水硫酸铜变蓝,就说明有水生成,也就是说,水煤气中含有H2.故答案为:证明水的生成,进而证明水煤气中含有H2
③为排除水煤气中原有的二氧化碳气体,我们可选用丙装置,其中的氢氧化钠溶液可吸二氧化碳.故答案为:除去水煤气中的CO2气体;
④澄清石灰水遇二氧化碳变浑浊,所以我们可以利用丁来验证CO2的生成,进而证明水煤气中有CO.故答案为:证明CO2的生成,进而证明水煤气中含有CO;
⑤浓硫酸可吸收水分,我们可以用戊装置吸收水煤气中的水分,排除干扰.故答案为:除去水煤气中的水蒸气.点评:
本题考点: 常见气体的检验与除杂方法;仪器的装配或连接;一氧化碳的化学性质;氢气的化学性质与燃烧实验.
考点点评: 根据题给装置和CO、H2的性质,首先确定检验CO和H2的方法,一般采用间接检验法;CO与CuO反应生成Cu和CO2,H2与CuO反应生成Cu和水;CO2可使澄清石灰水变浑浊,H2O可使无水CuSO4变蓝,根据这两种现象可以证明CO2和水的存在,也就间接证明CO和H2的存在.1年前查看全部
- 某种烃A的蒸气折合成标况下的密度是3.214g/L,已知该烃的碳氢质量比为5∶1,则:
某种烃A的蒸气折合成标况下的密度是3.214g/L,已知该烃的碳氢质量比为5∶1,则:
则:(1)该烃的相对分子量为( ) ;
(2)、确定该烃的分子式( );
(3)、如果该烃的一氯取代物有4种,写出该烃的结构简式( ).
(4)、烃A可由另一种烃B通过加成反应而制得,则烃B的可能的是( )(任写一种可能的结构简式) 玉素1年前1
玉素1年前1 -
 一点秋心 共回答了23个问题
一点秋心 共回答了23个问题 |采纳率100%(1)相对分子质量=1mol烃的质量=3.214g/L*22.4L/mol=71.9936≈72
(2)碳氢质量比为5:1.12x+y=72,12x=5y →X=5 Y=12 分子式:C5H12
(3)CH3CHCH2CH3
CH3
(4)CH3CH2CH=CHCH31年前查看全部
- (2011•重庆)一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合题图的是( )
(2011•重庆)一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合题图的是( )
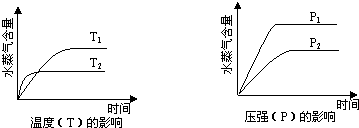
A.CO2(g)+2NH3(g)⇌CO(NH2)2(s)+H2O(g);△H<0
B.CO2(g)+H2(g)⇌CO(g)+H2O(g);△H>0
C.CH3CH2OH (g)⇌CH2=CH2(g)+H2O(g);△H>0
D.2C6H5CH2CH3(g)+O2(g)⇌2 C6H5CH=CH2(g)+2H2O(g);△H<0 wenj0181年前1
wenj0181年前1 -
 青柔月依依 共回答了21个问题
青柔月依依 共回答了21个问题 |采纳率85.7%解题思路:由左图可知,温度为t2到达平衡时间短,故t2>t1,随着温度的升高,水蒸气的含量减小,说明升高温度平衡向减少水的方向移动,则正反应应为放热反应;
由右图可知,压强为p1先到达平衡,故p1>p2,随着压强增大,水蒸气的含量增大,说明增大压强平衡向生成水的方向移动,以此解答该题.A、正反应是放热反应,升高温度平衡向逆反应移动,水蒸气的含量降低,正反应是体积减小的反应,增大压强平衡向正反应移动,水蒸气的含量增大,符合图象,故A正确;
B、正反应是吸热反应,升高温度平衡向正反应移动,水蒸气的含量增大,反应是一个体积不变的,压强对水蒸气的含量不影响,不符合图象,故B错误;
C、正反应是吸热反应,升高温度平衡向正反应移动,水蒸气的含量增大,正反应是体积增大的反应,增大压强平衡向逆反应移动,水蒸气的含量减小,不符合图象,故C错误;
D、正反应是放热反应,升高温度平衡向逆反应移动,水蒸气的含量降低,正反应是体积增大的反应,增大压强平衡向逆反应移动,水蒸气的含量降低,不符合图象,故D错误;
故选A.点评:
本题考点: 物质的量或浓度随时间的变化曲线.
考点点评: 本题考查外界条件对化学平衡的影响、化学平衡图象等,题目难度中等,解答的关键是能正确分析温度、压强对平衡移动的影响.1年前查看全部
- 由乙烯和乙醇蒸气组成的混和气体中,若碳元素的质量百分含量为60%,则氧元素的质量百分含量为( )
由乙烯和乙醇蒸气组成的混和气体中,若碳元素的质量百分含量为60%,则氧元素的质量百分含量为( )
A. 15.6%
B. 26.7%
C. 30%
D. 无法确定 ljmgdjsj1年前1
ljmgdjsj1年前1 -
 为你哭丧 共回答了18个问题
为你哭丧 共回答了18个问题 |采纳率100%解题思路:乙烯的分子式为C2H4,乙醇的分子式为C2H6O,可将乙醇的分子式看作C2H4•H2O,根据碳元素的质量百分含量可计算出C2H4的质量分数,进而计算的质量分数,进而计算氧元素的质量百分含量.乙烯的分子式为C2H4,乙醇的分子式为C2H6O,可将乙醇的分子式看作C2H4•H2O,
已知:ω(C)=60%,则ω(C2H4)=60%×[28/24]=70%,
则ω(H2O)=1-70%=30%,
所以:ω(O)=30%×[16/18]=26.7%,
故选B.点评:
本题考点: 元素质量分数的计算.
考点点评: 本题考查元素质量分数的计算,题目难度不大,注意利用分子式的转化,将乙醇的分子式可作C2H4•H2O.1年前查看全部
- 根据以下叙述制备氯化铜:先将浓盐酸用蒸气加热至80℃左右,慢慢加入含有FeO杂质的CuO粉,充分反应,使其溶解.已知:F
根据以下叙述制备氯化铜:先将浓盐酸用蒸气加热至80℃左右,慢慢加入含有FeO杂质的CuO粉,充分反应,使其溶解.已知:FeS不溶于水,但溶于酸;在除去溶液中的Fe 2+ 时,可采用的方法是( )
溶液中被沉淀离子 Fe 3+ Fe 2+ Cu 2+ 完全生成氢氧化物沉淀时,溶液的pH ≥3.7 ≥9.6 ≥6.4 A.可直接加碱,调整溶液的pH≥9.6 B.加入纯铜粉,将Fe 2+ 还原为Fe C.先将Fe 2+ 氧化成Fe 3+ ,再调整溶液pH至3~4 D.通入H 2 S使Fe 2+ 直接沉淀  一地碎发1年前1
一地碎发1年前1 -
 宇宙猪之ww姐 共回答了18个问题
宇宙猪之ww姐 共回答了18个问题 |采纳率83.3%A、因直接加碱,调整溶液pH≥9.6,Fe 2+ 以Fe(OH) 2 形式完全沉淀,此时的pH≥9.6,同时Cu 2+ 以Cu(OH) 2 的形式完全沉淀,不但除去了Fe 2+ ,也除去了Cu 2+ ,不符合除杂的原则,故A错误;
B、因铜粉的还原性比铁弱,不能将Fe 2+ 还原出来,故B错误;
C、将Fe 2+ 氧化成Fe 3+ ,Fe 3+ 以Fe(OH) 3 形式完全沉淀,pH在3~4,此时Cu 2+ 形成没有沉淀,过滤除去Fe(OH) 3 沉淀,既除去除去了杂质,也没有除去原物质,故C正确;
D、FeS不溶于水,但溶于酸,通入硫化氢,不能除去Fe 2+ ,但使Cu 2+ 形成CuS沉淀,除去了Cu 2+ ,不符合除杂的原则,故D错误;
故选C.1年前查看全部
- 0.94g某有机物在纯氧中完全燃烧,可生成二氧化碳2.64g,水0.54g,同时消耗氧气2.24g.又知此有机物蒸气0.
0.94g某有机物在纯氧中完全燃烧,可生成二氧化碳2.64g,水0.54g,同时消耗氧气2.24g.又知此有机物蒸气0.224L(已折算成标准状况下)的质量为0.94g.
(1)求此有机物的分子式.
(2)若此有机物跟FeCl3溶液作用显紫色,写出此有机物的结构简式. guo20011991年前0
guo20011991年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 298K时,将2.0g的苯置密闭容器内:若容器体积为2L,苯蒸气压力为多少?
298K时,将2.0g的苯置密闭容器内:若容器体积为2L,苯蒸气压力为多少?
若容器体积为6L,苯蒸气压力为多少?已知该温度下苯的蒸气压为12.7kPa. 快乐丑丑丫1年前1
快乐丑丑丫1年前1 -
 分管 共回答了18个问题
分管 共回答了18个问题 |采纳率94.4%利用理想气体状态方程pV=nRT.代入数据,在2L的容器中,假设所有苯均以气态存在,则有V=0.002,n=1/39,R=8.314,T=298,算得p=31.763kPa,由于此时苯的蒸汽压为12.7kPa,而算得的p大于此值,证明实际上有部分苯是以液态存在的,计算前提不成立,容器内压力就是苯的蒸汽压,p=12.7kPa.
同理,将V=0.006代入,可得第二问结果p=10.587kPa,小于蒸汽压,故苯全部以气态存在,计算前提成立,故p=10.6kPa1年前查看全部
- 石蜡燃烧实际上是石蜡蒸气在燃烧还是石蜡蒸汽在燃烧?
 布代虫1年前2
布代虫1年前2 -
 下雨了11 共回答了26个问题
下雨了11 共回答了26个问题 |采纳率92.3%严格说是“石蜡蒸气在燃烧”;“蒸气”是泛指液体或固体(如水、碘、汞、苯、石蜡等等)因蒸发、沸腾或升华而变成的气体.使用时前面要加上与之相关的事物,如水蒸气、苯蒸气、汞蒸气、碘蒸气.
“蒸汽”是特指,水加热到沸点所变成的水汽,气态的水.“蒸汽”特指水的蒸气,义同“水蒸气”,所以不能写成“水蒸汽”.1年前查看全部
- (2010•安徽模拟)四氯化钛是无色液体,沸点为136℃.它极易水解,遇空气中水蒸气即产生“白烟”(TiCl4+H2O═
(2010•安徽模拟)四氯化钛是无色液体,沸点为136℃.它极易水解,遇空气中水蒸气即产生“白烟”(TiCl4+H2O═TiOCl2+2HCl↑).在650~850℃下,将氯气通过二氧化钛和炭粉的混合物可得到四氯化钛和一种有毒气体.下图是实验室制备TiCl4的部分装置.
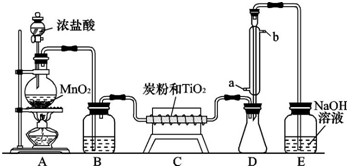
请回答:
(1)B装置中试剂为______,其作用是______.
(2)C装置中的反应方程式为______.
(3)D装置中冷凝水的方向为______进______出,该装置的作用为______.
(4)评价此装置的缺陷和不妥之处:
编号 装置缺陷和不妥之处 ① ② ③  chaochao09011年前1
chaochao09011年前1 -
 skyflybaby 共回答了16个问题
skyflybaby 共回答了16个问题 |采纳率93.8%解题思路:(1)根据制备的氯气中含有杂质水蒸气;
(2)由于TiO2、C、Cl2混合物在高温条件下制得TiCl4和一种有毒气体,根据化学反应中元素种类不变的规律可知:该有毒气体含有碳、氧两种元素,由碳、氧两种元素组成的有毒气体只有一氧化碳;因此TiO2、C、Cl2混合物在高温条件下反应生成TiCl4和一氧化碳;
(3)根据冷凝管内的水流方向由下向上,因为这样可以提高冷凝效果;四氯化钛沸点低,易挥发,所以要用冷凝管冷凝回收;
(4)①根据TiCl4 遇空气中水蒸气发生水解;
②根据TiCl4 水解产生的氯化氢极易溶于水;
③根据氯气通过二氧化钛和炭粉的混合物得到的CO气体有毒,(1)因制备的氯气中含有杂质水蒸气,可用浓硫酸来除去,故答案为:浓硫酸;干燥氯气;
(2)由于TiO2、C、Cl2混合物在高温条件下制得TiCl4和一种有毒气体,根据化学反应中元素种类不变的规律可知:该有毒气体含有碳、氧两种元素,由碳、氧两种元素组成的有毒气体只有一氧化碳;因此TiO2、C、Cl2混合物在高温条件下反应生成TiCl4和一氧化碳;
该反应的化学方程式为:TiO2+2Cl2+2C TiCl4+2CO,故答案为:TiO2+2Cl2+2C
TiCl4+2CO,故答案为:TiO2+2Cl2+2C  TiCl4+2CO;
TiCl4+2CO;
(3)因根据冷凝管内的水流方向由下向上,即a进b出,因为这样可以提高冷凝效果;四氯化钛是无色液体,沸点为136℃较低,受热易挥发,所以冷凝管冷凝回收,故答案为:a;b;冷凝回流四氯化钛;
(4)①、因TiCl4 遇空气中水蒸气发生水解,缺少阻止水蒸气进入D的装置,所以TiCl4 遇空气中水蒸气发生水解,缺少阻止水蒸气进入D的装置;
②、因TiCl4 水解产生的氯化氢极易溶于水,需要加上防倒吸的装置,所以TiCl4 水解产生的氯化氢极易溶于水,需要加上防倒吸的装置;
③、因氯气通过二氧化钛和炭粉的混合物得到的CO气体有毒,缺少CO的处理装置,所以由于CO气体有毒,缺少CO的处理装置.
故答案为:
编号 装置缺陷和不妥之处
① 不能阻止E装置的水汽进入D装置,而引起四氯化钛水解
② 由于氯化氢和氯气易溶于氢氧化钠溶液,E装置会产生倒吸现象
③ 不能防止CO的逸出点评:
本题考点: 制备实验方案的设计;氯气的化学性质;氯气的实验室制法.
考点点评: 本题是结合物质制备考查了基本实验操作,是一道综合性较强的实验题,考查考生分析实验装置并评价实验方案的能力.1年前查看全部
- 根据下列信息,写出有关化学反应方程式汞蒸气有毒,为防止汞蒸气使人中毒,可在洒落的液态汞上覆盖硫粉,产生+2价汞的硫化物
 awalkingbird1年前3
awalkingbird1年前3 -
 cq8gjd 共回答了21个问题
cq8gjd 共回答了21个问题 |采纳率95.2%正确的写法应是: Hg + S = HgS 写化学式是要注意大小写的. HG+S==HGS 不要反应条件,1年前查看全部
- 见下文某烃的蒸气对氢气的相对密度为43,取21.5g此烃与过量氧气反应,将其生成物通过浓硫酸,浓硫酸的质量增加31.5g
见下文
某烃的蒸气对氢气的相对密度为43,取21.5g此烃与过量氧气反应,将其生成物通过浓硫酸,浓硫酸的质量增加31.5g,再通过NaOH溶液,NaOH溶液质量增加66g.求此烃的分子式. hanmingrui19921年前1
hanmingrui19921年前1 -
 猪猪还冒rr 共回答了20个问题
猪猪还冒rr 共回答了20个问题 |采纳率95%M(CxHy)=43x2=86
n(CxHy)=21.5g/86(g/mol)=0.25mol
CxHy xCO2 y/2 H2O
1mol 44x g 9y g
0.25mol 66g 31.5g
解得x=6 y=14
即某烃为C6H14 己烷1年前查看全部
- 有机的 以下两句话能说明什么?1.该烃密度是相同状态下H2密度的8倍2.某烃的蒸气密度是相同状态下氢气密度恶毒42倍``
 环游地球1001年前3
环游地球1001年前3 -
 小宇子阳光 共回答了18个问题
小宇子阳光 共回答了18个问题 |采纳率83.3%1.该烃密度是相同状态下H2密度的8倍
也就是说它的相对分子质量为16
碳氢化合物,相对分子质量为16,只能是CH4甲烷
2.某烃的蒸气密度是相同状态下氢气密度的42倍``
也就是说它的相对分子质量为84
某碳氢化合物相对分子质量为84
设为CxHy
根据y1年前查看全部
- 有机蒸气防护滤盒能兼容防护PM2.5吗?
 sxwyh91281年前1
sxwyh91281年前1 -
 本该如是 共回答了24个问题
本该如是 共回答了24个问题 |采纳率95.8%不能.两码事.活性炭不是防雾霾细颗粒物的,主要用于有机分子蒸汽的防毒.对细微颗粒物没有防护作用
防范这种细微颗粒,目前可以参照的标准只有国标GB2626的工业防护标准,该标准是参照美国的N95/N100标准制定的对Pm0.07到Pm5之间的细微颗粒都能达到90%以上的防护效果.选购口罩必须要看是否有质量安全标志QS标志或者安全防护认证LA.如果没有国标和QS都是假冒伪劣山寨产品,根本档不住细微颗粒.这类产品一般不能沾水,所以不能清洗.一次性口罩佩戴时间4-10小时就需要抛弃,因为细菌会很快繁殖起来(市面上所谓抗菌口罩都是噱头,经过测试无一不是虚假宣传)
不过有的防毒面具可以加装警点过滤材料,使之可以起到防雾霾细颗粒物和有毒有机蒸汽的双作用.1年前查看全部
- 蒸气锅内气为10个标准大气压,相当于多少厘米高水银柱?相当于多少米高水柱?
 ligangcom1年前4
ligangcom1年前4 -
 游荡渔翁 共回答了22个问题
游荡渔翁 共回答了22个问题 |采纳率95.5%1标准大气压=760毫米汞柱=76厘米汞柱=1.013×10^5帕斯卡=10.336米水柱
10个标准大气压=760厘米高水银柱=103.36米高水柱1年前查看全部
大家在问
- 1以"春"为话题,以多角度描写,700字以上的作文
- 2直线a、b相交于点O,点A、B关于a对称,点B、C关于b对称,OA=OB.点A、O、C在一条直线上吗?为什么?
- 3下列关于无性生殖的叙述中,正确的是
- 4“画”这首诗的作者是谁?整首诗用一句话来形容该怎么说?
- 5稀硫酸,氢氧化钠溶液,稀盐酸,氢氧化钙溶液的酸碱性?
- 6so one ticket for 1351 on saturday翻译
- 7元旦庆会上老师买来了很多水果糖和奶糖,每位同学最多可以吃3块,也可以不吃.全班至少有多少人吃的两种糖完全一样多?
- 8求小学(六年级)脱式计算题要30道小数运算 30道分数运算 40道混合运算.最好是能用简算的.最好不要复制的实在不行给个
- 9让世界充满爱英语作文60字
- 10millie buys lily a good present every year同义句 快
- 11从军行七首(其一) 王昌龄 烽火城西百尺楼,黄昏独坐海风秋.更吹羌笛关山月,无那①金闺万
- 121.学校四年级和五年级捐款241元,如果将五年级捐款的总数中取出25元,就是四年级捐款数的2倍,(方程解)
- 13如图所示,在正三棱锥S-ABC中,M、N分别是SC、BC的中点,且MN⊥AM,若侧棱SA=2 ,则正三棱锥SABC外接球
- 14(2006•连云港二模)如图所示,竖直放置的两根足够长的光滑金属导轨相距为L,导轨的两端分别与电源(串有一滑动变阻器R)
- 15在满足根号X+根号Y=根号2009的正整数对(X,Y)中,x+y最大值是 1119 1517 1657 1749