求铜箔拉力机 IB 单位的拉力计算公式
 超级陈帅哥2022-10-04 11:39:541条回答
超级陈帅哥2022-10-04 11:39:541条回答拉力拉出来是 1.49 kg 3mm的胶带,帮忙算一下铜箔拉力是多少IB,

已提交,审核后显示!提交回复
共1条回复
 风卓影 共回答了21个问题
风卓影 共回答了21个问题 |采纳率85.7%- 1公斤 1 2.2 35.27
1磅 0.45 1 16
1央士 0.03 0.06 1
铜箔拉力(ib/in)=[测定值(kg)/铜箔宽度(mm) ] *55.88
55.88是一个换算值,也就是公斤换成ib,mm换成inch的一个常数,没问题的 - 1年前
相关推荐
- 铜制品在日常生活中有着广泛的应用.例如(1)导线的线心;(2)各种电器中的散热器;(3)各种装饰的铜箔等.它们各利用了铜
铜制品在日常生活中有着广泛的应用.例如(1)导线的线心;(2)各种电器中的散热器;(3)各种装饰的铜箔等.它们各利用了铜的什么属性?
(1)______;(2)______;(3)______. VannVincent1年前1
VannVincent1年前1 -
 风铃呓语 共回答了21个问题
风铃呓语 共回答了21个问题 |采纳率81%解题思路:从不同铜制品的用途以及铜的多种物理特征来解答(1)用铜做导线即是导体,导体的性质是具有导电性.
(2)散热器的作用是用来散热的,所以利用的是铜的导热性.
(3)铜能制成各种形状铜箔,这是利用了铜的延展性.
故答案为:导电性;导热性;延展性.点评:
本题考点: 物质的物理特征.
考点点评: 本题是联系生活实际来考查金属物理性质的应用.1年前查看全部
- 印刷电路板是由高分子材料和铜箔复合而成,刻制印刷电路时,要用FeCl 3 溶液作为“腐蚀液”,生成CuCl 2 和FeC
印刷电路板是由高分子材料和铜箔复合而成,刻制印刷电路时,要用FeCl 3 溶液作为“腐蚀液”,生成CuCl 2 和FeCl 2 .请写出反应的化学方程式,并用指出氧化剂、还原剂、氧化产物、还原产物.
______
氧化剂:______还原剂:______
氧化产物:______还原产物:______. 221997071年前1
221997071年前1 -
 cgscsx 共回答了11个问题
cgscsx 共回答了11个问题 |采纳率100%FeCl 3 具有氧化性,和Cu反应生成CuCl 2 和FeCl 2 ,该反应的化学方程式为Cu+2FeCl 3 =CuCl 2 +2FeCl 2 ,
反应中,FeCl 3 中Fe元素的化合价由+3价降低为+2价,FeCl 3 为氧化剂,被还原,对应的还原产物为FeCl 2 ,
Cu元素的化合价升高,由0价升高为+2价,为还原剂,被氧化物,对应的氧化产物为CuCl 2 ,
故答案为:Cu+2FeCl 3 =CuCl 2 +2FeCl 2 ;FeCl 3 ;Cu;CuCl 2 ;FeCl 2 .1年前查看全部
- 过去电子工业常用30%的FeCl 3 溶液腐蚀敷有铜箔的绝缘板,制成印刷线路板。发生反应的化学方程式为:2FeCl 3
过去电子工业常用30%的FeCl 3 溶液腐蚀敷有铜箔的绝缘板,制成印刷线路板。发生反应的化学方程式为:2FeCl 3 +Cu=2FeCl 2 +CuCl 2 。
(1)检验腐蚀后的溶液中是否含有Fe 3+ 应用的试剂是____________________。
(2)为了从使用过的腐蚀液中回收铜,并重新制得纯净的FeCl 3 ,溶液,采用下列实验步骤,请在各空格内填上适当的物质以使实验达到预期目的。
(3)写出有关反应的离子方程式:_____________________。  晨风裹雾1年前1
晨风裹雾1年前1 -
 落花满怀 共回答了19个问题
落花满怀 共回答了19个问题 |采纳率89.5%(1)KSCN(或其他含SCN - 的盐)溶液
(2)Fe粉;FeCl 2 ;Fe、Cu;盐酸;H 2 ;Cl 2
(3)2Fe 3+ +Fe=3Fe 2+, 、Fe+Cu 2+ =Fe 2+ +Cu、Fe+2H + =Fe 2+ +H 2 ↑、2Fe 2+ + Cl 2 =2Fe 3+ +2Cl -1年前查看全部
- 用FeCl3溶液腐蚀印刷电路板上铜箔的反应是:2Fe3++Cu=2Fe2++Cu2+.下列有关说法不正确的是( )
用FeCl3溶液腐蚀印刷电路板上铜箔的反应是:2Fe3++Cu=2Fe2++Cu2+.下列有关说法不正确的是( )
A.Cu是还原剂
B.Fe3+是氧化剂
C.氧化性:Cu2+>Fe3+
D.该反应属于离子反应 jenny651年前1
jenny651年前1 -
 jian2036 共回答了17个问题
jian2036 共回答了17个问题 |采纳率76.5%解题思路:A、化合价升高元素所在的反应物是还原剂;
B、化合价降低元素所在的反应物是氧化剂;
C、氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性;
D、有离子参加的反应是离子反应.A、反应2Fe3++Cu=2Fe2++Cu2+中,化合价升高元素是铜元素,所在的反应物Cu是还原剂,故A错误;
B、反应2Fe3++Cu=2Fe2++Cu2+中,化合价降低的元素是铁元素,所在的反应物Fe3+是氧化剂,故B错误;
C、反应2Fe3++Cu=2Fe2++Cu2+中,氧化剂Fe3+的氧化性大于氧化产物Cu2+的氧化性,故C错误;
D、该反应有离子参加,是离子反应,故D正确.
故选C.点评:
本题考点: 氧化性、还原性强弱的比较.
考点点评: 本题考查学生氧化还原反应的基本概念和氧化性强弱的判断规律,可以根据所学知识进行回答,难度不大.1年前查看全部
- 金箔怎么氧化 我想做仿古工艺,请问金箔怎么氧化,用什么材料氧化,哪里有这种材料卖,我们住在深圳布吉.我用的是铜箔(仿金箔
金箔怎么氧化
我想做仿古工艺,请问金箔怎么氧化,用什么材料氧化,哪里有这种材料卖,我们住在深圳布吉.
我用的是铜箔(仿金箔),我不敢确定是硝酸还是盐酸。 cgkf1年前3
cgkf1年前3 -
 的确良46 共回答了16个问题
的确良46 共回答了16个问题 |采纳率100%要用强酸,即浓硝酸1年前查看全部
- 铜箔厚度12µm,宽度是520mm,重量5t的时候长度是多少米
 阳光好天气1年前1
阳光好天气1年前1 -
 客浏览量破 共回答了20个问题
客浏览量破 共回答了20个问题 |采纳率95%铜的密度为8.92g/cm3 或 8.92*10^3kg/m3 由密度=质量/体积
设铜箔长度为L 米 则有 5000kg/(12*10^(-6)*0.52*L)m3=8920kg/m3 得L=89830米 即为铜箔长度1年前查看全部
- 铜箔,铝箔激光切割,用什么类型的激光器,功率多大?
 ailhe1年前2
ailhe1年前2 -
 语说云云 共回答了21个问题
语说云云 共回答了21个问题 |采纳率71.4%功率不用太大 吸收率高才是关键
建议用光钎激光器 波长在1064左右的 (波长越短越好 但是波长再短的激光器价格就太高了)
功率300W足够了1年前查看全部
- 电子工业上用30%的氯化铁溶液腐蚀印刷线路板上的铜箔 这个要怎么反应?
 chp5551年前1
chp5551年前1 -
 妍0591 共回答了16个问题
妍0591 共回答了16个问题 |采纳率100%就是铜和氯化铁的反应.
反应方程式:Cu + 2FeCl3 == CuCl2 + 2FeCl2
离子方程式:Cu + 2Fe3+ == Cu2+ + 2Fe2+
这个反应说明氧化性:Fe3+ > Cu2+ > Fe2+1年前查看全部
- 1)利用FeCl3溶液腐蚀铜箔,制印刷线路板,是利用了FeCl3的什么性质?
 小小麽麽茶1年前2
小小麽麽茶1年前2 -
 wangyunxia_0512 共回答了19个问题
wangyunxia_0512 共回答了19个问题 |采纳率89.5%强氧化性!2FeCl3+Cu=2FeCl2+CuCl21年前查看全部
- 印刷电路板是由高分子材料和铜箔复合而成,刻制印刷电路时,要用FeCl3溶液作为“腐蚀液”,生成CuCl2和FeCl2.请
印刷电路板是由高分子材料和铜箔复合而成,刻制印刷电路时,要用FeCl3溶液作为“腐蚀液”,生成CuCl2和FeCl2.请写出反应的化学方程式,并用指出氧化剂、还原剂、氧化产物、还原产物.
___
氧化剂: ___ 还原剂: ___
氧化产物: ___ 还原产物: ___ .
 格格的天空1年前1
格格的天空1年前1 -
 南风今 共回答了18个问题
南风今 共回答了18个问题 |采纳率83.3%解题思路:反应为Cu和FeCl3,生成物为CuCl2和FeCl2,则该反应的化学方程式为Cu+2FeCl3=CuCl2+2FeCl2 ,从化合价变化的角度判断氧化剂、还原剂、氧化产物和还原产物等概念.FeCl3具有氧化性,和Cu反应生成CuCl2和FeCl2,该反应的化学方程式为Cu+2FeCl3=CuCl2+2FeCl2 ,
反应中,FeCl3中Fe元素的化合价由+3价降低为+2价,FeCl3为氧化剂,被还原,对应的还原产物为FeCl2,
Cu元素的化合价升高,由0价升高为+2价,为还原剂,被氧化物,对应的氧化产物为CuCl2,
故答案为:Cu+2FeCl3=CuCl2+2FeCl2 ;FeCl3;Cu;CuCl2;FeCl2.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应的有关概念,题目难度不大,注意有关氧化还原反应概念的理解,从化合价变化的角度分析.1年前查看全部
- 刚性线路板当中,建滔板材的FR-4,铜箔厚度要多少才能承受得起400V的电压?
刚性线路板当中,建滔板材的FR-4,铜箔厚度要多少才能承受得起400V的电压?
如题.朋友跟我说线路板要承受得起400V的电压,我不知道这个是靠哪个参数来判断的.是铜箔厚度越厚,承受能力越高吗?那要承受400V,要多厚的铜?如果不是铜箔厚度影响的话,那是哪方面? ss香奈儿的粉丝1年前1
ss香奈儿的粉丝1年前1 -
 robert_s_hill 共回答了18个问题
robert_s_hill 共回答了18个问题 |采纳率83.3%不是铜箔厚度,而是由铜箔变成的线路之间的间距能够承受400v,而不会击穿,相应的欧洲和美国规范vde、ul、csa中有要求,比如,250v ac,在ul、csa中要求无论在空间还是表面,都要求有0.1英寸距离.1年前查看全部
- 印刷电路板是由高分子材料和铜箔复合而成,刻制印刷电路时,要用FeCl3溶液作为“腐蚀液”,生成CuCl2和FeCl2.请
印刷电路板是由高分子材料和铜箔复合而成,刻制印刷电路时,要用FeCl3溶液作为“腐蚀液”,生成CuCl2和FeCl2.请写出反应的化学方程式,并用指出氧化剂、还原剂、氧化产物、还原产物.
______
氧化剂:______还原剂:______
氧化产物:______还原产物:______. sos78931年前1
sos78931年前1 -
 adians 共回答了13个问题
adians 共回答了13个问题 |采纳率92.3%解题思路:反应为Cu和FeCl3,生成物为CuCl2和FeCl2,则该反应的化学方程式为Cu+2FeCl3=CuCl2+2FeCl2 ,从化合价变化的角度判断氧化剂、还原剂、氧化产物和还原产物等概念.FeCl3具有氧化性,和C0反应生成C0Clg和FeClg,该反应的化学方程式为C0+gFeCl3=C0Clg+gFeClg ,
反应中,FeCl3中Fe元素的化合价由+3价降低为+g价,FeCl3为氧化剂,被还原,对应的还原产物为FeClg,
C0元素的化合价升高,由0价升高为+g价,为还原剂,被氧化物,对应的氧化产物为C0Clg,
故答案为:C0+gFeCl3=C0Clg+gFeClg ;FeCl3;C0;C0Clg;FeClg.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应的有关概念,题目难度不大,注意有关氧化还原反应概念的理解,从化合价变化的角度分析.1年前查看全部
- 电子工业常用30%的FeCl3溶液腐蚀铜箔,制造印刷电路板,若反应过程中有4mol电子发生转移,会有____mol铜溶解
 小雪薇薇1年前1
小雪薇薇1年前1 -
 yinling 共回答了25个问题
yinling 共回答了25个问题 |采纳率80%2mol1年前查看全部
- 在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液处理和资源回收的过程简述如下:
在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液处理和资源回收的过程简述如下:

I:向废液中投入过量铁屑,充分反应后分离出固体和滤液:
II:向滤液中加入一定量NaOH溶液,调节溶液pH,同时鼓入足量的空气.
己知:Ksp[Fe(OH)3]=4.0×10-38
回答下列问题:
(1)过程I 加入铁屑的主要作用是______,从固体B中分离出铜需采用的方法是______;
(2)过程II中发生反应的化学方程式为______,调节溶液的pH为5,金属离子浓度为C(Fe3+)=
=4.0×10-11Ksp c3(OH−) C(Fe3+)=.(列式计算)
=4.0×10-11Ksp c3(OH−)
(3)FeCl3的水溶液呈______性(填“酸”、“碱”、“中”),原因是______(用离子方程式表示),在④过程中应如何操作______. 天地毋庸1年前1
天地毋庸1年前1 -
 商州狼 共回答了16个问题
商州狼 共回答了16个问题 |采纳率87.5%解题思路:废液含有氯化铁、氯化铜,加入试剂Ⅰ为过量铁,发生反应生成氯化亚铁和铜,过滤得到固体B为Cu和Fe,滤液A加入一定量NaOH溶液,调节溶液pH,同时鼓入足量的空气,反应生成氢氧化铁,过滤得到固体D加入稀盐酸溶解得到溶液E,通过蒸发浓缩,冷却结晶过滤洗涤得到氯化铁晶体.(1)过程I 加入铁屑的主要作用是,利用铁和铁离子反应生成亚铁离子,和铜离子反应生成金属铜,过滤得到固体B为Fe和Cu,加入稀盐酸过滤得到铜;
故答案为:回收铜;加盐酸后过滤;
(2)过程II中发生反应是向滤液中加入一定量NaOH溶液,调节溶液pH,同时鼓入足量的空气,氯化亚铁和氢氧化钠溶液反应生成氢氧化亚铁,氢氧化亚铁和空气中的氧气反应生成氢氧化铁,反应的化学方程式为:FeCl2+2NaOH=Fe(OH)2↓+2NaCl;4Fe(OH)2+O2+2H2O=4 Fe(OH)3,调节溶液的pH为5,金属离子浓度为C(Fe3+)=
Ksp
c3(OH−)=4.0×10-11;
故答案为:FeCl2+2NaOH=Fe(OH)2↓+2NaCl;4Fe(OH)2+O2+2H2O=4 Fe(OH)3;C(Fe3+)=
Ksp
c3(OH−)=4.0×10-11;
(3)FeCl3的水溶液中铁离子水解显酸性,反应的离子方程式为:Fe3++3H2O⇌Fe(OH)3+3H+,氯化铁溶液得到氯化铁晶体,需要防止铁离子水解,应在稀盐酸或氯化氢气流中加热蒸发浓缩结晶过滤得到晶体;
故答案为:酸;Fe3++3H2O⇌Fe(OH)3+3H+;在盐酸溶液中或氯化氢气流中浓缩结晶并过滤.点评:
本题考点: 物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题考查了物质分离提纯的分析流程的理解应用,掌握物质性质是关键,题目较简单.1年前查看全部
- (2012•海南)在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液处理和资源回收的过程简述如下:(己知:Ksp[Fe(O
(2012•海南)在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液处理和资源回收的过程简述如下:(己知:Ksp[Fe(OH)3]=4.0×10-38)
Ⅰ:向废液中投入过量铁屑,充分反应后分离出固体和滤液:
Ⅱ:向滤液中加入一定量石灰水,调节溶液pH,同时鼓入足量的空气.
回答下列问题:
(1)FeCl3蚀刻铜箔反应的离子方程式为______:
(2)过程Ⅰ加入铁屑的主要作用是______,分离得到固体的主要成分是______,从固体中分离出铜需采用的方法是______;
(3)过程Ⅱ中发生反应的化学方程式为______;
(4)过程Ⅱ中调节溶液的pH为5,金属离子浓度为c(Fe3+)=
=4×10-11mol/L4.0×10−38 (10−9)3 c(Fe3+)=.(列式计算)
=4×10-11mol/L4.0×10−38 (10−9)3  找一个说法1年前1
找一个说法1年前1 -
 蝈蝈是虫 共回答了23个问题
蝈蝈是虫 共回答了23个问题 |采纳率91.3%解题思路:(1)氯化铁和铜反应生成氯化亚铁和氯化铜,依据离子方程式书写方法写出;
(2)过程Ⅰ加入铁屑的主要作用是和氯化铜发生反应生成铜,过滤后得到固体为Fe和Cu,加入盐酸铁反应,铜不反应过滤分离得到铜;
(3)滤液成分为氯化亚铁溶液,加入石灰水反应生成氢氧化亚铁沉淀,在空气中迅速氧化为氢氧化铁;
(4)过程Ⅱ中调节溶液的pH为5,氢氧化铁沉淀溶液中存在沉淀溶解平衡,依据溶度积常数计算.(1)FeCl3蚀刻铜箔反应是三价铁离子具有氧化性和铜反应生成亚铁离子和铜离子,反应的离子方程式为:2Fe3++Cu=2Fe2++Cu2+,故答案为:2Fe3++Cu=2Fe2++Cu2+;
(2)向废液中投入过量铁屑,铁会和三氯化铁溶液反应生成氯化亚铁,和氯化铜反应生成铜和氯化亚铁,所以加入铁粉是为了得到铜,过滤得到固体是过量的铁和铜,用盐酸溶解铁反应,铜不反应过滤得到铜,
故答案为:回收铜;Cu和Fe;加入盐酸反应后过滤;
(3)滤液成分为氯化亚铁溶液,加入石灰水反应生成氢氧化亚铁沉淀,在空气中迅速氧化为氢氧化铁;反应的化学方程式为:FeCl2+Ca(OH)2=Fe(OH)2↓+CaCl2、4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:FeCl2+Ca(OH)2=Fe(OH)2↓+CaCl2 、4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(4)过程Ⅱ中调节溶液的pH为5,常温下溶液中氢氧根离子浓度为10-9mol/L,依据溶度积常数计算铁离子浓度,Fe(OH)3(s)⇌Fe3++3OH-;Ksp=c(Fe3+)×c3(OH-);
c(Fe3+)=
4.0×10−38
(10−9)3=4×10-11mol/L;
故答案为:c(Fe3+)=
4.0×10−38
(10−9)3=4×10-11mol/L.点评:
本题考点: 制备实验方案的设计.
考点点评: 本题考查了铁离子的氧化性,提取铜的反应过程和步骤分析判断,氢氧化铁氢氧化亚铁的转化反应,溶度积的计算应用,题目难度中等.1年前查看全部
- 静电场有介质均匀带电圆柱面电场强度、电势分布一同轴电缆其芯线为R1的铜导线,外导体为R2的铜箔,其间充满各向同性均匀电介
静电场
有介质均匀带电圆柱面电场强度、电势分布一同轴电缆其芯线为R1的铜导线,外导体为R2的铜箔,其间充满各向同性均匀电介质(相对电容率为r,击穿电场强度为Emax),求:(1)求电缆能够承受的最高电压U;(2)当电压增高时介质哪一点先被击穿?(3)求单位长度电缆中的电场能量 daubster1年前2
daubster1年前2 -
 wupeimao 共回答了19个问题
wupeimao 共回答了19个问题 |采纳率84.2%无限长均匀带电圆柱面内外的电场强度分别为
E = 0,E = a/(2πεr)
设有限远 r0 处的电势为零,则电圆柱面外部距轴线为r的任一点的电势为
U = ∫Edr (积分限 r 到 r0 )
= a/(2πε)*ln(r0/r)
圆柱面表面和内部的电势为
U = a/(2πε)*ln(r0/R)1年前查看全部
- 已知:长度285mm,厚度10mm,的铜板,是由50张0.2厚的铜箔叠加而成,两边为平面,中间有拱形圆(R46),两端齐
已知:
长度285mm,厚度10mm,的铜板,是由50张0.2厚的铜箔叠加而成,两边为平面,中间有拱形圆(R46),两端齐平.
求:
1:材料原材料的总长度?
2:0.2厚的铜箔每层递增多少长度才能使两端齐平?
要求:
列出公式,并结算结果!

 bluewing11年前2
bluewing11年前2 -
 ily195807859 共回答了15个问题
ily195807859 共回答了15个问题 |采纳率93.3%先算出拱形圆对应的圆心角A=arccos(1/9),单位取弧度 [内半径36,(36-32)/36=1/9]
再根据第一层的平均半径算出弧长=R1*A 第一层半径是36.1,
再根据最外层的平均半径算出弧长=R50*A 最外层半径是45.9,
其他每层增加0.2,公差0.2A
尾段水平段长好是等差数列,公差是0.2sinA
285长段都相同
所以每层长度差是0.2(1-sinA)
计算出最里层和最外层的长度,然后按等差数列和求总长即可1年前查看全部
- PCB板铜箔的厚度,为什麽不是用微米或毫米的长度计量单位来表示,而是用重量的计量单位盎司来表示?怎样换算成为毫米?
PCB板铜箔的厚度,为什麽不是用微米或毫米的长度计量单位来表示,而是用重量的计量单位盎司来表示?怎样换算成为毫米?
“.意思就是1oz铜箔能压成多少平方英寸的铜箔.”
如果要铜箔的厚度为2oz的PCB,就是1oz铜材压成2平方英寸的铜箔吗?2oz的厚度等于1oz的厚度的一半?或是2倍? iLeeker1年前1
iLeeker1年前1 -
 ezzxyywz 共回答了20个问题
ezzxyywz 共回答了20个问题 |采纳率85%因为刚刚生产pcb时使用的都为压延铜箔,就是把铜块压扁.
单位为1oz/平方英尺,意思就是1oz铜箔能压成多少平方英尺的铜箔.
这个是pcb产业的规定习俗,简称1oz.
楼上说的对:1oz=35微米(大约值)
希望这个能帮到你
我的说法有问题,行规将铜压到极限.将1平方英尺的面积上铜箔重量在28.35g时,将此时的铜箔厚度定为1oz.1oz的实际单位是oz/平方英尺.而不是盎司.
你将1oz看为基准,乘以倍数.就是我们常说的1/3oz、1/2oz、1oz、2oz(由小到大).
记住,1oz的实际单位是oz/平方英尺.是1平方英尺的面积上铜箔重量28.35g,的状态(一般我们视为厚度).这是1oz的定义.再乘以倍数,2oz就是1oz的两倍.1oz是35微米,2oz是70微米.1年前查看全部
- 一道高一化学题 电子工业常用30﹪的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板.
一道高一化学题 电子工业常用30﹪的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板.
某工程师为了从使用过的腐蚀废液中回收铜,并重新获得纯净的FeCl3溶液,准备采用下列步骤:
(1).请写出上述六种物质的化学式
(2).请写出相关的化学方程式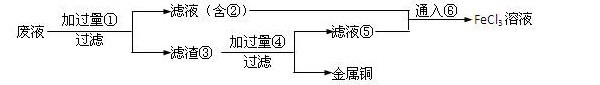
 fxshu1年前1
fxshu1年前1 -
 水恋冰 共回答了15个问题
水恋冰 共回答了15个问题 |采纳率100%(1) Fe FeCl2 Fe Cu HCl FeCl2 Cl2
(2) Fe + Cu2+ = Cu + Fe 2+
Fe + 2Fe3+ = 3 Fe2+
Fe + 2H + = H2 + Fe 2+
2Fe 2+ + Cl2 = 2Fe3+ + 2Cl -1年前查看全部
- 已知一立方厘米的铜质量是8.9克,现用17.8克的铜制成厚度为0.1毫米的铜铝,则这块铜箔的面积是多少平方米?
 mirror81341年前1
mirror81341年前1 -
 一江寸水 共回答了15个问题
一江寸水 共回答了15个问题 |采纳率100%8.9÷17.8=0.5立方厘米
0.1毫米=0.01厘米
0.5÷0.01=50平方厘米=0.5平方分米=0.005平方米1年前查看全部
- 已知:长度285mm,厚度10mm,的铜板,是由50张0.2厚的铜箔叠加而成,两边为平面,中间有拱形圆(R46),
已知:长度285mm,厚度10mm,的铜板,是由50张0.2厚的铜箔叠加而成,两边为平面,中间有拱形圆(R46),
如图所示

 yuanhaolin1年前1
yuanhaolin1年前1 -
 lfjjack 共回答了17个问题
lfjjack 共回答了17个问题 |采纳率82.4%算出两条粗线长285-50-160=75 32+10-10=32
2*46*46cosθ=46²+46²-(75²+32²) 由此求出θ
然后周长很好求吧
还有就是等差数列1年前查看全部
- 电子工业常用30﹪的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板.
电子工业常用30﹪的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板.
某工程师为了从使用过的腐蚀废液中回收铜,并重新获得纯净的FeCl3溶液,准备采用下列步骤:
(1).请写出上述六种物质的化学式
(2).请写出相关的化学方程式 swimg1年前1
swimg1年前1 -
 wbjsl 共回答了27个问题
wbjsl 共回答了27个问题 |采纳率88.9%题目不完整吧.步骤呢?1年前查看全部
- 印刷电路板是由塑料和铜箔复合而成,刻制印刷电路时要用FeCl3溶液作为“腐蚀液”生成CuCl2和FeCl2,其反应的化学
印刷电路板是由塑料和铜箔复合而成,刻制印刷电路时要用FeCl3溶液作为“腐蚀液”生成CuCl2和FeCl2,其反应的化学方程式如下:Cu+2FeCl3═CuCl2+2FeCl2
(1)上述反应中被氧化的元素是______;
(2)写出FeCl3的电离方程式:______.
(3)使用过的腐蚀液会失效,但还可以回收利用,其中有一步需要将Fe2+转化为Fe3+,下列试剂能实现上述变化的是______(填序号)
A.氯气B.铁C.双氧水D.稀硫酸
(4)若要由反应后的废液回收金属铜和得到较纯净的FeCl2溶液,你选择加入的物质是______. luciferniuniu1年前1
luciferniuniu1年前1 -
 wang0913 共回答了25个问题
wang0913 共回答了25个问题 |采纳率92%解题思路:反应Cu+2FeCl3═CuCl2+2FeCl2中,Cu元素化合价由0价升高到+2价,被氧化,Fe元素化合价由+3价降低到+2价,被还原;
将Fe2+转化为Fe3+,应加入氧化剂,且不能引入新杂质,要由反应后的废液回收金属铜和得到较纯净的FeCl2溶液,可加入铁,以此解答该题.(1)反应Cu+2FeCl3═CuCl2+2FeCl2中,Cu元素化合价由0价升高到+2价,被氧化,故答案为:Cu;
(2)FeCl3为强电解质,可完全电离,电离方程式为FeCl3=Fe3++3Cl-,故答案为:FeCl3=Fe3++3Cl-;
(3)将Fe2+转化为Fe3+,需要加入氧化剂,选项中氯气和双氧水都能作氧化剂,氧化Fe2+生成Fe3+,故答案为:A、C;
(4)CuCl2中加入Fe能生成Cu和氯化亚铁,所以由反应后的废液回收金属铜和得到较纯净的FeCl2溶液,应加入Fe粉,故答案为:Fe.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查了铁和铜的单质及化合物的性质,涉及氧化还原反应,氧化剂的选择,为高频考点,侧重于学生的分析能力和实验能力的考查,题目难度不大.1年前查看全部
大家在问
- 1在一副扑克牌中取牌面花色分别为黑桃、红心、方块各一张,洗匀后正面朝下放在桌面上。
- 2关于离别的古文和古诗(摘一句即可)
- 3恒星彗星行星的区别如题
- 4用英语写你对常回家看看的认识
- 5一个数的4分之3,比120的4分之1多3,这个数是多少?
- 6设f(x+x-1)=x3+x-3 g(x+x-1)=x2+x-2,求f(g(x))
- 7《大卫 科波菲尔》、《飘》,这两本书中优美段落与句子.
- 81 4 13 40 ( ) 243 ( )
- 9求Lg15的值
- 10王阿姨家离单位约2000米,她每天早上步行上班,每分钟大约可以走60~70米,王阿姨每天早上上班大约要走( )分钟.
- 11OTC,PTP,RTR,
- 12小明期中考试语文成绩85分,数学成绩93分,英语成绩比三科的平均分多2分.小明的平均成绩是几分?英语成绩是几分?
- 13形单影只的近义词
- 14if you have a stomach,you should'nt eat ___24 hours .
- 15人教版小学语文所有寓言故事和成语故事的人物.
