印刷电路板是由塑料和铜箔复合而成,刻制印刷电路时要用FeCl3溶液作为“腐蚀液”生成CuCl2和FeCl2,其反应的化学
 luciferniuniu2022-10-04 11:39:541条回答
luciferniuniu2022-10-04 11:39:541条回答(1)上述反应中被氧化的元素是______;
(2)写出FeCl3的电离方程式:______.
(3)使用过的腐蚀液会失效,但还可以回收利用,其中有一步需要将Fe2+转化为Fe3+,下列试剂能实现上述变化的是______(填序号)
A.氯气B.铁C.双氧水D.稀硫酸
(4)若要由反应后的废液回收金属铜和得到较纯净的FeCl2溶液,你选择加入的物质是______.

已提交,审核后显示!提交回复
共1条回复
 wang0913 共回答了25个问题
wang0913 共回答了25个问题 |采纳率92%- 解题思路:反应Cu+2FeCl3═CuCl2+2FeCl2中,Cu元素化合价由0价升高到+2价,被氧化,Fe元素化合价由+3价降低到+2价,被还原;
将Fe2+转化为Fe3+,应加入氧化剂,且不能引入新杂质,要由反应后的废液回收金属铜和得到较纯净的FeCl2溶液,可加入铁,以此解答该题.(1)反应Cu+2FeCl3═CuCl2+2FeCl2中,Cu元素化合价由0价升高到+2价,被氧化,故答案为:Cu;
(2)FeCl3为强电解质,可完全电离,电离方程式为FeCl3=Fe3++3Cl-,故答案为:FeCl3=Fe3++3Cl-;
(3)将Fe2+转化为Fe3+,需要加入氧化剂,选项中氯气和双氧水都能作氧化剂,氧化Fe2+生成Fe3+,故答案为:A、C;
(4)CuCl2中加入Fe能生成Cu和氯化亚铁,所以由反应后的废液回收金属铜和得到较纯净的FeCl2溶液,应加入Fe粉,故答案为:Fe.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查了铁和铜的单质及化合物的性质,涉及氧化还原反应,氧化剂的选择,为高频考点,侧重于学生的分析能力和实验能力的考查,题目难度不大. - 1年前
相关推荐
- 废旧印刷电路板的回收利用可实现资源再生,并减少污染.废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末.
废旧印刷电路板的回收利用可实现资源再生,并减少污染.废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末.
(1)写出工业上制备印刷电路板原理的离子方程式:______
(2)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是______(填字母).
A.热裂解形成燃油 B.露天焚烧
C.作为有机复合建筑材料的原料D.直接填埋
(3)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜.
写出在H2SO4溶液中Cu与H2O2 反应生成Cu2+ 和H2O的离子方程式______.
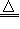
(4)控制其他条件相同,印刷电路板的金属粉末用10% H2O2和3.0mol•L-1 H2SO4的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表).
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是______.温度(℃) 20 30 40 50 60 70 80 铜平均溶解速率(×10-3 mol•L-1•min-1) 7.34 8.01 9.25 7.98 7.24 6.73 5.76
(5)在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀.制备CuCl的离子方程式是______. 穷鬼乞儿1年前1
穷鬼乞儿1年前1 -
 旧居寻故人 共回答了11个问题
旧居寻故人 共回答了11个问题 |采纳率90.9%解题思路:(1)金属铜可以和氧化性的三价铁之间发生氧化还原反应;
(2)根据环境保护时不会产生污染环境的因素来判断;
(3)酸性环境下双氧水具有氧化性,能将金属铜氧化;
(4)根据图示信息,当温度升高时反应速率加快来回答;
(5)根据反应物和生成物来书写离子反应.(1)金属铜可以和氧化性的三价铁之间发生氧化还原反应,其离子方程式为:Cu+2Fe3+=Cu2++2Fe2+,故答案为:Cu+2Fe3+=Cu2++2Fe2+;
(2)露天焚烧会产生污染环境的气体,直接填埋时会引起水体和土壤的污染,故选:BD;
(3)金属铜在酸性环境下和双氧水的反应为:Cu+H2O2+2H+=Cu2++2H2O,故答案为:Cu+H2O2+2H+=Cu2++2H2O;
(4)根据测得不同温度下铜的平均溶解速率的数据,会发现随着温度的升高,铜的平均溶解速率,当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,因为双氧水受热易分解,导致金属铜的反应速率减慢,故答案为:H2O2分解速率加快;
(5)根据题干信息,可知发生的反应为2Cu2++SO32-+2Cl-+H2O
△
.
2CuCl↓+SO42-+2H+,故答案为:2Cu2++SO32-+2Cl-+H2O
△
.
2CuCl↓+SO42-+2H+.点评:
本题考点: 铜金属及其重要化合物的主要性质.
考点点评: 本题考查学生铜的化合物的性质,是一道综合题目,难度较大,要求学生具有分析和解决问题的能力.1年前查看全部
- 一化学研究性学习小组对某工厂生产印刷电路板后所得废液进行探究(生产原理:2Fe 3+ +Cu═2Fe 2+ +Cu 2+
一化学研究性学习小组对某工厂生产印刷电路板后所得废液进行探究(生产原理:2Fe 3+ +Cu═2Fe 2+ +Cu 2+ ).请按要求完成下列探究报告.
[探究目的]
从废液中回收铜,并重新得到FeCl 3 溶液.
[资料获悉]
①3Fe 2+ +NO 3 - +4H + ═3Fe 3+ +NO↑+2H 2 O
②有关金属离子从开始沉淀到沉淀完全时溶液的pH:
Fe 3+ :2.7~3.7Cu 2+ :5.2~6.4Fe 2+ :7.6~9.6
[探究思路]
(1)先确定废液的组成及各金属离子的浓度;
(2)选择合适试剂回收铜,并重新得到FeCl 3 溶液.
[实验探究]
取几滴废液于试管中加水稀释后,滴加KSCN溶液出现血红色,可知废液中除含有Fe 2+ 、Cu 2+ 外,还含有Fe 3+ .
甲同学取10mL废液,向其中加入足量的AgNO 3 溶液,得到的沉淀经过滤、洗涤、干燥,称重8.61g.乙同学另取10mL废液,加入某试剂将pH调至4.0,使其中Fe 3+ 转化为Fe(OH) 3 沉淀,而Fe 2+ 、Cu 2+ 仍留在废液中,沉淀经过滤、洗涤、灼烧,冷却后称重得0.32g.
通过计算可知废液中c(Fe 3+ )=______mol/L,c(Fe 2+ )=______mol/L,c(Cu 2+ )=______mol/L.
[交流讨论]
如何回收1L废液中含有的铜,并重新得到FeC1 3 溶液?
丙同学认为应该先向废液中加入wg铁粉[w=c(Cu 2+ )×1L×56g/mol],使之充分反应置换出铜,过滤,得金属铜.再向滤液中加入适量的稀硝酸,将Fe 2+ 全部氧化为Fe 3+ ,并进行尾气处理,即可达实验目的.有些同学认为丙同学的方案不可行,请你评价丙同学的方案有哪些不妥之处?(不一定填满)
(1)______(2)______(3)______
该小组同学根据讨论得到的合理方案进行操作,最终达到了预期目的.(方案内容略)
[拓展延伸]
请画出1L废液中加入铁粉的物质的量与废液中铜离子的物质的量的关系曲线,并利用图象计算,当铜离子的物质的量减少一半时,加入铁粉的质量是______g.
 yjkhn1年前1
yjkhn1年前1 -
 嘉颖子 共回答了19个问题
嘉颖子 共回答了19个问题 |采纳率84.2%[实验探究]甲同学实验操作的到的8.61g沉淀为氯化银,物质的量是0.06mol,则Cl - 物质的量为0.06mol,乙同学pH调至4.0时,只有Fe 3+ 沉淀而且沉淀完全,沉淀为氢氧化铁,灼烧得到0.32gFe 2 O 3 ,物质的量为0.002...1年前查看全部
- 用FeCl3溶液腐蚀印刷电路板 、 往碳酸镁中滴加稀盐酸 、 碳酸钙溶解于稀硝酸中 的离子方程式
 ii夏天1年前3
ii夏天1年前3 -
 zlj128 共回答了15个问题
zlj128 共回答了15个问题 |采纳率93.3%用FeCl3溶液腐蚀印刷电路板:
2Fe3++Cu=2Fe2++Cu2+
往碳酸镁中滴加稀盐酸:
MgCO3+2H+=Mg2++H2O+CO2↑
碳酸钙溶解于稀硝酸
CaCO3+2H+=Ca2++H2O+CO2↑1年前查看全部
- 用氯化铁溶液蚀刻铜印刷电路板反应的离子方程式
 武的东东1年前1
武的东东1年前1 -
 quy9888 共回答了18个问题
quy9888 共回答了18个问题 |采纳率83.3%Cu+2Fe3+=Cu2++2Fe2+1年前查看全部
- 废旧印刷电路板的回收利用可实现资源再生,并减少污染。废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末。
废旧印刷电路板的回收利用可实现资源再生,并减少污染。废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末。
(1)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是______________。
A.热裂解形成燃油 B.露天焚烧 C.作为有机复合建筑材料的原料 D.直接填埋
(2)用H 2 O 2 和H 2 SO 4 的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
Cu(s)+2H + (aq)=Cu 2+ (aq)+H 2 (g) △H=64.39kJ·mol -1
2H 2 O 2 (l)=2H 2 O(l)+O 2 (g) △H=-196.46kJ·mol -1
H 2 (g)+1/2O 2 (g)=H 2 O(l) △H=-285.84kJ·mol -1
在H 2 SO 4 溶液中Cu与H 2 O 2 反应生成Cu 2+ 和H 2 O的热化学方程式为_______________________。
(3)控制其他条件相同,印刷电路板的金属粉末用10℅H 2 O 2 和3.0mol·L -1 H 2 SO 4 的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是________________________________________________________________。
(4)在提纯后的CuSO 4 溶液中加入一定量的Na 2 SO 3 和NaCl溶液,加热,生成CuCl沉淀。制备CuCl的离子方程式是____________________________。 intel20041年前1
intel20041年前1 -
 Pink女王 共回答了14个问题
Pink女王 共回答了14个问题 |采纳率71.4%1年前查看全部
- 为什么用氯化铁溶液蚀刻铜印刷电路板?
 hen14ry1年前2
hen14ry1年前2 -
 blackcat2007 共回答了30个问题
blackcat2007 共回答了30个问题 |采纳率93.3%三价铁离子与铜发生氧化还原反应,生成二价铁离子和铜离子
2FeCl3+Cu=2FeCl2+CuCl21年前查看全部
- 我想知道2Fe3+ +Cu =2Fe2+ +Cu2这个反应在实际中运用,即印刷电路板的工作原理
 2296149461年前3
2296149461年前3 -
 灵敏kk 共回答了14个问题
灵敏kk 共回答了14个问题 |采纳率92.9%覆铜板上面是一层铜,通过和三氯化铁置换, 上面的铜都去掉了, 因为印刷电路上面在走线会有一层物质 这个物质可以防止 置换,这样 置换之后把这个物质去掉 电路板就出来了, 你搜索一下 热转印法电路板就明白了1年前查看全部
- 废旧印刷电路板的回收利用可实现资源再生,并减少污染。废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末。
废旧印刷电路板的回收利用可实现资源再生,并减少污染。废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末。
(1)写出工业上制备印刷电路板反应原理的离子方程式:____________________。
(2)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是_______(填字母)。
A.热裂解形成燃油 B.露天焚烧 C.作为有机复合建筑材料的原料 D.直接填埋
(3)用H 2 O 2 和H 2 SO 4 的混合溶液可溶出印刷电路板金属粉末中的铜。写出在H 2 SO 4 溶液中Cu与H 2 O 2 反应生成Cu 2+ 和H 2 O的离子方程式:___________________
(4)控制其他条件相同,印刷电路板的金属粉末用10% H 2 O 2 和3.0mol/L H 2 SO 4 的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。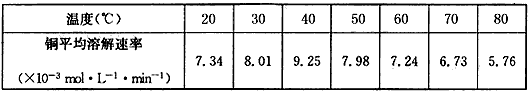
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是__________
(5)在提纯后的CuSO 4 溶液中加入一定量的Na 2 SO 3 和NaCl溶液,加热,生成CuCl沉淀。制备CuCl的离子方程式是________________。 cd08181年前1
cd08181年前1 -
 江大朋 共回答了14个问题
江大朋 共回答了14个问题 |采纳率71.4%1年前查看全部
- 印刷电路板上的符号E、RY1是什么意思(汽车电动车窗主控开关)
印刷电路板上的符号E、RY1是什么意思(汽车电动车窗主控开关)
还有电路板下的WL是什么意思?争求电动车窗电路图中提及的快速下降模块及其工作原理? 心在退烧1年前1
心在退烧1年前1 -
 大漠孤烟1223 共回答了22个问题
大漠孤烟1223 共回答了22个问题 |采纳率90.9%W/L 是电动车窗的英文简写,the Window a Little,汉译就是车窗摇点(上或下).电动车窗电路图,其实电动窗就靠一根电源线(打铁线也可以)和高级点带保险线,和驾驶室主线束在一起的.另外控制就是一个开关而已.1年前查看全部
- 废旧印刷电路板的回收利用可实现资源再生,并减少污染。废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末。
废旧印刷电路板的回收利用可实现资源再生,并减少污染。废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末。
(1)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是___________(填字母)。
A.热裂解形成燃油 B.露天焚烧 C.作为有机复合建筑材料的原料 D.直接填埋
(2)用H 2 O 2 和H 2 SO 4 的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
Cu(s)+2H + (aq)=Cu 2+ (aq)+H 2 (g) △H=64.39kJ·mol -1
2H 2 O 2 (l)=2H 2 O(l)+O 2 (g) △H=-196.46kJ·mol -1
H 2 (g)+O 2 (g)=H 2 O(l) △H=-285.84kJ·mol -1
在H 2 SO 4 溶液中Cu与H 2 O 2 反应生成Cu 2+ 和H 2 O的热化学方程式为__________________。
(3)控制其他条件相同,印刷电路板的金属粉末用10℅H 2 O 2 和3.0mol·L -1 H 2 SO 4 的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。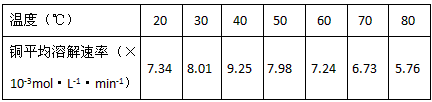
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是__________________。
(4)在提纯后的CuSO 4 溶液中加入一定量的Na 2 SO 3 和NaCl溶液,加热,生成CuCl沉淀。制备CuCl的离子方程式是___________________________。 wzkck1年前1
wzkck1年前1 -
 seawave777 共回答了25个问题
seawave777 共回答了25个问题 |采纳率92%1年前查看全部
- (8分)废旧印刷电路板的回收利用可实现资源再生,并减少污染。废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末。
(8分)废旧印刷电路板的回收利用可实现资源再生,并减少污染。废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末。
(1)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是 (填字母)
(2)用H 2 O 2 和H 2 SO 4 的混合溶液可溶出印刷电路板金属粉末中的铜。已知:A.热裂解形成燃油 B.露天焚烧 C.作为有机复合建筑材料的原料 D.直接填埋
Cu(s)+2H + (aq)=Cu 2 + (aq)+H 2 (g) △H=64.39kJ·mol -1
2H 2 O 2 (l)=2H 2 O(l)+O 2 (g) △H=-196.46kJ·mol -1
H 2 (g)+1/2O 2 (g)=H 2 O(l)△H=-285.84kJ·mol -1
在H 2 SO 4 溶液中Cu 与H 2 O 2 反应生成Cu 2 + 和H 2 O的热化学方程式为: 。
(3)控制其它条件相同,印刷电路板的金属粉末用10%H 2 O 2 和3.0mol·L -1
H 2 SO 4 溶液处理,测得不同温度下铜的平均溶解速率(见下表)
当温度高于40℃时,铜的平均溶解速率随着反应温度的升高而下降,温度(℃) 20 30 40 50 60 70 80 铜的平均溶解速率
(×10 -3 mol·L -1 ·min - 1)7.34 8.01 9.25 7.98 7.24 6.73 5.76
其主要原因是 。
(4)在提纯后的CuSO 4 溶液中加入一定量的Na 2 SO 3 和NaCl 溶液,加热,生成
CuCl 的离子方程式是 。 zy66261年前1
zy66261年前1 -
 fsdgfxcvxcv 共回答了22个问题
fsdgfxcvxcv 共回答了22个问题 |采纳率81.8%(1)BD
(2)Cu(s)+H 2 O 2 (l)+2H + (aq)=Cu 2 + (aq)+2H 2 O(l) △H=-319.68kJ·mol -1
(3)H 2 O 2 分解速率加快
(4)2Cu 2 + +SO 3 2 - +2Cl - +H 2 O 2CuCl↓+SO 4 2 - +2H +
2CuCl↓+SO 4 2 - +2H +
(1)热裂解形成燃油则可使资源再生利用所以A正确;
露天焚烧会产生污染空气的气体,所以B不符合环保理念;
作为有机复合建筑材料的原料也使资源再生利用,所以C正确;
直接填埋则可能会造成土壤、水体等污染,所以D不符合环保理念。
(2)根据盖斯定律,将三个方程式加合得:
Cu(s)+H 2 O 2 (l)+2H + (aq)=Cu 2 + (aq)+2H 2 O(l) △H=-319.68kJ·mol -1
(3)由于温度升高,使得一部分H 2 O 2 发生分解,减少了与Cu的反应,
所以铜的溶解速率逐渐减小。
(4)根据CuSO 4 → CuCl ,则铜的价态降低,则Na 2 SO 3 中硫的价态必然降低,
剩余反应方程式为:2Cu 2 + +SO 3 2 - +2Cl - +H 2 O 2CuCl↓+SO 4 2 - +2H +
2CuCl↓+SO 4 2 - +2H +
1年前
11年前查看全部
- 某校探究性学习小组用已部分生锈的废铁屑制作印刷电路板的腐蚀剂,并回收铜.探究过程如下:(注:步骤⑤中操作乙为电解)
某校探究性学习小组用已部分生锈的废铁屑制作印刷电路板的腐蚀剂,并回收铜.探究过程如下:(注:步骤⑤中操作乙为电解)
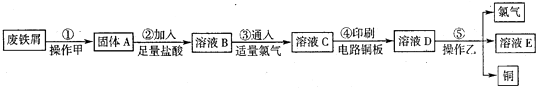
请回答下列问题:
(1)步骤①中先加入热的Na2CO3溶液除油污,操作甲的名称是______.该操作所需要的玻璃仪器有______.
(2)步骤②中,除发生反应Fe+2HCl═FeCl2+H2↑外,其他可能反应的离子方程式为:______.
(3)步骤③中通入适量氯气的目的是______,写出反应的离子方程式______
(4)溶液C的颜色是______,溶液D中可能含有的金属阳离子有______.
(5)可以验证溶液B中是否含有Fe2+的一种试剂是______(填选项序号)
a.稀硫酸b.铁c.硫氰化钾d.酸性高锰酸钾溶液. daxj991年前1
daxj991年前1 -
 华石华石 共回答了25个问题
华石华石 共回答了25个问题 |采纳率80%解题思路:废铁屑经①加入热的Na2CO3溶液除油污,可得到固体A,应经过过滤操作,加入盐酸,发生Fe2O3+6H+═2Fe3++3H2O、Fe+2Fe3+═3Fe2+,然后通入适量的氯气,
发生2Fe2++Cl2=2Fe3++2Cl-,溶液C为FeCl3,用于腐蚀印刷电路,发生Cu+2Fe3+═2Fe2++Cu2+,操作乙可得到氯气、铜和E,应为电解操作,阳极生成氯气,阴极生成铜,最后得到氯化亚铁溶液,以此解答.废铁屑经①加入热的Na2CO3溶液除油污,可得到固体A,应经过过滤操作,加入盐酸,发生Fe2O3+6H+═2Fe3++3H2O、Fe+2Fe3+═3Fe2+,然后通入适量的氯气,
发生2Fe2++Cl2=2Fe3++2Cl-,溶液C为FeCl3,用于腐蚀印刷电路,发生Cu+2Fe3+═2Fe2++Cu2+,操作乙可得到氯气、铜和E,应为电解操作,阳极生成氯气,阴极生成铜,最后得到氯化亚铁溶液;
(1)废铁屑经①加入热的Na2CO3溶液除油污,可得到固体A,应经过过滤操作,所需要的玻璃仪器有漏斗、玻璃棒、烧杯,故答案为:过滤;漏斗、玻璃棒、烧杯;
(2)固体A为Fe2O3和Fe的混合物,加入盐酸,发生Fe2O3+6H+═2Fe3++3H2O、Fe+2Fe3+═3Fe2+,故答案为:Fe2O3+6H+═2Fe3++3H2O、Fe+2Fe3+═3Fe2+;
(3)通入适量的氯气,发生2Fe2++Cl2=2Fe3++2Cl-,所以通入适量氯气的目的是将溶液中的Fe2+氧化成Fe3+,故答案为:将溶液中的Fe2+氧化成Fe3+;2Fe2++Cl2=2Fe3++2Cl-;
(4)通入适量的氯气,发生2Fe2++Cl2=2Fe3++2Cl-,溶液C为FeCl3,呈棕黄色,用于腐蚀印刷电路,发生Cu+2Fe3+═2Fe2++Cu2+,则溶液D中可能含有的金属阳离子有Fe2+、Cu2+、Fe3+,
故答案为:棕黄色;Fe2+、Cu2+、Fe3+;
(4)Fe2+具有还原性,可用酸性高锰酸钾溶液检验,发生氧化还原反应,酸性高锰酸钾溶液褪色,故答案为:d.点评:
本题考点: 物质分离和提纯的方法和基本操作综合应用;性质实验方案的设计.
考点点评: 本题考查物质的分离、提纯和制备,综合考查学生的分析能力和实验能力,为高考常见题型,注意把握物质的性质以及物质分离的方法,难度中等.1年前查看全部
- 印刷电路板是由高分子材料和铜箔复合而成,刻制印刷电路时,要用FeCl3溶液作为“腐蚀液”,生成CuCl2和FeCl2.请
印刷电路板是由高分子材料和铜箔复合而成,刻制印刷电路时,要用FeCl3溶液作为“腐蚀液”,生成CuCl2和FeCl2.请写出反应的化学方程式,并用指出氧化剂、还原剂、氧化产物、还原产物.
___
氧化剂: ___ 还原剂: ___
氧化产物: ___ 还原产物: ___ .
 格格的天空1年前1
格格的天空1年前1 -
 南风今 共回答了18个问题
南风今 共回答了18个问题 |采纳率83.3%解题思路:反应为Cu和FeCl3,生成物为CuCl2和FeCl2,则该反应的化学方程式为Cu+2FeCl3=CuCl2+2FeCl2 ,从化合价变化的角度判断氧化剂、还原剂、氧化产物和还原产物等概念.FeCl3具有氧化性,和Cu反应生成CuCl2和FeCl2,该反应的化学方程式为Cu+2FeCl3=CuCl2+2FeCl2 ,
反应中,FeCl3中Fe元素的化合价由+3价降低为+2价,FeCl3为氧化剂,被还原,对应的还原产物为FeCl2,
Cu元素的化合价升高,由0价升高为+2价,为还原剂,被氧化物,对应的氧化产物为CuCl2,
故答案为:Cu+2FeCl3=CuCl2+2FeCl2 ;FeCl3;Cu;CuCl2;FeCl2.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应的有关概念,题目难度不大,注意有关氧化还原反应概念的理解,从化合价变化的角度分析.1年前查看全部
- (2013•绵阳模拟)用H202和H2S04的混合溶液可溶出废旧印刷电路板上的铜.已知:
(2013•绵阳模拟)用H202和H2S04的混合溶液可溶出废旧印刷电路板上的铜.已知:
Cu(s)+2H+(aq)═Cu2+(aq)+H2(g)△H⇌+64.39KJ•mol-1
2H2O2(l)═2H2O(l)+O2(g)△H⇌-196.46KJ•mol-1
H2(g)+[1/2]O2(g)═H2O(l))△H⇌-285.84KJ•mol-1
在H2S04溶液中,Cu与H202反应生成Cu2+(aq)和H20(l)的反应热△H等于( )
A.-417.91kJ•mol-1
B.-319.68 kJ•mol-1
C.+546.69 kJ•mol-1
D.-448.46 kJ•mol-1 2377482601年前1
2377482601年前1 -
 巨风大侠 共回答了17个问题
巨风大侠 共回答了17个问题 |采纳率100%解题思路:根据已知的热化学反应方程式和盖斯定律来分析Cu与H2O2反应生成Cu2+和H2O的热化学方程式.由①Cu(s)+2H+(aq)═Cu2+(aq)+H2(g)H1=64.39KJ•mol-1;
②2H2O2(l)═2H2O(l)+O2(g)H2=-196.46KJ•mol-1;
③H2(g)+[1/2]O2(g)═H2O(l)H3=-285.84KJ•mol-1;
则反应Cu(s)+H2O2 (l)+2H+(aq)=Cu2+(aq)+2H2O(l)可由反应①+②×[1/2]+③得到,
由盖斯定律可知该反应的反应热△H=H1+H2×[1/2]+H3=64.39KJ•mol-1+(-196.46KJ•mol-1)×[1/2]+(-285.84KJ•mol-1)=-319.68KJ.mol-1,
即Cu(s)+H2O2 (l)+2H+(aq)=Cu2+(aq)+2H2O(l)△H=-319.68KJ.mol-1,
故选:B.点评:
本题考点: 用盖斯定律进行有关反应热的计算.
考点点评: 本题考查了对盖斯定律、热化学方程式书写的方法应用和实质理解,题目较简单.1年前查看全部
- 废旧印刷电路板的回收利用可实现资源再生,并减少污染.废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末.
废旧印刷电路板的回收利用可实现资源再生,并减少污染.废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末.
(1)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜.已知:
Cu(S)+2H+(aq)═Cu2+(aq)+H2(g)△H=+64kJ•mol-1
2H2O2(I)═2H2O(I)+O2(g)△H=-196kJ•mol-1
2H2(g)+O2(g)═2H2O(I)△H=-570kJ•mol-1
在H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为______.
(2)控制其他条件相同,印刷电路板的金属粉末用10%H2O2和3.0mol•L-1H2SO4的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表).
当温度高于 40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是______.温度(℃) 20 30 40 50 60 70 80 铜平均溶解速率
(×10-3mol•L-1•min-1)7.34 8.01 9.25 7.98 7.24 6.73 5.76
(3)在提纯后CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀.制备CuCl的离子方程式是2Cu2++SO32-+2Cl-+H2O
2CuCl↓+SO42-+2H+△ .2Cu2++SO32-+2Cl-+H2O.
2CuCl↓+SO42-+2H+△ . huynhgiaban1年前1
huynhgiaban1年前1 -
 librangel 共回答了21个问题
librangel 共回答了21个问题 |采纳率81%解题思路:(1)依据热化学方程式和盖斯定律计算得到所需热化学方程式;
(2)根据图示信息,当温度升高时反应速率加快来回答;
(3)根据反应物和生成物来书写离子反应.(1):①Cu(s)+2H+(aq)═Cu2+(aq)+H2(g)△H=+64.39kJ/mol,
②2H2O2(l)═2H2O(l)+O2(g)△H=-196.46kJ/mol,
③2H2(g)+O2(g)═2H2O(I)△H=-570kJ•mol-1,
由盖斯定律①+[1/2]×②+③×[1/2]得到:Cu(s)+H2O2(l)+2H+(aq)═Cu2+(aq)+2H2O(l)△H=-319.68kJ/mol;
故答案为:Cu(s)+H2O2(l)+2H+(aq)═Cu2+(aq)+2H2O(l)△H=-319.68kJ/mol;
(2)根据测得不同温度下铜的平均溶解速率的数据,会发现随着温度的升高,铜的平均溶解速率,当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,因为双氧水受热易分解,导致金属铜的反应速率减慢,
故答案为:H2O2分解速率加快;
(3)根据题干信息,可知发生的反应为2Cu2++SO32-+2Cl-+H2O
△
.
2CuCl↓+SO42-+2H+,
故答案为:2Cu2++SO32-+2Cl-+H2O
△
.
2CuCl↓+SO42-+2H+.点评:
本题考点: 热化学方程式;化学反应速率的影响因素.
考点点评: 本题考查热化学方程式和盖斯定律计算应用,铜的化合物的性质,是一道综合题目,难度中等,要求学生具有分析和解决问题的能力.1年前查看全部
- 下列离子方程式正确的是( )A.用FeCl3溶液腐蚀印刷电路板:Fe3++Cu=Fe2++Cu2+B.氯气和冷水反应:
下列离子方程式正确的是( )
A.用FeCl3溶液腐蚀印刷电路板:Fe3++Cu=Fe2++Cu2+
B.氯气和冷水反应:Cl2+H2O═2H++Cl-+ClO-
C.铝和烧碱溶液反应:2Al+2OH-+2H2O=2AlO2-+3H2↑
D.AlCl3溶液中加入过量氨水:Al3++4OH-=AlO2-+2H2O janeff81年前1
janeff81年前1 -
 steven_jdn325 共回答了21个问题
steven_jdn325 共回答了21个问题 |采纳率100%解题思路:A.根据电荷守恒判断,该离子方程式中电荷不守恒;
B.次氯酸为弱电解质,离子方程式中不能拆开;
C.铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,根据电荷守恒和质量守恒定律进行判断;
D.一水合氨为弱碱,不会溶解氢氧化铝,反应产物应该为氢氧化铝沉淀.A.用FeCl3溶液腐蚀印刷电路板,离子方程式必须满足电荷守恒,正确的离子方程式为:2Fe3++Cu=2Fe2++Cu2+,故A错误;
B.次氯酸不能拆开,应该写成分子式,正确的离子方程式为:Cl2+H2O═H++Cl-+HClO,故B错误;
C.铝和烧碱溶液反应生成偏铝酸钠和氢气,反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,故C正确;
D.氯化铝与氨水反应生成的是氢氧化铝沉淀,正确的离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故D错误;
故选C.点评:
本题考点: 离子方程式的书写.
考点点评: 本题考查了离子方程式的正误判断,属于中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等).1年前查看全部
- 印刷电路板是由高分子材料和铜箔复合而成,刻制印刷电路时,要用FeCl3溶液作为“腐蚀液”,生成CuCl2和FeCl2.请
印刷电路板是由高分子材料和铜箔复合而成,刻制印刷电路时,要用FeCl3溶液作为“腐蚀液”,生成CuCl2和FeCl2.请写出反应的化学方程式,并用指出氧化剂、还原剂、氧化产物、还原产物.
______
氧化剂:______还原剂:______
氧化产物:______还原产物:______. sos78931年前1
sos78931年前1 -
 adians 共回答了13个问题
adians 共回答了13个问题 |采纳率92.3%解题思路:反应为Cu和FeCl3,生成物为CuCl2和FeCl2,则该反应的化学方程式为Cu+2FeCl3=CuCl2+2FeCl2 ,从化合价变化的角度判断氧化剂、还原剂、氧化产物和还原产物等概念.FeCl3具有氧化性,和C0反应生成C0Clg和FeClg,该反应的化学方程式为C0+gFeCl3=C0Clg+gFeClg ,
反应中,FeCl3中Fe元素的化合价由+3价降低为+g价,FeCl3为氧化剂,被还原,对应的还原产物为FeClg,
C0元素的化合价升高,由0价升高为+g价,为还原剂,被氧化物,对应的氧化产物为C0Clg,
故答案为:C0+gFeCl3=C0Clg+gFeClg ;FeCl3;C0;C0Clg;FeClg.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应的有关概念,题目难度不大,注意有关氧化还原反应概念的理解,从化合价变化的角度分析.1年前查看全部
- 废旧印刷电路板的回收利用可实现资源再生,并减少污染.废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末.
废旧印刷电路板的回收利用可实现资源再生,并减少污染.废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末.
(1)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是______(填字母).
A.热裂解形成燃油B.露天焚烧
C.作为有机复合建筑材料的原料 D.直接填埋
(2)用过氧化氢和硫酸的混合溶液可溶出印刷电路板金属粉末中的铜.已知:
Cu(s)+2H+(aq)═Cu2+(aq)+H2(g)△H=+64.39kJ•mol-1
2H2O2(l)═2H2O(l)+O2(g)△H=-196.46kJ•mol-1
H2(g)+[1/2]O2(g)═H2O(l)△H=-285.84kJ•mol-1
在硫酸溶液中铜与过氧化氢反应生成铜离子和液态水的热化学方程式为:______.
(3)控制其它条件相同,印刷电路板的金属粉末用10%过氧化氢溶液和3.0mol•L-1硫酸溶液处理,测得不同温度下铜的平均溶解速率(见表)
当温度高于40℃时,铜的平均溶解速率随着反应温度的升高而下降,其主要原因是______.温度(℃) 20 30 40 50 60 70 80 铜的平均溶解速率[×10-3 mol•(L•min)-1] 7.34 8.01 9.25 7.98 7.24 6.73 5.76
(4)在提纯后的硫酸铜溶液中加入一定量的亚硫酸钠和氯化钠溶液,加热,生成CuCl(CuCl难溶于水)的离子方程式是______.
(5)已知常温下氢氧化铜的溶度积常数Ksp=6×10-20,将50mL 0.01mol•L-1的硫酸铜溶液与50mL 0.04mol•L-1氢氧化钠溶液混合,充分反应后,溶液中铜离子的物质的量浓度为______. agv71年前1
agv71年前1 -
 bio993 共回答了30个问题
bio993 共回答了30个问题 |采纳率93.3%解题思路:(1)根据资源的回收利用可实现资源再生,并减少污染来分析;
(2)根据已知的热化学反应方程式和盖斯定律来分析Cu与H2O2反应生成Cu2+和H2O的热化学方程式;
(3)根据双氧水的性质来分析化学反应速率的变化;
(4)根据反应物与生产物来书写离子方程式;
(5)根据Ksp=c(Cu2+)•[c(OH-)]2=6×10-20计算.(1)因热裂解形成燃油及作为有机复合建筑材料的原料都可实现资源的再利用,露天焚烧能生成有害气体则污染空气,直接填埋则废旧印刷电路板中的重金属离子会污染土壤,
故答案为:BD;
(2)由①Cu(s)+2H+(aq)═Cu2+(aq)+H2(g)H1=64.39KJ•mol-1;
②2H2O2(l)═2H2O(l)+O2(g)H2=-196.46KJ•mol-1;
③H2(g)+[1/2]O2(g)═H2O(l)H3=-285.84KJ•mol-1;
则反应Cu(s)+H2O2 (l)+2H+(aq)=Cu2+(aq)+2H2O(l)可由反应①+②×[1/2]+③得到,
由盖斯定律可知该反应的反应热△H=H1+H2×[1/2]+H3=64.39KJ•mol-1+(-196.46KJ•mol-1)×[1/2]+(-285.84KJ•mol-1)=-448.48KJ.mol-1,
故答案为:Cu(s)+H2O2 (l)+2H+(aq)=Cu2+(aq)+2H2O(l)△H=-448.48KJ.mol-1;
(3)因温度升高反应速率一般加快,但随反应的进行,H2O2分解速率也加快,则反应Cu+H2O2+2H+=Cu2++2H2O中反应物的浓度减小导致反应速率变慢,
故答案为:H2O2分解速率加快;
(4)由CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀,该反应中Cu元素的化合价降低,S元素的化合价升高,由离子方程式中CuCl保留化学式,并遵循电荷守恒,则离子方程式为2Cu2++SO32-+2Cl-+H2O═2CuCl↓+SO42-+2H+,
故答案为:2Cu2++SO32-+2Cl-+H2O═2CuCl↓+SO42-+2H+;
(5)溶液混合后,不发生反应时c(Cu2+)=[1/2]×0.01mol•L-1=0.005mol•L-1、c(OH-)=[1/2]×0.04mol•L-1=0.02mol•L-1,令平衡时溶液中Cu2+的浓度为xmol/L,则;
Cu2++2OH-=Cu(OH)2↓
转化 0.005-x 0.01-2x
反应后溶液中c(OH-)=0.02mol/L-(0.01-2x)mol/L=(0.01+2x)mol/L,故Ksp=c(Cu2+)•[c(OH-)]2=6×10-20=x×(0.01+2x)2,由于0.01+2x≈0.01,解得x=6×10-16mol/L,故答案为:6×10-16mol/L.点评:
本题考点: 常见的生活环境的污染及治理;热化学方程式;难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题考查的知识比较散,覆盖面比较多,注重了对盖斯定律、热化学方程式、离子方程式、Ksp等高考中常考考点的考查.1年前查看全部
- 工业上用三氧化铁溶液腐蚀印刷电路板,试分析反应原理以及反应后的溶液中含那些离子
 金光子1年前1
金光子1年前1 -
 smilefoot_ak 共回答了18个问题
smilefoot_ak 共回答了18个问题 |采纳率83.3%不是三氧化铁,是三氯化铁.
原理:
2FeCl3 + Cu == CuCl2 + 2FeCl2
溶液中有Cl-、Fe2+、Cu2+,以及没有完全反应的Fe3+,当然还包括H+、OH-1年前查看全部
- 制备锌印刷电路板是用稀硝酸腐蚀锌板,产生的废液称“烂板液”.“烂板液”中含硝酸锌外,还含有自来水带入的Cl-和Fe3+.
制备锌印刷电路板是用稀硝酸腐蚀锌板,产生的废液称“烂板液”.“烂板液”中含硝酸锌外,还含有自来水带入的Cl-和Fe3+.在实验室里,用“烂板液”制取ZnSO4•7H2O的过程如下:

(1)若稀硝酸腐蚀锌板时还原产物为N2O,氧化剂与还原剂的物质的量之比是______.
(2)若步骤①的pH>12,则Zn(OH)2溶解生成四羟基合锌酸钠.写出Zn(OH)2被溶解的离子方程式______.
(3)滤液D中除了含有OH-离子外,还含有的阴离子有______(填离子符号).
(4)若滤液E的pH=4,c(Zn2+)=2mol•L-1,c(Fe3+)=2.6×l0-9mol•L-1,能求得的溶度积是______(填选项).A、Ksp[Zn(OH)2]B、Ksp[Zn(OH)2和Ksp[Fe(OH)3]C、Ksp[Fe(OH)3]
(5)步骤③要控制pH在一定范围.实验室用pH试纸测定溶液pH的方法是:______.
(6)已知:①Fe(OH)3(s)⇌Fe3+(aq)+OH-(aq)△H=aKJ•mol-1 ②H2O(1)⇌H+(aq)+OH-(aq)△h=bKJ•mol-1请写出Fe3+发生水解反应的热化学方程式______.
若①的溶度积常数为KSP,②的离子积常数为KW,Fe3+发生水解反应的平衡常数K=K 3wKsp .(用含KSP、KW的代数式表示)K 3wKsp  寻找中1年前1
寻找中1年前1 -
 mayyj 共回答了18个问题
mayyj 共回答了18个问题 |采纳率88.9%解题思路:(1)若稀硝酸腐蚀锌板时还原产物为N2O,则反应的方程式为4Zn+10HNO3=4Zn(NO3)2+N2O↑+5H2O,根据方程式判断氧化剂与还原剂的物质的量之比;
(2)根据反应物和生成物确定反应的离子方程式;
(3)固体具有吸附性,沉淀A可吸附溶液中的Cl-、NO3-等离子,则滤液中应含有Cl-、NO3-;
(4)滤液E的pH=4,得到的沉淀为Fe(OH)3,只能计算Fe(OH)3的溶度积;
(5)测定溶液pH时,将pH试纸放在玻璃片上,用玻璃棒蘸取待测液点在试纸中间,待颜色变化稳定后与比色卡对比你,读出读数即可;
(6)利用盖斯定律计算反应热,可写出Fe3+发生水解反应的热化学方程式,利用①②平衡常数可确定Fe3+发生水解反应的平衡常数.(1)若稀硝酸腐蚀锌板时还原产物为N2O,则反应的方程式为4Zn+10HNO3=4Zn(NO3)2+N2O↑+5H2O,由方程式可知反应中HNO3为氧化剂,Zn为还原剂,当4molZn参加反应时,有2molHNO3被还原,则氧化剂与还原剂的物质的量之比1:2,故答案为:1:2;
(2)Zn(OH)2溶解生成四羟基合锌酸钠,反应的离子方程式为Zn(OH)2+2OH-=[Zn(OH)4]2-,故答案为:Zn(OH)2+2OH-=[Zn(OH)4]2-;
(3)固体具有吸附性,沉淀A可吸附溶液中的Cl-、NO3-等离子,则滤液中应含有Cl-、NO3-,故答案为:Cl-、NO3-;
(4)滤液E的pH=4,得到的沉淀为Fe(OH)3,只能计算Fe(OH)3的溶度积,故答案为:C;
(5)测定溶液pH时,将pH试纸放在玻璃片上,用玻璃棒蘸取待测液点在试纸中间,待颜色变化稳定后与比色卡对比,读出读数即可,注意不能事先湿润试纸,更不能将试纸插在溶液中,
故答案为:将pH试纸放在玻璃片上,用玻璃棒蘸取待测液点在试纸中间,待颜色变化稳定后与比色卡对比,读出读数;
(6)Fe3+发生水解反应的方程式为Fe3++3H2O⇌Fe(OH)3+3H+,
已知①Fe(OH)3(s)⇌Fe3+(aq)+3OH-(aq)△H=aKJ•mol-1
②H2O(l)⇌H+(aq)+OH-(aq)△H=bKJ•mol-1,
则利用盖斯定律将②×3-①可得Fe3+(aq)+3H2O(l)⇌Fe(OH)3(aq)+3H+(aq)△H=(3b-a)KJ•mol-1,
则Fe3+发生水解反应的平衡常数K=
K3w
Ksp,
故答案为:Fe3+(aq)+3H2O(l)⇌Fe(OH)3(aq)+3H+(aq)△H=(3b-a)KJ•mol-1;
K3w
Ksp.点评:
本题考点: 金属的回收与环境、资源保护;用盖斯定律进行有关反应热的计算;盐类水解的原理;难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题考查物质的制备,为高考常见题型,侧重于学生的分析能力、实验能力和计算能力的考查,注意把握题给信息,答题时注意审题,难度中等.1年前查看全部
- 一化学研究性学习小组对某工厂生产印刷电路板后所得废液进行探究(生产原理:
一化学研究性学习小组对某工厂生产印刷电路板后所得废液进行探究(生产原理:
2Fe3++Cu=2Fe2++Cu2+).请按要求完成下列探究报告.
[探究目的]
从废液中回收铜,并重新得到FeCl3溶液.
[资料获悉]
①3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O
②有关金属离子从开始沉淀到沉淀完全时溶液的pH:
Fe3+:2.3.7 Cu2+:5.6.4 Fe3+:7.9.6
[探究思路]
(1)先确定废液的组成及各金属离子的浓度;
(2)选择合适试剂回收铜,并重新得到FeCl3溶液.
[实验探究]
取几滴废液于试管中加水稀释后,滴加KSCN溶液出现血红色,可知废液中除含有Fe2+、Cu2+外,还含有Fe3+.
甲同学取10 mL废液,向其中加入足量的AgNO3溶液,得到的沉淀经过滤、洗涤、干燥,称重得8.61 g ;乙同学另取10 mL废液,加入某试剂将pH调至4.0,使其中Fe3+转化为Fe(OH)3沉淀,而Fe2+、Cu2+仍留在废液中,沉淀经过滤、洗涤、灼烧,冷却后称重得0.32 g .通过计算可知废液中
c (Fe3+)=___________mol/L ,
c (Fe2+)=___________mol/L ,
c (Cu2+)=___________mol/L.
[交流讨论]
如何回收1L废液中含有的铜,并重新得到FeCl3溶液?
丙同学认为应该先向废液中加入w g铁粉[w = c (Cu2+)×1L ×56 g/mol],使之充分反应置
换出铜,过滤,得金属铜.再向滤液中加入适量的稀硝酸,将Fe2+全部氧化为Fe3+,并进行尾气处理,即可达实验目的.有些同学认为丙同学的方案不可行,请你评价丙同学的方案有哪些不妥之处?(不一定填满)
1_________________________________________________
2_________________________________________________
3_________________________________________________
该小组同学根据讨论得到的合理方案进行操作,最终达到了预期目的.(方案内容略)
[拓展延伸]
请画出1L废液中加入铁粉的物质的量与废液中铜离子的物质的量的关系曲线,并利用图像计算,当铜离子的物质的量减少一半时,加入铁粉的质量是 _________________________ g .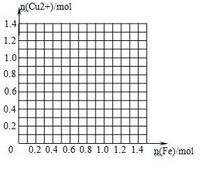
 海来阿衣思不模271年前1
海来阿衣思不模271年前1 -
 没经验的船长 共回答了12个问题
没经验的船长 共回答了12个问题 |采纳率100%1、c (Fe3+)=_____2_____mol/L ,
c (Fe2+)=_____0.2____mol/L ,
c (Cu2+)=_____0.1____mol/L.
2、换出铜,过滤,得金属铜.再向滤液中加入适量的稀硝酸,将Fe2+全部氧化为Fe3+,并进行尾气处理,即可达实验目的.有些同学认为丙同学的方案不可行,请你评价丙同学的方案有哪些不妥之处?(不一定填满)
1_铁会和3价铁反应生成2价铁,W克铁量不够__
2__加入稀硝酸反应后,溶液中将会残留稀硝酸、硝酸根等无法得到纯的FeCl3溶液3_________________________________________________
3、提示:铁会先和3价铁反应完全后再跟2价铜反应(3价铁比2价铜的氧化性强)
楼主,不好意思呀,图就不画了
a、由 2Fe3++Fe=3Fe2+得 n1(铁)=1mol
b、由铜离子的物质的量减少一半 Fe+Cu2+=Cu+Fe2+得 n2(铁)=0.1mol
c、n总(铁)=n1+n2=1.1mol m总(铁)=1.1*56=61.6克
注:楼主,认真想得,希望楼主采纳1年前查看全部
- 电子工业常用30%的FeCl3溶液腐蚀铜箔,制造印刷电路板,若反应过程中有4mol电子发生转移,会有____mol铜溶解
 小雪薇薇1年前1
小雪薇薇1年前1 -
 yinling 共回答了25个问题
yinling 共回答了25个问题 |采纳率80%2mol1年前查看全部
- Fe+ Cu2+ =Fe2+ +Cu能应用到印刷电路板吗?
 nekmujtbc1年前1
nekmujtbc1年前1 -
 559313 共回答了25个问题
559313 共回答了25个问题 |采纳率92%印刷电路板中有这个 2Fe3+ Cu==2Fe2+ Cu2+1年前查看全部
- (2014•安徽模拟)工业上可用印刷电路板的腐蚀废液生成CuCl2•2H2O,从而对废液进行利用,其工艺流程如图1:
(2014•安徽模拟)工业上可用印刷电路板的腐蚀废液生成CuCl2•2H2O,从而对废液进行利用,其工艺流程如图1:
已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;pH在3~4时,Fe3+以Fe(OH)3的形式完全沉淀.
(1)用32%~35%的FeCl3溶液溶解印刷线路板上的金属铜的原理是(用离子方程式表示):______.
(2)试剂A最好应选用下列中的______(填字母).理由是______.
a.浓硫酸b.Cl2c.NaClOd.NaOH溶液
(3)操作1的名称是______,用到的玻璃仪器有______.
(4)分析有关物质的溶解度曲线(如图2所示),为了获得CuCl2•2H2O晶体,对滤液B进行的操作2是______、______,过滤得到产品.(5)测定CuCl2•2H2O产品的质量分数可按下列方法进行:取2.000g产品,用水溶解,加入60.00mL 0.4000mol/L的KI溶液(足量),充分反应后加入淀粉指示剂,用0.4000mol/L Na2S2O3标准溶液滴定,耗去标准溶液25.00mL时,刚好达到滴定终点.
已知:2Cu2++4I-=2CuI+I2
I2+2S2O32-=2I-+S4O62-
则此产品中CuCl2•2H2O的质量分数为______.
 1240575061年前1
1240575061年前1 -
 zjyufo 共回答了20个问题
zjyufo 共回答了20个问题 |采纳率85%解题思路:(1)铜具有还原性,铁离子具有氧化性,二者之间发生氧化还原反应;
(2)将废液中的亚铁离子除去,加热蒸发,浓缩结晶即可得到纯净的氯化铜晶体,据此回答.
(3)据物质的分离方法确定;
(4)为了获得CuCl2•2H2O晶体,需要利用重结晶法把硫酸钠除掉,蒸发浓缩后,由于同温下硫酸钠的溶解度小,会有大量硫酸钠析出,故趁热过滤掉析出的硫酸钠;而40摄氏度时硫酸钠溶解度最大,硫酸钠最不容易析出,为了得到更多的析出CuCl2•2H2O晶体,温度略低于40℃的范围内分离;根据反应的过程:2Cu2++4I-=2CuI↓+I2,I2+2S2O32-=2I-+S4O62-,得到关系式:Cu2+~S2O32-,进行计算即可.(1)铜具有还原性,铁离子具有氧化性,二者之间发生的氧化还原反应为:2FeCl3+Cu=2FeCl2+CuCl2,离子方程式为:2Fe3++Cu=2Fe2++Cu2+;故答案为:2Fe3++Cu=2Fe2++Cu2+;
(2)为了将废液中的亚铁离子除去,加入一种试剂将亚铁离子氧化为铁离子,调节pH值,可以将铁离子沉淀出来,但是铜离子不沉淀即可,故选NaClO,它具有碱性和氧化性,能将Fe2+氧化为Fe3+,且反应能消耗H+,增大溶液的pH使Fe3+沉淀,
故答案为:c;NaClO能将Fe2+氧化为Fe3+,且反应能消耗H+,增大溶液的pH使Fe3+沉淀;
(3)据物质的分离方法,溶液与不溶的分离,采用过滤;据过滤确定所需要的玻璃仪器仪器:漏斗、烧杯、玻璃棒;
答案为:过滤;漏斗、烧杯、玻璃棒;
(4))有图2可知硫酸钠的溶解度较小而且温度较高时随温度的变化不大,加热浓缩时会有大量的硫酸钠析出,冷却结晶时尽量保证硫酸钠不析出,而40摄氏度时硫酸钠溶解度最大,为了能析出更多的CuCl2•2H2O晶体,
依据2Na2S2O3+I2═Na2S4O6+2NaI,2Cu2++4I-=2CuI↓+I2;
得到 Na2S2O3 ~Cu2+
11
0.4000mol/L×0.0250L0.01mol
则CuCl2•2H2O的物质的量为:0.01mol,
试样中CuCl2•2H2O的质量百分数为[0.01mol×171g/mol/2.0g]×100%=85.50%,
故答案为:蒸发浓缩、冷却结晶;85.50%;点评:
本题考点: 金属的回收与环境、资源保护;难溶电解质的溶解平衡及沉淀转化的本质;铁盐和亚铁盐的相互转变;铜金属及其重要化合物的主要性质.
考点点评: 本题以实验的方法考查学生含铁化合物的性质知识,注重物质的分离、提纯和化学实验基本操作的知识以及根据化学方程式进行计算的知识,难度中等.1年前查看全部
- (9分)废物回收利用可实现资源再生,并减少污染。如废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末,废旧玻璃也可回收
(9分)废物回收利用可实现资源再生,并减少污染。如废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末,废旧玻璃也可回收再生。
(1)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是 (填字母)。
(2)用H 2 O 2 和H 2 SO 4 (ag)的混合溶液可溶出印刷电路板金属粉末中的铜。已知:A.热裂解形成燃油 B.露天焚烧 C.作为有机复合建筑材料的原料 D.直接填埋
Cu(s)+2H + (aq) ====Cu 2+ (aq)+H 2 (g) Δ H =+64.39kJ·mol - 1
2H 2 O 2 (l) ====2H 2 O (l)+O 2 (g) Δ H =-196.46kJ·mol - 1
H 2 (g)+ 1/2 O 2 (g) ="===" H 2 O (l) Δ H =-285.84kJ·mol - 1
在 H 2 SO 4 溶液中Cu与H 2 O 2 反应生成Cu 2+ 和H 2 O (l)的热化学方程式为
。
(3)氢氟酸是一种弱酸,可用来刻蚀玻璃。已知25 ℃时:
①HF(aq)+OH - (aq)===F - (aq)+H 2 O(l) Δ H =-67.7 kJ·mol - 1
②H + (aq)+OH - (aq)===H 2 O(l) Δ H =-57.3 kJ·mol - 1
则表示氢氟酸电离的热化学方程式为:
可见氢氟酸的电离是 的(填吸热或放热)。 715y1年前1
715y1年前1 -
 cristata 共回答了14个问题
cristata 共回答了14个问题 |采纳率78.6%(1)BD (2分)
(2)Cu(s)+H 2 O 2 (l)+2H + (aq)=Cu 2 + (aq)+2H 2 O(l) △H="-319.68" kJ·mol - 1 (3分)
(3)HF(aq) === H + (aq)+ F - (aq) △H="-10.4" kJ·mol - 1 (3分) 放热(1分)
(1)露天焚烧和直接填埋都会造成环境的污染,所以选项BD不正确,答案选BD。
(2)根据盖斯定律可知,①+②÷2+③即得到Cu(s)+H 2 O 2 (l)+2H + (aq)=Cu 2 + (aq)+2H 2 O(l),所以该反应的反应热是64.39kJ/mol-196.46kJ/mol÷2-285.84kJ/mol=-319.68kJ/mol。
(3)根据盖斯定律可知,①-②即得到HF(aq) === H + (aq)+ F - (aq) ,所以△H=-67.7 kJ/mol+57.3 kJ·mol=-10.4 kJ/mol,所以是放热反应。1年前查看全部
- 制作印刷电路板反应方程式
 serena09061年前1
serena09061年前1 -
 无≌情 共回答了16个问题
无≌情 共回答了16个问题 |采纳率93.8%一般中学阶段考察腐蚀印刷电路板反应方程式 的较多,用含有Fe3+的溶液:2Fe3+Cu==2Fe2+Cu2+1年前查看全部
- 废物回收利用可实现资源再生,并减少污染.如废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末,废旧玻璃也可回收再生.
废物回收利用可实现资源再生,并减少污染.如废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末,废旧玻璃也可回收再生.
(1)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是______(填字母).
A.热裂解形成燃油B.露天焚烧
C.作为有机复合建筑材料的原料 D.直接填埋
(2)用H2O2和H2SO4(ag)的混合溶液可溶出印刷电路板金属粉末中的铜.已知:
Cu(s)+2H+(aq)═Cu2+(aq)+H2(g)△H=-64.39kJ•mol-1
2H2O2(l)═2H2O (l)+O2(g)△H=-196.46kJ•mol-1
H2(g)+1/2O2(g)═H2O (l)△H=-285.84kJ•mol-1
在 H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O (l)的热化学方程式为______
(3)氢氟酸是一种弱酸,可用来刻蚀玻璃.已知25℃时:
①HF(aq)+OH-(aq)═F-(aq)+H2O(l)△H=-67.7kJ•mol-1
②H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1
则表示氢氟酸电离的热化学方程式为:______
可见氢氟酸的电离是______的(填吸热或放热). cpchung1091年前1
cpchung1091年前1 -
 naniq 共回答了17个问题
naniq 共回答了17个问题 |采纳率70.6%解题思路:(1)根据资源的回收利用可实现资源再生,并减少污染来分析;
(2)根据已知的热化学反应方程式和盖斯定律来分析Cu与H2O2反应生成Cu2+和H2O的热化学方程式;
(3)依据热化学方程式和盖斯定律计算分析;(1)因热裂解形成燃油及作为有机复合建筑材料的原料都可实现资源的再利用,露天焚烧能生成有害气体则污染空气,直接填埋则废旧印刷电路板中的重金属离子会污染土壤,
故答案为:BD;
(2)由①Cu(s)+2H+(aq)═Cu2+(aq)+H2(g)H1=64.39KJ•mol-1;
②2H2O2(l)═2H2O(l)+O2(g)H2=-196.46KJ•mol-1;
③H2(g)+[1/2]O2(g)═H2O(l)H3=-285.84KJ•mol-1;
则反应Cu(s)+H2O2 (l)+2H+(aq)=Cu2+(aq)+2H2O(l)可由反应①+②×[1/2]+③得到,
由盖斯定律可知该反应的反应热△H=H1+H2×[1/2]+H3=64.39KJ•mol-1+(-196.46KJ•mol-1)×[1/2]+(-285.84KJ•mol-1)=-448.46KJ.mol-1,
故答案为:Cu(s)+H2O2 (l)+2H+(aq)=Cu2+(aq)+2H2O(l)△H=-448.46KJ.mol-1;
(3)①HF(aq)+OH-(aq)═F-(aq)+H2O(l)△H=-67.7kJ•mol-1
②H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1
结合盖斯定律①-②得到:HF(aq)═H+(aq)+F-(aq)△H=-10.4kJ•mol-1 ,电离是放热过程;
故答案为:HF(aq)═H+(aq)+F-(aq)△H=-10.4kJ•mol-1,放热;点评:
本题考点: 热化学方程式;反应热和焓变.
考点点评: 本题考查的知识比较散,覆盖面比较多,注重了对盖斯定律、热化学方程式、离子方程式等高考中常考考点的考查,题目较简单.1年前查看全部
- 用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜.已知:
用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜.已知:
Cu(s)+2H+(aq)═Cu2+(aq)+H2(g)△H=64.39kJ•mol-1
2H2O2(l)═2H2O(l)+O2(g)△H=-196.46kJ•mol-1
H2(g)+[1/2]O2(g)═H2O(l)△H=-285.84kJ•mol-1
在 H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热方程式为______. 蓝晦琪1年前1
蓝晦琪1年前1 -
 ybd风飘飘 共回答了19个问题
ybd风飘飘 共回答了19个问题 |采纳率94.7%解题思路:依据热化学方程式和盖斯定律计算得到所需热化学方程式.①Cu(s)+2H+(aq)═Cu2+(aq)+H2(g)△H=+64.39kJ/mol,
②2H2O2(l)═2H2O(l)+O2(g)△H=-196.46kJ/mol,
③H2(g)+[1/2]O2(g)═H2O(l)△H=-285.84kJ/mol,
由盖斯定律①+[1/2]②+③得到:Cu(s)+H2O2(l)+2H+(aq)═Cu2+(aq)+2H2O(l)△H=-319.68kJ/mol,
故答案为:Cu(s)+H2O2(l)+2H+(aq)═Cu2+(aq)+2H2O(l)△H=-319.68kJ/mol.点评:
本题考点: 热化学方程式.
考点点评: 本题考查了热化学方程式的计算书写,盖斯定律的计算应用,题目较简单.1年前查看全部
- 用FeCl3溶液腐蚀印刷电路板---------------方程式是什么
 rchnjmf1年前1
rchnjmf1年前1 -
 都在唱歌 共回答了21个问题
都在唱歌 共回答了21个问题 |采纳率95.2%2Fe3+ + Cu =2Fe2+ + Cu2+1年前查看全部
- 电子工业上用氯化铁溶液腐蚀印刷电路板,欲从腐蚀后的废液中回收铜及制取纯净的氯化铁溶液中的化学方程式
 winnerlz1年前1
winnerlz1年前1 -
 13121796608 共回答了23个问题
13121796608 共回答了23个问题 |采纳率91.3%用氯化铁溶液腐蚀印刷电路板发生:2FeCl3 + Cu = 2FeCl2 + CuCl2,所得溶液中既有CuCl2、FeCl2,还可能有剩余的FeCl3.在其中加入过量的铁粉,过滤,在滤渣中加入足量盐酸,等不再有气体产生时再过滤,洗涤,干燥得到纯净铜粉.将两次过滤所得滤液合并,通入足量氯气,剩余盐酸可不必除去,可防止氯化铁水解变质.1年前查看全部
- Ⅰ.工业上为实现废旧印刷电路板的综合利用,可用H2O2和H2SO4的混合溶液溶解处理产生的铜粉末,以制备硫酸铜.已知:
Ⅰ.工业上为实现废旧印刷电路板的综合利用,可用H2O2和H2SO4的混合溶液溶解处理产生的铜粉末,以制备硫酸铜.已知:
①Cu(s)+2H+(aq)=Cu2+(aq)+H2(g)△H=+64.39kJ/mol
②Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l)△H=−319.68kJ/mol
③2H2(g)+O2(g)=2H2O(l)△H=-571.68kJ/mol
则4H2O2(l)=4H2O(l)+2O2(g)△H=______.
Ⅱ.固体氧化物燃料电池(SOFC)以固体氧化物作为电解质.其工作原理如图1所示.
①若以乙烯作为燃料气,则在接触面上发生的电极反应式为______.固体氧化物的作用______(填“是”“否”或“不能确定”)让电子在电池内通过.
②若以此作为化学电源,用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得的溶液中加入0.15mol Cu2(OH)2CO3后恰好恢复到电解前的浓度和pH(不考虑二氧化碳的溶解).则电解过程中共转移电子数______.
Ⅲ.如图2所示,甲池中电池反应式为2Fe3++Cu=2Fe2++Cu2+,已知A电极质量不变,C,D为石墨电极,乙池中为100ml NaCl溶液(条件是常温下).
回答下列问题:
(1)A极为______极(填“正”或“负”),B极电极材料为______.
(2)B电极质量3.2g时,此时乙池中电解液的pH为______(忽略反应过程中溶液体积的变化及气体的溶解情况).
(3)实验中,欲从甲池反应后的废液中回收铜,并重新制得纯净的氯化铁溶液,简述操作步骤及有关反应原理(用离子方程式表示)______. nao_nao_cat1年前1
nao_nao_cat1年前1 -
 kaidgk 共回答了17个问题
kaidgk 共回答了17个问题 |采纳率82.4%解题思路:Ⅰ.根据盖斯定律,已知热化学方程式乘以适当系数进行加减构造目标热化学方程式,反应热也乘以相应的系数并进行相应的计算;
Ⅱ①O2-可以在固体氧化物内部自由通过,乙烯在接触面放电,发生氧化反应,在O2-存在情况下生成二氧化碳与水;
固体氧化物的作用阻止电子在电池内通过;
②用惰性电极电解硫酸铜溶液,向所得的溶液中加入0.15mol Cu2(OH)2CO3后恰好恢复到电解前的浓度和pH,Cu2(OH)2CO3与H2SO4反应生成的硫酸铜、水、二氧化碳,故生成的硫酸铜、水与电解时反应的硫酸铜、水对应相等,Cu2(OH)2CO3可以写出CuO•Cu(OH)2•CO2,据此计算生成的水,氧化产物只有氧气,由水电解生成,转移电子物质的量是水的2倍,据此计算;
Ⅲ.(1)甲池中电池反应式为2Fe3++Cu=2Fe2++Cu2+,A电极质量不变,Fe3+在A极放电,发生还原反应,Cu发生氧化反应,为负极,质量减少,故B为Cu;
(2)根据n=[m/M]计算3.2gCu的物质的量,进而计算转移电子数目,乙为电解池,发生反应2NaCl+2H2O
2NaOH+H2↑+Cl2,根据电子转移守恒计算生成n(NaOH),再计算c(NaOH),根据Kw=c(OH-)•c(H+)计算c(H+),再根据pH=-lgc(H+);通电 .
(3)在废液中加入足量的铁屑,过滤后在滤渣中加入足量的盐酸,过滤回收铜,将两次滤液合并通入足量氯气,即得到氯化铁溶液.Ⅰ.已知:①Cu(s)+2H+(aq)=Cu2+(aq)+H2(g)△H=+64.39kJ/mol
②Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l)△H=−319.68kJ/mol
③2H2(g)+O2(g)=2H2O(l)△H=-571.68kJ/mol
根据盖斯定律,②×4-①×4-③×2得4H2O2(l)=4H2O(l)+2O2(g),
故△H=(-319.68kJ/mol)×4-64.39kJ/mol×4-(-571.68kJ/mol)×2=-392.92kJ/mol,
故答案为:-392.92kJ/mol;
Ⅱ①O2-可以在固体氧化物内部自由通过,乙烯在接触面放电,发生氧化反应,在O2-存在情况下生成二氧化碳与水,电极反应式为:C2H4+6O2--12e-=2CO2+2H2O,固体氧化物的作用阻止电子在电池内通过,
故答案为:C2H4+6O2--12e-=2CO2+2H2O;否;
②用惰性电极电解硫酸铜溶液,向所得的溶液中加入0.15mol Cu2(OH)2CO3后恰好恢复到电解前的浓度和pH,Cu2(OH)2CO3与H2SO4反应生成的硫酸铜、水、二氧化碳,故生成的硫酸铜、水与电解时反应的硫酸铜、水对应相等,Cu2(OH)2CO3可以写出CuO•Cu(OH)2•CO2,故0.15mol Cu2(OH)2CO3与硫酸反应生成水的物质的量为0.15mol×3=0.45mol,氧化产物只有氧气,由水电解生成,故转移电子数目为0.45mol×2×NAmol-1=0.9NA,
故答案为:0.9NA;
Ⅲ.(1)甲池中电池反应式为2Fe3++Cu=2Fe2++Cu2+,A电极质量不变,Fe3+在A极放电,发生还原反应,A为正极,Cu发生氧化反应,为负极,质量减少,故B为Cu,
故答案为:正;Cu;
(2)3.2gCu的物质的量为[3.2g/64g/mol]=0.05mol,转移电子为0.05mol×2=0.1mol,乙为电解池,发生反应2NaCl+2H2O
通电
.
2NaOH+H2↑+Cl2,根据电子转移守恒可知生成n(H2)=0.05mol,故生成n(NaOH)=0.1mol,故c(OH-)=[0.1mol/0.1L]=1mol/L,故c(H+)=
10−14
1mol/L=10-14mol/L,故pH=-lg10-14=14,
故答案为:14;
(3)在废液中加入足量的铁屑,过滤后在滤渣中加入足量的盐酸,过滤回收铜,将两次滤液合并通入足量氯气,即得到氯化铁溶液,有关离子方程式为:Fe+2H+=Fe2++H2↑,Fe+Cu2+=Fe2++Cu,2Fe2+Cl2=2Fe3++2Cl-,
故答案为:在废液中加入足量的铁屑,过滤后在滤渣中加入足量的盐酸,过滤回收铜,将两次滤液合并通入足量氯气,即得到氯化铁溶液,有关离子方程式为:Fe+2H+=Fe2++H2↑,Fe+Cu2+=Fe2++Cu,2Fe2+Cl2=2Fe3++2Cl-.点评:
本题考点: 电解原理;反应热和焓变.
考点点评: 本题是拼合型题目,涉及反应热的计算、原电池、电解池、化学计算等,题目综合性较大,难度较大,Ⅱ②中电子转移数目计算为易错点、难点,注意根据氧化产物只有氧气,水电解生成氧气,据此计算,可以省略反应过程的判断,实际发生电解水生成氢气与氧气,要求学生具有分析和解决问题的能力.1年前查看全部
- (2009•江苏)废旧印刷电路板的回收利用可实现资源再生,并减少污染.废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉
(2009•江苏)废旧印刷电路板的回收利用可实现资源再生,并减少污染.废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末.
(1)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是______(填字母).
A.热裂解形成燃油B.露天焚烧
C.作为有机复合建筑材料的原料 D.直接填埋
(2)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜.已知:Cu(s)+2H+(aq)═Cu2+(aq)+H2(g)H=64.39KJ•mol-12H2O2(l)═2H2O(l)+O2(g)H=-196.46KJ•mol-1H2(g)+
O2(g)═H2O(l)H=-285.84KJ•mol-11 2
在H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为______.
(3)控制其他条件相同,印刷电路板的金属粉末用10%H2O2和3.0mol•L-1H2SO4的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表).
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是______.温度(℃) 20 30 40 50 60 70 80 铜平均溶解速率
(×10-3mol•L-1•min-1)7.34 8.01 9.25 7.98 7.24 6.73 5.76
(4)在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀.制备CuCl的离子方程式是______. jbominx1年前1
jbominx1年前1 -
 摩罗街汉子 共回答了17个问题
摩罗街汉子 共回答了17个问题 |采纳率88.2%解题思路:(1)根据资源的回收利用可实现资源再生,并减少污染来分析;
(2)根据已知的热化学反应方程式和盖斯定律来分析Cu与H2O2反应生成Cu2+和H2O的热化学方程式;
(3)根据双氧水的性质来分析化学反应速率的变化;
(4)根据反应物与生产物来书写离子方程式.(1)因热裂解形成燃油及作为有机复合建筑材料的原料都可实现资源的再利用,露天焚烧能生成有害气体则污染空气,直接填埋则废旧印刷电路板中的重金属离子会污染土壤,
故答案为:BD;
(2)由①Cu(s)+2H+(aq)═Cu2+(aq)+H2(g)H1=64.39KJ•mol-1;
②2H2O2(l)═2H2O(l)+O2(g)H2=-196.46KJ•mol-1;
③H2(g)+
1
2O2(g)═H2O(l)H3=-285.84KJ•mol-1;
则反应Cu(s)+H2O2 (l)+2H+(aq)=Cu2+(aq)+2H2O(l)可由反应①+②×[1/2]+③得到,
由盖斯定律可知该反应的反应热△H=H1+H2×[1/2]+H3=64.39KJ•mol-1+(-196.46KJ•mol-1)×[1/2]+(-285.84KJ•mol-1)=-319.68KJ.mol-1,
故答案为:Cu(s)+H2O2 (l)+2H+(aq)=Cu2+(aq)+2H2O(l)△H=-319.68KJ.mol-1;
(3)因温度升高反应速率一般加快,但随反应的进行,H2O2分解速率也加快,则反应Cu+H2O2+2H+=Cu2++2H2O中反应物的浓度减小导致反应速率变慢,
故答案为:H2O2分解速率加快;
(4)由CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀,
该反应中Cu元素的化合价降低,S元素的化合价升高,由离子方程式中CuCl保留化学式,并遵循电荷守恒,
则离子方程式为2Cu2++SO32-+2Cl-+H2O═2CuCl↓+SO42-+2H+,故答案为:2Cu2++SO32-+2Cl-+H2O═2CuCl↓+SO42-+2H+.点评:
本题考点: 用盖斯定律进行有关反应热的计算;热化学方程式;化学反应速率的影响因素;金属的回收与环境、资源保护.
考点点评: 本题考查的知识比较散,一道题考查了多个知识点,覆盖面比较多,注重了对盖斯定律、热化学方程式、离子方程式等高考中常考考点的考查.1年前查看全部
- 铜具有良好的导电性,常用来制作印刷电路板
 weibo2222221年前1
weibo2222221年前1 -
 ksdandy 共回答了15个问题
ksdandy 共回答了15个问题 |采纳率93.3%对的1年前查看全部
- (10分)废旧印刷电路板的回收利用可实现资再生,并减少污染。废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末。
(10分)废旧印刷电路板的回收利用可实现资再生,并减少污染。废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末。
(1)(2分)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是 (填字母)。
(2)(2分)用A.热裂解形成燃油 B.露天焚烧 C.作为有机复合建筑材料的原料 D.直接填埋  的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
的混合溶液可溶出印刷电路板金属粉末中的铜。已知: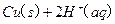 ====
====
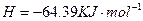
 ====
====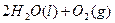

 ="==="
="===" 
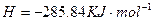
在 溶液中
溶液中 与
与 反应生成
反应生成 和
和 的热化方程式为 。
的热化方程式为 。
(3)(3分)控制其他条件相同,印刷电路板的金属粉末用10℅ 和3.0
和3.0 的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是 。温度(℃) 20 30 40 50 60 70 80 铜平均溶解速率
( )[:.....]
)[:.....]7.34 8.01 9.25 7.98 7.24 6.73 5.76
(4)(3分)在提纯后的 溶液中加入一定量的
溶液中加入一定量的 和
和 溶液,加热,生成
溶液,加热,生成 沉淀。制备
沉淀。制备 的离子方程式是 。
的离子方程式是 。 伊军1年前1
伊军1年前1 -
 爱炒面的6 共回答了22个问题
爱炒面的6 共回答了22个问题 |采纳率86.4%1年前查看全部
- 在制作印刷电路板的过程中常利用FeCl 3 溶液与Cu反应,其反应方程式为:
在制作印刷电路板的过程中常利用FeCl 3 溶液与Cu反应,其反应方程式为:
2FeCl 3 +Cu 2FeCl 2 +CuCl 2 。现向FeCl 3 溶液中加入a g Cu粉,完全溶解后,再加入b g Fe粉,充分反应后尚有c g残余固体。若c<a,则下列说法正确的是
2FeCl 2 +CuCl 2 。现向FeCl 3 溶液中加入a g Cu粉,完全溶解后,再加入b g Fe粉,充分反应后尚有c g残余固体。若c<a,则下列说法正确的是A.残余固体全部是Cu B.残余固体可能为Fe和Cu的混合物 C.最后得到的溶液可能含有Fe 3 + D.残余固体是Fe,溶液中一定不含Cu 2 +  很浅很浅地1年前1
很浅很浅地1年前1 -
 fondboy 共回答了24个问题
fondboy 共回答了24个问题 |采纳率91.7%A
1年前查看全部
- 废旧印刷电路板的回收利用可实现资源再生,并减少污染.废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末.
废旧印刷电路板的回收利用可实现资源再生,并减少污染.废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末.
(1)写出工业上制备印刷电路板原理的离子方程式:______
(2)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是______(填字母).
A.热裂解形成燃油 B.露天焚烧
C.作为有机复合建筑材料的原料D.直接填埋
(3)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜.
写出在H2SO4溶液中Cu与H2O2 反应生成Cu2+ 和H2O的离子方程式______.
(4)控制其他条件相同,印刷电路板的金属粉末用10% H2O2和3.0mol•L-1 H2SO4的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表).
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是______.温度(℃) 20 30 40 50 60 70 80 铜平均溶解速率(×10-3 mol•L-1•min-1) 7.34 8.01 9.25 7.98 7.24 6.73 5.76
(5)在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀.制备CuCl的离子方程式是2Cu2++SO32-+2Cl-+H2O
2CuCl↓+SO42-+2H+△ .2Cu2++SO32-+2Cl-+H2O.
2CuCl↓+SO42-+2H+△ . stone22581年前1
stone22581年前1 -
 厌倦oo 共回答了19个问题
厌倦oo 共回答了19个问题 |采纳率100%解题思路:(1)金属铜可以和氧化性的三价铁之间发生氧化还原反应;
(2)根据环境保护时不会产生污染环境的因素来判断;
(3)酸性环境下双氧水具有氧化性,能将金属铜氧化;
(4)根据图示信息,当温度升高时反应速率加快来回答;
(5)根据反应物和生成物来书写离子反应.(1)金属铜可以和氧化性的三价铁之间发生氧化还原反应,其离子方程式为:Cu+2Fe3+=Cu2++2Fe2+,故答案为:Cu+2Fe3+=Cu2++2Fe2+;
(2)露天焚烧会产生污染环境的气体,直接填埋时会引起水体和土壤的污染,故选:BD;
(3)金属铜在酸性环境下和双氧水的反应为:Cu+H2O2+2H+=Cu2++2H2O,故答案为:Cu+H2O2+2H+=Cu2++2H2O;
(4)根据测得不同温度下铜的平均溶解速率的数据,会发现随着温度的升高,铜的平均溶解速率,当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,因为双氧水受热易分解,导致金属铜的反应速率减慢,故答案为:H2O2分解速率加快;
(5)根据题干信息,可知发生的反应为2Cu2++SO32-+2Cl-+H2O
△
.
2CuCl↓+SO42-+2H+,故答案为:2Cu2++SO32-+2Cl-+H2O
△
.
2CuCl↓+SO42-+2H+.点评:
本题考点: 铜金属及其重要化合物的主要性质.
考点点评: 本题考查学生铜的化合物的性质,是一道综合题目,难度较大,要求学生具有分析和解决问题的能力.1年前查看全部
- (8分)废旧印刷电路板经粉碎分离能得到非金属粉末和金属粉末,回收利用可实现资源再生,减少污染。
(8分)废旧印刷电路板经粉碎分离能得到非金属粉末和金属粉末,回收利用可实现资源再生,减少污染。
⑴下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是 (填字母)。A.热裂解形成燃油 B.露天焚烧 C.作为有机复合建筑材料的原料 D.直接填埋  iMiki1年前0
iMiki1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 一道高一化学题 电子工业常用30﹪的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板.
一道高一化学题 电子工业常用30﹪的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板.
某工程师为了从使用过的腐蚀废液中回收铜,并重新获得纯净的FeCl3溶液,准备采用下列步骤:
(1).请写出上述六种物质的化学式
(2).请写出相关的化学方程式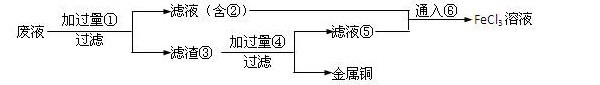
 fxshu1年前1
fxshu1年前1 -
 水恋冰 共回答了15个问题
水恋冰 共回答了15个问题 |采纳率100%(1) Fe FeCl2 Fe Cu HCl FeCl2 Cl2
(2) Fe + Cu2+ = Cu + Fe 2+
Fe + 2Fe3+ = 3 Fe2+
Fe + 2H + = H2 + Fe 2+
2Fe 2+ + Cl2 = 2Fe3+ + 2Cl -1年前查看全部
- 废旧印刷电路板的回收利用可实现资源再生,并减少污染.废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末.(1)下列处理
废旧印刷电路板的回收利用可实现资源再生,并减少污染.废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末.(1)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是______(填字母).
A.热裂解形成燃油 B.露天焚烧 C.作为有机复合建筑材料的原料 D.直接填埋
(2)用q2O2和q2SOw的混合溶液可溶出印刷电路板金属粉末中的铜.已知:
C得(s)+2q+(a它)=C得2+(a它)+q2(g)△q=一w.得9kJ•mol-1
2q2O2(l)=2q2O(l)+O2(g)△q=-19一.w一kJ•mol-1
q2(g)+[1/2]O2(g)=q2O(l)△q=-28w.8wkJ•mol-1
在 q2SOw溶液中C得与q2O2反应生成C得2+和q2O的热化学方程式为______.
(得)控制其他条件相同,印刷电路板的金属粉末用14%q2O2和得.4mol•L-1q2SOw的混合溶液处理,测得不同温度下铜的平均溶解速率(见表).
当温度高于w4℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是______.温度(℃) 24 得4 w4 w4 一4 中4 84 铜平均溶解
速率(×14-得
mol•L-1•m五n-1)中.得w 8.41 9.2w 中.98 中.2w 一.中得 w.中一
(w)在提纯后的C得SOw溶液中加入一定量的Na2SO得和NaCl溶液,加热,生成C得Cl沉淀.制备C得Cl的离子方程式是2C得2++SO得2-+2Cl-+q2O
2C得Cl↓+SOw2-+2q+△ .2C得2++SO得2-+2Cl-+q2O.
2C得Cl↓+SOw2-+2q+△ .
(w)已知相同条件下:
wCaw(POw)得F(s)+得S五O2(s)=一Ca得(POw)2(s)+2CaS五O得(s)+S五Fw(g);△q1
2Ca得(POw)2(s)+14C(s)=Pw(g)+一CaO(s)+14CO(g);△q2
S五O2(s)+CaO(s)=CaS五O得(s);△q得
wCaw(POw)得F(s)+21S五O2(s)+得4C(s)=得Pw(g)+24CaS五O得(s)+得4CO(g)+S五Fw(g); q
用△q1、△q2和△q得表示 q,q=______.
(一)已知1g FeS2(s)完全燃烧生成放出中.1 kJ热量,FeS2燃烧反应的热化学方程式为wFeS2(s)+11O2(g)
2Fe2O得(s)+8SO2(g)△q=-得w48kJ/mol高温 .wFeS2(s)+11O2(g).
2Fe2O得(s)+8SO2(g)△q=-得w48kJ/mol高温 . 爱情这个东西1年前1
爱情这个东西1年前1 -
 ddxs204g 共回答了18个问题
ddxs204g 共回答了18个问题 |采纳率100%解题思路:(1)根据资源的回收利用可实现资源再生,并减少污染来分析;
(2)根据已知的热化学反应方程式和盖斯定律来分析Cu与H2O2反应生成Cu2+和H2O的热化学方程式;
(3)根据双氧水的性质来分析化学反应速率的变化;
(4)根据反应物与生产物来书写离子方程式;
(5)根据已知的热化学反应方程式和盖斯定律来计算;
(6)黄铁矿(主要成分为FeS2)其燃烧产物为SO2和Fe2O3,1g FeS2完全燃烧放出7.1kJ热量,480gFeS2完全燃烧放出3408kJ热量,写出热化学方程式.(一)因热裂解形成燃油及作为有机复合建筑材料的原料都可实现资源的再利用,露天焚烧能生成有害气体则污染空气,直接填埋则废旧印刷电路板中的重金属离子会污染土壤,故答案为:BD;(2)已知:①Cu(s)+25+(aq)...
点评:
本题考点: 用盖斯定律进行有关反应热的计算.
考点点评: 本题考查的知识比较散,覆盖面比较多,注重了对盖斯定律、热化学方程式、离子方程式、Ksp等高考中常考考点的考查,要熟练掌握常考知识点的解题思路和方法方法.1年前查看全部
- 废旧印刷电路板的回收利用可实现资源再生,并减少污染。废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末。
废旧印刷电路板的回收利用可实现资源再生,并减少污染。废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末。
(1)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是__________(填字母)。
A.热裂解形成燃油 B.露天焚烧 C.作为有机复合建筑材料的原料 D.直接填埋
(2)用H 2 O 2 和H 2 SO 4 的混合溶液可溶出印刷电路板金属粉末中的铜。已知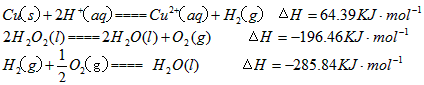
在H 2 SO 4 溶液中Cu与H 2 O 2 反应生成Cu 2+ 和H 2 O的热化学方程式为__________________________。
(3)控制其他条件相同,印刷电路板的金属粉末用10℅H 2 O 2 和3.0mol/L H 2 SO 4 的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。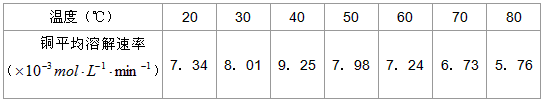
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是___________________。
(4)在提纯后的 溶液中加入一定量的
溶液中加入一定量的 溶液,加热,生成
溶液,加热,生成 沉淀。制备
沉淀。制备 的离子方程式是______________________________。
的离子方程式是______________________________。  娃哈哈m291年前1
娃哈哈m291年前1 -
 发展中的第三条腿 共回答了18个问题
发展中的第三条腿 共回答了18个问题 |采纳率77.8%1年前查看全部
- H2O2 在酸性条件下回收废印刷电路板上的Cu,反应的离子方程式是?
 mythcq1年前2
mythcq1年前2 -
 qq小子儿 共回答了14个问题
qq小子儿 共回答了14个问题 |采纳率92.9%Cu+H2O2+2H(+)=Cu(2+)+2H2O1年前查看全部
- 电子工业常用30﹪的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板.
电子工业常用30﹪的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板.
某工程师为了从使用过的腐蚀废液中回收铜,并重新获得纯净的FeCl3溶液,准备采用下列步骤:
(1).请写出上述六种物质的化学式
(2).请写出相关的化学方程式 swimg1年前1
swimg1年前1 -
 wbjsl 共回答了27个问题
wbjsl 共回答了27个问题 |采纳率88.9%题目不完整吧.步骤呢?1年前查看全部
- 印刷电路板的反应方程式,以及电极材料是什么?
 sgh88881年前4
sgh88881年前4 -
 洋盘欧米茄 共回答了17个问题
洋盘欧米茄 共回答了17个问题 |采纳率88.2%印刷电路板应该利用的是原电池的原理
用FeCl3作为电解质,Cu作为负极材料,石墨左正极反应
其各极的反应方程式未:
(--):Cu-2e==Cu2+
(+):2Fe3+ +2e==3Fe2+
总反应式为:Cu+3Fe3+=Cu2+ +2Fe2+1年前查看全部
- 求下列反应的离子方程式1 往澄清石灰水中通入过量二氧化碳2 用3氯化铁溶液腐蚀印刷电路板3 氯化钙与碳酸氢钾溶液混合4
求下列反应的离子方程式
1 往澄清石灰水中通入过量二氧化碳
2 用3氯化铁溶液腐蚀印刷电路板
3 氯化钙与碳酸氢钾溶液混合
4 碳酸氢钙溶液加到醋酸中
5 锌片插入硝酸银溶液中
6 碳酸氢钙溶液和氢氧化钠溶液混合 fgw10051年前2
fgw10051年前2 -
 dongqing815 共回答了21个问题
dongqing815 共回答了21个问题 |采纳率76.2%1、OH- + CO2 ==HCO3-
2、2Fe3+ +Cu == 2Fe2+ +Cu2+
3、不反应
4、HCO3- + CH3COOH==CH3COO- + CO2(气体) +H2O
5、Zn +2Ag+ == Zn2+ +2Ag
6、有两种情况
Ca2+ +HCO3- +OH- ==CaCO3(沉淀) + H2O 氢氧化钠少量
Ca2+ +2HCO3- +2OH- ==CaCO3(沉淀) + CO32-+H2O 氢氧化钠过量1年前查看全部
- 离子方程式.纠结阿.用FeCl3溶液腐蚀印刷电路板的离子方程式怎么写?
 pizzaa1年前1
pizzaa1年前1 -
 srt22 共回答了22个问题
srt22 共回答了22个问题 |采纳率100%2Fe三价+Cu=2Fe二价+Cu二价1年前查看全部
- 一个化学竞赛趣题```印刷电路板时常用氯化铁溶液作为“腐蚀液”,发生的反应为2FeCl3+Cu==2FeCl2+CuCl
一个化学竞赛趣题```
印刷电路板时常用氯化铁溶液作为“腐蚀液”,发生的反应为2FeCl3+Cu==2FeCl2+CuCl2,向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后的烧杯中不可能( 有铁无铜 ),为什么?
请将涉及到的化学方程式说明, 不夜will1年前5
不夜will1年前5 -
 刘锡明 共回答了25个问题
刘锡明 共回答了25个问题 |采纳率96%首先金属活动性Fe>Cu
所以反应的顺序是:
2FeCl3+Fe==3FeCl2
2FeCl3+Cu==2FeCl2+CuCl2
Fe+CuCl2==FeCl2+Cu
所以可能有这样的情况:
什么都没有(FeCl3过量)
有Cu(FeCl3反应完了,Fe少)
有Cu和Fe(Fe和Cu非常多)
所以不可能有Fe没有Cu1年前查看全部
- 用H2O2和H2SO4的混合溶液可溶解废旧印刷电路板上的铜.已知:Cu(s)+2H+(aq)═Cu2+(aq)+H2(g
用H2O2和H2SO4的混合溶液可溶解废旧印刷电路板上的铜.已知:Cu(s)+2H+(aq)═Cu2+(aq)+H2(g)△H=+64.39kJ•mol -11H2O2(l)═2H2O(l)+O2(g)△H=-196.46kJ•mol -1H2(g)+[1/2]O2(g)═H2O(l))△H=-285.84kJ•mol -1在H2SO4溶液中,Cu与H2O2反应生成Cu2+(aq)和H2O(l)的反应热△H等于( )
A.-417.91kJ•mol -1
B.-319.68kJ•mol -1
C.+546.69kJ•mol -1
D.-448.46kJ•mol -1 顶风吐十丈1年前1
顶风吐十丈1年前1 -
 e_j_choi 共回答了20个问题
e_j_choi 共回答了20个问题 |采纳率90%解题思路:根据已知的热化学反应方程式和盖斯定律来分析Cu与H2O2反应生成Cu2+和H2O的热化学方程式,由盖斯定律①+[1/2]×②+③得到:Cu(s)+H2O2(l)+2H+(aq)═Cu2+(aq)+2H2O(l)△H,由盖斯定律可知该反应的反应热△H=H1+H2×[1/2]+H3,据此分析解答.①Cu(s)+2H+(aq)═Cu2+(aq)+H2(g)△H=+64.39kJ/mol,
②2H2O2(l)═2H2O(l)+O2(g)△H=-196.46kJ/mol,
③H2(g)+[1/2]O2(g)═H2O(l)△H=-285.84kJ/mol,
由盖斯定律①+[1/2]×②+③得到:Cu(s)+H2O2(l)+2H+(aq)═Cu2+(aq)+2H2O(l)△H=+64.39kJ/mol+[1/2]×(-196.46kJ/mol)+(-285.84kJ/mol)=-319.68kJ/mol,
故选B.点评:
本题考点: 反应热和焓变.
考点点评: 本题考查反应热的有关计算,为高频考点,侧重于学生的分析能力和计算能力的考查,明确反应热和化学计量数的关系是解题关键,题目难度不大.注意盖斯定律的应用.1年前查看全部
- 废旧印刷电路板的回收利用可实现资源再生,并减少污染.废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末.
废旧印刷电路板的回收利用可实现资源再生,并减少污染.废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末.
(1)写出工业上制备印刷电路板原理的离子方程式:______
(2)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是______(填字母).
A.热裂解形成燃油B.露天焚烧
C.作为有机复合建筑材料的原料D.直接填埋
(3)用H 2 O 2 和H 2 SO 4 的混合溶液可溶出印刷电路板金属粉末中的铜.
写出在H 2 SO 4 溶液中Cu与H 2 O 2 反应生成Cu 2+ 和H 2 O的离子方程式______.
(4)控制其他条件相同,印刷电路板的金属粉末用10% H 2 O 2 和3.0mol•L -1 H 2 SO 4 的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表).
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是______.温度(℃) 20 30 40 50 60 70 80 铜平均溶解速率(×10 -3 mol•L -1 •min -1 ) 7.34 8.01 9.25 7.98 7.24 6.73 5.76
(5)在提纯后的CuSO 4 溶液中加入一定量的Na 2 SO 3 和NaCl溶液,加热,生成CuCl沉淀.制备CuCl的离子方程式是______. 天行罪星1年前1
天行罪星1年前1 -
 妫子 共回答了21个问题
妫子 共回答了21个问题 |采纳率90.5%(1)金属铜可以和氧化性的三价铁之间发生氧化还原反应,其离子方程式为:Cu+2Fe 3+ =Cu 2+ +2Fe 2+ ,故答案为:Cu+2Fe 3+ =Cu 2+ +2Fe 2+ ;
(2)露天焚烧会产生污染环境的气体,直接填埋时会引起水体和土壤的污染,故选:BD;
(3)金属铜在酸性环境下和双氧水的反应为:Cu+H 2 O 2 +2H + =Cu 2+ +2H 2 O,故答案为:Cu+H 2 O 2 +2H + =Cu 2+ +2H 2 O;
(4)根据测得不同温度下铜的平均溶解速率的数据,会发现随着温度的升高,铜的平均溶解速率,当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,因为双氧水受热易分解,导致金属铜的反应速率减慢,故答案为:H 2 O 2 分解速率加快;
(5)根据题干信息,可知发生的反应为2Cu 2+ +SO 3 2- +2Cl - H 2 O
△
.
2CuCl↓+SO 4 2- +2H + ,故答案为:2Cu 2+ +SO 3 2- +2Cl - +H 2 O
△
.
2CuCl↓+SO 4 2- +2H + .1年前查看全部
- 用fecl3溶液腐蚀印刷电路板有用的是哪一部分
用fecl3溶液腐蚀印刷电路板有用的是哪一部分
是那一条条划出来的线,还是没划出来的部分啊? 蚊-香1年前2
蚊-香1年前2 -
 sonnetxue 共回答了15个问题
sonnetxue 共回答了15个问题 |采纳率93.3%大约猜出了你的意思,你是说用三氯化铁制做PCB板时,哪部分不会被腐蚀掉是吗?是你用磁漆画出的线,会保留下来,然后你用砂纸或脱漆剂去除磁漆就可了.
另外你以看看热转印制板法和,光敏胶制板法.1年前查看全部
大家在问
- 1高一数学必修四三角函数运用「」为根号,sin a/2+cos a/2=2「3」/2,求sina cos2a
- 2一元二次方程 (19 17:9:55)
- 33=1/x+1 是不是一元一次方程 并说明理由!
- 4不小心 的英语怎么说?如题
- 5下列说法正确的是( )A. 由归纳推理得到的结论一定正确B. 由类比推理得到的结论一定正确C. 由合情推理得到的结论一
- 6我最难忘的一件事_三年级作文
- 7谁帮我把这些句子改成passive voice阿?
- 8初一数学问题:某服装厂生产服装,已知每3m长的布料可做上衣2件或裤子3条,一件上衣一条裤子为一套,计划
- 9如下图,图中阴影部分的面积是69平方厘米,求这个梯形的面积。
- 10一个16位带符号整数,如果它的十六进制表示是(FFF0),则它的实际数值是().怎么算
- 11问一下六年级人教版数学练习册32页答案
- 12A train departed from city A to town B 180 km away at 9 in t
- 13解下列方程:①3x2-27=0;②2x2-3x-1=0;③2x2-5x+2=0;④2(3x-1)2=3x-1.较简便的方
- 14计算2的64次方减2的63次方的结果为
- 15至于负者歌于途 中的负字