氮的简单阴离子是什么?
 霜上加雪2022-10-04 11:39:541条回答
霜上加雪2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 乌里 共回答了13个问题
乌里 共回答了13个问题 |采纳率92.3%- 氮气
- 1年前
相关推荐
- 下列说法正确的是()A.难失去电子的原子,获得电子的能力一定强B.易获得电子的原子形成的简单阴离子,其还原性一定弱C.凡
下列说法正确的是()
A.难失去电子的原子,获得电子的能力一定强
B.易获得电子的原子形成的简单阴离子,其还原性一定弱
C.凡单原子形成的离子,一定具有与稀有气体元素原子相同的核外电子排布 彰张华1年前1
彰张华1年前1 -
 xixi20184 共回答了18个问题
xixi20184 共回答了18个问题 |采纳率72.2%A 错误,比如碳原子既不易得也不易失
B 正确 如得电子 F2>Cl2>Br2>I2 还原性I->Br- >Cl->F-
C 如铁离子,亚铁离子都不是稀有气体结构 2 8 14 和 2 8 131年前查看全部
- (2012•泰州二模)已知:G、Q、R、T、X、Y、Z都是周期表中前四周期的元素,它们的核电荷数依次增大.G的简单阴离子
 (2012•泰州二模)已知:G、Q、R、T、X、Y、Z都是周期表中前四周期的元素,它们的核电荷数依次增大.G的简单阴离子最外层有2个电子,Q原子最外层电子数是内层电子数的两倍,X元素最外层电子数与最内层电子数相同;T2R的晶体类型是离子晶体,Y原子基态3p原子轨道上有2个未成对电子,其单质晶体类型属于原子晶体;在元素周期表中Z元素位于第10列.
(2012•泰州二模)已知:G、Q、R、T、X、Y、Z都是周期表中前四周期的元素,它们的核电荷数依次增大.G的简单阴离子最外层有2个电子,Q原子最外层电子数是内层电子数的两倍,X元素最外层电子数与最内层电子数相同;T2R的晶体类型是离子晶体,Y原子基态3p原子轨道上有2个未成对电子,其单质晶体类型属于原子晶体;在元素周期表中Z元素位于第10列.
回答下列问题:
(1)Z的核外电子排布式是______.
(2)X以及与X左右相邻的两种元素,其第一电离能由小到大的顺序为______.
(3)QR2分子中,Q原子采取______杂化,写出与QR2互为等电子体的一种分子的化学式:______.
(4)分子式为Q2G6R的物质有两种,其中一种易溶于水,原因是______;T的氯化物的熔点比Y的氯化物的熔点高,原因是______.
(5)据报道,由Q、X、Z三种元素形成的一种晶体具有超导性,其晶体结构如右图所示.晶体中距每个X原子周围距离最近的Q原子有______个. queenying1年前1
queenying1年前1 -
 银色飞马 共回答了16个问题
银色飞马 共回答了16个问题 |采纳率87.5%解题思路:G、Q、R、T、X、Y、Z都是周期表中前四周期的元素,它们的核电荷数依次增大.G的简单阴离子最外层有2个电子,则G为氢元素;Q原子最外层电子数是内层电子数的两倍,则Q原子有2个电子层,最外层电子数为4,故Q为碳元素;X元素最外层电子数与最内层电子数相同,原子序数大于碳元素,最外层电子数为2,应处于第三周期,故X为Mg元素;T2R的晶体类型是离子晶体,T为+1价、R为-2价,结合原子序数可知,T为Na元素、R为氧元素;Y原子基态3p原子轨道上有2个未成对电子,其单质晶体类型属于原子晶体,则Y为Si元素;在元素周期表中Z元素位于第10列,则Z为Ni元素,据此解答.G、Q、R、T、X、Y、Z都是周期表中前四周期的元素,它们的核电荷数依次增大.G的简单阴离子最外层有2个电子,则G为氢元素;Q原子最外层电子数是内层电子数的两倍,则Q原子有2个电子层,最外层电子数为4,故Q为碳元素;X元素最外层电子数与最内层电子数相同,原子序数大于碳元素,最外层电子数为2,应处于第三周期,故X为Mg元素;T2R的晶体类型是离子晶体,T为+1价、R为-2价,结合原子序数可知,T为Na元素、R为氧元素;Y原子基态3p原子轨道上有2个未成对电子,其单质晶体类型属于原子晶体,则Y为Si元素;在元素周期表中Z元素位于第10列,则Z为Ni元素,
(1)Z为Ni元素,原子核外电子数为28,Ni的核外电子排布式是:1s22s22p63s23p63d84s2,
故答案为:1s22s22p63s23p63d84s2;
(2)同周期自左而右第一电离能呈增大趋势,但Mg原子3s能级容纳两个电子,处于全满稳定状态,电子能量降低,第一电离能高于Al元素,故第一电离能Na<Al<Mg,
故答案为:Na<Al<Mg;
(3)CO2分子中碳原子成2个C=O双键,没有孤电子对,故碳原子采取sp杂化,CO2互为等电子体的一种分子的化学式:N2O(或CS2等),
故答案为:sp;N2O(或CS2等);
(4)分子式为C2H6O的物质有两种,其中一种易溶于水,该物质为乙醇,由于乙醇分子与水分子形成氢键,故易溶于水,
氯化钠属于离子晶体,四氯化硅属于分子晶体,离子晶体的熔点一般高于分子晶体,
故答案为:乙醇分子与水分子形成氢键;氯化钠属于离子晶体,四氯化硅属于分子晶体,离子晶体的熔点一般高于分子晶体;
(5)利用均摊法确定Q原子个数,每个X原子被两个晶胞共用,每个晶胞含有一个Q原子,所以晶体中距每个X原子周围距离最近的Q原子有2个,
故答案为:2.点评:
本题考点: 位置结构性质的相互关系应用;元素电离能、电负性的含义及应用;晶胞的计算;原子轨道杂化方式及杂化类型判断.
考点点评: 本题考查位置结构性质关系、核外电子排布规律、第一电离能、杂化理论、等电子体、晶体类型与性质、晶胞计算等,题目较为综合,推断元素是解题的关键,难度中等,旨在考查学生对基础知识的理解掌握.1年前查看全部
- 请列举 常见简单阳离子、常见简单阴离子、常见复杂阳离子、常见复杂阴离子.
请列举 常见简单阳离子、常见简单阴离子、常见复杂阳离子、常见复杂阴离子.
并且回答一下.由离子构成的物质有______(归类回答)如_____(具体物质) jimzhong8881年前2
jimzhong8881年前2 -
 wshyxc 共回答了18个问题
wshyxc 共回答了18个问题 |采纳率77.8%常见简单阳离子Ag+、Al3+、Ba2+、Ca2+、Cu2+、Fe2+、Fe3+、H+、K+、Li+、Mg2+、Mn2+、Na+、Zn2+
常见简单阴离子Br-、Cl-、F-、I-、O2-、S2-
常见复杂阳离子[Ag(NH3)2]+、NH4+、H3O+
常见复杂阴离子AlO2-、BrO-、CH3COO-、ClO-、CO32-、C2O42-、Cr2O72-、HCO3-、HS-、HSO3-、MnO4-、NO2-、NO3-、OH-、PO43-、SCN-、SO32-、SO42-
由离子构成的物质有盐类和强碱,如氯化钠NaCl、氢氧化钠NaOH1年前查看全部
- 下列说法中正确的是( ) A.难失电子的原子,获得电子的能力一定强 B.易得电子的原子所形成的简单阴离子,其还原性
下列说法中正确的是( )
A.难失电子的原子,获得电子的能力一定强 B.易得电子的原子所形成的简单阴离子,其还原性一定强 C.分子中键能越大,键长越长,则分子越稳定 D.电子层结构相同的不同离子,核电荷数越多半径越小  宏仔不吃糖1年前1
宏仔不吃糖1年前1 -
 望999 共回答了14个问题
望999 共回答了14个问题 |采纳率100%D
A错误,ⅣA的元素最外层有4个电子,既难失电子,也难获得电子;B错误,易得电子的原子所形成的简单阴离子,其还原性弱;C错误,分子中键能越大,键长越短,分子越稳定;D正确,电子层结构相同的不同离子,核电荷数越多,原子对电子的吸引力越强,半径越小。1年前查看全部
- 同主族元素的简单阴离子还原性越强,水解程度越大
 带刺黄瓜1年前1
带刺黄瓜1年前1 -
 攻刀 共回答了15个问题
攻刀 共回答了15个问题 |采纳率93.3%错了,同主族的从上到下的还原性逐渐递减,电离程度会减弱,且越来越不易水解,即还原性强,越不水解.1年前查看全部
- 同主族元素的简单阴离子还原性强,水解程度越小 那么氯离子比氟离子还原性强,氯离子
同主族元素的简单阴离子还原性强,水解程度越小 那么氯离子比氟离子还原性强,氯离子
同主族元素的简单阴离子还原性强,水解程度越小 那么氯离子比氟离子还原性强,氯离子就应该比氟离子更难水解啊.那为什么盐酸酸性还大于氢氟酸? findty20021年前4
findty20021年前4 -
 qliuhai0919 共回答了25个问题
qliuhai0919 共回答了25个问题 |采纳率76%同浓度酸电离出的氢离子越多酸性越强,盐酸和氢氟酸都是一元酸,所以它们的酸性强弱取决于电离程度.盐酸水解程度小,即电离程度大,所以盐酸酸性强于氢氟酸1年前查看全部
- 易得电子的原子所形成的简单阴离子,其还原性一定弱?
易得电子的原子所形成的简单阴离子,其还原性一定弱?
这句话为什么是对的? 飘一会1年前3
飘一会1年前3 -
 瓶盖rr 共回答了18个问题
瓶盖rr 共回答了18个问题 |采纳率88.9%易得电子的原子所形成的简单阴离子,其还原性一定弱?这句话是对的.因为原子易得电子,它的离子就难失电子了,失电子的性质是还原性,因此其还原性一定弱.1年前查看全部
- 已知:X、Y、Z、W都是周期表中前四周期的元素,它们的核电荷数依次增大.X的简单阴离子最外层有2个电子,Y原子最外层电子
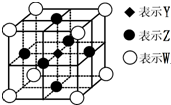 已知:X、Y、Z、W都是周期表中前四周期的元素,它们的核电荷数依次增大.X的简单阴离子最外层有2个电子,Y原子最外层电子数是内层电子数的两倍,Z的原子序数是Y的两倍,在元素周期表中W元素位于第11列.
已知:X、Y、Z、W都是周期表中前四周期的元素,它们的核电荷数依次增大.X的简单阴离子最外层有2个电子,Y原子最外层电子数是内层电子数的两倍,Z的原子序数是Y的两倍,在元素周期表中W元素位于第11列.
回答下列问题:
(1)Z原子核外有______种不同运动状态的电子.
(2)X、Y、Z、W中,在周期表中位于p区的元素是______(填元素符号).
(3)W原子基态电子排布式为______.
(4)Z以及与Z左右相邻的两种元素,这三种元素第一电离能由大到小的顺序是______(填元素符号,用“>”表示).
(5)Y2X4分子中,Y原子采取______杂化,推算Y2X4分子中σ键与π键数目之比为______.
(6)据报道,由Y、Z、W三种元素形成的一种晶体具有超导性,其晶体结构如图.晶体中与每个W原子距离最近的Y原子有______个.
(7)直接蒸干WCl2溶液得不到WCl2晶体,而是得到黑色固体,请你结合化学用语给出简要解释______. tianling8461年前1
tianling8461年前1 -
 rr阿蒙 共回答了16个问题
rr阿蒙 共回答了16个问题 |采纳率75%解题思路:X、Y、Z、W都是周期表中前四周期的元素,它们的核电荷数依次增大.X的简单阴离子最外层有2个电子,则X为H元素,Y原子最外层电子数是内层电子数的两倍,Y原子只能有2个电子层,最外层电子数为4,则Y为C元素;Z的原子序数是Y的两倍,其原子序数为12,则Z为Mg,在元素周期表中W元素位于第11列,则W为Cu元素.X、Y、Z、W都是周期表中前四周期的元素,它们的核电荷数依次增大.X的简单阴离子最外层有2个电子,则X为H元素,Y原子最外层电子数是内层电子数的两倍,Y原子只能有2个电子层,最外层电子数为4,则Y为C元素;Z的原子序数是Y的两倍,其原子序数为12,则Z为Mg,在元素周期表中W元素位于第11列,则W为Cu元素,
(1)Z为Mg元素,原子核外有12个电子,核外有12种不同运动状态的电子,故答案为:12;
(2)H、C、Mg、Cu中,在周期表中位于p区的元素是C,故答案为:C;
(3)W为Cu,原子核外电子数为29,根据能量最低原理与洪特规则,原子基态电子排布式为1s22s22p63s23p63d104s1,故答案为:1s22s22p63s23p63d104s1;
(4)与Mg左右相邻的两种元素,为Na、Al,三种元素同周期,随原子序数增大元素第一电离能呈增大趋势,但Mg元素原子3s能级容纳2个电子,为全满稳定状态,能量较低,较难失去电子,第一电离能高于同周期相邻元素,故第一电离能Mg>Al>Na,
故答案为:Mg>Al>Na;
(5)C2H4分子中,C原子成3个σ键、不含孤对电子,杂化轨道数目为3,N原子采取sp2杂化,推算C2H4分子中有4个C-H、1个C=C双键,双键中含有1个σ键、1个π键,故C2H4分子中σ键与π键数目之比=5:1,
故答案为:sp2;1:5;
(6)W原子位于顶角上,晶体中与每个W原子距离最近的Y原子位于体心,每个W原子为8个晶胞共用,故与W原子距离最近的Y原子共用8个,
故答案为:8;
(7)CuCl2溶液中存在平衡:CuCl2+2H2O⇌Cu(OH)2+2HCl,加热蒸发,HCl挥发,促进水解彻底进行,得到Cu(OH)2,Cu(OH)2受热分解得到CuO,故得不到CuCl2晶体,而是得到黑色固体
故答案为:CuCl2溶液中存在平衡:CuCl2+2H2O⇌Cu(OH)2+2HCl,加热蒸发,HCl挥发,促进水解彻底进行,得到Cu(OH)2,Cu(OH)2受热分解得到CuO.点评:
本题考点: 位置结构性质的相互关系应用;晶胞的计算.
考点点评: 本题考查物质结构与性质,涉及核外电子排布、电离能、杂化轨道、化学键、晶胞结构、盐类水解等,题目比较综合,侧重对基础知识的巩固运用,推断元素是解题关键,难度中等.1年前查看全部
- 下列说法错误的是( )A.同主族元素的简单阴离子还原性越强,水解程度越大B.Na和Cs属于IA族元素,Cs失电子的能力
下列说法错误的是( )
A.同主族元素的简单阴离子还原性越强,水解程度越大
B.Na和Cs属于IA族元素,Cs失电子的能力比Na强
C.IA族与VIIA族元素间可形成共价化合物或离子化合物
D.同周期元素(0族元素除外)从左到右,原子半径逐渐减小 赛小丫1年前1
赛小丫1年前1 -
 大话飞龙 共回答了26个问题
大话飞龙 共回答了26个问题 |采纳率84.6%解题思路:A.同主族元素的简单阴离子还原性越强,水解程度越小;
B.同主族,从上到下,元素原子半径逐渐减大,原子半径越大,越容易失去电子;
C、金属元素和非金属元素间形成离子化合物,非金属元素和非金属元素间形成共价化合物;
D.同周期元素(0族元素除外)从左到右,元素原子半径逐渐减小;A.同主族元素的简单阴离子还原性越强,水解程度越小,如F-水解程度大于Cl-,故A错误;
B.Na和Cs属于IA族元素,Cs的原子半径比Na大,原子半径越大,越容易失去电子,所以Cs失电子的能力比Na强,故B正确;
C、IA族含有金属元素和非金属元素,VIIA族全部是非金属元素,金属元素和非金属元素间形成离子化合物,非金属元素和非金属元素间形成共价化合物,所以IA族与VIIA族元素间可形成共价化合物或离子化合物,故C正确;
D.同周期元素(0族元素除外)从左到右,原子半径逐渐减小,故D正确;
故选:A;点评:
本题考点: 元素周期律的作用.
考点点评: 本题主要考查了元素周期律,难度不大,注意元素性质的递变性和规律性.1年前查看全部
- 质子数和电子数分别相同的微粒有:(1)简单阳离子:__________________ (2)简单阴离子:_______
质子数和电子数分别相同的微粒有:(1)简单阳离子:__________________ (2)简单阴离子:__________________
质子数和电子数分别相同的微粒有:
(1)简单阳离子:__________________
(2)简单阴离子:__________________ shuiyunyt5201年前1
shuiyunyt5201年前1 -
 wonderer_richard 共回答了21个问题
wonderer_richard 共回答了21个问题 |采纳率90.5%质子数和电子数分别相同的微粒有:
(1)简单阳离子:Na+、NH4+、H3O+
(2)简单阴离子:OH-、F-、NH2-、1年前查看全部
- 卤族元素和金属活动性顺序表氢前面的金属反应只能形成离子化合物么?卤族元素的简单阴离子的电子层数一定等于所在周期数么?
 5月30日0时1年前3
5月30日0时1年前3 -
 倾斜给人取走了 共回答了13个问题
倾斜给人取走了 共回答了13个问题 |采纳率84.6%不是 AlCl3就是共价化合物 卤族元素的简单阴离子的电子层数一定等于所在周期数1年前查看全部
- 为什么金属元素不能形成简单阳离子非金属元素不能形成简单阴离子?什么是简单阳离子、简单阴离子?
 碧成1年前1
碧成1年前1 -
 蓝天不会遗忘 共回答了20个问题
蓝天不会遗忘 共回答了20个问题 |采纳率90%可以形成离子NA+ K+ LI+ CA2+ MG2+ ZN2+
S2- CL- BR- I- F-1年前查看全部
- 下列说法中正确的是( )A.难失电子的原子,获得电子的能力一定强B.易得电子的原子所形成的简单阴离子,其还原性一定强C
下列说法中正确的是( )
A.难失电子的原子,获得电子的能力一定强
B.易得电子的原子所形成的简单阴离子,其还原性一定强
C.活泼金属与活泼非金属化合,易形成离子键
D.电子层结构相同的不同离子,核电荷数越多,半径越小 01231231231年前1
01231231231年前1 -
 杂交活动家 共回答了16个问题
杂交活动家 共回答了16个问题 |采纳率87.5%解题思路:A.ⅣA族元素以及零族元素,既难以失电子,也难以得电子;
B.易得电子的原子所形成的简单阴离子,还原性较弱;
C.活泼金属与活泼非金属可形成离子键;
D.电子层数相同,核电荷数越大的半径越小.A.难失电子的原子,获得电子的能力不一定强,如ⅣA族元素以及零族元素,故A错误;
B.元素的非金属性越强,越易得电子,对应的阴离子的还原性越弱,故B错误;
C.活泼金属与活泼非金属可形成离子化合物,含有离子键,故C正确;
D.电子层结构相同的不同离子,离子有带正电的质子和带负电的电子组成,相互吸引,质子多,吸引力越强,半径就越小,故D正确.
故选CD.点评:
本题考点: 元素周期律和元素周期表的综合应用;离子化合物的结构特征与性质.
考点点评: 本题考查较为综合,涉及元素周期律以及离子键等知识,为高频考点,侧重于学生的分析能力的考查,注意相关基础知识的积累,难度不大.1年前查看全部
- 在水溶液中能稳定存在且不与水反应的常见简单阴离子和复杂阴离子有哪些 求答案
 木鱼笨1年前1
木鱼笨1年前1 -
 zhangganghu 共回答了19个问题
zhangganghu 共回答了19个问题 |采纳率73.7%Cl- SO4 2- F- OH- CO3 2- HCO3- HSO4- NO3- SO3 2- NO2- AlO2- PO4 3- HPO4 2- H2PO4-
Ac- I- Br- CN- SCN- [Al(OH)]-这是我能想到的1年前查看全部
- 第七主族元素其简单阴离子的核外电子层数等于该元素所在的周期数吗?
 wer1191年前1
wer1191年前1 -
 宝贝彻夜未眠 共回答了16个问题
宝贝彻夜未眠 共回答了16个问题 |采纳率93.8%一定对的 我化学不错1年前查看全部
大家在问
- 1一业余体校新购进三种球,其中篮球占总数的[1/3],足球的个数与其它两种球个数的比是1:5,排球有150个,三种球共有多
- 2英语翻译:我们已经是多年的好朋友了.
- 3在两座房子之间有辆小汽车用英语怎么说?
- 4散度定理的意义是什么
- 5Have there been any acquisitions or divestitures within last
- 6怎么学会物理受力分析中的思维?老师讲后感觉蛮简单的,就是做的时候找不到思路.怎样才能有更好的思路去做呢?应该注意什么?
- 7函数单调区间怎么求f(x)=x^2-4x+1::::::f(x)=-2x^2+5x+1::::::::Y=-1/x:::
- 8这段英语有什么明显的错误吗,哪些语句可以说的更漂亮些呢.
- 9平面上的五个点A,B,C,D和E满足:AB=8厘米,BC=4厘米 AD=5厘米 DE=1厘米 AC=12厘米 AE=6厘
- 10峨冠博带的带是什么意思要五个字以下○∣\)﹡﹡﹡◎¯≧¯◎----|------------|---
- 11电路故障分析在用伏安法测小灯泡的电功率的电路图中,闭合开关,发现电流表示数几乎为零,电压表示数接近电源电压,是因为什么?
- 12Do you know how many d____ between the two different picture
- 13燃气灶打不着火?灶下面的两个气孔起什么作用?该如何调整?
- 14取几种植物的花瓣加入酒精研磨,然后各取少许,用稀酸或稀碱检验,现象如下表:
- 15形容悠闲而舒适填相应的词语
