Si的基态原子核外电子排布式是什么?
 小林仔1232022-10-04 11:39:541条回答
小林仔1232022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 iwinhell 共回答了14个问题
iwinhell 共回答了14个问题 |采纳率92.9%- 2 8 4
准确说是:1s2,2s2 2p6,3s2 3p2 - 1年前
相关推荐
- (2013•山东模拟)(1)与N元素同周期的第一电离能最大且电负性最小的元素的基态原子核外电子排布式为______.
 (2013•山东模拟)(1)与N元素同周期的第一电离能最大且电负性最小的元素的基态原子核外电子排布式为______.
(2013•山东模拟)(1)与N元素同周期的第一电离能最大且电负性最小的元素的基态原子核外电子排布式为______.
(2)氨气易溶于水生成氨水,氨水电离生成铵根离子,铵根离子中氮原子采取______杂化,NH+4中H-N-H键角比NH3中H-N-H键角大,原因为______.
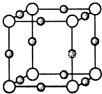
(3)Cu3N形成的晶体结构如图所示,N3-的配位数是______.
(4)常温常压下,给水施加一个弱电场便可形成冰,称之为“热冰”,热冰中微粒间存在的作用力有______,其大小顺序是______.
(5)NaF和NaCl属于同一主族的钠盐,但NaF的莫氏硬度比NaCl大,原因是______. yinweier1年前1
yinweier1年前1 -
 op56589 共回答了22个问题
op56589 共回答了22个问题 |采纳率90.9%解题思路:(1)与N元素同周期的第一电离能最大且电负性最小的元素是Ne;
(2)NH+4中N原子成4个N-H键、没有孤电子对,据此确定杂化方式;电子对之间排斥力:孤电子对-孤电子对>孤电子对-成键电子对>成键电子对-成键电子对,据此判断;
(3)由晶胞结构可知,晶胞中白色球数目=8×[1/8]=1,小灰色球数目=12×[1/4]=3,故白色球为N3-,小灰色球为Cu+,与N3-离子最近的Cu+离子位于棱上且关于N3-离子对称;
(4)热冰中微粒间存在的作用力有化学键、分子间作用力、氢键;
(5)相同类型的离子晶体,晶格能与离子半径成反比,离子晶体的晶格能越大,其莫氏硬度越大.(1)与N元素同周期的第一电离能最大且电负性最小的元素是Ne,其核外电子排布式为1S22S22P6,
故答案为:1S22S22P6;
(2)铵根离子中含有4个键,没有孤电子对,属于采取sp3杂化,氨气分子中氮原子上有一对孤对电子,铵根离子中氮原子上没有孤对电子,排斥力小,故NH+4中H-N-H键角比NH3中H-N-H键角大,
故答案为:sp3;气分子中氮原子上有一对孤对电子,铵根离子中氮原子上没有孤对电子,排斥力小;
(3)由晶胞结构可知,晶胞中白色球数目=8×[1/8]=1,小灰色球数目=12×[1/4]=3,故白色球为N3-,小灰色球为Cu+,与N3-离子最近的Cu+离子位于棱上且关于N3-离子对称,故N3-的配位数是6,
故答案为:6,
(4)热冰中微粒间存在的作用力有化学键、分子间作用力、氢键,微粒间作用力大小顺序是:化学键>氢键>分子间作用力,
故答案为:化学键、分子间作用力、氢键;化学键>氢键>分子间作用力;
(5)相同类型的离子晶体,晶格能与离子半径成反比,离子晶体的晶格能越大,其莫氏硬度越大,氟离子半径小于氯离子半径,所以氟化钠的晶格能大于氯化钠,则NaF的莫氏硬度比NaCl大,
故答案为:相同类型的离子晶体,晶格能与离子半径成反比,离子晶体的晶格能越大,其莫氏硬度越大,氟离子半径小于氯离子半径,所以氟化钠的晶格能大于氯化钠,则NaF的莫氏硬度比NaCl大.点评:
本题考点: 原子核外电子排布;配合物的成键情况;原子轨道杂化方式及杂化类型判断;不同晶体的结构微粒及微粒间作用力的区别.
考点点评: 本题是对物质结构的考查,涉及核外电子排布、杂化轨道、晶胞结构与计算、化学键、晶体类型与性质等,需要学生具备扎实的基础,难度中等.1年前查看全部
- 铬是人体必需的微量元素,在维持人体健康方面起重要作用.(1)Cr元素基态原子核外电子排布式为______.
铬是人体必需的微量元素,在维持人体健康方面起重要作用.(1)Cr元素基态原子核外电子排布式为______.
铬是人体必需的微量元素,在维持人体健康方面起重要作用.
(1)Cr元素基态原子核外电子排布式为______.
(2)与铬同周期的所有元素的基态原子中,最外层电子数与铬原子相同的元素有______(填元素符号),其中一种金属的+2价阳离子与NH3按1:4个数比形成的配合物离子化学式为______.
(3)CrO2Cl2常温下为深红色液体,能与CS2、CCl4等互溶.
①据此可判断固体CrO2Cl2的晶体类型为______.
②CS2分子中C、S两元素的电负性相对大小为______.
③CCl4分子中C原子的杂化类型为______.
(4)K2Cr2O7与H2O2作用可生成CrO5.CrO5的结构为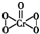 ,其中σ键与π键的个数比为______;已知H2O2的沸点(152.1℃)比摩尔质量相同的H2S沸点(-60.4℃)高,其原因是______.
,其中σ键与π键的个数比为______;已知H2O2的沸点(152.1℃)比摩尔质量相同的H2S沸点(-60.4℃)高,其原因是______.
 玉女彭彭儿1年前1
玉女彭彭儿1年前1 -
 叶徐青蓝 共回答了20个问题
叶徐青蓝 共回答了20个问题 |采纳率80%(1)Cr元素的原子序数为24,核外电子排布式为:1s22s22p63s23p63d54s1或[Ar]d54s1;
故答案为:1s22s22p63s23p63d54s1或[Ar]d54s1;
(2)铬元素的最外层电子数为1,同周期最外层排1个电子的元素还有K、Cu;Cu2+与NH3按1:4个数比形成的配合物为[Cu(NH3)4]2+;
故答案为:K、Cu;[Cu(NH3)4]2+;
(3)①根据相似相溶原理,非极性溶质易溶于非极性溶剂中,CCl4、CS2等是非极性溶剂,CrO2Cl2能与CCl4、CS2等互溶,所以CrO2Cl2是非极性分子,属于分子晶体;
故答案为:分子晶体;
②CS2分子中C、S两元素的化合价分别为+4,-2价,所以S元素得电子能力大于C,所以电负性:S>C;
故答案为:S>C;
③CCl4分子中C原子的价层电子对数n=4,C原子采取sp3;
故答案为:sp3;
(4)单键为σ键,双键键中有1个σ键、1个π键,CrO5的结构为 ,其中σ键有7个,π键有1个,σ键与π键的个数比为7:1;H2O2分子间存在氢键,使物质的熔点增大,而H2S分子间不存在氢键;
,其中σ键有7个,π键有1个,σ键与π键的个数比为7:1;H2O2分子间存在氢键,使物质的熔点增大,而H2S分子间不存在氢键;
故答案为:7:1;H2O2分子间存在氢键,H2S分子间不存在氢键;1年前查看全部
- 钙钪钛钒铬锰铁钴列铜锌的基态原子核外电子排布式分别是什么
 crysthui1年前1
crysthui1年前1 -
 txder 共回答了19个问题
txder 共回答了19个问题 |采纳率89.5%钙Ca 1s22s22p63s23p64s2
钪Sc 1s22s22p63s23p63d14s2
钛Ti 1s22s22p63s23p63d24s2
钒V 1s22s22p63s23p63d34s2
铬Cr 1s22s22p63s23p63d54s1
锰Mn 1s22s22p63s23p63d54s2
铁Fe 1s22s22p63s23p63d64s2
钴Co 1s22s22p63s23p63d74s2
镍Ni 1s22s22p63s23p63d84s2
铜Cu 1s22s22p63s23p63d104s1
锌Zn 1s22s22p63s23p63d104s21年前查看全部
大家在问
- 1酒精灯加铁丝网或防风罩可将火焰温度提高到多少摄氏度?
- 2两个因数的积是72.46,如果其中一个因数扩大到它的30倍,另一个因数缩小到它的三百分之一,这两个因数的积
- 3世界历史进程中经济全球化的特点是什么
- 4The girl _____(feel) relaxed after a three-day trip.
- 5已知单项式-2/3 a的x次方b的y+8次方与单项式4 a的2y次方b的3x-y次方的和为单项式,求这个单项式的积
- 6以回味为题的高中作文,要有心理描写,记叙一件事,最好有悬念(可有可无),
- 7什么是酒精沸腾点和凝固点什么是酒精的沸腾点和凝固点?什么是煤油的沸腾点和凝固点?
- 8P是三角形ABC内的一点,连接PB和PC.试证角BPA=角A+角1+角2
- 9But Bobo can't read和 i'm sorry.but you can put an ad(广告)in t
- 10下面几英语礼貌用语在什么场合用?
- 11小学课文中的《詹天佑》 的示意图怎么画?思考练习的答案是什么?
- 12LINGO min 45;(x1+x2) ST x1+x2>=1 x1
- 13假如你是李华,给cathy写一封感谢信,感谢她的热情服务.1.她的周到服务使活动顺利 2.他的讲解
- 14Do you always( ) sunglasses in the sun?A.wear B.dress C.try
- 15betty is t___ to her mother nowadayskorea
