K35ClO3晶体与H37Cl的浓盐酸反应后,生成氯气、氯化钾和水.则此反应生成的氯气的相对分子质量为()
 cara39732022-10-04 11:39:542条回答
cara39732022-10-04 11:39:542条回答
K35ClO3晶体与H37Cl的浓盐酸反应后,生成氯气、氯化钾和水.则此反应生成的氯气的相对分子质量为()
A 70.6 B 73 C 73.3 D74
求详解
A 70.6 B 73 C 73.3 D74
求详解

已提交,审核后显示!提交回复
共2条回复
相关推荐
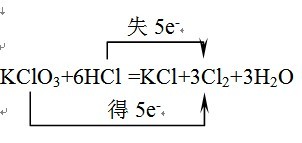
- 2、已知反应:KClO3+6HCl=KCl+3Cl2↑+3H2O,若用K35ClO3和H37Cl作用,下列说法正确的是
2、已知反应:KClO3+6HCl=KCl+3Cl2↑+3H2O,若用K35ClO3和H37Cl作用,下列说法正确的是
A、KCl中只含35Cl
B、KCl中只含37Cl
C、KCl中既含35Cl,又含37Cl
D、被氧化和被还原的氯原子数之比为6∶1
为什么 smail5201年前3
smail5201年前3 -
 韩rr时尚服饰 共回答了23个问题
韩rr时尚服饰 共回答了23个问题 |采纳率82.6%KClO3----Cl2
5HCl-----Cl2
HCl-------KCl
答案B
D是5:11年前查看全部
- 高一化学计算题(同位素)已知:KClO3+6HCl=KCl+3Cl+3H2O,现用K35ClO3和H37Cl反应,求制备
高一化学计算题(同位素)
已知:KClO3+6HCl=KCl+3Cl+3H2O,现用K35ClO3和H37Cl反应,求制备的Cl2的摩尔质量是多少 retonet1年前1
retonet1年前1 -
 lily070216 共回答了19个问题
lily070216 共回答了19个问题 |采纳率73.7%解这道题的关键在于弄清楚Cl2来自谁.KCl中Cl为负一价,根据氧化还原反应中化合价变化不能交叉,所以KCl中Cl来自于HCl,所以KClO3中Cl得到5个电子,5个HCl中Cl失去5个电子,即3mol的Cl2中一个Cl来自KClO3,5个来自于HCl,同理,1mol的Cl2中1/6个Cl来自KClO3,5/6个来自于HCl,现用K35ClO3和H37Cl反应,则1mol的Cl2摩尔质量为1/6×35+5/6×37等于36.67,则Cl2为36.67×2等于73.341年前查看全部
- 已知反应KClO3+6HCl+KCl+3Cl2↑+H2O若用K35ClO3与H37Cl作用 则下列说法中正确的是
已知反应KClO3+6HCl+KCl+3Cl2↑+H2O若用K35ClO3与H37Cl作用 则下列说法中正确的是
反应中转移电子数位6
KCl中只含有37Cl
KCl中既有35Cl有有37Cl
生成的氯气相对分子质量约为73.3 芝麻香片1年前1
芝麻香片1年前1 -
 天使的断翼xa 共回答了18个问题
天使的断翼xa 共回答了18个问题 |采纳率83.3%KClO3+6HCl=KCl+3Cl2↑+H2O
+5 ,-1*6=6 ,-1 ,0
↑_____|
,5e
可以看到有5个电子转移,所以A错误
由于KClO3的Cl都归中了,所以最后K+是和HCl里的Cl结合的,那么KCl中只含有37Cl,B这就是对的了
C和B矛盾
D,从上可知,氯气中1/4是Cl35,3/4是Cl37,这样的话相对分子质量大约就是
70/4+74/4*3=73,显然不对
PS,其实Cl35分子质量是35.5,不过即便如此结果还是73.25,还是不对1年前查看全部
- K35ClO3晶体与H37Cl的溶液反应后,生成氯气、氯化钾和水.下列说法正确的是( )
K35ClO3晶体与H37Cl的溶液反应后,生成氯气、氯化钾和水.下列说法正确的是( )
A. 被还原的K35ClO3和被氧化的H37Cl的物质的量之比为1:5
B. 生成的氯气其相对分子质量为72
C. 氯化钾既不是氧化产物,也不是还原产物
D. 每生成标准状况下的氯气11.2L,转移电子数为6.02×1023 第几条猫1年前4
第几条猫1年前4 -
 mfkfnwxfzz 共回答了19个问题
mfkfnwxfzz 共回答了19个问题 |采纳率89.5%解题思路:K35ClO3晶体与H37Cl的溶液反应后,生成氯气、氯化钾和水,发生2K35ClO3+12H37Cl=2K37Cl+35Cl2↑+537Cl2↑+6H2O,Cl元素的化合价由+5价降低为0,Cl元素的化合价由-1价升高为0,以此来解答.K35ClO3晶体与H37Cl的溶液反应后,生成氯气、氯化钾和水,发生2K35ClO3+12H37Cl=2K37Cl+35Cl2↑+537Cl2↑+6H2O,
A.Cl元素的化合价降低被还原,升高被氧化,由电子守恒及原子守恒可知,被还原的K35ClO3和被氧化的H37Cl的物质的量之比为1:5,故A正确;
B.生成的氯气中质量数为37、35的原子个数比为5:1,其相对分子质量为[37×5+35/6]×2=73.3,故B错误;
C.氯化钾中K、Cl元素的化合价反应前后不变,则氯化钾既不是氧化产物,也不是还原产物,故C正确;
D.由反应可知,生成3mol气体转移5mol电子,则每生成标准状况下的氯气11.2L,转移电子数为[11.2L/22.4L/mol]×[5/3]×6.02×1023,故D错误;
故选AC.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,注意盐酸在反应中起酸和还原剂的作用,明确Cl的质量数及原子守恒,题目难度中等.1年前查看全部
- 关于反应K35ClO3+6H37Cl═KCl+3Cl2↑+3H2O的有关叙述中,正确的是( )
关于反应K35ClO3+6H37Cl═KCl+3Cl2↑+3H2O的有关叙述中,正确的是( )
A.KCl中含有35Cl
B.生成物Cl2的相对分子质量为73.3
C.该反应转移的电子数为6e-
D.氧化剂和还原剂的物质的量之比为1:6 hirico1年前1
hirico1年前1 -
 登_陆_上_岛 共回答了24个问题
登_陆_上_岛 共回答了24个问题 |采纳率87.5%解题思路:该反应中Cl元素化合价由+5价、-1价变为0价,有[1/6]的HCl不作还原剂,起酸的作用,氧化剂是K35ClO3、还原剂 H37Cl,据此分析解答.A.HCl→KCl时Cl元素化合价不变,HCl起酸的作用,所以KCl中含有37Cl,故A错误;
B.生成氯气的相对分子质量=[35×1+37×5/3]=73.3,故B正确;
C.该反应转移的电子数为5e-,故C错误;
D.氧化剂是K35ClO3、还原剂是[5/6]的 H37Cl,所以氧化剂和还原剂的物质的量之比为1:5,故D错误;
故选B.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查了氧化还原反应,明确元素化合价转化是解本题关键,易错点是氯气相对分子质量的计算方法.1年前查看全部
- 已知:kCL03十6HCL=kcL+3CL2+3H2O,现用k35CLO3和H37cL反应求制备的氯气的式量是多少?
 estxzq1年前1
estxzq1年前1 -
 ync87 共回答了2681个问题
ync87 共回答了2681个问题 |采纳率81.1%根据归中原理,在KClO3+6HCl==KCl+3Cl2↑+3H2O这个反应中,生成的三个氯分子中,有一个氯原子是从氯酸钾中得到的,另五个氯原子是从氯化氢中得到的,已知氯酸钾中的氯的质量数为35,氯化氢中的氯的质量数为37,所以产生的6个氯原子的平均相对原子质量= (35 + 37*5 )/6 = 36.667 所以制备的氯气的式量(相对分子质量)为36.667*2=73.31年前查看全部
- 化学元素符号右上角数字的意义应该不是电荷数,更不是化合价,因为那个数是35,37就是K35CLO3和H37CL,其中35
化学元素符号右上角数字的意义
应该不是电荷数,更不是化合价,因为那个数是35,37
就是K35CLO3和H37CL,其中35和37标在右上角 崎岖之路1年前9
崎岖之路1年前9 -
 bjxl20 共回答了20个问题
bjxl20 共回答了20个问题 |采纳率95%那个是所带电荷数..
如果是n+则表示带n个正电荷.如果是n-则表示带n个负电荷.1年前查看全部
- 已知反应KClO3+6HCl---KCl+3Cl2+3H2O,若用K35ClO3和H37Cl作用,则下列说法中正确的是
已知反应KClO3+6HCl---KCl+3Cl2+3H2O,若用K35ClO3和H37Cl作用,则下列说法中正确的是
A 该反应中转移电子数目为6e B KCL只含有37Cl
C Cl2中只含有37Cl D 生成的氯气式量全是72
为什么A不对呀 huangzhf1年前3
huangzhf1年前3 -
 aaaaassssddd 共回答了16个问题
aaaaassssddd 共回答了16个问题 |采纳率75%下列说法中正确的是B
A该反应中转移电子数目为5e
C.Cl2中只含有37Cl,35Cl
D.生成的氯气式量全是37*5+35/6*2=73.31年前查看全部
- 已知:kCL03十6HCL=kcL+3CL2+3H2O,现用k35CLO3和H37cL反应求制备的氯气的式量是多少?
 Angela1481年前1
Angela1481年前1 -
 花开那叶 共回答了20个问题
花开那叶 共回答了20个问题 |采纳率90%根据归中原理,在KClO3+6HCl==KCl+3Cl2↑+3H2O这个反应中,生成的三个氯分子中,有一个氯原子是从氯酸钾中得到的,另五个氯原子是从氯化氢中得到的,已知氯酸钾中的氯的质量数为35,氯化氢中的氯的质量数为37,所以产生的6个氯原子的平均相对原子质量= (35 + 37*5 )/6 = 36.667 所以制备的氯气的式量(相对分子质量)为36.667*2=73.31年前查看全部
- 已知:KClO3+6HCl==KCl+3Cl2↑+3H2O,现用K35ClO3和H37Cl反应,求制备的氯气的式量是多少
已知:KClO3+6HCl==KCl+3Cl2↑+3H2O,现用K35ClO3和H37Cl反应,求制备的氯气的式量是多少?
 kagg3717511年前3
kagg3717511年前3 -
 漫漫想 共回答了23个问题
漫漫想 共回答了23个问题 |采纳率78.3%根据归中原理,在KClO3+6HCl==KCl+3Cl2↑+3H2O这个反应中,生成的三个氯分子中,有一个氯原子是从氯酸钾中得到的,另五个氯原子是从氯化氢中得到的,已知氯酸钾中的氯的质量数为35,氯化氢中的氯的质量数为37,所以产生的6...1年前查看全部
大家在问
- 1已知x1,x2是一元二次方程x²-x+2m-2=0的两个实根,求m的取值范围,求若m满足2x1+x2=m+1,
- 2下列关于物体可以看做质点的说法正确的有( )
- 3为什么5.98除0.23和598除23答案一样?
- 4很好的近义词是什么?
- 5甲乙两仓库共存粮180吨.从甲仓取出20%,乙仓取出12%后,两仓还剩404吨.甲仓原来存粮多少吨?
- 6数列{an}的通项公式an=n^2+kn,若此数列满足an < an +1则k范围
- 7如图,三角形ABC中,点D在AB上,BD=2AD,点E在BC上,BC=4BE,点F在AC上,AC=5CF,已知阴影三角形
- 8数学-------展示一下一个游泳池长50米,宽16米,需注水多少立方米才能上升1分米?注入的水有多少升?
- 9比较级最高级的变化规则
- 10已知x∈[3/8,4/9],试求函数y=x+根号(1-2x)的值域
- 11读书乐 作文
- 12我终于见到了大海!我心中的大海!
- 13在反应P4+CuSO4+H2O=Cu3P+H3PO4+H2SO4中,1mol CuSO4可以氧化多少mol白磷
- 14下列词语中,有两个错别字的一组是 [ ] A、谍血 宣泄 笑靥 纷
- 15计算:4时15分时针与分针的夹角.