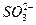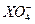还原产物怎么会有还原性?氧化产物怎么会有氧化性?我现在都高二了,还没明白.
 handsome6562022-10-04 11:39:541条回答
handsome6562022-10-04 11:39:541条回答比如那个什么单质的氧化还原的强弱与离子的氧化还原强弱是相反的,这句话一直困扰着我,我不知道这句话说的是哪个相反.解释的具体我会给高分的,因为老师说这个很重要.

已提交,审核后显示!提交回复
共1条回复
 蓝色宁静 共回答了24个问题
蓝色宁静 共回答了24个问题 |采纳率91.7%- 我们一个个问题来解决吧
1.还原产物怎么会有还原性?氧化产物怎么会有氧化性?
举个例子看看,比如这三个反应
C + 2 CuO == CO2↑ + 2 Cu(还原法制铜)①
Cu + 2 AgNO3== 2 Ag + Cu(NO3)2 ②
C + CO2 == 2 CO ③
在①中,还原产物是Cu,氧化产物是CO2
从②,我们可以看出,①的还原产物Cu可以在其他反应中作还原剂,表现出还原性
从③,我们可以看出,①的氧化产物CO2可以在其他反应中作氧化剂,表现出氧化性
所以,问题可以用以上实例回答
要从这个例子中挖出普遍规律的话,大致如下:
在反应中,某物质被还原,生成还原产物,那么这种物质中就有一种元素从高价态降为低价态.
因为还原产物中的该种元素是低价态的,还能升价(被氧化),所以还原产物表现出还原性
2.单质的氧化还原的强弱与离子的氧化还原强弱是相反的?
我拿常见点的铁银铜来说
单质还原性:Fe>Cu>Ag
阳离子氧化性:Ag+>Cu2+>Fe2+
可以看到正好是相反的顺序,这就是困扰你的那句话的意思
其实可以这么分析
单质的还原性越强,它就越容易失去电子,变成阳离子.我们知道,物质倾向于以更稳定的形式存在:单质在某条件下容易变成阳离子,说明在该条件下,阳离子比较稳定.
所以越容易变成阳离子的单质,它形成的阳离子就越“稳定”,这种“稳定”,表现为不容易得电子.
所以因果关系是这样的:
单质的还原性越强 → 单质越容易失电子变成阳离子 → 形成的阳离子越“稳定” → 这种阳离子越难得电子 → 这种阳离子的氧化性越弱
希望能帮你解决疑问 - 1年前
相关推荐
- 用0.1 mol·L -1 的Na 2 SO 3 溶液30 mL恰好将2×10 -3 mol的 还原,则元素X在还原产物
用0.1 mol·L -1 的Na 2 SO 3 溶液30 mL恰好将2×10 -3 mol的
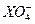 还原,则元素X在还原产物中的化合价是()
还原,则元素X在还原产物中的化合价是()A.+1 B.+2 C.+3 D.+4  起个名字真费尽1年前1
起个名字真费尽1年前1 -
 w5sf3j 共回答了17个问题
w5sf3j 共回答了17个问题 |采纳率88.2%1年前查看全部
- 为什么反应式中的物质应符合“氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物?
 zhang7233181年前1
zhang7233181年前1 -
 忙里偷闲 共回答了26个问题
忙里偷闲 共回答了26个问题 |采纳率84.6%这是由于热力学第二定律,也就是氧化剂+还原剂=还原产物+氧化产物时,Ea>0
而还原产物+氧化产物=氧化剂+还原剂时,Ea1年前查看全部
- 还原性:Fe2+>I->Cl- 不是还原剂的还原性强于还原产物的还原性么
 lysander0101年前1
lysander0101年前1 -
 骄傲佩佩 共回答了17个问题
骄傲佩佩 共回答了17个问题 |采纳率76.5%错误
反应方程式
2Fe(3+)+2I(-)=2Fe(2+)+I2
这里还原剂是I-,还原产物是Fe2+
所以还原性是I->Fe2+1年前查看全部
- 下列反应中,so2是还原产物的是
下列反应中,so2是还原产物的是
A.2h2so4(浓)+cu=cuso4+so2+2h20
B.Na2SO3+h2so4=na2so4+so2+h2o BT_Arima1年前4
BT_Arima1年前4 -
 xiongwenxian 共回答了12个问题
xiongwenxian 共回答了12个问题 |采纳率91.7%A 有化合价升降发生氧化还原反应 B只是复分解反应1年前查看全部
- 用0.1mol/L的Na2SO3溶液300mL,恰好将2×10-2mol的XO4-离子还原,则元素X在还原产物中的化合价
用0.1mol/L的Na2SO3溶液300mL,恰好将2×10-2mol的XO4-离子还原,则元素X在还原产物中的化合价是( )
A.+1
B.+2
C.+3
D.+4 zhangqinglu1年前1
zhangqinglu1年前1 -
 einqyv 共回答了21个问题
einqyv 共回答了21个问题 |采纳率85.7%解题思路:根据氧化还原反应中得失电子守恒计算.该反应中Na2SO3为还原剂,SO32-中的S被氧化,变为SO42-,化合价从+4升到+6价,失电子数=0.1mol/L×0.3L×2=0.06mol,
XO4-为氧化剂,其中X元素化合价降低,开始为+7价,得失电子守恒,得电子数[0.06/0.02]=3,可见X元素化合价变化为3,即从+7价降到+4价.
故选:D.点评:
本题考点: 根据化学式判断化合价;氧化还原反应的计算.
考点点评: 本题考查学生氧化还原反应中的电子守恒思想的应用知识,可以根据所学知识进行回答,难度不大.1年前查看全部
- 现有30mol0.1mol/L的Na2SO3溶液,恰好将0.002mol的[XO4]-离子还原,则X在还原产物中的化合价
现有30mol0.1mol/L的Na2SO3溶液,恰好将0.002mol的[XO4]-离子还原,则X在还原产物中的化合价是?
A.+1
B.+2
C.+3
D.+4 hfdion1年前1
hfdion1年前1 -
 cui977988966 共回答了23个问题
cui977988966 共回答了23个问题 |采纳率95.7%可以根据得失电子守恒来做这道题.
在[XO4]-中X是+7价,它要被还原,设还原后的化合价为a
Na2SO3要被氧化,氧化后S由+4价肯定要变到+6价,也就是说一个要失去2个电子.
那么一共要失去0.03*0.1*2个电子.
有0.002mol的[XO4]-得电子.
那么可以列方程:
0.002(7-x)=0.03*0.1*2
解得:x=4
所以是+4价1年前查看全部
- 一道高中化学题当溶液中X2O4(-2价)和SO3(-2价)的离子数之比为1:3时,正好完全发生氧化还原反应,X在还原产物
一道高中化学题
当溶液中X2O4(-2价)和SO3(-2价)的离子数之比为1:3时,正好完全发生氧化还原反应,X在还原产物中的化合价为? 小强的兄弟1年前4
小强的兄弟1年前4 -
 supermalone 共回答了23个问题
supermalone 共回答了23个问题 |采纳率95.7%可以有两种解法:
第一种:计算出X2O4(-2价)中X显+3价,设其在反应后变为A;SO3(-2价)中S显+4价,反应后变为+6价,列得失电子守恒方程,
(A-3)*2=(6-4)*3
A=6
X在还原产物中的化合价为+6价.
第二种:由X2O4(-2价)的形式想到硫代硫酸根S2O4(-2价).可知X2O4(-2价)中的X一个显+6价,一个显0价.同上列得失电子守恒方程,
(A-0)*1+(6-6)*1=(6-4)*3
解得:A=6
X在还原产物中的化合价为+6价.1年前查看全部
- 用SO2将XO4-离子还原,SO2被氧化成SO42-,SO2与XO4-物质的量之比为5∶2,则元素X在还原产物中的化合价
用SO2将XO4-离子还原,SO2被氧化成SO42-,SO2与XO4-物质的量之比为5∶2,则元素X在还原产物中的化合价
A.+1 B.+2 C.+3 D.+4
 商品831年前1
商品831年前1 -
 wjh528 共回答了20个问题
wjh528 共回答了20个问题 |采纳率85%选c1年前查看全部
- 为什么还原产物不是Mn2+而是MnO2
 cfghost1年前1
cfghost1年前1 -
 c1x2p3 共回答了17个问题
c1x2p3 共回答了17个问题 |采纳率76.5%二氧化碳的碳不是正二价是正四价1年前查看全部
- .3Cl2+6FeSO42Fe2(SO4)3+2FeCl3中2FeCl3是不是还原产物?
 妖月银狼1年前0
妖月银狼1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 已知:在同一个反应中,氧化剂的氧化性强于氧化产物的氧化性,还原剂的还原性强于还原产物的还原性.在一定条件下KClO3与I
已知:在同一个反应中,氧化剂的氧化性强于氧化产物的氧化性,还原剂的还原性强于还原产物的还原性.在一定条件下KClO3与I2按下式反应:2KClO3+I2═2KIO3+Cl2,下列判断正确的是( )
A.该反应属于置换反应
B.氧化性:I2>KClO3
C.还原性:KClO3>I2
D.还原剂为KClO3,氧化剂为I2 匿名来宾1年前1
匿名来宾1年前1 -
 星星无雨 共回答了14个问题
星星无雨 共回答了14个问题 |采纳率92.9%解题思路:2KClO3+I2═2KIO3+Cl2中,Cl元素的化合价降低,I元素的化合价升高,结合氧化还原反应基本概念和规律来解答.A.该反应为单质与化合物反应生成新单质、新化合物,则属于置换反应,故A正确;
B.由Cl元素的化合价降低可知,KClO3为氧化剂,则氧化性为KClO3>I2,故B错误;
C.由I元素的化合价升高可知,I2为还原剂,则还原性为I2>KClO3,故C错误;
D.Cl元素的化合价降低,I元素的化合价升高,则氧化剂为KClO3,还原剂为I2,故D错误;
故选A.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及反应类型判断的考查,注意氧化性、还原性比较,题目难度不大.1年前查看全部
- 氧化还原反应是否都满足氧化剂的氧化性强于氧化产物的氧化性,还原剂的还原性强于还原产物的还原性?
氧化还原反应是否都满足氧化剂的氧化性强于氧化产物的氧化性,还原剂的还原性强于还原产物的还原性?
如果是,那歧化反应呢,氯气和水反应 chh1ong1年前3
chh1ong1年前3 -
 huaou 共回答了16个问题
huaou 共回答了16个问题 |采纳率87.5%一定,可理解为作氧化剂的氯气氧化性强于生成的次氯酸,另一问类推.你的困惑可能是把一些氯气当成氧化剂一些氯气当作氧化产物了.1年前查看全部
- 用0.1摩/升的Na 2 SO 3 溶液30毫升,恰好将2×10 -3 摩XO 4 - 离子还原,则元素X在还原产物中的
用0.1摩/升的Na 2 SO 3 溶液30毫升,恰好将2×10 -3 摩XO 4 - 离子还原,则元素X在还原产物中的化合价是 [ ]
A.+1
B.+2
C.+3
D.+4 Emily0104261年前1
Emily0104261年前1 -
 酸奶卡拉 共回答了21个问题
酸奶卡拉 共回答了21个问题 |采纳率95.2%D1年前查看全部
- 12.已知:在同一反应中,氧化剂的氧化性强于氧化产物的氧化性,还原剂的还原性强于还原产物的还原性.在一定条件下KClO3
12.已知:在同一反应中,氧化剂的氧化性强于氧化产物的氧化性,还原剂的还原性强于还原产物的还原性.在一定条件下KClO3与I2按下式反应:2KClO3+ I2 ===2KIO3+ Cl2,下列判断正确的是
A.该反应属于置换反应
B.还原剂为KClO3,氧化剂为I2
C.还原性:I2>KIO3
D.氧化性:KClO3>KIO3 biaoi1年前4
biaoi1年前4 -
 依旧飘流2007 共回答了16个问题
依旧飘流2007 共回答了16个问题 |采纳率93.8%2KClO3+ I2 ===2KIO3+ Cl2,单质和化合物反应生成另一种单质和化合物,为置换反应.
其中KClO3中Cl化合价降低,得电子,为氧化剂.I2中I化合价升高失电子,为还原剂.
CL2为还原产物,KIO3为氧化产物.
因为在同一反应中,氧化剂的氧化性强于氧化产物的氧化性,还原剂的还原性强于还原产物的还原性.
所以还原性:I2>CL2,氧化性:KClO3>KIO3
综上选AD1年前查看全部
- 用0.2mol/L的Na2SO3溶液60mL,恰好将4×10-3mol XO4-还原,则元素X在还原产物中的化
用0.2mol/L的Na2SO3溶液60mL,恰好将4×10-3mol XO4-还原,则元素X在还原产物中的化合价是( )
A.+4
B.+3
C.+2
D.+1 曲子哥1年前1
曲子哥1年前1 -
 ps3boy 共回答了20个问题
ps3boy 共回答了20个问题 |采纳率100%解题思路:根据氧化还原反应中得失电子守恒:化合价升高值=化合价降低值来计算.该反应中Na2SO3为还原剂,SO32-中的S被氧化,变为SO42-,化合价从+4升到+6价,失电子数=0.2mol/L×0.06L×2=0.024mol,
XO4-为氧化剂,其中X元素化合价降低,开始为+7价,得失电子守恒,设元素X在还原产物中的化合价是x,
则4×10-3mol (7-x)=0.024mol,解得x=1,即元素X在还原产物中的化合价是+1价,
故选:D.点评:
本题考点: 氧化还原反应的计算.
考点点评: 本题考查学生氧化还原反应中的电子守恒思想的应用知识,可以根据所学知识进行回答,难度不大.1年前查看全部
- 氧化产物~还原产物的氧化性那个大 还原性呢
 赛恩迪斯特1年前3
赛恩迪斯特1年前3 -
 昨夜大雪 共回答了26个问题
昨夜大雪 共回答了26个问题 |采纳率92.3%这个不好说 必须具体问题具体分析
比如 Cl2+H2O====HCl+HClO 中HCl是还原产物,HClO是氧化产物,HClO明显有强氧化性,所以氧化性HClO也就是氧化产物强,还原性HCl强
又如H2S+H2SO4==加热==S↓+2H2O+SO2↑ 中S是氧化产物,SO2是还原产物,S单质的氧化性是弱于SO2的,所以氧化性SO2,也就是还原产物强.
还有比如变价的化合反应,最简单的,2H2+O2==点燃==2H2O,H2O即使氧化产物又是还原产物,所以这时候氧化性一样,还原性也就一样喽~
还是那句话,具体问题具体分析,多联系一下实际,氧化性和还原性很容易就比较出来了
这都是我一笔一笔打的,lz感觉我的回答好就选我吧,1年前查看全部
- “按照还原性从强到弱.应该是:还原剂>氧化产物>还原产物>氧化剂”怎么推导 主要是氧化产物>还原产物、
 顶级发艺1年前2
顶级发艺1年前2 -
 厕所里的大象 共回答了22个问题
厕所里的大象 共回答了22个问题 |采纳率95.5%氧化剂被还原得到还原产物,还原剂被氧化得到氧化产物,也就是说,氧化产物的原型是还原剂,还原产物的原型是氧化剂,还原剂是不可能把氧化剂还原的比自己还原性还强的,从氧化剂的方面也同理.不知道我这么说你明不明白……1年前查看全部
- 还原产物能否被还原剂还原?还原剂的还原性大于还原产物,那为什么还原产物不能被还原剂还原?比如:Fe+3与Cu反应生成的亚
还原产物能否被还原剂还原?
还原剂的还原性大于还原产物,那为什么还原产物不能被还原剂还原?
比如:Fe+3与Cu反应生成的亚铁离子不会被Cu还原呢?
如果加过量Cu,是不是还是不能还原? 06180331年前4
06180331年前4 -
 huangrui5186 共回答了12个问题
huangrui5186 共回答了12个问题 |采纳率100%因为还原产物的还原化性大于于还原剂的还原性.所以还原剂不能还原还原产物.
就像Fe+3与Cu反应生成的还原产物是Fe+2同时生成Cu+2.
若Cu还能继续还原Fe+2则会生成Fe而,你应该知道Fe会与二价Cu+2反应生成Cu和Fe+2.这时你就会发现,这个假设是不成立的.
所以加再多铜单质也不会吧二价铁离子还原1年前查看全部
- 当溶液中X2O7(2-)和SO3(2-)离子数之比为1:3时正好完全发生氧化还原反应,X在还原产物中的化合价为_____
当溶液中X2O7(2-)和SO3(2-)离子数之比为1:3时正好完全发生氧化还原反应,X在还原产物中的化合价为________
为什么SO3 2-要变成SO4 2- **复民1年前3
**复民1年前3 -
 永远圣诞节 共回答了17个问题
永远圣诞节 共回答了17个问题 |采纳率94.1%+3
S只有-2,-1,0,+2,+4,+6
SO3 2-只能氧化为SO4 21年前查看全部
大家在问
- 1某静电除尘器工作时内部电场线分布的俯视如图所示,带负电粉尘被吸附时由b点运动到a点,以下说法正确的是( )
- 2鸟的天堂加双引号和不加双引号是什么意思
- 3阅读思考并回答问题A student named Tom is trying to save money from hi
- 4配制50g质量分数为1%的氯化钠溶液,需质量分数为5%的氯化钠溶液和水各多少克,
- 51.一束光强为I0的自然光,相继通过三个偏振片P1、P2、P3后,出射光的光强为I=I0 / 8.若以入射光线为轴,旋转
- 6求翻译do you basically like yourself?
- 7优+全能大考卷四年级下第一单元测评卷
- 8treat others as you would like to be treated 翻译
- 9填空题;将一个正方体的凌长扩大到原来的3倍,它的表面积扩大到原来的【 】倍.
- 10校园里种的杨树棵数比松树少6分之1,杨树棵树又比梧桐树棵数多9分之1,松树有48棵 ,梧桐树有多少棵?
- 11一个自然数只有两个因数,它一定是质数.______.
- 12读完粗心的木工回答:木匠虽然很努力,最终却一事无成,这是什么原因?
- 13is,in,John,the,music连成一句话
- 14(1/2)请教:贾母笑道:”你不认得他.他是我们这里有名的一个泼皮破落户儿,南省俗谓作辣子,你只叫他...
- 15设直线l的方程为(m^2-2m-3)x-(2m^2+m-1)y=2m-6根据下列条件分别确定实数m的值