two序数次 knife复数 child复数 I宾格
 小小蜘蛛2022-10-04 11:39:544条回答
小小蜘蛛2022-10-04 11:39:544条回答
已提交,审核后显示!提交回复
共4条回复
 昭非 共回答了1个问题
昭非 共回答了1个问题 |采纳率100%- second knives children me
- 1年前
 请勿吸烟红河 共回答了22个问题
请勿吸烟红河 共回答了22个问题 |采纳率40.9%- second knives children
- 1年前
 jeankong 共回答了4个问题
jeankong 共回答了4个问题 |采纳率50%- second knifes children me
- 1年前
 骑单车的小胖猪 共回答了4个问题
骑单车的小胖猪 共回答了4个问题 |采纳率25%- second knifes children me
- 1年前
相关推荐
- 最高正价与最高化合价的关系,与主族序数与什么关系?
 OK0881年前1
OK0881年前1 -
 whx0512 共回答了15个问题
whx0512 共回答了15个问题 |采纳率93.3%主族元素的最高化合价就是最高正价.
主族最高正价=主族元素的最外层电子=价电子数=主族序数
例如:硫元素,最高正价是+6,该元素原子的最外层电子为6,价电子数为6,主族序数为6,即第VIA族.
希望我的回答能对你的学习有帮助!1年前查看全部
- (8分)现有A、B、C、D、E五种元素,都是短周期元素,其中A、B、C原子序数依次递增并都相差1。B的阳离子的电子层结构
(8分)现有A、B、C、D、E五种元素,都是短周期元素,其中A、B、C原子序数依次递增并都相差1。B的阳离子的电子层结构与Ne原子相同,2gB的氧化物与100ml 0.5mol/L的
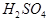 恰好完全反应。B单质与D单质反应后可形成离子化合物
恰好完全反应。B单质与D单质反应后可形成离子化合物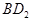 ;B单质与E单质可形成化合物BE。D的阴离子比B的阳离子多一个电子层,而E阴离子与B的阳离子电子层结构相同。
;B单质与E单质可形成化合物BE。D的阴离子比B的阳离子多一个电子层,而E阴离子与B的阳离子电子层结构相同。
(1)五种元素的名称是B________;D ;E________.
(2) 形成化合物 的化学键类型是: .
的化学键类型是: .
(3)用电子式表示化合物BD 2 的形成过程。 .
(4) A的氢氧化物的水溶液和C单质发生反应的离子方程式: . snsn261年前1
snsn261年前1 -
 害虫头头 共回答了17个问题
害虫头头 共回答了17个问题 |采纳率88.2%(1) B_镁;D氯;E 氧。 (每空1分)
(2)离子键、(极性)共价键。(1分,只填一种键不给分)
(3) (2分)
(2分)
(4)2OH - +2Al +2H 2 O=2AlO 2 - +3 H 2 ↑。(2分)
根据B单质与D单质反应后可形成离子化合物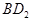 ,说明B是第ⅡA,D是第 Ⅶ A 。2gB的氧化物与100ml 0.5mol/L的
,说明B是第ⅡA,D是第 Ⅶ A 。2gB的氧化物与100ml 0.5mol/L的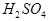 恰好完全反应,所以B的氧化物的相对分子质量是40,因此B是镁,则A是Na,C是Al,D是Cl,E是O。
恰好完全反应,所以B的氧化物的相对分子质量是40,因此B是镁,则A是Na,C是Al,D是Cl,E是O。
(2)过氧化钠中含有离子键和非极性键。
(3)氯化镁是离子化合物,其形成过程为 。
。
(4)铝和氢氧化钠反应的方程式为2OH - +2Al +2H 2 O=2AlO 2 - +3 H 2 ↑。1年前查看全部
- 元素周期表中,周期序数由什么决定?主族族序数由什么决定?
 龙虾城下1年前1
龙虾城下1年前1 -
 素面足矣 共回答了19个问题
素面足矣 共回答了19个问题 |采纳率100%根据量子力学,周期对应着元素原子的电子排布,显示出该原子的已装填电子层数目;主族族序数是由最外层电子的数目决定的,相同的价电子数会有类似的化学性质1年前查看全部
- (14分)有5 种短周期元素的原子序数按E、D、B、A、C的顺序依次增大;A、C同周期,B、C同主族;A与B可形成离子化
(14分)有5 种短周期元素的原子序数按E、D、B、A、C的顺序依次增大;A、C同周期,B、C同主族;A与B可形成离子化合物A 2 B,A 2 B中所有粒子的电子数相同,且电子总数为30;D和E可形成4核10电子的分子。试回答下列问题:
(1)写出五种元素的名称:A B C D 。
(2)用电子式表示离子化合物A 2 B的形成过程:
(3)写出下列物质的电子式:
D元素形成的单质 ;B与E形成的化合物 ;
A、B、E形成的化合物 ;D、E形成的化合物 。 enjoyit1年前0
enjoyit1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 与元素有关的化学题A B C D 四种元素,A元素所处的周期数,主族序数.原子序数均相等,B的原子半径是其所在主族中最小
与元素有关的化学题
A B C D 四种元素,A元素所处的周期数,主族序数.原子序数均相等,B的原子半径是其所在主族中最小的,B的最高价氧化物的水化物的化学式是HB03,C 元素原子的最外层电子数比此外层少2个,D的阳离子与C的阴离子具有相同的电子层排布,两元素可形成化合物D2C (1)B元素的名称是?(2)A B 形成的化合物的化学式为?B元素在元素周期表中的位置是?(3) C 元素的符号是?C 的最高价氧化物的化学式是? Google测试员52431年前2
Google测试员52431年前2 -
 青山流云 共回答了23个问题
青山流云 共回答了23个问题 |采纳率95.7%(1)氮 (2)NH3 第二周期第ⅥA族 (3)S H2SO4 补充:上面写错了 (3) S SO31年前查看全部
- 已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电
已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D是地壳中含量最多的金属元素.下列说法正确的是( )
A.1 mol 由元素A、B组成的化合物一定含有18 mol e-
B.元素D的最高价氧化物对应的水化物可以溶于过量的氨水中
C.含D的盐溶液既可能显酸性,也可能显碱性
D.化合物AE与DE含有不同类型的化学键 NEW2121年前1
NEW2121年前1 -
 hwayik 共回答了19个问题
hwayik 共回答了19个问题 |采纳率100%解题思路:A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,元素C在同周期的主族元素中原子半径最大,则C为Na元素;元素D是地壳中含量最多的金属元素,则D为Al元素;元素B的原子最外层电子数是其电子层数的2倍,B有2个电子层,最外层电子数为4,故B为C元素;其中元素A、E的单质在常温下呈气态,A的原子序数小于碳元素,A为H元素,E的原子序数等于铝元素,E为Cl元素.A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,元素C在同周期的主族元素中原子半径最大,则C为Na元素;元素D是地壳中含量最多的金属元素,则D为Al元素;元素B的原子最外层电子数是其电子层数的2倍,B有2个电子层,最外层电子数为4,故B为C元素;其中元素A、E的单质在常温下呈气态,A的原子序数小于碳元素,A为H元素,E的原子序数等于铝元素,E为Cl元素.
A、元素C、H组成的化合物属于烃,1mol烃中含有的电子数不一定是18mole-,如1mol甲烷含有10mol电子等,故A错误;
B、D为Al元素,氢氧化铝溶于强碱,不溶于弱碱,不能溶于氨水,故B错误;
C、D为Al元素,硫酸铝溶液呈酸性,偏铝酸钠溶液呈碱性,故C正确;
D、化合物AE是HCl,属于共价化合物,含有共价键;DE形成化合物是AlCl3,属于共价化合物物,含有共价键,二者含有的化学键类型相同,故D错误.
故选:C.点评:
本题考点: 原子结构与元素的性质.
考点点评: 考查元素推断、物质结构、元素化合物性质等,难度不大,推断元素是解题的关键.1年前查看全部
- [化学选修3:物质结构与性质]Q、R、X、Y、Z为周期表前四周期元素,原子序数依次递增.已知:①Q为元素周期表中原子半径
[化学选修3:物质结构与性质]
Q、R、X、Y、Z为周期表前四周期元素,原子序数依次递增.已知:
①Q为元素周期表中原子半径最小的元素;
②R的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;
③Y的基态原子的核外成对电子数是未成对电子数的3倍;
④Q、R、Y三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,Q、R两种元素组成的原子个数比为1:1的化合物N是中学化学中常见的有机溶剂;
⑤Z有“生物金属”之称,Z 4+ 离子和氩原子的核外电子排布相同.
请回答下列问题(答题时,Q、R、X、Y、Z用所对应的元素符号表示)
(1)化合物M的空间构型为______,其中心原子采取______杂化;化合物N在固态时的晶体类型为______.
(2)R、X、Y三种元素的第一电离能由小到大的顺序为______;
(3)由上述一种或多种元素组成的与RY 2 互为等电子体的分子为______(写分子式)
(4)由R、X、Y三种元素组成的RXY - 离子在酸性条件下可与NaClO溶液反应,生成X 2 、RY 2 等物质.该反应的离子方程式为______.
(5)Z原子基态时的外围电子排布式为______;Z的一种含氧酸钡盐的晶胞结构如图所示,晶体内与每个Z原子等距离且最近的氧原子数为______.
 nana76181年前1
nana76181年前1 -
 我爱过过 共回答了18个问题
我爱过过 共回答了18个问题 |采纳率94.4%由信息可知,Q为氢元素,R为碳元素,X为N元素,Y为氧元素,Z为钛元素,M为甲醛,N为苯;
(1)化合物M为甲醛,碳原子的孤电子对数为0,碳原子的σ键数为3,则碳原子采取sp 2 杂化,空间结构为平面三角形,化合物N为苯,是由碳、氢元素组成的化合物,苯是由苯分子直接构成的,则N在固态时的晶体类型为分子晶体,故答案为:平面三角形;sp 2 ;分子晶体;
(2)R、X、Y三种元素的分别为C、N、O,非金属性越强则元素的第一电离能越大,但N原子的电子排布中P轨道半满,则失去1个电子更难,即三种元素中N元素的第一电离能最大,
故答案为:C<O<N;
(3)RY 2 为CO 2 ,分子中有3个原子,价电子数为4+6×2=16,N 2 O的分子中有3个原子,价电子数为5×2+6=16,则CO 2 与N 2 O互为等电子体,故答案为:N 2 O;
(4)由RXY - 离子在酸性条件下可与NaClO溶液反应,生成X 2 、RY 2 等物质,由反应物与生成物,利用元素守恒、电荷守恒,则离子方程式为2CNO - +2H + +3ClO - ═N 2 ↑+2CO 2 ↑+3C1 - +H 2 O,
故答案为:2CNO - +2H + +3ClO - ═N 2 ↑+2CO 2 ↑+3C1 - +H 2 O;
(5)因Z 4+ 离子和氩原子的核外电子排布相同,则Z的原子序数为22,即Z为钛元素,其电子基态电子排布为1S 2 2S 2 2P 6 3S 2 3P 6 3d 2 4s 2 ,电子最后填充3d电子,则外围电子排布为
3d 2 4s 2 ,由晶体结构图可知,晶体内与每个Z原子等距离且最近的氧原子在棱的位置,则氧原子数为
1×3×8
4 =6,故答案为:3d 2 4s 2 ;6.1年前查看全部
- (2012•河南一模)在周期表主族元素中,甲元素与乙、丙、丁三元素紧密相邻.甲、乙的原子序数之和等于丙的原子序数;这四种
(2012•河南一模)在周期表主族元素中,甲元素与乙、丙、丁三元素紧密相邻.甲、乙的原子序数之和等于丙的原子序数;这四种元素原子的最外层电子数之和为20.下列判断正确的是( )
A.原子半径:丙>乙>甲>丁
B.乙和甲或乙和丁所能形成的化合物都是大气污染物
C.气态氢化物的稳定性:甲>丙
D.最高价氧化物对应水化物的酸性:丁>甲 wangxiaoya1234561年前1
wangxiaoya1234561年前1 -
 ckcy2002 共回答了21个问题
ckcy2002 共回答了21个问题 |采纳率90.5%解题思路:甲、乙两元素的原子序数之和等于丙元素的原子序数.若甲、丙同周期,其原子序数之差为1,乙只能是氢元素,由甲与乙、丙、丁在元素周期表中的位置关系可知,乙为氢元素不符合四元素原子最外层电子数之和为20.所以甲、丙必同主族,故原子序之差为2或8,四种元素不可能为氢和氦,则排除原子序数之差为2,甲、丙原子序之差为8,乙元素原子序数应为8,故乙为氧元素,则甲为氮元素,丙为磷元素,丁为碳元素,据此解答.甲、乙两元素的原子序数之和等于丙元素的原子序数.若甲、丙同周期,其原子序数之差为1,乙只能是氢元素,由甲与乙、丙、丁在元素周期表中的位置关系可知,乙为氢元素不符合四元素原子最外层电子数之和为20.所以甲、丙必同主族,故原子序之差为2或8,四种元素不可能为氢和氦,则排除原子序数之差为2,甲、丙原子序之差为8,乙元素原子序数应为8,故乙为氧元素,则甲为氮元素,丙为磷元素,丁为碳元素,
A.原子半径P>C>N>O,即丙>丁>甲>乙,故A错误;
B.乙和丁所能形成的化合物中二氧化碳不是大气污染物,故B错误;
C.非金属性N>P,则气态氢化物的稳定性比较:NH3>PH3,故C正确;
C.非金属性N>C,则最高价氧化物对应水化物的酸性比较是:硝酸>碳酸,故D错误;
故选C.点评:
本题考点: 原子结构与元素周期律的关系.
考点点评: 本题考查结构性质位置关系应用,难度较大,推断元素是解题关键,对于短周期及主族元素应非常清楚,关键是确定甲、乙、丙、丁四种元素,突破口为甲、乙两元素的原子序数之和等于丙元素的原子序数.1年前查看全部
- 2013央视3.15晚会曝光黄金行业乱象,所谓的千足金,很多都没达标,而是添加了另一种元素,叫做“铱”.铱的原子序数为7
2013央视3.15晚会曝光黄金行业乱象,所谓的千足金,很多都没达标,而是添加了另一种元素,叫做“铱”.铱的原子序数为77,相对原子质量为192.铱在化学元素周期表当中与黄金紧挨着,它的密度与黄金非常地相似.有的厂家就把这个铱掺杂到黄金当中,做成首饰来卖给消费者,周大生等品牌均涉及.下列说法不正确的是( )
A.铱的核电荷数为77
B.铱的中子数为115
C.铱是非金属元素
D.该“黄金”是混合物 lzzyxxk1年前1
lzzyxxk1年前1 -
 aothony 共回答了28个问题
aothony 共回答了28个问题 |采纳率85.7%解题思路:A、根据核电荷数=原子序数分析
B、根据相对原子质量=质子数+中子数分析
C、根据汉字偏旁部首分析元素的种类
D、根据混合物的定义分析A、原子序数等于核电荷数,原子序数为77,故核电荷数也为77,说法正确;
B、相对原子质量=质子数+中子数,故中子数=192-77=115,说法正确;
C、铱是金字旁,属于金属元素,C说法错误;
D、该“黄金”中含有金和铱两种物质,是混合物,说法正确;
故选C点评:
本题考点: 元素周期表的特点及其应用.
考点点评: 解答本题关键是要了解对于原子来说核内质子数等于核外电子数等于原子序数,相对原子质量=质子数+中子数.1年前查看全部
- 一道关于元素周期表的高一化学题8.下列各组元素的原子随着原子序数的递增,有关递变关系不正确的是( )A.原子半径:Si
一道关于元素周期表的高一化学题
8.下列各组元素的原子随着原子序数的递增,有关递变关系不正确的是( )
A.原子半径:Si > P > S > Cl B.最高正价:C < N < O
为什么啊 不是最高正价在同一周期从左往右增加么 kailan1年前3
kailan1年前3 -
 2006东南亚3 共回答了12个问题
2006东南亚3 共回答了12个问题 |采纳率91.7%氧和氟元素特别特殊,
氧一般都是-2价和0价.只有和氟化合才有+2价
氟由于太活泼,绝大部分都显-1价,只有氟气为0价 一般没有正价
而C元素有+4价,N元素有+5价
B答案正确1年前查看全部
- 短周期元素X、Y、Z和W的原子序数依次递增,且均为同周期,四元素原子的最外层电子数之和为18,X和Y的原子序数比为6:7
短周期元素X、Y、Z和W的原子序数依次递增,且均为同周期,四元素原子的最外层电子数之和为18,X和Y的原子序数比为6:7,X的最高正价是W的最低负价绝对值的2倍.下列说法不正确的是( )
A.Y的单质可能为原子晶体
B.X和W可组成离子化合物
C.Z和W的单质发生化学反应可生成两种共价化合物
D.Z和W的最高价氧化物对应的水化物都是强酸 可乐ss1年前1
可乐ss1年前1 -
 honlang197 共回答了20个问题
honlang197 共回答了20个问题 |采纳率85%解题思路:短周期元素X、Y、Z和W的原子序数依次递增,且在同一周期,X和Y元素原子的原子序数比为6:7,如果X的原子序数为6,则Y的原子序数为7,则X、Y、Z和W的最外层电子数只能为4、5、6、7,四种元素原子的最外层电子数之和为22,而且X的最高正价是W的最低负价的绝对值的4倍,不符合题意;
如果X的原子序数为12,X和Y元素原子的原子序数比为6:7,Y的原子序数应为14,由于X的最高正价是W的最低负价的绝对值的2倍,则W的原子序数为17,四种元素原子的最外层电子数之和为18,则Z原子最外层电子数为18-2-7-4=5,Z只能是15号元素,所以X、Y、Z和W以此为Mg、Si、P、Cl元素,根据元素所在周期表的位置结合元素周期律的递变规律推断元素、单质及化合物所具有的性质.短周期元素X、Y、Z和W的原子序数依次递增,且在同一周期,X和Y元素原子的原子序数比为6:7,如果X的原子序数为6,则Y的原子序数为7,则X、Y、Z和W的最外层电子数只能为4、5、6、7,四种元素原子的最外层电子数之和为22,而且X的最高正价是W的最低负价的绝对值的4倍,不符合题意;
如果X的原子序数为12,X和Y元素原子的原子序数比为6:7,Y的原子序数应为14,由于X的最高正价是W的最低负价的绝对值的2倍,则W的原子序数为17,四种元素原子的最外层电子数之和为18,则Z原子最外层电子数为18-2-7-4=5,Z只能是15号元素,所以X、Y、Z和W以此为Mg、Si、P、Cl元素,
A.Y为Si元素,其单质晶体硅属于原子晶体,故A正确;
B.氯化镁由镁离子与氯离子构成,属于离子化合物,故B正确;
C.磷与氯气反应可以生成三氯化磷、五氯化磷,故C正确;
D.高氯酸属于强酸,磷酸属于中强酸,故D错误,
故选D.点评:
本题考点: 原子结构与元素的性质.
考点点评: 本题考查原子结构和元素周期律的关系,题目难度较大,正确推断元素的种类为解答该题的关键.1年前查看全部
- A、B、C、D、E是元素周期表中的短周期主族元素,且原子序数依次增大.已知A与B不在同周期,A与C同主族B原子最外层电子
A、B、C、D、E是元素周期表中的短周期主族元素,且原子序数依次增大.已知A与B不在同周期,A与C同主族B原子最外层电子数是其电子层数的两倍,A、C、E原子最外层电子数之和为6D的氧化物具有两性,下列说法正确的是()
A.A、B只能形成一种化合物.B.离子半径:CE.DD.元素C、D的最高价氧化物对应水化物之间不能发生反应. fgmgupiao1年前2
fgmgupiao1年前2 -
 maggie_1983 共回答了20个问题
maggie_1983 共回答了20个问题 |采纳率95%A:氢
B:碳
C:钠
D:铝
E:硅
所以正确答案是C1年前查看全部
- (19分)有关元素X、Y、Z、W的信息如下 元素 有关信息 X 所在主族序数与所在周期序数之差为4 Y 最高价氧化物对应
(19分)
有关元素X、Y、Z、W的信息如下请回答下列问题:元素 有关信息 X 所在主族序数与所在周期序数之差为4 Y 最高价氧化物对应的水化物,能电离出电子数相等的阴、阳离子 Z 单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏 W 地壳中含量最高的金属元素
(1)W的单质与Y的最高价氧化物对应的水化物反应的离子方程式为 。
铜片、碳棒和ZX 3 溶液组成原电池,写出正极发生的电极反应方程式
_______________________________________________。
(2)向淀粉碘化钾溶液中滴加几滴ZX 3 的浓溶液,现象为_____________________,相关反应的离子方程式为_______________________________。
(3)以上述所得WX 3 溶液为原料制取无水WX 3 ,先制得WX 3 ·6H 2 O晶体,主要操作包括__________________________,在_____________________条件下加热WX 3 ·6H 2 O晶体,能进(4)一步制取无水WX 3 ,其原因是(结合离子方程式简要说明)_______________________________。 4759409511年前0
4759409511年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 有A、B、C 、D、E、F、G 六种前四周期元素,原子序数依次增大,其相关信息如下表: 请回答下列问题:
有A、B、C 、D、E、F、G 六种前四周期元素,原子序数依次增大,其相关信息如下表: 
请回答下列问题:
(1)A、B两种元素组成的一种化合物甲是重要的化工原料,常把它的产量作为衡量石油化工发展水平的标志,则甲分子中σ键和π键的个数比为 ,其中B原子采取 杂化。
(2)B、C、D三种元素的电负性由大到小的顺序为 (用元素符号表示)。
(3)C的氢化物比F的氢化物的沸点__________(填“高”或“低”),C的氢化物比F的氢化物的稳定性__________(填“强”或“弱”)。
(4)A 2 D的VSEPR模型名称为__________; 写出与A 2 D分子互为等电子体的微粒__________(填一种)。
(5)写出E 3 C 2 的电子式 ;
(6)G的基态原子核外电子排布式为 。 ZXALC1年前1
ZXALC1年前1 -
 草8草 共回答了18个问题
草8草 共回答了18个问题 |采纳率83.3%1年前查看全部
- 根据化合价解释原因探究钾元素(原子序数为19)单质与水反应的生成物,甲同学猜想生成物为H 和H2;乙同学猜想生成物为KO
根据化合价解释原因
探究钾元素(原子序数为19)单质与水反应的生成物,甲同学猜想生成物为H 和H2;乙同学猜想生成物为KOH和O2,你认为________同学的猜想不合理,请从化合价的角度解释原因_________________________________________________________________________
呃,打错了..应该是甲同学猜想生成物为KOH和H2. samsamsamho1年前1
samsamsamho1年前1 -
 hhhyyy6666 共回答了17个问题
hhhyyy6666 共回答了17个问题 |采纳率94.1%当然是乙同学的啦 钾与水反应中钾由0价上升为+1价 如果生成物是KOH和O2的话 O2中O显0价 而原价为-2价 H却没变 这样化合价升降不相等了 即整个反应中只有氧化反应 这违背了氧化还原反应的统一性1年前查看全部
- 如图所示是原子核的核子平均质量与原子序数Z的关系图像,下列说法正确的是 [
如图所示是原子核的核子平均质量与原子序数z的关系图像,下列说法正确的是 
[ ]
a.如d和e结合成f,结合过程一定会吸收核能
b.如d和e结合成f,结合过程一定会释放核能
c.如a***成b和c,***过程一定会吸收核能
d.如a***成b和c,***过程一定会释放核能 hfjj1t5d1年前1
hfjj1t5d1年前1 -
 uxnhdut 共回答了16个问题
uxnhdut 共回答了16个问题 |采纳率100%BD1年前查看全部
- A,B,C,D为原子序数依次增大的短周期元素,化合物AB对水的电离有抑制作用,化合物C2D对水电离有促进作用,则C
 sun196505011年前1
sun196505011年前1 -
 elacy 共回答了7个问题
elacy 共回答了7个问题 |采纳率85.7%A氢 B氟 C钠 D硫1年前查看全部
- 现有a、b、c、d、e五种短周期元素,原子序数依次增大,其中a对应的单质是第IA族中沸点最低的物质
现有a、b、c、d、e五种短周期元素,原子序数依次增大,其中a对应的单质是第IA族中沸点最低的物质
e的单质能和冷水剧烈反应生成a的单质.它们中的一种或几种元素可以组成中学常见的物质,这些物质见的转化关系如图所示
A能生成B和C和D B与E反应生成C和F D和E反应能生成F和G 则abcde与ABCDEFG分别为? yangruilin1年前2
yangruilin1年前2 -
 Vinkinson 共回答了19个问题
Vinkinson 共回答了19个问题 |采纳率68.4%a:H
e:Na
还有C、O(具体是bcd哪种,确定不了)
A是NaHCO3
B是CO2
C是Na2CO3
D是H2O
E是Na2O2
F是O2
G是NaOH1年前查看全部
- 原子序数依次增大的ABCDE都是元素周期表中前20号元素,BCD同周期,AD同主族,且A的原子结构中最外层电子数
原子序数依次增大的ABCDE都是元素周期表中前20号元素,BCD同周期,AD同主族,且A的原子结构中最外层电子数
原子序数依次增大的ABCDE都是元素周期表中前20号元素,BCD同周期,AD同主族,且A的原子结构中最外层电子数是电子层数的3倍。E和其他元素既不在同周期也不再同主族,D的最高价氧化物对应的水化物为强酸,且BCD的最高价氧化物对应的水化合物两两混合均能发生反应生成盐和水。则ABCDE分别为哪几种元素_________. 脏ル1年前2
脏ル1年前2 -
 cafe5420 共回答了24个问题
cafe5420 共回答了24个问题 |采纳率87.5%首先,你要把原题写清楚吧 这才能解题
等你1年前查看全部
- (2014•湖北模拟)原子序数依次增大的短周期主族元素W、X、Y、Z和M中,W的最外层电子数为其周期数的二倍;X和Z的A
(2014•湖北模拟)原子序数依次增大的短周期主族元素W、X、Y、Z和M中,W的最外层电子数为其周期数的二倍;X和Z的A2B型氢化物均为V形分子,Y的+1价离子比M的-1价离子少8个电子.根据以上叙述,下列说法中正确的是( )
A.上述四种元素的原子半径大小为W<X<Y<Z<M
B.由这些元素形成的三原子分子中,空间结构为直线形的有WX2,WZ2,ZX2
C.元素W与氢形成的原子个数比为1﹕1的化合物有很多种
D.X与Y可形成含有非极性共价键的共价化合物 醉倚望江楼1年前1
醉倚望江楼1年前1 -
 paul6699 共回答了15个问题
paul6699 共回答了15个问题 |采纳率80%解题思路:原子序数依次增大的短周期元素W、X、Y、Z和M中,W的最外层电子数为其周期数的二倍,则W只能有2个电子层,最外层电子数为4,故W为碳元素;X和Z的A2B型氢化物均为V形分子,X为氧元素,Z为硫元素;Y的+1价离子比M的-1价离子少8个电子,Y为钠元素,M为Cl元素.原子序数依次增大的短周期元素W、X、Y、Z和M中,W的最外层电子数为其周期数的二倍,则W只能有2个电子层,最外层电子数为4,故W为碳元素;X和Z的A2B型氢化物均为V形分子,X为氧元素,Z为硫元素;Y的+1价离子比M的-1价离子少8个电子,Y为钠元素,M为Cl元素,
A.同周期随原子序数增大原子半径减小,电子层越多原子半径越大,故原子半径Na>S>Cl>C>O,即X<W<M<Z<Y,故A错误;
B.CO2、SC2属于直线型结构,而SO2分子中S原子价层电子对数=2+[6−2×2/2]=3,有1对孤电子对,属于V型,故B错误;
C.元素C与氢形成的原子个数比为1﹕1的化合物有:C2H2、C6H6、苯乙烯(C8H8),等多种,故C正确;
D.O与Na可形成氧化钠、过氧化钠,二者都属于离子化合物,故D错误,
故选C.点评:
本题考点: 原子结构与元素周期律的关系.
考点点评: 本题考查结构性质位置关系综合应用,推断元素是解题的关键,需要学生熟练掌握基础知识,难度不大.1年前查看全部
- 现有A、B、C、D、E、F六种短周期元素,原子序数依次增大。已知A与D、C与E分别同主族,D、E、F同周期;A、B的最外
现有A、B、C、D、E、F六种短周期元素,原子序数依次增大。已知A与D、C与E分别同主族,D、E、F同周期;A、B的最外层电子数之和与C的最外层电子数相等,A与C形成的化合物常温下均为液态,A分别与E、F形成的气体分子电子总数相等。请回答下列问题:
(1) 元素B在周期表中的位置______________。
(2) A 2 C比A 2 E沸点高的原因是____________________________。
(3)写出同时含A、B、C、E四种元素的三种盐的化学式 、 、 。
(4)A 2 C的电子式为 ,C和D形成的一种化合物与A 2 C发生氧化还原反应,该反应的离子方程式为
(5)B元素的最高价氧化物的水化物与其氢化物反应的离子方程式
(6)在一定条件下,A、C的单质和A、C、D形成的离子化合物的水溶液可构成电池,该电池在放电过程中,电解质溶液的pH将________(填“增大”、“减小”或“不变”)。 kmrqc1年前0
kmrqc1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 甲,乙是周期表中相邻两个主族的两种元素,若甲的原子序数为x,则乙的为
 jlphxm1年前6
jlphxm1年前6 -
 ljq19840321 共回答了19个问题
ljq19840321 共回答了19个问题 |采纳率89.5%选A
其实很好推算的.假设甲乙为同周期,则乙的原子序数可能为x+1或者x-1
而假若不是在同一周期的话,分别减去或者加上n个8就可以了.
x-1-8-8=x-171年前查看全部
- 元素推断(高中)5.R、W、X、Y、Z为原子序数依次递增的同一短周期元素,下列说法一定正确的是(m、n均为正整数)A.若
元素推断(高中)
5.R、W、X、Y、Z为原子序数依次递增的同一短周期元素,下列说法一定正确的是(m、n均为正整数)
A.若R (OH)n为强碱,则W (OH)n+1也为强碱
B.若HnXOm为强酸,则Y是活泼非金属元素
C.若Y的最低化合价为-2,则Z的最高正化合价为+6
D.若X的最高正化合价为+5,则五种元素都是非金属元素
题目中的“依次递增”是这个意思吗?比如说X是钠 那Y就是镁吗?
稀有气体不属于非金属元素是吗? 玲愤怒ing1年前3
玲愤怒ing1年前3 -
 chenli 共回答了15个问题
chenli 共回答了15个问题 |采纳率93.3%依次递增,并不是代表相邻,只是代表后面的大于前面的而已
若R是Na的话,W是Mg A就错了
若Y是O的话,Z只能是F或He,由于F没有正价,He只显0价,所以C错
若X是N的话五种元素不一定都是非金属元素,所以D错
只能选B
元素分成三份,金属元素,非金属元素和稀有元素1年前查看全部
- 我国科学家在世界上首次合成铪元素的一种原子.已知铪元素在元素周期表中的原子序数是72,相对原子质量为185.下列说法错误
我国科学家在世界上首次合成铪元素的一种原子.已知铪元素在元素周期表中的原子序数是72,相对原子质量为185.下列说法错误的是( ) A.该元素的原子有72个质子 B.该元素是金属元素 C.该元素的原子有113个电子 D.该元素原子的中子数为113  落228片叶子1年前1
落228片叶子1年前1 -
 悠_着 共回答了12个问题
悠_着 共回答了12个问题 |采纳率91.7%在原子中质子数=核电荷数=核外电子数=原子序数,已知铪元素在元素周期表中的原子序数是72,故其质子数=核外电子数=原子序数=72,所以A正确,C错误;
铪元素的汉语名称的偏旁为金字旁,应为金属元素,所以B正确.
根据相对原子质量≈质子数+中子数,铪元素原子的相对原子质量为185,其中子数为185-72=113,所以D正确.
故选C.1年前查看全部
- 1—18号元素中,A、B两元素的原子序数之差为4,他们组成的化合物为AB,
 zhanghuan921年前4
zhanghuan921年前4 -
 默涵 共回答了10个问题
默涵 共回答了10个问题 |采纳率100%硫化镁
化学式MgS
化学式是AB表明是同价,原子序数差4就需要把常用化合物拿来试一下,看哪个符合.元素化合物这块要多做题,题型见得多、化合物掌握的熟就会取得好成绩.加油吧.1年前查看全部
- (2013•大理州模拟)日本福岛核泄漏危机发生后,福岛土壤首现剧毒放射性钚元素.原子序数为94的钚元素的一种原子中,质子
(2013•大理州模拟)日本福岛核泄漏危机发生后,福岛土壤首现剧毒放射性钚元素.原子序数为94的钚元素的一种原子中,质子数和中子数之和为239,下列关于该原子的说法不正确的是( )
A.中子数为145
B.核电荷数为239
C.质子数为94
D.核外电子数为94 深圳之无名小子1年前1
深圳之无名小子1年前1 -
 地理老师的耳朵 共回答了24个问题
地理老师的耳朵 共回答了24个问题 |采纳率91.7%解题思路:根据在原子中,原子序数=质子数=核电荷数=核外电子数,结合质子数加中子数的数值进行解答;A、在原子中质子数=核电荷数=核外电子数=原子序数,钚的原子序数为94,则其质子数为94,质子数+中子数=239,则其中子数为239-94=145,所以正确.
B、在原子中质子数=核电荷数=核外电子数=原子序数,钚的原子序数为94,则其核电荷数为94,所以错误.
C、在原子中质子数=核电荷数=核外电子数=原子序数,钚的原子序数为94,则其质子数为94,所以正确.
D、在原子中质子数=核电荷数=核外电子数=原子序数,钚的原子序数为94,则其核外电子数为94,所以正确.
故选B.点评:
本题考点: 原子的有关数量计算.
考点点评: 此题是对原子内部微粒的考查,解题的关键是利用了原子中:①原子序数等于质子数等于核电荷数等于核外电子数②相对原子质量等于质子数加中子数,进行解答问题1年前查看全部
- 有X.Y.Z.W四种元素,他们的原子序数分别为6、10、11、17,下列判断正确的是
有X.Y.Z.W四种元素,他们的原子序数分别为6、10、11、17,下列判断正确的是
A、X和W能形成共价化合物
B、Z和W能形成离子化合物
C、Y和Z不能形成化合物
D、Y分子中存在共价键
麻烦写出答案并有解题思路,我这部分有些不明白 goyearn1年前2
goyearn1年前2 -
 看嘎那 共回答了24个问题
看嘎那 共回答了24个问题 |采纳率83.3%正确选项为 A BC
根据原子序数可知道 X为碳 Y为氖 Z为纳 W为氯
这样就明确了 A X和W 可以形成CCl4(四氯化碳) 正确
B Z和W 形成NaCl(氯化钠)正确
C 氖和钠不能形成化合物,正确
D 稀有气体是单原子的,错误1年前查看全部
- 如何理解基数效用和序数效用在经济学中的意义
 18art1年前1
18art1年前1 -
 ff天使88 共回答了20个问题
ff天使88 共回答了20个问题 |采纳率90%关于这两个效用理论,当初初学时就纠结了很长时间,因为是用的高鸿业三版教材,有关序数效用论的部分写的只能用一塌糊涂来形容.我当初的疑问就是:为什么明明基数效应理论认为效应可以加减,而叙述效用理论认为效应不可以加减只能比较大小,可是到头来高鸿业版却推导出一个公式将基数效用理论的结论与叙述效用理论的结论统一了起来,即MRS12=MU1/MU2=P1/P2
这实在是让人匪夷所思,后来我找到了一个安慰自己的答案:高鸿业搞错了!理由是:根据三版P93第三段这一推导公式的关键理由“.消费者增加一种商品的数量所带来的效用的增加量和相应减少的另一种商品数量所带来的效用的减少量.”说这一句话就已经承认了效用的可加可减了,也就是承认了基数效用论了,也就难怪会推导出使得序数效用理论和基数效用理论成为一回事的公式了.于是乎很长一段时间我就这样告诉自己说高鸿业搞错了.
然而后来我的想法又变了!我也开始认为基数效用论与序数效用论是一回事了!问题出在基数与序数各自的定义上:虽然序数被定义为不可加减,这可比较,然而事实上,从严谨的逻辑意义上讲,比较的过程将直接导致加减概念的出现,否则比较的过程将无法进行.因此,认为基数与序数是一分为二的概念的想法本身就有问题,这两个概念根本就是掺和在一起的!因此对序数效用理论的推导才会导致和基数效用理论相容的结论.
现在我已经对传统的效用理论失去信心了,希望行为经济学别再让我失望.1年前查看全部
- A B C D E F为原子序数一次增大的五种短周期元素,其中仅含一种金属元素.A和D最外层电子数相同,B C和E 在周
A B C D E F为原子序数一次增大的五种短周期元素,其中仅含一种金属元素.A和D最外层电子数相同,B C和E 在周期表中相邻,且C E同主族,B元素的氢化物与其最高价氧化物水化物化合生成一种盐,B C的最外层电子数之和等于D的原子核外电子数,A和C可形成两种常见的化合物甲和乙(相对分子质量甲小于乙) ABCDEF分别是什么元素?
 只抽三五烟1年前1
只抽三五烟1年前1 -
 妖怪尼尼 共回答了21个问题
妖怪尼尼 共回答了21个问题 |采纳率90.5%abcde分别是氢氮氧纳氯1年前查看全部
- 铋是放射性元素吗?人教版新课标 物理3-5上说:“原子序数大于或等于83的都是放射性元素",可我在化学书元素周期表上明明
铋是放射性元素吗?
人教版新课标 物理3-5上说:“原子序数大于或等于83的都是放射性元素",可我在化学书元素周期表上明明看到铋不是放射性元素,
一问老师,它说:"铋虽然不是,但它的同位素是的"
不,我说错了!应该是:“原子序数大于或等于83的都是天然放射性元素,”
铋是天然放射性吗? aabbcc3691年前1
aabbcc3691年前1 -
 半点心-001 共回答了17个问题
半点心-001 共回答了17个问题 |采纳率94.1%对的,有很多放射性元素的同位素没有放射性;也有很多元素的同位素具有放射性;
所以,某元素有没有放射性是一个笼统的概念,通常指的是这个元素自然状态下的特性.
简单的例子,钾K-39是稳定的,但是其同位素K-40具有β放射性,半衰期1.277×10^9年;还有很多这样的例子.
因此上述两种说法都是正确的哦.
希望能帮到你1年前查看全部
- (2013•通州区二模)已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E 的单质
(2013•通州区二模)已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E 的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料.下列说法正确的是( )
A.元素A、B组成的化合物常温下一定呈气态
B.一定条件下,元素C、D的最高价氧化物对应的水化物都是强碱
C.工业上常用电解法制备元素C、D、E的单质
D.化合物AE与CE有相同类型的化学键 倩儿姑娘1年前1
倩儿姑娘1年前1 -
 七星传说 共回答了13个问题
七星传说 共回答了13个问题 |采纳率84.6%解题思路:从题目所给条件短周期常温下是气态的可以看出A为H元素、E为Cl元素,元素 B 的原子最外层电子数是其电子层数的2倍,电子层数只可能是2,故B为C元素、元素C在同周期的主族元素中原子半径最大,应位于同周期最左边,C为Na元素、原子序数比钠大的金属,D为Al元素.元素B的原子最外层电子数是其电子层数的2倍,电子层数只可能是2,故B为C元素,A的原子序数比B小且是气体,故A为H,元素 C 在同周期的主族元素中原子半径最大,应位于同周期最左边,C为Na元素、原子序数比钠大的金属,D为Al元素.
A.由C、H元素组成的化合物,比如苯在常温下呈液态,故A错误;
B.其对应的最高价氧化物对应的水化物为NaOH和Al(OH)3,Al(OH)3不是强碱,故B错误;
C.对于Na、Al、Cl2的制备,在工业上都采用电解的方法,故C正确;
D.化合物AE为HCl,为分子晶体,只有共价键,化合物CE为NaCl,是离子晶体,存在离子键,故D错误.
故选C.点评:
本题考点: 原子结构与元素周期律的关系.
考点点评: 本题主要考查的原子结构与元素周期律的应用,考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力.1年前查看全部
- 关于化学中的几个元素化学书中的元素周期表中原子序数110至114中的元素符号分别为Uun,Uuu,Uub,Uuq没有中文
关于化学中的几个元素
化学书中的元素周期表中原子序数110至114中的元素符号分别为Uun,Uuu,Uub,Uuq没有中文名称,那怎么读这四个东西,还有介绍一下这四个的化学性质 等待是最初的苍老1年前5
等待是最初的苍老1年前5 -
 abandonment 共回答了17个问题
abandonment 共回答了17个问题 |采纳率94.1%没有标注是因为还没有中文权威机构对此作出命名,故不能采取统一的中文读音,可根据英文发音,性质吗,因为这些元素都有超强的放射性很不稳定,人们观察到的时间很有限,所以不能确定其明确的性质1年前查看全部
- 分子电子数为36 双原子还原剂分子电子数为36 就是原子序数之和为36 XY 双原子分子 是一种高温还原剂请问是什么?
 篱东菊翁1年前3
篱东菊翁1年前3 -
 ygaiqq 共回答了18个问题
ygaiqq 共回答了18个问题 |采纳率77.8%CaS 把 挨个试出的这个 就这个有还原性1年前查看全部
- ABCD四种短周期元素的原子序数依次增大,AD同主族,BC同周期,AB组合成的化合物甲为气态.
 yan-he1年前1
yan-he1年前1 -
 penghuall 共回答了21个问题
penghuall 共回答了21个问题 |采纳率90.5%问题不够清楚,不过先给你个大概的可能吧,你再把题看看做相应的处理;常温下为气体的,NH3、CO、CO2、HF、CH4、H2S、HCl;再根据ABCD的顺序,A很可能就是H,而B可能就是C、N、F、S、Cl、中的一个;我们的常识D也很可能就是K,Na,极为可能就是Na吧!1年前查看全部
- 元素X的基态原子最外层电子排布为nsn-1npn+2,则X元素的原子序数为( )
元素X的基态原子最外层电子排布为nsn-1npn+2,则X元素的原子序数为( )
A. 9
B. 10
C. 17
D. 18 舒亦纤尘1年前1
舒亦纤尘1年前1 -
 匠人爱芳直 共回答了14个问题
匠人爱芳直 共回答了14个问题 |采纳率85.7%解题思路:根据排布规律可知nsn-1应排满,为2个电子,故n=3,元素X的基态原子最外层电子排布为3s2np5.nsn-1应排满,为2个电子,故n=3,元素X的基态原子最外层电子排布为3s2np5,为Cl元素,故选C.
点评:
本题考点: 原子核外电子排布.
考点点评: 本题考查原子结构与元素的性质,难度不大,注意根据构造原理,先排能量低的再排能量高的.1年前查看全部
- 每一周期元素原子序数的变化规律
 泥沙1年前2
泥沙1年前2 -
 穿个oo来找人 共回答了15个问题
穿个oo来找人 共回答了15个问题 |采纳率93.3%从左向右依次加11年前查看全部
- 用化学式回答原子序数11~18的元素的下列有关问题(急需!)
用化学式回答原子序数11~18的元素的下列有关问题(急需!)
(1)除稀有气体外,原子半径最大的是 (2)最高价氧化物的水化物碱性和酸性最强的各是___ 呈两性的是___ (3)能形成气态氢化物且最稳定的是___ pifu1年前2
pifu1年前2 -
 黑山白熊 共回答了23个问题
黑山白熊 共回答了23个问题 |采纳率91.3%Na,NaOH,H2SO4...1年前查看全部
- 例1.两种短周期的元素x和y,可组成化合物xy3,当y的原子序数为m时,x原子序数可能是①m-4 ②m+4 ③m+8 ④
例1.两种短周期的元素x和y,可组成化合物xy3,当y的原子序数为m时,x原子序数可能是①m-4 ②m+4 ③m+8 ④m+6,其中正确组合是
A.①② B.①②③ C.①②⑤ D.①②③④⑤
像这样的题,答案说什么由一般到特殊,用穷举法列出来,然后又说什么有一些特殊的物质(像NH3,PCL3)也要考虑到.
我有点晕,想问下这类题怎样做才能保证选对了? qing671年前1
qing671年前1 -
 花花ajiduc 共回答了22个问题
花花ajiduc 共回答了22个问题 |采纳率95.5%根据化合物的组成和短周期的题设条件,确定X、Y两元素的化合价,根据可能的化合价进而确定元素所在的周期数和主族数,最后确定原子序数.
两种短周期的元素x和y,可组成化合物xy3,
X、Y的化合价组合
X+3,硼(5)铝(13),P(15)Y,-1,F(9)Cl(17);
X,+6硫(16),Y,-2(O),
X+1,H(1)Y-3,N(5),P(15)
最后研究其差值即可.
像这类题目当你学习到一定程度,对化合物的组成和元素的化合价有一定的熟练程度作起来应该不是难题.
另外还要注意应用数学知识解题,如奇数之差为偶数,偶数之差为偶数等1年前查看全部
- 英语序数就几个啊~快!22nd23rd25th26th28th30th31st比如:1st——first
 flashrainy1年前3
flashrainy1年前3 -
 lyq016 共回答了19个问题
lyq016 共回答了19个问题 |采纳率94.7%22nd:twenty-second 23rd:twenty-third 25th:twenty-fifth 26th:twenty-sixth 28th:twenty-eighth 30th:thirtieth 31st:thirty-first1年前查看全部
- 根据原子序数查找元素名称、符号会出错么?
 li02131年前1
li02131年前1 -
 qbncly 共回答了25个问题
qbncly 共回答了25个问题 |采纳率88%一种原子序数对应一种元素名称、符号.1年前查看全部
- 若短周期元素中的两种元素能形成原子个数为2:3的化合物,这样的原子序数不可能是多少
若短周期元素中的两种元素能形成原子个数为2:3的化合物,这样的原子序数不可能是多少
A.1
B.3
C.5
D.6希望能够各举出几个例子,再说一下怎么样解这样的题目最快
谢谢了 sunnycjy1年前3
sunnycjy1年前3 -
 liutaoxhs 共回答了7个问题
liutaoxhs 共回答了7个问题 |采纳率71.4%B.3.
原子序数为1、3、5、6的元素分别是H 、Li 、B 、C.短周期元素中的两种元素形成原子个数为2:3的可以是B2O3 、C4H6.所以排除了ACD.这类题目根据比值关键要考虑元素的化合价,以及要注意有机化合物.1年前查看全部
- 氩元素的原子序数为什么是18..
 kikifeng1年前3
kikifeng1年前3 -
 dengqingpeng 共回答了18个问题
dengqingpeng 共回答了18个问题 |采纳率100%元素的核外电子是根据构造原理填入各级轨道的,1s 2s 2p 3s 3p 4s 3d……
s层只能容纳2个自旋方向相反的电子,p层能容纳6个电子(三个简并轨道,每个容纳2个自旋方向相反的电子),所以排到Ar时排了18个电子,K、L能级排满,3s、3p也是满的,符合稳定构型;又因为质子数等于电子数,所以原子序数是181年前查看全部
- 两种短周期元素组成的化合物中,原子个数比为1:2,两元素原子序数为p,q,p+q能等于15么?
 414933481年前2
414933481年前2 -
 艾城故事 共回答了26个问题
艾城故事 共回答了26个问题 |采纳率100%可以的,如NO2或N2O.1年前查看全部
- 元素最高正价等于族序数,Cu的最高正价是+2,但它的族序数是ⅠB,应该是+1价啊
 manbuxiasi1年前1
manbuxiasi1年前1 -
 孤天枫 共回答了24个问题
孤天枫 共回答了24个问题 |采纳率95.8%这句话只对主族元素(含0族)有效,Cu这样的副族元素不能套用.
ps:Cu的已知最高价是+3,不是+2,只是+1和+2比较常见.1年前查看全部
- 有两短周期元素X和Y,可组成化合物XY3,当Y为-2价时,X的原子序数为( ) A13 B5 C8 D16
 娃哈哈1ra1年前1
娃哈哈1ra1年前1 -
 的重要 共回答了25个问题
的重要 共回答了25个问题 |采纳率96%SO3:选D1年前查看全部
- 已知A,B为短周期元素,它们可组成BA4的化合物,若A原子序数为m,则B的原子序数不可能是? A m-3 B m+5 C
已知A,B为短周期元素,它们可组成BA4的化合物,若A原子序数为m,则B的原子序数不可能是? A m-3 B m+5 C m+15
 sjg520ly1年前1
sjg520ly1年前1 -
 time_well 共回答了20个问题
time_well 共回答了20个问题 |采纳率95%其实这种题,可以随便取一些元素套一下.
BA4,那么A应该是+1或者-1价的物质,+1可以选H,那么B选项中,就是C,然后甲烷CH4成立,-1就可以考虑第七主族的元素,A选项的m-3就是第四主族的元素,可以写出几种,都合题意.只有C选项,因为是短周期元素,m只能是1,2,3,对应16,17,18,不管哪个都不能满足要求.
所以应该是C1年前查看全部
- 短周期元素X,Y,Z,W的原子序数增大其原子的最外层电子数不少于最内层电子数.其中X是形成化合物种类最多的元素,①X的最
短周期元素X,Y,Z,W的原子序数增大其原子的最外层电子数不少于最内层电子数.其中X是形成化合物种类最多的元素,①X的最高价氧化物的电子式是?
在一定条件下,上述四种元素的单质均能与氧气反应,其中Z的氧化物既能溶于稀硫酸,又能溶于NaOH溶液,②Z元素在元素周期表中位于第几周期,第几主族.
Y固体单质与盐酸反应,再向反应后的溶液中加入过量烧碱溶液,最终溶液中有白色沉淀生成,③写出生成白色沉淀的反应方程式
向上述四种元素的单质的混合物中加入足量烧碱,固体部分溶解,过滤,向滤液中加入过量的盐酸溶液,最终溶液中有白色沉淀,④产生白色沉淀的离子方程式
X,Y,Z,W四种元素的原子半径由大到小顺序为(用元素符号表示) wenwen19811年前2
wenwen19811年前2 -
 yanggao198118 共回答了19个问题
yanggao198118 共回答了19个问题 |采纳率94.7%X、Y、Z、W分别为碳、镁、铝、硅1年前查看全部
- 原子序数为9和20的两种元素他们相互化合时形成什么类型的化学键
 ClareX1年前2
ClareX1年前2 -
 哪有那么多重名的 共回答了22个问题
哪有那么多重名的 共回答了22个问题 |采纳率100%原子序数为9和20的两种元素是F、Ca,这是典型的活泼非金属与活泼金属,它们相互化合时形成典型的离子键1年前查看全部
- 已知短周期的离子.原子序数为a的A显正二价,原子序数为b的B显正一价,原子序数为c的C显负三价,原子序数为d的D显负一价
已知短周期的离子.原子序数为a的A显正二价,原子序数为b的B显正一价,原子序数为c的C显负三价,原子序数为d的D显负一价.都具有相同的电子结构,则下列叙述正确的是
原子半径A>B>D>C
原子序数d>c>b>a
离子半径C>D>B>A
单质的还原性A>B>D>C Ellenie1年前1
Ellenie1年前1 -
 北极狐888 共回答了13个问题
北极狐888 共回答了13个问题 |采纳率92.3%他们的离子具有相同的电子结构(这一点很重要),不妨设该电子结构有x个电子.
A显+2价,所以是失去两个电子,所以a=x+2,
B显+1价,所以是失去一个电子,所以b=x+1,
C显-3价,所以是得到三个电子,所以c=x-3,
D显-1价,所以是得到一个电子,所以d=x-1,
原子序数为:a>b>d>c.
另外,还可以推出,AB比CD的周期数大1.
所以,原子半径:B>A>C>D.
还原性:B>A>C>D
离子半径:由于核外电子排列相同,所以,原子序数越大(核电荷数越多),则半径越小,所以:C>D>B>A1年前查看全部
大家在问
- 1小颖一家三口人.小颖的爸爸比妈妈大3岁.今年全家年龄的总和是71岁,8年前这个家庭的年龄总和是49岁.
- 2用什么方法除去地面上的青苔
- 3学校的占地面积约为3000( )
- 4你不是人,是猪。英语怎么说
- 5收集学习小组名称,有关科学的,谢谢【越多越好】
- 6有关成语的问题根据意思,写出相应的成语:1)不公开讲话,不出头露面.( )2)经受艰辛困苦.( )3)用新的眼光来看待.
- 7爱护、爱惜、珍惜的区别?
- 8根据下面的对话情景,在每个空白处填上一个适当的句子,使对话的意思连贯、完整。
- 9已知函数f(x)=[1/x]+alnx,其中a∈R,
- 10师徒俩7.5小时共做了1950个零件,已知徒弟每小时做110个,师傅每小时做几个
- 11(-1)的2n次方是有理数还是无理数?为什么
- 12核酸对于生物体的-----.-------和------.的生物合成具有重要作用.
- 13读《爸爸的花儿落了》有感 作文
- 14同学们在探究鸟类适于飞行的特点时,提出下列看法,你认为错误的是( )
- 15If the ratio of the degree of&