点解水制氢美国一个实验,试问点解水怎么能得到那么多的氢,谁可以帮我解释下
 xx11142022-10-04 11:39:543条回答
xx11142022-10-04 11:39:543条回答
已提交,审核后显示!提交回复
共3条回复
 跳蚤想家 共回答了25个问题
跳蚤想家 共回答了25个问题 |采纳率84%- 电解1mol水可以产生1mol氢气.
H2O =通电= H2↑ + 1/2 O2↑
1mol水体积是18毫升(4℃)
1mol氢气体积是22.4升(0℃,101.325KPa),体积与水相比增大了1240多倍,你说多不多. - 1年前
 片雪林 共回答了25个问题
片雪林 共回答了25个问题 |采纳率- 电解水得到的不光是氢气还有氧气
方程式为2H2O=2H2+O2 条件是电解 - 1年前
 大漠孤言直 共回答了58个问题
大漠孤言直 共回答了58个问题 |采纳率- 很少啊。只是氢是气体,看上去很多。
- 1年前
相关推荐
- (2014•余姚市模拟)氢气是清洁的能源,也是重要的化工原料,有关氢气的制取研究是一个有趣的课题.根据提供两种制氢方法,
(2014•余姚市模拟)氢气是清洁的能源,也是重要的化工原料,有关氢气的制取研究是一个有趣的课题.根据提供两种制氢方法,完成下列各题:
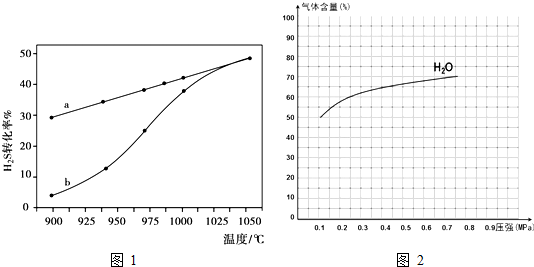
(1)方法一:H2S热分解法,反应式为:2H2S(g)⇌2H2(g)+S2(g)△H
在恒容密闭容器中,控制不同温度进行H2S的分解实验.H2S的起始浓度均为c mol•L-1.不同温度下反应相同时间t后,测得如图1所示H2S转化率曲线图.其中a为平衡转化率与温度关系曲线,b为未达到平衡时转化率与温度的关系曲线.
①△H______0(“>”、“<”或“=”),
②若985℃时,反应经t min达到平衡,此时H2S的转化率为40%,则t min内反应速率v(H2)=[ 0.4c/t] mol•L-1•min-1[ 0.4c/t] mol•L-1•min-1(用含c、t的代数式表示).
③请说明随温度的升高,曲线b向曲线a逼近的原因:______.
(2)方法二:以CaO为吸收体,将生物材质(以C计)与水蒸气反应制取H2.反应装置由气化炉和燃烧炉两个反应器组成,相关反应如下表所示:
①反应C(s)+2H2O(g)+CaO(s)═CaCO3(s)+2H2(g) K=______.(用K1、K2、K3表示)流程1:气化炉中产生H2 流程2:燃烧炉中CaO再生 通入水蒸气,主要化学反应:
I:C(s)+H2O(g)═CO(g)+H2(g)K1
Ⅱ:CO(g)+H2O(g)═CO2(g)+H2(g)K2
Ⅲ:CaO(s)+CO2(g)═CaCO3(s)K3通入纯氧,主要化学反应:
Ⅳ:C(s)+O2(g)═CO2(g)
△H=-393.8kJ•mol-1
V:CaCO3(s)═CaO(s)+CO2(g)
②如图2为反应I在一定温度下,平衡时各气体体积百分含量随压强变化的关系图.若反应达某一平衡状态时,测得c(H2O)=2c(H2)=2c(CO)=2mol•L-1,试根据H2O的体积百分含量变化曲线,补充完整CO的变化曲线示意图.
③对于可逆反应C(s)+2H2O(g)+CaO(s)⇌CaCO3(s)+2H2(g),△H=-87.9kJ•mol-1;采取以下措施可以提高H2产量的是______.(填字母编号)
A.降低体系的温度
B.使各气体组分浓度均加倍
C.适当增加水蒸气的通入量
D.增加CaO的量,提高CO2的吸收率?
(3)方法二与方法一相比其优点有______(写一个即可). 休克七夜1年前1
休克七夜1年前1 -
 小小朱仔 共回答了19个问题
小小朱仔 共回答了19个问题 |采纳率89.5%解题思路:(1)①根据温度升高,转化率增大,可知平衡正移,据此分析;
②根据转化率求出反应的量,再求反应速率;
③根据温度对速率的影响分析;
(2)①反应I、II、III之和为反应C(s)+2H2O(g)+CaO(s)═CaCO3(s)+2H2(g),据此分析;
②根据方程式确定CO与H2O变化量关系,根据图中H2O含量来确定CO的含量,据此分析;
③提高H2产量,则需使平衡正向移动,根据影响平衡的因素分析;
(3)方法二CaO能循环使用,据此分析.(1)①由图象可知,温度升高,转化率增大,则平衡正移,所以正方向为吸热方向,即△H>0,故答案为:>;
②H2S的起始浓度均为c mol•L-1,若985℃时,反应经t min达到平衡,此时H2S的转化率为40%,则参加反应的硫化氢为c mol•L-1×40%=0.4cmol•L-1,
v=[△c/t]=[0.4c/t]mol•L-1•min-1;
故答案为:[0.4c/t]mol•L-1•min-1;
③随着温度升高,反应速率逐渐加快,达到平衡所需时间缩短,所以曲线b向曲线a逼近;
故答案为:温度升高,反应速率加快,达到平衡所需时间缩短;
(2)①已知:I:C(s)+H2O(g)═CO(g)+H2(g) K1
Ⅱ:CO(g)+H2O(g)═CO2(g)+H2(g)K2
Ⅲ:CaO(s)+CO2(g)═CaCO3(s)K3
反应I、II、III之和为反应C(s)+2H2O(g)+CaO(s)═CaCO3(s)+2H2(g),则K=K1•K2•K3;
故答案为:K1•K2•K3;
②反应中H2O的变化量约等于CO的变化量,当起始水的含量为50%,则H2、CO各占25%,则CO的曲线的起点坐标为(0.1,25),平衡时水的含量为70%,则H2、CO各占15%,H2O含量变化与CO含量变化关于含量y=37.5的直线对称,故图中CO的变化曲线示意图为: ,
,
故答案为: ;
;
③提高H2产量,则需使平衡正向移动,已知C(s)+2H2O(g)+CaO(s)⇌CaCO3(s)+2H2(g),△H=-87.9kJ•mol-1;
A.该反应为放热反应,降低体系的温度,平衡正移,则能提高H2产量,故A正确;
B.该反应前后气体体积不变,使各气体组分浓度均加倍,则压强增大,平衡不移动,所以H2产量不变,故B错误;
C.适当增加水蒸气的通入量,平衡正移,则能提高H2产量,故C正确;
D.增加CaO的量,对平衡无影响,所以H2产量不变,故D错误;
故答案为:AC;
(3)方法二中实现了吸收剂CaO的循环,降低能耗,降低了生产成本,故答案为:实现了吸收剂CaO的循环,降低能耗.点评:
本题考点: 转化率随温度、压强的变化曲线;化学平衡常数的含义;化学平衡的影响因素.
考点点评: 本题考查反应热的判断、反应速率的计算、化学平衡图象与影响因素等,难度中等,注意把握图象中坐标的含义,充分利用图象中的信息,题目综合性强,侧重于考查学生对所学知识的应用能力.1年前查看全部
- 求一个化学反应的原理:硅氢氧化钠氢氧化钙反应(工业制氢)原理
求一个化学反应的原理:硅氢氧化钠氢氧化钙反应(工业制氢)原理
Si+2NaOH+Ca(OH)2=Na2SiO3+CaO+2H2气标我想问的是 这个方程式是不是几个方程式合并的呢?第二个问题是 这个方程式为什么能发生呢? 觉得咖啡苦1年前1
觉得咖啡苦1年前1 -
 jimmyhao 共回答了16个问题
jimmyhao 共回答了16个问题 |采纳率81.3%据我所知,这个方程不成立,工业制取氢气也不可能用溶液法.
产物是氧化钙,反应体系却是溶液,显然不可能.
一般要溶液体系呈强碱性,就是用钠钾,钙通常只做检验用.
此外离子溶液中矽酸钙是沉淀.1年前查看全部
- 为什么电解水制取氢气不是理想而经济的制氢方法
 Oligonucleotide1年前1
Oligonucleotide1年前1 -
 moyankang 共回答了20个问题
moyankang 共回答了20个问题 |采纳率100%理论上,氢气与氧气燃烧生成一摩尔水,所放出的能量等于电解一摩尔水,得到氢气和氧气所需要的能量相同.但在电解水的过程中,由于电路电阻、气体的收集贮存等多方面的原因,使得实际耗能量远大于理论耗能量.如果用电解得到氢气作为能源使用,由于工艺上的各种原因,能量转化率也一定小于理论值.所以用电解水制取氢气的得不偿失的.1年前查看全部
- 氢能是21世纪最理想的能源,但制氢还没有想出真正合适的方法,图是电解水制氢的简易装置图.
氢能是21世纪最理想的能源,但制氢还没有想出真正合适的方法,图是电解水制氢的简易装置图.
回答下列问题:
(1)电解水实验所用到的电源是______(填“直流电”或“交流电”).
(2)甲管生成______气体,b应接电源______极.
(3)检验乙管中气体的方法是______.
(4)在实际操作时,常在水中滴加少量稀硫酸和氢氧化钠溶液,这是为了______.
(5)理论上甲、乙两试管中气体的体积比为______.
(6)通过以上实验得出的结论是______.
 奴颜媚骨1年前1
奴颜媚骨1年前1 -
 让我一笑而过 共回答了15个问题
让我一笑而过 共回答了15个问题 |采纳率80%(1)电解水实验所用到的电源是直流电;
(2)由电解水的装置可知,甲管生成的气体较多是氢气,乙管生成的气体较少是氧气,应接电源的正极,所以,b应接电源的正极;
(3)由于乙管中的气体是氧气能支持燃烧,所以,检验的方法是:将带火星的木条深入试管内看是否复燃;
(4)由于稀硫酸和氢氧化钠在溶于水时能解离出自由移动的离子.所以,在实际操作时,常在水中滴加少量稀硫酸和氢氧化钠溶液,这是为了增强水的导电性;
(5)理论上甲、乙两试管中气体的体积比为2:1;
(6)通电分解水生成了氢气和氧气.说明了水是由氢元素和氧元素组成的;在通电分解水时,水分子变成了氢分子和氧分子,说明了在化学反应中分子分成原子,原子再重新组合成新的分子.
故答为:(1)直流电;(2)氢气,正; (3)将带火星的木条深入试管内看是否复燃;(4)增强水的导电性;(5)2:1;(6)水是由氢元素和氧元素组成的或在化学反应中分子分成原子,原子再重新组合成新的分子.1年前查看全部
- 甲烷催化热分解制氢的原理和催化剂是什么?
 angelmantang1年前1
angelmantang1年前1 -
 cara3063 共回答了22个问题
cara3063 共回答了22个问题 |采纳率100%甲烷制氢新法该法是利用C60作催化剂用甲烷制造氢气.日本工业技术院物质工学工业技术研究所利用C60(碳原子结合成足球状的物质)作催化剂,用甲烷稳定地制造了氢气.利用C60作催化剂,在理论上比现有金属催化剂使用寿命长.1年前查看全部
- (2008•茂名二模)某学习小组查找出热化学循环制氢法:
(2008•茂名二模)某学习小组查找出热化学循环制氢法:
2H2O(l)+SO2(g)+I2(s)→H2SO4(aq)+2HI(g)
H2SO4(aq)→H2O(l)+SO2(g)+[1/2]O2(g)
2HI(g)→H2(g)+I2(g)
从理论上讲,该循环中,1mol H2O能制得氢气( )
A.1mol
B.2mol
C.0.25mol
D.0.5mol Anthony-wck1年前1
Anthony-wck1年前1 -
 练武奇才 共回答了19个问题
练武奇才 共回答了19个问题 |采纳率94.7%解题思路:根据方程式中的循环反应可知,水中氢元素最终完全生成氢气,利用氢原子守恒计算解答.根据方程式中的循环反应可知,水中氢元素最终完全生成氢气,根据氢原子守恒可知,1mol H2O能制得1mol氢气,
故选A.点评:
本题考点: 化学方程式的有关计算.
考点点评: 本题考查学生根据方程式的计算,利用原子守恒解答是关键,侧重对学生思维能力的考查,难度中等.1年前查看全部
- 电解水制氢,如何收集氢
 yishengyilian1年前1
yishengyilian1年前1 -
 jswxck 共回答了22个问题
jswxck 共回答了22个问题 |采纳率100%排水集气法1年前查看全部
- 目前科学家认为理想的制氢方法是寻找合适的光分解催化剂,使水在太阳光照射下分解产生氢气.下列有关说法不正确的是( )
目前科学家认为理想的制氢方法是寻找合适的光分解催化剂,使水在太阳光照射下分解产生氢气.下列有关说法不正确的是( )
A.该催化剂能加快水在太阳光照射下分解的速率
B.该制氢的方法是将光能转化成化学能
C.该方法是将化学能转化成光能
D.该催化剂在此过程前后,质量与化学性质不变 1986uu1年前1
1986uu1年前1 -
 joc_999000 共回答了22个问题
joc_999000 共回答了22个问题 |采纳率86.4%解题思路:根据催化剂的特点及水在太阳光照射下分解产生氢气的反应中能量的变化分析.A、催化剂有催化作用,即可改变化学反应的速率,为了迅速制得氢气,可用催化剂加快水在太阳光照射下分解的速率.故A正确.
B、由题意可知,该技术是产生氢气和氧气,氢气燃烧时放出热量,故利用该技术可以将光能转化为化学能.故B正确;
C、由上述分析可知,该方法是将光能转化成化学能.故C不正确;
D、由催化剂的特点可知,该催化剂在此过程前后,质量与化学性质不变.故D正确.
故选C.点评:
本题考点: 氢气的用途和氢能的优缺点;催化剂的特点与催化作用;物质发生化学变化时的能量变化.
考点点评: 本题解题的关健是:能根据信息分析得出寻找合适的光分解催化剂,使水在太阳光照射下分解产生氢气中的能量转化,理解催化剂的特点.1年前查看全部
- 电解水制氢工艺是不是15种危险工艺
 27年白活了1年前1
27年白活了1年前1 -
 mingchao919 共回答了25个问题
mingchao919 共回答了25个问题 |采纳率92%不是1年前查看全部
- 开发和利用清洁而又高效的新能源,是21世纪人类面临的重要课题.氢气是未来最理想的能源,理想的制氢方法是______.目前
开发和利用清洁而又高效的新能源,是21世纪人类面临的重要课题.氢气是未来最理想的能源,理想的制氢方法是______.目前已经开发利用的氢氧燃料电池是一种将______能转化为电能的装置.
 温柔如汤1年前1
温柔如汤1年前1 -
 xin1987 共回答了19个问题
xin1987 共回答了19个问题 |采纳率84.2%解题思路:氢气是一种清洁的能源,开发前景良好;燃料电池是一种把化学能转化成电能的装置.电解水可以制取氢气,但是要消耗大量的电能;利用太阳能分解水制氢气是一种比较理想的方法.故填:利用太阳能分解水制氢气.
氢氧燃料电池是一种将化学能转化为电能的装置.故填:化学.点评:
本题考点: 氢气的用途和氢能的优缺点.
考点点评: 解答本题要掌握制取氢气的理想方法和能量转化方面的知识,只有这样才能对相关方面的问题做出正确的判断.1年前查看全部
- 2010山东省理综2816、硫一碘循环分解水制氢主要涉及下列反应:Ⅰ SO2+2H2O+I2===H2SO4+2HI Ⅱ
2010山东省理综28
16、硫一碘循环分解水制氢主要涉及下列反应:
Ⅰ SO2+2H2O+I2===H2SO4+2HI
Ⅱ 2HI H2+I2
Ⅲ 2H2SO4===2SO2+O2+2H2O
(1)分析上述反应,下列判断正确的是 .
a.反应Ⅲ易在常温下进行 b.反应Ⅰ中SO2氧化性比HI强
c.循环过程中需补充H2O d.循环过程中产生1mol O2的同时产生1mol H2
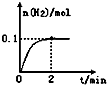
(2)一定温度下,向1L密闭容器中加入1mol HI(g),发生反应Ⅱ,H2物质的量随时间的变化如图所示.
2 min内的平均反应速率v(HI)= .该温度下,H2(g)+I2(g) 2HI(g)的平衡常数K= .
相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则 是原来的2倍.
a.平衡常数 b.HI的平衡浓度 c.达到平衡的时间 d.平衡时H2的体积分数
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡 移动(填“向左”“向右”或者“不”);若加入少量下列试剂中的 ,产生H2的速率将增大.
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
(4)以H2为燃料可制成氢氧燃料电池.
已知 2H2(g)+O2(g)===2H2O(I) △H=-572KJ.mol-1
某氢氧燃料电池释放228.8KJ电能时,生成1mol液态水,该电池的能量转化率为 .
请问为什么(1)中A为什么错了,请问(3)的第二空是如何判断的
 滕鑫1年前1
滕鑫1年前1 -
 别在乎我是谁 共回答了23个问题
别在乎我是谁 共回答了23个问题 |采纳率78.3%28.
(1)c 由于硫酸很稳定,所以反应 Ⅲ最难进行.需要很高的热能,也就是说在较高温度下才能进行;
(2)0.1mol•L-1•min-1;64;b
(3)向右;b 锌能和硫酸铜反应产生少量的铜,锌、铜、稀硫酸形成原电池,使反应加快
(4)80%1年前查看全部
- 锌与足量稀硫酸反应可制的氯化锌和氢气,32.5克的锌可制氢多少克
锌与足量稀硫酸反应可制的氯化锌和氢气,32.5克的锌可制氢多少克
ZN+2HCL=ZNCL2+H2 原子质量ZN-65 H--1 CL--35.5 制造hh1年前1
制造hh1年前1 -
 想喝点酒 共回答了23个问题
想喝点酒 共回答了23个问题 |采纳率87%设生成气体为x g
Zn+2HCl==ZnCl2+H2(气体)
65----------------------2
32.5---------------------x
x=1g
所以可以制取H2 1g1年前查看全部
- (2012浙江7)下列说法不正确的 是() A. 利用太阳能在催化剂参与下分解 水制氢是把光能转化为化学能的绿色 化学方
(2012浙江7)下列说法不正确的 是() A. 利用太阳能在催化剂参与下分解 水制氢是把光能转化为化学能的绿色 化学方法 B. 蔗糖、淀粉、油脂及其水解产物 均为非电解质 C. 通过红外光谱分析可以区分乙醇 和乙酸乙酯 D. 石油催化裂化的主要目的是提高 汽油等轻质油的产量与质量;石油裂 解的主要目的是得到更多的乙烯、丙 烯等气态短链烃
 东方世玉1年前4
东方世玉1年前4 -
 a112951 共回答了12个问题
a112951 共回答了12个问题 |采纳率33.3%B 油脂 水解的产物为甘油和高级脂肪酸 (钠),高级脂肪酸(钠)属于电解 质,B错误1年前查看全部
- (2011•雅安)如图是实验室 常用的两个气体制备、收 集、净化的多功能装置. (1)若用于制氢
(2011•雅安)如图是实验室 常用的两个气体制备、收 集、净化的多功能装置. (1)若用于制氢
(2011•雅安)如图是实验室 常用的两个气体制备、收 集、净化的多功能装置.
(1)若用于制氢气,且产生的气体中 不含酸性杂质气体,则试剂X常用 ,用图示放置的乙装置收集氢气,A应 与 (填“B”或“C”)相连.
(2)若X是稀盐酸、Y是石灰石,用甲
乙两装置可组成发生、净化、收集C O2气体的系列装置.若乙中放入饱和N aHCO3溶液,则该溶液的作用是除去 ;若乙中放入浓硫酸,浓硫酸的作用 是
(3)若X是水,Y是CaC2固体,则从A 中放出乙炔(化学式:C2H2)气体, 同时还生成一种碱.乙炔微溶于水, 密度与空气接近.若用乙装置收集乙 炔,则乙中还应该装入;生成乙炔的 化学方程式是

 luguang_20061年前1
luguang_20061年前1 -
 514948449 共回答了12个问题
514948449 共回答了12个问题 |采纳率83.3%(1)若用于制氢气,且产生的气体中 不含酸性杂质气体,则试剂X常用(硫酸 ),用图示放置的乙装置收集氢气,A应 与 (C)(填“B”或“C”)相连.(2)若X是稀盐酸、Y是石灰石,用甲乙两装置可组成发生、净化、收集C O2...1年前查看全部
- 电解水制氢实验,请问该怎么增大电流?
电解水制氢实验,请问该怎么增大电流?
电压直流12伏 导线粗 但是速度还是不快 请问怎么增大电流?或者有什么办法? 蓝色海岸线51年前1
蓝色海岸线51年前1 -
 重庆渝安kk 共回答了23个问题
重庆渝安kk 共回答了23个问题 |采纳率73.9%在12V之上,电解速度与电压电流的关系十分小,在物理学角度可以不计.它这时只与电极的接触面大小和电极的活泼性有关.对于你来说这时最好向水中加氢氧化钠或硫酸来增强导电性,这样电解速度快.1年前查看全部
- 硫—碘循环分解水制氢主要涉及下列反应:I SO2+2H2O+I2==H2SO4+2HI II 2HI H2+I2 III
硫—碘循环分解水制氢主要涉及下列反应:I SO2+2H2O+I2==H2SO4+2HI II 2HI H2+I2 III 2H2SO4=
硫—碘循环分解水制氢主要涉及下列反应:
I SO2+2H2O+I2==H2SO4+2HI
II 2HI H2+I2
III 2H2SO4==2SO2+O2+2H2O
(1)分析上述反应,下列判断正确的是?
a.反应III易在常温下进行
b.反应I中SO2氧化性比HI强
c.循环过程中需补充H2O
d.循环过程中产生1molO2的同时产生1 molH2 thyhjsh1年前1
thyhjsh1年前1 -
 gyu1 共回答了16个问题
gyu1 共回答了16个问题 |采纳率93.8%选C
(1)分析上述反应,下列判断正确的是?
a.反应III易在常温下进行
不是的,需要加热
b.反应I中SO2氧化性比HI强
不对
应该是氧化产物硫酸比还原产物HI的氧化性强,他两的氧化性是SO2氧化性比HI弱
因为SO2还原性比HI强 .(还原剂SO2比还原产物HI的还原性强)
c.循环过程中需补充H2O
是的
毕竟是反应了2mol而生成的是1mol
d.循环过程中产生1molO2的同时产生1 molH2
不对产生1molO2的同时产生2 molH21年前查看全部
- 化学方程式12个,乙炔与溴水,实验室制乙烯,苯酚与氢氧化钠,苯酚钠与盐酸,苯酚钠通入CO2,乙醛的银镜反应,乙醛与新制氢
化学方程式12个,
乙炔与溴水,实验室制乙烯,苯酚与氢氧化钠,苯酚钠与盐酸,苯酚钠通入CO2,乙醛的银镜反应,乙醛与新制氢氧化铜,乙醛的催化氧化,乙醛与H2,CH3-C-CH3与H2,
||
O
乙酸乙酯与稀硫酸,乙酸乙酯与氢氧化钠
氧用双键连在碳上 chrisnet20081年前2
chrisnet20081年前2 -
 tangzhaokun 共回答了14个问题
tangzhaokun 共回答了14个问题 |采纳率92.9%乙炔与溴水:C2H2+2Br2=CHBr2-CHBr2
实验室制乙烯:CH3CH2OH→浓硫酸&170℃→CH2=CH2↑+H2O
苯酚与氢氧化钠:苯环-OH+NaOH=苯环-ONa+H2O
苯酚钠与盐酸:苯环-ONa+HCl=苯环-OH+NaCl
苯酚钠通入CO2:CO2+2 苯环-ONa+H2O=2 苯环-OH+Na2CO3
乙醛的银镜反应:CH3-CHO+2Ag(NH3)2NO3+H2O=CH3-COONH4+2NH4NO3+2Ag↓+NH3
乙醛与新制氢氧化铜:CH3CHO+2Cu(OH)2→(加热)CH3COOH+Cu2O↓+2H2O
乙醛的催化氧化(你说的这个应该是用乙醇催化氧化制乙醛吧):2CH3CH2OH +O2 →(加热)Cu或Ag → 2CH3CHO +2H2O
乙醛与H2:CH3CHO+H2=催化剂= CH3CH2OH
CH3-C-CH3(丙酮)与H2:CH3-C-CH3+H2=催化剂= CH3-CH-CH3
|| || |
O O OH
乙酸乙酯与稀硫酸:CH3COOC2H5+H2O←稀硫酸,加热→CH3COOH+C2H5OH(双箭头,可逆反应的意思)
乙酸乙酯与氢氧化钠:CH3COOC2H5+NaOH→加热→CH3COONa+C2H5OH1年前查看全部
- 硫一碘循环分解水制氢主要涉及下列反应:
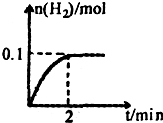 硫一碘循环分解水制氢主要涉及下列反应:
硫一碘循环分解水制氢主要涉及下列反应:
Ⅰ.SO2+2H2O+I2═H2SO4+2HI
Ⅱ.2HI⇌H2+I2
Ⅲ.2H2SO4═2SO2+O2+2H2O
(1)整个过程中SO2、I2的作用是______.
(2)一定温度下,向1L密闭容器中加入1mol HI(g),发生反应Ⅱ,生成的
I2为气体,H2物质的量随时间的变化如图所示.0-2min内的平均反应速率v(HI)=______,能作为该反应达到平衡状态判断依据的是______.
①n(H2)=n(I2)
②压强不再变化
③气体密度不再变化
④2个H-I断裂的同时,有1个H-H断裂
⑤各组分浓度保持不变
⑥c(HI):c(H2):c(I2)=2:1:1
已知有关键能数据:I2-151kJ/mol、H2-436kJ/mol、HI-298kJ/mol,则分解0.2molHI时的能量变化是______ (填“吸收”或“放出”)______kJ的热量.
(3)实验室用Zn和硫酸制取H2,为了加快反应速率,下列措施不可行的是(填序号)______.
a.加入浓硝酸b.加入少量CuSO4固体c.用粗锌代替纯锌d.加热e.把锌粒制成锌粉 f.用98.3%浓硫酸. 烦NO烦1年前1
烦NO烦1年前1 -
 heilang888 共回答了24个问题
heilang888 共回答了24个问题 |采纳率100%解题思路:(1)根据SO2、I2在反应前后的质量分析;
(2)由图可知,2min内H2物质的量的变化量,然后计算化学反应速率,再利用化学反应速率之比等于化学计量数之比来解答;根据化学平衡状态分析;根据反应热计算;
(3)根据影响化学反应速率的因素分析.(1)SO2、I2在反应前后质量和性质不变,故答案为:催化剂;
(2)由图可知2min内氢气的物质的量增加了0.1mol,则氢气的浓度为0.1mol/L,用氢气表示的化学反应速率为[0.1mol/L/2min]=0.05mol/(L.min),由反应中的化学计量数可知v(HI)为0.05mol/(L.min)×2=0.1mol/(L.min);①n(H2)=n(I2),没有明确反应方向,不变判断反应是否平衡;②压强自始至终不再变化,不能判断平衡;③气体自始至终密度不再变化,不能判断平衡;④2个H-I断裂的同时,有1个H-H断裂,正逆反应速率相等,能判断反应是否平衡;⑤各组分浓度保持不变是判断平衡的标志;⑥c(HI):c(H2):c(I2)=2:1:1,没有明确反应方向,不变判断反应是否平衡;根据题目中的数据,可知HI分解的反应热:△H=+298kJ/mol×2-151kJ/mol-436kJ/mol=+9kJ/mol;则分解0.2molHI需要吸收:
9kJ/mol
2×0.2mol=0.9kJ,故答案为:0.1mol/L.min;④⑤;吸收;0.9;
(3)加入浓硝酸、用98.3%浓硫酸,溶液具有强氧化性,则不会生成氢气;加热、粗锌代替纯锌、把锌粒制成锌粉,都能加快反应速率;加入CuSO4 后,Zn与硫酸铜溶液反应置换出Cu,则构成原电池加快了化学反应速率,故答案为:a、f.点评:
本题考点: 化学平衡状态的判断;反应热和焓变;化学反应速率的影响因素.
考点点评: 本题较复杂,考查的知识点多,注重了基础知识和基本技能的训练,同时体现新课程改革的指导思想,明确化学反应速率及其影响因素、平衡状态的特点、电化学的知识点是解答本题的关键.1年前查看全部
- 从质量守恒定律观点看,水可作为制氢的原料,其原因是——
 zhangxiuyun8881年前3
zhangxiuyun8881年前3 -
 恋叶潇潇 共回答了23个问题
恋叶潇潇 共回答了23个问题 |采纳率87%化学反应前后元素种类不变1年前查看全部
- (2012•莆田一模)用惰性电极电解尿素[CO(NH2)2]的碱性溶液制氢,装置如图所示,电解池中的隔膜仅阻止气体通过.
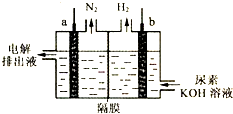 (2012•莆田一模)用惰性电极电解尿素[CO(NH2)2]的碱性溶液制氢,装置如图所示,电解池中的隔膜仅阻止气体通过.电解时总的化学方程式为:CO(NH2)2+2OH-
(2012•莆田一模)用惰性电极电解尿素[CO(NH2)2]的碱性溶液制氢,装置如图所示,电解池中的隔膜仅阻止气体通过.电解时总的化学方程式为:CO(NH2)2+2OH-
CO通电 .
+N2↑+3H2↑,以下说法不正确的是( )2−3
A.a为阳极,b为阴极
B.电解时,溶液中OH-向b极移动
C.阴极反应式:2H2O+2e-═H2↑+2OH-
D.电解后,溶液pH减小 lipeng010384101年前1
lipeng010384101年前1 -
 hdxshop 共回答了18个问题
hdxshop 共回答了18个问题 |采纳率94.4%解题思路:该电池反应时中,氮元素化合价由-3价变为0价,H元素化合价由+1价变为0价,所以生成氮气的电极是阳极,生成氢气的电极是阴极,结合电解质溶液中氢氧根离子浓度的变化分析解答.A.该电池反应时中,氮元素化合价由-3价变为0价,H元素化合价由+1价变为0价,则氮元素被氧化,氢元素被还原,所以生成氮气的电极a是阳极,生成氢气的电极b是阴极,故A正确;
B.电解时,电解质溶液中阴离子向阳极移动,根据A知,a是阳极,所以氢氧根离子向a极移动,故B错误;
C.阴极上水得电子生成氢气和氢氧根离子,电极反应式为2H2O+2e-═H2↑+2OH-,故C正确;
D.根据电池反应式知,氢氧根参加反应,导致溶液中氢氧根离子浓度减小,溶液的pH减小,故D正确;
故选:B.点评:
本题考点: 电解原理.
考点点评: 本题考查了电解原理,明确元素化合价变化是解本题关键,根据元素化合价变化与阴阳极的关系来分析解答,难度中等.1年前查看全部
- 天然气制氢原料的优点和意义是什么呢?
 falsecrew1年前1
falsecrew1年前1 -
 kaikai2006 共回答了22个问题
kaikai2006 共回答了22个问题 |采纳率95.5%现在制氢行业采用天然气做原料已经是多数企业的首选,首先天然气价格便宜,再就是组分简单,甲烷含量在93%以上,硫含量底,从而降低了装置因为烯烃饱和、脱硫和裂解的能耗.1年前查看全部
- 1996年,范克(Fwnk.J.E)等人提出用H2O和H2SO4为原料进行热化学循环制氢法:
1996年,范克(Fwnk.J.E)等人提出用H2O和H2SO4为原料进行热化学循环制氢法:
2H2O(l)+SO2(g)+I2(s)═H2SO4(aq)+2HI(g)
H2SO4(aq)═H2O(l)+SO2(g)+[1/2]O2(g)
2HI(g)═H2(g)+I2(g)
从理论上讲,该循环中,1mol原料H2O能制得氢气( )
A.0.25mol
B.0.5mol
C.1mol
D.2mol 舞台冷焰火1年前1
舞台冷焰火1年前1 -
 标枪王 共回答了24个问题
标枪王 共回答了24个问题 |采纳率91.7%已知:①2H2O(l)+SO2(g)+I2(s)═H2SO4(aq)+2HI(g)
②H2SO4(aq)═H2O(l)+SO2(g)+[1/2]O2(g)
③2HI(g)⇌H2(g)+I2(g)
①+②+③可得H2O(l)=H2(g)+[1/2]O2(g),
根据方程式中的循环反应可知,水中氢元素最终完全生成氢气,根据氢原子守恒可知,1mol H2O能制得1mol氢气,
故选C.1年前查看全部
- 电解制氢电解食盐水 可以制氢,但同时制出的氯多吗?怎么处理?(我在家里提取氢,但我可不想被毒死!)谁能帮我解决这个问题?
 long1631年前1
long1631年前1 -
 刘13会功 共回答了28个问题
刘13会功 共回答了28个问题 |采纳率78.6%关键是你怎么收集了
氢气这个东西这么便宜用得着用电么.
工业上把空气压缩 然后按照熔点不同提取出来的氢气 比你那个简陋实验设备制取出来的氢气要纯得多 而且很便宜 而且在一般在各种工厂都能用的到
主要是气焊用的 要比较好买到1年前查看全部
- (2011•南京一模)联合国气候变化大会于2010年1l月在墨西好召开.“减碳”措施之一是节能.下列制氢方法最节能的是(
(2011•南京一模)联合国气候变化大会于2010年1l月在墨西好召开.“减碳”措施之一是节能.下列制氢方法最节能的是( )
A.金属钠与水反应:2Na+2H2O=2NaOH+H2↑
B.焦炭与水反应:C+H2O
CO+H2高温 .
C.太阳能光催化分解水.2H2O
2H2↑+O2↑催化剂 .光照
D.天然气与水反应:CH4+H2O
CO+3H2高温 . lalei1年前1
lalei1年前1 -
 话梦 共回答了11个问题
话梦 共回答了11个问题 |采纳率90.9%解题思路:有效“减碳”的手段之一是节能,利用太阳光催化分解水制氢是最节能的,减少电能、天然气、热能的利用.A.消耗电能,不是最节能的方法,故A错误;
B.消耗热能,不是减碳的手段,故B错误;
C.利用太阳光催化分解水制氢是最节能的,故C正确;
D.天然气是非再生能源,且不是最节能的方法,故D错误.
故选C.点评:
本题考点: 使用化石燃料的利弊及新能源的开发.
考点点评: 本题考查能源的利用和减碳等知识,题目难度不大,保护环境人人有责.1年前查看全部
- 利用化学制氢法来生产的氢气,每个氢气钢瓶(40L)大约多少钱?
 qian12311年前1
qian12311年前1 -
 禾火1111 共回答了19个问题
禾火1111 共回答了19个问题 |采纳率89.5%不好算的 化学方法制氢气的反应有很多 比如酸和金属反应 酸的电解 盐类电解 要看你用什么方法了 而且还要考虑原料的价格 比如铁和铝的价格就有差距 自己写化学式算一下吧 一摩尔氢气是22.4升1年前查看全部
- (2013•昆明一模)氢化钙(CaH2)是一种重要的制氢剂,与水接触时发生反应的化学方程式为CaH2+2H2O=Ca(O
(2013•昆明一模)氢化钙(CaH2)是一种重要的制氢剂,与水接触时发生反应的化学方程式为CaH2+2H2O=Ca(OH)2+2H2↑.若制取10g氢气,需要消耗多少氢化钙?
 娃娃的眼睛1年前1
娃娃的眼睛1年前1 -
 我爱小瑜521 共回答了18个问题
我爱小瑜521 共回答了18个问题 |采纳率83.3%设消耗氢化钙的质量为x.
CaH2+2H2O=Ca(OH)2+2H2↑
42 4
x 10g
[42/x=
4
10g]
解之得:x=105g
答:需要消耗105克氢化钙.1年前查看全部
- (2013•绍兴一模)绿色化制氢技术是现代能源工业的方向,以CaO为吸收体,将生物质(以C计)与水蒸气反应制取H2.反应
(2013•绍兴一模)绿色化制氢技术是现代能源工业的方向,以CaO为吸收体,将生物质(以C计)与水蒸气反应制取H2.反应装置由气化炉和燃烧炉两个反应器组成,相关反应如下表所示:
请回答下列问题:流程1:气化炉中产生H2 流程2:燃烧炉中CaO再生 通入水蒸气,主要化学反应:
①C(s)+H2O(g)=CO(g)+H2(g)
△H=+131.6kJ•mol-1
②CO(g)+H2O(g)=CO2(g)+H2(g)
△H=-41.2kJ•mol-1
③CaO(s)+CO2(g)=CaCO3(s)
△H=-178.3kJ•mol-1通入纯氧,主要化学反应:
④C(s)+O2(g)=CO2(g)
△H=-393.8kJ•mol-1
⑤CaCO3(s)=CaO(s)+CO2(g)
K
(1)气化炉中总反应:C(s)+2H2O(g)+CaO(s)=CaCO3(s)+2H2(g)△H=______kJ•mol-1
(2)燃烧炉中反应⑤所需的能量由反应④提供.如果再生1mol CaO,至少需通入纯氧______mol.
(3)当只改变温度或压力时,反应⑤有如图所示的变化: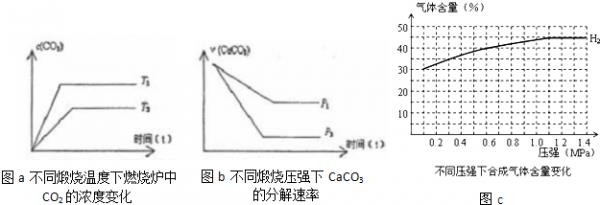
图a推知T1______T2(填“>”、“<”、“=”),若温度升高,平衡常数K值______(填“增大”、“减小”、“不变”)
图b推知P1______P2(填“>”、“<”、“=”),压强增大,CaCO3的分解率______(填“增大”、“减小”、“不变”)
(4)在一定温度、不同压力时,气化炉中H2的变化量约等于CO的变化量(即△n(H2)=△n(CO)),当起始c(H2):c(CO)=3:2时,请根据n(H2)变化,补充完整图C中n(CO)图示变化.
(5)一定条件下,气化炉中的各反应达到平衡状态,采取以下措施可以提高H2产量的是______(用相关编号填写)
A.反应②中使用合适的催化剂B.不断移走CaCO3,并升高气化炉内的温度
C.适当增加水蒸气的通入量D.增加CaO的量,提高CO2的吸收率
(6)写出一条这种制H2技术的优点______. 后来1181年前1
后来1181年前1 -
 alinyes 共回答了22个问题
alinyes 共回答了22个问题 |采纳率95.5%解题思路:(1)根据盖斯定律构造目标热化学方程式,据此计算反应热;
(2)由反应③可知,反应⑤再生1mol CaO吸收178.3kJ热量,结合反应④的反应热计算需要氧气物质的量;
(3)根据“先拐先平数值大”原则判断温度、压强大小;反应⑤是吸热反应,根据平衡时二氧化碳浓度分析升高温度平衡移动方向,进而判断温度对平衡常数影响;反应⑤正反应是气体体积增大的反应,分析增大压强平衡移动方向判断碳酸钙转化率变化;
(4)气化炉中H2的变化量约等于CO的变化量,当起始c(H2):c(CO)=3:2时,H2含量变化与CO含量变化关于含量y=25的直线对称;
(5)提高H2产量,应改变措施使反应①、②的平衡向正反应方向移动,结合平衡移动原理与反应特征分析解答;
(6)实现了吸收剂CaO的循环,降低了能耗;实现了能量自给,符合节能减排.(1)已知:①C(s)+H2O(g)=CO(g)+H2(g)△H=+131.6kJ•mol-1②CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41.2kJ•mol-1③CaO(s)+CO2(g)=CaCO3(s)△H=-178.3kJ•mol-1根据盖斯定律,①+②+③得C(s)+2H2O...
点评:
本题考点: 用盖斯定律进行有关反应热的计算;化学平衡的影响因素;化学平衡的调控作用.
考点点评: 本题考查反应热有关计算、化学平衡图象与影响因素等,难度中等,注意利用“先拐先平数值大”与“定一议二”分析化学平衡图象.1年前查看全部
- 为了普及氢动力汽车,科学家仍在不懈努力.据英国《新科学家》杂志报道,以色列科学家发明了一种车用制氢装置,装置中制氢气的原
为了普及氢动力汽车,科学家仍在不懈努力.据英国《新科学家》杂志报道,以色列科学家发明了一种车用制氢装置,装置中制氢气的原理:硼(B)和水在高温下反应,生成氢氧化硼[B(OH)3]和氢气.其反应的化学方程式为______________.
 老装甲兵1年前3
老装甲兵1年前3 -
 盟盟滴宝宝 共回答了25个问题
盟盟滴宝宝 共回答了25个问题 |采纳率96%分析:书写化学方程式时,必须熟悉反应物、生成物和反应条件,必须依据客观事实、遵守质量守恒定律.首先明确反应物及生成物.由“硼(B)和水在高温下反应”可得:反应物为:B H2O 由“生成氢氧化硼[B(OH)3]和氢气”得:生成物为B(OH)3 H2
下面,就是配平问题了.我们可用归一法做.设较复杂的B(OH)3 为“1”.我们要先配化合物,再配单质,因为化合物牵一发而动全身啊!因为反应物中有H单质,所以H可最后配平.我们可以发现,当H2O系数乘以3时,两边的O平衡,(而B本身就平衡,所以不用帮它配平了.)我们可以看见,此时反应物有6个H,生成物中有5个,因为H2O前已写上系数,所以它不能动了,应该改动生成物中的H,当H乘以3/2时,H也平衡了.到这里,所有的元素都配平了,但是计量系数不能为分数,根据等式中的等式基本性质,所以每个化合物前都要乘以最小公倍数2.
故该反应的化学方程式为:2B+6H2O 高温 . 2B(OH)3+3H2↑.
我做过,1年前查看全部
- (15分)甲烷是天然气、沼气、坑气及煤气的主要成分之一,可用作燃料及制造氢、一氧化碳、甲醛等物质的原料,其中用作制氢合成
(15分)甲烷是天然气、沼气、坑气及煤气的主要成分之一,可用作燃料及制造氢、一氧化碳、甲醛等物质的原料,其中用作制氢合成氨的工艺流程示意图如下:
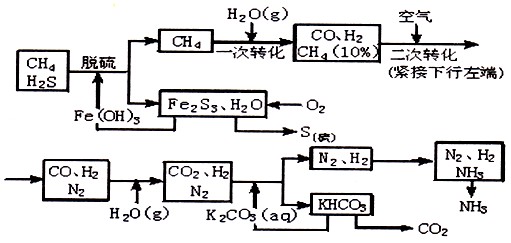
依据上述流程,完成下列填空:
(1)天然气脱硫时的化学方程式是_______________________________。
(2)n mol CH 4 经一次转化后产生CO 0.9n mol,产生H 2 _____________mol,假设后面几步转化各物质均完全反应,则理论上可制备得到氨气 mol(用含n的代数式表示)
(3)K 2 CO 3 (aq)和CO 2 反应在加压下进行,加压的理论依据是___________
A.相似相容原理 B.勒夏特列原理 C. 酸碱中和原理
(4)分析流程示意图回答,该合成氨工艺主要起始原料是 ,辅助原料有_________。
(5)整个流程有三处循环,一是Fe(OH) 3 循环,二是 循环,三是N 2 、H 2 循环。 deng36651年前1
deng36651年前1 -
 Joan110 共回答了16个问题
Joan110 共回答了16个问题 |采纳率93.8%(1)3H 2 S + 2Fe(OH) 3 ="=" Fe 2 S 3 + 6H 2 O (2分)
(2)2.7n, 2.5n (4分) (3)B (2分)
(4) CH 4 、H 2 O、空气; K 2 CO 3 ;Fe(OH) 3 (每个1分)(5)K 2 CO 3 (aq) (2分)
(1)流程图中已给出反应物是H 2 S和Fe(OH) 3 ,生成物是Fe 2 S 3 和H 2 O,CH 4 没有参与反应,所以天然气脱硫时的化学方程式为3H 2 S + 2Fe(OH) 3 ="=" Fe 2 S 3 + 6H 2 O。
(2)根据方程式CH 4 +H 2 O CO+3H 2 可知,生成CO 0.9n mol,则生成氢气水0.9n mol×3=2.7nmol。二次转化时,又生成0.1nmolCO,所以共计时nmolCO,和水蒸气反应又产生nmol氢气,因此总共生成3.7nmol氢气,所以生成氨气时3.7nmol×2÷3=2.5nmol。
CO+3H 2 可知,生成CO 0.9n mol,则生成氢气水0.9n mol×3=2.7nmol。二次转化时,又生成0.1nmolCO,所以共计时nmolCO,和水蒸气反应又产生nmol氢气,因此总共生成3.7nmol氢气,所以生成氨气时3.7nmol×2÷3=2.5nmol。
(3)CO 2 为气体,反应是体积减小的,所以加压有利于平衡右移,依据是勒夏特列原理,答案选B。
(4)根据流程示意图可知,该合成氨工艺主要起始原料是CH 4 、H 2 O、空气,而辅助原料是K 2 CO 3 、Fe(OH) 3 。
(5)合根据流程示意图可知,循环利用的物质除了氢氧化铁、氮气和氢气外,还有碳酸钾。1年前查看全部
- 如何利用电解水大量制氢
 ze0891年前2
ze0891年前2 -
 shararon 共回答了16个问题
shararon 共回答了16个问题 |采纳率87.5%用太阳能代替电
方程式为2H2O=催化剂、光照=2H2(上)+O2(上)
用电的话太慢了,还耗电,得不偿失1年前查看全部
- (2010•龙岩)金属氢化物如氢化钙(CaH2)、氢化钠(NaH)是一种重要的制氢剂,与水接触时,分别发生如下反应:
(2010•龙岩)金属氢化物如氢化钙(CaH2)、氢化钠(NaH)是一种重要的制氢剂,与水接触时,分别发生如下反应:
CaH2+2H2O=Ca(OH)2+2H2↑NaH+H2O=NaOH+H2↑
(1)若某化学反应需要消耗10g氢气,需要消耗多少克NaH?
(2)登山运动员登山时也需通过金属氢化物与水反应获得氢气以提供必须的能量.小红认为,若用CaH2替代NaH,有利于登山运动员减轻包袱负担.为什么? 阿珍20081年前1
阿珍20081年前1 -
 1207226 共回答了17个问题
1207226 共回答了17个问题 |采纳率94.1%解题思路:(1)10g氢气来自于氢化钠与水的反应,因此根据氢化钠与水反应的化学方程式可计算生成10g氢气需要消耗氢化钠的质量;
(2)比较生成相同质量的氢气消耗氢化钠与氢化钙的质量大小,就能得到减轻包袱负担的原因.(1)设制10g氢气需消耗氢化钠的质量为x
NaH+H2O=NaOH+H2↑
24 2
x 10g
24:2=x:10g
解之得 x=120g
答:制10g氢气需消耗氢化钠的质量为120g;
(2)设生成10g氢气需消耗氢化钙的质量为y
CaH2+2H2O=Ca(OH)2+2H2↑
42 4
y 10g
42:4=y:10g
解之得 y=105g
∵生成10g氢气需氢化钙105g,而需氢化钠却要120g
∴得到同样质量的氢气消耗氢化钙的质量小于氢化钠质量,因此,可以减轻包袱负担.点评:
本题考点: 根据化学反应方程式的计算;化学方程式的概念、读法和含义.
考点点评: 根据反应的化学方程式可知:消耗24份质量的氢化钠可得到2份质量的氢气,消耗42份质量的氢化钙就可得到4份质量的氢气,显然得到相同质量的氢气,消耗氢化钠的质量大于氢化钙的质量.1年前查看全部
- 下列措施不能达到节能减排目的是( ) A.利用太阳能制氢燃料 B.用家用汽车代替公交车 C.利用潮汐能发电 D.用节能
下列措施不能达到节能减排目的是( ) A.利用太阳能制氢燃料 B.用家用汽车代替公交车 C.利用潮汐能发电 D.用节能灯代替白炽灯  jiasi91281年前1
jiasi91281年前1 -
 guang126 共回答了23个问题
guang126 共回答了23个问题 |采纳率87%A、利用太阳能制氢燃料,是节能同时减少污染气体排放,故A能节能减排;
B、用家用汽车代替公交车,不能节能减排,反而增加了汽车尾气的排放,故B不能节能减排;
C、利用潮汐能发电,潮汐是一种绿色能源,利用潮汐发电,又可以节省资源,同时减少了气体的排放,故C能节能减排;
D、用节能灯代替白炽灯,消耗相同电力的条件下,节能灯的发光效率比白炽灯更高,能节能,间接减少污染气体排放,故D能节能减排;
故选B.1年前查看全部
- (2012•石景山区一模)氢化钙(CaH2)是一种重要的制氢剂,与水接触时,发生反应生成氢氧化钙和氢气.
(2012•石景山区一模)氢化钙(CaH2)是一种重要的制氢剂,与水接触时,发生反应生成氢氧化钙和氢气.
(1)写出该反应的化学方程式.
(2)若需要40g氢气,计算至少需要消耗氢化钙的质量. 娃哈哈fe5601年前1
娃哈哈fe5601年前1 -
 猛龙战机 共回答了27个问题
猛龙战机 共回答了27个问题 |采纳率85.2%解题思路:(1)根据反应物、生成物与反应条件书写化学方程式;
(2)可根据化学方程式进行计算,写出配平的化学方程式,找出氢气和氢化钙的质量比,列出比例式求解.【解】(1)反应物氢化钙和水生成物为氢氧化钙和氢气;反应条件为常温,
故化学方程式为:CaH2+2H2O═Ca(OH)2+2H2↑故答案为:CaH2+2H2O═Ca(OH)2+2H2↑
(2)设至少需要消耗氢化钙的质量为x.
CaH2+2H2O═Ca(OH)2+2H2↑
42 4
x 40g
[42/x=
4
40g]
x=420 g
答:需要消耗氢化钙的质量为420g点评:
本题考点: 根据化学反应方程式的计算;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题主要考查学生利用化学方程式进行简单计算的能力.试题比较简单,关键是要步骤规范,才能保证不失分.1年前查看全部
- 硫一碘循环分解水制氢主要涉及下列反应:
硫一碘循环分解水制氢主要涉及下列反应:
ⅠSO2+2H2O+I2═H2SO4+2HI
Ⅱ2HI H2+I2
H2+I2
Ⅲ2H2SO4═2SO2+O2+2H2O

(1)分析上述反应,下列判断正确的是______.
a.反应Ⅲ易在常温下进行b.反应Ⅰ中SO2氧化性比HI强
c.循环过程中需补充H2Od.循环过程中产生1mol O2的同时产生1mol H2
(2)一定温度下,向1L密闭容器中加入1mol HI(g),发生反应Ⅱ,H2物质的量随时间的变化如图所示.
0~2min内的平均反应速率v(HI)=______.该温度下,H2(g)+I2(g) 2HI(g)的平衡常数K=______.
2HI(g)的平衡常数K=______.
相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则______是原来的2倍.
a.平衡常数b.HI的平衡浓度c.达到平衡的时间d.平衡时H2的体积分数
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡______移动(填“向左”“向右”或者“不”);若加入少量下列试剂中的______,产生H2的速率将增大.
a.NaNO3 b.CuSO4c.Na2SO4d.NaHSO3
(4)以H2为燃料可制成氢氧燃料电池.
已知2H2(g)+O2(g)═2H2O(I)△H=-572KJ.mol-1某氢氧燃料电池释放228.8KJ电能时,生成1mol液态水,该电池的能量转化率为______. 傻大黑粗1年前1
傻大黑粗1年前1 -
 amaninbj 共回答了17个问题
amaninbj 共回答了17个问题 |采纳率88.2%解题思路:(1)根据已知的反应来分析物质的性质,并利用氧化还原反应来分析氧化性的强弱,利用三个已知反应可得到分解水制氢气的反应来解答;
(2)由图可知,2min内H2物质的量的变化量,然后计算化学反应速率,再利用化学反应速率之比等于化学计量数之比来解答;利用三段法计算平衡时各物质的浓度,根据平衡常数的表达式来计算即可;利用浓度对化学平衡的影响来分析HI的平衡浓度、达到平衡的时间、平衡时H2的体积分数,但温度不变,平衡常数不变;
(3)根据氢离子浓度的变化来分析水的电离平衡移动,并利用原电池原理来分析反应速率加快的原因;
(4)根据热化学反应方程式计算生成1mol水放出的能量,再利用燃料电池释放228.8KJ电能来计算电池的能量转化率.(1)因硫酸在常温下稳定,则反应Ⅲ常温下不发生,故a错;由反应Ⅰ可知,还原剂的还原性大于还原产物的还原性,则还原性SO2>HI,即SO2的氧化性比HI的弱,故b错;
由反应Ⅰ×2+Ⅱ×2+Ⅲ可得到2H2O═2H2+O2,则该循环中消耗水,需要及时补充水,故c正确;循环过程中产生1molO2的同时产生2molH2,故d错;故答案为:c;
(2)由图可知2min内氢气的物质的量增加了0.1mol,则氢气的浓度为[0.1mol/1L]=0.1mol/L,用氢气表示的化学反应速率为[0.1mol/L/2mim]=0.05mol/(L.min),
由反应中的化学计量数可知v(HI)为0.05mol/(L.min)×2=0.1mol/(L.min);
2HI(g) H2(g)+I2(g)
H2(g)+I2(g)
开始浓度 1molL 0 0
转化浓度 0.2mol/L 0.1mol/L 0.1mol/L
平衡浓度 0.8mol/L 0.1mol/L 0.1mol/L
则该温度下K1=
0.1mol/L×0.1mol/L
(0.8mol/L)2=[1/64],
又 2HI(g) H2(g)+I2(g)与H2(g)+I2(g)
H2(g)+I2(g)与H2(g)+I2(g) 2HI(g)互为逆反应,则它们的化学平衡常数的乘积等于1,
2HI(g)互为逆反应,则它们的化学平衡常数的乘积等于1,
即H2(g)+I2(g) 2HI(g)的化学平衡常数K=[1
2HI(g)的化学平衡常数K=[1
K1=64,
对该反应,当温度不变开始加入HI(g)的物质的量是原来的2倍,则温度不变,K不变,故a错;物质的量为原来的2倍,该反应是反应前后气体体积相等的反应,
则反应体系中各物质的浓度都是原来的2倍,故b正确;物质的量增大,则化学反应速率先增大的快,后随浓度的减小,速率增大的程度变小,故c错;
由反应方程式及原来的量与后来的量成正比,则这两种情况下建立的平衡为等效平衡,即平衡时H2的体积分数相同,故d错;
故答案为:0.1mol/L.min;64;b;
(3)由水的电离平衡为H2O⇌H++OH-,则硫酸电离出的c(H+)对水的电离起抑制作用,当Zn消耗了H+,c(H+)减小,水的电离平衡向右移动;若加入NaNO3,溶液
具有硝酸的强氧化性,则不会生成氢气;加入NaHSO3会和H+反应,降低c(H+),则反应速率减慢;Na2SO4 的加入,离子不参与反应,则对化学反应速率无影响;
加入CuSO4 后,Zn与硫酸铜溶液反应置换出Cu,则构成原电池加快了化学反应速率,故答案为:向右;b;
(4)由2H2(g)+O2(g)═2H2O(I)△H=-572KJ.mol-1可知,生成1mol水时放出的热量为572KJ×
1/2]=286KJ,
则电池的能量转化率为为[228.8KJ/286KJ]×100%=80%,故答案为:80%.点评:
本题考点: 物质的量或浓度随时间的变化曲线;氧化性、还原性强弱的比较;化学电源新型电池;化学反应速率的概念;化学平衡移动原理.
考点点评: 本题较复杂,考查的知识点多,注重了基础知识和基本技能的训练,同时体现新课程改革的指导思想,明确氧化还原反应、平衡移动、电化学的知识点是解答本题的关键.1年前查看全部
- 电解制氢方法中,电解槽氧出口总管的地方总是容易泄漏,为什么?
 崇尚ll1年前1
崇尚ll1年前1 -
 拼车一族 共回答了24个问题
拼车一族 共回答了24个问题 |采纳率95.8%氧气浓度很好,且有电场存在很容易发生氧化反应,对设备腐蚀很严重1年前查看全部
- 电解制氢正极用铝负极用铁行吗?
 xwsage1年前1
xwsage1年前1 -
 媚姿 共回答了21个问题
媚姿 共回答了21个问题 |采纳率85.7%不行,铁是活泼金属1年前查看全部
- 电解水制氢为什么加碱
 毛无牙1年前1
毛无牙1年前1 -
 一双筷子走ll 共回答了23个问题
一双筷子走ll 共回答了23个问题 |采纳率73.9%纯水的导电性弱,实验现象不明显,无法制的较多的氢气,所以用强电解质,如碱来增加导电性.1年前查看全部
- 以甲烷为原料制取氢气是工业上常用的制氢方法,则CH4与H2O反应生成CO2和H2的热化学方程式
 小吉安1年前1
小吉安1年前1 -
 ZQWSW 共回答了16个问题
ZQWSW 共回答了16个问题 |采纳率93.8%你是在问那个热化学方程式怎么写吗?1年前查看全部
- 电解水制氢反应慢,其中原因是?
 用户名是柠檬草1年前1
用户名是柠檬草1年前1 -
 wangqunpj 共回答了15个问题
wangqunpj 共回答了15个问题 |采纳率93.3%你用的水较为纯净,而纯净的水中缺少能自由移动的离子,导电性不好.
应在其中加入少量的硫酸或氢氧化钠(就这两样,若是其他的离子化合物的话会发生发应的),这样水中有自由移动的离子,水导电性强,反应速率就加快了.1年前查看全部
- 电解水制氢设备价格?每小时产生300立方氢气
 vivianhai1年前2
vivianhai1年前2 -
 -冰点- 共回答了20个问题
-冰点- 共回答了20个问题 |采纳率100%这个问题不太好回答,要看你什么样的配置.你需要的氢气纯度高不高,一般估计的三百万到四百万吧.1年前查看全部
- 1氢气是未来理想的能源,其突出的优点是()、()、().目前不能推广使用的原因是().理想的制氢方法是().
1氢气是未来理想的能源,其突出的优点是()、()、().目前不能推广使用的原因是().理想的制氢方法是().
2化学电池是把()直接转化为()的装置,其优点()、()、()等 kentrue1年前1
kentrue1年前1 -
 未清123456 共回答了15个问题
未清123456 共回答了15个问题 |采纳率80%1.易燃烧,产生热量大,清洁
制取成本高和储存困难 电解水
2.化学能 电能
能量转化效率高,洁净,噪声低造价小1年前查看全部
- 英语翻译针对车载二甲醚水蒸气重整制氢反应体系,计算了反应体系中主要反应的化学平衡常数随温度的变化关系;确立了反应体系的独
英语翻译
针对车载二甲醚水蒸气重整制氢反应体系,计算了反应体系中主要反应的化学平衡常数随温度的变化关系;确立了反应体系的独立方程并进行了热力学平衡计算,研究了水醚比、温度、压力等对平衡的影响.结果表明,发动机的排气温度能够满足二甲醚水蒸气重整所需要的温度,并且在温度大于473K、水醚比为2~4、常压条件下能够获得较高的二甲醚转化率和氢气产率.重整气中主要包含氢气、二氧化碳和过量的水,还含有少量的一氧化碳. 逸盫1年前2
逸盫1年前2 -
 l_nn 共回答了20个问题
l_nn 共回答了20个问题 |采纳率85%According to the steam reforming of dimethyl ether hydrogen reaction system,the calculation of main reaction in the reaction system chemical equilibrium constant temperature relations; Established the reaction system independent equation and thermodynamic equilibrium calculation,the ether,temperature,water than pressure on the influence of the balance.The results show that the engine exhaust temperature can meet steam reforming of dimethyl ether to temperature,and in the temperature than 473 K,water ether than for 2 4,atmospheric pressure conditions can obtain higher dimethyl ether conversion and hydrogen production rate.Reforming gas hydrogen,carbon dioxide,mainly includes and excess water,still contain a small amount of carbon monoxide.1年前查看全部
- 电解水制氢实验电流20A安全吗?电压3伏 或者12伏10A 既安全速度又快的电流电压要多少?
 Nancy631年前2
Nancy631年前2 -
 一箭穿 共回答了16个问题
一箭穿 共回答了16个问题 |采纳率87.5%36V以下的电压是属于安全电压,电流强度不能太大,否则容易灼伤.导线可以粗一些,用作电极的锌皮可以宽一些,可以增加与水的接触面积,有利于加快制造氢气.1年前查看全部
- 硫--碘循环分解水制氢主要涉及下列反应:
 硫--碘循环分解水制氢主要涉及下列反应:
硫--碘循环分解水制氢主要涉及下列反应:
I、SO2+2H2O+I2=H2SO4+2HIⅡ、2HI⇌H2+I2Ⅲ、2H2SO4=2SO2+O2+2H2O
(1)分析上述反应,下列判断正确的是______
a.反应III易在常温下进行
b.反应I中SO2氧化性比HI强
c.循环过程中需补充H2O
d.循环过程中产生1molO2的同时产生1molH2
(2)一定温度下,向1L密闭容器中加入1molHI(g),发生反应II,H2物质的量随时间的变化如图所示.
0-2min内的平均反应速率v(HI)=______;该温度下,H2(g)+I2(g)⇌2HI(g)的平衡常数K=______.相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则______是原来的2倍.
a.平衡常数b.HI的平衡浓度c.达到平衡的时间d.平衡时H2的体积分数
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡______ 移动(填“向左”“向右”或“不”);若加入少量下列试剂中的______,产生H2的速率将增大.
A.NaNO3b.CuSO4c.Na2SO4d.NaHSO3. lithylq1年前1
lithylq1年前1 -
 凌小石 共回答了19个问题
凌小石 共回答了19个问题 |采纳率94.7%解题思路:(1)a.硫酸常温下,不易分解.
b.反应中二氧化硫表现还原性,氧化性比HI强.
c.1molSO2消耗2molH2O生成1molH2SO4,1molH2SO4分解生成1molSO2与1molH2O.
d.由Ⅲ可知产生lmolO2的同时产生2molSO2,由I可知2molSO2生成4molHI,由Ⅱ可知4molHI分解生成2mol H2.
(2)由图可知,2min内H2物质的量的变化量,然后计算化学反应速率,再利用化学反应速率之比等于化学计量数之比来解答;根据反应方程式写平衡表达式,结合平衡浓度计算平衡常数,化学方程式改变方向,平衡常数互为倒数;利用浓度对化学平衡的影响来分析HI的平衡浓度、达到平衡的时间、平衡时H2的体积分数,但温度不变,平衡常数不变;
(3)实验室用Zn和稀硫酸制取H2,随反应进行氢离子浓度减小,反应时溶液中水的电离平衡正向进行;依据影响化学反应速率因素分析判断增大反应速率的试剂,注意原电池反应的分析判断.(1)a.硫酸常温下温度,不易分解,故a错误;b.反应中二氧化硫表现还原性,还原性比HI强,碘单质氧化性大于二氧化硫,故b错误;c.1molSO2消耗2molH2O生成1molH2SO4,1molH2SO4分解生成1molSO2与1molH2O,循环中水...
点评:
本题考点: 化学平衡的计算;化学反应速率的影响因素.
考点点评: 本题主要考查了反应方程式的分析及计算,反应平衡图象,平衡常数、反应速率概念计算应用,难度中等.对于图象,要看清图象的含义、拐点、平衡点,结合平衡移动规律进行判断.1年前查看全部
- 电解水制氢,电极选择哪种材料好?制氢快?
电解水制氢,电极选择哪种材料好?制氢快?
电解水所用材料:
1、电解质(稀硫酸、食盐水……)
2、电极材料(铜、铁、锌、石墨)
3、电流(DC12,V9A.DC12V,35A) 清水无香0001年前1
清水无香0001年前1 -
 hssm 共回答了15个问题
hssm 共回答了15个问题 |采纳率73.3%1.电解质用稀硫酸
2.电极材料用惰性电极石墨.
3.电解水最好用直流电源,电流越大越好.既DC12V,35A.1年前查看全部
- 金属氢化物如氢化钙(CaH2)、氢化钠(NaH)是一种重要的制氢剂,与水接触时,分别发生如下反应:
金属氢化物如氢化钙(CaH2)、氢化钠(NaH)是一种重要的制氢剂,与水接触时,分别发生如下反应:
CaH2+2H2O=Ca(OH)2+2H2↑NaH+H2O=NaOH+H2↑
(1)若某化学反应需要消耗10g氢气,需要消耗多少克NaH?
(2)登山运动员登山时也需通过金属氢化物与水反应获得氢气以提供必须的能量.小红认为,若用CaH2替代NaH,有利于登山运动员减轻包袱负担.为什么? 西塞山前桃花流水1年前3
西塞山前桃花流水1年前3 -
 如雪如梅18 共回答了22个问题
如雪如梅18 共回答了22个问题 |采纳率95.5%解题思路:(1)10g氢气来自于氢化钠与水的反应,因此根据氢化钠与水反应的化学方程式可计算生成10g氢气需要消耗氢化钠的质量;
(2)比较生成相同质量的氢气消耗氢化钠与氢化钙的质量大小,就能得到减轻包袱负担的原因.(1)设制10g氢气需消耗氢化钠的质量为x
NaH+H2O=NaOH+H2↑
24 2
x 10g
24:2=x:10g
解之得 x=120g
答:制10g氢气需消耗氢化钠的质量为120g;
(2)设生成10g氢气需消耗氢化钙的质量为y
CaH2+2H2O=Ca(OH)2+2H2↑
42 4
y 10g
42:4=y:10g
解之得 y=105g
∵生成10g氢气需氢化钙105g,而需氢化钠却要120g
∴得到同样质量的氢气消耗氢化钙的质量小于氢化钠质量,因此,可以减轻包袱负担.点评:
本题考点: 根据化学反应方程式的计算;化学方程式的概念、读法和含义.
考点点评: 根据反应的化学方程式可知:消耗24份质量的氢化钠可得到2份质量的氢气,消耗42份质量的氢化钙就可得到4份质量的氢气,显然得到相同质量的氢气,消耗氢化钠的质量大于氢化钙的质量.1年前查看全部
- PSA装置的英文PSA是哪几个单词的缩写PSA是一个制氢装置,炼油厂用得比较多。
 ediosntian1年前2
ediosntian1年前2 -
 析析yl 共回答了19个问题
析析yl 共回答了19个问题 |采纳率73.7%楼上那位是网站翻译的吧?被骂的好搞笑啊~
楼主,恰好本人工作跟其有关,本人给你正
PSA是英文名称(Pressure Swing Adsorption)的缩写,也叫变压吸附法
目前中小型合成氨厂采用最多的是单纯CO2获得净化气的PSA装置,以替代传统的湿法脱碳.变换气经PSA脱碳后净化气中的CO2含量小于0.2%,直接进精炼工序.此类装置运行情况,氢回收率大于97%,净化气中倾氮比在3.0左右,并且在脱除CO2的同时,还将大部分杂质脱除,减小了后续工段的负担.
非在线翻译,1年前查看全部
- 据人民网报道,有一集团拟将在太空建立巨大的集光装置,把太阳光变成激光用于分解海水制氢,其反应可表示为:2H2O
据人民网报道,有一集团拟将在太空建立巨大的集光装置,把太阳光变成激光用于分解海水制氢,其反应可表示为:2H2O
2H2↑+O2↑.有下列几种说法:TiO2 .激光
①水分解反应是放热反应;
②氢气是一级能源;
③使用氢气作燃料有助于控制温室效应;
④若用生成的氢气与空气中多余的二氧化碳反应生成甲醇储存起来,可改善生存条件.
其中叙述正确的是( )
A.①②
B.②③
C.③④
D.①②③④ 寒夜独醉1年前1
寒夜独醉1年前1 -
 luozhen1030 共回答了20个问题
luozhen1030 共回答了20个问题 |采纳率95%解题思路:①水分解反应是吸热反应;
②能源可划分为一级能源和二级能源,自然界中以现成形式提供的能源称为一级能源;需要依靠其它能源的能量间接制取的能源称为二级能源;
③氢气作燃料燃烧产物为水,温室效应与二氧化碳的排放有关;
④CO2+3H2
CH3OH+H2O,可减少二氧化碳的排放,同时储存能源.钌−膦鉻合物 .加压 ①把太阳光变成激光用于分解海水制氢,太阳光提供能量,所以,水分解反应是吸热反应,故①错误;
②自然界中没有现存的氢气,把太阳光变成激光用于分解海水制氢,说明氢气为二级能源,故②错误;
③温室效应产生的原因是二氧化碳的增多,使用氢气作燃料2H2+O2
点燃
.
2H2O,能减少二氧化碳的含量,有助于控制温室效应,故③正确;
④甲醇是重要的化工原料,也可作燃料,CO2+3H2
钌−膦鉻合物
.
加压CH3OH+H2O,可减少二氧化碳的排放,同时储存能源,可改善生存条件,故④正确;
故选C.点评:
本题考点: 使用化石燃料的利弊及新能源的开发.
考点点评: 本题主要考查了海水制氢,了解能源分类、温室效应抓住题干信息结合相关知识分析是解答的关键,题目难度不大.1年前查看全部
- 电解尿素( CO(NH2)2 )的碱性溶液制氢的装置中,电解时,阴极、阳极的电极反应式分别是什么?
 More20031年前1
More20031年前1 -
 韩庚加油 共回答了10个问题
韩庚加油 共回答了10个问题 |采纳率80%阳极:CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O
阴极:6H2O + 6e-= 3H2↑ +6OH-1年前查看全部
大家在问
- 1用方程式解释BaCO3能溶于酸而BaSO4不能
- 2在298K,100KPa时,500L的容器中能容纳H2的质量?
- 3水结成冰后体积增加了[1/11],冰融化成水后,体积减少( )
- 4在括号内填从4到23的不同的整数,使等式成立:1=1/3+1/( )+1/( )+1/( )+1/( )+1/( )+1
- 5punch-list
- 6(2012•长沙模拟)下列不属于变态发育的动物是( )
- 7有四个有理数:2,3,8,12,将这四个数(每个数只能用一次),进行加减乘除乘方运算,使其得24,算式是什么?
- 8求13题答案及解析
- 9下列关于氧气化学性质的叙述,不正确的是( )
- 10怎么了?的句型(英语)
- 11如图,三角形abc和三角形a'b’c’都是锐角三角形,cd,c'd'分别是高,且ac等于a'c'
- 12请教5道地理题15、16、17、19、20题,具体方法是什么?
- 13B[X/X平方-6X加9大于0]怎么算
- 14一道关于平方根的题已知a是√7的小数部分,b是5-√7的小数部分,求2a+3b的值
- 151.某工程队招聘甲.乙两种工人150人,甲乙两种工人每人每月的工资分别是600元和1000元,可是要求乙种工人人数不少于
