将7.0g的铜银合金溶解在一定量的浓硝酸中,放出的混合气体和0.56L的氧气混合,通入水中恰好完全被吸收
 sean器2022-10-04 11:39:543条回答
sean器2022-10-04 11:39:543条回答则铜银合金中铜的质量是( )
A.1.6g B.2.4g C.3.2g D.4.8g
要详细解题过程.

已提交,审核后显示!提交回复
共3条回复
 cxh_cher 共回答了17个问题
cxh_cher 共回答了17个问题 |采纳率100%- 解析:设铜银合金中铜和银的质量分别为X ,Y 克
质量守恒:X + Y = 7 ----------------------------------------1
得失电子守恒:2* X/64 + 1*Y /108 = 0.56/22.4*4 -------------2
由1和2式可得:X = 1.6(g) Y= 5.4(g)
所以选A. - 1年前
 花开的声音_小草 共回答了184个问题
花开的声音_小草 共回答了184个问题 |采纳率- A
- 1年前
 ygp12 共回答了9540个问题
ygp12 共回答了9540个问题 |采纳率0.2%- m=64*0.56*2/22.4=3.2g
C - 1年前
相关推荐
- (2005•西城区二模)某课外小组欲用化学方法测定铜合金中铜的质量分数.现有待测的铜锌合金和铜银合金,实验室仅提供稀盐酸
(2005•西城区二模)某课外小组欲用化学方法测定铜合金中铜的质量分数.现有待测的铜锌合金和铜银合金,实验室仅提供稀盐酸和常用的仪器.
(1)你认为能够测出其铜的质量分数的是______合金.
(2)取该合金粉末32.5g,与足量的稀盐酸充分反应,得到0.4g气体.请计算该合金中铜的质量分数. 火毒amanne1年前1
火毒amanne1年前1 -
 新鹏 共回答了21个问题
新鹏 共回答了21个问题 |采纳率90.5%(1)在金属活动顺序中,铜在氢后,不与稀酸发生反应,锌在氢前,能与稀酸发生反应,因而铜锌合金能测定出铜的质量分数;而银在氢后,也不与稀酸发生反应,因而铜银合金不能测定出铜的质量分数;
(2)设合金中锌的质量为x,则:
Zn+2HCl═ZnCl2+H2↑
65 2
x 0.4g
[65/2=
x
0.4g]
解得:x=13g
所以铜锌合金中铜的质量分数为:[32.5g−13g/32.5g]×100%=60%.
答:该合金中铜的质量分数为60%.
故答案为:(1)铜锌;
(2)60%.1年前查看全部
- 六年级优化题一块铜银合金重810克,其中铜的质量是因质量的七分之二,求合金中铜、银各有多少千克
 kathyqianqian1年前1
kathyqianqian1年前1 -
 d1sha 共回答了16个问题
d1sha 共回答了16个问题 |采纳率81.3%设银的质量为X,
那么铜的质量为2/7X:
X+2/7X=810
x=810 /(9/7)
X=630(克) (银的质量)
铜的质量是:630*(2/7)=180(克)1年前查看全部
- Cu,Ag与浓硝酸反应30g铜银合金与80ML 13.5mol/L的HNO3反应,待铜银合金完全反应后,标准情况下产生6
Cu,Ag与浓硝酸反应
30g铜银合金与80ML 13.5mol/L的HNO3反应,待铜银合金完全反应后,标准情况下产生6.72L气体,溶液中H+的浓度变为1mol/L,求铜和银的质量(反应前后溶液质量不变) xagon1年前2
xagon1年前2 -
 zg8016 共回答了19个问题
zg8016 共回答了19个问题 |采纳率94.7%物质守恒,生成气体无论是NO2还是NO,均与被还原HNO3等物质的量.
1.被还原硝酸的物质的量即生成气体的物质的量,即6.72/22.4=0.3mol.
2.剩余硝酸的浓度=10^0=1mol/L,反应的硝酸为(13.5-1)*0.08=1mol.设合金中Ag、Cu的物质的量分别为x、y,则
108x+64y=30g---1
未被还原的硝酸最后以AgNO3,Cu(NO3)2形式存在,有x+2y,被还原硝酸的物质的量为0.3mol,总的参加反应的硝酸为1mol,得
x+2y+0.3=1---2
1.2联立,解得x=0.1mol、y=0.3mol
合金中银的质量分数 0.1*108/30=36%
所以铜的质量是19.2克,银是10.8克1年前查看全部
- 为了测定某铜银合金的成分,将30.0g的合金完全溶于80mL 13.5mol/L的浓HNO3中,待合金完全溶解后,收集到
为了测定某铜银合金的成分,将30.0g的合金完全溶于80mL 13.5mol/L的浓HNO3中,待合金完全溶解后,收集到气体6.72L(标准状况),并测得溶液的PH=0.假设反应后的溶液体积仍为80mL.试计算:
1.被还原的HNO3的物质的量
2.合金中银的质量分数
求解~~详细过程……
我有两个问题:1.问题中有铜和HNO3反应,银和HNO3反应,有没有Cu把AgNO3置换的反应呢?
2.生成的气体为什么是NO,NO2的混合气体而不是纯NO2呢?
 想象中的1年前1
想象中的1年前1 -
 内衣紫色 共回答了14个问题
内衣紫色 共回答了14个问题 |采纳率85.7%1n(NO NO2)=67.2/22.4=0.3mol=n(HNO3)被还原
你的问题 下面有人说了 我就不回答了
忘了 还有第二问的
2、根据H+ 这种最简单 个人认为 嘿嘿
Agxg Cu30-xg
x/108*1+(30-x)/64*2+0.3=1 x=10.8g 下面你会了瓦1年前查看全部
- (2014•徐汇区一模)为了测定某铜银合金成分,将30g合金完全溶于80mL13.5mol/L的浓硝酸中,待反应完全后,
(2014•徐汇区一模)为了测定某铜银合金成分,将30g合金完全溶于80mL13.5mol/L的浓硝酸中,待反应完全后,收集到0.3mol气体,并测得溶液中c(H+)是1mol/L.假设反应后溶液体积仍为80mL,则合金中银的质量分数为( )
A.36%
B.66.3%
C.78.7%
D.96.6% xulu1年前1
xulu1年前1 -
 窗帘盒 共回答了23个问题
窗帘盒 共回答了23个问题 |采纳率95.7%解题思路:30gCu、Ag合金完全溶于80mL13.5mol/L的浓硝酸中,待反应完全后,收集到0.3mol气体,并测得溶液中c(H+)=1mol/L,说明硝酸有剩余,还原产物为NO2或NO、NO2的混合物,因此被还原的硝酸的物质的量即为气体的物质的量为0.3mol,参加反应的硝酸为13.5molLL×0.080L-1mol/L×0.080L=1mol,设合金中铜为xmol,银为ymol,根据二者质量之和及N原子守恒列方程计算,进而计算合金中Ag的质量分数.30gCu、Ag合金完全溶于80mL13.5mol/L的浓硝酸中,待反应完全后,收集到0.3mol气体,并测得溶液中c(H+)=1mol/L,说明硝酸有剩余,还原产物为NO2或NO、NO2的混合物,因此被还原的硝酸的物质的量即为气体的物质的量为0.3mol,参加反应的硝酸为13.5molLL×0.080L-1mol/L×0.080L=1mol,
设合金中铜为xmol,银为ymol,则:
根据二者质量,有:64x+108y=30
根据N原子守恒,有:2x+y+0.3=1
联立方程,解得x=0.3,y=0.1,
故合金中Ag的质量分数=[0.1mol×108g/mol/30g]×100%=36%
故选A.点评:
本题考点: 有关混合物反应的计算.
考点点评: 本题考查混合物的有关计算,注意利用守恒法进行计算,侧重方法技巧与学生思维能力的考查,难度中等.1年前查看全部
- (2011•湖南模拟)将14g铜银合金与足量的一定浓度的硝酸溶液反应,把放出的气体与标准状况下体积为1.12L的O2混合
(2011•湖南模拟)将14g铜银合金与足量的一定浓度的硝酸溶液反应,把放出的气体与标准状况下体积为1.12L的O2混合后再通入水中,恰好全部被吸收,则合金中铜的质量为( )
A.3.2g
B.4.8g
C.6.4g
D.10.8g 风云傲雨1年前1
风云傲雨1年前1 -
 13306838 共回答了17个问题
13306838 共回答了17个问题 |采纳率88.2%解题思路:铜、银与硝酸反应生成硝酸铜、硝酸银与氮的氧化物,氮的氧化物与氧气、水反应生成硝酸,纵观整个过程,金属提供的电子等于氧气获得的电子,根据二者质量与电子转移列方程计算.铜、银与硝酸反应生成硝酸铜、硝酸银与氮的氧化物,氮的氧化物与氧气、水反应生成硝酸,纵观整个过程,金属提供的电子等于氧气获得的电子,
n(O2)=[1.12L/22.4L/mol]=0.05mol,
设Cu、Ag的物质的量分别为x、y,则:
根据质量列方程:x×64g/mol+y×108g/mol=14g
根据电子守恒列方程:2x+1×y=0.05mol×4
解得:x=0.05mol;y=0.1mol
m(Cu)=0.05mol×64g/mol=3.2g,
故选A.点评:
本题考点: 有关混合物反应的计算.
考点点评: 本题考查混合物计算、氧化还原反应的有关计算,难度中等,根据始态终态法判断金属提供的电子等于氧气获得的电子是关键,注意氧化还原反应中守恒思想的运用.1年前查看全部
- 小华欲测定铜锌合金及铜银合金中铜的质量分数,实验室只提供一瓶未标明浓度的稀盐酸和必要地仪器。
小华欲测定铜锌合金及铜银合金中铜的质量分数,实验室只提供一瓶未标明浓度的稀盐酸和必要地仪器。
(1)你认为能测出铜的质量分数的合金是________
(2)小华取65g该合金的粉末与足量稀盐酸充分反应,经测定知反应产生了0.4g气体,则该合金中铜的质量分数是_________
(3)要得到干燥、纯净的铜,需要用到的仪器有_________
A量筒 B漏斗 C烧杯 D玻璃棒
E酒精灯 F托盘天平 G铁架台(带铁夹) H铁架台(带铁圈)
 尘封书页1年前1
尘封书页1年前1 -
 sung60 共回答了21个问题
sung60 共回答了21个问题 |采纳率90.5%(1)铜锌合金
(2)0.8
(3)BCDEH1年前查看全部
- (2010•南通一模)某研究性学习小组拟通过铜银合金与浓硝酸的反应,测定该合金的组成.考虑到NO2的聚合,该小组同学查阅
(2010•南通一模)某研究性学习小组拟通过铜银合金与浓硝酸的反应,测定该合金的组成.考虑到NO2的聚合,该小组同学查阅到下列资料:
17℃、1.01×105Pa,2NO2(g)⇌N2O4(g) 的平衡常数K=13.3,该条件下密闭容器中N2O4 和NO2的混合气体达到平衡时c(NO2)=0.0300mol•L-1.
(1)此时平衡混合气体中c(N2O4)=______(保留两位有效数字,下同).
(2)17℃、1.01×105Pa时,将12.44g合金放入足量浓硝酸中,待合金完全溶解后,收集到NO2和N2O4的混合气体5.00L.
①根据平衡体系中NO2和N2O4的物质的量浓度,计算5.00L气体中NO2、N2O4的物质的量分别为______、______.
②计算合金中银的质量分数.______. MEIMEI11221年前1
MEIMEI11221年前1 -
 水若禅心 共回答了17个问题
水若禅心 共回答了17个问题 |采纳率88.2%解题思路:(1)根据题中的信息17℃、1.01×105Pa,2NO2(g)⇌N2O4(g) 的平衡常数K=13.3,该条件下密闭容器中N2O4 和NO2的混合气体达到平衡时c(NO2)=0.0300mol•L-1.结合化学平衡常数,计算平衡状态下
c(N2O4).
(2)根据题中的信息,利用物质的量浓度、体积与物质的量的关系式:c=[n/V]解决;原子守恒、氧化还原反应中转移电子相等,Cu→Cu2+,1mol铜失去2mol电子,Ag→Ag+,1mol银失去1mol电子,结合化学反应方程式的计算;混合物中某种成分质量分数的求算关系式解决.根据2NO2(g)⇌N2O4(g) 的平衡常数K=13.3,该条件下密闭容器中N2O4 和NO2的混合气体达到平衡时c(NO2)=0.0300mol•L-1,K=
c(N2O4)
c2(NO2),c(N2O4)=K×(0.03)2mol•L=0.012mol•L-1
故答案为:0.0120 mol•L-1
(2)①根据题中的信息,c(NO2)=0.0300mol•L-1,及(1)中的计算结果c(N2O4)=0.012mol•L-1
体积为5.00L,计算的n(NO2)=0.0300mol•L-1•5.00L=0.15mol;
n(N2O4)=0.012mol•L-1×5.00L=0.06mol
故答案为:0.15mol0.06mol
②设合金中Cu、Ag的物质的量分别为xmol、ymol.根据氧化还原反应中氧化剂得到的电子的总量与还原剂失去的电子的总量相等,则有:
64x+108y=12.44
2x+y=0.15+0.06×2
解得:x=0.11mol,y=0.05mol
m(Ag)=0.05mol×108g/mol=5.4g
w(Ag)=[5.4g/12.44g]×100%=43.4%
故答案为:43.4%点评:
本题考点: 化学平衡的计算.
考点点评: 本题将氧化还原反应,化学平衡的计算,物质的量浓度,混合物中某成分的质量分数的计算结合在一起,形成的一道综合题,解决时需要见这些知识点有机的结合在一起,特别是氧化还原反应中得失电子相等,要应用好,此处容易出错.1年前查看全部
- 一块铜银合金重810g,其中,铜的质量是银的质量的2/7,求合金中铜、银各有多少克?
一块铜银合金重810g,其中,铜的质量是银的质量的2/7,求合金中铜、银各有多少克?
要式子、过程,不要方程,快些,
铜的质量是银的质量的七分之二 hougao1年前1
hougao1年前1 -
 沙漠中的独峰驼 共回答了21个问题
沙漠中的独峰驼 共回答了21个问题 |采纳率90.5%银的质量=810/(1+2/7)=630 克
铜的质量=810-630=180 克1年前查看全部
- 将14g铜银合金和足量的HNO3反映,放出的气体与标准状况下的气体1.12L的O2混合后再
将14g铜银合金和足量的HNO3反映,放出的气体与标准状况下的气体1.12L的O2混合后再
将14g铜,银合金与足量的某浓度的HNO3反应,将放出的气体与1.12L(标况)O2混合,通入到水中,恰好完全吸收.
1 则合金中铜的质量为——?
若所用硝溶液为40ml,刚好完全反应,试确定其物质的量浓度可能范围?
为什么要用 NO和NO2 确定范围哪?
NO又是哪里来的哪? 575639891年前1
575639891年前1 -
 emb001com 共回答了12个问题
emb001com 共回答了12个问题 |采纳率83.3%根据得失电子守恒
设合金中铜有Xmol 银有ymol
64x+108y=14
2x+y=1.12/22.4*4
x=0.05mol
y=0.1mol
铜的质量为=0.05*64=3.2g
Cu(NO3)2 AgNO3
4NO2+O2+2H2O===4HNO3
则硝酸的浓度为=(0.05*2+0.1+0.05*4)/0.04=10mol/L
4NO+3O2+2H2O====4HNO3
则硝酸的浓度为=(0.05*2+0.1+0.05*4/3)/0.04=20/3mol/L
硝酸浓度的范围(20/3---10)mol/L1年前查看全部
- 17.2克的铜银合金与100毫升的稀硝酸反应生成2.24升NO (1)求该稀硝酸物质的量浓度 (2
17.2克的铜银合金与100毫升的稀硝酸反应生成2.24升NO (1)求该稀硝酸物质的量浓度 (2
17.2克的铜银合金与100毫升的稀硝酸反应生成2.24升NO
(1)求该稀硝酸物质的量浓度
(2)用上述稀硝酸最多溶解铁的质量是多少 华侨0011年前1
华侨0011年前1 -
 梦泽青云 共回答了20个问题
梦泽青云 共回答了20个问题 |采纳率75%(你没有说稀硝酸是否完全反应完,如果稀硝酸过量,则没法求,所以我就当作稀硝酸被消耗完了来做)
(1)
Cu和Ag与稀硝酸反应的化学方程式:
3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
3Ag+4HNO3=3AgNO3+NO↑+2H2O
观察2个反应式的右边,发现每生成2个No,会生成3Cu(NO3)2;生成1个No,生成3个3AgNO3.
即不管是哪个反应,生成No和NO3的比例都是1:3
2.24L NO在标况下是0.1mol
所以 NO3是0.3mol.
由于 稀硝酸完全转化为NO3和NO,所以稀硝酸有0.4mol
所以稀硝酸物质的量浓度为0.4/0.1=4mol/L
(2)
铁和稀硝酸反应:
少量铁:Fe+4HNO3(稀)==Fe(NO3)3+NO↑+2H2O
过量铁:3Fe+8HNO3(稀)==3Fe(NO3)2+2NO↑+4H2O
求最多溶解铁的量,所以应该按照第二个反应式来求
铁的质量M=56×3/8×0.4=8.4g1年前查看全部
- 铜银合金与硝酸5.6g铜银合金与一定量浓硝酸反应,随着反应进行,硝酸浓度降低,生成气体的颜色变浅当铜反应完毕时收集到NO
铜银合金与硝酸
5.6g铜银合金与一定量浓硝酸反应,随着反应进行,硝酸浓度降低,生成气体的颜色变浅当铜反应完毕时收集到NO2,NO的体积均为448ml,求铜和银的质量
 两条鱼05511年前1
两条鱼05511年前1 -
 dick5 共回答了16个问题
dick5 共回答了16个问题 |采纳率81.3%448ml气体就是0.448/22.4=0.02mol Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O1 2x 0.02x=0.01 mol 3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O3 ...1年前查看全部
- 为了测定某铜银合金的成分,将30.0g的合金完全溶于80mL 13.5mol/L的浓HNO3中,待合金完全溶解后,收集到
为了测定某铜银合金的成分,将30.0g的合金完全溶于80mL 13.5mol/L的浓HNO3中,待合金完全溶解后,收集到气体6.72L(标准状况),并测得溶液的PH=0.假设反应后的溶液体积仍为80mL.试计算:1.被还原的HNO3的物质的量 2.合金中银的质量分数 我想问问为什么告诉PH=0 就可以知道n(H+)=1mol/L
 kingrj1年前1
kingrj1年前1 -
 最爱啃西瓜 共回答了16个问题
最爱啃西瓜 共回答了16个问题 |采纳率100%已知PH=0,根据PH计算公式pH=-lg[H+]=0;即C(H+)=10^0=1mol/l1年前查看全部
- 铜银合金共重370克,银比铜的1/7少30 克,铜和银各多少克
铜银合金共重370克,银比铜的1/7少30 克,铜和银各多少克
列式计算 dfkdhfkdh1年前1
dfkdhfkdh1年前1 -
 bcu8653462 共回答了16个问题
bcu8653462 共回答了16个问题 |采纳率100%设银质量为xg,铜质量为yg
则x+y=370
x=1/7y-30
1/7y-30+y=370 得y=350
所以x=370-350=20
解之x=20,y=350
答:银20克,铜350克1年前查看全部
- 将7g某铜银合金与足量的amol\L的HNO3充分反应,完全溶解后放出的气体与标准状况下0.56L的氧气混合,通入水中恰
将7g某铜银合金与足量的amolL的HNO3充分反应,完全溶解后放出的气体与标准状况下0.56L的氧气混合,通入水中恰好完全吸收,则合金中铜的质量是多少
 iwitch1年前2
iwitch1年前2 -
 琳琳71521 共回答了14个问题
琳琳71521 共回答了14个问题 |采纳率78.6%设Cu和Ag的物质的量分别为x 、y
由于Cu和Ag失去的电子全部转移到了NOx,而之后这部分电子又全部转移给了O2,
所以由得失电子守恒 2x+y = 0.56/22.4 * 4 ①
总质量 64x+108y=7 ②
解得 x =0.025 mol
合金中铜的质量m(Cu) = 0.025 * 64 = 1.6 g1年前查看全部
- 14.0 g铜银合金与足量某浓度的硝酸反应,将放出的气体与1.12 L(标准状况)氧气混合,
14.0 g铜银合金与足量某浓度的硝酸反应,将放出的气体与1.12 L(标准状况)氧气混合,
14 g铜银合金与足量的某浓度的硝酸反应,将放出的气体与1.12 L(标准状况下)氧气混合,通入水中恰好全部被吸收,则合金中铜的质量为( )
A.9.6 g B.6.4 g C.3.2 g D.1.6 g
从表面看,铜、银的质量分数未知,硝酸的浓度未知,似乎条件不足.但仔细观察可以发现,硝酸中的氮元素在整个过程中实际上化合价并未发生改变.由此,设铜的物质的量、银的物质的量分别为x、y,结合得失电子守恒可以得到: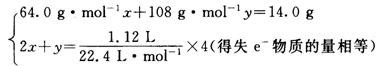
解得所以铜的质量为3.2 g.C
我的问题是:第二个式子后面为什么乘以4? bluelyon1年前1
bluelyon1年前1 -
 aqlq2005 共回答了17个问题
aqlq2005 共回答了17个问题 |采纳率88.2%第二个式子,意图是 电子守恒
因为Cu、Ag失去的电子,最终被O2全部得到.
左边是Cu、Ag失去的电子数2x+y,右边是O2得到的电子数1.12/22.4 * 4(物质的量×4)
1 mol O2得到4 mol 电子(0 → -2.有2个O)1年前查看全部
- 为了测定某铜银合金的成分,将20.4g合金溶于50ml12.8mol/L的浓硝酸中,待合金完全溶解后收集到4.48L(标
为了测定某铜银合金的成分,将20.4g合金溶于50ml12.8mol/L的浓硝酸中,待合金完全溶解后收集到4.48L(标准状况下)气体 并测得溶液中氢离子浓度为0.8mol/L假设反应后溶液的体积仍未50ml 试计算(1)被还原硝酸的物质的量 (2)合金中银的质量合数
 秦小尸1年前1
秦小尸1年前1 -
 苏大狼 共回答了23个问题
苏大狼 共回答了23个问题 |采纳率87%反应后得到的气体,不管是NO2还是NO,都与硝酸有定量关系,
标况下4.48L,即是0.2mol
所以被还原的有0.2mol
(2)总共有12.8×50/1000=0.64mol
被还原了0.2mol
还剩0.8×50/1000=0.04mol
所以与铜离子、银离子结合的硝酸根是0.64-0.2-0.04=0.4mol
所以设银xmol,铜ymol
所以108x 64y=20.4
x 2y=0.4
解出xy即可算出银的质量分数.
希望对你有所帮助!1年前查看全部
- 14g铜银合金与一定浓度的硝酸反应,将生成的气体与1.12L氧气混合,通入水中,完全反应,问原合金中的铜的质量
14g铜银合金与一定浓度的硝酸反应,将生成的气体与1.12L氧气混合,通入水中,完全反应,问原合金中的铜的质量
这是个选择题目,答案看你们能想出来不
反正我考虑这题目的时候想银反应不反应,后来想不管怎么样,o2都被反应了
于是我就想1.12L氧气不是0.05mol么,1个氧气4个电子,这就是0.2mol电子,而且肯定有0.1mol的NO反应了吧,所以n从5到2又给了3mol,所以这是0.5mol,所以铜有1.6g,可他就是不对,还请高人指点思想不对的地方
我当时没忽略水啊,我想过这中方法,加上水以后,就更乱了因为有NO也有NO2所以不应该用这种方法,我知道可能还有NO2+H2O出硝酸再弄铜,还有出NO,但这样每法做 个性的名字就是我1年前3
个性的名字就是我1年前3 -
 marky_live 共回答了21个问题
marky_live 共回答了21个问题 |采纳率95.2%是3.2g……
从整个变化过程中可以看出,铜失去电子变成 Cu2+ ,银失去电子变成 Ag+ ,硝酸在反应过程中实际上没有变化,而氧气得到电子变为-2价.所以在整个过程中 CU、Ag失去的电子数等于O2得到的电子数.
设 Cu的物质的量为x,Ag的物质的量为y
64x+108y=14
2x+y=0.05molX2X2
解得:x=0.05mol y=0.1mol
所以铜的质量为:0.05molx64g/mol=3.2g
我很懒……
而且我自己的方法应该是有漏洞……
所以不拿出来丢人了……1年前查看全部
- 一块铜银合金重810克,其中铜的质量是银质量的七分之二,求合金中铜,银各有多少克?
 monitecresty1年前2
monitecresty1年前2 -
 雨桐点点 共回答了8个问题
雨桐点点 共回答了8个问题 |采纳率87.5%设银的质量为X,那么铜的质量为2/7X:
X+2/7X=810
x=810 /(9/7)
X=630(克) (银的质量)
铜的质量是:630*(2/7)=180(克)1年前查看全部
- 有一块铜银合金的质量为51.6克,将它溶解在足量的稀硝酸中,在标准状况下,收集到6.72升气体,求合金中铜的质量.
 ladenfish1年前1
ladenfish1年前1 -
 wang73he 共回答了26个问题
wang73he 共回答了26个问题 |采纳率88.5%解题思路:收集的气体为NO,物质的量为0.3mol,令合金中铜为xmol,银为ymol,利用二者质量和为51.6g,电子转移守恒列方程,计算x、y的值,再根据m=nM计算铜的质量.收集到6.72升气体为NO,物质的量为[6.72L/22.4l/mol]=0.3mol.
令合金中铜为xmol,银为ymol,则:
利用二者质量和为51.6g,有64x+108y=51.6
根据电子转移守恒有2x+y=0.3×3
联立方程,解得x=0.3;y=0.3.
所以合金中铜的质量为0.3mol×64g/mol=19.2g.
答:合金中铜的质量为19.2g.点评:
本题考点: 有关混合物反应的计算.
考点点评: 考查混合物的计算,难度中等,利用电子转移守恒计算,较常规方法简单,注意守恒思想的运用.1年前查看全部
- 关于铜银合金与硝酸的反应计算题.
关于铜银合金与硝酸的反应计算题.
为了测定某铜银合金的成分,将30克合金溶于80ml 13.5mol/L的浓硝酸中,待合金完全溶解后,收集到6.72L气体(标准状况下),并测得溶液中c(H*)=1mol/L,设反应后溶液体积仍为80ml,计算:(1)被还原的硝酸的物质的量;(2)合金中银的质量分数 aiqian1321年前1
aiqian1321年前1 -
 kuyehantian 共回答了22个问题
kuyehantian 共回答了22个问题 |采纳率90.9%原硝酸物质的量n=cV=13.5×0.08=1.08mol
收集气体物质的量n=V/Vm=6.72/22.4=0.3mol
反应后溶液的硝酸物质的量n=cV=1×0.08=0.08mol
生成气体可能是NO2或NO2与NO的混合气体,而这两种气体都是每个分子含一个N,因此气体中N总物质的量应等于气体总物质的量,即为0.3mol
而被还原的HNO3都是转化为这些气体,因此被还原HNO3物质的量0.3mol【①答案】
反应后,Cu→Cu(NO3)2,Ag→Ag(NO3)
设原合金中Cu物质的量x,Ag物质的量y
根据n=nM,以合金总质量为等式,列出第一个方程:
(一)64x+108y=30
开头算过,最初硝酸共有1.08mol,最后只剩0.08mol,说明参加反应的HNO3物质的量为1.08-0.08=1mol;
而被还原的有0.3mol,因此未被氧化(即以NO3 -形式存在于盐中)的为1-0.3=0.7mol
Cu(NO3)2中每个Cu 2+对应2个NO3 -,AgNO3中每个Ag +对应1个NO3 -,且Cu 2+与Cu等物质的量,Ag +与Ag等物质的量
因此以未被还原的NO3 -为等量,列第二个方程
(二)2x+y=0.7
解得x=0.3mol,y=0.1mol,Ag质量m=nM=0.1×108=10.8g
因此Ag质量分数10.8g/30.0g=36%【②答案】1年前查看全部
- 14g铜银合金与足量的某浓度的硝酸反应,将放出的气体与1.12L(标准状况下)氧气混合,通入水中恰好全部被吸收,则合金中
14g铜银合金与足量的某浓度的硝酸反应,将放出的气体与1.12L(标准状况下)氧气混合,通入水中恰好全部被吸收,则合金中铜的质量为( )
A. 9.6 g
B. 6.4 g
C. 3.2 g
D. 1.6 g put20061年前3
put20061年前3 -
 benhen 共回答了14个问题
benhen 共回答了14个问题 |采纳率85.7%解题思路:铜、银与硝酸反应生成硝酸铜、硝酸银与氮的氧化物,氮的氧化物与氧气、水反应生成硝酸,纵观整个过程,金属提供的电子等于氧气获得的电子,根据二者质量与电子转移列方程计算.铜、银与硝酸反应生成硝酸铜、硝酸银与氮的氧化物,氮的氧化物与氧气、水反应生成硝酸,纵观整个过程,金属提供的电子等于氧气获得的电子,
n(O2)=[1.12L/22.4L/mol]=0.05mol,
设Cu、Ag的物质的量分别为x、y,则:
根据质量列方程:x×64g/mol+y×108g/mol=14g
根据电子守恒列方程:2x+1×y=0.05mol×4
解得:x=0.05mol,y=0.1mol
m(Cu)=0.05mol×64g/mol=3.2g,
故选C.点评:
本题考点: 化学方程式的有关计算;有关混合物反应的计算.
考点点评: 本题考查混合物计算、氧化还原反应的有关计算,难度中等,根据始态终态法判断金属提供的电子等于氧气获得的电子是关键,注意氧化还原反应中守恒思想的运用.1年前查看全部
- 30.为了测定某铜银合金的组成,将17.2 g合金溶于50 mL 11.0 mol/L的浓硝酸中,待合金完全溶解后,只生
30.为了测定某铜银合金的组成,将17.2 g合金溶于50 mL 11.0 mol/L的浓硝酸中,待合金完全溶解后,只生成NO2和NO气体,共4.48 L(标准状况),并测得此时溶液中硝酸的物质的量浓度为1.0 mol/L.假设反应后溶液的体积仍为50 mL.试计算:
⑴.被还原的硝酸的物质的量;
⑵.合金中银的质量分数.
答案是30.⑴收集到的气体为NO2和NO,故
被还原的n(HNO3)=n(气体)=4.48 L÷22.4L•mol-1=0.20 mol……………………2分
⑵反应的n(HNO3)=11.0 mol•L-1×0.050 L-1.0 mol•L-1×0.050L=0.50 mol…… 1分
设合金中铜、银物质的量分别为x、y,则
64 g•mol-1•x+108 g•mol-1•y=17.2 g …………① ………………1分
又,产物Cu(NO3)2、AgNO3中含NO3-物质的量各为2x、y,据 N守恒可得
2x+y+0.20 mol=0.50 mol ……………………② ………… 1分
解①②得 y=0.10 mol………………………………………………………………1分
故W(Ag)%=(0.10 mol×108g•mol-1÷17.2g)×100%=62.8%…………………… 1分
其他解法也可.
其中Cu(NO3)2、AgNO3中含NO3-物质的量各为2x、y,这个是直接得到的还是通过方程式?我通过写方程式的确是2x y 有没有办法直接确定就是2x y 这样以后计算就方便了 就是假如该题我设Cu(NO3)2有x mol 我是不是能不写方程式 直接判断出NO3- 有2x mol? ygad1年前1
ygad1年前1 -
 edwardlll 共回答了18个问题
edwardlll 共回答了18个问题 |采纳率94.4%是直接得到的
意指Cu(NO3)2、AgNO3
NO3-就两个去处,一个是被还原,另一个就是与铜离子、银离子结合.1年前查看全部
- 为了测定某铜银合金的成分,将20.4g合金溶于50ml12.8mol/L的浓硝酸中,待合金完全溶解后收集到4.48L(标
为了测定某铜银合金的成分,将20.4g合金溶于50ml12.8mol/L的浓硝酸中,待合金完全溶解后收集到4.48L(标准状况下)气体 并测得溶液中氢离子浓度为0.8mol/L假设反应后溶液的体积仍未50ml 试计算(1)被还原硝酸的物质的量 (2)合金中银的质量合数
 温馨小烛061年前1
温馨小烛061年前1 -
 songwenjiao256 共回答了14个问题
songwenjiao256 共回答了14个问题 |采纳率78.6%(1)被还原硝酸的物质的量:合金完全溶解后收集到4.48L(标准状况下)气体,说明0.2mol硝酸被还原.
NO3- + 2H+ + e- → NO2↑ + H2O 反应前n(H+)=0.05*12.8=0.64mol
反应后n(H+)=0.05*0.8=0.04mol
NO3- + 4H+ +3e- → NO↑ + 2H2O
NO3-被还原成 NO2时,1mol NO3-消耗2molH+;
NO3-被还原成 NO时,1mol NO3-消耗4molH+.
而反应完总共消耗0.6molH+,生成气体为0.2mol.那么可以计算出生成NO2为0.1mol,生成NO为0.1mol. 那么,生成0.1molNO2和生成0.1molNO总共需要0.4mol电子,这0.4mol电子是
20.4g铜银合金提供.
0.4mol电子全部由Cu提供,需要铜:0.2*64=12.8g;
0.4mol电子全部由Ag提供,需要银:108*0.4=43.2g.由十字交叉法:
Cu 12.8 22.8 3
20.4 = --------------
Ag 43.2 7.6 1
由计算得出:铜提供的电子为3/4,银提供的电子为1/4;总共提供了0.4mol电子,那么铜提供了0.3mol电子;银提供了0.1mol电子.
计算得:铜的质量为9.6g;银的质量为10.8g.
(2)合金中银的质量合数:10.8/20.4=53%
纯手打,希望对你有所帮助!不明白请追问!1年前查看全部
- 为了测定某铜银合金的成分,将30.0g的合金完全溶于80mL 13.5mol/L的浓HNO3中,待合金完全溶解后,收集到
为了测定某铜银合金的成分,将30.0g的合金完全溶于80mL 13.5mol/L的浓HNO3中,待合金完全溶解后,收集到气体6.72L(标准状况),并测得溶液的PH=0.假设反应后的溶液体积仍为80mL.试计算:
1.合金中银的质量分数
2.所得气体的组成(若为混合物,需算出各组成成分的体积 越甲1年前1
越甲1年前1 -
 ngc882003 共回答了23个问题
ngc882003 共回答了23个问题 |采纳率91.3%1
测得溶液的PH=0说明反应后c(H+) = 1mol/L
所以反应后剩余有n(HNO3) = 1 * 0.08 = 0.08mol
所以参与反应的n(HNO3) = 13.5 * 0.08 - 0.08 = 1mol
n(NO) + n(NO2) = 6.72/22.4 = 0.3mol
所以有0.3mol的NO3-被还原.
所以与Ag+和Cu2+结合的NO3-的物质的量 = 1 - 0.3 = 0.7mol
所以有:n(Ag) + 2*n(Cu) = 0.7mol
108*n(Ag) + 64 * n(Cu) = 30g
解得:n(Ag) = 0.1mol,n(Cu) = 0.3mol
所以合金中银的质量分数 = 108*0.1/30 * 100% = 36%
由n(Ag) = 0.1mol,n(Cu) = 0.3mol可得,反应一共转移电子数 = 0.1*1 + 0.3*2 = 0.7mol
所以有:3*n(NO) + n(NO2) = 0.7mol
又因为:n(NO) + n(NO2) = 6.72/22.4 = 0.3mol
所以n(NO) = 0.2mol,n(NO2) = 0.1mol
所以NO体积 = 22.4*0.2 = 4.48L,NO2体积 = 22.4*0.1 = 2.24L1年前查看全部
- 将14g铜银合金与足量的一定浓度的硝酸溶液反应,把放出的气体与标准状况下体积为1.12L的O2混合后再通入水中,恰好全部
将14g铜银合金与足量的一定浓度的硝酸溶液反应,把放出的气体与标准状况下体积为1.12L的O2混合后再通入水中,恰好全部被吸收,则合金中铜的质量为( )
A. 3.2g
B. 4.8g
C. 6.4g
D. 10.8g ilsam1年前1
ilsam1年前1 -
 ostrich_1 共回答了17个问题
ostrich_1 共回答了17个问题 |采纳率94.1%解题思路:铜、银与硝酸反应生成硝酸铜、硝酸银与氮的氧化物,氮的氧化物与氧气、水反应生成硝酸,纵观整个过程,金属提供的电子等于氧气获得的电子,根据二者质量与电子转移列方程计算.铜、银与硝酸反应生成硝酸铜、硝酸银与氮的氧化物,氮的氧化物与氧气、水反应生成硝酸,纵观整个过程,金属提供的电子等于氧气获得的电子,
n(O2)=[1.12L/22.4L/mol]=0.05mol,
设Cu、Ag的物质的量分别为x、y,则:
根据质量列方程:x×64g/mol+y×108g/mol=14g
根据电子守恒列方程:2x+1×y=0.05mol×4
解得:x=0.05mol;y=0.1mol
m(Cu)=0.05mol×64g/mol=3.2g,
故选A.点评:
本题考点: 有关混合物反应的计算.
考点点评: 本题考查混合物计算、氧化还原反应的有关计算,难度中等,根据始态终态法判断金属提供的电子等于氧气获得的电子是关键,注意氧化还原反应中守恒思想的运用.1年前查看全部
- 铜铝合金和铜银合金外观相似,这样来鉴别他们?
 不懂才要问1年前5
不懂才要问1年前5 -
 我今年三十七 共回答了19个问题
我今年三十七 共回答了19个问题 |采纳率100%滴少量稀盐酸铜铝合金有气泡铜银合金没有1年前查看全部
- 为了测定某铜银合金的成分,将30.0g合金溶于80mL13.5mol/L的浓硝酸中,待合金完全溶解后,收集到气体6.72
为了测定某铜银合金的成分,将30.0g合金溶于80mL13.5mol/L的浓硝酸中,待合金完全溶解后,收集到气体6.72L(标准状况),(不考虑N2O4的生成)并测得溶液中的c(H+)=1mol/L.假设反应后溶液的体积仍为80mL.试计算:
(1)被还原的硝酸的物质的量;
(2)合金中银的质量分数. oo修行者1年前1
oo修行者1年前1 -
 arlesvan 共回答了15个问题
arlesvan 共回答了15个问题 |采纳率93.3%解题思路:被还原的硝酸的物质的量等于生成气体的物质的量,根据反应中消耗硝酸的物质的量结合质量守恒列方程组可计算合金中银的质量分数.(1)被还原的硝酸的物质的量等于生成气体的物质的量,即:n(HNO3)(被还原)=[6.72L/22.4L/mol]=0.3mol,
答:被还原的硝酸的物质的量为0.3mol.
(2)剩余硝酸的物质的量为n(HNO3)(剩余)=0.08L×1mol/L=0.08mol,
参加反应的硝酸为:0.08L×13.5mol/L-0.08mol=1mol,
设混合物中含有xmolAg,ymolCu,
则有
108x+64y=30.0(质量守恒)
x+2y+0.3+0.08=1.08(N元素守恒)
解之得:
x=0.1
y=0.3
则:m(Ag)=0.1mol×108g/mol=10.8g,
合金中银的质量分数为:
10.8g
30.0g×100%=36.0%.
答:合金中银的质量分数为36.0%.点评:
本题考点: 有关混合物反应的计算.
考点点评: 本题考查方程式的相关计算,可从质量守恒的角度计算,可以省去书写化学方程式的繁琐.1年前查看全部
- (2006•深圳一模)某研究性学习小组在验证铜银合金与浓硝酸反应中,除生成NO2气体外,还有少量的NO生成.查阅资料得知
(2006•深圳一模)某研究性学习小组在验证铜银合金与浓硝酸反应中,除生成NO2气体外,还有少量的NO生成.查阅资料得知:常温下NO2与N2O4混合存在,在低于0℃几乎只有无色的N2O4液体或晶体存在,为此他们设计了如图所示的验证实验装置(图中已略去了不必要的装置)

回答下列问题:
(1)写出铜与硝酸反应的可能的反应的方程式______
(2)实验开始前要先打开A部分的活塞K1,持续通一段时间氮气再关闭活塞K1,这样作的目的是______,装置B瓶的作用是______.
(3)A中的反应停止后,打开D中的活塞K2再通入氧气,若反应中确有NO产生,则D出现的现象是______,实验发现通入氧气温度的高低对实验现象有较大的影响,为了便于观察,通入的______(填“热”或“冷“)氧气.
(4)已知合金的质量为a,且合金完全溶解,若还想测定铜的质量分数,只需要利用A装置中反应后的溶液进行简单的实验操作,就可以达到实验目的.试简述实验过程:______. 渔浅1年前1
渔浅1年前1 -
 阳江十八子 共回答了13个问题
阳江十八子 共回答了13个问题 |采纳率100%解题思路:(1)依据铜和浓硝酸反应过程中随硝酸浓度变稀后铜和稀硝酸反应生成一氧化氮气体;
(2)通入氮气是排除装置中的空气,避免生成的一氧化氮气体被氧化为二氧化氮;B装置是利用浓硫酸的吸水性吸收气体中的水蒸气避免在C中 冷却后水和二氧化氮反应生成一氧化氮;
(3)一氧化氮和氧气反应生成红棕色气体二氧化氮气体;温度高反应速率快;
(4)铜银合金和硝酸全部反应生成铜盐和银盐,利用A装置中银离子和氯离子形成的沉淀称量计算得到合金中铜的质量分数.(1)铜和浓硝酸反应生成二氧化氮,过程中随硝酸浓度变稀后铜和稀硝酸反应生成一氧化氮气体,反应的可能化学方程式为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O、3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,
故答案为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O、3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O;
(2)通入氮气是排除装置中的空气,避免生成的一氧化氮气体被氧化为二氧化氮;B装置是利用浓硫酸的吸水性吸收气体中的水蒸气避免在C中冷却后水和二氧化氮反应生成一氧化氮,
故答案为:排除系统的空气,防止NO氧化为NO2;吸收水蒸气,防止水蒸气在C中冷凝后与NO2反应产生NO;
(3)A中的反应停止后,打开D中的活塞K2再通入氧气,若反应中确有NO产生,一氧化氮和氧气反应生成红棕色气体二氧化氮气体,通入氧气温度越高反应速率越快,通入热的氧气,
故答案为:出现红棕色气体;热;
(4)铜银合金和硝酸全部反应生成铜盐和银盐,利用A装置中银离子和氯离子形成的氯化银沉淀称量,计算得到合金中铜的质量分数,
故答案为:在A中加入过量的Cl-的溶液,过滤、洗涤、干燥并称量沉淀的质量.点评:
本题考点: 性质实验方案的设计;硝酸的化学性质.
考点点评: 本题考查了物质性质的实验设计,硝酸性质的应用,实验步骤和产物性质及其反应现象是解题关键,题目难度中等.1年前查看全部
- 取铜银合金1G放入硝酸溶液中溶解,再加盐酸,则得氯化银沉淀0.27G,求此合金中铜.银的质量分数
取铜银合金1G放入硝酸溶液中溶解,再加盐酸,则得氯化银沉淀0.27G,求此合金中铜.银的质量分数
那就是怎样求?我知道他是铜银合金中银的质量,但是我就是不会求 syluoli1年前1
syluoli1年前1 -
 070412a 共回答了17个问题
070412a 共回答了17个问题 |采纳率94.1%n(Ag)=n(AgCl)=0.27/143.5 mol=0.002mol
m(Ag)=108*0.002 g=0.216g
银的质量分数:0.216/1*100%=21.6%
铜的质量分数:1-21.6%=78.4%1年前查看全部
- 铜金属有很多种类,常见的有铜锌合金,铜镁合金,铜银合金,铜铁合金,现在有一种合金,为确定其为四种金属
铜金属有很多种类,常见的有铜锌合金,铜镁合金,铜银合金,铜铁合金,现在有一种合金,为确定其为四种金属
的哪一种,作如下实验:将20g合金粉末加入到98g百分之二十稀硫酸中,恰好完全反映后,过滤,将滤液蒸干后得到固体纯净物32.2g,通过计算回答:
此合金含有的另外一种金属化合物
生成氢气质量
该合金中含铜的质量分数
 wunai13141年前1
wunai13141年前1 -
 peter_oicq 共回答了20个问题
peter_oicq 共回答了20个问题 |采纳率85%设合金中另外一种金属为A,相对原子质量为X
A + H2SO4 = ASO4 + H2↑
98 X+96
98g*20% 32.2g
98:(X+96)= 98g*20% :32.2g
解得X=65
说明合金中的另外一种金属为锌
设合金中含锌的质量为Y,生成氢气的质量为Z
Zn + H2SO4 = ZnSO4 + H2↑
65 98 2
Y 98g*20% Z
65:98=Y:98g*20% Y=13g
该合金中含铜的质量分数为(20g-13g)/20g*100%=35%
98:2=98g*20% :Z
Z=0.4g
答:此合金含有的另外一种金属为锌
生成氢气质量为0.4克;
该合金中含铜的质量分数为35%1年前查看全部
- 为了测定某铜银合金的成分,将30.0g合金溶于80mL12.5mol/l浓硝酸中,待合金完全溶解后,收集到气体6.72L
为了测定某铜银合金的成分,将30.0g合金溶于80mL12.5mol/l浓硝酸中,待合金完全溶解后,收集到气体6.72L(标况),并测得溶液中的c(H+)=1mol/L.假设反应后溶液的体积仍为80ml,试计算:
(1)被还原的硝酸的物质的量.(2)合金中银的质量分数. lily19911年前1
lily19911年前1 -
 加菲猫的xx 共回答了20个问题
加菲猫的xx 共回答了20个问题 |采纳率100%n(HNO3被还原)=6.72/22.4=0.3mol
Cu:xmol;Ag:ymol:64x+108y=30,2x+y=12.5*0.08-0.3-1*0.081年前查看全部
- 14克铜银合金与足量的某浓度的硝酸反应,将放出的气体与1.22L氧气混合,通入水中,恰好被完全吸收,则合金
14克铜银合金与足量的某浓度的硝酸反应,将放出的气体与1.22L氧气混合,通入水中,恰好被完全吸收,则合金
铜的质量为多少克?有思路也可以, 求租华师大附近1年前1
求租华师大附近1年前1 -
 伍东雷 共回答了20个问题
伍东雷 共回答了20个问题 |采纳率90%HNO3-----铜银合金-----(NO,NO2)-----O2-------HNO3
可以看出硝酸没变.
所以铜银合金转移的电子数目=O2转移电子数目
设Cu为X摩尔 Ag为Y摩尔
64X+108Y=14
2X+Y=4*(1.22/22.4)1年前查看全部
- 化学计算 在线等~~ 为了测定某铜银合金的成分,将30.0g合金溶于13.5mol/L的浓硝酸中,带合金完全溶解后,收集
化学计算 在线等~~ 为了测定某铜银合金的成分,将30.0g合金溶于13.5mol/L的浓硝酸中,带合金完全溶解后,收集到气体6.72L(标准状况),并测得溶液的PH=0.假设反应后溶液的体积仍为80mL,计算
1.被还原的硝酸的物质的量
2.合金中银的质量分数
要详细的过程,答得好加分 mfmvl1年前1
mfmvl1年前1 -
 猪儿哪个飞啊 共回答了21个问题
猪儿哪个飞啊 共回答了21个问题 |采纳率81%反应是
Cu + 4HNO3浓=Cu(NO3)2 + 2NO2 + 2H2O
Ag + 2HNO3浓=AgNO3 + NO2 + H2O
两个反应中的HNO3都起两个作用,酸的作用,生成盐Cu(NO3)2和AgNO3,氧化剂的作用,生成NO2气体
且N元素守恒,每1个NO2生成,就是1个HNO3被还原
所以,气体6.72L,即0.3mol,即被还原的HNO3为0.3mol
pH=0,即H+浓度1mol/L,即HNO3过量了0.08mol
被还原HNO3为0.3mol
所以,起到酸的作用的HNO3为13.5×0.08-0.08-0.3=0.7mol
生成Cu(NO3)2和AgNO3
设Ag的质量分数为x,则Cu为(1-x)
则,根据NO3^-的量
30x/108+2×30(1-x)/64=0.7
得,x=36%1年前查看全部
- (2005•宁夏)小帆同学想测定铜锌合金和铜银合金中铜的质量分数,实验室只有一瓶稀盐酸和必要的仪器.
(2005•宁夏)小帆同学想测定铜锌合金和铜银合金中铜的质量分数,实验室只有一瓶稀盐酸和必要的仪器.
(1)你认为小帆同学在这样的实验条件下,能测定______合金中铜的质量分数.
(2)用其中一种合金粉末32.5g与足量稀盐酸充分反应,生成0.4g气体.算一算,该合金中铜的质量分数. 非洲蟋蟀1年前1
非洲蟋蟀1年前1 -
 wodemingtianbush 共回答了29个问题
wodemingtianbush 共回答了29个问题 |采纳率93.1%解题思路:(1)两种金属中一种金属的活动性比氢强,一种金属的活动性比氢弱,只有满足此条件才能测定出铜的质量分数.
(2)根据氢气的质量求出锌的质量,再用合金质量减去锌的质量即为铜的质量,据此分析即可.(1)铜的活动性比氢弱,不与稀酸发生反应,锌的活动性比氢强,能与稀酸发生反应,因而铜锌合金能测定出铜的质量分数;而银的活动性比氢弱,也不与稀酸发生反应,因而铜银合金不能测定出铜的质量分数.
(2)设:合金中锌的质量为x.
Zn+2HCl=ZnCl2+H2↑
65 2
x 0.4g
[65/2=
x
0.4g]
x=13g
合金中铜的质量=32.5g-13g=19.5g
则铜的质量分数为:
19.5g
32.5g×100%=60%
故答案为:(1)铜锌;
(2)铜的质量分数=60%点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 本题考查了金属活动性顺序的应用,完成此题,可以依据金属活动性顺序的意义以及化学方程式的计算进行.1年前查看全部
- 小华欲测定铜锌合金及铜银合金中铜的质量分数,实验室只提供一瓶未标明浓度的稀盐酸和必要地仪器
小华欲测定铜锌合金及铜银合金中铜的质量分数,实验室只提供一瓶未标明浓度的稀盐酸和必要地仪器
2)小华取65g该合金的粉末与足量稀盐酸充分反应,经测定知反应产生了0.4g气体,则该合金中铜的质量分数是_________ 猪猪的快乐1年前1
猪猪的快乐1年前1 -
 zhou1xing 共回答了18个问题
zhou1xing 共回答了18个问题 |采纳率88.9%设铜锌合金中锌的质量为x
Zn+2HCl=ZnCl2+H2↑
65 2
x 0.4g
65/x=2/0.4g
x=13g
铜锌合金中铜的质量=65g-13g=52g
铜的质量分数=52g/65g×100%=80%1年前查看全部
- 14g铜银合金与足量的某浓度的硝酸反应,将放出的气体与1.12L(标况)氧气混合,通入水中恰好完全吸收,则合金中铜的质量
14g铜银合金与足量的某浓度的硝酸反应,将放出的气体与1.12L(标况)氧气混合,通入水中恰好完全吸收,则合金中铜的质量为()
2g
请问是怎么算的啊?硝酸浓度不确定怎么判断放出的是什么气体呢? xzhwsj1年前1
xzhwsj1年前1 -
 lhy_103 共回答了18个问题
lhy_103 共回答了18个问题 |采纳率88.9%氧化的铜是由氧气来完成的 O2 0.05mol 铜是 m=n*M=64*0.05=3.21年前查看全部
- (10分)某研究性学习小组拟通过铜银合金与浓硝酸的反应,测定该合金的组成。考虑到NO 2 的聚合,该小组同学查阅到下列资
(10分)某研究性学习小组拟通过铜银合金与浓硝酸的反应,测定该合金的组成。考虑到NO 2 的聚合,该小组同学查阅到下列资料:
17℃、1.01×10 5 Pa,2NO 2 (g) N 2 O 4 (g) 的平衡常数 K =13.3,该条件下密闭容器中N 2 O 4 和NO 2 的混合气体达到平衡时 c (NO 2 )="0.0300" mol·L - 1 。
N 2 O 4 (g) 的平衡常数 K =13.3,该条件下密闭容器中N 2 O 4 和NO 2 的混合气体达到平衡时 c (NO 2 )="0.0300" mol·L - 1 。
⑴此时平衡混合气体中 c (N 2 O 4 )= (保留两位有效数字,下同)。
⑵17℃、1.01×10 5 Pa时,将12.44g合金放入足量浓硝酸中,待合金完全溶解后,收集到NO 2 和N 2 O 4 的混合气体5.00L。
①根据平衡体系中NO 2 和N 2 O 4 的物质的量浓度,计算5.00L气体中NO 2 、N 2 O 4 的物质的量分别为 、 。
②计算合金中银的质量分数。 女刀1年前1
女刀1年前1 -
 股海白条 共回答了22个问题
股海白条 共回答了22个问题 |采纳率72.7%1年前查看全部
- 为了测定某铜银合金的成分,将30g的合金完全溶解于80ML 12.5MOL/L的浓硝酸中,完全反应后收集到标况下气体6.
为了测定某铜银合金的成分,将30g的合金完全溶解于80ML 12.5MOL/L的浓硝酸中,完全反应后收集到标况下气体6.72L,并测得溶液的C(H+)=1MOL/L,假使反应后溶液的体积仍然为80ML,求被还原的硝酸的物质的量,合金中银的百分含量.
 安圣灵1年前1
安圣灵1年前1 -
 gm170 共回答了18个问题
gm170 共回答了18个问题 |采纳率100%n(HNO3被还原)=6.72/22.4=0.3mol
Cu:xmol;Ag:ymol:64x+108y=30,2x+y=12.5*0.08-0.3-1*0.081年前查看全部
- 某同学设计如下实验测量m g铜银合金样品中铜的质量分数.
某同学设计如下实验测量m g铜银合金样品中铜的质量分数.

下列说法中不正确的是( )
A.收集到的V L气体全为 NO
B.过滤用到的玻璃仪器是:烧杯、漏斗、玻璃棒
C.操作Ⅱ应是洗涤
D.铜的质量分数为:[143.5V−22.4w/100.4m]×100% nightsoul_0911年前1
nightsoul_0911年前1 -
 不可就药地爱上蕤 共回答了13个问题
不可就药地爱上蕤 共回答了13个问题 |采纳率92.3%解题思路:根据流程可知:铜银合金与足量硝酸反应生成硝酸铜、硝酸银溶液、NO或NO2气体,用排水法收集到的VL气体为NO;向反应后的溶液中加入氯化钠溶液,反应生成氯化银沉淀,过滤后得到氯化银固体,然后洗涤、干燥,最后得到干燥的AgCl固体,
A.由流程图可知,实验排水法收集,二氧化氮能与水反应生成NO,无论金属与硝酸反应生成是NO或NO2或NO、NO2,最后收集的气体为NO;
C.根据分析可知,操作Ⅱ是在过滤之后,烘干之前,由于过滤后的氯化银附着一些离子,应洗涤附着的物质,防止影响氯化银的质量测定;
C.由流程图可知,实验原理为,在反应后溶液中加入氯化钠,将银离子转化为氯化银沉淀,通过测定氯化银沉淀的质量,计算银的质量,进而计算铜的含量.铜银合金与足量硝酸反应生成硝酸铜、硝酸银溶液、NO或NO2气体,由于二氧化氮与水反应生成一氧化氮,则用排水法收集到的VL气体为NO;向反应后的溶液中加入NaCl溶液,反应生成AgCl沉淀,过滤后得到AgCl固体,然后洗涤、干燥,最后得到干燥的AgCl,
A.由流程图可知,实验排水法收集,二氧化氮能与水反应生成NO,故不能金属与硝酸反应生成是NO或NO2或NO、NO2,最后收集的气体为NO,故A正确;
B.过滤用到的玻璃仪器为:烧杯、漏斗、玻璃棒,故B正确;
C.由流程图可知,溶液中加入氯化钠,将银离子转化为氯化银沉淀,通过测定氯化银沉淀的质量,计算银的质量,进而计算铜的含量,操作Ⅱ是在过滤之后,烘干之前,由于过滤后的氯化银附着一些离子,应洗涤附着的物质,防止影响氯化银的质量测定,故操作Ⅱ应是洗涤,故C正确;
D.氯化银的质量为wg,所以合金中银的质量为:wg×[108/143.5]=[108w/143.5]g,故合金中铜的质量分数为:
mg−
108w
143.5g
mg×100%=[143.5m−108w/143.5]×100%,故D错误;
故选D.点评:
本题考点: 物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题考查学生对实验原理的理解、物质组成的测定等知识,题目难度中等,理解实验基本操作方法及测定原理为解答关键,需要学生具有扎实的基础知识与综合运用知识分析解决问题的能力.1年前查看全部
- 金属材料鉴别铜合金有很多种类.常见的有铜锌合金,铜镁合金,铜银合金,铜铁合金.现有一种铜合金,未确定其为四种合金中哪一种
金属材料鉴别
铜合金有很多种类.常见的有铜锌合金,铜镁合金,铜银合金,铜铁合金.现有一种铜合金,未确定其为四种合金中哪一种,作如下实验
将20克合金粉末加入到98克20%稀硫酸中,恰好完全反应后过滤,将滤液蒸干后得到固体纯净物32.2克
(1)此合金含有的另一种金属的化学式为?
(2)求解生成氢气的质量?
(3)该合金中含铜的质量
知道里面过去以有的解答我看过,看不懂. 枭首于阵1年前2
枭首于阵1年前2 -
 ll一小棵 共回答了22个问题
ll一小棵 共回答了22个问题 |采纳率90.9%首先,不可能是铜银合金,这不用说.由题意,恰好完全反应,即硫酸完全反应,硫酸根全部由硫酸转移到反应后滤液中,也就是硫酸根全在蒸干后的固体纯净物中,反应前硫酸根怎么算?稀硫酸中溶质的质量=98*20%=19.6克,硫酸根的质量=19.6×96/98=19.2克,这对吧,那么固体纯净物中金属质量就是32.2-19.2=13克,金属与硫酸比为13:19.6=65:98,相对分子质量65是什么?锌.然后就是列方程式计算了,则生成氢气的质量为0.4克,该合金中含铜的质量=20-13=7克.全手打.1年前查看全部
- 为测定铜银合金的成分,将30g合金溶于80ml,18.5mol/L的农硝酸中 合金完全溶解后收集到6.72L气体(标准状
为测定铜银合金的成分,将30g合金溶于80ml,18.5mol/L的农硝酸中 合金完全溶解后收集到6.72L气体(标准状况下),测得溶液中氢离子的浓度为1mol/L,假设反应后的溶液体积仍为80ml,求合金中银的质量分数
 wuzju1年前1
wuzju1年前1 -
 kluivert28 共回答了14个问题
kluivert28 共回答了14个问题 |采纳率92.9%1、产生的气体不论是NO2还是NO,气体中N原子的物质的量 =6.72L/22.4L/mol=0.3mol
设铜的物质的量为xmol 银为ymol
则 Cu(NO3)2中硝酸根为2x mol AgNO3中硝酸根为y mol
利用反应前后N原子守恒,原溶液中N原子=溶液中N原子+气体中N原子
0.08 L * 18.5mol/L=2x+y+0.08L * 1mol/L + 0.3mol
64g/mol * xmol+108g/mol = 30g
列方程组求解 y=0.1 mol
银的质量分数=0.1*108/30 *100%=36%1年前查看全部
- 将14g铜银合金与足量某浓度的硝酸反应,使放出的气体与1.12L(标准状况)氧气混合恰好被水全部吸收生成硝酸,则合金中铜
将14g铜银合金与足量某浓度的硝酸反应,使放出的气体与1.12L(标准状况)氧气混合恰好被水全部吸收生成硝酸,则合金中铜的质量为( )
A. 3.2g
B. 4.43g
C. 10.8g
D. 12.4g liyiliu1年前1
liyiliu1年前1 -
 经常上线 共回答了11个问题
经常上线 共回答了11个问题 |采纳率100%解题思路:铜、银与硝酸反应生成硝酸铜、硝酸银与氮的氧化物,氮的氧化物与氧气、水反应生成硝酸,纵观整个过程,金属提供的电子等于氧气获得的电子,设Cu、Ag的物质的量分别为x、y,根据二者质量与电子转移列方程计算,再根据m=nM计算Cu的质量.铜、银与硝酸反应生成硝酸铜、硝酸银与氮的氧化物,氮的氧化物与氧气、水反应生成硝酸,纵观整个过程,金属提供的电子等于氧气获得的电子,
n(O2)=[1.12L/22.4L/mol/L]=0.05mol,
设Cu、Ag的物质的量分别为x、y,则:
根据质量列方程:x×64g/mol+y×108g/mol=14g
根据电子守恒列方程:2x+1×y=0.05mol×4
解得:x=0.05mol,y=0.1mol
m(Cu)=0.05mol×64g/mol=3.2g,
故选A.点评:
本题考点: 化学方程式的有关计算;有关混合物反应的计算.
考点点评: 本题考查混合物计算、氧化还原反应的有关计算,难度中等,根据始态终态法判断金属提供的电子等于氧气获得的电子是关键,注意氧化还原反应中守恒思想的运用.1年前查看全部
- 14g铜银合金与足量的某浓度的硝酸反应,将放出的气体与1.12L(标准状况下)氧气混合,通入水中恰好全部被吸收,则合金中
14g铜银合金与足量的某浓度的硝酸反应,将放出的气体与1.12L(标准状况下)氧气混合,通入水中恰好全部被吸收,则合金中铜的质量为( )
A. 9.6 g
B. 6.4 g
C. 3.2 g
D. 1.6 g 步青云6661年前3
步青云6661年前3 -
 jxlcool 共回答了13个问题
jxlcool 共回答了13个问题 |采纳率84.6%解题思路:铜、银与硝酸反应生成硝酸铜、硝酸银与氮的氧化物,氮的氧化物与氧气、水反应生成硝酸,纵观整个过程,金属提供的电子等于氧气获得的电子,根据二者质量与电子转移列方程计算.铜、银与硝酸反应生成硝酸铜、硝酸银与氮的氧化物,氮的氧化物与氧气、水反应生成硝酸,纵观整个过程,金属提供的电子等于氧气获得的电子,
n(O2)=[1.12L/22.4L/mol]=0.05mol,
设Cu、Ag的物质的量分别为x、y,则:
根据质量列方程:x×64g/mol+y×108g/mol=14g
根据电子守恒列方程:2x+1×y=0.05mol×4
解得:x=0.05mol,y=0.1mol
m(Cu)=0.05mol×64g/mol=3.2g,
故选C.点评:
本题考点: 化学方程式的有关计算;有关混合物反应的计算.
考点点评: 本题考查混合物计算、氧化还原反应的有关计算,难度中等,根据始态终态法判断金属提供的电子等于氧气获得的电子是关键,注意氧化还原反应中守恒思想的运用.1年前查看全部
- 实验测得下列数据:所用铜银合金质量为15.0 g,浓硝酸的体积为40 mL,浓度为13.5mol
实验测得下列数据:所用铜银合金质量为15.0 g,浓硝酸的体积为40 mL,浓度为13.5mol
实验测得下列数据:所用铜银合金质量为15.0 g,浓硝酸的体积为40 mL,浓度为13.5mol·L-1.实验后:A中溶液体积为40mL,H+浓度为1.0mol·L-1.若设反应中硝酸既无挥发也无分解,则:
①参加反应的硝酸的物质的量为______________; 2297910391年前1
2297910391年前1 -
 hgstzy 共回答了20个问题
hgstzy 共回答了20个问题 |采纳率95%直接用原来硝酸溶液中的硝酸-反应后溶液中剩余的硝酸就可以了!
参加反应的硝酸=0.04L×13.5mol·L-1-0.04L×1.0mol·L-1
=0.5mol1年前查看全部
- 研究某铜银合金的组成,将30g该合金溶于13.5mol每升的浓硝酸中,待金属完全溶解后,收集到的气体为6.72升(标准状
研究某铜银合金的组成,将30g该合金溶于13.5mol每升的浓硝酸中,待金属完全溶解后,收集到的气体为6.72升(标准状况),并测得溶液c(H+)=1mol每升.假设反应后溶液体积不变,试计算:
(1)被还原的硝酸的物质的量.
(2)合金中银的质量. 域恋-微1年前4
域恋-微1年前4 -
 hjkl741 共回答了25个问题
hjkl741 共回答了25个问题 |采纳率92%铜银合金中Cu xmol 银ymol ,
则:64x+108y=30 该合金溶于13.5mol每升的浓硝酸中,待金属完全溶解后,收集到的气体为6.72升(标准状况),因为是浓硝酸因而产生的气体是NO2.则:得失电子守恒:2x+y= 6.72/22.4
解之:y=0.268mol ,即m(Ag)=108×0.268=28.9g硝酸被还原后生成NO2,因而NO2的物质的量就是被还原硝酸的物质的量,即:6.72/22.4 = 0.3mol
结论:(1)被还原的硝酸的物质的量0.3mol
(2)合金中银的质量:28.9g1年前查看全部
- 光速求救 请详解将14g铜银合金与足量HNO3反应,放出的气体与标准状况下体积为1.12L的O2混合后再通入水中,恰好全
光速求救 请详解
将14g铜银合金与足量HNO3反应,放出的气体与标准状况下体积为1.12L的O2混合后再通入水中,恰好全部吸收,则合金质量为 3.2g为什么
合金质量为 3.2g改为合金中铜的质量为 3.2g 蓝月亮666071年前1
蓝月亮666071年前1 -
 悠悠草原 共回答了20个问题
悠悠草原 共回答了20个问题 |采纳率90%设Cu物质的量为x,Ag物质的量为y
由质量守恒得:64x+108y=14
由电子守恒得:2x+y=1.12/22.4*2*2=0.2
解之得:x=0.05mol y=0.1mol1年前查看全部
- 1g铜银合金,放入过量硝酸中,使其全部溶解,再加盐酸,得氯化银沉淀0.35g,求此铜银合金的铜和银的质量分数
 爬山的小蛇1年前1
爬山的小蛇1年前1 -
 zxj111 共回答了17个问题
zxj111 共回答了17个问题 |采纳率88.2%nAgCl=mAgCl÷MAgCl=0.35÷142.5=0.0024
nAg= nAgCl=0.0024
mAg=nAg*MAg=0.0024*107=0.2568
mCu=1-0.2568=0.7432
Cu%=0.7432÷1*100=74.32%
Ag%=0.2568÷1*100=25.68%1年前查看全部
- k2so4与AgNo3反应铜银合金与硝酸反应后的溶液加K2SO4.通过计算测得的铜的质量分数比往里面加盐酸的结果偏大还是
k2so4与AgNo3反应
铜银合金与硝酸反应后的溶液加K2SO4.通过计算测得的铜的质量分数比往里面加盐酸的结果偏大还是偏小,为什么 imnir1年前1
imnir1年前1 -
 hfhsx_2000 共回答了14个问题
hfhsx_2000 共回答了14个问题 |采纳率92.9%原因很简单 因为硫酸生成的硫酸银微溶于水,也就是说Ag+没有完全沉淀,而氯化银是不溶于水的,Ag+全部沉淀了!
所以:测得的铜的质量分数比往里面加盐酸的结果偏大1年前查看全部
大家在问
- 1甲乙两车分别从ab两地出发,相向而行,速度比为4;5,两车第一次相遇后,甲的速度提高了四分之一,已的速
- 2初二物理学期计划和目标给个字数三百左右的..
- 3一只蝴蝶0.5时飞行3.9千米,一只蜜蜂飞行速度是这只蝴蝶的2.4倍,这只蜜锋每时飞行多少米
- 4已知y=f(x)是定义域为R的奇函数,当x∈[0,+∞)时,f(x)=x2-2x.
- 5英语翻译Reading is an active,fluent process which requires stude
- 6你在那边过的好吗?(查英语句子)
- 7用闻所未闻造句急!
- 8阅读下列材料:材料1:故致知之道,在乎即事观理,以格夫物。物格者,事物之理,各有以诣其极而无余之谓也。理之在物者,既诣其
- 9一个圆柱和一个圆锥等底等高,圆锥的体积比圆柱少360立方厘米,圆柱的体积是( )立方厘米,圆锥的体积是( )
- 103个改写同义句.急...!The comic books have been sold out in the shop.
- 11有10g的氢氧化钠样品,加入100g7.3%的稀盐酸,恰好完全反应后,发现烧杯内的物质质量为107.8g,蒸发液体得到食
- 12Could you tell to me something about their cultural backgrou
- 13搜集读书故事,交流读书方法,探讨读书内容,这是某校新近成立的读书小组的活动安排。作为小组成员的你,请参与下列活动。
- 14求often、always、usually之间的区别.希望有详细分析
- 15《我是团员,我应该怎样做?》写一篇500~600字的作文,周四就要交!


