用溶解平衡解释重金属富集如题急重金属在水中即能以化合物的形态存在.也能以离子形态存在.由于重金属化合物溶解度很小,往往沉
 百川的博客2022-10-04 11:39:541条回答
百川的博客2022-10-04 11:39:541条回答如题
急
重金属在水中即能以化合物的形态存在.也能以离子形态存在.由于重金属化合物溶解度很小,往往沉积于水底,又由于重金属离子在正电荷,在水中易被带负电荷的土壤浇漓吸附,大多数会很快沉降下来,因此重金属一般都富集在排水口下游的地泥中,成为一个长期的次生污染源.一般污染物在汛期水量的稀释下,其浓度是降低的,而重金属污染物并不降低,甚至是升高的,试用溶解平衡等知识解释.

已提交,审核后显示!提交回复
共1条回复
 坚持V胜利 共回答了15个问题
坚持V胜利 共回答了15个问题 |采纳率80%- 1.重金属一类污染物,从溶解状态被吸附或转变为不溶性化合物,沉淀后进入底泥.
2.将底泥中的重金属分为5态:金属可交换态(可交换态)、碳酸盐结合态(碳酸盐态)、铁(锰)氧化物结合态(铁/锰态)、有机质及硫化物结合态(有机态)、残渣晶格结合态(残渣态).
3.碳酸盐态在酸性条件下容易向环境中释放,因此对水环境的影响也比较大.4.铁锰氧化物结合态是与铁锰氧化物结合在一起的,或本身就成为氢氧化物沉淀的这部分重金属,这部分重金属不易释放,但在水体氧化还原电位降低时易释放出来.
5.有机态是指重金属硫化物沉淀及与各种形态有机质结合的重金属,通过化学键与有机质结合在一起,只有在强氧化条件下才可以分解,这部分重金属被认为较稳定.
6.残渣态是指结合在土壤硅铝酸盐矿物晶格中的金属离子,在正常情况下难以释放.
7.沉积在底泥中重金属的5种形态,只有残渣态在自然条件下不易释放,对河流生态环境危害较小,而其余4态均在适当条件下可向水体中释放,尤其是可交换态更容易向水体释放.
8.根据上述原理就可以有选择的进行溶解平衡过程的解答. - 1年前
相关推荐
- 溶解平衡曲线是不是线上每一点都是Q=Ksp呢?也就是每一时刻都平衡?
 健康宝贝1年前1
健康宝贝1年前1 -
 妍妍1231 共回答了14个问题
妍妍1231 共回答了14个问题 |采纳率85.7%是的,在曲线上的点都是饱和的,下面的都是不饱和的,上方的都是过饱和,会沉淀的.1年前查看全部
- (20分)选修四模块的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理。请回答下列问题
(20分)选修四模块的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理。请回答下列问题:
(1) 一定温度下,在一个固定容积的密闭容器中,可逆反应 A(g) +2B(g) 4C (g) △H >0 达到平衡时,c(A) ="2" mol·L -1 ,c ( B) =" 7" mol·L -1 ,c ( C) =" 4" mol·L -1 。试确定B的起始浓度c (B)的取值范围是 ;若改变条件重新达到平衡后体系中C的质量分数增大,下列措施可行的是 。
4C (g) △H >0 达到平衡时,c(A) ="2" mol·L -1 ,c ( B) =" 7" mol·L -1 ,c ( C) =" 4" mol·L -1 。试确定B的起始浓度c (B)的取值范围是 ;若改变条件重新达到平衡后体系中C的质量分数增大,下列措施可行的是 。
A. 增加C的物质的量 B. 加压
C. 升温 D.使用催化剂
(2)常温下,取 pH=2的盐酸和醋酸溶液各100mL, 向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如右图所示。则图中表示醋酸溶液中pH变化曲线的是 ( 填“A”或“B”)。 设盐酸中加入的Zn质量为m 1 ,醋酸溶液中加入的Zn质量为 m 2 。 则
m 1 m 2 ( 选填“<”、“=”、“>”)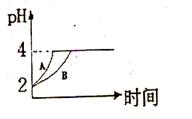
(3) 在体积为3L的密闭容器中,CO与H 2 在一定条件下反应生成甲醇:CO ( g) + 2H 2 ( g) → CH 3 OH(g) ΔH= —91kJ·mol -1 。反应达到平衡时,平衡常数表达式K= ,升高温度,K值 (填“增大”、“减小”或“不变”)。
(4) 难溶电解质在水溶液中也存在溶解平衡。在常温下,溶液里各离子浓度以它们化学计量数为方次的乘积是一个常数,叫溶度积常数。例如: Cu(OH) 2 (s) Cu 2+ (aq) + 2OH - ( aq),Ksp =" c" (Cu 2+ ) c 2 (OH - ) =" 2×10" -20 。当溶液中各离子浓度计量数方次的乘积大于溶度积时,则产生沉淀。若某CuSO 4 溶液里c( Cu 2+ ) ="0.02" mol·L -1 ,如果生成Cu(OH) 2 沉淀,应调整溶液pH,使pH大于 ; 要使0.2 mol·L -1 的CuSO 4 溶液中Cu 2+ 沉淀较为完全 ( 使Cu 2+ 浓度降至原来的万分之一)则应向溶液里加NaOH溶液,使溶液pH等于 。
Cu 2+ (aq) + 2OH - ( aq),Ksp =" c" (Cu 2+ ) c 2 (OH - ) =" 2×10" -20 。当溶液中各离子浓度计量数方次的乘积大于溶度积时,则产生沉淀。若某CuSO 4 溶液里c( Cu 2+ ) ="0.02" mol·L -1 ,如果生成Cu(OH) 2 沉淀,应调整溶液pH,使pH大于 ; 要使0.2 mol·L -1 的CuSO 4 溶液中Cu 2+ 沉淀较为完全 ( 使Cu 2+ 浓度降至原来的万分之一)则应向溶液里加NaOH溶液,使溶液pH等于 。
(5) 常温下,某纯碱(Na 2 CO 3 ) 溶液中滴入酚酞,溶液呈红色。则该溶液呈 性。在分析该溶液遇酚酞呈红色原因时,甲同学认为是配制溶液所用的纯碱样品中混有NaOH 所致;乙同学认为是溶液中Na 2 CO 3 电离出的CO 3 2- 水解所致。请你设计一个简单的实验方案用来评判甲乙两位同学的观点是否正确(包括操作、现象和结论) 。 火花的方法1年前1
火花的方法1年前1 -
 wonterful 共回答了13个问题
wonterful 共回答了13个问题 |采纳率100%1)[3 mol·L -1 , 9 mol·L -1 ] C
(2)B <
(3) C(CH 3 OH)/ [C( CO) * C 2 (H 2 )] 减小
(4)5 7
(5) 碱 向红色溶液中加入足量BaCl 2 溶液,如果溶液还显红色说明甲正确,红色褪色说明乙正确(其他试剂合理也给分)
1年前查看全部
- 关于溶解平衡:Mg(OH)2(s)⇌Mg2+(aq)+2OH-(aq),下列说法中正确的是( )
关于溶解平衡:Mg(OH)2(s)⇌Mg2+(aq)+2OH-(aq),下列说法中正确的是( )
A.加入固体Mg(OH)2,可以增大溶液中镁离子的浓度
B.溶度积常数表示式:KSP=c( Mg2+)•c(OH-)2
C.加入NaOH浓溶液,可以增加Mg(OH)2的溶解量
D.升高温度,不会影响溶解平衡 灵异神话1年前1
灵异神话1年前1 -
 jiji01520 共回答了16个问题
jiji01520 共回答了16个问题 |采纳率93.8%解题思路:A、加入固体Mg(OH)2,平衡不移动;
B、根据溶度积常数的概念书写;
C、加入NaOH浓溶液,使溶解平衡逆移;
D、升高温度溶解度增大.A、加入固体Mg(OH)2,平衡不移动,镁离子的浓度不变,故A错误;
B、根据溶度积常数的概念书写,溶度积常数表示式:KSP=c( Mg2+)•c(OH-)2;故B正确;
C、加入NaOH浓溶液,使溶解平衡逆移,Mg(OH)2的溶解量减小,故C错误;
D、升高温度溶解度增大,溶解平衡正移,故D错误;
故选:B.点评:
本题考点: 难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题考查了难溶电解质的溶解平衡,影响平衡的因素,注意把握平衡常数的意义,题目难度不大.1年前查看全部
- 化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:
 化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:
化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:
(1)一定温度下,在一个固定容积的密闭容器中,可逆反应 A(g)+2B(g)=4C (g)△H>0 达到平衡时,c(A)=2mol•L-1,c(B)=7mol•L-1,c(C)=4mol•L-1.试确定B的起始浓度c(B)的取值范围是______;若改变条件重新达到平衡后体系中C的质量分数增大,下列措施可行的是______.
A.增加C的物质的量B.加压C.升温D.使用催化剂
(2)常温下,取 pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图1所示.则图中表示醋酸溶液中pH变化曲线的是______ ( 填“A”或“B”). 设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为 m2. 则 m1______ m2 ( 选填“<”、“=”、“>”)
(3)在体积为3L的密闭容器中,CO与H2在一定条件下反应生成甲醇:CO(g)+2H2(g)→CH3OH(g).反应达到平衡时,平衡常数表达式K=c(CH3OH) c(CO)×c2(H2) ,升高温度,K值______(填“增大”、“减小”或“不变”).在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=c(CH3OH) c(CO)×c2(H2)
mol•(L•min)-12nB 3tB .
mol•(L•min)-12nB 3tB
(4)难溶电解质在水溶液中存在着电离平衡.在常温下,溶液里各离子浓度以它们化学计量数为方次的乘积是一个常数,叫溶度积常数.例如:
Cu(OH)2(s)=Cu2+(aq)+2OH-(aq),Ksp=c(Cu2+)[c(OH-)]2=2×10-20
当溶液中各离子浓度方次的乘积大于溶度积时,则产生沉淀,反之固体溶解.若某CuSO4溶液里c( Cu2+)=0.02mol•L-1,如果生成Cu(OH)2沉淀,应调整溶液pH,使之大于______; 要使0.2mol•L-1的CuSO4 溶液中Cu2+沉淀较为完全 (使Cu2+浓度降至原来的千分之一)则应向溶液里加NaOH溶液,使溶液pH值为______.
(5)常温下,某纯碱(Na2CO3) 溶液中滴入酚酞,溶液呈红色.则该溶液呈______性.在分析该溶液遇酚酞呈红色原因时,甲同学认为是配制溶液所用的纯碱样品中混有NaOH 所致;乙同学认为是溶液中Na2CO3电离出的CO32-水解所致.请你设计一个简单的实验方案给甲和乙两位同学的说法以评判(包括操作、现象和结论)______. karsly1年前0
karsly1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 沉淀的溶解中使溶解平衡正向移动的方法有哪几种
 kokubo_wing1年前1
kokubo_wing1年前1 -
 wwund 共回答了23个问题
wwund 共回答了23个问题 |采纳率87%沉淀的溶解中使溶解平衡正向移动,即反应平衡向溶解的方向移动.
1.利用酸效应
如果沉淀中的阴离子可以与H+反应,则可以通过加入酸来增加溶液中H+浓度,使沉淀溶解度增大
比如BaCO3沉淀,当溶液中含大量H+时可以完全溶解.
2.利用络合效应
在溶液中加入可以与沉淀中的某个离子发生络合反应,生成稳定络合物的络合剂,使沉淀溶解度增大.
比如AgCl沉淀,在溶液中加入过量NH3.H2O后完全溶解.
3.利用温度
对大多数沉淀,升高溶液的温度有利于其电离和溶解.
比如升高温度后BaSO4沉淀的溶解度有少量增加.
4.利用盐效应(很少涉及)
在溶液中加入与沉淀不发生反应的强电解质,使溶液中的离子强度增大,沉淀的溶解度也会随之增加.
比如AgCl沉淀,在溶液中加入饱和KNO3溶液后溶解度稍有增加.1年前查看全部
- 用溶解平衡原理说明BaSO4在Na2SO4溶液中溶解度比在水中小的原因
 不辜负相思意1年前2
不辜负相思意1年前2 -
 虫虫00811 共回答了20个问题
虫虫00811 共回答了20个问题 |采纳率95%BaSO4在水中的溶解能力可以用溶度积表示:Ksp(BaSO4)=c(Ba2+)×c(SO42-),Ksp(BaSO4)为定值,在硫酸钠溶液中硫酸根离子的浓度大,则钡离子的浓度就小,硫酸钡的溶解度也小.1年前查看全部
- 一个化学疑问石灰水中存在溶解平衡 加入生石灰后 生石灰与水反应 平衡左移 为什么最后最后溶解的氢氧化钙的量减少了
 yeuyao1年前4
yeuyao1年前4 -
 gilesgong 共回答了20个问题
gilesgong 共回答了20个问题 |采纳率95%本来氢氧化钙的溶解度就很低,又加上这个氧化钙与水反应,减少了溶剂,当达到饱和溶液的时候,水的量再减少,溶解在水中的氢氧化钙会析出来.所以最后溶解的氢氧化钙的量会越来越少,最后水反应完,溶液也就不复存在了.1年前查看全部
- 以下是25℃时几种难溶电解质的溶解度: 在无机化合物的提纯中,常利用难溶电解质的溶解平衡原理除去某些杂质离子。
以下是25℃时几种难溶电解质的溶解度: 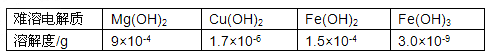
在无机化合物的提纯中,常利用难溶电解质的溶解平衡原理除去某些杂质离子。
例如:
①为了除去氯化铵中的杂质Fe 3+ ,先将混合物溶于水,再加入一定量的试剂反应,过滤结晶即可;
②为了除去氯化镁晶体中的杂质Fe 3+ ,先将混合物溶于水,加入足量的氢氧化镁,充分反应,过滤结晶即可;
③为了除去硫酸铜晶体中的杂质Fe 2+ ,先将混合物溶于水,加入一定量的H 2 O 2 ,将Fe 2+ 氧化成Fe 3+ ,调节溶液的pH=4,过滤结晶即可。
请回答下列问题:
(1)上述三个除杂方案都能够达到很好效果,Fe 3+ 、Fe 2+ 都被转化为________(填化学式)而除去。
(2)①中加入的试剂应该选择________为宜,其原因是___________________________。
(3)②中除去Fe 3+ 所发生的总反应的离子方程式为_______________________________。
(4)下列与方案③相关的叙述中,正确的是________(填字母)。
A.H 2 O 2 是绿色氧化剂,在氧化过程中不引进杂质,不产生污染
B.将Fe 2+ 氧化为Fe 3+ 的主要原因是Fe(OH) 2 沉淀比Fe(OH) 3 沉淀较难过滤
C.调节溶液pH=4可选择的试剂是氢氧化铜或碱式碳酸铜
D.Cu 2+ 可以大量存在于pH=4的溶液中
E.在pH>4的溶液中Fe 3+ 一定不能大量存在 光影流年记忆1年前1
光影流年记忆1年前1 -
 uu成熟食 共回答了24个问题
uu成熟食 共回答了24个问题 |采纳率95.8%(1)Fe(OH) 3
(2)氨水;不会引入新的杂质
(3)2Fe 3+ +3Mg(OH) 2 ===3Mg 2+ +2Fe(OH) 3
(4)ACDE1年前查看全部
- 化学 难容电解质的溶解平衡问题(2012·山东临沂三摸)一定温度下, Mg(OH)2在下列液体中的溶解度 由摸大到小的顺
化学 难容电解质的溶解平衡问题
(2012·山东临沂三摸)一定温度下, Mg(OH)2在下列液体中的溶解度 由摸大到小的顺序是:( )
50 mL蒸馏水;20 mL 0.5 mol/L MgCl2溶液;100 mL 0.5 mol/L NaOH溶液;30 mL 0.2 mol/L NaHSO4溶液;60 mL 0.2 mol/L NH4Cl溶液A.①②③④⑤ B.④⑤①②③
C.⑤④①②③ D.④⑤①③②
 神勇小不点A1年前1
神勇小不点A1年前1 -
 julliene 共回答了17个问题
julliene 共回答了17个问题 |采纳率70.6%选B 45123
4的NaHSO4为强酸性环境,5的NH4Cl为弱酸性环境,此时碱性的Mg(OH)2溶解度较大,4的酸性更强则溶解度更大
23均存在同离子效应,溶解度低于1的蒸馏水
23比较则3的OH-影响更大,因此3的溶解度最小1年前查看全部
- 只有难溶电解质在溶液中才存在溶解平衡,这句话对吗?
 DGSDI1年前3
DGSDI1年前3 -
 sun桃花鱼sun 共回答了27个问题
sun桃花鱼sun 共回答了27个问题 |采纳率92.6%只要是电解质达到饱和状态时就存在溶解平衡,比如:饱和的氯化钠水溶液(有其固体)中,存在氯化钠晶体的不断溶解和形成.1年前查看全部
- 化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:
化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:
(1)一定温度下,在一个固定容积的密闭容器中,可逆反应 A(g)+2B(g)═4C(g)△H>0 达到平衡时,c(A)=2mol•L-1,c( B)=4mol•L-1,c ( C)=4mol•L-1.试确定B的起始浓度c (B)的取值范围是______;若改变条件重新达到平衡后体系中C的质量分数增大,下列措施可行的是______.
A.增加C的物质的量B.加压C.升温D.使用催化剂
(2)常温下,取 pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图1所示.则图中表示醋酸溶液中pH变化曲线的是______ ( 填“A”或“B”). 设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为m2. 则m1______ m2.( 选填“<”、“=”、“>”)
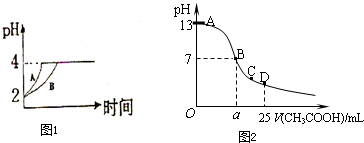
(3)某温度时,在25mL 0.1mol/L NaOH溶液中逐滴加入0.2mol/L CH3COOH溶液,曲线如图2所示,有关粒子浓度关系的比较正确的是______
A.在A、B间任一点,溶液中一定都有c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B.在B点,a>12.5,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+)
C.在C点:c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
D.在D点:c(CH3COO-)+c(CH3COOH)=2c(Na+) liuruixu1年前1
liuruixu1年前1 -
 lcv19555 共回答了20个问题
lcv19555 共回答了20个问题 |采纳率95%解题思路:(1)若A完全转化为C,B取最小值,若C完全转化为反应物,B取最大值;改变条件重新达到平衡后体系中C的体积分数增大,可使平衡正向移动或增加C;
(2)从醋酸是弱电解质的角度分析,醋酸与Zn反应同时,电离出H+,pH变化较缓慢;
(3)在25mL 0.1mol.L-1NaOH溶液中逐滴加入0.2mol•L-1 CH3COOH 溶液,二者之间相互反应,当恰好完全反应时,所需醋酸的体积为12.5mL,当反应至溶液显中性时,醋酸应稍过量,且c(OH-)=c(H+),注意根据电荷守恒思想来比较离子浓度大小.(1)可逆反应A(g)+2B(g)⇌4C(g)△H>0达到平衡时,c(A)=2mol/L,c(B)=4mol/L,c(c)=4mol/L,若A完全转化为C,消耗B为4mol/L,则B最小值为0mol/L,若C完全转化为反应物,生成2molB,则B的最大值为6mol/L,因反应为可逆反应,均不能完全转化,则B的浓度范围为0mol/L<c(B)≤6mol/L;
若改变条件重新达到平衡后体系中C的质量分数增大,应使平衡向正反应方向移动,
A、增加C的物质的量,等效为增大压强,平衡向逆反应方向移动,C的质量分数降低,故错误;
B、加压,平衡向逆反应方向移动,C的质量分数降低,故错误;
C、升温,平衡向正反应方向移动,C的质量分数增大,故正确;
D、使用催化剂,平衡不移动,C的质量分数不变,故错误;
故选C;
故答案为:0 mol•L-1≤c(B)≤6mol•L-1; C;
(2)由于醋酸是弱电解质,与Zn反应同时,电离出H+,所以pH变化较缓慢,所以B曲线是醋酸溶液的pH变化曲线.由图知盐酸和醋酸的pH变化都是由2到4,盐酸中氢离子浓度逐渐减小,但醋酸中存在电离平衡,氢离子和锌反应时促进醋酸电离,补充反应的氢离子,所以醋酸是边反应边电离H+,故消耗的Zn多,所以m1<m2.
故答案为:B;<;
(3)A、在A、B间任一点,溶液中只存在四种离子有Na+、H+、CH3COO-、OH-,根据电荷守恒则有:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),c(H+)<c(OH-),溶液中离子浓度大小关系可能为:c (Na+)>c (CH3COO-)>c (OH-)>c (H+),但也可以是氢氧化钠过量,c (Na+)>c (OH-)>c (CH3COO-)>c (H+),故A错误;
B、在B点溶液显中性,则结果是c(OH-)=c(H+),根据电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-),则一定有c(Na+)=c(CH3COO-),溶液的成分为:反应生成的醋酸钠和剩余的醋酸,醋酸钠的水解程度和醋酸的电离程度相等,故有:c(Na+)=c(CH3COO-)>c(OH-)=c(H+),故B错误;
C、在C点,溶液显酸性,故有c(OH-)<c(H+),根据电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),故c(Na+)<c(CH3COO-),c (CH3COO-)>c (Na+)>c (H+)>c (OH-),故C错误;
D、在D点时,醋酸剩余,剩余的醋酸的浓度和生成的醋酸钠浓度相等均为0.05mol/l,根据物料守恒,则:c(CH3COO-)+c(CH3COOH)=0.1mol•L-1,c(Na+)=0..05mol/L,c (CH3COO-)+c (CH3COOH)=2c (Na+)故D正确;
故选:D.点评:
本题考点: 化学平衡的影响因素;弱电解质在水溶液中的电离平衡;离子浓度大小的比较.
考点点评: 本题考查了弱电解质的电离,酸碱混合后离子浓度大小比较,化学平衡影响因素的判断,难度中等,注意溶液H+与OH-离子浓度相等时,氨水过量,题目难度中等.1年前查看全部
- 选修四模块的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:
 选修四模块的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:
选修四模块的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:
(1)一定温度下,在一个固定容积的密闭容器中,可逆反应 A(g)+2B(g)⇌4C (g)△H>0 达到平衡时,c(A)=2mol•L-1,c ( B)=7mol•L-1,c ( C)=4mol•L-1.试确定B的起始浓度c (B)的取值范围是______;若改变条件重新达到平衡后体系中C的质量分数增大,下列措施可行的是______.
A.增加C的物质的量 B.加压
C.升温D.使用催化剂
(2)常温下,取 pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示.则图中表示醋酸溶液中pH变化曲线的是______ ( 填“A”或“B”). 设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为 m2. 则
m1______ m2 ( 选填“<”、“=”、“>”)
(3)在体积为3L的密闭容器中,CO与H2在一定条件下反应生成甲醇:CO ( g)+2H2( g)→CH3OH(g)△H=-91kJ•mol-1.反应达到平衡时,平衡常数表达式K=______,升高温度,K值______(填“增大”、“减小”或“不变”).
(4)难溶电解质在水溶液中也存在溶解平衡.在常温下,溶液里各离子浓度以它们化学计量数为方次的乘积是一个常数,叫溶度积常数.例如:Cu(OH)2(s)⇌Cu2+ (aq)+2OH- ( aq),Ksp=c (Cu2+ ) c 2(OH - )=2×10 -20.当溶液中各离子浓度计量数方次的乘积大于溶度积时,则产生沉淀.若某CuSO4溶液里c( Cu2+)=0.02mol•L-1,如果生成Cu(OH)2沉淀,应调整溶液pH,使pH大于______; 要使0.2mol•L-1的CuSO4 溶液中Cu2+沉淀较为完全 ( 使Cu2+浓度降至原来的万分之一)则应向溶液里加NaOH溶液,使溶液pH等于______.
(5)常温下,某纯碱(Na2CO3) 溶液中滴入酚酞,溶液呈红色.则该溶液呈______性.在分析该溶液遇酚酞呈红色原因时,甲同学认为是配制溶液所用的纯碱样品中混有NaOH 所致;乙同学认为是溶液中Na2CO3电离出的CO32-水解所致.请你设计一个简单的实验方案用来评判甲乙两位同学的观点是否正确(包括操作、现象和结论)______. maodunzhong1年前1
maodunzhong1年前1 -
 jakelz 共回答了15个问题
jakelz 共回答了15个问题 |采纳率86.7%解题思路:(1)该反应可能是由C转化为A、B,也可能是由A、B转化为C,采用极限法判断B的取值范围;结合选项运用平衡移动原理分析解答;
(2)pH=2的盐酸和醋酸,醋酸浓度大于盐酸,随着反应的进行,醋酸继续电离出氢离子;酸与足量的金属反应时,需要金属的质量与酸的物质的量成正比;
(3)化学平衡常数K=
;升高温度,平衡向吸热反应方向移动;c(CH3OH) c(CO)c2(H2)
(4)要使溶液中产生沉淀,则c(OH-)>
,再根据水的离子积常数计算氢离子浓度,从而计算溶液的pH.Ksp c(Cu2+)
(5)常温下,纯碱(Na2CO3) 溶液中滴入酚酞,溶液呈红色,则该溶液呈碱性;
向红色溶液中加入足量BaCl2溶液,生成碳酸钡沉淀,根据颜色的变化分析.(1)该反应可能是由C转化为A、B,也可能是由A、B转化为C,如果该反应由A、B转化为C,转化为C时需要c(B)=[1/2]c(C)=2mol/L,则B的初始浓度为9mol/L,如果反应是由C转化为A和B,转化为2mol/LA时,转化为B为4mol/L,则原来气体中存在B为3mol/L,所以B初始浓度范围为:3mol•L-1~9mol•L-1,若改变条件重新达到平衡后体系中C的质量分数增大,应使平衡向正反应方向移动,
A.增加C的物质的量,等效为增大压强,平衡向逆反应方向移动,C的质量分数降低,故A错误;
B.加压,平衡向逆反应方向移动,C的质量分数降低,故B错误;
C.升温,平衡向正反应方向移动,C的质量分数增大,故C正确;
D.使用催化剂,平衡不移动,C的质量分数不变,故D错误;
故答案为:3mol•L-1~9mol•L-1 ;C;
(2)pH=2的盐酸和醋酸,醋酸浓度大于盐酸,随着反应的进行,醋酸继续电离出氢离子,所以醋酸pH变化较缓慢,则醋酸溶液中pH变化曲线为B;
酸与足量的金属反应时,需要金属的质量与酸的物质的量成正比,pH相等的醋酸和盐酸,醋酸浓度大于元素,等体积等pH的醋酸和盐酸,醋酸的物质的量大于盐酸,所以醋酸需要金属的质量多,故答案为:B;<;
(3)化学平衡常数K=
c(CH3OH)
c(CO)c2(H2);升高温度,平衡向逆反应方向移动,则平衡常数减小,故答案为:
c(CH3OH)
c(CO)c2(H2);减小;
(4)要使溶液中产生沉淀,则c(OH-)>
Ksp
c(Cu2+)=
2×10−20
0.02mol/L═10-9 mol/L,再根据水的离子积常数得氢离子浓度<
10−14
10−9mol/L=10-5mol/L,则pH大于5;使0.2mol•L-1的CuSO4 溶液中Cu2+沉淀较为完全( 使Cu2+浓度降至原来的万分之一),Cu2+浓度降至为2×10-5 mol/L,故c(OH-)=
2×10−20
2×10−5mol/L=10-7mol/L,则c(H+)=10-7mol/L,所以溶液的pH=-lg10-7=7,
故答案为:5;7;
(5)要验证该溶液遇酚酞呈红色原因,可用以下方法:
方法一:向红色溶液中加入足量BaCl2溶液,如果溶液显红色,说明甲正确,如果红色褪去点评:
本题考点: 化学平衡的影响因素;化学平衡常数的含义;弱电解质在水溶液中的电离平衡;盐类水解的应用;难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题考查较综合,涉及难溶物的溶解平衡、化学平衡常数、弱电解质的电离、盐类的水解等知识点,根据溶度积常数、化外界条件对化学平衡的影响、弱电解质的电离特点来分析解答,题目难度不大1年前查看全部
- 当氢氧化镁固体在水中达到溶解平衡Mg(OH)2(s)⇌Mg2+(aq)+2OH-(aq)时,为使Mg(OH)2
当氢氧化镁固体在水中达到溶解平衡Mg(OH)2(s)⇌Mg2+(aq)+2OH-(aq)时,为使Mg(OH)2 固体的量减少,须加入少量的( )
A. NH4Cl
B. NaOH
C. MgSO4
D. NaNO3 撵猫的老鼠1年前2
撵猫的老鼠1年前2 -
 wolflp 共回答了13个问题
wolflp 共回答了13个问题 |采纳率84.6%解题思路:根据平衡移动原理及溶度积解答,要使Mg (OH)2 固体进一步溶解,即平衡向右移动,可以加水,或降低Mg2+或OH-的浓度.A、加入少量NH4Cl,NH4+与OH-结合生成氨水,故氢氧根的浓度减小,故平衡右移,故A正确;
B、加入NaOH,OH-的浓度增大,平衡向左移动,Mg (OH)2 固体的量增大,故B错误;
C、加入少量Mg2S04,镁离子的浓度增大,平衡左移,Mg (OH)2 固体的量增大,故C错误;
D、加入少量NaNO3,不改变各种物质的浓度,故D错误;
故选A.点评:
本题考点: 难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题考查化学平衡的移动,难度不大,注意D选项硝酸钠为强酸强碱盐不对氢氧化镁中的离子浓度产生影响.1年前查看全部
- 选修四模块的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:
 选修四模块的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:
选修四模块的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:
(1)一定温度下,在一个固定容积的密闭容器中,可逆反应 A(g)+2B(g)⇌4C(g)△H>0达到平衡时,c(A)=2mol•L-1,c(B)=7mol•L-1,c(C)=4mol•L-1.试确定B的起始浓度c(B)的取值范围是______;
(2)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示.则图中表示醋酸溶液中pH变化曲线的是______( 填“A”或“B”).设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为m2. 则m1______m2( 选填“<”、“=”、“>”).
(3)在体积为3L的密闭容器中,CO与H2在一定条件下反应生成甲醇:CO(g)+2H2(g)=CH3OH(g)△H=-91kJ•mol-1.反应达到平衡时,平衡常数表达式K=c(CH3OH) c(CO).c2(H2) ,升高温度,K值______(填“增大”、“减小”或“不变”).c(CH3OH) c(CO).c2(H2)
(4)难溶电解质在水溶液中也存在溶解平衡.在常温下,溶液里各离子浓度以它们化学计量数为方次的乘积是一个常数,叫溶度积常数.例如:Cu(OH)2(s)⇌Cu2+(aq)+2OH-(aq),Ksp=c(Cu2+)c2(OH-)=2×10-20.当溶液中各离子浓度计量数方次的乘积大于溶度积时,则产生沉淀.若某CuSO4溶液里c(Cu2+)=0.02mol•L-1,如果生成Cu(OH)2沉淀,应调整溶液pH,使pH大于______. 我小不懂1年前1
我小不懂1年前1 -
 星随所愿 共回答了19个问题
星随所愿 共回答了19个问题 |采纳率89.5%解题思路:(1)该反应可能是由C转化为A、B,也可能是由A、B转化为C,采用极限法判断B的取值范围;
(2)pH=2的盐酸和醋酸,醋酸浓度大于盐酸,随着反应的进行,醋酸继续电离出氢离子;酸与足量的金属反应时,需要金属的质量与酸的物质的量成正比;
(3)化学平衡常数K=
;升高温度,平衡向吸热反应方向移动;c(CH3OH) c(CO).c2(H2)
(4)要使溶液中产生沉淀,则c(OH-)>
,再根据水的离子积常数计算氢离子浓度,从而计算溶液的pH.Ksp c(Cu2+) (1)该反应可能是由C转化为A、B,也可能是由A、B转化为C,如果该反应由A、B转化为C,转化为C时需要c(B)=[1/2]c(C)=2mol/L,则B的初始浓度为9mol/L,如果反应是由C转化为A和B,转化为2mol/LA时,转化为B为4mol/L,则原来气体中存在B为3mol/L,所以B初始浓度范围为:3mol•L-1~9mol•L-1,
故答案为:3mol•L-1~9mol•L-1;
(2)pH=2的盐酸和醋酸,醋酸浓度大于盐酸,随着反应的进行,醋酸继续电离出氢离子,所以醋酸pH变化较缓慢,则醋酸溶液中pH变化曲线为B;
酸与足量的金属反应时,需要金属的质量与酸的物质的量成正比,pH相等的醋酸和盐酸,醋酸浓度大于元素,等体积等pH的醋酸和盐酸,醋酸的物质的量大于盐酸,所以醋酸需要金属的质量多,故答案为:B;<;
(3)化学平衡常数K=
c(CH3OH)
c(CO).c2(H2);升高温度,平衡向逆反应方向移动,则平衡常数减小,故答案为:
c(CH3OH)
c(CO).c2(H2);减小;
(4)要使溶液中产生沉淀,则c(OH-)>
Ksp
c(Cu2+)mol/L=
2×10−20
0.02=10-9 mol/L,再根据水的离子积常数得氢离子浓度<
10−14
10−9mol/L=10-5mol/L,则pH大于5,故答案为:5.点评:
本题考点: 弱电解质在水溶液中的电离平衡;化学平衡常数的含义;常见离子的检验方法;难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题考查较综合,涉及难溶物的溶解平衡、化学平衡常数、弱电解质的电离等知识点,根据溶度积常数、化外界条件对化学平衡的影响、弱电解质的电离特点来分析解答,题目难度不大.1年前查看全部
- 化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:
化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:
(1)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示.则图中表示醋酸溶液中pH变化曲线的是______(填”A”或”B”).设盐酸中加入的Zn质量为m 1 ,醋酸溶液中加入的Zn质量为m 2 .则m 1 ______m 2 .(选填”<“、”=“或”>“)
(2)在体积为3L的密闭容器中,CO与H 2 在一定条件下反应生成甲醇:CO(g)+2H 2 (g)⇌CH 3 OH(g).该反应的平衡常数表达式K=______,升高温度,K值______(填”增大”“减小”或”不变”).在500℃,从反应开始到平衡,氢气的平均反应速率v(H 2 )=______.
(3)难溶电解质在水溶液中存在着溶解平衡.在某温下,溶液里各离子浓度以它们化学计量数为方次的乘积是一个常数,叫溶度积常数.例如:Mg(OH) 2 (s)⇌Mg 2+ (aq)+2OH - (aq),某温度下K sp =c(Mg 2+ )[c(OH - )] 2 =2×10 -11 .若该温度下某MgSO 4 溶液里c(Mg 2+ )=0.002mol•L -1 ,如果生成Mg(OH) 2 沉淀,应调整溶液pH,使之大于______;该温度下,在0.20L的0.002mol•L -1 MgSO 4 溶液中加入等体积的0.10mol•L -1 的氨水溶液,该温度下电离常数K (N H 3 • H 2 O)=2×1 0 -5 ,经计算______(填”有”或”无”)Mg(OH) 2 沉淀生成.
(4)常温下,向某纯碱(Na 2 CO 3 )溶液中滴入酚酞,溶液呈红色,则该溶液呈______性.在分析该溶液遇酚酞呈红色的原因时,甲同学认为是配制溶液所用的纯碱样品中混有NaOH所致;乙同学认为是溶液中Na 2 CO 3 电离出的 C
水解所致.请你设计一个简单的实验方案给甲和乙两位同学的说法以评判(包括操作、现象和结论).O 2-3 
 lipeng5181年前1
lipeng5181年前1 -
 朗姆饼干 共回答了20个问题
朗姆饼干 共回答了20个问题 |采纳率85%(1)由于醋酸是弱电解质,与Zn反应同时,电离出H + ,所以pH变化较缓慢,所以B曲线是醋酸溶液的pH变化曲线.由图知盐酸和醋酸的pH变化都是由2到4,盐酸中氢离子浓度逐渐减小,但醋酸中存在电离平衡,氢离子和锌反应时促进醋酸电离,补充反应的氢离子,所以醋酸是边反应边电离H + ,故消耗的Zn多,所以m 1 <m 2 .
故答案为:B;<;
(2)因化学平衡常数等于生成物的浓度系数次幂之积除以反应物的浓度系数次幂之积,所以K=
c(C H 3 OH)
c(CO) c 2 ( H 2 ) ,由图可知,升高温度,甲醇的含量降低,平衡逆向移动,则化学平衡常数减小,由图象可知,在500℃时,2min到达平衡,甲醇的平均反应速率v(CH 3 OH)=
n B
3L
t B mol•(L•min) -1 =
n B
3 t B mol•(L•min) -1 ,由速率之比等于化学计量数之比求出,则v(H 2 )=2v(CH 3 OH)=
2 n B
3 t B mol•(L•min) -1 ;
故答案为:K=
c(C H 3 OH)
c(CO) c 2 ( H 2 ) ,减小,
2 n B
3 t B mol•(L•min) -1 ;
(3)c(OH - )=
K SP
C(M g 2+ ) =
2×1 0 -11
0.002 mol/L=10 -4 mol/L,则c(H + )=10 -10 mol/L,所以溶液的pH=10,在0.20L的0.002mol•L -1 MgSO 4 溶液中加入等体积的0.10mol•L -1 的氨水溶液,假设氨水的电离程度不变,则混合溶液中氢氧根离子浓度=
20 ×10 -3 mol/L=4.45×10 -3 mol/L>10 -4 mol/L,所以有沉淀生成,
故答案为:10,有;
(4)酚酞遇碱变红色,该溶液呈红色说明是碱性溶液,要验证该溶液遇酚酞呈红色原因,可用以下方法,
方法一:向红色溶液中加入足量BaCl 2 溶液,如果溶液显红色,说明甲正确,如果红色褪去,说明乙正确;
方法二:加热,如果红色不变说明甲正确,如果红色加深,说明乙正确,
故答案为:向红色溶液中加入足量BaCl 2 溶液,如果溶液还显红色说明甲正确,红色褪去说明乙正确.1年前查看全部
- 难溶化合物的饱和溶液存在溶解平衡,例如:AgCl(s)→Ag+ + Cl-,Ag2CrO4(s)→2Ag+ + CrO2
难溶化合物的饱和溶液存在溶解平衡,例如:AgCl(s)→Ag+ + Cl-,Ag2CrO4(s)→2Ag+ + CrO2-4,在一定温度下,其离子浓度乘积为常数,这一常数叫溶度积常数,用Ksp表示,已知Ksp(AgCl) = c(Ag+)•c(Cl-)=1.8×10-10 ,Ksp(Ag2CrO4) = [c(Ag+)]2•c(CrO2-4)=1.9×10-12,现用0.01mol•L-1AgNO3溶液滴定0.01 mol•L-1KCl和0.001 mol•L-1K2CrO4混合溶液,通过计算回答:
当刚出现Ag2CrO4沉淀时,溶液中Cl- 浓度是多少?(设混合溶液在反应中体积不变)
13×10-6 mol·L-1.
(可逆符号用→代替) new_zhou1年前1
new_zhou1年前1 -
 飘飘大泡菜 共回答了19个问题
飘飘大泡菜 共回答了19个问题 |采纳率94.7%要使CrO2-4开始沉淀,则此时:
c(Ag+)=(1.9×10-12/0.001)1/2
根据:Ksp(AgCl) = c(Ag+)•c(Cl-)=1.8×10-10
此时:C(Cl-)=1.8×10-10/c(Ag+)
=4.13×10-6 mol·L-1.1年前查看全部
- 用溶解平衡观点如何解释溶质的溶解饱和和结晶的过程?
 花之木1年前1
花之木1年前1 -
 老房子在远方 共回答了20个问题
老房子在远方 共回答了20个问题 |采纳率95%溶解==结晶,2者可逆1年前查看全部
- 关于溶解平衡方程式书写问题请看例题:向AgBr固体加过量NaI溶液浸泡.写出离子方程式.我的问题是,方程式需不需要标明每
关于溶解平衡方程式书写问题
请看例题:向AgBr固体加过量NaI溶液浸泡.写出离子方程式.
我的问题是,方程式需不需要标明每个物质状态,用可逆号还是等号?除了热化学方程式外,什么样的方程式是必须标明每个反应物和产物状态的? dorris1年前1
dorris1年前1 -
 liangxiulong 共回答了22个问题
liangxiulong 共回答了22个问题 |采纳率90.9%如果只是写方程式,
标注状态或者不标注,都可以.
用等号,因为过量NaI,这是彻底的反应.
AgI 不加沉淀符号,因为AgBr也是难溶物.
写成 AgBr + I- = AgI + Br- 就可以了.
如果让你写溶解-沉淀平衡的方程式,请标注状态.
AgBr (s) + I- (aq) ==可逆== AgI (s) + Br- (aq)
一般来说,不是特别严格.1年前查看全部
- (rr11•浦东新区二模)Ca(OH)r是一种强电解质,口在水溶液中存在溶解平衡Ca(OH)r(手)⇌Car++rOH-
(rr11•浦东新区二模)Ca(OH)r是一种强电解质,口在水溶液中存在溶解平衡Ca(OH)r(手)⇌Car++rOH-.常温下饱和Ca(OH)r溶液的浓度为r.rrmol/L,由此求w该溶解平衡常数K的数值是( )
A.1.6×10-3
B.3.2×10-5
C.8.0×10-6
D.3.1×104 睁着眼睛做梦1年前1
睁着眼睛做梦1年前1 -
 princessray 共回答了25个问题
princessray 共回答了25个问题 |采纳率96%解题思路:依据氢氧化钙的溶度积常数计算,通过氢氧化钙的溶解度概念分析计算得到.常温5饱和Ca(小的)2溶液的浓度为下.下2m小l/L,此时溶液的体积约为1下下mL,c(Ca2+)=下.下2m小l/L;
c(小的-)=下.下2m小l/L×2=下.下六m小l/L;
Ksp=c(Ca2+)•c2(小的-)=下.下2×下.下六2=3.2×1下-5(m小l3•L-3),故选B;点评:
本题考点: 难溶电解质的溶解平衡及沉淀转化的本质;化学平衡的计算.
考点点评: 本题考查了沉淀溶度积常数的计算应用,掌握基础和计算离子浓度是关键,注意溶度积常数的计算表达,题目较简单.1年前查看全部
- 化学学科中的平衡理论 【典例导析】化学学科中的平衡理论主要包括:平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列
化学学科中的平衡理论
【典例导析】化学学科中的平衡理论主要包括:
平衡、电离平衡、水解平衡和溶解平衡四种,且均
符合勒夏特列原理.请回答下列问题:x0b Ⅰ.有甲、乙两个容积相等的恒容密闭容器,发生
反应3A(g)+B(g) =(可逆反应)xC(g) ΔH=Q kJ/mol
回答下列问题:
(1)下列各项能作为判断该反应达到化学平衡状态
的依据是 (填序号).
①v(A)=3v(B) ②混合气体的密度保持不变
③有3 mol A消耗的同时有1 mol B生成
④C的浓度保持不变
(2)根据实验测得的数据可知,温度越高该反应的
化学平衡常数越大,则Q 0(填“大于”或
“小于”).
(3)向甲中通入6 mol A和2 mol B,向乙中通入
1.5 mol A、0.5 mol B和3 mol C,将两容器的温度
恒定在770 K,使反应3A(g)+B(g) xC(g)达到平
衡,此时测得甲、乙两容器中C的体积分数均为0.2.
①若平衡时,甲、乙两容器中A的物质的量相等,则
x= ;
若平衡时,甲、乙两容器中A的物质的量不相等,则
x= .
②平衡时甲中A的体积分数为 ;x0b ③若平衡时两容器的压强不相等,则两容器中压强
之比为 . fandywj31年前1
fandywj31年前1 -
 一片云lxr 共回答了20个问题
一片云lxr 共回答了20个问题 |采纳率95%(1)③④【①因为A、B都在方程式的一边,所以无论什么情况下,v(A)=3v(B) ,故①错误;②因为密度=质量÷体积,质量根据守恒定律是不变的,体积因为是密闭容器,体积不变,所以密度始终不变,②错;③是因为消耗A是向正向进行的,生成B是向逆向进行的,而且速率满足方程式的系数,故③正确,④根据原始定义,某一物质的浓度不再发生变化,证明达到了平衡状态】
(2)大于 【升温对正反应有利,升高温度向正反应方向移动,正反应为吸热反应,故 ΔH=Q >0】
(3)①2 4 【若方程式的两边的系数不相等,则x≠4,那么两容器中反应物的原物质的物质的量相同,所以得到3×3/x+1.5=6 3×1/x+0.5=2 ,解得x=2,此时甲、乙两容器中A的物质的量相等 ; 若方程式两边的系数相等,则要满足原物质的物质的量之比相同,所以得到6/(1.5+3×3/x)=2/(0.5+3×1/x),x=4符合上式,此时甲、乙两容器中A的物质的量不相等】
②平衡时甲中A的体积分数为60%
【若方程式两边系数不相等 ,则3A + B === 2C
6 2 0
3x x 2x
6-3x 2-x 2x
得到2x/(6-3x+2-x+2x)=0.2 解得x=2/3 ,然后求出此时ABC的物质的量,计算质量分数
同理当方程式两边系数相等时,即3A + B === 4C 时,也用此方法计算】
③8:5【若压强不相等,那么是按照原来的配料比加的,那么方程式为3A + B===4C ,甲中ABC物质的量分别为4.8、 1.6 、1.6,一共是8,乙中物质的量分别为3、1、1,一共是5,因为两容器的体积相等,所以压强之比等于物质的量之比=8:5】1年前查看全部
- (2013•赤壁市模拟)化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.
 (2013•赤壁市模拟)化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:
(2013•赤壁市模拟)化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:
(1)一定温度下,在一个固定容积的密闭容器中,可逆反应 A(g)+2B(g)═4C(g)△H>0 达到平衡时,c(A)=2mol•L-1,c(B)=4mol•L-1,c(C)=4mol•L-1.试确定B的起始浓度c(B)的取值范围是______;若改变条件重新达到平衡后体系中C的质量分数增大,下列措施可行的是______.
A.增加C的物质的量B.加压C.升温D.使用催化剂
(2)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图甲所示.则图中表示醋酸溶液中pH变化曲线的是______ (填“A”或“B”).设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为m2.则m1______ m2.(选填“<”、“=”、“>”)
(3)某温度时,在25mL 0.1mol/L NaOH溶液中逐滴加入0.2mol/L CH3COOH溶液,曲线如图乙所示,有关粒子浓度关系的比较正确的是______.
A.在A、B间任一点,溶液中一定都有c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B.在B点,a>12.5,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+)
C.在C点:c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
D.在D点:c(CH3COO-)+c(CH3COOH)=2c(Na+)
(4)难溶电解质在水溶液中存在着电离平衡.在常温下,溶液里各离子浓度以它们化学计量数为方次的乘积是一个常数,叫溶度积常数.例如:Cu(OH)2(s)⇌Cu2+(aq)+2OH-(aq),Ksp=c(Cu2+ )c2(OH-)=2×10-20.当溶液中各离子浓度方次的乘积大于溶度积时,则产生沉淀,反之固体溶解.若某CuSO4溶液里c( Cu2+)=0.02mol•L-1,如果生成Cu(OH)2沉淀,应调整溶液pH,使之大于______;要使0.2mol•L-1的CuSO4 溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一)则应向溶液里加NaOH溶液,使溶液pH值为______.
(5)常温下,某纯碱(Na2CO3)溶液中滴入酚酞,溶液呈红色.则该溶液呈______性.在分析该溶液遇酚酞呈红色原因时,甲同学认为是配制溶液所用的纯碱样品中混有NaOH所致;乙同学认为是溶液中Na2CO3电离出的CO32-水解所致.请你设计一个简单的实验方案给甲和乙两位同学的说法以评判(包括操作、现象和结论)______. 9o9gerer1年前1
9o9gerer1年前1 -
 goodpasswords 共回答了26个问题
goodpasswords 共回答了26个问题 |采纳率100%解题思路:(1)若A完全转化为C,B取最小值,若C完全转化为反应物,B取最大值;改变条件重新达到平衡后体系中C的体积分数增大,可使平衡正向移动或增加C;
(2)醋酸为弱酸,等pH时,醋酸浓度较大,与锌反应时,醋酸进一步电离出氢离子,则醋酸的pH变化较小,醋酸中存在电离平衡,氢离子和锌反应时促进醋酸电离,补充反应的氢离子,pH变化等量时,消耗的锌较多,以此解答;
(3)在25mL 0.1mol.L-1NaOH溶液中逐滴加入0.2mol•L-1 CH3COOH 溶液,二者之间相互反应,当恰好完全反应时,所需醋酸的体积为12.5mL,当反应至溶液显中性时,醋酸应稍过量,且c(OH-)=c(H+),注意根据电荷守恒思想来比较离子浓度大小;
(4)根据Ksp=c(Cu2+)•[c(OH-)]2=2×10-20,根据Cu2+离子的浓度计算OH-离子的浓度,根据水的离子积常数计算氢离子浓度,并以此计算溶液pH值;
(5)常温下,纯碱(Na2CO3) 溶液中滴入酚酞,溶液呈红色,则该溶液呈碱性;向红色溶液中加入足量BaCl2溶液,生成碳酸钡沉淀,根据颜色的变化分析..(1)可逆反应A(g)+2B(g)⇌4C(g)△H>0达到平衡时,c(A)=2mol/L,c(B)=4mol/L,c(c)=4mol/L,若A完全转化为C,消耗B为4mol/L,则B最小值为0mol/L,若C完全转化为反应物,生成2mol/LB,则B的最大值为6mol/L,因反应为可逆反应,均不能完全转化,则B的浓度范围为0mol/L<c(B)<6mol/L;
若改变条件重新达到平衡后体系中C的质量分数增大,应使平衡向正反应方向移动,
A增加C的物质的量,等效为增大压强,平衡向逆反应方向移动,C的质量分数降低,故A错误;
B加压,平衡向逆反应方向移动,C的质量分数降低,故B错误;
C升温,平衡向正反应方向移动,C的质量分数增大,故C正确;
D使用催化剂,平衡不移动,C的质量分数不变,故D错误;
故答案为:0mol/L<c(B)<6mol/L;C;
(2)由于醋酸是弱电解质,与Zn反应同时,电离出H+,所以pH变化较缓慢,所以B曲线是醋酸溶液的pH变化曲线.由图知盐酸和醋酸的pH变化都是由2到4,盐酸中氢离子浓度逐渐减小,但醋酸中存在电离平衡,氢离子和锌反应时促进醋酸电离,补充反应的氢离子,所以醋酸是边反应边电离H+,故消耗的Zn多,所以m1<m2,
故答案为:B;<;
(3)A、在A、B间任一点,溶液中只存在四种离子有Na+、H+、CH3COO-、OH-,根据电荷守恒则有:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),c(H+)<c(OH-),溶液中离子浓度大小关系为:c (Na+)>c (CH3COO-)>c (OH-)>c (H+),还有可能c (Na+)>c (OH-)>c (CH3COO-)>c (H+),故A错误;
B、在B点溶液显中性,则结果是c(OH-)=c(H+),根据电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-),则一定有c(Na+)=c(CH3COO-),溶液的成分为:反应生成的醋酸钠和剩余的醋酸,醋酸钠的水解程度和醋酸的电离程度相等,故有:c(Na+)=c(CH3COO-)>c(OH-)=c(H+),故B错误;
C、在C点,溶液显酸性,故有c(OH-)<c(H+),根据电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),故c(Na+)<c(CH3COO-),c (CH3COO-)>c (Na+)>c (H+)>c (OH-),故C错误;
D、在D点时,醋酸剩余,剩余的醋酸的浓度和生成的醋酸钠浓度相等均为0.05mol/l,根据物料守恒,则:c(CH3COO-)+c(CH3COOH)=0.1mol•L-1,c(Na+)=0..05mol/L,c (CH3COO-)+c (CH3COOH)=2c (Na+),故D正确;
故选D;
(4)某CuSO4溶液里c(Cu2+)=0.02mol/L,如果生成Cu(OH)2沉淀,则应有c(OH-)≥
2×10−20
0.02mol/L=10-9mol/L,则c(H+)≤
1×10−14
10−9mol/L=10-5mol/L,
所以pH≥-lg(10-5)=5;
Cu2+沉淀较为完全是的浓度为[0.2mol/L/1000]=2×10-4mol/L,
则c(OH-)=
2×10−20
2×10−4mol/L═10-8mol/L,
则c(H+)=
1×10−14
10−8mol/L=10-6mol/L,
所以pH=-lg(10-6)=6,
故答案为:5; 6;
(5)常温下,纯碱(Na2CO3) 溶液中滴入酚酞,溶液呈红色,则该溶液呈碱性;
要验证该溶液遇酚酞呈红色原因,可用以下方法:
方法一:向红色溶液中加入足量BaCl2溶液,如果溶液显红色,说点评:
本题考点: 化学平衡的影响因素;弱电解质在水溶液中的电离平衡;难溶电解质的溶解平衡及沉淀转化的本质;离子浓度大小的比较.
考点点评: 本题考查弱电解质的电离,化学平衡影响因素分析判断,侧重于学生的分析能力的考查,为高考常见题型和高频考点,有利于培养学生的良好的科学素养,提高学生学习的积极性,注意把握弱电解质的电离特点和影响因素,平衡移动原理实质理解应用、溶度积常数的计算,题目难度不大,注意把握计算公式的运用.1年前查看全部
- 电离平衡和溶解平衡有什么关联
 xyldh1年前1
xyldh1年前1 -
 独孤的日子 共回答了18个问题
独孤的日子 共回答了18个问题 |采纳率100%ksp影响溶解度,而ksp又和电离平衡有关.1年前查看全部
- 从溶解平衡原理说明硫酸钡在硫酸钠溶液中的溶解度比在水中小的原因
 楚留光1年前1
楚留光1年前1 -
 yuzhoutaigong 共回答了25个问题
yuzhoutaigong 共回答了25个问题 |采纳率92%BaSO4==ba2++so42-微溶于水.
na2so4==2na++so42-易溶于水.
由于硫酸钠溶液中含有大量的硫酸根离子,抑制了硫酸钡产生硫酸根离子1年前查看全部
大家在问
- 1为什么sinx中的x趋向于零时等于x
- 2高数一道极限题 证明(1+x)的1/n次方在x趋于零时的极限值为1.
- 3我评陈胜根据语文课本上的陈涉世家来评论陈胜好的坏的都可以.
- 4数的运算先说出运算顺序,在计算375+450÷18×25(5分之4+4分之1)÷3分之7+10分之7
- 5下图示意某国城镇人口和乡村人口的变化。读图回答1~2题。
- 6下列排序以及化学用语的使用,没有错误的一项是( )
- 7Launch Concerns什么意思?
- 8解方程:x:5/6=3/15
- 95瓶果汁 是6元 翻译
- 10999-111=?多少
- 11(2012•浙江模拟)下列说法正确的是( )
- 12已知点Q(3,0)点P在圆x^2+y^2=1运动,动点M满足向量PM=1/2向量MQ,求点M的轨迹方程
- 13代数式ax+by,当x=5,y=2时,它的值是7;x=8,y=5时,它的值是4,试求x=7,y= -5时代数式ax-by
- 141/2+1/4+1/8=1/16+.+1/2n=1-( )
- 15导数和微积分先学哪个?rt随便看看
