碳酸钾是不是与氧化钙反应才生成氢氧化钾、碳酸钙啊?碳酸钾与氢氧化钙不会反应吧?
 gao9362022-10-04 11:39:541条回答
gao9362022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 xdboyx2000 共回答了16个问题
xdboyx2000 共回答了16个问题 |采纳率93.8%- 当然反应,在溶液中,碳酸钙溶解度最小,因此平衡向着形成碳酸钙的方向移动,反应进行的相当完全.其实过去在电力不发达的时候,利用石灰和碳酸钠的反应正是获得烧碱(氢氧化钠)的一种方法.而钠和钾在这个反应中都是无关离子.
- 1年前
相关推荐
- 氢氧化钠 硫化钙 碳酸钾 氯化铝 二氧化碳 硫酸铜 氢气 高锰酸钾
 hnwccrj1年前1
hnwccrj1年前1 -
 我会回来的0 共回答了17个问题
我会回来的0 共回答了17个问题 |采纳率94.1%NaOH CaCl2 K2CO3 AlCl3 CO2 CuSO4 H2 K2MnO41年前查看全部
- (1)草木灰是柴草燃烧后所留下的灰分,含有碳酸钾,硫酸钾,氯化钾,以及磷,钙等多种元素.草木灰中90%以上的钾盐是水溶性
(1)草木灰是柴草燃烧后所留下的灰分,含有碳酸钾,硫酸钾,氯化钾,以及磷,钙等多种元素.草木灰中90%以上的钾盐是水溶性的,因此草木灰是农村常用的钾肥,但草木灰不宜用做氮肥的铵盐(如碳酸氢铵,硝酸铵)混合使用.
(2)在实验室里配制CuSO4溶液时,加入少量硫酸. 小mm1年前2
小mm1年前2 -
 karmen1314 共回答了15个问题
karmen1314 共回答了15个问题 |采纳率86.7%1,草木灰中有碳酸钾之类的强碱弱酸盐,因此溶液为碱性,易于使铵类碱反应,生成氨气,导致氮的流失
2,阳离子易水解的盐溶解时大多要加酸抑制水解.1年前查看全部
- 碳酸钾中含有少量氯化钾和不溶于水的物质,在t 0C时将20g该混合物放入60g溶质质量分数为18.5%的氯化钙溶液
碳酸钾中含有少量氯化钾和不溶于水的物质,在t 0C时将20g该混合物放入60g溶质质量分数为18.5%的氯化钙溶液
碳酸钾中含有少量氯化钾和不溶于水的物质,在t ℃时将20g该混合物放入60g溶质质量分数为18.5%的氯化钙溶液中,恰好完成反应,过滤后得到14.5g固体,再将该固体放入足量水中,充分溶解后仍有12.2g固体,求:
1、 原混合物中氯化钾的质量分数.
2、 t ℃时氯化钾的溶解度. 名字都被占了1年前1
名字都被占了1年前1 -
 screama6 共回答了20个问题
screama6 共回答了20个问题 |采纳率75%可以肯定的是最后的固体是碳酸钙和那些开始就不溶于水的顽固物质,假设开始碳酸钾是xmol,氯化钾是ymol,杂质是z克.根据初始条件20g,可得99x+74.5y+z=20,根据完全反应可知碳酸钾与溶液中氯化钙完全反应,也就是说溶液中氯化钙是多少mol原来混合物中碳酸钾就是多少mol(一对一反应嘛),氯化钙的n=60*0.185/111=0.1mol,即x值.最后根据碳酸根守恒,最后12.2克物质是碳酸钙和不溶物质,即100x+z=12.2,得z=2.2g,那么原来氯化钾的质量就等于20-99*0.1-2.2=7.9,(这题出的真逗,氯化钾物质的量都超过碳酸钾了,还叫含少量),质量分数就是7.9/20=39.5%
第二题,首先知道了原来碳酸钾是0.1mol,那完全反应后生成的氯化钾是0.1mol,质量是7.45g,加上原来的氯化钾一共是15.35g,第一次溶于水后新出的氯化钾质量=14.5-12.2(很好理解,析出的在第二次溶解了,溶解的量就是第一次析出的量),即2.3g,则饱和溶液中含氯化钾的质量就是15.35-2.3=13.05g,t°C下溶解度就是13.05*100/60=21.75g(溶解度定义)
这是我的解法,仅供参考1年前查看全部
- 有科学家提出回收利用CO2的构想:把空气吹入碳酸钾溶液,从溶液中提取出CO2,又在合成塔使之变为燃料甲醇(CH3OH).
有科学家提出回收利用CO2的构想:把空气吹入碳酸钾溶液,从溶液中提取出CO2,又在合成塔使之变为燃料甲醇(CH3OH).该技术流程如下:
N2、O2 H2
|( 这里箭头是向下的) |(这里箭头是向下的)
空气——吸收池————分解池——合成塔——甲醇(横杠代表向右的箭头
(吸收池中盛有饱和的K2CO3溶液,合成塔内的反应条件为300℃、200kPa和催化剂.)
1)合成塔中发生反应的化学方程式 2)请在图中标出可循环利用的物质名称和循环方向 3)若空气不经吸收池和分解池而直接通入合成塔,你认为可行吗?原因.
4)请计算生产4.8t甲醇,可回收空气中CO2的质量是多少? zlx_7212221年前0
zlx_7212221年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 4道化学填空分离和提纯下列混合物1.碘水中提取碘-----2.从碳酸钾和食盐的混合物中提取纯碱----3.除去水中的钠离
4道化学填空
分离和提纯下列混合物
1.碘水中提取碘-----
2.从碳酸钾和食盐的混合物中提取纯碱----
3.除去水中的钠离子和氯离子----
4.除去二氧化碳中的少量HCl气体-- 再说一次爱上你1年前1
再说一次爱上你1年前1 -
 guaichang 共回答了22个问题
guaichang 共回答了22个问题 |采纳率72.7%1.萃取
2.应该是碳酸纳里提取纯碱吧?那么应该是是————冷却热饱和溶液
3.蒸馏
4.把气体通入水中1年前查看全部
- 现有硫酸氯化钡碳酸钾硫酸铁和氯水5种溶液有如图所示的相互关系图中每条连线两端的物质皆可发生化学反应下
现有硫酸氯化钡碳酸钾硫酸铁和氯水5种溶液有如图所示的相互关系图中每条连线两端的物质皆可发生化学反应下
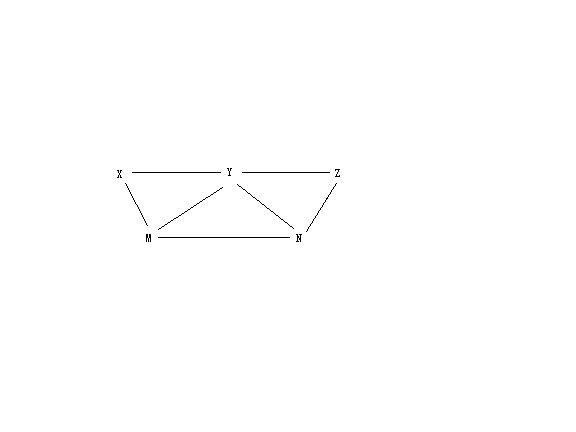
A:X一定为硫酸
B:Y一定为碳酸钾
C:Z可能为氯水
D:M可能为硫酸铁
不合理的是 Flysun_20071年前0
Flysun_20071年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 关于碳肥 草木灰的~一下三种物质都是常用的化学肥料:1 .尿素 2 .氯化铵 3 .碳酸钾 4.碳铵(NH4HCO3).
关于碳肥 草木灰的~
一下三种物质都是常用的化学肥料:1 .尿素 2 .氯化铵 3 .碳酸钾 4.碳铵(NH4HCO3)..其中属于氮肥的是_____,草木灰中有较多的_____.(填写编号),碳铵受热后会失去肥效,请用化学方程式解释原因______________________ 蓝色心情abc1年前3
蓝色心情abc1年前3 -
 学会坚强hh 共回答了14个问题
学会坚强hh 共回答了14个问题 |采纳率100%1.3
一般条件下硝酸铵可分解NH4NO3====HNO3+NH3↑1年前查看全部
- 如何用一种试剂鉴别碳酸钾,氢氧化钾,氯化钡,亚硫酸钠
如何用一种试剂鉴别碳酸钾,氢氧化钾,氯化钡,亚硫酸钠
急 天地之间的轮回1年前1
天地之间的轮回1年前1 -
 vogue296 共回答了25个问题
vogue296 共回答了25个问题 |采纳率100%硫酸吧,
1生成气体
2无反应,
3沉淀
4大概会有颜色反应吧1年前查看全部
- 有硝酸,氯化铜,碳酸钾,氢氧化钒和硫酸钠五种溶液,其中_____和其余四种都能发生化学反应,这些反应的基本
有硝酸,氯化铜,碳酸钾,氢氧化钒和硫酸钠五种溶液,其中_____和其余四种都能发生化学反应,这些反应的基本
类型都属于______反应,写出有关反应的化学方程式. 洪水伴着龙卷风1年前4
洪水伴着龙卷风1年前4 -
 衣剑封侯 共回答了13个问题
衣剑封侯 共回答了13个问题 |采纳率92.3%氢氧化钒
复分解
(1)氢氧化钒与硝酸:3HNO3+V(OH)3==V(NO3)3+3H2O
(2)氢氧化钒与氯化铜:3CuCl2+2V(OH)3==3Cu(OH)2(沉淀)+2VCl3
(3)氢氧化钒与碳酸钾:3K2CO3+2V(OH)3==V2(CO3)3(沉淀)+6KOH
(4)氢氧化钒与硫酸钠:3Na2SO4+2V(OH)3==V2(SO4)3(沉淀)+6NaOH
其中V2(SO4)3(硫酸钒)是微溶,可以看做沉淀!
每个反应都符合复分解反应的条件:有水、沉淀或气体生成!
复分解反应的实质是两种物质互换离子,各元素化合价不变!
做这种题,得把溶解性表背下来,在对每种物质进行反应,一一比较就可以了~1年前查看全部
- 用一种试剂鉴别氢氧化钠、碳酸钾、硝酸钡、氨水、氯化钾?
 我是阿辉哥1年前4
我是阿辉哥1年前4 -
 yuanjianfeng 共回答了19个问题
yuanjianfeng 共回答了19个问题 |采纳率100%只要用硫酸铝溶液就可以!
氢氧化钠:先出现沉淀,然后沉淀消失
碳酸钾:有沉淀和气体(双水解)
硝酸钡:白色沉淀!
氨水:白色沉淀
氯化钾:无现象!
然后用检验出来的碳酸钾去检验硝酸钡、氨水.前者有沉淀,后者没有沉淀!1年前查看全部
- 实验制取CO2,能否用碳酸钾或碳酸钠粉末代替块状碳酸钙
实验制取CO2,能否用碳酸钾或碳酸钠粉末代替块状碳酸钙
如题.为什么. lxmlf15671年前2
lxmlf15671年前2 -
 一片梧桐树叶 共回答了18个问题
一片梧桐树叶 共回答了18个问题 |采纳率100%从二氧化碳产生的原理上看是没问题的,问题的关键在于用粉末状的碳酸钾和碳酸钠本身会溶解在水里,用盐酸溶液跟它们混合制取二氧化碳相当于拿碳酸钾或碳酸钠溶液跟盐酸溶液倒在一起,反应速度太快太充分,会突然产生大量的气泡导致混合液喷出容器,可能导致实验人员受伤,最幸运的也是来不及收集或者仔细观察反应状态它们就反应完了.而用块状碳酸钙不会溶解在水里,可以跟盐酸保持一定的反应速度生成二氧化碳,是很理想的制取方式.1年前查看全部
- 初三化学第九单元的计算题1.向50g 碳酸钾浴液中加入51.5g 稀硝酸,恰好完全反应,生成硝酸钾、二氧化碳和水,反应后
初三化学第九单元的计算题
1.向50g 碳酸钾浴液中加入51.5g 稀硝酸,恰好完全反应,生成硝酸钾、二氧化碳和水,反应后浴液的质量减少了1.1g .请计算:(1)二氧化碳的质量 (2)50g 碳酸钾浴液中溶质的质量 (3)反应后所得浴液中溶质的质量分数(谢谢~) pla6411141年前1
pla6411141年前1 -
 阿于 共回答了15个问题
阿于 共回答了15个问题 |采纳率86.7%(1)二氧化碳的质量=1.1g
设碳酸钾溶液中溶质的质量为X,反应后所得溶液中溶质的质量为Y
K2CO3+2HNO3=2KNO3+H2O+CO2(气体符号)
138 202 44
X Y 1.1g
138/X=202/Y=44/1.1g
X=3.45g
Y=5.05g
反应后所得溶液的质量=50g+51.5g-1.1g=100.4g
反应后所得溶液中溶质的质量分数=5.05g/100.4g *100%=5%
答:(1)二氧化碳的质量为1.1克
(2)50g 碳酸钾溶液中溶质的质量为3.45克
(3)反应后所得溶液中溶质的质量分数为5%
如帮到了你,
【你的10分满意,我们团队的无限动力】1年前查看全部
- 甲烷燃料电池,碳酸钾溶液作电解质
甲烷燃料电池,碳酸钾溶液作电解质
你给的电极反应式,H原子个数未守恒.应该是错了. 001011年前2
001011年前2 -
 lovesnoopy 共回答了18个问题
lovesnoopy 共回答了18个问题 |采纳率83.3%负极:10OH-+CO32-+CH4-8e-=2HCO3-+7H2O
正极:2O2+8e-+4H2O=8OH-1年前查看全部
- 碳酸钾和硫酸钾反应生成硫酸钾,水和二氧化碳化学方程式
 cet20060001年前3
cet20060001年前3 -
 雨双儿 共回答了18个问题
雨双儿 共回答了18个问题 |采纳率88.9%K2CO3+H2SO4==K2SO4+H2O+CO2↑1年前查看全部
- (2013•大兴区二模)据有关资料介绍:将贝壳(主要成分是碳酸钙)灼烧后与草木灰(主要成分是碳酸钾)在水中作用,可以得到
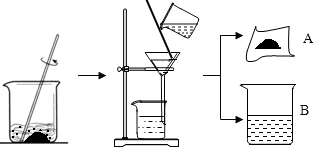 (2013•大兴区二模)据有关资料介绍:将贝壳(主要成分是碳酸钙)灼烧后与草木灰(主要成分是碳酸钾)在水中作用,可以得到氢氧化钾.某化学课外小组的同学们为了制取氢氧化钾,将少量碳酸钙充分灼烧后的固体放入烧杯中,再向其中加入一定量10%的碳酸钾溶液,充分反应冷却后过滤、洗涤得到固体A和溶液B,操作步骤如图所示.请你与小组同学共同完成以下探究:
(2013•大兴区二模)据有关资料介绍:将贝壳(主要成分是碳酸钙)灼烧后与草木灰(主要成分是碳酸钾)在水中作用,可以得到氢氧化钾.某化学课外小组的同学们为了制取氢氧化钾,将少量碳酸钙充分灼烧后的固体放入烧杯中,再向其中加入一定量10%的碳酸钾溶液,充分反应冷却后过滤、洗涤得到固体A和溶液B,操作步骤如图所示.请你与小组同学共同完成以下探究:
【提出问题1】固体A中的成分是什么?
【查阅资料】
①CaCO3
CaO+CO2↑高温 .
②碳酸钾与碳酸钠性质相似,在溶液中都能与氢氧化钙发生复分解反应.
【猜想与假设】甲同学:只有CaCO3;乙同学:CaCO3、Ca(OH)2;丙同学:CaCO3、CaO
甲、乙两位同学认为丙同学的猜想不合理,理由是______(用化学方程式表示).
【实验与探究】
甲、乙同学为了验证各自的猜想,分别进行了下述实验:
【反思与评价】小组同学讨论后认为,甲同学的实验不能证明他的猜想,理由是______;而乙同学的实验能证明他的猜想,因此小组同学确定了固体A的成分.实验操作 实验现象 实验结论 甲同学:取少量固体于试管中,向其中加入稀盐酸 有气泡产生 自己的猜想正确 乙同学:______ ______ 自己的猜想正确
【提出问题2】溶液B中溶质的成分是什么?
【猜想与假设】猜想1:KOH、K2CO3;猜想2:KOH、Ca(OH)2;猜想3:KOH
【表达与交流】结合上述实验,同学们讨论确定了猜想______正确,理由是______.为了得到纯净的氢氧化钾,需要向溶液B中滴加适量的一种溶液,发生反应的化学方程式为______. 相约在xx1年前1
相约在xx1年前1 -
 网上孤客 共回答了22个问题
网上孤客 共回答了22个问题 |采纳率90.9%解题思路:由题目的信息可知:甲、乙两位同学认为丙同学的猜想不合理,理由是生石灰和水反应生成熟石灰,因此氧化钙不存在;甲同学:取少量固体于试管中,向其中加入稀盐酸,有气泡产生,他的猜想不一定正确,因为CaCO3和Ca(OH)2混合物加入盐酸也会有气体产生,所以不能证明固体中只有CaCO3.乙同学:取少量固体于试管中,加水溶解后过滤,向滤液中加入酚酞溶液,滤液变为红色,说明是碳酸钙和氢氧化钙的混合物,因此乙同学的猜想正确;结合上述实验,同学们讨论确定了猜想2是正确的,因为反应后一定有KOH生成,上述实验中乙同学证明了固体含有Ca(OH)2,则溶液中一定存在溶解的Ca(OH)2;为了得到纯净的氢氧化钾,只要把过量的氢氧化钙除去即可,氢氧化钙可以用适量的碳酸钾除去,氢氧化钙与碳酸钾反应生成碳酸钙白色沉淀和氢氧化钾,配平即可.【猜想与假设】甲、乙两位同学认为丙同学的猜想不合理,理由是生石灰和水反应生成熟石灰,因此氧化钙不存在,故答案为:CaO+H2O=Ca(OH)2【实验与探究】甲同学:取少量固体于试管中,向其中加入稀盐酸,有气泡产生...
点评:
本题考点: 实验探究物质的组成成分以及含量.
考点点评: 本题属于实验探究题,要注意由实验现象得出正确的结论,设计实验方案时,要注意用最少的药品和最简单的方法;关于对实验设计方案的评价,要在两个方面考虑,一是方案是否可行,能否达到实验目的;二是设计的方法进行比较,那种方法更简便.本考点主要出现在实验题中.1年前查看全部
- 碳酸钾受热分解成什么?化学方程式是什么
 刺玫瑰AITA1年前3
刺玫瑰AITA1年前3 -
 梦里花开了 共回答了9个问题
梦里花开了 共回答了9个问题 |采纳率88.9%分解成氧化钾和二氧化碳.
方程式是:K2CO3==△==K2O+CO2↑1年前查看全部
- 硫酸与碳酸钾粉末反应现象
 xmingbb1年前1
xmingbb1年前1 -
 523597882 共回答了21个问题
523597882 共回答了21个问题 |采纳率76.2%碳酸钾粉末溶解,产生气泡1年前查看全部
- 请来验证碳酸钾加热是生成氧化钾和二氧化碳吗?
请来验证碳酸钾加热是生成氧化钾和二氧化碳吗?
如果是请写一个分子式过程给我.
同理:碳酸钠加热的情况? 老火啊啊1年前1
老火啊啊1年前1 -
 acuj 共回答了19个问题
acuj 共回答了19个问题 |采纳率89.5%K2CO3==K2O+CO2
Na2CO3==Na20+CO21年前查看全部
- 碳酸钾和盐酸反应的化学方程式?(配平)
 七十二变361年前4
七十二变361年前4 -
 我爱小奶嘴 共回答了17个问题
我爱小奶嘴 共回答了17个问题 |采纳率88.2%K2CO3+2HCl=2KCl+H2O+CO2↑1年前查看全部
- (2012•达州)草木灰是一种常见的农家肥料,其主要成分是碳酸钾(K2CO3);硫酸铵[(NH4)2SO4]是一种氮肥.
(2012•达州)草木灰是一种常见的农家肥料,其主要成分是碳酸钾(K2CO3);硫酸铵[(NH4)2SO4]是一种氮肥.为了给农民朋友提供技术指导,小明对这两种肥料作了相关性质的探究.
【友情提示】:碳酸钾与纯碱具有相似的化学性质;
【实验探究】:并完成以下各题
【交流共享】:①硫酸铵不宜长期使用,易造成土壤酸化而板结;草木灰的使用既实现了变废为宝,还起到了改良酸性土壤的作用;探究过程 K2CO3 (NH4)2SO4 结论及化学方程式 ①、分别取碳酸钾和硫酸铵固体,加足量水搅拌,测其温度变化情况 得到澄清溶液;
温度无明显变化得到澄清溶液;
温度明显降低都易溶于水;
硫酸铵溶于水时吸收的热量大于放出的热量.②、取①中溶液分别滴入紫色石蕊试液,观察溶液颜色变化,并判断其酸碱性 ______ 变红 碳酸钾溶液显______性
硫酸铵溶液显______性③、另取①中溶液分别加入足量稀盐酸,观察现象 ______ 无明显现象 写出相关反应的化学方程式:
______④、再取①中溶液分别加入Ba(OH)2溶液,观察现象 产生
白色沉淀______ (NH4)2SO4与Ba(OH)2溶液反应的化学方程式:
(NH4)2SO4+Ba(OH)2=BaSO4↓+2H2O+2NH3↑
②草木灰和硫酸铵能否混合使用?(填“能“或“否”)______
【知识拓展】:若要鉴别失去标签的碳酸钾和硫酸铵固体,下列试剂不可用的是:______.
A、水B、稀盐酸C、氯化钡溶液D、无色酚酞试液. wazxap1年前1
wazxap1年前1 -
 shiigloo 共回答了14个问题
shiigloo 共回答了14个问题 |采纳率92.9%解题思路:【实验探究】:②根据碳酸钾与纯碱具有相似的化学性质,呈碱性,使石蕊试液变蓝,硫酸铵使石蕊试液变红,说明呈酸性;
③根据碳酸钾与盐酸反应生成氯化钾、水和二氧化碳解答;
④根据氢氧化钡和硫酸铵反应生成硫酸钡、氨气和水解答;
【交流共享】:②铵态氮肥和显碱性物质混合能生成氨气,从而降低肥效;
【知识拓展】:A、根据碳酸钾和硫酸铵溶于水溶液显酸碱性分析;
B、根据碳酸钾与盐酸反应生成二氧化碳气体,硫酸铵与盐酸不反应分析;
C、氯化钡与碳酸钾和硫酸铵反应都生成白色沉淀分析;
D、根据无色酚酞遇碱性物质碳酸钾变红,遇酸性的硫酸铵不显色分析;【实验探究】:②碳酸钾与纯碱具有相似的化学性质,所以碳酸钾溶液呈碱性,使石蕊试液变蓝,硫酸铵使石蕊试液变红,说明呈酸性,故填:变蓝;碱;酸;
③碳酸钾与盐酸反应生成氯化钾、水和二氧化碳,反应的化学方程式为2HCl+K2CO3=2KCl+CO2↑+H2O,故填:产生大量气泡;2HCl+K2CO3=2KCl+CO2↑+H2O;
④氢氧化钡和硫酸铵反应生成硫酸钡、氨气和水,硫酸钡是不溶于水的白色物质,氨气有刺激性气味,故填:产生白色沉淀、有刺激性气味的气体生成
【交流共享】:②铵态氮肥和显碱性物质混合能生成氨气,从而降低肥效,故填:否;
【知识拓展】:A、把碳酸钾和硫酸铵固体溶于水形成溶液,测其温度就能区分,故A可用;
B、碳酸钾与盐酸反应生成二氧化碳气体,硫酸铵与盐酸不反应,能区分,故B可用;
C、氯化钡与碳酸钾反应生成白色沉淀碳酸钡,氯化钡与硫酸铵反应生成白色沉淀硫酸钡,现象一样,不能区分,故C不可用;
D、无色酚酞遇碱性物质碳酸钾变红,遇酸性的硫酸铵不显色,能区分,故D可用;
故选C.点评:
本题考点: 实验探究物质的性质或变化规律;酸碱指示剂及其性质;盐的化学性质;酸、碱、盐的鉴别.
考点点评: 本题主要考查氮肥、钾肥的判断和使用时的注意事项,难度稍大,须熟练运用酸碱盐的性质进行解答;1年前查看全部
- 碳酸钾为何能与碳酸氢氨反应?不水容液都呈碱性吗
 qianxiaoqiu1年前3
qianxiaoqiu1年前3 -
 权儿乖乖 共回答了18个问题
权儿乖乖 共回答了18个问题 |采纳率94.4%NH4+ + CO32- =NH3+HCO3-1年前查看全部
- 关于物质的酸碱性碳酸钾溶液竟然是碱性的!难道不是某酸某都是酸性的吗?请问该怎么区别?
 melodyyan1年前7
melodyyan1年前7 -
 sicyang 共回答了21个问题
sicyang 共回答了21个问题 |采纳率100%有一种简单的记法
如果一个盐是弱酸强碱盐 就是醋酸,碳酸等弱酸的酸根配上强碱的阳离子比如钠离子,钾离子
那么就显碱性
反之,如果是强酸弱碱盐比如硫酸铵,氯化铵,就显酸性
口诀就是谁强显谁性,同强显中性(比如醋酸铵,氯化钠)
这个涉及水解的知识 具体的可以再问我1年前查看全部
- 有一混合溶液是由碳酸钾、氯化镁、稀硫酸、稀硝酸四种物质中的两种混合而成,向该混合液中滴加氢氧化钡溶液,产生沉淀的质量与滴
有一混合溶液是由碳酸钾、氯化镁、稀硫酸、稀硝酸四种物质中的两种混合而成,向该混合液中滴加氢氧化钡溶液,产生沉淀的质量与滴入氢氧化钡溶液的体积的关系如图,则该混合物的可能组成是:(图是一开始一条向上的斜线,然后就变为水平直线)
为什么不是碳酸钾和氯化镁?我选的是这个,但是答案上是氯化镁和稀硫酸.
某物质经过鉴定只含有一种元素,则此物质()
我选的是可能是纯净物,也可能是混合物,但是答案上选的是:一定是一种单质.
为什么? mfdwl1年前3
mfdwl1年前3 -
 cwb94191034 共回答了20个问题
cwb94191034 共回答了20个问题 |采纳率90%1. 这个完全取决于图的细节了.
碳酸钾和氯化镁:图像是不经过原点的斜线+水平线,斜线与纵轴交在原点上方;或者直接是不经过原点的水平线
氯化镁和稀硫酸:图像是经过原点的斜线+另一条斜率不同的斜线+水平线
稀硫酸和稀硝酸:图像是经过原点的斜线+水平线
氯化镁和稀硝酸:图像是不经过原点的斜线+水平线,斜线与横轴交在原点右方;
碳酸钾和稀硫酸:图像是经过原点的斜线+水平线
碳酸钾和稀硝酸:图像是水平线;或是经过原点的斜线+水平线
请对号入座
2. 你正确,答案脑残1年前查看全部
- 有一混合溶液是由碳酸钾、稀硫酸、氯化镁、稀硝酸四种物质中的两种混合而成.
有一混合溶液是由碳酸钾、稀硫酸、氯化镁、稀硝酸四种物质中的两种混合而成.
向该混合溶液中滴加氢氧化钡溶液,则改混合溶液可能是_或_
产生沉淀 plxshmily1年前3
plxshmily1年前3 -
 savage_casper 共回答了15个问题
savage_casper 共回答了15个问题 |采纳率100%出现什么现象?
如果是出现白色沉淀,那么混合溶液可能是稀硫酸和氯化镁的混合溶液,或稀硫酸和稀硝酸的混合溶液.1年前查看全部
- 浓硫酸和碳酸钾反应吗?浓硫酸和铁反应有铁离子进入溶液吗?壬酸戊酸是酸性化合物吗?
 晨意晨心1年前1
晨意晨心1年前1 -
 yundao14 共回答了19个问题
yundao14 共回答了19个问题 |采纳率84.2%1、浓硫酸和碳酸钾反应,因为浓硫酸并不是纯硫酸,里面有水,就会有H+,反应后产生CO2和水,如此循环
2、有,这是肯定的,只是量很少,因为任何可能的反应都会进行,只是进行的程度不同
3、是,它们是羧酸化合物,只能电离出很少的H+1年前查看全部
- 写出下面的化学式:碳酸钠 碳酸钙 碳酸钡 碳酸钾 磷酸钠 磷酸钙 氯化铵 硫酸铵 硝酸铵 氨气 高锰酸钾 锰酸钾 氯酸钾
 vv_COM1年前1
vv_COM1年前1 -
 dlgcgs 共回答了20个问题
dlgcgs 共回答了20个问题 |采纳率90%碳酸钠 Na2CO3
碳酸钙 CaCO3
碳酸钡 BaCO3
碳酸钾 K2CO3
磷酸钠 Na3PO4
磷酸钙 Ca3(PO4)2
氯化铵 NH4Cl
硫酸铵 (NH4)2SO4
硝酸铵 NH4NO3
氨气 NH3
高锰酸钾 KMnO4
锰酸钾 K2MnO4
氯酸钾 KClO31年前查看全部
- 三个方程式帮写下1.氯化钡和硫酸钠反应2.碳酸钾和稀盐酸3.氢氧化钡于稀硝酸
 magiclady1年前4
magiclady1年前4 -
 cdz0529 共回答了18个问题
cdz0529 共回答了18个问题 |采纳率83.3%BaCl2+Na2SO4==BaSO4↓ + 2NaCl
K2CO3+2HCl==2KCl + H2O+CO2↑
Ba(OH)2+2HNO3==Ba(NO3)2+2H2O1年前查看全部
- 碳酸钾受潮后,产生氢氧化钾的化学方程式
碳酸钾受潮后,产生氢氧化钾的化学方程式
不是碳酸钾与氢氧化钙的反应 9sul1年前0
9sul1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 13.8克碳酸钾跟86.2克硝酸溶液恰好完全反映
13.8克碳酸钾跟86.2克硝酸溶液恰好完全反映
(1)求原硝酸溶液中溶质的质量分数
(2)若将反映后的溶液温度降到0度,有多少克硝酸甲晶体析出?已知0度硝酸钾溶解度13.3克/100克水
黄铜是一种由铜,锌两种金属组成的合金.为了测定某1黄铜的成分,取样品粉末16.25克,放入盛有足量稀H2SO4的烧杯中,使它们充分反应.反映前烧杯中稀硫酸的质量是85.00克,反应后烧杯中物质的总质量是101.11克.问该合金中铜的质量分数是多少? jennyxqq1年前1
jennyxqq1年前1 -
 lindahch 共回答了21个问题
lindahch 共回答了21个问题 |采纳率95.2%K2CO3 + 2 HNO3 == 2 KNO + H2O+CO2↑
138 126 138 18
13.8g X Y Z
(1)X=126×13.8÷138 = 12.6g
∴W(HNO3)=(12.6÷126)×100% = 10%
(2)Y=138×13.8÷138 = 13.8g
Z=18×13.8÷138 = 1.8g
∴M(KNO)溶=(13.3÷100)×1.8 = 0.2394g
∴M(KNO)析=13.8-0.2394 = 13.5606g1年前查看全部
- 有一包白色粉末,其中可能是硝酸钡,氯化钙,碳酸钾,
有一包白色粉末,其中可能是硝酸钡,氯化钙,碳酸钾,
1.将部分粉末加入水中,振荡,有白色沉淀生成.2.向1的悬浊液中加入过量的稀硝酸,白色沉淀消失,并有气体生成;3.取少量2.的溶液滴入稀硫酸.有白色沉淀生成;4.取少量2.的溶液滴入硝酸银溶液,有白色沉淀生成.
试根据上述实验现象,判断原白色粉末的组成,并写出有关反应的化学方程式
.将部分粉末加入水中,振荡,有白色沉淀生成。
这一点实在是想不通啊 3种物质分别在水中都不能产沉淀啊、、 zxcv1234xx1年前2
zxcv1234xx1年前2 -
 nameation 共回答了20个问题
nameation 共回答了20个问题 |采纳率95%白色粉末是:氯化钙,碳酸钾,硝酸钡
1.Ba(NO3)2+K2CO3=BaCO3↓+2KNO3
CaCl2+K2CO3=CaCO3↓+2KCl
2.BaCO3+2HNO3=Ba(NO3)2+CO2↑+H2O
CaCO3+2HNO3=Ca(NO3)2+CO2↑+H2O
3.Ba(NO3)2+H2SO4=BaSO4↓+2HNO3
4.KCl+AgNO3=AgCl↓+KNO3
三种物质都是电解质,在水中完全电离成阴阳离子,钙离子,钡离子与碳酸根离子均不共存,所以生成了沉淀,实际上也可以说是在溶液中发生了化学反应.1年前查看全部
- 一些化学方程式,帮个忙~硝酸钠溶液和氯化钠溶液氯化钡溶液喝硫酸钾溶液氯化铁溶液和氢氧化钠溶液碳酸钾和盐酸氧化铜和硝酸盐酸
一些化学方程式,帮个忙~
硝酸钠溶液和氯化钠溶液
氯化钡溶液喝硫酸钾溶液
氯化铁溶液和氢氧化钠溶液
碳酸钾和盐酸
氧化铜和硝酸
盐酸和硝酸银
硫酸和氢氧化钡
稀硫酸与氢氧化钠稀溶液
稀盐酸与硫酸钠溶液
氯化钠溶液与硝酸银溶液
碳酸钡与硫酸钠溶液 slyuer1年前1
slyuer1年前1 -
 erahui 共回答了10个问题
erahui 共回答了10个问题 |采纳率100%NaNO3和NaCl不能反应 BaCl2 + 2KNO3 = Ba(NO3)2 + 2KCl FeCl3 + 3NaOH = Fe(OH)3↓ + 3NaCl K2CO3 + 2HCl = 2KCl + H2O + CO2↑ CuCl2 + 2HNO3 = Cu(NO3)2 + 2HCl HCl + AgNO3 = AgCl↓ + HNO3 H2SO4 + Ba(OH)2 = Ba...1年前查看全部
- 有一包白色粉末,可能含有硝酸钡,氯化镁,碳酸钾,氢氧化钠,现做以下实验
有一包白色粉末,可能含有硝酸钡,氯化镁,碳酸钾,氢氧化钠,现做以下实验
1取一定量的粉末加入水中,震荡,有白色沉淀生成
2向1的沉淀物中加入足量稀硝酸,白色沉淀完全消失,没有气泡产生
3向1的上层清液中滴入稀硫酸,有白色沉淀生成
问原白色粉末中一定有什么,一定不含有什么
写出各部变化的离子方程式 傲视群英1年前3
傲视群英1年前3 -
 幻影宝贝 共回答了14个问题
幻影宝贝 共回答了14个问题 |采纳率92.9%解析:
1取一定量的粉末加入水中,震荡,有白色沉淀生成,可以是 BaCO3 Mg(OH)2
2向1的沉淀物中加入足量稀硝酸,白色沉淀完全消失,没有气泡产生.所以没有 BaCO3 ,所以一定有Mg(OH)2 ,故有 氢氧化钠和氯化镁.一定没有碳酸钾
3向1的上层清液中滴入稀硫酸,有白色沉淀生成,所以有硝酸钡.
所以原白色粉末中一定有氢氧化钠,氯化镁,硝酸钡.一定不含有碳酸钾.
离子方程式:Mg2+ + 2OH-=Mg(OH)2(沉淀)
Mg(OH)2+ 2H+= Mg2+ + 2H2O
Ba2+ + SO42-= BaSO4(沉淀)1年前查看全部
- 稀硫酸、硝酸钡、氢氧化钠、碳酸钾中,能两两发生反应的是?
稀硫酸、硝酸钡、氢氧化钠、碳酸钾中,能两两发生反应的是?
请写出化学方程式(不能反映的,请说明原因)
 yym211年前1
yym211年前1 -
 安徽需要我们 共回答了21个问题
安徽需要我们 共回答了21个问题 |采纳率81%H2SO4+Ba(NO3)2=BaSO4↓+2HNO3H2SO4+2NaOH=Na2SO4+2H2OH2SO4+K2CO3=K2SO4+H2O+CO2↑Ba(NO3)2+NaOH=不反应,不符合复分解反应进行的条件.Ba(NO3)2+K2CO3=BaCO3↓+2KNO3NaOH+K2CO3=不反应,不符合复分解反应进行的条件.1年前查看全部
- 碳酸钾溶液与盐酸,及碳酸钾与石灰水反应的方程式
碳酸钾溶液与盐酸,及碳酸钾与石灰水反应的方程式
急!@! 6007571年前3
6007571年前3 -
 经得起世界考验 共回答了17个问题
经得起世界考验 共回答了17个问题 |采纳率88.2%碳酸钾溶液与盐酸:K2CO3 + 2HCl = 2KCl + H2O + CO2↑
碳酸钾与石灰水:K2CO3 + Ca(OH)2 = 2KOH + CaCO3↓1年前查看全部
- (2012•徐汇区二模)有一包白色固体混合物,可能由硫酸铜、碳酸钾、硫酸钠、氯化钡、氯化钾中的一种或几种混合而成,为确定
(2012•徐汇区二模)有一包白色固体混合物,可能由硫酸铜、碳酸钾、硫酸钠、氯化钡、氯化钾中的一种或几种混合而成,为确定其组成进行如下实验:
实验结论:该包白色固体混合物中肯定含有的物质是______;可能含有______.实验步骤 实验现象 分析与解释 1.取少量样品盛放于试管中,加入足量水,振荡后静止. 试管中溶液为无色,底部有少量白色沉淀. 混合物不存在硫酸铜,可能存在______ 2.取实验1试管底部白色沉淀,滴加过量盐酸. ______ 试管底部白色沉淀是碳酸钡. 3.取实验1试管中清液,先滴加硝酸,再滴加硝酸银溶液. 有白色沉淀产生. 该实验中先滴加硝酸的目的是______  王云卿1年前1
王云卿1年前1 -
 phq0526 共回答了28个问题
phq0526 共回答了28个问题 |采纳率96.4%硫酸铜溶液为蓝色,根据现象试管中溶液为无色,底部有少量白色沉淀,说明混合物不存在硫酸铜,一定存在氯化钡,可能存在的是剩余的物质:碳酸钾、硫酸钠、氯化钾;根据碳酸钡溶于盐酸生成氯化钡、水、二氧化碳,硫酸钡不溶于盐酸,根据分析与解释:试管底部白色沉淀是碳酸钡,所以会看到的现象是有气泡,白色沉淀全部消失;取实验1试管中清液,先滴加硝酸,再滴加硝酸银溶液是为了检验是否含有氯离子,滴加硝酸是先和碳酸钾反应除去碳酸根离子的干扰,根据沉淀是碳酸钡,说明固体中一定有碳酸钾和氯化钡,由于白色固体中含有氯化钡,即已经含有氯离子,所以再加硝酸银,并不能说明是否含有氯化钾,所以可能含有的是氯化钾.
故答案为:
实验步骤 实验现象 分析与解释
碳酸钾、硫酸钠、氯化钾
有气泡,白色沉淀全部消失
消除碳酸钾的干扰碳酸钾、氯化钡氯化钾1年前查看全部
- 碳酸钾和碳酸铵有什么反应
 zxn5071年前1
zxn5071年前1 -
 fyj34447 共回答了22个问题
fyj34447 共回答了22个问题 |采纳率90.9%应该不会发生反应的.因为 这两种物质都是 以 碳酸根 为主.1年前查看全部
- 草木灰的主要成分是碳酸钾,某同学为检验它含有的碳酸根离子,应选择的试剂是( )
草木灰的主要成分是碳酸钾,某同学为检验它含有的碳酸根离子,应选择的试剂是( )
A. 氢氧化钙溶液
B. 稀盐酸和氢氧化钙溶液
C. 水
D. 稀盐酸 lory5211年前1
lory5211年前1 -
 yangzhou2000 共回答了14个问题
yangzhou2000 共回答了14个问题 |采纳率85.7%解题思路:检验溶液中是否含碳酸根离子或碳酸氢根离子的方法是加入稀盐酸再将气体通入石灰水中,观察现象;检验溶液中是否含碳酸根离子离子:加入稀盐酸再将气体通入石灰水中,有气体产生并生成白色沉淀,则:溶液中一定含碳酸根离子.
故选B点评:
本题考点: 证明碳酸盐.
考点点评: 解答本题的关键是要掌握碳酸盐的性质,只有掌握了碳酸盐的性质才能正确的判断检验碳酸根离子的方法.1年前查看全部
- 有一包白色固体,可能由硫酸铜、硝酸钡、碳酸钾、硫酸钾、氯化钠中的一种或几种组成
有一包白色固体,可能由硫酸铜、硝酸钡、碳酸钾、硫酸钾、氯化钠中的一种或几种组成
1.取样,放入水中搅拌,过滤.现象:得到白色沉淀A 无色溶液B.
2.将白色沉淀A放入_________中.现象:沉淀部分溶解并 ② .白色沉淀A是_________
3.向无色溶液B滴加硝酸酸化的_________.现象:产生白色沉淀.
4.再向3中的上层清液中滴加____ 现象:________,说明原固体中有氯化钠. 默茜1年前1
默茜1年前1 -
 dongsheng_xia 共回答了18个问题
dongsheng_xia 共回答了18个问题 |采纳率94.4%无色溶液:没有硫酸铜.白色沉淀:粉末有硝酸钡.
因为沉淀部分溶解,所以既有BaSO4,又有BaCO3.那么原粉末有:Ba(NO3)2,K2CO3,K2SO4.没有CuSO4
2.将白色沉淀A放入_稀硝酸_中. 现象:沉淀部分溶解并 ② .白色沉淀A是_硫酸钡,碳酸钡混合物_
3.向无色溶液B滴加硝酸酸化的_硝酸钡_. 现象:产生白色沉淀.
此举除去SO4 2-,CO3 2-,选用硝酸钡防止对下一步实验检测Cl-造成干扰
4.再向3中的上层清液中滴加_硝酸银溶液_ 现象:_出现白色沉淀_,说明原固体中有氯化钠.1年前查看全部
- 偏铝酸钠 碳酸钾 碱性谁强请问偏铝酸钠与碳酸钾的碱性谁强,为什么
 hunter95901年前1
hunter95901年前1 -
 boxinwang 共回答了16个问题
boxinwang 共回答了16个问题 |采纳率93.8%偏铝酸钠的碱性强.因为在水溶液中,碳酸的酸性比偏铝酸的酸性强,则碳酸在水中的电离程度比偏铝酸大,根据电离平衡原理,ALO2- +H2O=OH- +HALO2.则水中的氢氧根的浓度大且碳酸存在二级电离,因此偏铝酸钠的碱性比碳酸钾强.1年前查看全部
- 什么样的物体具有导电性,为什么,下列哪些物体不能导电,为什么1.NACL晶体2.纯硫酸3,融化的碳酸钾 4液态氯化
 dapaojj1年前2
dapaojj1年前2 -
 tackiezhou 共回答了14个问题
tackiezhou 共回答了14个问题 |采纳率92.9%41年前查看全部
- 甲乙丙三位同学做实验时,不慎将稀盐酸,氢氧化钙,碳酸钾三种物质混合在一起,发现产生白色沉淀
甲乙丙三位同学做实验时,不慎将稀盐酸,氢氧化钙,碳酸钾三种物质混合在一起,发现产生白色沉淀
甲,乙,丙三位同学做实验时,不慎将稀盐酸,氢氧化钙,碳酸钾三种物质混合在一起,发现产生白色沉淀为探究反应后溶液中的成分请教老师,老师告诉他们最好先确定反应后溶液的溶解性.
【猜想与假设】甲:反应后的溶液为酸性;乙:反应后的溶液为碱性;丙:反应后的溶液为中性;
(1)甲,乙,丙三位同学的猜想不合理的是______(填“甲,乙,丙”).
【进行实验】取少量过滤后得到的溶液,向其中滴加几滴酚酞试液.
【通过分析,得出结论】
(2)如果乙同学发现溶液呈红色,取少量滤液,滴加稀盐酸,产生气泡,由此推断滤液中一定不含有三种反应物中的______(填物质名称或化学式);一定含有______(填物质名称或化学式,包括生成物);可能含有______(填物质名称或化学式,包括生成物).
【拓展与迁移】
(3)如果丙同学发现滤液滴加酚酞试液后呈无色,则反应后溶液的酸碱性为______(填“酸性,碱性或中性”),无色滤液滴加稀盐酸后没有气泡产生,则滤液中一定含有______(填物质名称或化学式).
 sd26662261年前1
sd26662261年前1 -
 天有情地无情 共回答了22个问题
天有情地无情 共回答了22个问题 |采纳率86.4%(1) 甲 酸性溶液中不存在碳酸钙沉淀
(2)HCl KCl KOH,K2CO3 第一步反应H离子和氢氧根,然后钙离子和碳酸跟
(3)中性 KCl1年前查看全部
- 用一种试剂出去下列物质中的杂质(括号内为杂质),写出有关化学方程式.1.氯化钾(碳酸钾)2.氯化亚铁(氯化铜)3.氢氧化
用一种试剂出去下列物质中的杂质(括号内为杂质),写出有关化学方程式.1.氯化钾(碳酸钾)2.氯化亚铁(氯化铜)3.氢氧化铜(碳酸钠)
 温岭一言九鼎1年前3
温岭一言九鼎1年前3 -
 hansar101 共回答了16个问题
hansar101 共回答了16个问题 |采纳率93.8%除去杂质要注意和先找物理性质的差异,特别关注溶解性及其他一些物质的特性(如铁能被磁铁所吸引)然后才是化学性质差异.如本题中第三小题,一个可溶一个不溶,则用溶解过滤除之.
第一题分析两者相同点及不同点,特别关注不同点一个是碳酸根一个氯离子.所以本题我们只需用氯离子来换碳酸根离子,同时使用杂离子变成沉淀或气体.本题应加入含氯离子的物质,同时将碳酸根除去,可用酸及能使用碳酸根沉淀的金属离子.如钙离子,钡离子等
K2CO3+2HCl=2KCl+H2O+CO2 K2CO3+CaCl2=CaCO3+2KCl
第三题 分析 不同的离子是金属离子,但凡是亚铁离子不溶的,铜离子也不溶.但二者由在金属活动性表中顺序不同,按金属活动顺序表中置换的规律是前金属后盐,而题中正好是后金属盐,所以就用前金属单质铁去转换铜.这样就使用氯化铜转化为了氯化亚铁.
CuCl2+Fe=Cu+FeCl21年前查看全部
- 某碳酸钾样品中含有碳酸钠、硝酸钾和硝酸钡三种杂质中的一种或两种.现将13.8g样品加入到足量水中,样品全部溶解.再加入过
某碳酸钾样品中含有碳酸钠、硝酸钾和硝酸钡三种杂质中的一种或两种.现将13.8g样品加入到足量水中,样品全部溶解.再加入过量的氯化钙溶液,得到9g沉淀.对样品所含杂质的正确的判断是( )
A. 肯定有硝酸钾,肯定没有碳酸钠
B. 肯定有硝酸钡,可能还含有碳酸钠
C. 肯定没有硝酸钡,肯定有硝酸钾
D. 肯定没有硝酸钡和碳酸钠 李梦雯1年前1
李梦雯1年前1 -
 wangkkk1 共回答了20个问题
wangkkk1 共回答了20个问题 |采纳率95%解题思路:取样品加入水中,全部溶解,则不可能硝酸钡,因为硝酸钡能与碳酸钾反应生成碳酸钡的沉淀,加入氯化钙能产生沉淀,然后根据沉淀的质量进一步确定碳酸钠和硝酸钾的存在.样品加入水中,全部溶解,说明一定无硝酸钡,因为硝酸钡能与碳酸钾反应生成碳酸钡的沉淀;
假设13.8g纯碳酸钾产生碳酸钙的质量为x,则有
K2CO3+CaCl2═CaCO3↓+2KCl
138 100
13.8g x
[138/13.8g=
100
x]
x=10g
假设13.8g为纯碳酸钠则设产生碳酸钙的质量为y,则有
Na2CO3+CaCl2═CaCO3↓+2NaCl
106 100
13.8gy
[106/13.8g=
100
y]
y≈13g
若含有碳酸钠则得到沉淀的质量应该大于10g小于13g,而实际只得到9g,故可能含有碳酸钠,一定含有硝酸钾,观察选项,B、C的判断合适.
故选:BC;点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 本题考查了物质共存的问题以及根据化学方程式的计算,完成此题,可以依据已有的知识进行,判断混合物的组成时,要采用极值法和平均值法.1年前查看全部
- 如何鉴别碳酸钠,碳酸钾,氯化钠,硫酸钾?写出有关反应的化学方程式和离子反应式.
 海曼与人鱼1年前2
海曼与人鱼1年前2 -
 ylindi 共回答了12个问题
ylindi 共回答了12个问题 |采纳率91.7%先加AgNO3溶液碳酸钠:2AgNO3+Na2CO3=Ag2CO3↓+2NaNO32Ag+ +CO3-=Ag2CO3↓碳酸钾:2AgNO3+K2CO3=Ag2CO3↓+2KNO32Ag+ +CO3-=Ag2CO3↓氯化钠:AgNO3+NaCl=AgCl↓+NaNO3Ag+ +Cl-=AgCl↓硫酸钾无明显反应接着加HNO3碳酸钠和...1年前查看全部
- 有哪一种试剂能鉴别碳酸氢钠,碳酸钾,硅酸钠,硫化钾,氯化钠和硝酸钾的吗?
 tangjason20041年前1
tangjason20041年前1 -
 彭欣欣 共回答了17个问题
彭欣欣 共回答了17个问题 |采纳率100%氯化氢气体1年前查看全部
- 为什么滴加浓盐酸可鉴别饱和碳酸氢钠,碳酸钾,亚硫酸钠,氯化钠,硝酸钾五种无色溶液
 xiangxcy1年前1
xiangxcy1年前1 -
 2068963 共回答了26个问题
2068963 共回答了26个问题 |采纳率88.5%解析:
浓盐酸滴加饱和碳酸氢钠,反应式:NaHCO3+HCl = NaCl + CO2(气体) + H2O 现象为:有无色无味的气体生成.
浓盐酸滴加饱和碳酸钾溶液中,反应式:K2CO3 + HCl = KCl + KHCO3 ,KHCO3+HCl=KCl + CO2(气体) + H2O 现象为:先没有气体,后产生无色无味的气体.
浓盐酸滴加饱和亚硫酸钠溶液中,反应式:Na2SO3 + HCl = NaCl + NaHSO3 ,NaHSO3+HCl=NaCl + SO2(气体) + H2O 现象为:先没有气体,后产生无色有刺激性气味的气体.
浓盐酸滴加饱和NaCl溶液中,同离子效应,NaCl = Na+ + Cl- HCl=Cl- +H+ 饱和NaCl中C(Cl-)浓度增大,使饱和NaCl溶液有晶体析出.现象为:有晶体析出.
浓盐酸滴加饱和硝酸钾溶液中,只吸收HCl.无明显现象.1年前查看全部
- 相同物质的量的碳酸钾 碳酸钠 碳酸镁 碳酸氢钠分别与足量的稀盐酸反应,生成气体的质
相同物质的量的碳酸钾 碳酸钠 碳酸镁 碳酸氢钠分别与足量的稀盐酸反应,生成气体的质
A碳酸钾生成的气体最多
B碳酸镁生成的气体最多
C一样多
D无法确定 饿嘀神啊1年前1
饿嘀神啊1年前1 -
 jokul_x 共回答了22个问题
jokul_x 共回答了22个问题 |采纳率100%C一样多
物质的量相同的话,含C的物质的量也一样,所以生成CO2一样多1年前查看全部
- 将稀盐酸加入澄清石灰水的试管中,无明显现象;将稀盐酸加入另一只有碳酸钾的试管中,有气体生成.反应结束后,把两支试管中的废
将稀盐酸加入澄清石灰水的试管中,无明显现象;将稀盐酸加入另一只有碳酸钾的试管中,有气体生成.反应结束后,把两支试管中的废液倒入废液缸,发现废液缸中有少量气泡,最终有白色沉淀生成.
请问:1.废液缸中的白色沉淀是什么?
2.第一只试管的废液中一定含有的物质是什么? baobao197110121年前3
baobao197110121年前3 -
 吴尊尼 共回答了10个问题
吴尊尼 共回答了10个问题 |采纳率100%废液缸中的白色沉淀是CaCo3,第一只试管的废液中一定含有的物质是盐酸
首先看懂题目,理解题目意思,这是一道过量与不足的题目,
2Hcl+Ca(oH)2=Cacl2+2H2o Hcl稍过量
2Hcl+k2co3=2kcl+co2+H2o k2co3过量1年前查看全部
- 写出下列离子鼓号的化学式1.氧离子 2.+2价的钙 3.两个氢离子 4.氦气 5.氢氧化钙6.硝酸铜 7.碳酸钾 8.硫
写出下列离子鼓号的化学式
1.氧离子 2.+2价的钙 3.两个氢离子 4.氦气 5.氢氧化钙
6.硝酸铜 7.碳酸钾 8.硫酸铵 9.磷酸铵 10.氧化钾
11.氯化铝 12.磷酸 13.碳酸 14.硝酸 15.硫酸 16.氧化镁 倩颖红妆1年前1
倩颖红妆1年前1 -
 vcbc 共回答了12个问题
vcbc 共回答了12个问题 |采纳率91.7%1.O2-
2.Ca2+
3.2H+
4.He
5.Ca(OH)2
6.Cu(NO3)2
7.K2CO3
8.(NH4)2SO4
9.(NH4)3PO4
10.K2O
11.AlCl3
12.H3PO4
13.H2CO3
14.HNO3
15.H2SO4
16.MgO1年前查看全部
大家在问
- 1综合性学习。 今年5月11日是母亲节,
- 2球一篇关于校园环境变化的英语作文
- 3‘’因为没有我不喜欢的食物‘’用英语该怎么翻译?
- 4在△ABC中,∠C=90°,AC=BC,AD平分∠BAC交BC于D,DE⊥AB,垂足为E,且AB=10cm,则三角形BE
- 5金星与其他的行星自转方向相反,是____自转的,其他8大行星都____自转.
- 6改错(每句一处错):I hae only two yuan
- 7一项工程,由甲乙合作需24小时完成.如果甲单独做需要三十小时完成.现在由甲单独做三小时后.剩下部分有甲乙合作还需几小时完
- 8若a 2 +b 2 =4,则两圆(x-a) 2 +y 2 =1和x 2 +(y-b) 2 =1的位置关系是______.
- 94又10分之七加2又5分之四等于多少?麻烦详细点.
- 10苹果含有多少水分
- 11根据下面材料写作文 急!公园里的一盆名花对一朵野花说:“没人来观赏,你还值得开放吗?”野花答到:“我是花,我就值得开放;
- 12王老师带的钱正好可以买15个篮球每个60元,或者买20个排球每个75元.问王老师带了多少钱?
- 13It seemed helpless to save him
- 14再见!明天见翻译成英语
- 15设y1=x-1,y2=2x+1/4,当x为何值时,y1与y2互为相反数
