不溶性盐能与酸反应吗不溶性盐能否与酸反应?请详细说明,
 kktfqpyygy2022-10-04 11:39:541条回答
kktfqpyygy2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 阿康dragon 共回答了11个问题
阿康dragon 共回答了11个问题 |采纳率100%- 可以,比如说盐酸与碳酸钙反应
- 1年前
相关推荐
- 光敏印油的化学成分?具有水溶性还是油溶性呢?会溶于那些试剂?
 mark19981年前1
mark19981年前1 -
 暮雨珠痕 共回答了12个问题
暮雨珠痕 共回答了12个问题 |采纳率83.3%油溶性,酒精和汽油、煤油、柴油、润滑油、苯、甲苯、二甲苯、氯仿、二硫化碳等等1年前查看全部
- 碳酸钠 是只有难溶性盐才可能分解吗?如果能分解同为可溶性盐怎么比较其碳酸盐热分解温度
 闹市隐者1年前2
闹市隐者1年前2 -
 飞翔密室 共回答了12个问题
飞翔密室 共回答了12个问题 |采纳率100%碳酸钠分解温度更高.
通常状况下CaCO3在几百度的温度下就会分解.
Na2CO3一般都很稳定不分解,但是极高的温度且有比它更强的碱与其混合的时候,它才会分解为CO2和NaOH.
比较稳定性:钠和钙的最高价氧化物对应的水化物NaOH和Ca(OH)2都是强碱,但NaOH的碱性更强,钠的失电子能力更强.因此钠和钙的碳酸盐相比较钠的碳酸盐更稳定1年前查看全部
- 粗盐中含有不溶性的泥沙.可溶性的氯化钙.氯化镁及一些硫酸盐,对粗盐中的这些杂质可采用____和____
粗盐中含有不溶性的泥沙.可溶性的氯化钙.氯化镁及一些硫酸盐,对粗盐中的这些杂质可采用____和____
过滤和蒸发
过滤我可以理解 蒸发就不行了 希望能得到大家的解答. 哥哥猫1年前2
哥哥猫1年前2 -
 哪个知道我的心 共回答了17个问题
哪个知道我的心 共回答了17个问题 |采纳率94.1%根据杂质的溶解度随温度的变化比较大和NaCl的溶解度几乎不受温度影响所以用蒸发可以除去一些杂质.1年前查看全部
- 盐与碱溶液的反应很多盐的溶液能和碱溶液反应,产生难溶性碱的沉淀.初中阶段总是解释说两种化合物相互交换成分,那么它能不能解
盐与碱溶液的反应
很多盐的溶液能和碱溶液反应,产生难溶性碱的沉淀.初中阶段总是解释说两种化合物相互交换成分,那么它能不能解释成“在碱性环境下水解”呢? 妖精薇笑1年前2
妖精薇笑1年前2 -
 我们活着我们爱着 共回答了24个问题
我们活着我们爱着 共回答了24个问题 |采纳率91.7%.所谓的水解是物质与水发生的复分解反应
你是盐与碱反应,水只是让它们电离后,发生离子反应,怎么能说是水解...- -||1年前查看全部
- 为什么难溶性的碱只能与酸反应不好意思,这是老师说的
 重庆山城1年前1
重庆山城1年前1 -
 白日梦的天使 共回答了19个问题
白日梦的天使 共回答了19个问题 |采纳率94.7%你这种说法不对吧?
Al(OH)3和Zn(OH)2都是难溶性的碱,但是它们可以和NaOH反应呀.
呃,这样的话,那就属于知识的盲点了,你就先这么记着吧,不要追根溯源,因为那样反而会误导你,因为事实上肯定不止的,除了上述所说可以和NaOH反应的以外,难溶性的碱还可以和酸式盐反应等等,比如Al(OH)3可以和NaHSO4反应,后者是酸式盐1年前查看全部
- 酸能不能与金属不溶物反应像硫酸,盐酸,硝酸这三种酸能不能与氢氧化锌,氢氧化铜氢氧化铁这类的不溶性的碱反应?酸能不能与不溶
酸能不能与金属不溶物反应
像硫酸,盐酸,硝酸这三种酸能不能与氢氧化锌,氢氧化铜氢氧化铁这类的不溶性的碱反应?
酸能不能与不溶性的碱反应,不溶性的盐反应? wangbo88161年前4
wangbo88161年前4 -
 yylove3 共回答了19个问题
yylove3 共回答了19个问题 |采纳率73.7%能反应呀
Cu(OH)2+H2SO4==CuSO4+2H2O1年前查看全部
- 难溶性盐是弱电解质?为什么?
 jiuka19801年前4
jiuka19801年前4 -
 bimawen 共回答了26个问题
bimawen 共回答了26个问题 |采纳率84.6%不对.难溶性的盐在水中有小部分溶于水,而溶于水的这部分是完全电离于水中的.故难溶性的盐是弱电解质.1年前查看全部
- 难溶物洗涤,用()洗去油脂,难溶性金属氧化物,碱,碳酸盐等可用()洗,在用水冲洗.
 小二上西瓜1年前1
小二上西瓜1年前1 -
 咚的咙咚呛 共回答了28个问题
咚的咙咚呛 共回答了28个问题 |采纳率96.4%汽油,酸1年前查看全部
- 高中化学倒吸问题若一种气体通入可溶性液体时极易倒吸,但为什么通入到不溶性液体时不会倒吸?飘出气体的装置的气压不也减少了吗
高中化学倒吸问题
若一种气体通入可溶性液体时极易倒吸,但为什么通入到不溶性液体时不会倒吸?飘出气体的装置的气压不也减少了吗?并且少于另一装置的气压啊?
请求详细解答及原理
thanks ~~
插一句~~我想知道气体从装置中出来后,若通向烧杯中,烧杯装有诸如苯这样的溶剂(气体不溶于苯),气体既然不会溶于苯,那就会从烧杯中溢出,那飘出气体的装置的气压不还是小于烧杯中的气压吗? 巨源村人1年前8
巨源村人1年前8 -
 ponny_wpy 共回答了23个问题
ponny_wpy 共回答了23个问题 |采纳率95.7%通入到不溶性液体时不会倒吸是因为装置中一直在产生气体,压强不会变小而小于外界气压的,而当反应停止时或产生气体少的时候,如果不先从水中撤出导管,那也会倒吸的,这就是要先撤出导管,再使反应停止的原因.
而当一种气体通入可溶性液体(气体在该液体中溶解度较大)易倒吸,其实也是这个原因,你可以这样想:反应产生的气体被液体吸收的瞬间,容器内压强小于外界压强,就肯定会引起倒吸!1年前查看全部
- 什么是难溶性盐?
 yinwen82131年前1
yinwen82131年前1 -
 636891417 共回答了14个问题
636891417 共回答了14个问题 |采纳率100%难容性盐就是难溶解在水中的盐,它的溶解度小于0.1g,也就是在100g水中只有小于0.1g的物质溶解在水里.比如CaCO31年前查看全部
- 粗盐提纯中除难溶性杂质的主要步骤有哪些
 bl10081年前1
bl10081年前1 -
 lclclc09663 共回答了18个问题
lclclc09663 共回答了18个问题 |采纳率100%过滤1年前查看全部
- 难溶性的盐是强电解质在水中的电离方程式好不好写?如:硅酸钠
 ame301年前2
ame301年前2 -
 风丝袅87 共回答了23个问题
风丝袅87 共回答了23个问题 |采纳率87%难溶的盐在水中当然不能写电离方程式,但硅酸钠是钠盐,溶解的哈1年前查看全部
- 粗盐提纯的根本原理一般的顺序是:1.2.过滤(不溶性杂质) 3.滴加氯化钡(除硫酸根离子)SO42-+Ba2+=BASO
粗盐提纯的根本原理
一般的顺序是:1.
2.过滤(不溶性杂质)
3.滴加氯化钡(除硫酸根离子)SO42-+Ba2+=BASO4
4.滴加氢氧化钠 (除镁离子)Mg2++2OH-=Mg(OH)2
5.加碳酸钠(除过量的氯化钡)Ba2+CO32-=BaCO3
6.滴加稀盐酸(除过量的碳酸钠、氢氧化钠)其中沉淀也要过滤
7.蒸发
为什么要先加氯化钡,再加氢氧化钠啊?顺序倒一下不是也一样吗 eason0061年前1
eason0061年前1 -
 过客wsw 共回答了12个问题
过客wsw 共回答了12个问题 |采纳率100%这两个顺序可以颠倒的,
只要保证氯化钡在碳酸钠之前加
盐酸最后加就没有问题了
请注意:氯化钡和氢氧化钠是不反应的!
不要乱说1年前查看全部
- 哪些碳酸盐具有难溶性碱加热分解的性质,请写出反应的化学方程式
 1044726161年前2
1044726161年前2 -
 lanhui999 共回答了18个问题
lanhui999 共回答了18个问题 |采纳率88.9%CaCO3 -----> CaO + CO21年前查看全部
- 如果向某溶液中加入另种试剂,生成了难溶性的电解质,则说明原溶液中的相应离子已沉淀完全,
 YellowRice1年前1
YellowRice1年前1 -
 lucylee316 共回答了20个问题
lucylee316 共回答了20个问题 |采纳率80%显然不对,究竟沉淀完不完全要靠KSP来判断,就是溶度积.1年前查看全部
- 明矾和活性炭太都吸附不溶性杂质,要吸附可溶性杂质,要用什么药品
 荷花湾1年前1
荷花湾1年前1 -
 商业农夫 共回答了15个问题
商业农夫 共回答了15个问题 |采纳率86.7%可溶性杂质(如果真的是严格可溶)没法吸附.
或者说特定杂质特定吸附.
因为是可溶,所以几乎没有多个分子聚结的情况,没有办法吸附(这是物理变化)(明矾不能叫吸附)
只能通过加试剂,除杂1年前查看全部
- 活性炭是吸附可溶性杂质还是不溶性杂质
 zzdjb1年前2
zzdjb1年前2 -
 heshen432 共回答了20个问题
heshen432 共回答了20个问题 |采纳率85%活性炭主要吸附不溶性杂质,颜色气味.也可以吸附某些可溶性杂质1年前查看全部
- 明矾是吸附可溶性杂质还是不溶性杂质
 c6kl1年前4
c6kl1年前4 -
 相知无近远 共回答了16个问题
相知无近远 共回答了16个问题 |采纳率93.8%不溶性的.明矾可以吸附悬浮在水中的微小不溶杂质使之沉降1年前查看全部
- 在种难溶性的固体中滴入什么,观察到有大量气泡产生,这种固体可能是碳酸盐
 yu198401231年前1
yu198401231年前1 -
 jamesdang 共回答了20个问题
jamesdang 共回答了20个问题 |采纳率95%加入稀盐酸1年前查看全部
- 怎么样证明某黑色固体为碳某同学猜想生铁与盐酸反应生成的不溶性杂质是碳 请设计简单的实验证明这一猜想
 sunnytechie1年前2
sunnytechie1年前2 -
 houwang 共回答了19个问题
houwang 共回答了19个问题 |采纳率89.5%取固体粉末在空气中点燃,并将生成的气体通入澄清石灰水中,能使澄清石灰水变浑浊的话,黑色固体就是碳
或者与氧化铜反应,能还原氧化铜的就是他了1年前查看全部
- 如果想某一溶液中加入足量试剂,生成了难溶性的电解质,则说明原溶液中的相应离子已沉淀完全,为什么错
 wtlsz1年前1
wtlsz1年前1 -
 豌豆小凡 共回答了24个问题
豌豆小凡 共回答了24个问题 |采纳率100%沉淀也有溶度积的问题(不懂得话就理解成溶解度)只有当溶液中离子浓度降低到到10^5mol/L以下时才认为除干净了,有的沉淀的溶解度相对较大,并不满足这个要求,所以有时即使生成了沉淀也不能认为完全除干净,解决方法就是生成溶解度更小的沉淀1年前查看全部
- 净水过程中加明矾吸附是为了去除不溶性杂质还是可溶性杂质
 安西都护1年前1
安西都护1年前1 -
 rzh543 共回答了23个问题
rzh543 共回答了23个问题 |采纳率95.7%这个是吸附一些不溶杂质(如有机质微粒).1年前查看全部
- (1)自来水生产过程中先用方法除去水中不溶性杂质,再进行消毒.X是一种常见的自来水消毒剂,工业上制取X的化学方程式为:C
(1)自来水生产过程中先用方法除去水中不溶性杂质,再进行消毒.X是一种常见的自来水消毒剂,工业上制取X的化学方程式为:Cl2+2NaClO2=2NaCl+2X,则X的化学式是______.
(2)地下水硬度过大会影响生产和生活,应软化后使用.
a.检验硬水常用的是物质是______
b.如果某地地下水钙、镁离子含量过高(假设主要以CaCl2、MgCl2形式存在),可先加入适量的熟石灰,反应的化学方程式为______,再加入适量的纯碱后生成沉淀,即可将水软化. amin3151年前1
amin3151年前1 -
 riverun 共回答了10个问题
riverun 共回答了10个问题 |采纳率90%解题思路:(1)化学反应前后,元素的种类不变,原子的种类、总个数不变;
(2)利用肥皂水可以检验硬水和软水;
(3)氢氧化钙能和氯化镁反应生成氢氧化镁白色沉淀和氯化钙.(1)由Cl2+2NaClO2=2NaCl+2X可知,反应前氯原子是4个,反应后应该是4个,其中2个包含在2X中;
反应前钠原子是2个,反应后是2个;
反应前氧原子是4个,反应后应该是4个,包含在2X中;
由分析可知,每个X中含有1个氯原子和2个氧原子,化学式是ClO2.
故填:ClO2.
(2)a、向水中加入肥皂水时,如果产生的泡沫较多,是软水,如果产生的泡沫很少或不产生泡沫,是硬水.
故填:肥皂水.
b、氢氧化钙和氯化镁反应的化学方程式为:MgCl2+Ca(OH)2═Mg(OH)2↓+CaCl2.
故填:MgCl2+Ca(OH)2═Mg(OH)2↓+CaCl2.点评:
本题考点: 质量守恒定律及其应用;硬水与软水;碱的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变,原子的种类、总个数不变,这是书写化学方程式、判断物质的化学式、判断化学计量数、进行相关方面计算的基础.1年前查看全部
- 【八上科学】某固体物质中含有硝酸钾和不溶性杂物...
【八上科学】某固体物质中含有硝酸钾和不溶性杂物...
某固体物质中含有硝酸钾和不溶性杂物,把它们加入一定量的水中充分溶解,其结果如下
温度(摄氏度) 10 40 65 75
剩余固体(克) 261 175 82 82
求:所加水的质量和混合物中硝酸钾质量.(硝酸钾溶解度如下)
温度(摄氏度) 10 40 50 55 60 65 75 80
溶解度(克) 20.9 63.9 85.5 95 110 126 150 169
不是继续。sorry jiajia91351年前2
jiajia91351年前2 -
 mengttkl 共回答了19个问题
mengttkl 共回答了19个问题 |采纳率84.2%65度和75度都剩余82克固体,说明杂质是82克.
从10度到40度,硝酸钾溶解度上升(63.9-20.9)=43克,而从10度到40度,固体减少(261-175)=86克,说明用了200克水.200克水在10度时可以溶解20.9*2=41.8克硝酸钾.
混合物中硝酸钾质量=261+41.8-82=220.8克.1年前查看全部
- 水是生命之源,人类的日常生活与工农业生产都离不开水.自然界中的水含有许多可溶性和不溶性杂质,通过多种途径可以使水得到不同
水是生命之源,人类的日常生活与工农业生产都离不开水.自然界中的水含有许多可溶性和不溶性杂质,通过多种途径可以使水得到不同程度的净化.

(1)自然界的水是______(填“混合物”或“纯净物”)
(2)图1是自来水厂净水过程示意图.在此过程中,净化水的方法主要有______(至少写三种).
(3)硬水中含有较多可溶性钙、镁化合物,长期饮用硬水可能会引起体内结石.生活中常用______来区分软水与硬水.
(4)水中若含过量的氮、磷元素,会使藻类生长繁殖过快,导致水质恶化,发生“水华”现象.已知藻类主要含有C106H263O110N16P等物质,下列物质大量使用会导致“水华”现象的是______(填字母序号).
A.向水中加入活性炭来净水B.大量使用含Na5P3O10的洗衣粉
C.过量使用尿素[CO(NH2)2]等化学肥料
(5)某课外小组收集了一些浑浊的河水,利用如图2所示的简易净水装置进行净化.该装置中的小卵石、石英沙的作用是______.
(6)小明同学将浑浊的湖水样品倒入烧杯中,先采用如图3所示装置进行过滤.请问:图中还缺少的一种仪器是______,其作用是______;漏斗下端紧靠烧杯内壁是为了______. uiuiif341年前1
uiuiif341年前1 -
 t34w67457 共回答了20个问题
t34w67457 共回答了20个问题 |采纳率95%解题思路:(1)观察自来水厂净化处理的过程,分析过程中所使用的净化水的方法;
(2)根据硬水、软水与肥皂水混合所出现现象的明显不同,确定使用肥皂水区分硬水与软水;
(3)分析蒸馏水的获得过程,根据变化前后是否产生新物质,判断过程中所发生变化的类型;
(4)水中氮、磷含量过高,会引起赤潮,因此致使水中含氮、磷量增加的做法会引发赤潮;
(5)根据简易净水器的示意图,判断图示中小卵石、石英沙、活性炭的净化作用;
(6)过根据过滤时注意事项和各仪器的用途分析解答:漏斗下端紧靠烧杯内壁是为了防止滤液溅出;(1)自来水厂净化处理中经过沉淀池的沉淀、过滤池的过滤、活性炭吸附池的吸附、投药消毒的消毒杀菌,故该过程中净化水的方法主要有沉淀、过滤、吸附、消毒;
(2)使用肥皂水可区分硬水和软水,倒入肥皂水泡沫少者为硬水,泡沫丰富者为软水;
(3)制取蒸馏水的过程是加热蒸发与冷凝两种单元操作的联合,蒸发、冷凝过程中都没有新的物质形成,因此蒸馏过程属于物理变化过程;
(4)大量使用含Na5P3O10的洗衣粉和过量使用尿素[CO(NH2)2]都会造成水所氮、磷含量的增加,因此②③两种做法可能引发赤潮;
(5)简易净水器,其中小卵石、石英沙的可除去水中不溶性固体杂质,其主要作用是过滤;
(6)图中无玻璃棒引流,如不使用玻璃棒引流,会造成过滤时液体溅出,甚至会损坏滤纸;漏斗下端管口未紧靠烧杯内壁,会使液体溅出;
答案:
(1)混合物,
(2)沉淀、过滤、吸附、消毒,
(3)肥皂水,
(4)BC,
(5)过滤
(6)玻璃棒,引流,防止液体飞溅点评:
本题考点: 自来水的生产过程与净化方法;过滤的原理、方法及其应用;硬水与软水;纯净物和混合物的判别;富营养化污染与含磷洗衣粉的禁用.
考点点评: 本题为涉及较多的化学基础知识,题目难点不大但涉及面较广,耐心审题、沉着作答对于解答类似问题会有较大帮助.1年前查看全部
- (12分)粗食盐中除含有钙离子、镁离子、硫酸根离子等可溶性杂质外,还含有泥沙等不溶性杂质。我们食用的精盐是用粗食盐提纯而
(12分)粗食盐中除含有钙离子、镁离子、硫酸根离子等可溶性杂质外,还含有泥沙等不溶性杂质。我们食用的精盐是用粗食盐提纯而得到的。通常经过以下步骤:①加入稍过量的BaCl 2 溶液;②加入稍过量的NaOH溶液;③加入稍过量的Na 2 CO 3 溶液;④过滤;⑤滴入稀盐酸至无气泡产生;
回答下列问题。
(1)实验室进行NaCl溶液蒸发时,一般有以下操作过程①放置酒精灯;②固定铁圈位置;③放上蒸发皿(蒸发皿中盛有NaCl溶液);④加热搅拌;⑤停止加热。其正确的操作顺序为
(2)如何运用最简单方法检验步骤①后溶液中有无SO 4 2 - 离子? 。如果有,应该如何除去SO 4 2 - 离子? 。
(3)步骤③加入稍过量Na 2 CO 3 溶液,直至不再产生沉淀为止。请问这步操作的目的是 。
(4)将经过步骤④过滤操作后。请问这一操作能除掉哪些杂质?
。
(5)实验室里将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,使用玻璃棒的目的: 。 sksniper1年前1
sksniper1年前1 -
 幻想泡泡0302 共回答了21个问题
幻想泡泡0302 共回答了21个问题 |采纳率85.7%(12分)(1)①②③④⑤
(2)静止片刻在上层清液处,滴加一滴BaCl 2 溶液,如果出现白色浑浊,则溶液中有SO 4 2 - 。除去SO 4 2 - 的方法是在溶液中加入过量的BaCl 2 溶液。
(3)除去Ca 2+ 及过量Ba 2+
(4)BaSO 4 、CaCO 3 、Mg(OH) 2 、BaCO 3 、泥沙(5)搅拌,引流。
考查物质的分离和提纯。
(1)蒸发时如果出现大量晶体时,即应该停止加热,所以正确的顺序是①②③④⑤。
(2)检验溶液中有无SO 4 2 - 离子的方法是继续滴加氯化钡溶液,即静止片刻在上层清液处,滴加一滴BaCl 2 溶液,如果出现白色浑浊,则溶液中有SO 4 2 - 。除去SO 4 2 - 的方法是在溶液中加入过量的BaCl 2 溶液。
(3)由于溶液中含有钙离子及过量的钡离子,所以碳酸钠的作用是除去Ca 2+ 及过量Ba 2+
。
(4)由于钙离子转化为碳酸钙,镁离子转化为氢氧化镁,SO 4 2 - 转化为硫酸钡,因此过滤除去的物质是BaSO 4 、CaCO 3 、Mg(OH) 2 、BaCO 3 及泥沙。
(5)在溶解和蒸发时都需要玻璃棒搅拌,而过滤时则起引流的作用。1年前查看全部
- 硬水 软水为什么硬水中有大量的【可溶性钙镁化合物】,而硬水煮沸后出现水垢,水沟的主要成分是【不溶性钙镁化合物】?
 一览小1年前1
一览小1年前1 -
 sunny_rabbit 共回答了27个问题
sunny_rabbit 共回答了27个问题 |采纳率88.9%自然界的水流经沙土,特别是石灰岩层时会使得当中的盐有溶解,从而含有大量的可溶性钙镁化合物,例如碳酸氢钙、碳酸镁、碳酸氢镁等可溶物,硬水煮沸,在高温下这些物质发生了化学变化,碳酸氢钙分解生成碳酸钙难溶于水从而沉淀,镁的化合物会水解生成氢氧化镁沉淀,沉淀慢慢形成越来越厚的水垢,主要成份是致密的碳酸钙和氢氧化镁.1年前查看全部
- 某固体混合物中含有硝酸钾和不溶性杂质、把它们加入一定量的水中充分溶解,其结果如下表:
某固体混合物中含有硝酸钾和不溶性杂质、把它们加入一定量的水中充分溶解,其结果如下表:
温度(℃) 10 40 65 75
剩余固体(g) 261 175 82 82
硝酸钾的溶解度见下表:
温度(℃) 10 40 50 55 60 65 75 80
溶解度(g) 20.9 63.9 85.5 95 110 126 150 169
求1)所加水的质量:
2)该固体混合物中硝酸钾的质量. CON_MAN1年前1
CON_MAN1年前1 -
 南木狼 共回答了18个问题
南木狼 共回答了18个问题 |采纳率94.4%1)从10度升温到40度硝酸钾的溶解度差值为63.9-20.9=43g
也就是说加100g水那么温度有10度升到40度,固体减少量应为43g那么加水量
m=(261-175)÷43×100=200g
(2)有条件可以看出,65度以后个体粮不在减少,说明硝酸钾全部溶解,所以可以求得10度是未溶解的硝酸钾质量m1=261-82=179g,由第一问可知溶剂水的质量问200g,又因为10度时还有为溶解的硝酸钾,所以10度是溶液为饱和溶液,所以设10度时溶液中的硝酸钾质量为m2:则
m2/200=20.9/100 得m2=41.8
所以该固体混合物中硝酸钾的质量M=m1+m2=179+41.9=220.9g1年前查看全部
- 将下列各组中的物质混合,若每组中最后一种物质过量,充分反应后过滤,则滤纸上仅留下一种不溶性物质(纯净物)的是( )
将下列各组中的物质混合,若每组中最后一种物质过量,充分反应后过滤,则滤纸上仅留下一种不溶性物质(纯净物)的是( )
①氢氧化钠溶液、氯化镁溶液、硝酸;②氯化钡溶液、硝酸钠溶液、稀硫酸;③氯化铜溶液、氯化亚铁溶液、锌粒;④氯化钠溶液、硝酸银溶液、盐酸;⑤硫酸铁溶液、硝酸钠溶液、氢氧化钡溶液.
A. ②④
B. ②③
C. ③⑤
D. ①④ wangxiangkun11年前1
wangxiangkun11年前1 -
 xjbdjb 共回答了19个问题
xjbdjb 共回答了19个问题 |采纳率94.7%解题思路:①硝酸过量不会使反应产物中含有沉淀;
②氯化钡溶液与稀硫酸反应生成硫酸钡沉淀;
③氯化铜溶液、氯化亚铁溶液都与锌粒发生置换反应;
④氯化钠溶液与硝酸银溶液反应生成的氯化银沉淀不溶于稀盐酸;
⑤硫酸铁溶液与氢氧化钡溶液反应生成两种沉淀.因为每组中最后一种物质过量,充分反应后过滤,则滤纸上仅留下一种不溶性物质(纯净物)的是,所以反应后产生沉淀,且只有一种沉淀.①硝酸过量不会使反应产物中含有沉淀,不符合题意,故①错误.②氯化钡溶液与稀硫...
点评:
本题考点: 复分解反应及其发生的条件;金属的化学性质.
考点点评: 此题是对物质间反应的考查,解题的关键是分清三物质之间两两反应时情况,同时也要结合最后物质过量的条件,是一道对物质间反应情况的训练题.1年前查看全部
- 溶液中的沉淀能与溶质反应吗不溶性的酸和碱都不能使酸碱指示剂变色.但稀盐酸却能和碳酸钙反应生成二氧化碳
 踏浪辰伊1年前1
踏浪辰伊1年前1 -
 ordi 共回答了10个问题
ordi 共回答了10个问题 |采纳率100%所谓的沉淀,都是可以溶解在水中的,不过溶解度很小很小,当稀盐酸跟碳酸钙里面溶解的碳酸根离子反应以后,溶解平衡会向正反应方向移动,所以碳酸钙会不断溶解,不断反应,而不溶性的酸和碱因为溶解度很小,所以不能使酸碱指示剂变色.1年前查看全部
- 〓急〓下列各组盐中 都是难溶性盐的是
〓急〓下列各组盐中 都是难溶性盐的是
A.CuSO4、AgCl、CaCO3
B.KNO3、BaCl2、K2CO3
C.BaSO4、AgCl、BaCO3
D.MgSO4、Cu(NO3)2、Ag2CO3 圆88961年前3
圆88961年前3 -
 j9xueli 共回答了18个问题
j9xueli 共回答了18个问题 |采纳率88.9%C
A中.CuSO4 d中Cu(NO3)2都易溶
B都易溶
DCu(NO3)2易溶 MgSO4微溶1年前查看全部
- 一般来说,在相同温度下,不溶性正盐对应的酸式盐的溶解度比正盐的大,如CaCO3难溶于水,Ca(HCO3)2易溶于水;磷酸
一般来说,在相同温度下,不溶性正盐对应的酸式盐的溶解度比正盐的大,如CaCO3难溶于水,Ca(HCO3)2易溶于水;磷酸的钙盐溶解性由大到小为:Ca(H2PO4)2>CaHPO4>Ca3(PO4)2.可溶液性正盐对应的酸式盐溶解度比其正盐[1]的小,如Na2CO3的溶解性大于NaHCO3,K2CO3的溶解性大于KHCO3.正因为如此,才有向饱和的碳酸钠溶液中通入过量的二氧化碳有沉淀生成,其反应的方程式为:
Na2CO3(饱和)+CO2+H2O=2NaHCO3↓
最后那句话(正因为如此.)不懂
其实我想问的是为什么向饱和的碳酸钠溶液中通入过量的二氧化碳有沉淀生成,这个反应原理是什么,实在对不起,上面说错了 度是09071年前5
度是09071年前5 -
 无天邪狐 共回答了17个问题
无天邪狐 共回答了17个问题 |采纳率70.6%如果高中而言...你只要知道碳酸氢钠的溶解度要小于碳酸钠...
如果大学的话...由于重新引入氢键...即分子间和分子内两种..
分子内的氢键你可以去网上看下你就知道了,他的定义和效果.
而HCO3-是以分子内氢键结合的...因此他的溶解度和融沸点都降低...所以才会出现这样效果...也出现了碳酸氢钠加热分解成碳酸钠..
生成了沉淀了啊...因为碳酸氢钠的溶解度低..所以会有他的晶体析出...生成沉淀啊...高中三个发生反应的条件:1生成气体(易挥发)2.难溶物..3.H20(弱电解质)1年前查看全部
- 有一包固体混合物,其中含硝酸钠和某一不溶性杂质.将其投入一定量的水中,使其充分溶解,所得结果如下表:
有一包固体混合物,其中含硝酸钠和某一不溶性杂质.将其投入一定量的水中,使其充分溶解,所得结果如下表:
温度(度):10 40 75
剩余物质的质量(克):201 132 72
硝酸钠溶解度见下表:
温度:10 25 40 50 55 60 65 75 80
溶解度:81 92 104 114 117 124 130 150 166
问:(1)该实验用水多少克?(只要回答第一个问题,为什么要这样算)(在每个步骤解释一下)特别是前几个步骤)
1)由上表温度变化后固体不断减少,所以断定10℃和40℃时,都是饱和溶液
表2的40°-10° 相减得 23克
表1的40°-10° 相减得 69克
相除 得3.
即表1里面的溶剂为表2的3倍
表2为100克
所以 有300克水
75℃ 不是饱和溶液吗?干嘛不用78-10 二用40-10?怎么看出10 40是饱和溶液的 kolavo1年前1
kolavo1年前1 -
 可以问一个问题吗 共回答了17个问题
可以问一个问题吗 共回答了17个问题 |采纳率88.2%假定溶剂是100g ,从10℃到40℃时溶解NaNO3的质量=104g-81g=23g
同理溶剂是x, 从10℃到40℃时溶解NaNO3的质量=201g-132g=69g
因此100g /x=23g/69g
x=300g1年前查看全部
- 分离不溶性固体和可溶性固体的操作是什么?有什么要点?
 猪cc1年前0
猪cc1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 通过晾晒海水或煮盐井水、盐湖水等,可以蒸发除去水分得到粗盐.粗盐中含有难溶性杂质(泥沙等)和多种可溶性杂质(氯化镁、氯化
通过晾晒海水或煮盐井水、盐湖水等,可以蒸发除去水分得到粗盐.粗盐中含有难溶性杂质(泥沙等)和多种可溶性杂质(氯化镁、氯化钙等).
[提出问题]如何才能将粗盐中难溶性杂质和可溶性杂质(氯化镁、氯化钙)除去,从而获得较纯的食盐晶体?
[资料准备]
[实验方案]某同学为了提纯粗盐,设计了如下实验方案并进行实验.20℃时,一些物质的溶解度 OH - CO 3 2- Na + 溶 溶 Ca 2+ 微 不 Mg 2+ 不 微 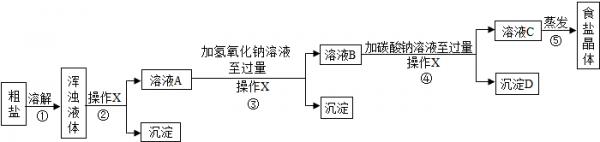
[交流与表达]
(1)实验步骤①和②的目的是______;实验步骤③和④的目的是______.
(2)实验操作X的名称是______,该操作中要用到的玻璃仪器有烧杯、玻璃棒和______.
(3)实验步骤③的主要目的是______(用化学方程式回答);判断氢氧化钠溶液已过量的方法是______.
(4)实验步骤④中生成的沉淀D是______.
(5)实验步骤⑤用蒸发溶剂的方法而不用降低溶液温度的方法获取食盐晶体,原因是______;在蒸发食盐溶液的过程中要使用玻璃棒,作用是______.
[反思与评价]
(6)有同学认为只需要用氢氧化钠溶液和碳酸钠溶液中任意一种试剂就能将两种可溶性杂质出去,你认为这种方法______(选填“可行”或“不可行”),理由是______.
(7)有同学认为原实验方案不完善,做出这种评价的依据是______.
[实验方案设计]
(8)为了完善原实验方案,你设计的实验是______(仅写出补充部分的实验操作和现象) 原野ee1年前1
原野ee1年前1 -
 海底的老鹰 共回答了24个问题
海底的老鹰 共回答了24个问题 |采纳率70.8%(1)通过溶解、过滤可以把粗盐中不溶性杂质除去.
故填:除去粗盐中的难溶性杂质.
通过步骤③和④,可以除去粗盐中的易溶性杂质CaCl 2 、MgCl 2 .
故填:除去粗盐中的易溶性杂质CaCl 2 、MgCl 2 .
(2)实验操作X的名称是过滤,该操作中要用到的玻璃仪器有烧杯、玻璃棒和漏斗.
故填:过滤;漏斗.
(3)实验步骤③的主要目的是除去氯化镁,氢氧化钠和氯化镁反应生成氢氧化镁沉淀和氯化钠,反应的化学方程式为:MgCl 2 +2NaOH═Mg(OH) 2 ↓+2NaCl.
故填:MgCl 2 +2NaOH═Mg(OH) 2 ↓+2NaCl.
判断氢氧化钠溶液已过量的方法是:取样品少许,加入试管中,滴加酚酞试液,溶液变红色.
故填:取样品少许,加入试管中,滴加酚酞试液,溶液变红色.
(4)实验步骤④中生成的沉淀D是碳酸钙.
故填:碳酸钙.
(5)实验步骤⑤用蒸发溶剂的方法而不用降低溶液温度的方法获取食盐晶体,原因是氯化钠的溶解度受温度影响较小.
故填:氯化钠的溶解度受温度影响较小.
在蒸发食盐溶液的过程中要使用玻璃棒,作用是搅拌溶液,避免因局部过热,造成液滴飞溅.
故填:搅拌溶液,避免因局部过热,造成液滴飞溅.
(6)这种方法不可行,因为MgCO 3 、Ca(OH) 2 均为微溶物,只用任意一种试剂就会有一种杂质生成微溶物而不能全部除去.
故填:不可行;MgCO 3 、Ca(OH) 2 均为微溶物,只用任意一种试剂就会有一种杂质生成微溶物而不能全部除去.
(7)做出这种评价的依据是:在除去MgCl 2 和CaCl 2 的同时,又引入了新的杂质NaOH和Na 2 CO 3 .
故填:在除去MgCl 2 和CaCl 2 的同时,又引入了新的杂质NaOH和Na 2 CO 3 .
(8)设计的实验是:向溶液C中逐滴加入稀盐酸至不再产生气泡,滴加酚酞试液时溶液不变色.
故填:向溶液C中逐滴加入稀盐酸至不再产生气泡,滴加酚酞试液时溶液不变色.1年前查看全部
- 长期使用的锅炉底部会形成一层锅垢,它是由一种难溶性的盐和一种难溶性的碱组成的,下列可能属于锅垢成分的一组是
长期使用的锅炉底部会形成一层锅垢,它是由一种难溶性的盐和一种难溶性的碱组成的,下列可能属于锅垢成分的一组是
( )A.Ca(OH) 2 和MgCO 3 B.CaSO 4 和Mg(OH) 2 C.CaCO 3 和Mg(OH) 2 D.CaCl 2 和MgCO 3  dazzle1231年前1
dazzle1231年前1 -
 574931354 共回答了14个问题
574931354 共回答了14个问题 |采纳率92.9%根据信息“锅垢是由一种难溶性的盐和一种难溶性的碱组成”,逐项判断物质的溶解性即可.
A、Ca(OH) 2 和MgCO 3 都是微溶物质,不合题意;
B、CaSO 4 是微溶于水的盐,不合题意;
C、CaCO 3 和Mg(OH) 2 都是不溶于水的盐和碱,符合题意;
D、CaCl 2 是易溶于水的盐,MgCO 3 是微溶于水的盐,不符合题意.
故选C1年前查看全部
- 用下图操作可完成甲、乙两个实验.甲实验为配制溶质的质量分数为20%的氯化钠溶液,乙实验为粗盐中难溶性杂质的去除.下列说法
用下图操作可完成甲、乙两个实验.甲实验为配制溶质的质量分数为20%的氯化钠溶液,乙实验为粗盐中难溶性杂质的去除.下列说法中,正确的是( ) 
A.甲实验按照②③①的步骤,如图所示操作,配制的溶液浓度偏小 B.甲实验操作顺序为②③①,②①如图所示操作,操作③在读取体积时仰视了,配制的溶液浓度偏大 C.乙实验各步操作中的玻璃棒都是用来搅拌的 D.乙实验的步骤是①⑤④,其中④当蒸发皿中出现较多固体时,就停止加热  我爱木头1年前1
我爱木头1年前1 -
 fishsilk 共回答了13个问题
fishsilk 共回答了13个问题 |采纳率92.3%A、甲实验配制溶液时,先称量,再量取、最后溶解,所以按照②③①的步骤进行,由于没有移动游码,所以左码右物和左物右码称得的质量相同,配制溶液的浓度不变,故A错;
B、操作③在读取体积时仰视了,量取到的水体积偏大,所以配制溶液浓度偏小,故B错;
C、过滤时玻璃棒的作用是引流,故C错;
D、粗盐提纯的步骤是溶解、过滤、蒸发,所以乙实验的步骤是①⑤④,其中④当蒸发皿中出现较多固体时,就停止加热,靠余热使剩余的固体结晶析出,故D正确.
故选D.1年前查看全部
- 将含有不溶性物质的硝酸钾固体的混合物放入一定量的水中充分搅拌,得到的实验数据如表1;硝酸钾在不同温度时的溶解度如表2:
将含有不溶性物质的硝酸钾固体的混合物放入一定量的水中充分搅拌,得到的实验数据如表1;硝酸钾在不同温度时的溶解度如表2:
表1:
温度/℃ 20
40
60
剩余固体质量/g
136.8
72.2
20
表2:
温度/℃ 20 30 40 50 60 70 80
溶解度/g
31.6
45.8
63.9
85.5
110
138
169
(1)原固体混合物中硝酸钾的质量是
(2)加入水的质量是
(为什么前2次为饱和溶液,20g就是不溶性物质)请详细说明,
前2次指温度为20、40度的时候 玉台清酒1年前1
玉台清酒1年前1 -
 zhuzinju 共回答了20个问题
zhuzinju 共回答了20个问题 |采纳率90%设含有不溶性物质的硝酸钾固体总质量为x,杂质的质量为20g,加入的水的质量为y.
从表2可知,20℃时,硝酸钾的溶解度为31.6g.该温度下,饱和溶液中溶质质量分数=
溶解度
100g+溶解度
×100%,所以饱和溶液中溶质和溶剂的质量比相等.故
x-136.8g
y
=
31.6g
100g
.
60℃时,硝酸钾的溶解度为110g.温度再升高物质的质量减轻,所以40℃时得到的溶液是硝酸钾的饱和溶液,故
x-20g
y
=
110g
100g
.
所以x=200g y=200g,固体中硝酸钾的质量为200g-20g=180g.
故答案:(1)180g (2)200g1年前查看全部
- 跪求,高中化学必修1附录2难溶性那个表
跪求,高中化学必修1附录2难溶性那个表
老师要抽背,急!
 sanmao0371年前1
sanmao0371年前1 -
 yun1314 共回答了17个问题
yun1314 共回答了17个问题 |采纳率100%1年前查看全部
- 化学实验室欲除去粗盐中混有的少量不溶性杂质,请回答下列有关问题(1)其正确的操作步骤是[1] [2] [3] (
 tyh_48061年前1
tyh_48061年前1 -
 qlezh 共回答了20个问题
qlezh 共回答了20个问题 |采纳率95%一,要有绵纸做成漏斗状
二,把粗盐用水溶解到入漏斗状的绵纸里滤下的盐水用容器接住
三,把接下的盐水烧干后等到的盐就是纯净的盐1年前查看全部
- 玻璃仪器里,如附有不溶性碳酸钙,正确的洗涤操作是?
玻璃仪器里,如附有不溶性碳酸钙,正确的洗涤操作是?
A:用稀硫酸冲洗,再用蒸馏水冲洗
B:用稀盐酸冲洗,再用蒸馏水冲洗
为何选B不选A donghuchun1年前4
donghuchun1年前4 -
 timeagain 共回答了23个问题
timeagain 共回答了23个问题 |采纳率82.6%碳酸钙和硫酸反应生成硫酸钙是沉淀会附着在玻璃仪器上.盐酸和碳酸钙生成氯化钙是可溶的,用蒸馏水就能洗掉!1年前查看全部
- 赏析: 我就是硝酸盐那一类型的,化学性质是不溶性盐,打我学化学起,化学就没与我反应过.
赏析: 我就是硝酸盐那一类型的,化学性质是不溶性盐,打我学化学起,化学就没与我反应过.
这种 把自己比作化学中的一种物质 来写自己对化学没有天赋
好像很妙 但我又说不出在哪里 恳请赐教 姬树1年前3
姬树1年前3 -
 Gloria_cjw 共回答了18个问题
Gloria_cjw 共回答了18个问题 |采纳率83.3%这句话用了比喻的手法,把自己比作硝酸盐,体现了自己与化学没有缘分,就像硝酸盐一般,难溶于水,就像自己难以进入化学的海洋,自嘲中带着悲伤,比喻十分巧妙.
我对化学不太了解,对于硝酸盐的性质不甚熟悉,回答不够完整,请见谅.1年前查看全部
- 中考试卷不再给出“酸碱盐的溶解性表”,那么一些难溶性物质有什么简便记法吗
 kevinshenjia1年前1
kevinshenjia1年前1 -
 飞翔147 共回答了15个问题
飞翔147 共回答了15个问题 |采纳率100%老师总结的
所有的酸:硝酸盐 钠盐 钾盐 铵盐都溶与水
碱中只有NH4OH NAOH CA(OH)2 BA(OH)2 可溶外,其余不溶
盐酸盐中只有AGCL不溶,其余都溶
硫酸盐中只有BASO4不溶 CASO4 AGSO4微溶外,其余都溶
碳酸盐中只有NA2CO3 K2CO3 (NH4)2CO3溶之外,其余不溶1年前查看全部
- Cu(OH)2,Fe(OH)3等类似不溶性碱放入水中是否能电离,能否使酚酞变色,若不能电离,如何与酸反应
 路还要走1年前2
路还要走1年前2 -
 dd-之海 共回答了16个问题
dd-之海 共回答了16个问题 |采纳率87.5%它们是可以电离的,不溶并不是一点都不溶,它们有极少量溶解在水中并电离,所以能与酸反应,但电离出的氢氧根离子浓度太小,所以不能使酚酞变色1年前查看全部
- 让我郁闷了N久的几道化学题.1.某粗盐样品中含有可溶性的氯化镁、氯化钙杂质和不溶性的泥沙.常温下,将140 g该粗盐样品
让我郁闷了N久的几道化学题.
1.某粗盐样品中含有可溶性的氯化镁、氯化钙杂质和不溶性的泥沙.常温下,将140 g该粗盐样品溶解于水中,过滤得到不足3 g泥沙和1000 g溶液.取出500 g溶液进行测定,其中含有镁元素1.2 g,钙元素2 g,氯元素42.6 g.则原粗盐中氯化钠的质量分数约为( )
A.83.6% B.86.3% C.88.1% D.91.6%
2.已知t°C时,氯化钾的溶解度为40g.在该温度下,将20g氯化钾固体加入到50g水中,充分溶解,形成的溶液中溶质的质量分数为( )
A.25% B.28.6% C.33.3% D.50%
我知道答案是什么,
请说明为什么. 拓拔路儿1年前1
拓拔路儿1年前1 -
 爱你很痛 共回答了24个问题
爱你很痛 共回答了24个问题 |采纳率79.2%1.A
500 g溶液中:
镁元素1.2 g来自于 MgCl2.
MgCl2中Mg的质量分数:24/(35.5*2+24) 所以MgCl2质量为4.75g
所以MgCl2中Cl的质量:4.75g-1.2 g=3.55g
钙元素2 g来自于CaCl2
CaCl2中Ca的质量分数:40/(40+35.5*2) 所以 CaCl2质量为5.55g
所以CaCl2中Cl的质量:5.55g-2 g=3.55g
氯元素42.6 g来自于MgCl2,CaCl2,NaCl
NaCl中Cl的质量:42.6 g-3.55g-3.55g=35.5g
所以NaCl的质量为58.5g(方法和前面的一样)
500 g溶液中NaCl的质量为58.5g.1000 g溶液中NaCl的质量为117g
溶液一共140g.质量分数:117/140=83.6%
选A
2.B
氯化钾的溶解度为40g :t°时100g水中可以溶解40gKCl
将20g氯化钾固体加入到50g水中,就恰好可以完全溶解
质量分数:20/(50+20)=28.6%
选B1年前查看全部
- 有一包固体混合物,含有硝酸钾和不溶性杂质,把它们放入一定量的水中充分溶解.
有一包固体混合物,含有硝酸钾和不溶性杂质,把它们放入一定量的水中充分溶解.
有一包固体混合物中含有硝酸钾和不溶性杂质,把它们放入一定量的水中充分溶解,其
结果如下表:
温度 10℃ 40℃ 75℃
剩余固体 261g 175g 82g
硝酸钾溶解度表
温度℃ 10 40 50 55 60 65 75 80
溶解度g 20.9 63.9 85.5 95 110 126 150 169
(1)通过计算,所用水的质量是多少?
(2)原固体中含硝酸钾的质量是多少?
(3)若要完全溶解此混合物中的硝酸钾,所必须的最低温度接近多少? tiao_wu_ba1年前1
tiao_wu_ba1年前1 -
 木知了 共回答了18个问题
木知了 共回答了18个问题 |采纳率100%(1)从溶解度表来看,当温度从10升高到40时,100g水中溶解的硝酸钾增加了43g,而从实际混合物在水中的溶解情况看,当温度从10升高到40时,溶解的硝酸钾增加了86g,所以用的水应该为200g;
(2)从溶解度表同样可以得到当温度从40升高到75时,200g水能再溶解硝酸钾为2×(150-63.9)g=172.2g,但实际混合物溶解时,温度从40升高到75时,200g水能再溶解硝酸钾仅为(175-82)=93g<172.2g,所以剩下的82g为不溶性杂质,含硝酸钾175g;
(3)55℃.50℃时硝酸钾溶解度为85.5g,200g水最多溶解171g硝酸钾,小于175g,而55℃时,200g水最多溶解190g硝酸钾,大于175g.故最低温度应该接近55.1年前查看全部
- 已知由海水制得的粗盐中含有的主要成分为氯化钠,还有不溶性泥沙,可溶性氯化钙,氯化镁以及硫酸盐,设计实验提纯氯化纳
 yqbtb8131年前1
yqbtb8131年前1 -
 苗玉 共回答了20个问题
苗玉 共回答了20个问题 |采纳率95%这到题目我读书的的时候化学书上有,建议你仔细看看一下书1年前查看全部
- 热水溶性有机碳 包含了 水溶性有机碳吗?还是提取了水溶性有机碳后的土壤经震荡、水浴、震荡、离心、过滤
热水溶性有机碳 包含了 水溶性有机碳吗?还是提取了水溶性有机碳后的土壤经震荡、水浴、震荡、离心、过滤
热水溶性有机碳 包含了 水溶性有机碳吗?还是提取了水溶性有机碳后的土壤经震荡、水浴、震荡、离心、过滤后的提取液才称为 热水溶性有机碳?怎么提取热水溶性有机碳,请大概说下 zhaoyueboy1年前1
zhaoyueboy1年前1 -
 为爱独行 共回答了15个问题
为爱独行 共回答了15个问题 |采纳率100%抱歉,哦,我这些都还没教到了,不能帮你了,
我想你应该可以去请教你老师,这样才能更确切的得到一个最完美的解释,
希望,你能得到你满意的答案1年前查看全部
大家在问
- 1麻烦老师解答:正是因为人们有了像小
- 2在线求指导:下列叙述中正确的是 下列叙述中正确的是 [ ] A.氧化反应一定是化合反应 B.物质只有和氧气发
- 3谁能帮我整整天文学中要用的物理公式,
- 4看一道高中英语选择题---Ann looks hot and dry.----So____ you if you had
- 5much to our surprise 是副词短语还是介词短语,to my surprise和 as fast as呢
- 630目等于多少毫米(微米)?
- 7古代诗文中有许多蕴涵着丰富人生哲理的佳句.对待生死:对待挫折:(要求上下相连,意思完整)
- 8七年级题目,龙门活页的题,计算每天的最高价与最低价的差,以及这些差得平均值
- 9用图像法求一元二次方程2x的平方-4x-1=0的近似解
- 10硫化钠怎么变成硫化氢钠求完整的化学方程式
- 11用一条长为40cm的绳子围成一个面积为a cm²的长方形,a的值不可能为 A 20 B 40 C 100 D120
- 12把1cm估读到分度值的下一位
- 13你是谁,我是小明 翻译成英文
- 14大漠孤烟直,长河落日圆 翻译
- 15用直径为200毫米的圆柱形钢块锻造长,宽,高分别为300毫米300毫米,100毫米的长方体零件,应截取圆钢多长?(结果保

