可溶性盐是不是只有在碳酸盐中钾盐,钠盐,铵盐才可溶?还有如果说KNO3一般不参与复分解反应,那么是不是硝酸钠,硝酸铵都不
 小rongrangel2022-10-04 11:39:541条回答
小rongrangel2022-10-04 11:39:541条回答是不是只有在碳酸盐中钾盐,钠盐,铵盐才可溶?
还有如果说KNO3一般不参与复分解反应,那么是不是硝酸钠,硝酸铵都不参与复分解反应?

已提交,审核后显示!提交回复
共1条回复
 yyy20100 共回答了19个问题
yyy20100 共回答了19个问题 |采纳率84.2%- 不是 所有的钾盐,钠盐,铵盐都可以溶
判断复分解反应是否可以进行看三点
1、生成物有水;
2、生成物有气体;
3、生成物有难溶物体;
符合以上三点任何一点都可以进行
否则就不能进行 - 1年前
相关推荐
- 如果一种物质的杂质是可溶性的,杂质不反应,那么在计算所得溶液溶质的质量分数为?如果杂质不溶的公式
 心灵与心灵1年前1
心灵与心灵1年前1 -
 comawhite129 共回答了20个问题
comawhite129 共回答了20个问题 |采纳率95%如果你没有办法把杂质排除,那么计算时就会把它视为所求的溶质,换句话说,你在计算式把溶质算多一些,质量分数当然会偏高.1年前查看全部
- 硬水 软水为什么硬水中有大量的【可溶性钙镁化合物】,而硬水煮沸后出现水垢,水沟的主要成分是【不溶性钙镁化合物】?
 一览小1年前1
一览小1年前1 -
 sunny_rabbit 共回答了27个问题
sunny_rabbit 共回答了27个问题 |采纳率88.9%自然界的水流经沙土,特别是石灰岩层时会使得当中的盐有溶解,从而含有大量的可溶性钙镁化合物,例如碳酸氢钙、碳酸镁、碳酸氢镁等可溶物,硬水煮沸,在高温下这些物质发生了化学变化,碳酸氢钙分解生成碳酸钙难溶于水从而沉淀,镁的化合物会水解生成氢氧化镁沉淀,沉淀慢慢形成越来越厚的水垢,主要成份是致密的碳酸钙和氢氧化镁.1年前查看全部
- 检验可溶性硫酸盐的常用试剂是?钾盐,钠盐,钡盐,强碱.这四个哪个?急用...
 X凤姐来了1年前1
X凤姐来了1年前1 -
 baibinger 共回答了17个问题
baibinger 共回答了17个问题 |采纳率82.4%2.BaCl2 、 HCl Ba2+ + SO42- =BaSO4↓1年前查看全部
- 纯水清澈透明、不含杂质,而硬水含较多可溶性钙和镁的化合物.现有两瓶无色液体,分别为纯水和硬水,请你参与小雯同学对水的探究
纯水清澈透明、不含杂质,而硬水含较多可溶性钙和镁的化合物.现有两瓶无色液体,分别为纯水和硬水,请你参与小雯同学对水的探究,并回答有关问题:
(1)区别纯水和硬水的方法有多种.小雯采用的方法是:分别取样于蒸发皿中,加热蒸干,有固体析出的是硬水.您设计的另一种方法______.
(2)小雯在做实验时,发现硬水在加热的过程中,产生了少量气体并得到一种难溶性的固体.
【提出猜想】产生气体可能是二氧化碳;难溶性的固体可能是碳酸钙.
【设计实验】
①要证明产生的气体是二氧化碳,我的方法是______;
②向这种难溶性的固体中滴入稀盐酸,观察到有大量的气泡产生,则这种固体可能是碳酸钙;若这种固体是碳酸钙,写出该反应的化学方程式:______;
【反思】
①人们在生产、生活中不宜使用硬水,在日常生活中对如何处理硬水你有什么看法:______;
②生活中要除去热水瓶中的水垢,可以采用的方法是______. ALOMAS1年前1
ALOMAS1年前1 -
 特大神经病 共回答了18个问题
特大神经病 共回答了18个问题 |采纳率83.3%解题思路:(1)根据实验室常用肥皂水检验水的硬度进行分析;
(2)【设计实验】①根据实验室常用石灰水检验二氧化碳进行分析;
②根据碳酸根离子会与酸反应生成气体进行分析;
【反思】①生活中常用煮沸的方法处理硬水;
②根据家里显酸性的物质进行分析.(1)在生活中还可以用肥皂水检验水的硬度.取水样,加入肥皂水后振荡,出现泡沫较多的是软水,出现泡沫较少的是硬水.
故答案为:取水样分别放入两支试管中,各滴入少量肥皂水振荡;泡沫多的是纯水,泡沫少的是硬水;
(2)【设计实验】①二氧化碳可以使澄清石灰水变浑浊,可以用石灰水检验二氧化碳的存在,将气体通入澄清石灰水中,澄清石灰水变浑浊,证明气体是二氧化碳.
故答案为:将气体通入澄清石灰水中,澄清石灰水变浑浊;
②碳酸根离子会与氢离子反应生成二氧化碳气体.
故答案为:CaCO3+2HCl=CaCl2+H2O+CO2↑
【反思】①生活中常用加热煮沸的方法使硬水变软水.
故答案为:加热煮沸可以使硬水变软水;
②水垢的主要成分是碳酸盐,碳酸盐会溶于酸,生活中常见的酸有醋酸,生活中要除去热水瓶中的水垢,可以采用的方法是
故答案为:加入食醋浸泡.点评:
本题考点: 硬水与软水;证明碳酸盐;二氧化碳的检验和验满;书写化学方程式、文字表达式、电离方程式.
考点点评: 在解此类题时,首先要充分读题,从中找出有用的知识结合问题进行解答,此类题的难度一般不大,起点高,但是落点低,主要是书本中的题.1年前查看全部
- 某混合物中可能含有可溶性硫酸盐、碳酸盐及硝酸盐,请鉴别其中含有三种中的哪种或哪几种.
 紫茉飞1年前1
紫茉飞1年前1 -
 dandao 共回答了16个问题
dandao 共回答了16个问题 |采纳率93.8%假设三种盐同时溶于水时不产生沉淀
1.取样,溶于水,加过量酸化氯化钡,若有气泡则有碳酸盐,若有沉淀则有硫酸盐.
2.将上步得到溶液加入盐酸酸化的碘化钾溶液,若溶液变棕色则有硝酸盐.1年前查看全部
- 除去粗盐中可溶性杂质,加入试剂的顺序和用量怎样的?
 jakey5151年前2
jakey5151年前2 -
 tracy870824 共回答了12个问题
tracy870824 共回答了12个问题 |采纳率100%.粗盐成分:主要为NaCl,并有CaCl2,MgCl2以及Na2SO4等 加入NaOH溶液 杂质是 MgCl2 MgCl2 + 2NaOH == Mg(OH)2↓ + 2NaCl 加入BaCl2溶液 杂质是Na2SO4 Na2SO4 + BaCl2 == BaSO4↓+2NaCl 加入Na2CO3溶液 杂质是 CaCl2和BaCl2 CaCl2 + Na2CO3 ==CaCO3↓ + 2NaCl BaCl2 + Na2CO3 ==BaCO3↓ +2NaCl 加入NaOH溶液,杂质是什么,写出化学方程式 杂质是 MgCl2 MgCl2 + 2NaOH == Mg(OH)2↓ + 2NaCl 加入BaCl2溶液,杂质是什么,写出化学方程式 杂质是Na2SO4 Na2SO4 + BaCl2 == BaSO4↓+2NaCl 加入Na2CO3溶液,杂质是什么,写出化学方程式 杂质是 CaCl2和BaCl2 CaCl2 + Na2CO3 ==CaCO3↓ + 2NaCl BaCl2 + Na2CO3 ==BaCO3↓ +2NaCl 最后加入盐酸除去杂质NaOH和Na2CO3 HCl+NaOH = NaCl+H2O Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑1年前查看全部
- 可溶性盐和可溶性盐反应方程式{10条}{反应产物必需要有沉淀或气体或水产生}谢谢
 离开花的花瓣1年前2
离开花的花瓣1年前2 -
 真心意 共回答了22个问题
真心意 共回答了22个问题 |采纳率95.5%盐1+盐2→新盐1+新盐2
KCl+AgNO3==AgCl↓+KNO3 NaCl+AgNO3==AgCl↓+NaNO3
Na2SO4+BaCl2==BaSO4↓+2NaCl BaCl2+2AgNO3==2AgCl↓+Ba(NO3)2
Na2CO3+BaCl2==BaCO3↓+2NaCl Na2CO3+CaCl2==CaCO3↓+2NaCl K2CO3+BaCl2==BaCO3↓+2KCl K2CO3+CaCl2==CaCO3↓+2KCl
K2CO3+Ba(NO3)2==BaCO3↓+2KNO3 Na2CO3+Ca(NO3)2==CaCO3↓+2NaNO31年前查看全部
- 长江三角洲的形成 是因为加入可溶性盐使胶体聚沉,还是因为加入带相反电荷的胶粒使胶体聚沉?
长江三角洲的形成 是因为加入可溶性盐使胶体聚沉,还是因为加入带相反电荷的胶粒使胶体聚沉?
如果是因为第一个原因,那么您能否举一个加入相反电荷的胶粒使胶体聚沉的实例? junjun6412081年前1
junjun6412081年前1 -
 挫骨扬沙 共回答了18个问题
挫骨扬沙 共回答了18个问题 |采纳率88.9%是第一个 原因是海水中有NaCl是可溶性盐1年前查看全部
- 蒸馏水能鉴别硝酸钠中的可溶性硫酸盐杂质吗,什么现象,硝酸银和盐酸行吗
 重庆妹妹cqmm1年前1
重庆妹妹cqmm1年前1 -
 馒头小妞 共回答了18个问题
馒头小妞 共回答了18个问题 |采纳率88.9%用蒸馏水鉴别?没有明显现象,硝酸银可以,但不太好,除非你是知道杂质就是硫酸盐的,只是想判断又还是没有,因为,氯离子也会和银离子有白色的沉淀,如果是未知杂质,你不好判断的.盐酸也是不好判断,没气体,没沉淀,没颜色变化,1年前查看全部
- 区分是否可溶如何快速的区别物质是否具有可溶性?(例如放在水里,怎么看?)
 味味Q歪歪1年前2
味味Q歪歪1年前2 -
 kimdoctor 共回答了23个问题
kimdoctor 共回答了23个问题 |采纳率82.6%就是少量物质放在水里,搅拌后,迅速“消失”,说明该物质易溶;
硝酸盐可溶钾,钠,铵
硝酸盐入水无踪影;
氯化物不溶氯化银;
硫酸盐不溶硫酸钡;
碳酸盐只溶钾,钠,铵;
碱溶钡和钾,钠,铵.1年前查看全部
- 溶液中可溶性溶质用什么表示,难溶的固体与液体呢
 poptf1年前1
poptf1年前1 -
 宁与静 共回答了19个问题
宁与静 共回答了19个问题 |采纳率84.2%s(solid)表示固体 如AgCl(s)
aq(aqueous)表示溶液 如NaOH(aq)氢氧化钠溶液
l(liquid)表示液体
g(gas)表示气体1年前查看全部
- A是可溶性碱,B是可溶性盐,会生成两种沉淀么?
 5月19日遇见他1年前1
5月19日遇见他1年前1 -
 kangjiaszl 共回答了15个问题
kangjiaszl 共回答了15个问题 |采纳率93.3%应该可以,反应试 为:MgSO4+Ba(OH)2—Mg(OH)2↓+BaSO4↓1年前查看全部
- 一种盐跟一种碱反应生成水和另一种可溶性盐应该是复分解反应,是不是?
 神州烽火1年前1
神州烽火1年前1 -
 xingfan122 共回答了18个问题
xingfan122 共回答了18个问题 |采纳率94.4%一种盐跟一种碱反应生成水和另一种可溶性盐是不可能的,违背质量守恒定律.盐+碱→新盐+新碱,反应进行条件是:反应物中的盐与碱要溶于水,而生成物中的新盐和新碱要至少有一个难溶于水.盐+碱→新盐+新碱,这条反应一定是复分解反应,由两种化合物互相交换成分,生成另外两种化合物.
但也需要注意,如氢氧化钠溶液与硫酸铜溶液反应可生成蓝色的氢氧化铜沉淀和硫酸钠溶液,但反应后的产物如果久置,蓝色沉淀会很快变成黑色沉淀.因为氢氧化铜沉淀不稳定,容易分解为黑色的氧化铜和水.1年前查看全部
- 检验盐酸或可溶性盐酸盐常用的试剂为( )和( )
检验盐酸或可溶性盐酸盐常用的试剂为( )和( )
检验硫酸或可溶性硫酸盐常用的试剂为( )和( )
检验碳酸或可溶性碳酸盐常用的试剂为( )和( )
P.S.最好有化学式 刘建垒1年前2
刘建垒1年前2 -
 黄鹤白云 共回答了8个问题
黄鹤白云 共回答了8个问题 |采纳率100%1.
AgNO3 、 HNO3
Ag+ +Cl- =AgCl↓
2.
BaCl2 、 HCl
Ba2+ + SO42- =BaSO4↓
3.
澄清石灰水[Ca(OH)2] 、 HCl
Ca2+ +CO32- =CaCO3↓
CaCO3+2H+ =Ca2+ +CO2↑+H2O1年前查看全部
- 如题:怎么对高温液体中的不可溶性固体,用物理方式进行剔除?
如题:怎么对高温液体中的不可溶性固体,用物理方式进行剔除?
方法不限,多多益善,请做详细解释.
对于特满意答案,到时还将进行加分.
本题主要以多为要点,只要能解决问题,方法越多越好.
本题高温液体主要针对方向:
一、温度极高
二、大体积,大分量
三、在尽可能不对液体进行移动的情况下,进行固体剔除,或者说,在对已提纯液体进行提取时,不会夹杂固体
所以,过滤网方式不易使用.如果是离心力,有助固体分离,但不易剔除,如有好办法,请做详细介绍.
举例:钢水 腼腆米1年前1
腼腆米1年前1 -
 查看V 共回答了14个问题
查看V 共回答了14个问题 |采纳率71.4%从炼钢炉中冶炼出来的钢水含有少量的气体及杂质,一般是将钢水注入精炼包中,进行吹氩、脱气、钢包精炼等工序,得到较纯净的钢质.1年前查看全部
- 一道计算和基础概念①有100克含少量可溶性杂质(杂质不参加化学反应)的硝酸铵和硫酸铵的均匀混合物,将其分成两等份,一份与
一道计算和基础概念
①有100克含少量可溶性杂质(杂质不参加化学反应)的硝酸铵和硫酸铵的均匀混合物,将其分成两等份,一份与足量氢氧化钠共热,在标准状况下收集到13.44升氨气,另一份溶解后加适量的硝酸钡,使其沉淀,过滤,小心将滤液蒸干,得到固体52.4克,求混合物的百分组成.
②氧化亚铁的俗称
③四氧化三铁和稀硝酸在常温下的反应方程式
④铁和稀硝酸在常温下的反应方程式 sw4691年前1
sw4691年前1 -
 njce 共回答了16个问题
njce 共回答了16个问题 |采纳率93.8%同学,不瞒您说,我高中当了3年的化学课代表,对化学计算还是比较擅长的.第一问:NH4NO3+NaOH=加热=NaNO3+H2O+NH3(NH4)2SO4+2NaOH=加热=Na2SO4+2H2O+2NH3根据质量守恒定律则有,反应前n(NH4+)=nNH3=(13.44/22.4)=0.6...1年前查看全部
- 很重要很重要的一个题,希望大家帮帮我. 某混合物中可能含有可溶性硫酸盐,碳酸盐,及硝酸盐.怎么检验
很重要很重要的一个题,希望大家帮帮我. 某混合物中可能含有可溶性硫酸盐,碳酸盐,及硝酸盐.怎么检验
很重要很重要的一个题,希望大家帮帮我.
某混合物中可能含有可溶性硫酸盐,碳酸盐,及硝酸盐.怎么检验其中是否含有硫酸盐? sukyu1年前1
sukyu1年前1 -
 葫芦超人 共回答了15个问题
葫芦超人 共回答了15个问题 |采纳率93.3%加入Bacl2,就是氯化钡,在向生成的白色沉淀中放入盐酸,若白色沉淀不溶解则含硫酸盐1年前查看全部
- 关于硬水软水的1、下列说法正确的是( )A.软水中一定不含钙,镁化合物.B.含有可溶性钙,镁化合物的水是硬水.C.井水是
关于硬水软水的
1、下列说法正确的是( )
A.软水中一定不含钙,镁化合物.
B.含有可溶性钙,镁化合物的水是硬水.
C.井水是软水
D.软水可作锅炉用水.
(我是选B的,但是答案是D耶,B哪里错了?D又哪里对了?麻烦指导指导!) liu1in1年前2
liu1in1年前2 -
 微微三笑 共回答了16个问题
微微三笑 共回答了16个问题 |采纳率75%软水、硬水中都含有可溶性钙,镁化合物,只是含量的多少不同而已
软水中的化合物少,用作锅炉用水不会生太多的水垢1年前查看全部
- 某混合物中可能含有可溶性硫酸盐,碳酸盐及硝酸盐.为了检验其中是否含有硫酸盐,某同学取少量混合物溶于水后,想起中加入氯化钡
某混合物中可能含有可溶性硫酸盐,碳酸盐及硝酸盐.为了检验其中是否含有硫酸盐,某同学取少量混合物溶于水后,想起中加入氯化钡溶液,发现有白色沉淀生成,并由此得出该混合物中含有硫酸盐的结论.你认为这一结论可靠吗?为什么?应该怎样检验?(提示:碳酸盐能溶于稀硝酸和稀盐酸)
 mzqian1年前4
mzqian1年前4 -
 东邪07 共回答了29个问题
东邪07 共回答了29个问题 |采纳率86.2%解题思路:只加氯化钡,不能判断是否有硫酸盐,碳酸钡也是白色沉淀,应该加入氯化钡之后再加稀硝酸,看沉淀是否溶解,若不溶解为硫酸钡,若溶解为碳酸钡.碳酸钡和硫酸钡都不溶于水,如只加氯化钡生成沉淀不能证明含有硫酸盐,可在加入氯化钡之后再加入稀硝酸,如沉淀部分溶解且有气泡生成,则说明既含有碳酸盐也含有硫酸盐,如沉淀不溶解,则没有气泡生成,则说明只含有硫酸盐,如沉淀完全溶解,则说明不含硫酸盐.
答:不可靠,应在加入氯化钡溶液后再加入稀硝酸,观察沉淀是否溶解.点评:
本题考点: 物质的检验和鉴别的基本方法选择及应用.
考点点评: 本题考查物质的检验和鉴别,侧重于学生的分析能力和实验能力的考查,为高频考点,注意把握物质的性质的异同,把握实验设计的原理,难度不大.1年前查看全部
- 1.检验钡离子可以用稀硫酸或硝酸酸化的可溶性硫酸盐.为什么要硝酸酸化?
1.检验钡离子可以用稀硫酸或硝酸酸化的可溶性硫酸盐.为什么要硝酸酸化?
2.检验银离子也为什么要用硝酸酸化的可溶性盐酸盐?
3.检验硫酸根离子为什么要先加盐酸后加氯化钡?
4.检验氯离子为什么要加硝酸银和稀硝酸?
5.为什么检验离子不能单纯加一样物质呢?好像很多离子都要再加个硝酸什么的.为什么? 魔影紫光1年前5
魔影紫光1年前5 -
 jiumangxing2008 共回答了13个问题
jiumangxing2008 共回答了13个问题 |采纳率76.9%你所说的所有情况都是一样的,酸化的目的是放置其他离子干扰,比如不加酸化,碳酸根要和Ba沉淀,就不确定沉淀是碳酸钡还是硫酸钡,所以酸化.如果有沉淀就一定是硫酸钡,硫酸钡不溶于酸.这些是初中就该要掌握的内容,没事记记沉淀表吧教材最后面的表格1年前查看全部
- A、B、C、D、E是中学所学的无机试剂。B、C、D、E都是可溶性正盐(不包括复盐);且组成它们的阴、阳离子均不相同。现进
A、B、C、D、E是中学所学的无机试剂。B、C、D、E都是可溶性正盐(不包括复盐);且组成它们的阴、阳离子均不相同。现进行如下实验:
①常温下,0.05 mol/LA溶液的pH=13;C溶液显中性,D、E的溶液显酸性;
②A与B的浓溶液混合时有刺激性气味的气体产生,同时有白色沉淀生成;
③A与D的溶液混合时有白色沉淀生成,当A过量时沉淀部分溶解;
④E溶液与B、C、D的浓溶液反应均有白色沉淀生成。
根据上述实验信息,请回答下列问题。
(1)写出A和D的化学式:A________,D________,A中阴离子的电子式是________。
(2)E溶液的实验室保存方法是________________________。
(3)实验测得B的溶液显碱性,则B电离产生的阳离子与阴离子的物质的量浓度的比值____2(填“大于”“小于”或 “等于”)。
(4)1 mol D与A反应生成沉淀的最大质量为_______________。
(5)为进一步确定C的组成,还需要进行的实验操作是________(填名称)。 froghui1年前0
froghui1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 分离不溶性固体和可溶性固体的操作是什么?有什么要点?
 猪cc1年前0
猪cc1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- “曾青得铁则化为铜”,里面的曾青从现代化学观点理解,曾青应赋予的最恰当的涵义为 A硫酸铜B可溶性铜盐
“曾青得铁则化为铜”,里面的曾青从现代化学观点理解,曾青应赋予的最恰当的涵义为 A硫酸铜B可溶性铜盐
= =,理由,你们懂的 色声香味触法1年前2
色声香味触法1年前2 -
 雍正之流 共回答了27个问题
雍正之流 共回答了27个问题 |采纳率88.9%B
铁比铜活泼,能从铜盐溶液中置换出铜.1年前查看全部
- “含氧化镁的可溶性盐”的含义如何理解?
 T-Mac_yy1年前1
T-Mac_yy1年前1 -
 月夜虫 共回答了19个问题
月夜虫 共回答了19个问题 |采纳率94.7%应该是指含有氧离子和镁离子的可溶性复盐.这样就可以写成氧化镁结合其他物质的形式嘛!1年前查看全部
- 通过晾晒海水或煮盐井水、盐湖水等,可以蒸发除去水分得到粗盐.粗盐中含有难溶性杂质(泥沙等)和多种可溶性杂质(氯化镁、氯化
通过晾晒海水或煮盐井水、盐湖水等,可以蒸发除去水分得到粗盐.粗盐中含有难溶性杂质(泥沙等)和多种可溶性杂质(氯化镁、氯化钙等).
[提出问题]如何才能将粗盐中难溶性杂质和可溶性杂质(氯化镁、氯化钙)除去,从而获得较纯的食盐晶体?
[资料准备]
[实验方案]某同学为了提纯粗盐,设计了如下实验方案并进行实验.20℃时,一些物质的溶解度 OH - CO 3 2- Na + 溶 溶 Ca 2+ 微 不 Mg 2+ 不 微 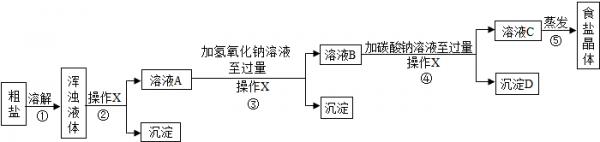
[交流与表达]
(1)实验步骤①和②的目的是______;实验步骤③和④的目的是______.
(2)实验操作X的名称是______,该操作中要用到的玻璃仪器有烧杯、玻璃棒和______.
(3)实验步骤③的主要目的是______(用化学方程式回答);判断氢氧化钠溶液已过量的方法是______.
(4)实验步骤④中生成的沉淀D是______.
(5)实验步骤⑤用蒸发溶剂的方法而不用降低溶液温度的方法获取食盐晶体,原因是______;在蒸发食盐溶液的过程中要使用玻璃棒,作用是______.
[反思与评价]
(6)有同学认为只需要用氢氧化钠溶液和碳酸钠溶液中任意一种试剂就能将两种可溶性杂质出去,你认为这种方法______(选填“可行”或“不可行”),理由是______.
(7)有同学认为原实验方案不完善,做出这种评价的依据是______.
[实验方案设计]
(8)为了完善原实验方案,你设计的实验是______(仅写出补充部分的实验操作和现象) 原野ee1年前1
原野ee1年前1 -
 海底的老鹰 共回答了24个问题
海底的老鹰 共回答了24个问题 |采纳率70.8%(1)通过溶解、过滤可以把粗盐中不溶性杂质除去.
故填:除去粗盐中的难溶性杂质.
通过步骤③和④,可以除去粗盐中的易溶性杂质CaCl 2 、MgCl 2 .
故填:除去粗盐中的易溶性杂质CaCl 2 、MgCl 2 .
(2)实验操作X的名称是过滤,该操作中要用到的玻璃仪器有烧杯、玻璃棒和漏斗.
故填:过滤;漏斗.
(3)实验步骤③的主要目的是除去氯化镁,氢氧化钠和氯化镁反应生成氢氧化镁沉淀和氯化钠,反应的化学方程式为:MgCl 2 +2NaOH═Mg(OH) 2 ↓+2NaCl.
故填:MgCl 2 +2NaOH═Mg(OH) 2 ↓+2NaCl.
判断氢氧化钠溶液已过量的方法是:取样品少许,加入试管中,滴加酚酞试液,溶液变红色.
故填:取样品少许,加入试管中,滴加酚酞试液,溶液变红色.
(4)实验步骤④中生成的沉淀D是碳酸钙.
故填:碳酸钙.
(5)实验步骤⑤用蒸发溶剂的方法而不用降低溶液温度的方法获取食盐晶体,原因是氯化钠的溶解度受温度影响较小.
故填:氯化钠的溶解度受温度影响较小.
在蒸发食盐溶液的过程中要使用玻璃棒,作用是搅拌溶液,避免因局部过热,造成液滴飞溅.
故填:搅拌溶液,避免因局部过热,造成液滴飞溅.
(6)这种方法不可行,因为MgCO 3 、Ca(OH) 2 均为微溶物,只用任意一种试剂就会有一种杂质生成微溶物而不能全部除去.
故填:不可行;MgCO 3 、Ca(OH) 2 均为微溶物,只用任意一种试剂就会有一种杂质生成微溶物而不能全部除去.
(7)做出这种评价的依据是:在除去MgCl 2 和CaCl 2 的同时,又引入了新的杂质NaOH和Na 2 CO 3 .
故填:在除去MgCl 2 和CaCl 2 的同时,又引入了新的杂质NaOH和Na 2 CO 3 .
(8)设计的实验是:向溶液C中逐滴加入稀盐酸至不再产生气泡,滴加酚酞试液时溶液不变色.
故填:向溶液C中逐滴加入稀盐酸至不再产生气泡,滴加酚酞试液时溶液不变色.1年前查看全部
- 离子鉴别有ABCD四种可溶性离子化合物,组成中的阳离子分别是Ag+,K+,Mg2+,Cu2+ 阴离子分别是Cl-,NO3
离子鉴别
有ABCD四种可溶性离子化合物,组成中的阳离子分别是Ag+,K+,Mg2+,Cu2+ 阴离子分别是Cl-,NO3-,OH-,SO42-中的一种.他们的稀溶液两两反应的现象:A+B→白色沉淀,C+D→蓝色沉淀 B+D→白色沉淀 判断 A B C D 荆棘小鸟1年前1
荆棘小鸟1年前1 -
 cc86 共回答了17个问题
cc86 共回答了17个问题 |采纳率76.5%A 、MgCl2 B、AgNO3 C、CuSO4 D、KOH1年前查看全部
- 怎样理解盐可溶性的口诀比如,盐酸盐,银不溶;硫酸盐,钡不溶……这样的口诀怎样理解 ?答得好我会给30分的
 络络微尘1年前1
络络微尘1年前1 -
 太阳96 共回答了19个问题
太阳96 共回答了19个问题 |采纳率89.5%复分解反应口诀:
有酸参加用强酸,
无酸参加须可溶,
或气或水或沉淀。
钾钠铵盐硝酸盐,
都能溶于水中间,
盐酸除了银和汞,
硫酸难溶是钡铅。
碳酸磷酸不多溶,
溶者只有钾钠铵。
碱有钾钠铵和钡,
硫化物中加镁盐。
余者皆是难溶物....1年前查看全部
- 碱性氧化物+水→(可溶性)碱的方程式
碱性氧化物+水→(可溶性)碱的方程式
氧化钠和水 氧化钾和水 氧化钙和水 氧化钡和水 氨气通入水中的反应方程式和离子方程式 eddieren1年前1
eddieren1年前1 -
 天使大BABY 共回答了19个问题
天使大BABY 共回答了19个问题 |采纳率84.2%1,Na2O+H2O=2NaOH
2,K2O+H2O=2KOH
3,CaO+H2O=Ca(OH)2
4,BaO+H2O=Ba(OH)2
5,NH3+H2O=NH4OH1年前查看全部
- 现有A.B.C.D四种可溶性盐,它们的阳离子分别是Ba2+.Ag+.Na+.Cu2+中的一种;
现有A.B.C.D四种可溶性盐,它们的阳离子分别是Ba2+.Ag+.Na+.Cu2+中的一种;
阴离子则可能是三氧化氮离子,硫根离子.氯离子.碳酸根离子中的一种.
(1)若把少量的四种盐溶解在四友试管中,其中D盐溶液呈蓝色;
(2)若向四友试管中分别加入盐酸,B盐溶液中有沉淀生成,D盐溶液中有气体放出.
试推断(写化学式):
A是?
B是?
C是?
D是?
不好意思!
(1)问中是C盐溶液呈蓝色;
本人输入有误! 天堂红颜1年前3
天堂红颜1年前3 -
 shrimp32 共回答了13个问题
shrimp32 共回答了13个问题 |采纳率100%是(1)问中是C盐溶液呈蓝色吧?
因为只有Cu盐溶液可能为蓝色(可为绿色、蓝绿色)
所以C盐溶液有Cu2+.
又向四友试管中分别加入盐酸,B盐溶液中有沉淀生成,而所以B盐溶液中有Ag+,而Ag+与硫根离子.氯离子.碳酸根离子不可共存,所以B盐溶液的溶质为AgNO3.
又因为上述四盐皆为可溶性盐,而D溶液中加盐酸有气体放出,所以D溶液的溶质为Na2CO3(上述阴离子只有碳酸根离子能与H+反应参生气体,而在阳离子中只有Na2CO3为可溶盐)
所以A溶液的溶质为BaCl2(只剩下Ba2+了,而阴离子只剩下Cl-和(SO4)2-了,BaSO4为不可溶盐,所以只有BaCl2了)
最后剩下(SO4)2-,所以C溶液的溶质为CuSO4.
答:
A是BaCl2
B是AgNO3
C是CuSO4
D是Na2CO3
更正一下没有什么“三氧化氮离子”,是硝酸根离子.
不是硫根,而是硫酸根1年前查看全部
- 鉴定可溶性还原糖的实验前最好检测一下蔗糖溶液和葡萄糖溶液的纯度
鉴定可溶性还原糖的实验前最好检测一下蔗糖溶液和葡萄糖溶液的纯度
这句话为什么是正确的?蔗糖不是还原糖啊 cuttlefish011年前1
cuttlefish011年前1 -
 laohei5 共回答了16个问题
laohei5 共回答了16个问题 |采纳率87.5%对的呀1年前查看全部
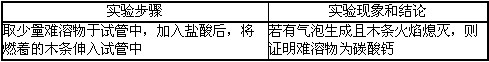
- 浴室喷头长时间使用会有白色固体附着,这是因为硬水中含有较多的可溶性的钙、镁化合物,其中碳酸氢钙[Ca(HCO 3 ) 2
浴室喷头长时间使用会有白色固体附着,这是因为硬水中含有较多的可溶性的钙、镁化合物,其中碳酸氢钙[ca(hco 3 ) 2 ]受热易分解,生成难溶性的化合物、气体等物质。某小组探究碳酸氢钙受热完全分解后产物的成分。
【提出猜想】从组成物质元素的角度分析:
猜想1:生成的难溶性化合物可能是____。
猜想2:放出的气体可能是o 2 、h 2 、co 2 。
【方案设计】请你设计实验,帮助该组同学确定难溶物的成分。
【实验探究】该组同学设计如下实验,继续探究气体的成分。 
操作1:加热a装置,一段时间后,b装置中的澄清石灰水变浑浊。
操作2:在a处用燃着的木条检验,无明显现象。
【实验结论】结论1:碳酸氢钙分解产生的气体一定有____;一定没有_____。
结论2:碳酸氢钙受热分解的化学方程式为ca(hco 3 ) 2 caco 3 ↓+co 2 ↑
caco 3 ↓+co 2 ↑
【实验交流】交流1:从安全的角度考虑,操作2中存在的实验不足是_____________。
交流2:小组内某同学对上述结论提出***:
 发财猪哥哥1年前1
发财猪哥哥1年前1 -
 sindy1388 共回答了14个问题
sindy1388 共回答了14个问题 |采纳率92.9%1年前查看全部
- 下列哪个实验用到碘液( )A. 可溶性还原糖的鉴定B. 蛋白质的鉴定C. 脂肪的鉴定D. 淀粉的鉴定
 esgarcot1年前7
esgarcot1年前7 -
 crystalftt 共回答了17个问题
crystalftt 共回答了17个问题 |采纳率94.1%解题思路:生物大分子的检测方法:蛋白质与双缩脲试剂产生紫色反应;淀粉遇碘液变蓝;还原糖与斐林试剂在水浴加热的条件下产生砖红色沉淀;观察DNA和RNA的分布,需要使用甲基绿吡罗红染色,DNA可以被甲基绿染成绿色,RNA可以被吡罗红染成红色,脂肪需要使用苏丹III(苏丹IV)染色,使用酒精洗去浮色以后在显微镜下观察,可以看到橘黄色(红色)的脂肪颗粒.据此分析解答.A、可溶性还原糖的鉴定需要斐林试剂,A错误;
B、蛋白质的鉴定需要双缩脲试剂,B错误;
C、脂肪需要使用苏丹Ⅲ或苏丹Ⅳ染液,C错误;
D、淀粉遇碘变蓝,D正确.
故选:D.点评:
本题考点: 检测还原糖的实验;检测蛋白质的实验.
考点点评: 此题主要考查生物大分子的检测以及实验材料的选择,意在考查学生对基础知识的理解掌握,难度适中.1年前查看全部
- 可溶性铝盐和偏铝酸盐制取Al(OH)3有哪些办法
 体温表1年前1
体温表1年前1 -
 dwlw 共回答了10个问题
dwlw 共回答了10个问题 |采纳率100%氯化铝+少量氢氧化钠
偏铝酸钠+二氧化碳
偏铝酸钠+少量盐酸1年前查看全部
- 在研究硝酸钠的可溶性程度时,观测它在不同温度的水中的溶解度的观测结果下表,求回归方程斜率?
在研究硝酸钠的可溶性程度时,观测它在不同温度的水中的溶解度的观测结果下表,求回归方程斜率?
温度(x)0 10 20 50 70
溶解度(y)66.7 76.0 85.0 112.3 128.0
由此得到的回归直线的斜率是?正确答案是0.8809,连答案都对不上的就不要来咯.而且,不要告诉我按计算器. tuntun2221年前1
tuntun2221年前1 -
 花生苏 共回答了16个问题
花生苏 共回答了16个问题 |采纳率87.5%这个所谓标准答案应该是计算机模拟计算出来的,人工理论上可以算,就是用最小二乘法,但计算复杂没有什么意义,如果是要求自己计算的话可以用作图法或者取两点计算斜率然后取平均的方法,当然会和标准答案有所偏差.如果可以的话用origin等作图软件拟合出来的结果应该是和标准答案一样的1年前查看全部
- 测工业废水中镍的的含量已知在氨溶液中,碘存在条件下,镍与丁二酮肟作用.形成组成比例为1:4的旧红色的可溶性络合物.测定式
测工业废水中镍的的含量
已知在氨溶液中,碘存在条件下,镍与丁二酮肟作用.形成组成比例为1:4的旧红色的可溶性络合物.测定式样(体积为10ml)中镍的含量.其上限为10mg/L下限为0.25mg/L测定时,铁.钴.铜离子是主要干扰物.消除方法是加入适量的Na2_EDTA溶液.利用上述已知条件,设计一个测定工业废水中镍的含量的方案(含条件实验.消除干扰.计算定量) 苏醒的夏天1年前1
苏醒的夏天1年前1 -
 心随我动 共回答了17个问题
心随我动 共回答了17个问题 |采纳率94.1%水质 镍的测定火焰原子吸收分光光度法 GB 11912-89
1 主题内容与适用范围
本标准规定了用火焰原子吸收分光光度法直接测定工业废水中镍.
本标准适用于工业废水及受到污染的环境水样,最低检出浓度为0.05mg/L,校准曲线的浓度范围0.2~5.0mg/L.
2 原理
将试液喷入空气-乙炔贫燃火焰中.在高温下,镍化合物离解为基态原子,其原子蒸气对锐线光源(镍空心阴极灯)发射的特征谱线232.0nm产生选择性吸收.在一定条件下,吸光度与试液中镍的浓度成正比.
3 试剂
本标准所用试剂除另有说明外,均使用符合国家标准或专业标准的分析纯试剂和去离子水或同等纯度的水.
3.1 硝酸(HNO3),=1.42g/mL,优级纯.
3.2 硝酸(HNO3),=1.42g/mL.
3.3 硝酸溶液,1+99:用硝酸(3.1)配制.
3.4 硝酸溶液,1+1:用硝酸(3.2)配制.
3.5 高氯酸(HClO4),=1.54g/mL,优级纯.
3.6 镍标准贮备液:称取光谱纯金属镍1.0000g,准确到0.0001g,加硝酸(3.1)10mL,待完全溶解后,用去离子水稀释至1000mL,每毫升溶液含1.00mg镍.
3.7 标准工作溶液:移取镍贮备液(3.6)10.0mL于100mL容量瓶中,用硝酸溶液(3.4)稀释至标线,摇匀.此溶液中镍的浓度为100mg/L.
4 仪器
4.1 原子吸收分光光度计.
4.2 镍空心阴极灯.
4.3 乙炔钢瓶或乙炔发生器.
4.4 空气压缩机,应备有除水、除油、除尘装置.
4.5 仪器参数:不同型号仪器的最佳测试条件不同,可根据仪器说明书自行选择.
5 样品
5.1 采样前,所用聚乙烯瓶用洗涤剂洗净,再用硝酸(3.4)浸泡24h以上,然后用水冲洗干净.
5.2 若需测定镍总量,样品采集后立即加入硝酸(3.1),使样品pH为1~2.
5.3 测定可滤态镍时,采样后尽快通过0.45m滤膜过滤,并立即按(5.2)酸化.
6 步骤
6.1 试料
测定镍总量时,一般要进行消解处理.取适量水样(使含镍在10~250g)加5mL硝酸(3.1),置于电热板上在近沸状态下将样品蒸发近干.冷却后再加入硝酸(3.1)5mL,重复上述操作一次,必要时再加入硝酸(3.1)或高氯酸,直到消解完全.等蒸至近干,加硝酸(3.3)溶解残渣,若有不溶沉淀应通过定量滤纸过滤至50mL容量瓶中,加硝酸(3.3)至标线,摇匀.
6.2 空白试验
用水代替试料,采用相同的步骤,且与采样和测定中所用的试剂用量相同做空白试验.
6.3 干扰
6.3.1 本标准测镍基体干扰不显著,但当无机盐浓度较高时则产生背景干扰,采用背景校正器校正;在测量浓度许可时,也可采用稀释法.
6.3.2 使用232.0nm作吸收线,存在波长相距很近的镍三线,选用较窄的光谱通带可以克服邻近谱线的光谱干扰.
6.4 校准曲线的绘制
用硝酸溶液(3.3)稀释标准工作溶液(3.7)配制至少5个标准溶液,且试料的浓度应落在0.2~5.0mg/L范围内.按所选择的仪器工作参数调好仪器,用硝酸溶液(3.3)调零后,测量每份溶液的吸光度,绘制校准曲线.
6.5 测量
在测量标准溶液的同时,测量空白和试料.根据扣除空白后试料的吸光度,从校准曲线查出试料中的含量.
注:①测定可滤态镍时,用(5.3)制备的试料直接喷入测定.
②测定镍总量时,一般进行消解前处理,用试料(6.1)进行测定.
7 结果的表示
实验室样品中镍的浓度C(mg/L)按下式计算:
式中:C——实验室样品中镍浓度,mg/L.
m——试料中镍的含量,g.
V——分取水样的体积,mL.
8 精密度和准确度
13个实验室分析含镍1.02mg/L的统一样品,重复性相对标准偏差为1.65%,再现性相对标准偏差为3.29%,回收率在95%~105%之间.
本标准还用于含镍0.07~5.45mg/L的矿山、冶炼、电镀、机械等行业41种废水样品分析,其相对标准偏差为0.2%~10%,加标回收率为92%~109%.1年前查看全部
- 为什么检验可溶性硫酸盐要放稀硝酸酸化?
 90anhoamg1年前1
90anhoamg1年前1 -
 古骨 共回答了18个问题
古骨 共回答了18个问题 |采纳率94.4%那是防止碳酸盐的干扰.因为检验硫酸盐往往用钡盐去检验,而碳酸钡也会沉淀,这样就无法区别了.所以用稀硝酸酸化.那么结果没出现气泡而有沉淀的就是硫酸盐了1年前查看全部
- 让我郁闷了N久的几道化学题.1.某粗盐样品中含有可溶性的氯化镁、氯化钙杂质和不溶性的泥沙.常温下,将140 g该粗盐样品
让我郁闷了N久的几道化学题.
1.某粗盐样品中含有可溶性的氯化镁、氯化钙杂质和不溶性的泥沙.常温下,将140 g该粗盐样品溶解于水中,过滤得到不足3 g泥沙和1000 g溶液.取出500 g溶液进行测定,其中含有镁元素1.2 g,钙元素2 g,氯元素42.6 g.则原粗盐中氯化钠的质量分数约为( )
A.83.6% B.86.3% C.88.1% D.91.6%
2.已知t°C时,氯化钾的溶解度为40g.在该温度下,将20g氯化钾固体加入到50g水中,充分溶解,形成的溶液中溶质的质量分数为( )
A.25% B.28.6% C.33.3% D.50%
我知道答案是什么,
请说明为什么. 拓拔路儿1年前1
拓拔路儿1年前1 -
 爱你很痛 共回答了24个问题
爱你很痛 共回答了24个问题 |采纳率79.2%1.A
500 g溶液中:
镁元素1.2 g来自于 MgCl2.
MgCl2中Mg的质量分数:24/(35.5*2+24) 所以MgCl2质量为4.75g
所以MgCl2中Cl的质量:4.75g-1.2 g=3.55g
钙元素2 g来自于CaCl2
CaCl2中Ca的质量分数:40/(40+35.5*2) 所以 CaCl2质量为5.55g
所以CaCl2中Cl的质量:5.55g-2 g=3.55g
氯元素42.6 g来自于MgCl2,CaCl2,NaCl
NaCl中Cl的质量:42.6 g-3.55g-3.55g=35.5g
所以NaCl的质量为58.5g(方法和前面的一样)
500 g溶液中NaCl的质量为58.5g.1000 g溶液中NaCl的质量为117g
溶液一共140g.质量分数:117/140=83.6%
选A
2.B
氯化钾的溶解度为40g :t°时100g水中可以溶解40gKCl
将20g氯化钾固体加入到50g水中,就恰好可以完全溶解
质量分数:20/(50+20)=28.6%
选B1年前查看全部
- 如果要除去粗盐中含有的可溶性杂质氯化钙,氯化镁及一些硫酸钠,应加入什么试剂?
如果要除去粗盐中含有的可溶性杂质氯化钙,氯化镁及一些硫酸钠,应加入什么试剂?
三种方法
 taxismile1年前1
taxismile1年前1 -
 ll101 共回答了15个问题
ll101 共回答了15个问题 |采纳率86.7%先加过量氯化钡 生成硫酸钡沉淀,除掉硫酸根离子; 再加过量 碳酸钠,生成 钡离子 钙离子 镁离子的硫酸盐沉淀,将它们全都除掉了 ,再加过量盐酸就可以了中和多余的碳酸钠,最后加热 使盐酸挥发掉就可以1年前查看全部
- 一些可溶性盐的重金属(如铜盐、钡盐、汞盐、银盐等)在溶液中与蛋白质作用会使蛋白质发生变性丧失其生理功能,危及生命.由此可
一些可溶性盐的重金属(如铜盐、钡盐、汞盐、银盐等)在溶液中与蛋白质作用会使蛋白质发生变性丧失其生理功能,危及生命.由此可知,可溶性的重金属盐为有毒物质.在医疗上用X射线检查肠胃病时,常让病人服用硫酸钡的悬浊液(俗称钡餐.硫酸钡不溶于水,也不与酸反应),但不能服用碳酸钡,其原因是人体胃液中含有一定的(填物质的化学式)______,与碳酸钡反应后,产生了一定量的使人中毒的______离子.若因氯化钡中毒,甲、乙同学提出了两种不同的解毒方案:甲认为可以饮用硫酸钠溶液来解毒,乙同学认为可以多饮鲜牛奶,你认为谁的方案更好?原因什么?还有其他方案吗?请你补充一个.______.
 小丫呵1年前1
小丫呵1年前1 -
 9030735 共回答了20个问题
9030735 共回答了20个问题 |采纳率80%解题思路:胃酸的成分是盐酸,化学式为:HCl.
重金属盐有毒是因可溶的重金属盐可电离出重金属离子,硫酸钡是难溶于水且难溶于酸的钡盐,因而不能电离出钡离子;而碳酸钡可与胃液中的盐酸反应生成可溶性的氯化钡,能电离出钡离子.
解毒时服用的物质不应对人体有害,或过量时对人体健康有影响.胃酸的成分是盐酸,化学式为:HCl.
由于硫酸钡是难溶于水且难溶于酸的钡盐,因而不能电离出钡离子被人体吸收,不会使人体内的蛋白质变性,而碳酸钡可与胃液中的盐酸反应生成可溶性的氯化钡,能电离出钡离子,易被人体吸收而导致蛋白质变性,引起中毒.
若服用硫酸钠,则会导致人体内钠盐的含量增多,导致疾病发生,富含蛋白质的鲜牛奶、豆浆等是人体需要的营养物质,又含蛋白质,可阻止钡离子破坏人体蛋白质.
故答案为:HCl; 钡;乙,若服用硫酸钠,则会导致人体内钠盐的含量增多,导致疾病发生,富含蛋白质的鲜牛奶、豆浆等是人体需要的营养物质,又含蛋白质,可阻止钡离子破坏人体蛋白质;多次饮鲜豆浆点评:
本题考点: 证明盐酸和可溶性盐酸盐;常见中毒途径及预防方法.
考点点评: 理解重金属盐中毒的原理,掌握复分解反应的条件,以及人体营养元素与营养物质的基本知识,是解决问题的关键.1年前查看全部
- 浴室喷头长时间使用会有白色固体附着,这是因为自来水中含有较多的可溶性的钙、镁化合物,其中碳酸氢钙 Ca(HCO3)2受热
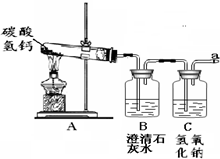 浴室喷头长时间使用会有白色固体附着,这是因为自来水中含有较多的可溶性的钙、镁化合物,其中碳酸氢钙 ca(hco3)2受热易分解,生成难溶性的化合物、气体等物质.某小组探究碳酸氢钙受热分解后产物的成分.
浴室喷头长时间使用会有白色固体附着,这是因为自来水中含有较多的可溶性的钙、镁化合物,其中碳酸氢钙 ca(hco3)2受热易分解,生成难溶性的化合物、气体等物质.某小组探究碳酸氢钙受热分解后产物的成分.
提出猜想:从组成物质元素的角度分析:
猜想1.生成的难溶性化合物可能是______(填化学式).
猜想2.放出的气体可能是o2、h2、co2.
方案设计:请你设计实验,帮助该组同学确定难溶物的成分.
继续探讨:该组同学设计如图实验,继续探究气体的成分.实验步骤 实验现象和结论 取少量难溶物于试管中,______,然后将燃着的木条伸入试管中 若______且木条火焰熄灭,则证明猜想正确
操作1.加热a装置,一段时间后,b装置中的澄清石灰水变浑浊,c装置氢氧化钠溶液的作用是______.
操作2.在a处用燃着的木条检验,无明显现象.
实验结论:
结论:碳酸氢钙分解产生的气体一定有co2;一定没有o2和h2.
实验交流:
交流1.从安全的角度考虑,操作2中存在的实验不足是______.
交流2.小组内某同学对上述结论提出***,认为该实验没有对氧气进行验证,请说出你的观点并阐述理由:______. 尚程茶社1年前1
尚程茶社1年前1 -
 活动如果是 共回答了11个问题
活动如果是 共回答了11个问题 |采纳率81.8%解题思路:根据质量守恒定律,生成的难溶性化合物可能是碳酸钙;由题目给出的信息可知:碳酸钙可以用稀盐酸检验,碳酸钙与盐酸反应生成氯化钙和水和二氧化碳,因此有气泡冒出,并且木条熄灭.该组同学设计如图实验,继续探究气体的成分,C装置氢氧化钠溶液的作用是吸收二氧化碳;从安全的角度考虑,操作2中存在的实验不足是:氢气具有可燃性,点燃气体前没有先验纯;我认为对氧气已经进行验证了,因此不同意此观点;因为氧气具有助燃性,若有氧气产生,实验操作2中的木条燃烧得会更旺.猜想1.根据质量守恒定律,生成的难溶性化合物可能是碳酸钙;故答案为:CaCO3
【方案设计】碳酸钙可以用稀盐酸检验,碳酸钙与盐酸反应生成氯化钙和水和二氧化碳,因此有气泡冒出,并且木条熄灭;故答案为:实验步骤:加入稀盐酸;实验现象和结论:有气泡产生
【继续探究】操作1.该组同学设计如图实验,继续探究气体的成分,C装置氢氧化钠溶液的作用是吸收二氧化碳;故答案为:除去(或吸收)CO2
【实验交流】交流1.从安全的角度考虑,操作2中存在的实验不足是:氢气具有可燃性,点燃气体前没有先验纯;故答案为:点燃气体前没有先验纯
交流2.我认为对氧气已经进行验证了,因此不同意此观点;因为氧气具有助燃性,若有氧气产生,实验操作2中的木条燃烧得会更旺;故答案为:不同意此观点;因为氧气具有助燃性,若有氧气产生,实验操作2中的木条燃烧得会更旺.(答案合理均给分)点评:
本题考点: 实验探究物质的组成成分以及含量;常见气体的检验与除杂方法;质量守恒定律及其应用;氢气、一氧化碳、甲烷等可燃气体的验纯.
考点点评: 有关实验方案的设计和对实验方案的评价是中考的热点之一,设计实验方案时,要注意用最少的药品和最简单的方法;关于对实验设计方案的评价,要在两个方面考虑,一是方案是否可行,能否达到实验目的;二是设计的方法进行比较,那种方法更简便.1年前查看全部
- 粗盐提纯方程式及步骤就是出去其中可溶性的盐的步骤,分别要加什么,为什么加还有加的顺序及原因
 sunny_star881年前1
sunny_star881年前1 -
 我来下电影 共回答了13个问题
我来下电影 共回答了13个问题 |采纳率100%⑴、粗盐中含有较多的可溶性杂质(CaCl2、MgCl2等)和不溶性杂质(泥沙等).可通过什么方法来制取精盐?
除去可溶性杂质,一般是选择一种或几种化学试剂将这些可溶性杂质反应掉,同时不能生成新的杂质.除去不溶性杂质一般通过溶解、过滤、蒸发三个步骤来实现.
⑵、实验前所称量的粗盐不宜过多,否则会出现过剩的现象,影响提纯的质量.溶解时要注意及时搅拌,以使粗盐能够完全溶解到水中.
⑶、过滤时要注意“一贴、两低、三靠”.建议在过滤前先静置一会儿,过滤时先让上层滤液滤过,再将混有泥沙的溶液倒入漏斗中.如果一起倒入会造成滤纸的堵塞,减缓过滤的速度.
步骤:
加入BaCl2,产生白色沉淀,至白色沉淀不再增加时停止,虑出沉淀BaSO4,除去杂质SO42-;
加入Na2CO3,产生白色沉淀,至白色沉淀不再增加时停止,虑出沉淀CaCO3,除去杂质Ca2+;
加入NaOH,产生白色沉淀,至白色沉淀不再增加时停止,虑出沉淀Mg(OH)2,Ba(OH)2;
最后加入HCl至溶液呈中性.1年前查看全部
- 有A、B、C、D四种可溶性离子化合物,它们的阳离子是Ag+、Na+、Mg2+、Cu2+,阴离子是Cl-、OH-、NO3-
有A、B、C、D四种可溶性离子化合物,它们的阳离子是Ag+、Na+、Mg2+、Cu2+,阴离子是Cl-、OH-、NO3-、SO42-(每种离子只能用一次)现将溶液两两混合,记录现象如下:A+B→白色沉淀;2B+D→白色沉淀;C+D→蓝色沉淀则A、B、C、D的化学式分别是______、______、______、______.
 qq1096072111年前2
qq1096072111年前2 -
 jonem 共回答了23个问题
jonem 共回答了23个问题 |采纳率87%解题思路:题设各离子中能组合为白色沉淀的物质有AgCl、Mg(OH)2;又D与其他物质反应产生一种白色沉淀、一种蓝色沉淀,题设各离子中能组合为蓝色沉淀的物质只有Cu(OH)2,这样可以确定D中含OH-,从而确定D为NaOH;再由“B+D→白色沉淀”确定B为MgCl2;由A、B反应情况确定A为AgNO3;由C、D反应情况确定C为CuSO4.题设各离子中能组合为白色沉淀的物质有AgCl、Mg(OH)2;又D与其他物质反应产生一种白色沉淀、一种蓝色沉淀,题设各离子中能组合为蓝色沉淀的物质只有Cu(OH)2,这样可以确定D中含OH-,从而确定D为NaOH;再由“B+D→白色沉淀”确定B为MgCl2;由A、B反应情况确定A为AgNO3;由C、D反应情况确定C为CuSO4.故四种物质分别为AgNO3、MgCl2、CuSO4、NaOH,
故答案为:AgNO3;MgCl2;CuSO4;NaOH.点评:
本题考点: 物质的检验和鉴别的实验方案设计.
考点点评: 本题考查物质的检验和鉴别,为高频考点,把握发生的反应及习题中的信息为解答的关键,侧重分析、推断能力的考查,注意白色沉淀、蓝色沉淀为推断的突破口,题目难度不大.1年前查看全部
- 使用硬水会给生活和生产带来许多麻烦,在日常生活中,我们最常用______方法来降低水的硬度,这个过程主要是将水中的可溶性
使用硬水会给生活和生产带来许多麻烦,在日常生活中,我们最常用______方法来降低水的硬度,这个过程主要是将水中的可溶性钙盐转化为碳酸钙(水垢的主要成分)沉淀的过程.如果想知道得到的水是软水还是硬水,我们可以用______检验.请你写出除去水垢的化学方程式:______.  把鞋底磨穿1年前1
把鞋底磨穿1年前1 -
 42425792 共回答了24个问题
42425792 共回答了24个问题 |采纳率95.8%硬水软化的方法有蒸馏和煮沸;用肥皂水可以鉴别硬水和软水,泡沫多的是软水,泡沫少的是硬水;水垢的主要成分是碳酸钙,属于沉淀不溶于水可以与盐酸反应,所以用盐酸来除水垢,反应物是碳酸钙和盐酸,生成物是氯化钙、水、二氧化碳,二氧化碳后面标上上升符号,用观察法配平即可.
故答案为:煮沸;肥皂水;CaCO 3 +2HCl═CaCl 2 +H 2 O+CO 2 ↑.1年前查看全部
- 已知由海水制得的粗盐中含有的主要成分为氯化钠,还有不溶性泥沙,可溶性氯化钙,氯化镁以及硫酸盐,设计实验提纯氯化纳
 yqbtb8131年前1
yqbtb8131年前1 -
 苗玉 共回答了20个问题
苗玉 共回答了20个问题 |采纳率95%这到题目我读书的的时候化学书上有,建议你仔细看看一下书1年前查看全部
- 家中烧开水的铝壶和盛放开水的暖瓶,使用时间长了易结水垢.因为硬水中含有较多的可溶性的钙、镁化合物,其中碳酸氢钙[Ca(H
家中烧开水的铝壶和盛放开水的暖瓶,使用时间长了易结水垢.因为硬水中含有较多的可溶性的钙、镁化合物,其中碳酸氢钙[Ca(HCO 3 ) 2 ]受热易分解,生成水和大量的气体,还有一种难溶性的化合物,它是水垢的成分之一.
【问题】碳酸氢钙受热分解的另外两种生成物是什么?
【假设】①你认为生成物中的固体可能是______,理由是______.
②小红认为生成物中的气体可能是O 2 ,与你的假设是否一致,说明理由______.
【实验】依据你的假设设计实验方案(注:写清操作步骤、现象、结论)
假设①的方案
假设②的方案
写出假设②方案中涉及的化学方程式______. 酒幕风香1年前1
酒幕风香1年前1 -
 飞子在线 共回答了12个问题
飞子在线 共回答了12个问题 |采纳率91.7%(1)碳酸氢钙[Ca(HCO 3 ) 2 ]受热易分解,生成水和大量的气体,还有一种难溶性的化合物,它是水垢的成分之一.根据质量守恒定律确定该固体是含钙的化合物,又因为该固体是难溶物,所以可能为碳酸钙.故答案为:CaCO 3 ;根据质量守恒定律确定该固体是含钙的化合物,又因为该固体是难溶物,所以可能为碳酸钙.
(2)小红认为生成物中的气体可能是O 2 ,我认为是二氧化碳,因为根据质量守恒定律,反应前后原子的种类和个数不变,若为氧气,反应前后差一个碳原子.故答案为:不一致,气体应为二氧化碳,根据质量守恒定律,反应前后原子的种类和个数不变,若为氧气,反应前后差一个碳原子.
实验:碳酸钙可以用稀盐酸和燃烧的木条检验;二氧化碳可以用澄清的石灰水来检验;二氧化碳和氢氧化钙反应生成碳酸钙白色沉淀和水.故答案为:假设①的方案:取少量难溶物于试管中,加入稀盐酸后,将燃着的木条伸入试管中;若有气泡冒出并且木条火焰熄灭,就证明难溶物是碳酸钙.假设②的方案:将收集的气体通入石灰水中,若石灰水变浑浊,则证明气体为二氧化碳.CO 2 +Ca(OH) 2 =CaCO 3 ↓+H 2 O1年前查看全部
- 在可溶性还原糖、油脂、蛋白质的鉴定实验中,对实验材料的选择叙述错误的是( )
在可溶性还原糖、油脂、蛋白质的鉴定实验中,对实验材料的选择叙述错误的是( )
A.马铃薯块茎中含有较多的糖且近于白色,是进行可溶性还原糖鉴定的理想材料
B.大豆种子蛋白质含量高,是进行蛋白质鉴定的理想植物组织材料
C.花生种子富含油脂且子叶肥厚,是用于油脂鉴定的好材料
D.鸡蛋清含蛋白质多,是进行蛋白质鉴定的动物材料 Google测试员5161年前1
Google测试员5161年前1 -
 babykiller 共回答了9个问题
babykiller 共回答了9个问题 |采纳率88.9%解题思路:生物组织中化合物的鉴定:(1)斐林试剂可用于鉴定还原糖,在水浴加热的条件下,溶液的颜色变化为砖红色(沉淀).斐林试剂只能检验生物组织中还原糖(如葡萄糖、麦芽糖、果糖)存在与否,而不能鉴定非还原性糖(如淀粉).(2)蛋白质可与双缩脲试剂产生紫色反应.(3)脂肪可用苏丹Ⅲ染液(或苏丹Ⅳ染液)鉴定,呈橘黄色(或红色).A、马铃薯块茎中含有较多的糖,是淀粉,属于非还原性糖,因而不是进行可溶性还原糖鉴定的理想材料,A错误;
B、大豆种子蛋白质含量高,是进行蛋白质鉴定的理想植物组织材料,可用双缩脲试剂鉴定,B正确;
C、花生种子富含油脂且子叶肥厚,是用于油脂鉴定的好材料,可用苏丹Ⅲ染液(或苏丹Ⅳ染液)鉴定,C正确;
D、鸡蛋清含蛋白质多,是进行蛋白质鉴定的动物材料,可用双缩脲试剂鉴定,但需要稀释,D正确.
故选:A.点评:
本题考点: 检测还原糖的实验;检测蛋白质的实验;检测脂肪的实验.
考点点评: 本题综合考查鉴定可溶性还原糖、油脂、蛋白质的相关知识,意在考查学生理解所学知识的要点和综合运用所学知识分析问题的能力,具备设计简单生物学实验的能力,并能对实验现象和结果进行解释、分析的能力.1年前查看全部
- 粗食盐中的硫酸钠.氯化镁等可溶性杂质,应用化学方法使其转化为氯化钠.试剂的加入顺序可以是什么?【两种
 超级Q版yy1年前1
超级Q版yy1年前1 -
 水土流失s 共回答了17个问题
水土流失s 共回答了17个问题 |采纳率82.4%先加入过量氢氧化钡,再加入过量碳酸钠,再加入足量的盐酸1年前查看全部
- 可溶性盐与可溶性盐反应
 kenbyrain1年前1
kenbyrain1年前1 -
 yixinxiangfuo 共回答了17个问题
yixinxiangfuo 共回答了17个问题 |采纳率76.5%CuSO4+Ba(OH)2==BaSO4+Cu(OH)2
CuSO4和Ba(OH)2均可溶性盐
BaSO4和Cu(OH)2均为沉淀
溶液中离子反应符合以下规律:(只需符合一条即可(适用于初中和高中基础阶段))
生成物为沉淀(有很多 氯化银,硫酸钡等可查表知)
生成物为气体逸出(如CO2等)
生成物为弱电解质(如H2O NH3•H2O等)1年前查看全部
- 粗盐提纯中除去可溶性杂质是根据什么除去的?比如氯化镁 硫酸钠..急!
 kean2001cn1年前2
kean2001cn1年前2 -
 五子希 共回答了18个问题
五子希 共回答了18个问题 |采纳率88.9%根据物质溶解性.生成溶解性小的物质而除去.
氯化镁——加氢氧化钠,生成氢氧化镁沉淀
硫酸钠——加氯化钡,生成硫酸钡沉淀1年前查看全部
大家在问
- 1可溶性盐与可溶性盐反应
- 2风节迈伦金石斯寿 岺苔结分兰翠相鲜
- 3已知函数f(x)=alnx-bx3在x=1处取得极大值-1
- 4关于论文中参考文献标注的问题,论文中参考文献的序号应该标在哪里?比如说:风和日丽,天气晴朗.这句话是引用某位学者的,那参
- 5已知抛物线顶点在原点,焦点坐标为(-3.0),求其方程
- 6花枝招展 可以用来形容花么?那个啥,大家都晓得这个词可以用来形容女子,那花行不?给个明确点的答案。你们的意思是行老?有确
- 7roll their sleeves up in helping意译怎么翻,SOS!
- 8(-15)减去15 解原式:是不是就直接等于0
- 9第四题看图填空的第一小题
- 10如何区分定语从句与宾语从句?He told me that you were stupid.中的me担当的是什么成分,不
- 11三角形、长方形、五边形卡片共40张,一共有156个角,长方形、五边形卡片张数相同,这3张卡片各多少张?
- 12补全对话:___ ___are you in, May? I'm in Class Two.
- 13有红黄蓝白四种颜色的小棒各8根,放在一个箱子里.
- 14要建造一座过街天桥,甲、乙两队合做15天完成,如甲队做5天,乙队做3天,只能完成全工程的7/30.甲、乙两队单独完成全部
- 15蜀道后期表达了作者怎样的心情