二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。
 spddeb2022-10-04 11:39:541条回答
spddeb2022-10-04 11:39:541条回答| 二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。请回答下列问题: (1)煤的气化过程中产生的有害气体H 2 S用Na 2 CO 3 溶液吸收,生成两种酸式盐,该反应的化学方程式为:______________________________。 (2)利用水煤气合成二甲醚的三步反应如下: ① 2H 2 (g) + CO(g)  CH 3 OH(g);ΔH =-90.8 kJ·mol -1 CH 3 OH(g);ΔH =-90.8 kJ·mol -1 ② 2CH 3 OH(g)  CH 3 OCH 3 (g) + H 2 O(g);ΔH=-23.5 kJ·mol -1 CH 3 OCH 3 (g) + H 2 O(g);ΔH=-23.5 kJ·mol -1 ③ CO(g) + H 2 O(g)  CO 2 (g) + H 2 (g);ΔH=-41.3 kJ·mol -1 CO 2 (g) + H 2 (g);ΔH=-41.3 kJ·mol -1 总反应:3H 2 (g) + 3CO(g) 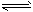 CH 3 OCH 3 (g) + CO 2 (g)的ΔH= ___________;一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是__________(填字母代号)。 CH 3 OCH 3 (g) + CO 2 (g)的ΔH= ___________;一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是__________(填字母代号)。a.压缩体积 b.加入催化剂 c.减少CO 2 的浓度 d.增加CO的浓度 e.分离出二甲醚 (3)已知反应②2CH 3 OH(g)  CH 3 OCH 3 (g) + H 2 O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH 3 OH,反应到某时刻测得各组分的浓度如下: CH 3 OCH 3 (g) + H 2 O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH 3 OH,反应到某时刻测得各组分的浓度如下: |
 |
| ① 比较此时正、逆反应速率的大小:v正 ______ v逆 (填“>”、“<”或“=”)。 ② 温度升高,该反应的平衡常数K ___________(填“增大”、“减小”或“不变”) |

已提交,审核后显示!提交回复
共1条回复
 yw桐 共回答了20个问题
yw桐 共回答了20个问题 |采纳率95%- (1)Na 2 CO 3 +H 2 S==NaHCO 3 +NaHS
(2)-246.4kJ· mol -1 ;a、 c、 e
(3) ① > ;② 减少 - 1年前
相关推荐
- 二甲醚(CH 3 OCH 3 )和甲醇(CH 3 OH)被称为21世纪的新型燃料。以CH 4 和H 2 O为原料制备二甲
二甲醚(CH 3 OCH 3 )和甲醇(CH 3 OH)被称为21世纪的新型燃料。以CH 4 和H 2 O为原料制备二甲醚和甲醇的工业流程如下: 
请填空:
(1)在一定条件下,反应室1中发生反应:CH 4 (g)+H 2 O(g) CO(g)+3H 2 (g); △ H>0。在其它条件不变的情况下降低温度,逆反应速率将 _____ (填“增大”、“减小”或“不变”)。将1.0molCH 4 和2.0molH 2 O通入反应室1(假设容积为10L),1min末有0.1molCO生成,则1min内反应的平均速率 v (H 2 )=______ mol·L -1 ·min -1 。
CO(g)+3H 2 (g); △ H>0。在其它条件不变的情况下降低温度,逆反应速率将 _____ (填“增大”、“减小”或“不变”)。将1.0molCH 4 和2.0molH 2 O通入反应室1(假设容积为10L),1min末有0.1molCO生成,则1min内反应的平均速率 v (H 2 )=______ mol·L -1 ·min -1 。
(2)在一定条件下,已知反应室2的可逆反应除生成二甲醚外还生成了气态水,其化学方程式为________ 。
(3)在压强为0.1MPa条件下,反应室3(容积为2L)中0.2molCO与0.4molH 2 在催化剂作用下反应生成甲醇:CO(g)+2H 2 (g) CH 3 OH(g),CO的平衡转化率与温度、压强的关系如下图所示,则:
CH 3 OH(g),CO的平衡转化率与温度、压强的关系如下图所示,则:
① P 1 _____ P 2 (填“<”、“>”或“=”)。
②在 P 1 压强下,100℃时,反应CO(g)+2H 2 (g)  CH 3 OH(g)的平衡常数 K 的值为 ________ ,若温度不变,再加入1.0molCO后重新达到平衡,则CO的转化率 ______ (填“增大”、“不变”或“减小”),CH 3 OH的体积分数________(填“增大”、“不变”或“减小”)。
CH 3 OH(g)的平衡常数 K 的值为 ________ ,若温度不变,再加入1.0molCO后重新达到平衡,则CO的转化率 ______ (填“增大”、“不变”或“减小”),CH 3 OH的体积分数________(填“增大”、“不变”或“减小”)。
③在其它条件不变的情况下,反应室3再增加0.2molCO与0.4molH 2 ,达到新平衡时,CO的转化率______(填“增大”、“不变”或“减小”), c (CH 3 OH)_________ 0.1mol/L(填“>”、“<”或“ = ”) sk25671年前1
sk25671年前1 -
 dorissong113 共回答了17个问题
dorissong113 共回答了17个问题 |采纳率100%1年前查看全部
- 精制二甲醚是什么和MTBE是一回事儿吗?
 肖之伟1年前0
肖之伟1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 二甲醚(C 2 H 6 O)可由一氧化碳和物质X在一定的条件下制得。反应的化学方程式为 ,则X的化学式为
二甲醚(C 2 H 6 O)可由一氧化碳和物质X在一定的条件下制得。反应的化学方程式为  ,则X的化学式为 [ ]
,则X的化学式为 [ ]A、 C 2 H 5 OH
B、 H 2 O 2
C、 C 2 H 4
D、 H 2 风流宋玉1年前1
风流宋玉1年前1 -
 frankmei2008 共回答了14个问题
frankmei2008 共回答了14个问题 |采纳率92.9%D1年前查看全部
- 下列各组物质中属于同分异构体的是 A.H 2 O和D 2 O B.乙醇(CH 3 CH 2 OH)和二甲醚(CH 3 C
下列各组物质中属于同分异构体的是
A.H 2 O和D 2 O B.乙醇(CH 3 CH 2 OH)和二甲醚(CH 3 CH 2 -O-CH 2 CH 3 ) C. 
D. 
 爱如泉涌泪如冰1年前1
爱如泉涌泪如冰1年前1 -
 gu_sumercool 共回答了27个问题
gu_sumercool 共回答了27个问题 |采纳率100%C
1年前查看全部
- 标况下的二甲醚是液体还是气体
 tast20071年前1
tast20071年前1 -
 tangshu7349 共回答了22个问题
tangshu7349 共回答了22个问题 |采纳率95.5%【密度】相对密度1.617(空气=1)
【熔点(℃)】-138.5)
【沸点(℃)】-24.9
标况是零摄氏度,所以是气体.1年前查看全部
- 二甲醚(CH3OCH3)是一种高效、清洁,具有优良环保性能的新型燃料.工业上制备二甲醚时在催化反应室中(压强2.0~10
 二甲醚(CH3OCH3)是一种高效、清洁,具有优良环保性能的新型燃料.工业上制备二甲醚时在催化反应室中(压强2.0~10.0MPa,温度230~280℃)进行的反应为:
二甲醚(CH3OCH3)是一种高效、清洁,具有优良环保性能的新型燃料.工业上制备二甲醚时在催化反应室中(压强2.0~10.0MPa,温度230~280℃)进行的反应为:
①CO(g)+2H2(g)⇌CH3OH(g)△H1=-90.7kJ•mol-1,
②2CH3OH(g)⇌CH3OCH3(g)+H2O(g)△H2=-23.5kJ•mol-1,
③CO(g)+H2O(g)⇌CO2(g)+H2(g)△H3=-41.2kJ•mol-1,
(1)催化反应室中总反应3CO(g)+3H2(g)⇌CH3OCH3(g)+CO2(g)的△H=______.
(2)在温度和容积不变的条件下发生反应①,能说明该反应达到化学平衡状态的依据是______(多选扣分).
a.容器中压强保持不变;b.混合气体中c(CO)不变;c.v正(CO)=v逆(H2);d.c(CH3OH)=c(CO)
(3)在2L的容器中加入amolCH3OH(g)发生反应②,达到平衡后若再加入amolCH3OH(g)重新达到平衡时,CH3OH的转化率______(填“增大”、“减小”或“不变”).
(4)850℃时在一体积为10L的容器中通入一定量的CO和H2O(g)发生反应③,CO和H2O(g)浓度变化如图所示.
①0~4min的平均反应速率υ(CO)=______.
②若温度不变,向该容器中加入4molCO、2molH2O、3molCO2(g)和3molH2(g),起始时D正______V逆(填“<”、“>”或“=”),请结合必要的计算说明理由Qc=[0.3,mol/L×0,3mol/L/0.4mol/L×0.2mol/L]=[9/8],K=[0.12mol/L×0.12mol/L/0.08mol/L×0.18mol/L]=1,因为Qc>K,平衡左移,V正<V逆Qc=[0.3,mol/L×0,3mol/L/0.4mol/L×0.2mol/L]=[9/8],K=[0.12mol/L×0.12mol/L/0.08mol/L×0.18mol/L]=1,因为Qc>K,平衡左移,V正<V逆. 宁波dd1年前1
宁波dd1年前1 -
 毛毛青子 共回答了23个问题
毛毛青子 共回答了23个问题 |采纳率82.6%解题思路:(1)依据盖斯定律结合热化学方程式计算得到;
(2)化学平衡的标志是正逆反应速率相同,各组分浓度不变,据此分析选项判断;
(3)②反应前后气体体积不变,增大压强平衡不变;
(4)①依据化学反应速率概念结合图象分析计算;
②依据图象分析计算平衡常数,结合浓度商和平衡常数比较分析判断平衡移动方向.(1)①CO(g)+2H2(g)⇌CH3OH(g)△H1=-90.7kJ•mol-1,
②2CH3OH(g)⇌CH3OCH3(g)+H2O(g)△H2=-23.5kJ•mol-1,
③CO(g)+H2O(g)⇌CO2(g)+H2(g)△H3=-41.2kJ•mol-1,
依据盖斯定律①×2+②+③:3CO(g)+3H2(g)⇌CH3OCH3(g)+CO2(g)的△H=-246.1KJ/mol;
故答案为:3CO(g)+3H2(g)⇌CH3OCH3(g)+CO2(g)的△H=-246.1KJ/mol;
(2)CO(g)+2H2(g)⇌CH3OH(g),反应是气体体积减小的放热反应;
a.反应前后气体体积变化,容器中压强保持不变,证明反应达到平衡,故a正确;
b.平衡状态的标志是物质浓度 保持不变,混合气体中c(CO)不变说明反应达到平衡,故b正确;
c.依据化学方程式反应达到平衡时2v正(CO)=v逆(H2)证明反应达到平衡,故C错误;
d.反应过程中c(CH3OH)=c(CO)说明剩余一氧化碳和生成甲醇浓度相同,但不能证明正逆反应速率相同,故d错误;
故答案为:ab;
(3)在2L的容器中加入amolCH3OH(g)发生反应②,反应前后气体体积不变,达到平衡后若再加入amolCH3OH(g)相当于增大压强,平衡不变,CH3OH的转化率不变
故答案为:不变;
(4)①图象分析平衡后一氧化碳浓度变化为0.2mol/L-0.08mol/L=0.12mol/L;V(CO)=[0.12mol/L/4min]=0.03mol/L•min;
故答案为:0.03mol/L•min;
②若温度不变,向该容器中加入4molCO、2molH2O、3molCO2(g)和3molH2(g),Qc=[0.3,mol/L×0,3mol/L/0.4mol/L×0.2mol/L]=[9/8],K=[0.12mol/L×0.12mol/L/0.08mol/L×0.18mol/L]=1
因为Qc>K,平衡左移,V正<V逆
故答案为:<;因为Qc>K,平衡左移,所以V正<V逆.点评:
本题考点: 用盖斯定律进行有关反应热的计算;化学平衡的影响因素;化学平衡状态的判断;化学平衡的计算.
考点点评: 本题考查了热化学方程式和盖斯定律的计算应用,化学平衡影响因素的分析判断,平衡常数的计算应用,题目难度中等.1年前查看全部
- 二甲醚(CH3OCH3)被称为本世纪的新型燃料,它清洁、高效,具有优良的环保性能.以CH4和H2O为原料制备二甲醚的工业
二甲醚(CH3OCH3)被称为本世纪的新型燃料,它清洁、高效,具有优良的环保性能.以CH4和H2O为原料制备二甲醚的工业流程如图:

请回答下列问题:
(1)新型燃料二甲醚(CH3OCH3)中碳元素的化合价为______.
(2)一定条件下,反应室1中发生的反应为CH4+H2O
CO+3H2,在其它条件不变的情况下升高温度,则该反应将______ (填“加快”、“减慢”或“不变”).催化剂 .△
(3)在催化剂、加热的条件下,反应室2中生成了二甲醚(CH3OCH3) 和水,则该反应的化学方程式是2CO+4H2
CH3OCH3+H2OMnO2 .△ 2CO+4H2.
CH3OCH3+H2OMnO2 .△  175797899q1年前1
175797899q1年前1 -
 康撒A不MUSIC 共回答了23个问题
康撒A不MUSIC 共回答了23个问题 |采纳率82.6%解题思路:(1)根据化合物中正负化合价代数和为零进行分析;
(2)根据温度与分子运动速度的关系进行分析;
(3)根据一氧化碳和氢气在催化剂、加热的条件下生成二甲醚和水进行分析.(1)在CH3OCH3中,
设碳元素的化合价为x则:
x+(+1)×3+(-2)+x+(+1)×3=0
解得x=-2;
(2)升高温度分子运动速度快,反应物接触的几率大,反应速度就快;
(3)一氧化碳和氢气在催化剂、加热的条件下生成二甲醚和水,化学方程式为:2CO+4H2
MnO2
.
△CH3OCH3+H2O.
故答案为:(1)-2;
(2)加快;
(3)2CO+4H2
催化剂
.
△CH3OCH3+H2O.点评:
本题考点: 物质的相互转化和制备;有关元素化合价的计算;书写化学方程式、文字表达式、电离方程式.
考点点评: 解答本题关键是要知道化合价的求法,反应速度的影响因素,知道方程式书写时的注意事项.1年前查看全部
- Ⅰ:利用水煤气合成二甲醚的三步反应如下:
Ⅰ:利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)⇌CH3OH(g);△H=-90.8kJ•mol-1
②2CH3OH(g)⇌CH3OCH3(g)+H2O(g);△H=-23.5kJ•mol-1
③CO(g)+H2O (g)⇌CO2(g)+H2(g);△H=-41.3kJ•mol-1
总反应:3H2(g)+3CO(g)⇌CH3OCH3(g)+CO2(g)的△H=______:
Ⅱ:如图甲、乙是电化学实验装置. (1)若甲、乙两烧杯中均盛有饱和NaCI溶液.
(1)若甲、乙两烧杯中均盛有饱和NaCI溶液.
①甲中石墨棒上的电极反应式______,电子的移动方向为______;
②乙中总反应的离子方程式为2Cl-+2H2O
2OH-+H2↑+Cl2↑电解 .2Cl-+2H2O,Cl-移向______电极(填Fe或C);
2OH-+H2↑+Cl2↑电解 .
(2)若甲、乙两烧杯中均盛有CuSO4溶液.
①甲中铁棒上的电极反应式为:______;
②如果起始时乙中盛有200mL pH=5的CuSO4溶液(25℃),一段时间后溶液的pH变为1,若要使溶液恢复到电解前的状态,可向溶液中加入______(填写物质的化学式)______g. derne1年前1
derne1年前1 -
 yatou8700 共回答了9个问题
yatou8700 共回答了9个问题 |采纳率88.9%解题思路:I:根据盖斯定律,观察目标方程式可知,①×2+②+③,即得到3H2(g)+3CO(g)⇌CH3OCH3(g)+CO2 (g),故△H=2△H1+△H2+△H3=-246.4kJ•mol-1;
II:(1)①根据装置可知甲是原电池,乙是电解池.由于氯化钠溶液显中性,所以发生吸氧腐蚀,石墨是正极,氧气得到电子,方程式为O2+2H2O+4e-=4OH-,电子由负极出正极入,所以电子由铁经导线移向石墨;
②根据乙中电子流向可知,石墨和电源的正极相连,作阳极,溶液中的氯离子放电.铁和电源的负极相连,作阴极,溶液中的氢离子放电.所以总反应式为2Cl-+2H2O
2OH-+H2↑+Cl2↑,阴离子向阳极移动,所以向石墨极移动;电解 .
(2)①铁是活泼的金属,作负极失电子发生氧化反应;
②乙中阳极是OH-放电,生成氧气.阴极是铜离子放电,生成铜,总反应式为:2CuSO4+2H2O
2H2SO4+2Cu+O2↑.反应中生成氢离子的物质的量是0.2L×0.1mol/L=0.02mol,所以根据方程式可知生成铜是0.1mol,因此要使溶液恢复到电解前的状态,可向溶液中加入0.01mol氧化铜或0.01mol碳酸铜,其质量是分别为0.8g、1.24g.电解 .Ⅰ:①2H2(g)+CO(g)⇌CH3OH(g);△H=-90.8kJ•mol-1
②2CH3OH(g)⇌CH3OCH3(g)+H2O(g);△H=-23.5kJ•mol-1
③CO(g)+H2O (g)⇌CO2(g)+H2(g);△H=-41.3kJ•mol-1
依据盖斯定律计算,①×2+②+③,得到总反应的热化学方程式:3H2(g)+3CO(g)⇌CH3OCH3(g)+CO2(g)△H=-246.4kJ/mol;
故答案为:-246.4kJ/mol;
II:(1)①根据装置可知甲是原电池,乙是电解池.由于氯化钠溶液显中性,所以发生吸氧腐蚀,石墨是正极,氧气得到电子,电极反应为:O2+2H2O+4e-=4OH-,电子由负极出正极入,所以电子由铁经导线移向石墨;
故答案为:O2+2H2O+4e-=4OH-;经导线移向石墨;
②根据乙中电子流向可知,石墨和电源的正极相连,作阳极,溶液中的氯离子放电.铁和电源的负极相连,作阴极,溶液中的氢离子放电.所以总反应式为:2Cl-+2H2O
电解
.
2OH-+H2↑+Cl2↑,阴离子向阳极移动,所以向C极移动,
故答案为:2Cl-+2H2O
电解
.
2OH-+H2↑+Cl2↑;C;
(2)①铁是活泼的金属,作负极,所以电极反应式为:Fe-2e-=Fe2+;
故答案为:Fe-2e-=Fe2+;
②乙中阳极是OH-放电,生成氧气.阴极是铜离子放电,生成铜,总反应式为2CuSO4+2H2O
电解
.
2H2SO4+2Cu+O2↑.反应中生成氢离子的物质的量是0.2L×0.1mol/L=0.02mol,所以根据方程式可知生成铜是0.1mol,因此要使溶液恢复到电解前的状态,可向溶液中加入0.01mol氧化铜或0.01mol碳酸铜,其质量是分别为:0.01mol×80g/mol=0.8g、0.01mol×124g/mol=1.24g,
故答案为:CuO或CuCO3;0.8或1.24.点评:
本题考点: 用盖斯定律进行有关反应热的计算;原电池和电解池的工作原理.
考点点评: 本题考查了盖斯定律和热化学方程式的计算应用,原电池电解池的原理分析判断,在守恒计算分析应用,掌握基础是关键,题目难度中等.1年前查看全部
- 一公斤二甲醚等于多少立方米液化气.
 龙之随心1年前2
龙之随心1年前2 -
 话大 共回答了17个问题
话大 共回答了17个问题 |采纳率82.4%你问的不严谨,体积?热值?耗痒量?不同参数等值也不同!1年前查看全部
- 我国首台使用二甲醚为燃料的城市客车有效地解决了公交车冒黑烟的问题.
我国首台使用二甲醚为燃料的城市客车有效地解决了公交车冒黑烟的问题.
(1)已知二甲醚的化学式为C2H6O,二甲醚的相对分子质量是______,其中碳、氢元素的质量比为______.
(2)二甲醚在空气中完全燃烧生成二氧化碳和水,请计算完全燃烧92g二甲醚需要氧气多少克? 蓝水木1年前1
蓝水木1年前1 -
 网中鱼格格 共回答了17个问题
网中鱼格格 共回答了17个问题 |采纳率88.2%解题思路:(1)化合物的相对分子质量就等于各原子的相对原子质量的总和,各元素的质量比就等于各原子的相对原子质量之和的比;
(2)根据质量守恒定律,已知二甲醚的质量求出需要氧气的质量.(1)二甲醚的相对分子质量为:12×2+1×6+16=46;碳、氢元素的质量比=(12×2):(1×6)=4:1;
(2)设完全燃烧92g二甲醚需要氧气的质量为x
C2H6O+3O2
点燃
.
2CO2+3H2O
4696
92gx
[46/92g=
96
x]
x=192g
答:完全燃烧92g二甲醚需要氧气的质量为192g.
故答案为:(1)46、4:1;(2)192g.点评:
本题考点: 相对分子质量的概念及其计算;元素质量比的计算;根据化学反应方程式的计算.
考点点评: 本题主要考查学生运用化学式以及利用化学方程式进行计算的能力.注重基础知识的掌握.1年前查看全部
- 如何写制备二甲醚催化剂的综述
 ywb674201年前1
ywb674201年前1 -
 天马行空百宝囊 共回答了12个问题
天马行空百宝囊 共回答了12个问题 |采纳率91.7%二甲醚制备主要有3种
1.甲醇脱水法,催化剂一般为硫酸
2.合成气一步法制备二甲醚,催化剂一般为甲醇合成及脱水的复合催化体系
3.CO2加氢法,这种方法刚刚受到关注,还处于探索阶段,主要催化剂为Cu系催化剂,典型的有Cu-Zn,Cu-Mn等
总体框架就是这样的1年前查看全部
- 二甲醚(C2H6O)是不是氧化物?如果不是怎么样的化学式表示的物质是氧化物?
二甲醚(C2H6O)是不是氧化物?如果不是怎么样的化学式表示的物质是氧化物?
如题,刚要上初二,化学新人预习基本不懂…… gregli1年前1
gregli1年前1 -
 真诚ss 共回答了13个问题
真诚ss 共回答了13个问题 |采纳率100%二甲醚不是氧化物
氧化物指的是氧与另外一种元素形成的化合物,如果除了氧以外的元素超过一种,就不叫氧化物了~
1年前查看全部
- 二甲醚(CH3OCH3)燃料电池正极的电极反应为:
 从不言妥协1年前1
从不言妥协1年前1 -
 bushtod 共回答了18个问题
bushtod 共回答了18个问题 |采纳率88.9%负极:CH3OCH3+3H2O→2CO2+12e-+12H+正极:3O2+12e-+12H+→6H2O
总反应式为 CH3OCH3+3O2→2CO2+3H2O
好像是这样的吧,记不太清了1年前查看全部
- 二甲醚(CH 3 OCH 3 )被称为21世纪的新型燃料,它清洁、高效,具备优良的环保性能.利用天然气可以生产二甲醚.
二甲醚(CH 3 OCH 3 )被称为21世纪的新型燃料,它清洁、高效,具备优良的环保性能.利用天然气可以生产二甲醚. 请填写下列空白:
(1)与二甲醚具有相同分子式的有机化合物是: _________ (填字母编号).
A、CH 3 COOH B、CH 3 OH C、CH 4 D、C 2 H 5 OH
(2)二四醚在空气中完全燃烧生成二氧化碳和水,其反应的化学方程式是: _____________
(3)二甲醚可由合成气(CO与H 2 的混合物)在一定条件下制得.用合成气制二四醚时,还产生了一种可参与大气循环的无机化合物,该反应的化学方程式可能是: _______________
(4)制备二四醚的合成气可由甲烷与水蒸气或二氧化碳经高温催化反应制得.合成气除制二甲醚外,还可用于冶炼金属,用它冶炼铁的生产过程示意图如图所示:
在上图炼铁的还原反应室中,合成气中的两种气体都能与Fe 2 O 3 反应生成铁单质,其中不属于四种基本反应类型的化学方程式为 __________________ .  wuwukong1年前1
wuwukong1年前1 -
 迁徙的鸟long 共回答了14个问题
迁徙的鸟long 共回答了14个问题 |采纳率100%1年前查看全部
- 二甲醚(C2H6O)具有清洁无污染的特点,将有望成为一种全新的替代能源.下列说法错误的是( )
二甲醚(C2H6O)具有清洁无污染的特点,将有望成为一种全新的替代能源.下列说法错误的是( )
A.二甲醚属于有机化合物
B.二甲醚的相对分子质量为46
C.2.3g二甲醚中含碳元素1.2g
D.二甲醚中碳、氢元素的质量比为1:3 Yun_Ni1年前1
Yun_Ni1年前1 -
 weeew1 共回答了18个问题
weeew1 共回答了18个问题 |采纳率83.3%解题思路:A、含有碳元素的化合物叫有机化合物,简称有机物;B、根据相对分子质量为组成分子的各原子的相对原子质量之和,进行分析判断;C、根据一定质量物质中某一元素质量的计算方法考虑;D、根据化合物中各元素质量=各原子的相对原子质量×原子个数,进行分析解答.A、二甲醚中含有碳元素,属于有机物,故A说法正确;B、二甲醚(C2H6O)的相对分子质量为12×2+1×6+16=46,故B说法正确;C、2.3g二甲醚中含碳元素质量为:2.3g×2446×100%=1.2g,故C说法正确;D、二甲醚中碳、氢元...
点评:
本题考点: 有机物与无机物的区别;相对分子质量的概念及其计算;元素质量比的计算;化合物中某元素的质量计算.
考点点评: 本题难度不大,考查同学们结合新信息、灵活运用化学式的含义与有关计算进行分析问题、解决问题的能力.1年前查看全部
- (2014•宁波二模)二甲醚(DME)被誉为“21世纪的清洁燃料”.由合成气制备二甲醚的主要原理如下:
(2014•宁波二模)二甲醚(DME)被誉为“21世纪的清洁燃料”.由合成气制备二甲醚的主要原理如下:
反应Ⅰ:CO(g)+2H2(g)⇌CH3OH(g)△H1
反应Ⅱ:2CH3OH(g)⇌CH3OCH3(g)+H2O(g)△H2
反应Ⅲ:2CO(g)+4H2(g)⇌CH3OCH3(g)+H2O(g)△H3
相关反应在不同温度时的平衡常数及其大小关系如下表所示
回答下列问题:温度/K 反应I 反应Ⅱ 已知:
K1>K2>K1′>K2′298 K1 K2 328 K1′ K2′
(1)反应Ⅰ的△S______0(填“>”或“<”);反应Ⅱ的平衡常数表达式为K=[CH3OCH3][H2O] [CH3OH] K=,反应Ⅲ是______反应(填“吸热”或“放热”).[CH3OCH3][H2O] [CH3OH]
(2)在合成过程中,因为有CO(g)+H2O(g)⇌CO2(g)+H2(g)反应发生,所以能提高CH3OCH3的产率,原因是______.
(3)如图1两条曲线分别表示反应I(按物质的量比:n(CO):n(H2)=1:2)中压强为0.1MPa和5.0MPa下CO转化率随温度的变化关系,计算压强为0.1MPa、温度为200℃时,平衡混合气中甲醇的物质的量分数
是______.
(4)反应Ⅲ逆反应速率与时间的关系如图2所示:
①试判断t2时改变的条件是______或______.
②若t4扩大容器体积,t5达到平衡,t6时增大反应物浓度,请在上图中画出t4-t6的变化曲线. neorion1年前1
neorion1年前1 -
 水月果儿 共回答了14个问题
水月果儿 共回答了14个问题 |采纳率92.9%解题思路:(1)根据反应中气体的体积减小可判断反应的焓变;平衡常数为生成物的浓度幂之积除以反应物的浓度幂之积;从图中数据可知温度升高反应ⅠⅡ的平衡常数均减小,所以反应ⅠⅡ均是放热反应,△H1、△H2小于0,利用盖斯定律Ⅰ×2+Ⅱ得反应Ⅲ,根据,△H1、△H2判断△H3的正负,确定反应Ⅲ的热效应;
(2)依据化学平衡移动的原理:减小生成物浓度平衡向正方向移动,增大反应物浓度平衡向正方向移动,分析解答;
(3)增大压强,平衡向正反应方向移动,结合图象,判断A、B两条曲线对应的压强,然后利用三段式法解答该题;
(4)①该反应是一个反应前后气体体积减小的且是正反应是放热的化学反应,t2时逆反应速率增大,且平衡时反应速率大于t2时反应速率,平衡向逆反应方向移动;
②t4时降压,逆反应速率减小,平衡逆向移动,随着反应的进行,逆反应速率减小,在t5时达到新的平衡状态,t6时增大反应物的浓度,t6点逆反应速率不变,平衡向正反应方向移动,随着反应的进行,逆反应速率增大,大于原平衡浓度.(1)CO(g)+2H2(g)⇌CH3OH(g)是一个气体体积减小的反应,所以熵值减小,△S<0;
依据方程式2CH3OH(g)⇌CH3OCH3(g)+H2O(g)可知K=
[CH3OCH3][H2O]
[CH3OH];
从图中数据可知温度升高反应ⅠⅡ的平衡常数均减小,所以反应ⅠⅡ均是放热反应,△H1、△H2都小于0,利用盖斯定律Ⅰ×2+Ⅱ得反应Ⅲ,则△H3=2×△H1+△H2,△H1、△H2都小于0,所以△H3=2×△H1+△H2<0,故反应Ⅲ是放热反应;
故答案为:<;K=
[CH3OCH3][H2O]
[CH3OH];放热;
(2)依据化学平衡移动原理:减小生成物浓度平衡向正方向移动,增大反应物浓度平衡向正方向移动,在CO(g)+H2O(g)⇌CO2(g)+H2(g)中反应消耗了H2O(g)有利于反应II、III正向移动;同时此反应生成了H2,有利于反应I、III正向移动;
故答案为:此反应消耗了H2O(g)有利于反应II、III正向移动;同时此反应生成了H2,有利于反应I、III正向移动;
(3)从方程式可知,反应物有3mol气体,生成物有2mol气体,所以压强增大时平衡气体体积减小的方向移动,即正向移动,在200℃时,转化率高的压强大,故A曲线对应压强为5.0MPa,曲线对应压强为0.1MPa,从图中可知压强为0.1MPa、温度为200℃时CO的转化率为0.5,设加入COamol,则有H22amol
CO(g)+2H2(g)⇌CH3OH(g).
反应前(mol) a 2a 0
反应了(mol) 0.5a a 0.5a
平衡时(mol) 0.5a a 0.5a
可求得[0.5a/0.5a+a+0.5a]×100%=25%
故答案为:25%;
(4)①该反应是一个反应前后气体体积减小的且是正反应是放热的化学反应,t2时逆反应速率增大,且平衡时反应速率大于t2时反应速率,平衡向逆反应方向移动,改变的条件为增大生成物C浓度或升高温度;
故答案为:增大生成物C浓度或升高温度;
②t4时降压,逆反应速率减小,平衡逆向移动,随着反应的进行,逆反应速率减小,在t5时达到新的平衡状态,t6时增大反应物的浓度,t6点逆反应速率不变,平衡向正反应方向移动,随着反应的进行,逆反应速率增大,大于原平衡浓度,所以其图象为: ,
,
故答案为: .
.点评:
本题考点: 反应热和焓变;化学平衡建立的过程;化学平衡的影响因素;物质的量或浓度随时间的变化曲线.
考点点评: 本题考查了熵变焓变的判断、化学平衡常数表达式的书写、外界条件对反应速率的影响等知识点,看清图象表达的含义是解题的关键所以,题目难度中等.1年前查看全部
- 二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。
二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。 请回答下列问题:
(1)煤的气化的主要化学反应方程式为:____________。
(2)煤的气化过程中产生的有害气体H 2 S用Na 2 CO 3 溶液吸收,生成两种酸式盐, 该反应的化学方程式为:____________________。
(3)利用水煤气合成二甲醚的三步反应如下: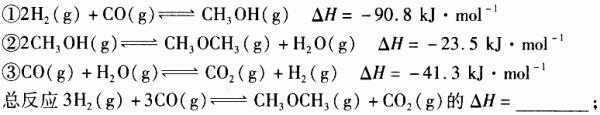
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是____(填字母代号)。
a.高温高压
b.加入催化剂
c.减少CO 2 的浓度
d.增加CO的浓度
e.分离出二甲醚
(4)已知反应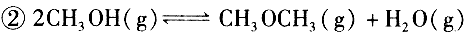 某温度下的平衡常数为400。此温度下,在密闭容器中加入CH 3 OH,反应到某时刻测得各组分的浓度如下:
某温度下的平衡常数为400。此温度下,在密闭容器中加入CH 3 OH,反应到某时刻测得各组分的浓度如下: 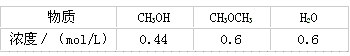
①比较此时正、逆反应速率的大小:v 正 ____v 逆 (填“>”、“<”或“=”)。
②若加入CH 3 OH后,经10 min反应达到平衡,此时c(CH 3 OH)=_________;该时间内反应速率v( CH 3 OH)=___________。 liuerguang1年前1
liuerguang1年前1 -
 朱晓琳 共回答了16个问题
朱晓琳 共回答了16个问题 |采纳率87.5%1年前查看全部
- 乙醇(CH3CH2OH)和二甲醚(CH3-O-CH3)互为( )
乙醇(CH3CH2OH)和二甲醚(CH3-O-CH3)互为( )
A.位置异构体
B.官能团异构体
C.同系物
D.碳链异构体 心晴冷月1年前1
心晴冷月1年前1 -
 tzlyg 共回答了17个问题
tzlyg 共回答了17个问题 |采纳率88.2%解题思路:A.组成相同而分子中的取代基或官能团(包括碳碳双键和三键)在碳架(碳链或碳环)上的位置不同,这些化合物叫位置异构体;
B.官能团异构又叫异类异构,又称功能团异构.分子式相同,但构成分子的官能团不同;
C.结构相似,分子组成上相差1个或者若干个CH2基团的化合物互称为同系物;
D.碳链异构,是指化合物分子中的碳原子骨架连接方式不同,构成不同的碳链或碳环,一般用于形容碳氢化合物.乙醇(CH3CH2OH)和二甲醚(CH3-O-CH3)分子式相同,结构不同,互为同分异构体,二者官能团不同,属于官能团异构.
故选:B.点评:
本题考点: 同分异构现象和同分异构体.
考点点评: 本题考查同分异构现象,题目难度不大,注意同分异构体的种类.1年前查看全部
- 二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上利用H 2 和CO 2 合成二甲醚的反应
二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上利用H 2 和CO 2 合成二甲醚的反应如下:6H 2 (g)+2CO 2 (g)⇌CH 3 OCH 3 (g)+3H 2 O(g)
已知该反应平衡常数(K)与温度(T)的关系如图所示.
(1)一定温度下,在一个固定体积的密闭容器中进行该反应.下列能判断反应达到化学平衡状态的是______(选填编号).
a.c(H 2 )与c(H 2 O)的比值保持不变 b.单位时间内有2mol H 2 消耗时有1mol H 2 O生成
c.容器中气体密度不再改变 d.容器中气体压强不再改变
(2)温度升高,该化学平衡移动后到达新的平衡,CH 3 OCH 3 的产率将______(填“变大”、“变小”或“不变”,下同),混合气体的平均式量将______.
(3)一定温度和压强下,往体积为20L的容器中通入一定物质的量的H 2 与CO 2 ,达到平衡时,容器中含有0.1mol二甲醚.计算H 2 的平均反应速率:______(用字母表示所缺少的物理量并指明其含义).
(4)工业上为提高CO 2 的转化率,采取方法可以是______(选填编号).
a.使用高效催化剂 b.增大体系压强
c.及时除去生成的H 2 O d.增加原料气中CO 2 的比例.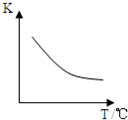
 枫之冥想1年前1
枫之冥想1年前1 -
 fhqypm126 共回答了18个问题
fhqypm126 共回答了18个问题 |采纳率83.3%(1)a.c(H 2 )与c(H 2 O)的比值保持不变时,说明该反应达到平衡状态,故正确;
b.无论反应是否达到平衡状态,单位时间内有2mol H 2 消耗时有1mol H 2 O生成,所以不能说明该反应达到平衡状态,故错误;
c.混合物的质量不变,容器的体积不变,所以无论反应是否达到平衡状态,容器中气体密度始终不变,故错误;
d.该反应是一个反应前后气体体积减小的可逆反应,当容器中气体压强不再改变时,该反应达到平衡状态,故正确;
故选ad;
(2)根据温度和K之间的关系图知,当升高温度时,K减小,说明该反应向逆反应方向移动,则二甲醚产率减小,平衡向逆反应方向移动,则气体的物质的量增大,质量不变,则其平均摩尔质量减小,所以其平均式量减小,故答案为:变小;变小;
(3)根据v=
△c
△t 知,二甲醚的平均反应速率=
0.1mol
20L
t =
0.005
t mol/(L.s) ,根据二甲醚和氢气的关系式知,氢气的平均反应速率═
0.005
t mol/(L.s) ×6=
0.03
t mol/(L.s),t-达到平衡所需的时间(单位:s,可自定),
故答案为:
0.03
t mol/(L.s),t-达到平衡所需的时间(单位:s,可自定);
(4)a.使用高效催化剂只改变反应速率不影响化学平衡移动,故错误;
b.该反应是一个反应前后气体体积减小的可逆反应,增大体系压强平衡向正反应方向移动,所以能提高二氧化碳的转化率,故正确;
c.及时除去生成的H 2 O,平衡向正反应方向移动,所以能提高二氧化碳的转化率,故正确;
d.增加原料气中CO 2 的比例,平衡向正反应方向移动,但二氧化碳的转化率减小,故错误;
故选bc.1年前查看全部
- 二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。
二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。请回答下列问题:
(1)煤的气化的主要化学反应方程式为:___________________________。
(2)煤的气化过程中产生的有害气体H 2 S用Na 2 CO 3 溶液吸收,生成两种酸式盐,该反应的化学方程式为:________________________________________。
(3)利用水煤气合成二甲醚的三步反应如下:
① 2H 2 (g) + CO(g) CH 3 OH(g);ΔH =-90.8 kJ·mol -1
CH 3 OH(g);ΔH =-90.8 kJ·mol -1
② 2CH 3 OH(g) CH 3 OCH 3 (g) + H 2 O(g);ΔH=-23.5 kJ·mol -1
CH 3 OCH 3 (g) + H 2 O(g);ΔH=-23.5 kJ·mol -1
③ CO(g) + H 2 O(g) CO 2 (g) + H 2 (g);ΔH=-41.3 kJ·mol -1
CO 2 (g) + H 2 (g);ΔH=-41.3 kJ·mol -1
总反应:3H 2 (g) + 3CO(g) CH 3 OCH 3 (g) + CO 2 (g)的ΔH= ___________;一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是__________(填字母代号)。
CH 3 OCH 3 (g) + CO 2 (g)的ΔH= ___________;一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是__________(填字母代号)。
a.高温高压 b.加入催化剂 c.减少CO 2 的浓度 d.增加CO的浓度 e.分离出二甲醚
(4)已知反应②2CH 3 OH(g) CH 3 OCH 3 (g) + H 2 O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH 3 OH ,反应到某时刻测得各组分的浓度如下
CH 3 OCH 3 (g) + H 2 O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH 3 OH ,反应到某时刻测得各组分的浓度如下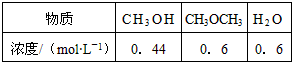
① 比较此时正、逆反应速率的大小:v 正 ______ v 逆 (填“>”、“<”或“=”)。
② 若加入CH 3 OH后,经10 min反应达到平衡,此时c(CH 3 OH) = _________;该时间内反应速率
v(CH 3 OH) = __________。 lizhili20051年前1
lizhili20051年前1 -
 毛雨枫 共回答了19个问题
毛雨枫 共回答了19个问题 |采纳率100%1年前查看全部
- 二甲醚和乙醇是同分异构体,其鉴别可采用化学方法及物理方法,下列鉴别方法中不能对二者进行鉴别的是( ) A.利用金属钠或
二甲醚和乙醇是同分异构体,其鉴别可采用化学方法及物理方法,下列鉴别方法中不能对二者进行鉴别的是( ) A.利用金属钠或金属钾 B.利用燃烧法 C.利用红外光谱法 D.利用核磁共振氢谱  jianglihui06151年前1
jianglihui06151年前1 -
 梦中千紫鹤 共回答了23个问题
梦中千紫鹤 共回答了23个问题 |采纳率91.3%A.乙醇中含有-OH,可与金属钠或金属钾反应生成氢气,可鉴别,故A正确;
B.由于分子式相同,燃烧产物相同,不能鉴别,故B错误;
C.二甲醚和乙醇中分别含有-O-和-OH,官能团不同,可用红外光谱法鉴别,故C正确;
D.二者含有的H原子的种类和性质不同,可用核磁共振氢谱鉴别,故D正确.
故选B.1年前查看全部
- 二甲醚(C2H6O)是一种清洁燃料,能替代柴油作车用能源,具有广阔的市场前景.下列有关二甲醚的说法错误的是( )
二甲醚(C2H6O)是一种清洁燃料,能替代柴油作车用能源,具有广阔的市场前景.下列有关二甲醚的说法错误的是( )
A.相对分子质量为46g
B.由C、H、O三种元素组成
C.碳元素的质量分数最大
D.碳、氢、氧原子个数比为2:6:1 九月飞雨1年前1
九月飞雨1年前1 -
 29路公交 共回答了13个问题
29路公交 共回答了13个问题 |采纳率76.9%解题思路:A、相对分子质量单位是“1”,不是“克”,常常省略不写.
B、根据二甲醚化学式的含义进行分析判断.
C、根据化合物中元素的质量分数=[相对原子质量×原子个数/相对分子质量]×100%,进行分析判断.
D、根据二甲醚分子的构成进行分析判断.A、相对分子质量单位是“1”,不是“克”,常常省略不写,故选项说法错误.
B、二甲醚是由C、H、O三种元素组成的,故选项说法正确.
C、二甲醚中碳原子的相对原子质量之和为12×2=24,氢原子的相对原子质量之和为1×6=6,氧原子的相对原子质量之和为16,碳元素的相对原子质量之和最大,则碳元素的质量分数最高,故选项说法正确.
D、1个二甲醚分子是由2个碳原子、6个氢原子和1个氧原子构成的,则碳、氢、氧原子个数比为2:6:1,故选项说法正确.
故选A.点评:
本题考点: 化学式的书写及意义;相对分子质量的概念及其计算;元素的质量分数计算.
考点点评: 本题难度不大,考查同学们结合新信息、灵活运用化学式的含义与有关计算进行分析问题、解决问题的能力.1年前查看全部
- 二甲醚(CH 3 OCH 3 )是一种清洁燃料,能替代柴油作车用能源,具有广阔的市场前景.请回答下列问题:
二甲醚(CH 3 OCH 3 )是一种清洁燃料,能替代柴油作车用能源,具有广阔的市场前景.请回答下列问题:
(1)二甲醚属于 (填“酸”、“碱”、“盐”、“氧化物”或“有机物”中一种)。
(2)二甲醚的一个分子中,C、H、O三种原子的个数之比为 (填最简整数比)。
(3)二甲醚中,C、O两元素的质量之比为 (填最简整数比)。
(4)二甲醚可由合成气(CO和H 2 )在一定条件下制得.用合成气制二甲醚时,还产生了一种可参与大气循环的常温下为液体的氧化物,该反应的化学方程式是: 。 _大米1年前0
_大米1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 乙丁烯,二甲醚,叔丁基氯混合气;工业燃烧用可以替代液化气烧吗
乙丁烯,二甲醚,叔丁基氯混合气;工业燃烧用可以替代液化气烧吗
还有三种混合经过70度气化后,经过150米的管道才开始燃烧,会不会产生二次液化,因为叔丁基氯的沸点是51-52度 turbing1年前1
turbing1年前1 -
 北溟悠鲲 共回答了21个问题
北溟悠鲲 共回答了21个问题 |采纳率95.2%工业燃烧可以,只要相应的管道和燃烧设备支持就可以,二甲醚对塑料有腐蚀性.1年前查看全部
- 甲烷,甲醇,二甲醚,氢气的燃烧速度分析.谁快,谁慢,为什么?
 青春女孩1年前1
青春女孩1年前1 -
 80年代的小垃圾 共回答了19个问题
80年代的小垃圾 共回答了19个问题 |采纳率84.2%第一是氢气,第二是甲烷,第三是二甲醚,第四是甲醇.(mol质量相同时)
以下是原因,举例说明:CH4+2O2=CO2+2H2O
原料部分:
1mol的CH4分子中含有4mol的C-H键,破坏它们需要4*414=1656KJ的能量
2mol的O2中含有2mol的O=O键,破坏他们需要498*2=996KJ能量
即全部破坏需要996+1656=2652KJ的能量
产物部分:
1mol的CO2中含有2mol的C=O键,形成他们会释放2*803=1606KJ的能量
2mol的H2O中含有4mol的O-H键,形成他们会释放464*4=1856KJ的能量
即全部释放的为1606+1856=3462KJ的能量
结论部分:
那意思就是说燃烧1molCH4所产生的能量
可以使3462/2652=1.30542mol的CH4继续燃烧
即增长率为30.542%
其他部分:
依照上述方法算出
氢气增长率为35.474%
甲醇24.577%
二甲醚29.503%
所以第一是氢气,第二是甲烷,第三是二甲醚,第四是甲醇.
纯属手打,计算很累,1年前查看全部
- 在城市燃气应用中,二甲醚与液化石油气相比,二甲醚主要存在热值低和易溶胶性等问题。 这句话对吗
 zjlvy1年前1
zjlvy1年前1 -
 大江东去123 共回答了13个问题
大江东去123 共回答了13个问题 |采纳率92.3%对1年前查看全部
- 用分别用高能电子流轰击二甲醚和乙醇会产生哪些分子离子和碎片离子
用分别用高能电子流轰击二甲醚和乙醇会产生哪些分子离子和碎片离子
会产生怎样的图谱 闲时听雪1年前1
闲时听雪1年前1 -
 扼杀理想的哥哥 共回答了18个问题
扼杀理想的哥哥 共回答了18个问题 |采纳率88.9%应该发生能级跃迁,核外电子受激发射出,产生带正电粒子,可能甚至破坏化学键使C-O键断裂1年前查看全部
- 乙醇与二甲醚是不是同系物
 dxw1931年前1
dxw1931年前1 -
 flytosky1980 共回答了17个问题
flytosky1980 共回答了17个问题 |采纳率100%不是同系物
是同分异构体
乙醇CH3CH2OH,二甲醚CH3OCH31年前查看全部
- 为什么乙醇比二甲醚的沸点高?同上.
 billzhou1年前1
billzhou1年前1 -
 花椒树下 共回答了19个问题
花椒树下 共回答了19个问题 |采纳率94.7%乙醇能形成分子间氢键,汽化时需要破坏这个氢键,所需要的能量增加,体现为沸点的增大.
氢键为C2H5O…HOH5C2
|
H1年前查看全部
- 如何把二氧化碳和二甲醚分离
 qqlwen1年前1
qqlwen1年前1 -
 岳父泰山 共回答了19个问题
岳父泰山 共回答了19个问题 |采纳率84.2%化学方法:通入足量氢氧化钠溶液中,收集二甲醚,然后加足量盐酸使碳酸钠/碳酸氢钠分解,收集二氧化碳
物理方法:通入四氯化碳(或其他非极性溶剂),此时的气体只剩二氧化碳
也可以向一楼说的,直接降温分离1年前查看全部
- 关于二甲醚的沸点二甲醚:C2H6O结构上说应该是极性分子吧.但为什么在常温中是气体呢?不是极性分子都是比较高的沸点吗?(
关于二甲醚的沸点
二甲醚:C2H6O
结构上说应该是极性分子吧.但为什么在常温中是气体呢?不是极性分子都是比较高的沸点吗?(比如水和酒精) 风儿lkmdh1年前3
风儿lkmdh1年前3 -
 yaoxin55_ly 共回答了26个问题
yaoxin55_ly 共回答了26个问题 |采纳率92.3%水和酒精分子间都有氢键,分子间作用力大,而二甲醚虽然是极性分子,但是没有氢键,分子间作用力小得多,极性分子熔沸点不一定很高,但是二甲醚的熔沸点乙烷比高
楼上不懂别乱说1年前查看全部
- 甲烷,甲醇,二甲醚,氢气.从分子结构方面化学方面分析一下谁的燃烧速度快?排序!
 字处理1年前1
字处理1年前1 -
 joeyyh 共回答了15个问题
joeyyh 共回答了15个问题 |采纳率93.3%化学反应速度主要取决于打开化学键的难易,甲烷燃烧需要打开C-H键;甲醇需要C-H,O-H,C-O键;二甲醚为C-H,C-O键;氢气为H-H键.化学键的键能决定了打开的难易,所以氢气速度最快,其次为甲烷,再次为二甲醚,最后是甲醇.1年前查看全部
- 大哥,能不能从分子结构方面分析一下甲烷,甲醇,二甲醚,氢气的燃烧速度快慢顺序?
 爱的心跳1年前1
爱的心跳1年前1 -
 zwbcxj 共回答了25个问题
zwbcxj 共回答了25个问题 |采纳率88%第一是氢气,第二是甲烷,第三是二甲醚,第四是甲醇.(mol质量相同时)
从分子结构上来说,与他们的三维结构基本上没有太大的关系
有关系的是他们的原子种类
不同的原子种类
决定了他们之间互相结合的结合能不同
同mol质量,燃烧快慢是总结合能与总键能比值之间的比较.
总的来说,与他们分子结构没有太大关系.1年前查看全部
- 二甲醚的相对分子质量是?二甲醚中碳 氢氧 三种元素的质量比为?
 流星划過那晚1年前1
流星划過那晚1年前1 -
 hyj7732360 共回答了21个问题
hyj7732360 共回答了21个问题 |采纳率90.5%分子式 CH3-O-CH3 (C2H6O,和乙醇一样.) 分子量 46.C:H:O 质量比= 24:6:16 = 12:3:81年前查看全部
- 乙醇 二甲醚能否用质谱法鉴别?
 终生美丽之爱自己1年前4
终生美丽之爱自己1年前4 -
 赣北小狼 共回答了19个问题
赣北小狼 共回答了19个问题 |采纳率89.5%不可以,因为两者质量一样.
乙醇: CH3CH2OH
二甲醚:CH3OCH3.
望乞满意.1年前查看全部
- 有机物命名问题,为什么甲苯不叫甲基苯,为什么二甲醚不叫二甲基醚,这个基字是在什么条件下可以省略的.
 32岁的男人1年前1
32岁的男人1年前1 -
 SmileTU 共回答了19个问题
SmileTU 共回答了19个问题 |采纳率84.2%基字可以不省略呀,可有可无1年前查看全部
- 英语翻译针对车载二甲醚水蒸气重整制氢反应体系,计算了反应体系中主要反应的化学平衡常数随温度的变化关系;确立了反应体系的独
英语翻译
针对车载二甲醚水蒸气重整制氢反应体系,计算了反应体系中主要反应的化学平衡常数随温度的变化关系;确立了反应体系的独立方程并进行了热力学平衡计算,研究了水醚比、温度、压力等对平衡的影响.结果表明,发动机的排气温度能够满足二甲醚水蒸气重整所需要的温度,并且在温度大于473K、水醚比为2~4、常压条件下能够获得较高的二甲醚转化率和氢气产率.重整气中主要包含氢气、二氧化碳和过量的水,还含有少量的一氧化碳. 逸盫1年前2
逸盫1年前2 -
 l_nn 共回答了20个问题
l_nn 共回答了20个问题 |采纳率85%According to the steam reforming of dimethyl ether hydrogen reaction system,the calculation of main reaction in the reaction system chemical equilibrium constant temperature relations; Established the reaction system independent equation and thermodynamic equilibrium calculation,the ether,temperature,water than pressure on the influence of the balance.The results show that the engine exhaust temperature can meet steam reforming of dimethyl ether to temperature,and in the temperature than 473 K,water ether than for 2 4,atmospheric pressure conditions can obtain higher dimethyl ether conversion and hydrogen production rate.Reforming gas hydrogen,carbon dioxide,mainly includes and excess water,still contain a small amount of carbon monoxide.1年前查看全部
- 下列方法能用于鉴别二甲醚(CH3OCH3)和乙醇的是( )
下列方法能用于鉴别二甲醚(CH3OCH3)和乙醇的是( )
A.李比希燃烧法
B.铜丝燃烧法
C.红外光谱法
D.元素分析仪 经典黄飞鸿1年前1
经典黄飞鸿1年前1 -
 也想飞 共回答了17个问题
也想飞 共回答了17个问题 |采纳率94.1%解题思路:A.李比希燃烧法可定量测定元素含量,而乙醇和二甲醚中元素的含量相同;
B.铜丝燃烧法可定性确定有机物中是否存在卤素
C.红外光谱法确定有机物中的化学键和官能团;
D.二者组成元素相同,均为C、H、O.A.李比希燃烧法能够测定元素的含量,而二甲醚和乙醇为同分异构体,二者元素的含量相同,无法用李比希燃烧法鉴别,故A错误;
B.铜丝燃烧法可定性确定有机物中是否存在卤素,而二甲醚和乙醇中都不含卤素,无法鉴别二者,故B错误;
C.红外光谱法确定有机物中的官能团,二甲醚与乙醇中的官能团不同,可鉴别,故C正确;
D.二甲醚(CH3OCH3)和乙醇的组成元素均为C、H、O,不能利用元素分析仪鉴别,故D错误;
故选C.点评:
本题考点: 有机物结构式的确定.
考点点评: 本题考查有机物的鉴别,为高频考点,把握二者结构的差异、性质的差异为解答的关键,注意红外光谱法、核磁共振氢谱均为确定有机物结构常用的方法,题目难度不大.1年前查看全部
- (2012•西安模拟)二甲醚(CH3OCH3)被称为21世纪的新型燃料.工业上制备二甲醚在催化反应室中(压强2.0-10
(2012•西安模拟)二甲醚(CH3OCH3)被称为21世纪的新型燃料.工业上制备二甲醚在催化反应室中(压强2.0-10.0MPa,温度230-280℃)进行下列反应
①CO(g)+2H2(g)⇌CH3OH(g)△H1=-90.7kJ•mol-1
②2CH3OH(g)⇌CH3OCH3(g)+H2O(g)△H2=-23.5kJ•mol-1
③CO(g)+H2O(g)⇌CO2(g)+H2(g)△H3=-41.2kJ•mol-1
(1)对于反应②,在温度和容积不变的条件下,能说明该反应已达到平衡状态的是______(填序号字母)
a.n(CH3OH)=n(CH3OCH3)=n(H2O)b.容器内压强保持不变
c.H2O(g)的浓度保持不变d.CH3OH的消耗速率与CH3OCH3的消耗速率之比为2:1
(2)对于反应③,若要提高CO的转化率,在其它条件不变的情况下可以采取的措施为______(填写序号字母)
a.加入一定量的H2O(g)b.降低反应温度
c.加入催化剂 d.缩小容器体积
(3)在某温度下,若反应①各物质起始浓度分别为:c(CO)=1.0mol•L-1,c(H2)=2.4mol•L-1,5min后达到平衡,CO的转化率为50%,则5min内H2的平均反应速率为;______在相同温度下,若反应物的起始浓度分别为c(CO)=4.0mol•L-1,c(H2)=amol•L-1,达到平衡后,c(CH3OH)=2.0mol•L-1,则a=______.
(4)催化反应室中总反应3CO(g)+3H2(g)⇌CH3OCH3(g)+CO2(g)的△H=______;已知830℃时反应③的平衡常数K=1.0,则在催化室中反应③的平衡常数K______1.0 (填>或<或=)
(5)9.2g二甲醚完全燃烧生成液态水和CO2时放出291.0kJ热量,则二甲醚燃烧的热化学方程式为______,二甲醚的燃烧热为______. 1vuer1年前1
1vuer1年前1 -
 chong711 共回答了17个问题
chong711 共回答了17个问题 |采纳率88.2%解题思路:(1)可逆反应2CH3OH(g)⇌CH3OCH3(g)+H2O(g)△H2=-23.5kJ•mol-1若达到平衡状态,一定满足正逆反应速率相等,各组分的浓度、百分含量不再变化,据此进行判断是否达到平衡状态;
(2)根据反应③CO(g)+H2O(g)⇌CO2(g)+H2(g)△H3=-41.2kJ•mol-1的特点及影响化学平衡的因素进行分析;
(3)根据一氧化碳的转化率计算出氢气的浓度变化,5min后达到平衡,CO的转化率为50%,则△c(CO)=1mol/L×50%=0.5mol/L,根据v(CO)=[1/2]v(H2)=[△c/△t]计算v(H2);计算该温度下的平衡常数,根据平衡常数计算平衡时氢气的浓度,根据甲醇的平衡浓度计算氢气浓度的变化量,进而计算a的值;
(4)根据盖斯定律由已知的热化学方程式乘以相应的数值进行加减,来构造目标热化学方程式,反应热也乘以相应的数值进行加减;根据温度对化学平衡的影响判断化学平衡常数大小;
(5)依据燃烧热概念含义是1mol甲醚完全燃烧生成稳定氧化物二氧化碳和液态水放出的热量为燃烧热,结合书写方法写出热化学方程式.(1)a.n(CH3OH)=n(CH3OCH3)=n(H2O),不能判断各组分的浓度是否不再变化,无法判断是否达到平衡状态,故a错误;
b.该反应是体积不变的反应,反应过程中容器内压强始终不变,所以容器内压强保持不变,无法判断是否达到平衡状态,故b错误;
c.H2O(g)的浓度保持不变,表明正逆反应速率相等,达到了平衡状态,故c正确;
d.CH3OH的消耗速率与CH3OCH3的消耗速率之比为2:1,表示的是正逆反应,且满足化学计量关系,说明达到了平衡状态,故d正确;
故选cd;
(2)反应CO(g)+H2O(g)⇌CO2(g)+H2(g)△H3=-41.2kJ•mol-1,若要提高CO的转化率,必须使化学平衡向着正向移动,
a.加入一定量的H2O(g),水蒸气的浓度增大,化学平衡向着正向移动,一氧化碳的转化率增大,故a正确;
b.该反应为放热反应,通过降低温度,平衡向着正向移动,可以提高一氧化碳的转化率,故b正确;
c.加入催化剂,催化剂不影响化学平衡的移动,不会影响一氧化碳的转化率,故c错误;
d.缩小容器体积,增大了压强,由于该反应是体积不变的反应,压强不影响化学平衡,故d错误;
故选ab;
(3)5min后达到平衡,CO的转化率为50%,则△c(CO)=1mol/L×50%=0.5mol/L,一氧化碳和氢气的化学计量数之比为1:2,所以v(H2)=2v(CO)=2×[0.5mol/L/5min]=0.2mol/(L•min);
该温度到达平衡时,c(CO)=0.5mol/L,c(H2)=2.4mol/L-2×0.5mol/L=1.4mol/L,c(CH3OH)=0.5mol/L,所以该温度下,平衡常数k=
0.55
0.5×1.42=[25/49],若反应物的起始浓度分别为:c(CO)=4mol/L,c(H2)=a mol/L,达到平衡后,c(CH3OH)=2mol/L,则平衡时c(CO)=4mol/L-2mol/L=2mol/L,设平衡时氢气的浓度为ymol/L,所以[2
2×y2=
25/49],解得y=1.4,故a=2mol/L×2+1.4mol/L=5.4mol/L,
故答案为:0.2mol/(L•min);5.4.
(4)已知:①CO(g)+2H2(g)⇌CH3OH(g)△H=-90.7kJ/mol,
②2CH3OH(g)⇌CH3OCH3(g)+H2O(g)△H=-23.5kJ/mol,
③CO(g)+H2O(g)⇌CO2(g)+H2(g)△H=-41.2kJ/mol,
由盖斯定律可知,①×2+②+③得3CO(g)+3H2(g)⇌CH3OCH3(g)+CO2(g)△H=-246.1kJ/mol,
催化室中的温度230-280℃,已知830℃时反应③的平衡常数K=1.0,由于该反应为放热反应,温度降低,平衡向着正向移动,化学平衡常数增大,所以>1.0,
故答案为:-246.1kJ/mol;>;
(5)9.2g二甲醚的物质的量为:n=[9.2g/46g/mol]=0.02mol,0.2mol二甲醚完全燃烧生成液态水和CO2时放出291.0kJ热量,所以二甲醚的燃烧热为:[291.2kJ/0.2mol]=1455kJ/mol,则二甲醚燃烧方式的热化学方程式为:CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l)△H1=-1455kJ/mol;
故答案为:CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l)△H1=-1455kJ/mol;1455kJ/mol.点评:
本题考点: 化学平衡状态的判断;热化学方程式;化学平衡常数的含义;化学平衡的调控作用.
考点点评: 本题考查了化学平衡状态的判断、化学平衡常数的计算等知识,题目综合性较大,涉及盖斯定律、热化学方程式书写、化学反应速率、化学平衡计算、平衡常数,题目难度中等,注意平衡常数的有关计算,成为近几年高考的热点,注意盖斯定律在求算反应热中应用.1年前查看全部
- 为什么分子组成都是C2H6O的乙醇和二甲醚在性质上差异很大?例如,乙醇能与金属钠反应放出氢气而二甲醚却不能,乙醇易溶与水
为什么分子组成都是C2H6O的乙醇和二甲醚在性质上差异很大?例如,乙醇能与金属钠反应放出氢气而二甲醚却不能,乙醇易溶与水而二甲醚却不溶与水?
 xiuxiantime1年前1
xiuxiantime1年前1 -
 wlovep 共回答了17个问题
wlovep 共回答了17个问题 |采纳率88.2%虽然分子组成都是C2H6O,但它们的结构是完全不一样的,一种是醇类,其官能团为OH(羟基),一种是醚类,其官能团是:C-O-C.乙醇的化学式:CH3-CH2-OH,而甲醚的化学式为:CH3-O-CH3.因此它们的性质完全不同.1年前查看全部
- 三甲醚(C 2 H 6 O)是一种清洁燃料,能替代柴油作车用能源,具有广阔的市场前景.下列有关二甲醚的说法错误的是
三甲醚(C 2 H 6 O)是一种清洁燃料,能替代柴油作车用能源,具有广阔的市场前景.下列有关二甲醚的说法错误的是 [ ]A.由C、H、O三种元素组成
B.一个分子中含有3个氢分子
C.相对分子质量为46
D.属于有机化合物 kevin11221年前1
kevin11221年前1 -
 dan0819 共回答了22个问题
dan0819 共回答了22个问题 |采纳率95.5%B1年前查看全部
- (1)世博会已右千辆新能源汽车投入运行,其中部分公交车采用二甲醚(C2H6O)做燃料.二甲醚完全燃烧生成二氧化碳和水,写
 (1)世博会已右千辆新能源汽车投入运行,其中部分公交车采用二甲醚(C2H6O)做燃料.二甲醚完全燃烧生成二氧化碳和水,写出该反应的化学方程式:C2H6O+3O2
(1)世博会已右千辆新能源汽车投入运行,其中部分公交车采用二甲醚(C2H6O)做燃料.二甲醚完全燃烧生成二氧化碳和水,写出该反应的化学方程式:C2H6O+3O2
2CO2+3H2O点燃 .C2H6O+3O2.
2CO2+3H2O点燃 .
(2)在世博园区内分布着许多“直饮水”点(如图所示),其“直饮水”主要生产流程为:自来水→活性炭→超滤膜分离→紫外线消毒→直饮水,其中活性炭起______作用;超滤膜可以让水分子通过,其它大分子污染物则被截留,这个分离过程属于______(填“物理变化”或“化学变化”). chda1年前1
chda1年前1 -
 果冻025 共回答了18个问题
果冻025 共回答了18个问题 |采纳率88.9%解题思路:(1)书写化学方程式时首先由二甲醚(C2H6O)得化学式确定生成物的化学式,是解题的关键;再根据质量守恒定律进行配平即可;
(2)知道“直饮水”主要生产流程为:自来水→活性炭→超滤膜分离→紫外线消毒→直饮水的原理,同时知道不同物质的不同特性.解;
(1)若甲醚(C2H6O)做燃料,根据其化学式的组成可推断,其完全燃烧产物有二氧化碳和水.故反应化学方程式为:C2H6O+3O2
点燃
.
2CO2+3H2O
(2)根据“直饮水”主要生产流程为:自来水→活性炭→超滤膜分离→紫外线消毒→直饮水,一方面利用了活性炭的吸附作用;另一方面利用的超滤膜可以让水分子通过,其它大分子污染物则被截留的性质,这个分离过程属于物理变化.
故答案为:
(1)C2H6O+3O2
点燃
.
2CO2+3H2O;(2)吸附;物理变化点评:
本题考点: 常用燃料的使用与其对环境的影响;自来水的生产过程与净化方法;化学变化和物理变化的判别;书写化学方程式、文字表达式、电离方程式.
考点点评: 解答材此类信息给予题时,必须把握题中的已有的信息,结合已有的化学知识进行拓展解答即可.1年前查看全部
- (2013•芜湖模拟)二甲醚(CH3OCH3)被称为21世纪的新型燃料,清洁、高效,有优良的环保性能,以二甲醚、空气、氢
(2013•芜湖模拟)二甲醚(CH3OCH3)被称为21世纪的新型燃料,清洁、高效,有优良的环保性能,以二甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.有关说法不正确的是( )
A.该燃料电池中通入二甲醚的一极为负极
B.二甲醚作为汽车燃料不会产生氮的氧化物和碳氢化合物的污染
C.在燃料电池中二甲醚最终转化为CO2和H2O
D.消耗0.5 mol二甲醚可以向外电路提供6mol e- tikki1年前1
tikki1年前1 -
 我塞 共回答了19个问题
我塞 共回答了19个问题 |采纳率84.2%解题思路:该电池属于燃料电池,负极上燃料二甲醚失电子发生氧化反应,电极反应式为CH3OCH3+160H--12e-═2CO32-+11H2O,正极上氧气得电子发生还原反应,电极反应式为3O2+12e-+6H2O=12OH-,结合物质间的关系式解答.A.该燃料电池中,二甲醚失电子发生氧化反应,所以通入二甲醚的电极是负极,电极反应式为CH3OCH3+160H--12e-═2CO32-+11H2O,故A正确;
B.二甲醚属于有机物,燃烧生成二氧化碳和水,所以不产生氮的氧化物和碳氢化合物的污染,故B正确;
C.碱性电池中,二氧化碳能和氢氧根离子反应生成碳酸根离子,所以二甲醚最终转化为碳酸根离子和水,故C错误;
D.消耗0.5 mol二甲醚可以向外电路提供电子的物质的量=0.5mol×2×(4+2)=6mol,故D正确;
故选C.点评:
本题考点: 化学电源新型电池.
考点点评: 本题考查了原电池原理,明确正负极上发生的电极反应式是解本题关键,注意电极反应式的书写要结合电解质溶液的酸碱性,为易错点.1年前查看全部
- 如何向液化气中参二甲醚
 gouhuawei1年前1
gouhuawei1年前1 -
 sea_board017 共回答了16个问题
sea_board017 共回答了16个问题 |采纳率93.8%首先要弄明白以下几点:
1.两者在钢瓶中均为液态.
2.两者瓶内压力相差根据瓶内多少有所差别.
3.不管是把二甲醚充入到液化气瓶内,还是把液化气充入到二甲醚瓶内,都需要以液相充入.
4.普通单口钢瓶直立摆放时,出气口所出气体为气相,倒立时出口气体为液相.
5.充入比例可以按重量多少公斤兑多少公斤计算.
具体操作步骤:
1.一瓶正立,一瓶倒立,用倒气充枪连接.
2.把正立瓶中的气体稍稍放出一些,以减少被充入瓶内的压力,然后打开充枪开关和气瓶阀门即可掺入.1年前查看全部
- (2013•吉林二模)CO和H2的混合气体俗称合成气,是一种重要的工业原料气,可以在一定条件下制备甲醇,二甲醚等多种有机
 (2013•吉林二模)CO和H2的混合气体俗称合成气,是一种重要的工业原料气,可以在一定条件下制备甲醇,二甲醚等多种有机物.工业上利用天然气(主要成分为CH4)与水进行高温重整制备合成气.
(2013•吉林二模)CO和H2的混合气体俗称合成气,是一种重要的工业原料气,可以在一定条件下制备甲醇,二甲醚等多种有机物.工业上利用天然气(主要成分为CH4)与水进行高温重整制备合成气.
(1)已知:CH4、H2和CO的燃烧热分别为890.3kJ/mol、285.8kJ/mol和283.0kJ/mol,且1mol液态水汽化时的能量变化为44.0kJ.写出甲烷与水蒸气在高温下反应制取合成气的热化学方程式______.
(2)在一定条件下,向体积为2L的密闭容器中充入0.40mol CH4和0.60mol H2O(g),测得CH4(g)和H2(g)的物质的量浓度随时间变化如下表所示:
①3-4min之间,化学平衡向______反应方向移动(填“正”或“逆”).时间/min
物质
浓度0 1 2 3 4 CH4 0.2mol•L-1 0.13mol•L-1 0.1mol•L-1 0.1mol•L-1 0.09mol•L-1 H2 0mol•L-1 0.2mol•L-1 0.3mol•L-1 0.3mol•L-1 0.33mol•L-1
②3min时改变的反应条件是______(只填一种条件的改变)
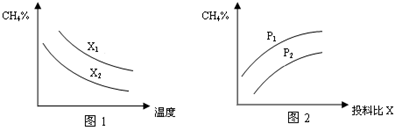
(3)已知温度、压强、投料比X〔n(CH4)/n(H2O)〕对该反应的影响如图所示.
①图1中的两条曲线所示投料比的关系X1______X2(填“=”“>”或“<”下同)
②图2中两条曲线所示的压强比的关系:p1______p2
(4)以天然气(设杂质不参与反应)、KOH溶液为原料可设计成燃料电池
①放电时,正极的电极反应式______
②设装置中盛有100.0mL 3.0mol/L KOH溶液,放电时参与反应的氧气在标准状况下的体积为8.96L,放电过程中没有气体逸出,则放电完毕后,所得溶液中各离子浓度由大到小的关系为______. qinglaixia1年前1
qinglaixia1年前1 -
 beyond_chu 共回答了13个问题
beyond_chu 共回答了13个问题 |采纳率92.3%解题思路:(1)根据燃烧热写出热化学方程式,利用盖斯定律计算;(2)反应方程式为CH4(g)+H2O(g)=CO(g)+3H2(g),根据表中数据可知3min时达到平衡,再根据4min时各组分浓度变化量判断改变的条件;(3)①碳水比n(CH4)/n(H2O)值越大,平衡时甲烷的转化率越低,含量越高;②根据压强对平衡移动影响,结合图象分析解答;(4)①甲烷燃料电池工作时,正极发生还原反应,氧气得电子被还原;②计算氧气的物质的量,进而计算生成二氧化碳的物质的量,根据n(NaOH)与n(CO2)比例关系判断反应产物,进而计算溶液中电解质物质的量,结合盐类水解与电离等判断.(1)已知:①H2(g)+[1/2]O2(g)=H2O(l)△H=-285.8kJ•mol-1
②CO(g)+[1/2]O2(g)=CO2(g) )△H=-283.0kJ•mol-1
③CH4(g)+2O2(g)=CO2(g)+2H2O(l))△H=-890.3kJ•mol-1,
④H2O(g)=H2O(l)△H=-44.0kJ•mol-1,
利用盖斯定律将④+③-②-3×①可得:CH4(g)+H2O(g)=CO(g)+3H2(g)
△H=(-44.0kJ•mol-1)+(-890.3kJ•mol-1)-(-283.0kJ•mol-1)-3×(-285.8kJ•mol-1)=+206.1 kJ•mol-1,
故答案为:CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.1kJ/mol;
(2)①反应方程式为CH4(g)+H2O(g)=CO(g)+3H2(g),由表中数据可知3-4min之间,CH4浓度减小,H2浓度增大,则反应向生产氢气的方向移动,即向正方向进行,故答案为:正;
②3min时改变的反应条件,反应向正反应方向进行,可能为升高温度或增大H2O的浓度或减小CO的浓度,故答案为:升高温度或增大H2O的浓度或减小CO的浓度;
(3)①碳水比n(CH4)/n(H2O)值越大,平衡时甲烷的转化率越低,含量越高,故x1>x2,故答案为:>;
②该反应正反应是气体体积增大的反应,增大压强平衡向逆反应方向移动,平衡时甲烷的含量增大,故p1>p2,故答案为:>;
(4)①正极发生还原反应,氧气在正极放电生成氢氧根离子,正极电极反应式为:O2+4e-+2H2O=4OH-,故答案为:O2+4e-+2H2O=4OH-;
②参与反应的氧气在标准状况下体积为8960mL,物质的量为[8.96L/22.4L/mol]=0.4mol,根据电子转移守恒可知,生成二氧化碳为[0.4mol×4/8]=0.2mol,n(NaOH)=0.1L×3.0mol•L-1=0.3mol,n(NaOH):n(CO2)=0.3mol:0.2mol=3:2,发生发生2CO2+3NaOH=Na2CO3+NaHCO3+H2O,溶液中碳酸根水解,碳酸氢根的水解大于电离,溶液呈碱性,故c(OH-)>c(H+),碳酸根的水解程度大于碳酸氢根,故c(HCO3-)>c(CO32-),钾离子浓度最大,水解程度不大,碳酸根浓度原大于氢氧根离子,故c(K+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),
故答案为:c(K+)>c (HCO3- )>c (CO32- )>c (OH- )>c( H+).点评:
本题考点: 化学平衡的计算;热化学方程式;化学电源新型电池;化学平衡建立的过程;离子浓度大小的比较.
考点点评: 本题综合性较大,涉及热化学方程式书写、化学平衡图象、化学平衡的影响因素、化学平衡计算、原电池、化学计算、离子浓度比较等,为高考常见题型,难度中等,是对基础知识与学生能力的综合考查,注意把握化学平衡的影响因素以及图象、数据的分析能力的培养.1年前查看全部
- 上海作为2010年世博会的举办城市,公共交通的“绿色”也已经在进行,以二甲醚(化学式为C2H6O,简称甲醚)为燃料的公共
上海作为2010年世博会的举办城市,公共交通的“绿色”也已经在进行,以二甲醚(化学式为C2H6O,简称甲醚)为燃料的公共交通作为“绿色”花园中的一点鲜艳的绿色已正式启动,解决了汽车尾部冒黑烟的问题.下列叙述正确的是( )
A.甲醚与乙醇是同分异构体
B.甲醚可由甲醇在一定条件下发生消去反应而制得
C.甲醚作燃料不会产生氮的氧化物和碳氢化合物的污染
D.1mol甲醚完全燃烧消耗的氧气与1mol甲醇完全燃烧消耗的氧气相同 clotena1年前1
clotena1年前1 -
 其实我也是个yy 共回答了24个问题
其实我也是个yy 共回答了24个问题 |采纳率95.8%解题思路:A.同分异构体体是指分子式相同,结构不同的有机化合物的互称;
B.根据消去反应的条件判断;
C.甲醚含碳氢氧,燃烧生成二氧化碳和水,所以不产生氮的氧化物和碳氢化合物的污染,故B正确;
D.根据分子式计算耗氧量.A.乙醇分子式为C2H6O,结构为:CH3CH2OH,甲醚的分子式为C2H6O,结构为CH3OCH3,结构不同,互为同分异构体,故A正确;
B.醇发生消去反应的条件是和羟基相连的邻碳上有氢离子,甲醇没有邻碳,故甲醇不会发生消去反应,故B错误;
C.甲醚属于含氧衍生物,燃烧生成二氧化碳和水,所以不产生氮的氧化物和碳氢化合物的污染,故C正确;
D.甲醚的分子式为C2H6O,1mol甲醚耗氧3mol,甲醇分子式为CH4O,1mol甲醇耗氧1.5mol,故D错误;
故选AC点评:
本题考点: 同分异构现象和同分异构体;消去反应与水解反应.
考点点评: 本题考查了同分异构体和甲醚和甲醇的性质,较基础,注意醇类发生消去反应的条件.1年前查看全部
- (2014•浙江模拟)二甲醚(CH3OCH3)以其优良的性质,被称为21世纪的新型“清洁能源”,在未来可能替代柴油和液化
 (2014•浙江模拟)二甲醚(CH3OCH3)以其优良的性质,被称为21世纪的新型“清洁能源”,在未来可能替代柴油和液化气作为洁净液体燃料使用.工业上以C0和H2为原料生产CH30CH3的新工艺主要发生三个反应:
(2014•浙江模拟)二甲醚(CH3OCH3)以其优良的性质,被称为21世纪的新型“清洁能源”,在未来可能替代柴油和液化气作为洁净液体燃料使用.工业上以C0和H2为原料生产CH30CH3的新工艺主要发生三个反应:
①CO(g)+2H2(g)⇌CH3OH(g)△H1=-91KJ•mol-1
②2CH30H(g)⇌CH30CH3(g)+H20(g)△H2=-24KJ•mol-1
③CO(g)+H2O(g)⇌CO2(g)+H2(g)△H3=-41KJ•mol-1
回答下列问题:
(1)写出新工艺的总反应的热化学方程式:______,平衡常数表达式K=c(CH3OCH3)c(CO2) c3(CO)c3(H2) .c(CH3OCH3)c(CO2) c3(CO)c3(H2)
(2)一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是______(填字母代号).
a.低温高压b.加入催化剂c.减少CO2的浓度d.增加CO的浓度
(3)在某温度下,2L密闭容器中发生反应①,起始时CO、H2的物质的量分别为2mol和6mol,3min后达到平衡,测得CO的转化率为60%,则3min内CO的平均反应速率为______.若同样条件下起始时CO的物质的量为4mol,达到平衡后CH3OH为2.4mol,则起始时H2的物质的量为:______.
(4)某温度下在2L恒容密闭容器中加入CH3OH发生反应②,测得有关数据如下:
则此反应在该温度下的平衡常数为______,若再向容器分别加入甲醇0.02mol、CH3OCH3 1.0mol,此时该反应v正反应______v逆反应(填“>”、“<”或“=”).反应时间/min 0 1 2 3 4 c(CH3OH)/mol•L-1 0.51 0.2 0.1 0.01 0.01
(5)为了寻找合适的反应温度,研究者进行了一系列试验,每次试验保持原料气组成、压强、反应时间等因素不变,试验结果CO转化率随温度变化的规律如图试解释原因是:______. cnlamar1年前1
cnlamar1年前1 -
 xddhh 共回答了7个问题
xddhh 共回答了7个问题 |采纳率85.7%解题思路:(1)根据盖斯定律计算△H;平衡常数指产物浓度系数次幂的乘积与反应物浓度系数次幂的乘积的比值;
(2)要提高CO的转化率,应该不条件平衡正向进行方向判断;
(3)依据化学平衡三段式列式计算,结合平衡常数计算 氢气起始量;
(4)根据表中数据,3分钟后达到平衡状态,计算出该反应的平衡常数;向容器分别加入甲醇0.02mol、CH3OCH31.0mol,重新计算出浓度商,与化学平衡常数对比,判断平衡移动方向;
(5)由图表可知,在较低温时,反应体系均未达到平衡,CO的转化率主要受反应速率影响,随着温度的升高反应速率增大,CO的转化率也增大;在较高温时,反应体系均已达到平衡,随着温度的升高平衡向逆反应方向移动,CO的转化率减小.(1)已知①CO( g)+2H2(g)⇌CH3OH( g)△H1=-91kJ•mol-1,
②2CH30H(g)⇌CH30CH3(g)+H20(g)△H2=-24kJ•mol-1,
③CO(g)+H2O(g)⇌CO2(g)+H2(g)△H3=-41kJ•mol-1,
根据盖斯定律,①×2+②+③得3CO(g)+3H2(g)⇌CH3OCH3(g)+CO2(g)△H=-247kJ•mol-1,
平衡常数指产物浓度系数次幂的乘积与反应物浓度系数次幂的乘积的比值,所以K=
c(CH3OCH3)c(CO2)
c3(CO)c3(H2);
故答案为:3CO(g)+3H2(g)⇌CH3OCH3(g)+CO2(g)△H=-247KJ•mol-1,
c(CH3OCH3)c(CO2)
c3(CO)c3(H2);
(2)一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施应使平衡正向进行,3CO(g)+3H2(g)⇌CH3OCH3(g)+CO2(g)△H=-247KJ•mol-1;
a.反应是气体体积减小的放热反应,低温高压平衡正向进行,一氧化碳转化率增大,故a正确;
b.加入催化剂 改变反应速率不改变化学平衡,一氧化碳转化率不变,故b错误;
c.减少CO2的浓度,平衡正向进行,一氧化碳转化率增大,故c正确;
d.增加CO的浓度,平衡正向进行,一氧化碳转化率减小,故d错误;
故答案为:ac;
(3)在某温度下,2L密闭容器中发生反应①,起始时CO、H2的物质的量分别为2mol和6mol,3min后达到平衡,测得CO的转化率为60%,依据化学平衡三段式列式计算:
CO(g)+2H2(g)⇌CH3OH(g)
起始量(mol/L) 1 3 0
变化量(mol/L) 0.6 0.6 0.2
平衡量(mol/L) 0.4 2.4 0.2
则3min内CO的平均反应速率=[0.6mol/L/3min]=0.2mol/L•min;
若同样条件下起始时CO的物质的量为4mol,达到平衡后CH3OH为2.4mol,设氢气起始量ymol/L
CO(g)+2H2(g)⇌CH3OH(g)
起始量(mol/L)2y 0
变化量(mol/L)1.2 2.4 1.2
平衡量(mol/L) 0.8 y-2.41.2
依据化学平衡常数不变计算得到
1.2
0.8×(y−2.4)2=
0.2
0.4×2.42
y=4.2mol/L;
氢气物质的量为8.4mol
故答案为:0.2 mol•L-1•min-1,8.4 mol;
(4)根据反应方程式:2CH3OH(g)⇌CH3OCH3(g)+H2O(g),
反应前c(CH3OH)/mol•L-1:0.51 0 0
3分钟后达到平衡状态浓度:0.01 0.25 0.25
平衡常数为:
0.25×0.25
0.012=625,
再向容器分别加入甲醇0.02mol、CH3OCH31.0mol反应的浓度商为:
(1.0+0.25)×0.25
0.032≈347.2<625,平衡向着正向移动,正反应速率大于逆反应速率,
故答案为:625;>;
(5)由图表可知,温度低于240℃时,CO的转化率随着温度的升高而增大;温度高于240℃时,CO的转化率随着温度的升高而减小,
在较低温时,各反应体系均未达到平衡,CO的转化率主要受反应速率影响,随着温度的升高反应点评:
本题考点: 化学平衡的计算;热化学方程式;化学平衡的影响因素;化学平衡的调控作用.
考点点评: 本题考查反应热的计算、平衡移动、化学平衡常数等,难度中等,难点在于读图明白温度为240℃时反应体系均已达到平衡.1年前查看全部
- 二甲醚是一种绿色、可再生的新能源。如图是绿色电源“燃料电池”的工作原理示意图(a、b均为多孔性Pt电极)。该电池工作时,
二甲醚是一种绿色、可再生的新能源。如图是绿色电源“燃料电池”的工作原理示意图(a、b均为多孔性Pt电极)。该电池工作时,下列说法不正确的是

A.a电极为该电池负极 B.O 2 在b电极上得电子,被氧化 C.电池工作时,a电极反应式:
CH 3 OCH 3 —12e - +3H 2 O→2CO 2 ↑+12H +D.电池工作时,燃料电池内部H + 从a电极移向b电极  西域刀客0小宝1年前1
西域刀客0小宝1年前1 -
 zxd_psj 共回答了24个问题
zxd_psj 共回答了24个问题 |采纳率83.3%B
1年前查看全部
- 乙醇,二甲醚的水溶性哪个好(用氢键解释)求大神帮助
 战车511年前1
战车511年前1 -
 夜听雨68 共回答了20个问题
夜听雨68 共回答了20个问题 |采纳率85%乙醇好,乙醇中存在羟基,此羟基可与水之间形成氢键.而二甲醚中没有可形成氢键的基团,所以水溶性不及乙醇.1年前查看全部
大家在问
- 1how to do it和 what to do是什么来的?是不是宾语从句改为简单句?
- 2某校参加“祖冲之”杯数学邀请赛的选手的平均分数是75分,其中男参赛选手比女选手多80%,而女选手比男选手的平均分数高20
- 3在括号里填上恰当的词语。
- 4初中文言文扩展阅读150,151的题目与文章
- 5甲烷与不足量的氧气反应的化学方程式
- 6如图的中间是一个边长为4厘米的小正方形.该图形的面积是多少平方厘米?
- 7语文猜一猜:又圆又扁肚里空,有面镜子在空中.老少见它都低头,磨练搓手有鞠躬.大一日用平( ) 抓住特别( )(把搭配不当
- 8下面是一名英国籍学生Kate Green的基本情况Kate是你的好朋友,请你根据表格内容把她介绍给你的其他朋友.结尾已经
- 9怎样做自学笔记?
- 10某酸与某碱混合,如何计算混合溶液的pH
- 11关于对数函数指数函数中的一个基本公式问题
- 12若β是方程2x²-x-5=0的根,则β²-1/2β的值是
- 13数学计数问题如果A={0,1,2,…,m},那么在平面直角坐标系下,集合{(x,y)|x,y属于A}中有多少个不同的点?
- 14代数式2x2+3x+7的值为12,则代数式4x2+6x-10=______.
- 15he plays football in the playground after school every day.用





