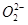将0.l mol• 醋酸溶液加水稀释,下列说法正确的是 A.溶液中c(H+)和c( )都减小 B.溶液中c(
 香皂泡泡2022-10-04 11:39:542条回答
香皂泡泡2022-10-04 11:39:542条回答
将0.l mol• 醋酸溶液加水稀释,下列说法正确的是 A.溶液中c(H+)和c( )都减小 B.溶液中c(H+)
将0.l mol• 醋酸溶液加水稀释,下列说法正确的是
A.溶液中c(H+)和c( )都减小 B.溶液中c(H+)增大
C.醋酸电离平衡向左移动 D.溶液的pH增大
求D的详细解答
将0.l mol• 醋酸溶液加水稀释,下列说法正确的是
A.溶液中c(H+)和c( )都减小 B.溶液中c(H+)增大
C.醋酸电离平衡向左移动 D.溶液的pH增大
求D的详细解答

已提交,审核后显示!提交回复
共2条回复
 天蝎座1106 共回答了14个问题
天蝎座1106 共回答了14个问题 |采纳率85.7%- 加入水,CH3COOH溶液电离程度增大
因为加水稀释体积扩大,微粒总浓度减小,平衡为抑制减小,要向生成更多微粒方向移动,也就是正向移动,从而促进电离.越稀越电离.
但因为体积扩大占优势,所以氢离子浓度还减小,氢氧根浓度增加.(因为离子积常数不变)
所以选D
其实换个想法,联系实际,醋是越稀释,越不酸(pH增大).
4465864452011-11-27 16:49
氢离子不是变多了嘛?为什么氢离子浓度还减小?不懂啊.T T回复
张家琛wd2011-11-27 16:54
回复 446586445:氢离子数量/变多没错,但是体积也是变大.体积变大比氢离子变多要快,氢离子浓度=氢离子数量/体积,综合一下,氢离子浓度反而变小了.回复
如果有疑问最好追问,如果评论有时候会注意不到的. - 1年前
 浪夫 共回答了1个问题
浪夫 共回答了1个问题 |采纳率- 酸溶液(非浓)加水,PH值增大。就这么多
- 1年前
相关推荐
- 下列叙述正确的是 A.常温下,78 g Na 2 O 2 中含有的阴离子数是2N A B.常温下,l L 0.l mol
下列叙述正确的是
A.常温下,78 g Na 2 O 2 中含有的阴离子数是2N A B.常温下,l L 0.l mol·L -1 NH 4 NO 3 溶液中含有的NH 4 + 数是0.l N A C.常温常压下,22.4 L SO 2 和O 2 混合气体中含有的氧原子数是2 N A D.铁铝混合物与一定量盐酸反应生成1 mol H 2 时,转移电子数是2 N A  rock_po1年前1
rock_po1年前1 -
 脚趾不臭 共回答了13个问题
脚趾不臭 共回答了13个问题 |采纳率92.3%1年前查看全部
- 下列关于0.l mol·L-1氯化铵溶液的说法正确的是 ( ) A.溶液中离子浓度关系为:c(Cl-)>c(NII4+)
下列关于0.l mol·L-1氯化铵溶液的说法正确的是 ( ) A.溶液中离子浓度关系为:c(Cl-)>c(NII4+)>c(
下列关于0.l mol·L-1氯化铵溶液的说法正确的是 ( )
A.溶液中离子浓度关系为:c(Cl-)>c(NII4+)>c(H+)>c(OH-)
B.向溶液中加入适量氨水使混合液的pH=7,混合被中c(NH4+)>c(C1-)
C.向溶液中滴加几滴浓盐酸,c(NH4+)减小
D.向溶液中加入少量CH3COONa固体,c(NH4+)减小 北欧海风1年前3
北欧海风1年前3 -
 maloneyuyi 共回答了20个问题
maloneyuyi 共回答了20个问题 |采纳率100%应选择AD
本来应存在C(Cl-)=C(NH4+)
A.但NH4++H2O=(可逆符号)NH3.H2O+H+ 但水解的量很少 , 因此溶液显酸性C(H+)>C(OH-)
这样就有一部分NH4+转化成了NH3.H2O 因此C(Cl-)>C(NH4+)
B.根据电荷守恒:C(OH-)+C(Cl-)=C(H+)+C(NH4+)由于PH=7,则C(OH-)=C(H+)
则:C(NH4+)=C(Cl-)
C.加入HCl等于增大了C(H+),平衡向左移动,C(NH4+)增大.
D.加入CH3COONa固体,引入CH3COO-,生成CH3COOH,消耗了H+,平衡向右移动, c(NH4+)减小1年前查看全部
大家在问
- 16年级男生有275人比女生1.5倍少19人,用方程式
- 2HOH是什么的化学式,氢氧化氢的化学式怎么写
- 3找规律:16分之1,8分之1,(),(),1().24分之5,12分之5,(),(),3分之10,()
- 4“我希你给我的承诺能兑现,希望我们永远在一起!”英语翻译一下,
- 5请问if引导的虚拟语气能不能处理成省略主语的非谓语形式?比如(she ignored me as if she hadn
- 6由四舍五入法得到的近似数8.8×103,下列说法中正确的是( )
- 7质量为1kg的物体A,在光滑水平面上以6m/s的速度与质量为2kg,速度为2m/s的物体B发生碰撞,
- 8she thinks that she ()met him somewhere.填ever还是once?
- 9Don't forget to feed my cat with some fish.改为同义句
- 10以下说法中正确的是 ( )A.布朗运动是指悬浮的固体颗粒内分子的无规则运动B.物体的温度越高,分子平均动能一定越大C.
- 11小明进行一次投篮训练,共投三组 ,每一组投10个。第1组投中5个,第2组投中6个,第3组投中7个。在这次训练中小明的投篮
- 12电热水壶,电饭锅,等电器工作时,将()的电能转化为内能,而电风扇,电视机等电器工作时,将()的电能转化为内能(选填,部分
- 13设指数函数f(x)=a^x(a>0且a≠1)则下列不等式正确的是
- 14举例说明分段函数在实际生活中的应用
- 15关于光现象,下列说法正确的是( )