319,将下列电极反应中有关离子浓度减半时,电极电势增大的反应是( )
 shuixiangzhizi2022-10-04 11:39:542条回答
shuixiangzhizi2022-10-04 11:39:542条回答A Cu2+ + 2e= Cu B 2H+ + 2e = H2
C Fe3+ + e= Fe2+ D Br2 + 2e= 2Br—
E I2+2e=2I-
原因及类似题目如何判断
整个答案不记得了,只记得有E

已提交,审核后显示!提交回复
共2条回复
 ldp1978 共回答了13个问题
ldp1978 共回答了13个问题 |采纳率76.9%- A中[氧化型]减半,[还原型]不变,ln([氧化型]/[还原型])减小,(RT)/(nF)是正数且不变,所以,E增大;同理,B增大;C由于[氧化型]与[还原型]同时减半,故E不变;D减小;E减小.
综上,选AB.
类似的题目还是用能斯特方程解比较好——不要说,是离子在左就增大,在右就减小——不一定的!
比如说(Cr2O7)2- + 14H+ + 6e- == 2Cr3+ + 7H2O,其中[氧化型]=[(Cr2O7)2-][H+]^14,[还原型]=[Cr3+]^2,[氧化型]是指与氧化态反应的所有反应离子系数次方之积,同理[还原型],所以要具体问题具体分析,不要死记结论哦! - 1年前
 billowriver 共回答了3个问题
billowriver 共回答了3个问题 |采纳率- E=E(标准)+(RT)/(nF)ln([氧化型]/[还原型])
满意答案中的公式用错了~~~中间应该是“+”号~~~所以答案是D和E。 - 1年前
相关推荐
- 写出下列电极反应和化学方程式
 平成人1年前1
平成人1年前1 -
 柠檬1024 共回答了17个问题
柠檬1024 共回答了17个问题 |采纳率82.4%12.碱性锌锰原电池
电极反应一般写成:
负极Zn+20H--2e-=ZnO+H20
正极2Mn02+2H2O +2e-=Mn203+H2O+20H-
总反应方程式Zn+2Mn02=ZnO+Mn203.
其他的相对简单,这里就不赘述了.
一般先写总反应式,然后写负极反应,最后一减得到正极反应式.1年前查看全部
- 如图是以铅蓄电池为电源,模拟氯碱工业电解饱和食盐水的装置图(C、D均为石墨电极).已知:铅蓄电池在放电时发生下列电极反应
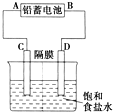 如图是以铅蓄电池为电源,模拟氯碱工业电解饱和食盐水的装置图(C、D均为石墨电极).已知:铅蓄电池在放电时发生下列电极反应:负极Pb+SO42--2e-═PbSO4
如图是以铅蓄电池为电源,模拟氯碱工业电解饱和食盐水的装置图(C、D均为石墨电极).已知:铅蓄电池在放电时发生下列电极反应:负极Pb+SO42--2e-═PbSO4
正极PbO2+4H++SO42-+2e-═PbSO4+2H2O
(1)请写出电解饱和食盐水的化学方程式2NaCl+2H2O
2NaOH+Cl2↑+H2↑通电 .2NaCl+2H2O.
2NaOH+Cl2↑+H2↑通电 .
(2)若在电解池中C极一侧滴酚酞试液,电解一段时间后未呈红色,说明铅蓄电池的A极为______极.
(3)用铅蓄电池电解1L饱和食盐水(食盐水足量、密度为1.15g/cm3)时,
①若铅蓄电池消耗H2SO42mol,则可收集到H2的体积(标准状况下)为______ L.
②若消耗硫酸amol,电解后除去隔膜,所得溶液中NaOH的质量分数表达式为(假设氯气全部排出)[40a1000×1.15−
(71+2)]×100%a/2 [40a1000×1.15−
(71+2)]×100% (用含a的代数式表示).a/2 赞
T帅 花朵
共回答了21个问题采纳率:81% 举报
解题思路:(1)惰性电极电极饱和食盐水生成氢气、氯气和氢氧化钠,原子守恒配平写出;
(2)电解池中C极一侧滴2滴酚酞试液、电解一段时间后,未呈红色说明C电极为阳极,电源A为正极;
(3)①依据电解氯化钠生成氯气电极反应计算转移电子物质的量;
②依据铅蓄电池和电解池中电子转移守恒计算;
③依据铅蓄电池电极反应计算消耗硫酸转移电子,电解过程中电子守恒,根据电解氯化钠溶液的化学方程式计算电解后溶液中溶质和溶液质量得到氢氧化钠的质量分数;(1)惰性电极电极饱和食盐水生成氢气、氯气和氢氧化钠,反应的化学方程式为:2NaCl+2H2O
通电
.
2NaOH+Cl2↑+H2↑,
故答案为:2NaCl+2H2O
通电
.
2NaOH+Cl2↑+H2↑;
(2)电解池中C极一侧滴2滴酚酞试液、电解一段时间后,未呈红色说明C电极为阳极,D为阴极,电源A为正极,故答案为:正极;
(3)①蓄电池消耗H2SO4 2mol,依据电极反应PbO2+4H++SO42-+2e-=PbSO4+2H2O,消耗2mol硫酸电子转移2mol,电解食盐水阴极电极反应2H++2e-=H2↑转移电子2mol生成氢气1mol,标准状况体积为22.4L,则可收集到H2的体积22.4L,
故答案为:22.4;
②依据电极反应PbO2+4H++SO42-+2e-=PbSO4+2H2O,消耗amol硫酸电子转移amol,2NaCl+2H2O
通电
.
2NaOH+Cl2↑+H2↑,反应中转移电子2mol,生成氢氧化钠物质的量为2mol,消耗amol硫酸电子转移amol,生成氢氧化钠amol,氢气0.5amol,氯气0.5amol,得到氢氧化钠溶液的质量分数=[40a
1000×1.15−
a/2(71+2)]×100%,
故答案为:[40a
1000×1.15−
a/2(71+2)]×100%.点评:
本题考点: 电解原理.
考点点评: 本题考查了原电池,电解池电极分析判断,电极反应中电子守恒计算应用,注意电子守恒的分析判断是解题关键,题目难度中等.1年前
8可能相似的问题-
如图是模拟工业电解饱和食盐水的装置图,下列叙述正确的是( )
1年前1个回答
-
1年前1个回答
-
1年前1个回答
你能帮帮他们吗
Copyright © 2022 YULUCN.COM - 雨露学习互助 - 17 q. 0.048 s. - webmaster@yulucn.com Syrup51年前1
Syrup51年前1 -
 T帅 共回答了21个问题
T帅 共回答了21个问题 |采纳率81%解题思路:(1)惰性电极电极饱和食盐水生成氢气、氯气和氢氧化钠,原子守恒配平写出;
(2)电解池中C极一侧滴2滴酚酞试液、电解一段时间后,未呈红色说明C电极为阳极,电源A为正极;
(3)①依据电解氯化钠生成氯气电极反应计算转移电子物质的量;
②依据铅蓄电池和电解池中电子转移守恒计算;
③依据铅蓄电池电极反应计算消耗硫酸转移电子,电解过程中电子守恒,根据电解氯化钠溶液的化学方程式计算电解后溶液中溶质和溶液质量得到氢氧化钠的质量分数;(1)惰性电极电极饱和食盐水生成氢气、氯气和氢氧化钠,反应的化学方程式为:2NaCl+2H2O
通电
.
2NaOH+Cl2↑+H2↑,
故答案为:2NaCl+2H2O
通电
.
2NaOH+Cl2↑+H2↑;
(2)电解池中C极一侧滴2滴酚酞试液、电解一段时间后,未呈红色说明C电极为阳极,D为阴极,电源A为正极,故答案为:正极;
(3)①蓄电池消耗H2SO4 2mol,依据电极反应PbO2+4H++SO42-+2e-=PbSO4+2H2O,消耗2mol硫酸电子转移2mol,电解食盐水阴极电极反应2H++2e-=H2↑转移电子2mol生成氢气1mol,标准状况体积为22.4L,则可收集到H2的体积22.4L,
故答案为:22.4;
②依据电极反应PbO2+4H++SO42-+2e-=PbSO4+2H2O,消耗amol硫酸电子转移amol,2NaCl+2H2O
通电
.
2NaOH+Cl2↑+H2↑,反应中转移电子2mol,生成氢氧化钠物质的量为2mol,消耗amol硫酸电子转移amol,生成氢氧化钠amol,氢气0.5amol,氯气0.5amol,得到氢氧化钠溶液的质量分数=[40a
1000×1.15−
a/2(71+2)]×100%,
故答案为:[40a
1000×1.15−
a/2(71+2)]×100%.点评:
本题考点: 电解原理.
考点点评: 本题考查了原电池,电解池电极分析判断,电极反应中电子守恒计算应用,注意电子守恒的分析判断是解题关键,题目难度中等.1年前查看全部
- 对于下列电极反应,MnO2 + 4H+ + 2e = Mn2+ + 2H2O 如果增大溶液的pH值,则该电极的电极电势:
 dreamfantasy1年前1
dreamfantasy1年前1 -
 中意许留山 共回答了19个问题
中意许留山 共回答了19个问题 |采纳率100%(1)PH升高,[H+]降低!
(2)E == E0 + 0.059/2*lg[H+]^4/[Mn2+]
(3)则该电极的电极电势降低!1年前查看全部
- 无机及分析化学,写出下列电极反应的离子电子式
 wwwggg681年前0
wwwggg681年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 第7题,下列电极反应,标准电极电势代数值最小的是?为什么?
 逍遥鹰王1年前2
逍遥鹰王1年前2 -
 牵手是牵心 共回答了16个问题
牵手是牵心 共回答了16个问题 |采纳率81.3%A可以看做是标准电极电势φ(θ),其他可按条件电极电势计算φ,公式为ψ=φ(θ)+(0.059/n)×lg[c(X)/Ksp](近似),其中n为转移电子数,c(X)为卤素例子浓度,认为是1mol/l,Ksp为溶度积常数,计算的结果是沉淀的生成增...1年前查看全部
大家在问
- 1求两个字的笔名 出自古代诗词文言文的那种 最好说明出处和意思 不要太普遍 笔画少一点最好
- 2开学的遐想 500字500字保底,不要太成熟
- 3函数y=2/1x²–lnx的单调递减区间是什么?
- 4no food is permitted for four hours after administration of
- 5已知a+b=6,ab等于5,则a-b=?
- 6北京一度电是0.48元,那20元是多少度电啊?
- 7R-Recommendation 是什么意思
- 8这是他第三次犯那个同样的错误翻译成英文
- 9好像在思考什么.这个成语是什么?
- 10鸭嘴兽的英文介绍,最好配备中文翻译.介绍内容包括它的外表样子,栖息地(澳大利亚哪里,生活的环境),生活习惯(如何捕食,食
- 11升降机由静止开始匀加速上升2s速度达到3m/s,接着匀速运动上升10s,再匀减速上升3s停下来.求:
- 12有主格宾格还有什么
- 13我最好的老师作文350安
- 14已知a,b互为相反数,c,d互为倒数,m的绝对值等于2.求.(1)6-2a-2b+3cd的值 (
- 15一.我发现“之”的意思不一样,我能写出不同的意思



