(2012•宜春模拟)温度为T时,向4L恒容密闭容器中充入2.0molPCl5,反应PCl5(g)⇌PCl3(g)+Cl
 风随云舞2022-10-04 11:39:541条回答
风随云舞2022-10-04 11:39:541条回答| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.32 | 0.38 | 0.40 | 0.40 |
A.保持其他条件不变,升高温度,平衡时c(PCl3)=0.11 mol•L-1,则反应的△H<0
B.反应在前50s的平均速率v(PCl3)=0.0032 mol•L-1•s-1
C.相同温度下,起始时向容器中充入2.0 mol PCl5、0.40 molPCl3和0.40 molCl2,反应达平衡前v(正)>v(逆)
D.相同温度下,起始时向容器中充入4.0 mol PCl3、和4.0 mol Cl2,达到平衡时,PCl3的转化率小于80%

已提交,审核后显示!提交回复
共1条回复
 智加 共回答了18个问题
智加 共回答了18个问题 |采纳率77.8%- 解题思路:A、由表中数据可知,平衡时n(PCl3)=0.4mol,保持其他条件不变,升高温度,平衡时,c(PCl3)=0.11 mol/L,则n′(PCl3)=0.44mol,根据平衡时n(PCl3),判断平衡移动方向,升高温度平衡向吸热反应方向移动;
B、由表中数据可知50s内,△n(PCl3)=0.32mol,根据v=[△c/△t]计算;
C、先求平衡常数K,再求浓度商(Qc),K>Qc,说明平衡向正反应方向移动,K<Qc,说明平衡向逆反应方向移动,K=Qc,说明平衡不移动,据此判断平衡移动;
D、等效为起始加入4.0molPCl5,与原平衡相比,压强增大,平衡向逆反应方向移动,平衡时的PCl5转化率较原平衡低,故平衡时PCl3的物质的量小于0.8mol,即相同温度下,起始时向容器中充入4.0 mol PCl3、和4.0 mol Cl2,达到平衡时,PCl3的物质的量小于0.8mol,参加反应的PCl3的物质的量大于3.2mol,据此判断.A、由表中数据可知,平衡时n(PCl3)=0.4mol,保持其他条件不变,升高温度,平衡时,c(PCl3)=0.11 mol/L,则n′(PCl3)=0.11 mol/L×4L=0.44mol,说明升高温度平衡正向移动,正反应为吸热反应,即△H>O,故A错误;
B、由表中数据可知50s内,△n(PCl3)=0.32mol,v(PCl3)=
0.32mol
4L
50s=0.0016mol/(L•s),故B错误;
C、对于可逆反应:PCl5(g)⇌PCl3(g)+Cl2(g),
开始(mol/L):0.5 0 0
变化(mol/L):0.1 0.1 0.1
平衡(mol/L):0.4 0.1 0.1
所以平衡常数k=[0.1×0.1/0.4]=0.025.
起始时向容器中充入2.0 mol PCl5、0.40 molPCl3和0.40 molCl2,起始时PCl5的浓度为0.5mol/L、PCl3的浓度为0.1mol/L、Cl2的浓度为0.1mol/L,浓度商Qc=[0.1×0.1/0.5]=0.02,K>Qc,说明平衡向正反应方向移动,反应达平衡前v(正)>v(逆),故C正确;
D、等效为起始加入4.0molPCl5,与原平衡相比,压强增大,平衡向逆反应方向移动,平衡时的PCl5转化率较原平衡低,故平衡时PCl3的物质的量小于0.8mol,即相同温度下,起始时向容器中充入4.0 mol PCl3、和4.0 mol Cl2,达到平衡时,PCl3的物质的量小于0.8mol,参加反应的PCl3的物质的量大于3.2mol,故达到平衡时,PCl3的转化率高于80%,故D错误.
故选C.点评:
本题考点: 化学平衡的计算.
考点点评: 本题考查反应速率、平衡常数计算、平衡移动、等效平衡等,难度中等,注意D中使用等效平衡思想分析,使问题简单化,也可以根据平衡常数计算,但比较麻烦. - 1年前
相关推荐
- (2009•宜春一模)四个大小相同的小球分别标有数字1、1、2、2,把它们放在一个盒子中,每次试验均是从中任意摸出两个小
(2009•宜春一模)四个大小相同的小球分别标有数字1、1、2、2,把它们放在一个盒子中,每次试验均是从中任意摸出两个小球记下标号并放回,设它们的标号分别为x、y,记ξ=x+y.
(1)若一次试验中ξ的值为偶数,则称为一次试验中事件A发生了,求五次试验中事件A发生至少四次的概率;
(2)求一次试验中随机变量ξ的分布列及数学期望. 套了套了1年前1
套了套了1年前1 -
 牧神的晚宴 共回答了15个问题
牧神的晚宴 共回答了15个问题 |采纳率80%解题思路:(1)先求出每次试验中事件A发生的概率,然后根据五次试验至少发生四次的概率为P=P5(4)+P5(5),由n次独立重复试验中恰好发生k次的概率公式解之即可;
(2)随机变量ξ的所有取值为2、3、4,根据n次独立重复试验中恰好发生k次的概率公式求出相应的概率,列出分布列,最后根据数学期望公式解之即可.(1)依题意知:每次试验中事件A发生的概率为P=P(ξ=2)+P(ξ=4)=[1/3](3分)
则五次试验至少发生四次的概率:
P=P5(4)+P5(5)=
C45(
1
3)4
2
3+(
1
3)5=[11/243](6分)
(2)随机变量ξ的所有取值为2、3、4.
P(ξ=2)=[1/6];P(ξ=3)=
C12
•C12
6=[2/3];P(ξ=4)=[1/6].(9分)
ξ的分布列是:
ξ 2 3 4
P [1/6] [2/3] [1/6]ξ的数学期望Eξ=2×[1/6]+3×[2/3]+4×[1/6]=3(12分)点评:
本题考点: 离散型随机变量的期望与方差;n次独立重复试验中恰好发生k次的概率.
考点点评: 本题主要考查了离散型随机变量的期望与方差,以及n次独立重复试验中恰好发生k次的概率,同时考查了运算求解的能力,属于基础题.1年前查看全部
- (2013•宜春模拟)下列离子或分子组中能大量共存,且满足相应要求的是( )
(2013•宜春模拟)下列离子或分子组中能大量共存,且满足相应要求的是( )
选项 离子或分子 要求 A K+、NO3-、Cl-、HS- c(K+)<c(Cl-) B Fe3+、NO3-、SO32-、Cl- 滴加盐酸立即有气体产生 C NH4+、Al3+、SO42-、CH3COOH 滴加NaOH溶液立即有气体产生 D Na+、HCO3-、Mg2+、SO42- 滴加氨水立即有沉淀产生
A.A
B.B
C.C
D.D 鱼在雪中游1年前1
鱼在雪中游1年前1 -
 网独雁 共回答了23个问题
网独雁 共回答了23个问题 |采纳率87%解题思路:A.根据电荷守恒定律解题;
B.注意是否能发生氧化还原反应;
C.滴加NaOH会先和醋酸反应;
D.氨水与碳酸氢根反应生成碳酸根.A.根据电荷守恒理论,因为氯离子大于钾离子,导致溶液正负电子不守恒,故A错误;
B.由于Fe3+能够氧化SO32-,所以不能大量共存,故B错误;
C.滴加NaOH会先和醋酸反应,再与其他离子反应,故C错误;
D.滴加氨水开始产生MgCO3沉淀,后产生Mg(OH)2,最后只能Mg(OH)2沉淀,故D正确.
故选D.点评:
本题考点: 离子共存问题.
考点点评: 本题考查离子共存问题,题目难度不大,注意从离子之间能否发生反应生成沉淀、气体、弱电解质、氧化还原反应以及相互促进的水解等角度分析,注意离子反应的先后顺序.1年前查看全部
- (2000•宜春模拟)高锰酸钾中锰元素的化合价是( )
(2000•宜春模拟)高锰酸钾中锰元素的化合价是( )
A.+7
B.+4
C.+2
D.+6 sarun1年前1
sarun1年前1 -
 一诺千千 共回答了15个问题
一诺千千 共回答了15个问题 |采纳率93.3%解题思路:根据在化合物中正负化合价代数和为零,进行解答.根据在化合物中正负化合价代数和为零,K元素化合价为+1,氧元素的化合价为-三,可得KMnO4中锰元素的化合价为:(+1)+x+(-三)×4=c,解答 x=+三;
故选A.点评:
本题考点: 有关元素化合价的计算.
考点点评: 本题考查学生根据在化合物中正负化合价代数和为零计算指定元素化合价的解题能力.1年前查看全部
- (2009•宜春模拟)铁是工农业生产和人们生活离不开的重要金属材料之一.
(2009•宜春模拟)铁是工农业生产和人们生活离不开的重要金属材料之一.
(1)工业上利用高炉炼铁所需原料有铁矿石、焦炭、石灰石,其中,焦炭的作用是 ①______
②______;用一氧化碳和赤铁矿(主要成分氧化铁)反应炼铁的化学方程式Fe2O3+3CO
2Fe+3CO2高温 .Fe2O3+3CO.
2Fe+3CO2高温 .
(2)通过以上方法得到的是生铁,另一种铁合金的名称是______.
(3)为探究铁钉锈蚀条件,一位同学设计了以下实验:
该同学根据以上实验现象得出了铁钉锈蚀是铁与空气中的氧气、水蒸气等发生化学反应的过程.你认为,该同学的以上实验方案是否合理______(填“合理”或“不合理”),理由是______实验一 实验二
实验装置
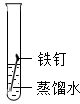
10天后观察到的实验现象 铁钉表面没有明显的锈斑 铁钉表面有明显的锈斑
______.
(4)请举出一个防止铁制品生锈的实例______
______. 心泪雨1年前1
心泪雨1年前1 -
 alsonann 共回答了20个问题
alsonann 共回答了20个问题 |采纳率95%解题思路:(1)根据高炉炼铁的原料及各原料的作用分析即可;炼铁过程中利用一氧化碳可将铁从其氧化物中置换出来;
(2)生铁和钢都是铁的合金;
(3)钢铁生锈的条件是钢铁与氧气和水同时接触;
(4)结合生锈的条件是需要水与氧气的性质解决.(1)炼铁时要用到焦炭,它有两个作用.炼铁时需要高温,焦炭与氧气反应生成二氧化碳,同时放出大量热,可供给炼铁使用;炼铁时还需一氧化碳作还原剂,二氧化碳与过量焦炭反应可以生成一氧化碳.还原剂CO和Fe2O3反应生成铁与二氧化碳,故答案为:①生成还原剂CO,②燃烧放热,维持炉温 Fe2O3+3CO
高温
.
2Fe+3CO2
(2)生铁和钢都是铁的合金,故答案为:钢
(3)钢铁生锈的条件是钢铁与氧气和水同时接触,实验一是铁钉只与水和及少量的氧气接触;实验二是铁钉与水和氧气欧充分接触;还应该在设计一个铁钉与较多量的氧气接触的化学反应,可以在一根试管中放入铁钉和干燥剂,最后堵上橡皮塞做一个对比试验.故答案为:不合理,该实验方案没有能充分说明铁钉锈蚀与空气中的氧气有关,因此,还需要增加一个铁钉锈蚀与空气中的氧气是否有关的对比实验.
(4)金属生锈需要水与氧气,隔绝其中的任何条件都可防锈.故答案为:在久置不用的菜刀表面涂一层植物油;厨房里的铁锅用完后,用水洗净、擦干等点评:
本题考点: 铁的冶炼;探究金属锈蚀的条件;生铁和钢;书写化学方程式、文字表达式、电离方程式.
考点点评: 此题涉及到了工业炼铁的知识以及铁生锈的条件和防止铁生锈的方法,只有同学们熟练掌握相关的知识才能对相关方面的问题做出正确的判断.1年前查看全部
- (2013•宜春模拟)已知a=b-2,则(a-b)2+(b-a)+1的值为______.
 根号三条1年前1
根号三条1年前1 -
 半杯凉咖啡 共回答了17个问题
半杯凉咖啡 共回答了17个问题 |采纳率88.2%解题思路:由a=b-2得到a-b=-2,b-a=2,然后利用整体代入方法计算即可.∵a=b-2,
∴a-b=-2,b-a=2,
∴原式=(-2)2+2+1
=7.
故答案为7.点评:
本题考点: 代数式求值.
考点点评: 本题考查了代数式求值:先把代数式根据已知条件进行变形,然后利用整体思想进行计算.1年前查看全部
- (了tt9•宜春模拟)请设计人个实验,证明乙醇是含有碳元素和氢元素的化合物.提示:
(了tt9•宜春模拟)请设计人个实验,证明乙醇是含有碳元素和氢元素的化合物.提示:
①实验室酒精灯里的酒精是无水乙醇,乙醇燃烧后的产物是4氧化碳和水;
②不考虑酒精灯灯芯的燃烧.
(c)除乙醇外,此实验人定要用到的药品是______;
(了)完成实验报告(请分步骤填写).
实验操作 现象 结论 ______ ______ ______ ______ ______ ______  一只小小鸟08981年前1
一只小小鸟08981年前1 -
 huacuo912 共回答了18个问题
huacuo912 共回答了18个问题 |采纳率100%解题思路:根据检验氢元素常检验生成物中是否有水,检验碳元素常检验生成物中是否有二氧化碳等进行分析.(1)检验二氧化碳的试剂为澄清的石灰水,故需要澄清的石灰水;
(2)根据化学原理,检验氢元素常用干冷的烧杯罩在火焰上方检验是否有水雾,检验二氧化碳常用澄清石灰水检验是否有白色的沉淀.
故答案为:(1)澄清石灰水(C4(OH)2);
(2)
实验操作 现象 结论
1、点燃酒精灯,在酒清灯火焰上方罩j个干冷的烧杯 若烧杯内壁有水珠 乙醇含有氢元素
2、在酒精灯火焰上方罩j个内壁蘸有澄清石灰水的烧杯 若澄清石灰水变浑浊 乙醇含有碳元素点评:
本题考点: 质量守恒定律及其应用;化学实验方案设计与评价;常见气体的检验与除杂方法;二氧化碳的检验和验满.
考点点评: 本题主要考查了如何设计实验证明某种物质中含有哪些元素方面的内容,学生要掌握检验水和二氧化碳的简易方法,检验物质燃烧生成的水用干冷的烧杯,检验二氧化碳用澄清石灰水.1年前查看全部
- 我省宜春某麻纺厂生产的“XX牌”服饰以其美观大方、舒适,为消费者所喜爱.该品牌衬衫的面料成分为“75%苎麻,25%棉”,
我省宜春某麻纺厂生产的“XX牌”服饰以其美观大方、舒适,为消费者所喜爱.该品牌衬衫的面料成分为“75%苎麻,25%棉”,请问:
(1)该衬衫的纤维种类属于______(填“天然纤维”或“合成纤维”).
(2)要检验某服装是否用涤纶制成的该品牌衬衫的假冒产品,简便的方法是:______. 雨伽木1年前1
雨伽木1年前1 -
 bigstoneetp 共回答了15个问题
bigstoneetp 共回答了15个问题 |采纳率93.3%(1)麻和棉都属于天然纤维,故该衬衫的纤维种类属于天然纤维;
(2)因为天然纤维燃烧快,灰烬少;合成纤维燃烧时纤维卷缩,灰烬为黑褐色硬块.故可用灼烧的方法进行鉴别.
故答案为:(1)天然纤维;(2)取面料少许灼烧,燃烧时纤维卷缩,灰烬为黑褐色硬块的是假冒产品;燃烧快、灰烬少且呈浅灰色的是真产品.1年前查看全部
- (2014•宜春模拟)镁是海水中含量较多的金属元素,单质镁、镁合金以及镁的化合物在科学研究和工业生产中用途非常广泛.
(2014•宜春模拟)镁是海水中含量较多的金属元素,单质镁、镁合金以及镁的化合物在科学研究和工业生产中用途非常广泛.
(1)Mg2Ni是一种储氢合金,已知:
Mg(s)+H2(g)═MgH2(s)△H1=-74.5kJ•mol-1
Mg2Ni(s)+2H2(g)═Mg2NiH4(s)△H2=64.4kJ•mol-1
Mg2Ni(s)+2MgH2(s)═2Mg(s)+Mg2NiH4(s)△H3
则△H3═______ kJ•mol-1
(2)工业上可用电解熔融的无水氯化镁获得镁.其中氯化镁晶体脱水是关键的工艺之一.一种正在试验的氯化镁晶体脱水的方法是:先将MgCl2•6H20转化为MgCl2•NH4Cl•nNH3,然后在700℃脱氨得到无水氯化镁,脱氨反应的化学方程式为MgCl2•NH4Cl•nNH3
MgCl2+(n+1)NH3↑+HCl↑700℃ .MgCl2•NH4Cl•nNH3;用惰性电极电解熔融氯化镁,阴极的电极反应式为______
MgCl2+(n+1)NH3↑+HCl↑700℃ .
(3)储氢材料Mg(AlH4)2在110℃-200℃的反应为:Mg(AlH4)2=MgH2+2Al+3H2↑,每生成27gAl转移电子的物质的量为______
(4)镁的一种化合物氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等.为了确定实验室制备的Mg(ClO3)2•6H2O的纯度,做如下试验:
步骤1:准确称量3.50g产品配成100mL溶液.
步骤2:取10mL于锥形瓶中,加入10mL稀硫酸和20mL 1.000mol•L-1的FeSO4溶液,微热.
步骤3:冷却至室温,用0.100mol•L-1 K2Cr2O7溶液滴定至终点,此过程中反应的离子方程式为:Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O.
步骤4:将步骤2、3重复两次,平均消耗K2Cr2O7溶液15.00mL.
产品中Mg(ClO3)2•6H2O的纯度为______(用百分号表示,精确到小数点后一位)
(5)一种有机镁化合物可用于制造光学元件的涂布液,化学式可表示为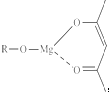 ,它可以发生如下反应:
,它可以发生如下反应: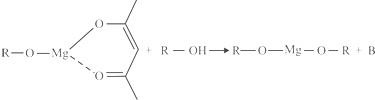
ROH与B的核磁共振氢谱如下图: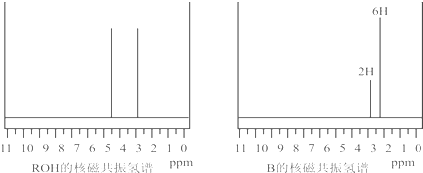
ROH由C、H、O、F四种元素组成的含氟化合物,分子中只有一个氧原子,所有氟原子化学环境相同,相对分子质量为168,则ROH的结构简式为______;B的结构简式为______. kinjili1年前1
kinjili1年前1 -
 zjxinchang 共回答了26个问题
zjxinchang 共回答了26个问题 |采纳率96.2%解题思路:(1)依据热化学方程式和盖斯定律计算得到所需让化学方程式;
(2)先将MgCl2•6H20转化为MgCl2•NH4Cl•nNH3,然后在700℃脱氨得到无水氯化镁,依据原子守恒书写化学方程式;用惰性电极电解熔融氯化镁,阴极上是镁离子得到电子生成镁;
(3)氧化还原反应电子转移守恒计算;
(4)氯酸根离子具有氧化性,可以将亚铁离子氧化为正三价;根据化学反应得出各物质之间的关系式,计算百分含量;
(5)依据反应过程和核磁氢谱分析物质结构.(1)①Mg(s)+H2(g)═MgH2(s)△H1=-74.5kJ•mol-1
②Mg2Ni(s)+2H2(g)═Mg2NiH4(s)△H2=64.4kJ•mol-1
Mg2Ni(s)+2MgH2(s)═2Mg(s)+Mg2NiH4(s)△H3
由盖斯定律②-2×①得到Mg2Ni(s)+2MgH2(s)═2Mg(s)+Mg2NiH4(s)△H3 =64.4KJ/mol-2×(-74.5KJ/mol)=213.4KJ/mol,则△H3=213.4KJ/mol,
故答案为:213.4;
(2)MgCl2•NH4Cl•nNH3,在700℃脱氨得到无水氯化镁,反应的化学方程式MgCl2•NH4Cl•nNH3
700℃
.
MgCl2+(n+1)NH3↑+HCl↑;用惰性电极电解熔融氯化镁,阴极上是镁离子得到电子生成镁,电极反应为:Mg2++2e-=Mg;
故答案为:MgCl2•NH4Cl•nNH3
700℃
.
MgCl2+(n+1)NH3↑+HCl↑;Mg2++2e-=Mg;
(3)储氢材料Mg(AlH4)2在110℃-200℃的反应为:Mg(AlH4)2=MgH2+2Al+3H2↑,反应中生成2molAl转移电子6mol,每生成27gAl转移电子的物质的量为3mol;
故答案为:3mol;
(4)氯酸根离子具有氧化性,可以将亚铁离子氧化为正三价,化学方程式为:ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O,根据化学方程式:ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O以及Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O,可以得出:ClO3-~6Fe2+,Cr2O72-~6Fe2+,用0.100mol•L-1 K2Cr2O7溶液滴定至终点过程可以得出剩余的亚铁离子的物质的量为:0.100mol•L-1×0.015L×6=0.009mol,和氯酸根离子反应的亚铁离子的物质的量为:20×10-3L×1.000mol•L-1-0.009mol=0.011mol,
氯酸根离子的物质的量为:[1/6]×0.011mol,产品中Mg(ClO3)2•6H2O的质量分数:([1/12]×0.011×299g/mol)×10×[1/3.5]×100%=78.3%,
故答案为:78.3%;
(5)ROH由C、H、O、F四种元素组成的含氟化合物,分子中只有一个氧原子,核磁氢谱表示含有2个氢原子,所有氟原子化学环境相同,说明在一个碳原子上,相对分子质量为168,则ROH的结构简式为(CF3)2CHOH;依据反应过程化学键断裂位置分析判断生成产物B的结构简式为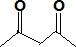 ,
,
故答案为: .
.点评:
本题考点: 反应热和焓变;电解原理;制备实验方案的设计.
考点点评: 本题考查对常见金属元素及其化合物主要性质的掌握,主要是氧化还原反应,电子转移计算,滴定实验步骤和含量的计算分析,有机物结构和反应过程分析是解题关键,题目难度中等.1年前查看全部
- (2012•宜春模拟)以色列科学家发现准晶体,独享2011年诺贝尔化学奖.已知的准晶体都是金属互化物.人们发现组成为铝-
(2012•宜春模拟)以色列科学家发现准晶体,独享2011年诺贝尔化学奖.已知的准晶体都是金属互化物.人们发现组成为铝-铜-铁-铬的准晶体具有低摩擦系数、高硬度、低表面能,正被开发为炒菜锅的镀层.下列说法正确的是( )
A.已知的准晶体是离子化合物
B.已知的准晶体中含有非极性键
C.合金的硬度一般比各组份金属的硬度更低
D.准晶体可开发成为新型材料 linguozhu1年前1
linguozhu1年前1 -
 lee106719 共回答了23个问题
lee106719 共回答了23个问题 |采纳率91.3%解题思路:由准晶体都是金属互化物,说明该准晶体为合金,为金属晶体,含有金属键,该晶体具有较高的硬度,是一种新型材料.A.已知的准晶体都是金属互化物,为金属晶体,不存在离子键,故A错误;
B.已知的准晶体都是金属互化物,不存在非极性键,为金属晶体,含有金属键,故B错误;
C.由题给信息可知,该晶体为合金,具有较高的硬度,故C错误;
D.该晶体具有低摩擦系数、高硬度、低表面能的特点,为新型材料,具有开发为新材料的价值,故D正确.
故选D.点评:
本题考点: 晶体的类型与物质熔点、硬度、导电性等的关系.
考点点评: 本题考查晶体的知识,题目难度不大,注意把握题给信息是解答该题的关键.1年前查看全部
- (2009•宜春一模)随机变量ζ~N(μ,σ2),若P(ζ<2)=a且p(ζ<10)=1-a,其中a∈(0,1),则μ的
(2009•宜春一模)随机变量ζ~N(μ,σ2),若P(ζ<2)=a且p(ζ<10)=1-a,其中a∈(0,1),则μ的值为______.
 大写1231年前1
大写1231年前1 -
 燕子622 共回答了12个问题
燕子622 共回答了12个问题 |采纳率100%解题思路:利用正态曲线的对称性,可得曲线的对称轴是直线x=μ,由此可得结论.∵ζ~N(μ,σ2),
∴曲线的对称轴是直线x=μ,
∵p(ζ<10)=1-a
∴p(ζ>10)=a
又∵P(ζ<2)=a
∴μ=[2+10/2]=6
故答案为:6点评:
本题考点: 正态分布曲线的特点及曲线所表示的意义.
考点点评: 题考查正态分布曲线的特点及曲线所表示的意义,主要考查正态曲线的对称性,是一个基础题.1年前查看全部
- (2009•宜春模拟)已知A、E是碱,X、Y是酸,其余的物质都是盐,G是不溶于稀硝酸的白色沉淀,它们之间的转化关系如下图
(2009•宜春模拟)已知A、E是碱,X、Y是酸,其余的物质都是盐,G是不溶于稀硝酸的白色沉淀,它们之间的转化关系如下图所示.

请回答:
(1)写出有关物质的化学式:A______;F______.
(2)写出下列反应的化学方程式:
A+B:______;
D+F:______. 爱唱反调1年前1
爱唱反调1年前1 -
 廖无墨的红袖 共回答了17个问题
廖无墨的红袖 共回答了17个问题 |采纳率94.1%(1)A是碱,X是酸,A与Y能反应生成不溶于稀硝酸的白色沉淀G,故G是硫酸钡,A是氢氧化钡,X是硫酸,常见的酸还有盐酸,所以Y可能为盐酸,常见的碱还有氢氧化钠,所以E可能是氢氧化钠,则氢氧化钠能与硫酸反应生成F为硫酸钠,所以本题答案为:Ba(OH)2,Na2SO4;
(2)根据框图,C与盐酸反应生成的D能与硫酸钠反应生成硫酸钡,所以C中含钡离子,能与盐酸反应,故C可能为碳酸钡,那么与盐酸反应生成的D为氯化钡,氢氧化钡可与B反应生成碳酸钡和氢氧化钠,故B为碳酸钠,故A+B的反应为氢氧化钡与碳酸钠的反应,D+F的反应为氯化钡与硫酸钠的反应,所以本题答案为:Ba(OH)2+Na2CO3═BaCO3↓+2NaOH,
BaCl2+Na2SO4═BaSO4↓+2NaCl.1年前查看全部
- (2013•宜春模拟)小明利用自己的零花钱,为灾区小学的同学购买学习用品,了解到某商店每个书包价格比每本词典多10元.用
(2013•宜春模拟)小明利用自己的零花钱,为灾区小学的同学购买学习用品,了解到某商店每个书包价格比每本词典多10元.用180元恰好可以买到4个书包和3本词典.
(1)每个书包和每本词典的价格各是多少元?
(2)小明计划用600元为灾区25位学生每人购买一件学习用品(一个书包或一本词典)后.余下不少于6O元的钱购买体育用品.共有哪几种购买书包和词典的方案? 0or11年前1
0or11年前1 -
 xinhzhe 共回答了17个问题
xinhzhe 共回答了17个问题 |采纳率82.4%解题思路:(1)设每个书包的价格为x元,则每本词典的价格为(x-10)元,根据用180元恰好可以买到4个书包和3本词典,列出方程,求出方程的解即可;
(2)设购买书包y个,则购买词典(25-y)本,根据计划用600元为灾区25位学生每人购买一件学习用品(一个书包或一本词典)后,余下不少于6O元的钱购买体育用品,列出不等式,求出不等式的解集,即可得出购买方案.(1)设每个书包的价格为x元,则每本词典的价格为(x-10)元,根据题意得:
4x+3(x-10)=180,
解得:x=30,
∴x-10=20;
答:每个书包的价格为30元,每本词典的价格为20元.
(2)设购买书包y个,则购买词典(25-y)本,根据题意得:
600-[30y+20(25-y)]≥60;
解得:y≤4.
因为y取非负整数,所以y的值为0或1或2或3或4.
所以有五种购买方案,分别是:
①书包0个,词典25本;
②书包1个,词典24本;
③书包2个,词典23本;
④书包3个,词典22本;
⑤书包4个,词典21本.点评:
本题考点: 一元一次不等式的应用;一元一次方程的应用.
考点点评: 此题考查了一元一次方程的应用,解题的关键是读懂题意,找出之间的数量关系,列出不等式求出不等式的解集,注意y只能取正整数.1年前查看全部
- (2014•宜春模拟)在自然条件下,二倍体植物(2n=4)形成四倍体植物的过程如图所示.下列说法正确的是( )
(2014•宜春模拟)在自然条件下,二倍体植物(2n=4)形成四倍体植物的过程如图所示.下列说法正确的是( )
A.减数分裂失败一定发生在减数第二次分裂
B.二倍体植物与四倍体植物存在生殖隔离现象
C.二倍体植物经长期的地理隔离才能形成四倍体植物
D.测定四倍体植物基因组的全部DNA序列时只需测4条染色体 ttds021年前1
ttds021年前1 -
 天使的唇 共回答了21个问题
天使的唇 共回答了21个问题 |采纳率95.2%解题思路:据图分析,二倍体植株减数分裂失败形成的异常配子中含有2个染色体组,自花授粉形成受精卵中含有4个染色体组,发育形成四倍体.A、减数分裂失败既可以发生在减数第一次分裂也可以发生在减数第二次分裂,A错误;
B、二倍体植物与四倍体植物杂交后代为三倍体,三倍体联会紊乱不可育,二者间存在生殖隔离现象,B正确;
C、二倍体植物染色体加倍才能形成四倍体植物,不一定需要地理隔离,C错误;
D、测定四倍体植物基因组的全部DNA序列时只需测定2条染色体,D错误.
故选:B.点评:
本题考点: 染色体组的概念、单倍体、二倍体、多倍体.
考点点评: 本题考查染色体组、生物进化、基因组计划等相关知识,意在考查学生的识图和理解能力,属于中档题.1年前查看全部
- (2009•宜春模拟)下列反应属于分解反应的是( )
(2009•宜春模拟)下列反应属于分解反应的是( )
A.木炭在氧气中燃烧
B.铝与硫酸铜反应
C.将石灰石煅烧制得氧化钙
D.用大理石与稀盐酸反应制取二氧化碳 laoqu1年前1
laoqu1年前1 -
 大白狗 共回答了18个问题
大白狗 共回答了18个问题 |采纳率88.9%解题思路:分解反应是一种物质发生化学变化生成多种物质的反应,特征是“一变多”A、木炭燃烧是碳与氧气生成二氧化碳的反应,是化合反应,故此选项错误.
B、铝与硫酸铜反应是单质与化合物生成单质与化合物的反应,是置换反应,故此选项错误.
C、石灰石高温煅烧会生成二氧化碳与氧化钙,符合分解反应的“一变多”特征,故此选项正确.
D、大理石与盐酸是两种物质反应,不是分解反应,故此选项错误.
故选C点评:
本题考点: 分解反应及其应用.
考点点评: 此题是对分解反应类型的考查,解题的重点是抓住“一变多”的分解反应特性,属基础性知识考查题.1年前查看全部
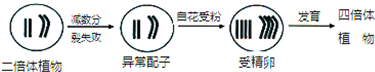
- (2014•宜春模拟)全钒流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如图所示,
 (2014•宜春模拟)全钒流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如图所示,其中H+的作用是参与正极反应,并通过交换膜定向移动使右槽溶液保持电中性.下列有关说法不正确的是( )
(2014•宜春模拟)全钒流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如图所示,其中H+的作用是参与正极反应,并通过交换膜定向移动使右槽溶液保持电中性.下列有关说法不正确的是( )
A.放电时当左槽溶液逐渐由黄变蓝,其电极反应式为:VO2++e-+2H+═VO2++H2O
B.充电时若转移的电子数为3.01×1023个,左槽溶液中n(H+)的变化量为1.0mol
C.充电时,H+由左槽定向移动到右槽
D.充电过程中,右槽溶液颜色逐渐由绿色变为紫色 lx1681981年前1
lx1681981年前1 -
 两把鼻涕两把眼泪 共回答了20个问题
两把鼻涕两把眼泪 共回答了20个问题 |采纳率80%解题思路:A.当左槽溶液逐渐由黄变蓝,V元素的化合价由+5价变为+4价,该电极上得电子发生还原反应;
B.充电过程中,右槽为阴极,V元素化合价由+3价变为+2价;
C.充电时,氢离子向阴极移动;
D.充电时,若转移的电子数为3.01×1023个即物质的量为0.5mol,根据转移电子和氢离子的物质的量之间的关系式判断.A.当左槽溶液逐渐由黄变蓝,V元素的化合价由+5价变为+4价,该电极上得电子发生还原反应,电极反应式为VO2++2H++e-=VO2++H2O,故A正确;
B.充电时,左槽发生的反应为VO2++H2O═VO2++2H++e-,当转移电子为3.01×1023个即为0.5mol电子时,生成氢离子为1mol,此时氢离子参与正极反应,通过交换膜定向移动使电流通过溶液,溶液中离子的定向移动可形成电流,通过0.5mol电子,则左槽溶液中n(H+)的变化量为1mol-0.5mol=0.5mol,故B错误;
C.放电时,该装置为原电池,左槽作正极,右槽作负极,充电过程中,右槽为阴极,H+可以通过质子交换膜向右移动,故C正确;
D.充电过程中,右槽为阴极,V元素化合价由+3价变为+2价,所以右槽溶液颜色逐渐由绿色变为紫色,故D正确;
故选B.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了化学电源新型电池,根据充放电时各个电极上得失电子来分析解答,难点是电极反应式的书写,要根据电解质溶液酸碱性书写,难度中等.1年前查看全部
- (2013•宜春模拟)下列有关说法正确的是( )
(2013•宜春模拟)下列有关说法正确的是( )
A.同种元素的原子均有相同的质子数和中子数
B.IA族金属元素是同周期中金属性最强的元素
C.ⅦA族元素的阴离子还原性越强,其最高价氧化物对应水化物的酸性越强
D.2SO2(g)+O2(g)═2SO3(g)和4SO2(g)+2O2(g)═4SO3(g)的△H相等 adl0859101年前1
adl0859101年前1 -
 qijiandon 共回答了8个问题
qijiandon 共回答了8个问题 |采纳率75%解题思路:A.同种元素的原子均有相同的质子数,而中子数不同;
B.同周期中从左向右金属性减弱;
C.ⅦA族元素的阴离子还原性越强,对应非金属性越弱;
D.△H与热化学反应中的化学计量数有关.A.同种元素的原子均有相同的质子数,而中子数不同,如H、D、T,故A错误;
B.同周期中从左向右金属性减弱,则IA族金属元素是同周期中金属性最强的元素,故B正确;
C.ⅦA族元素的阴离子还原性越强,对应非金属性越弱,则最高价氧化物对应水化物的酸性越弱,故C错误;
D.△H与热化学反应中的化学计量数成正比,则2SO2(g)+O2(g)═2SO3(g)和4SO2(g)+2O2(g)═4SO3(g)的△H不等,故D错误;
故选B.点评:
本题考点: 元素周期表的结构及其应用;质量数与质子数、中子数之间的相互关系;反应热和焓变.
考点点评: 本题考查较综合,涉及元素周期表的结构及应用、元素性质变化规律及反应热,为高频考点,注重高频考点的考查,选项D为解答的易错点,题目难度不大.1年前查看全部
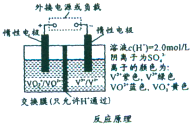
- (2014•宜春模拟)某植物(其叶片如图1所示)放在黑暗中两天后,根据图2所示,处理其中一片叶片.然后将整株植物置于阳光
(2014•宜春模拟)某植物(其叶片如图1所示)放在黑暗中两天后,根据图2所示,处理其中一片叶片.然后将整株植物置于阳光下4小时,取该叶片经酒精脱色处理后,滴加碘液(棕黄色)显色,下列有关该实验结果和现象的描述正确的是( )
①X和Y两部分对照能证明光合作用需要水 ②Y和木塞夹着的叶片部分对照能证明光合作用需要光
③实验后的结果显示出X为蓝色,Y为棕黄色④w和x两部分对照能证明光合作用需要叶绿素等色素.
A.③④
B.①③
C.②④
D.①② richardmyh1年前1
richardmyh1年前1 -
 yishenyouni 共回答了20个问题
yishenyouni 共回答了20个问题 |采纳率95%解题思路:本题主要考查了光合作用的过程.
光合作用是指绿色植物通过叶绿体,利用光能把二氧化碳和水转变成储存着能量的有机物,并释放出氧气的过程.光合作用的光反应阶段(场所是叶绿体的类囊体膜上):水的光解产生[H]与氧气,以及ATP的形成.光合作用的暗反应阶段(场所是叶绿体的基质中):CO2被C5固定形成C3,C3在光反应提供的ATP和[H]的作用下还原生成糖类等有机物.
将植物放在黑暗中两天的目的是消耗掉叶片中原有的淀粉;碱石灰的作用是吸收CO2.X和Y两部分对照实验能证明光合作用需要CO2,Y和木塞夹着的叶片部分因无CO2都不能完成光合作用合成有机物.①X和Y两部分的单一变量是有无CO2,所以该对照实验能证明光合作用需要CO2,而不是水,①错误;
②Y和木塞夹着的叶片部分有两个变量,即CO2和光,所以该实验不能证明光合作用需要光,②错误;
③X部分有CO2,能正常进行光合作用合成淀粉,用碘液检测显示为蓝色;Y部分没有CO2,不能正常进行光合作用合成淀粉,用碘液检测显示为棕黄色(碘液的颜色),③正确;
④W和X两部分的单一变量是有无叶绿素,所以该对照实验能证明光合作用需要叶绿素,④正确.
所以③④正确.
故选:A.点评:
本题考点: 光反应、暗反应过程的能量变化和物质变化.
考点点评: 本题主要考查学生的析图能力,实验分析能力和理解能力.光合作用需要光照,没有光照就没有光合作用.呼吸作用不需要光照,在有光和无光的时候都能进行.在实验设计时要注意两个原则:对照原则和单一变量原则.在实验中还要保证无光变量相同且适宜,要减少无关变量的干扰.1年前查看全部
- (2014•宜春模拟)某研究性学习它组在网上搜集到信息:钾、钙、钠、镁等活泼金属能在CO2气体着燃烧.他们对钠在CO2气
(2014•宜春模拟)某研究性学习它组在网上搜集到信息:钾、钙、钠、镁等活泼金属能在CO2气体着燃烧.他们对钠在CO2气体着燃烧进行了下列实验:
(1)要熄灭燃烧的钠,可以选用的物质是______(填字母)操作过程 实验现象 将干燥的玻璃燃烧匙着燃烧的钠迅速
伸入到盛有装满CO2的集气瓶着钠在盛有CO2的集气瓶着继续燃烧 反应后冷却 集气瓶底附着黑色颗粒,瓶壁上附着有白色
物质
a.水多.泡沫灭火剂c.干沙土二.二氧化碳
(2)该它组同学对瓶壁上的白色物质的成分进行讨论并提出假设
Ⅰ.白色物质是Na2O;
Ⅱ.白色物质是Na2COy;
Ⅲ.白色物质还可能是______
(y)
①通过对上述实验的分析,你认为上述三y假设着,______成立.实验步骤 实验现象 ①取少量白色物质于试管着,加入适量水,振荡,样品全
部溶于水,向其着加入过量的CaC左2溶液出现白色沉淀 ②静置片刻,取上层清液于试管着,滴加无色酚酞试液 无明显现象
多.按下表内要求讲行操作;
c.将上述8支试管放人y7℃水浴,保温17分钟:试管1 试管2 试管y 试管4 蒸馏水 1.7 1.7 1.7 A Ph=8缓冲液 0.7 0.7 0.7 0.7 淀粉溶液 1 1 1 1 甲生物提取液 0.y 乙生物提取液 0.y 丙生物提取液 0.y 总体积 y.y y.y y.y 多
二.在上述8支试管冷却后滴入碘液:
e.观察比较实验组的三支试管与对照组试管的颜色及其深浅;
实验结果如下(注:“+”显色,“++”显色更深;“一”不显色).
请分析回答下列问题:试管1 试管2 试管y 试管4 颜色深浅程度 ++ + - C  (1)表着A的数值为______,C的颜色深浅程度最可能为______(用“+”或“一”表示).
(1)表着A的数值为______,C的颜色深浅程度最可能为______(用“+”或“一”表示).
(2)该实验的自变量是______,无关变量除了各组间pH、温度外,还可以有______(写出2种即可).
(y)除了用碘液检验淀粉的剩余量来判断实验结果外,还可以用______试剂来检测生成物的量.若用该试剂检验,颜色变化最深的试管是______.
(4)根据上述结果得出的结论是:不同来源的淀粉酶,虽然酶浓度相同,但活性不同.造成实验着三种酶活性差异的根本原因是______.
(7)同学们还做了反应速率与底物浓度关系的实验.在图着坐标着已根据实验结果画出y号试管着酶活性的曲线,请你在坐标着画出2号试管着酶活性的曲线. l8274958771年前1
l8274958771年前1 -
 夜舞樱花 共回答了17个问题
夜舞樱花 共回答了17个问题 |采纳率94.1%解题思路:(1)根据题干信息来分析,金属钠是一种活泼金属,用来灭火的物质和金属钠之间不能反应.
(2)白色固体还可能是氧化钠与碳酸钠的混合物;
(3)①氧化钠能与水反应生成氢氧化钠,氢氧化钠不能与氯化钙反应;
b该实验的目的是比较甲、乙、丙三种微生物所产生的淀粉酶的活性,因而实验的自变量是不同的淀粉酶,其他如PH、温度、提取液的量和浓度都为无关变量,应相同且适宜.四组实验中试管4为对照,从结果可推测三种酶的活性大小的关系为乙>丙>甲,即试管2中淀粉酶的活性最高,其次是试管3、试管1,试管4的颜色最深应为+++(或多于+++).淀粉酶的化学本质是蛋白质,是由基因决定的.实验结果是用碘液检测分解后的淀粉量,也可以用斐林试剂检测淀粉分解的产物.(1)a.钠和水能反应生成可燃性气体氢气,所以水不能灭火,故错误;
b.金属钠在二氧化碳中能燃烧,泡沫灭火器喷出的泡沫中含有大量水分,水能与钠反应生成可燃性气体氢气,所以不能用泡沫灭火器灭火,故错误;
c.干沙土能隔绝空气,所以细沙土能灭火,故正确;
d.金属钠在二氧化碳中能燃烧,不能用二氧化碳灭火,故错误;
故答案为:c
(2)钠在二氧化碳中燃烧这一化学反应的反应物中只含有钠元素、碳元素和氧元素,没有氢元素,可能生成氧化钠或碳酸钠或二者的混合物;
故答案为:九a2O和九a2CO九的混合物;
(九)①氧化钠能与水反应生成氢氧化钠,氢氧化钠不能与氯化钙溶液反应产生白色沉淀,且其水溶液显碱性,碳酸钠能与氯化钙反应生成氯化钠和碳酸钙白色沉淀,故Ⅱ成立;
故答案为:Ⅱ
b(1)实验设计应遵循单一变量原则,5支试管中溶液的总体积为九.九,所以A的数值为九.九-b.5-1=1.8.5组实验中试管c为对照,从结果可推测三种酶的活性大小的关系为乙>丙>甲,即试管2中淀粉酶的活性最高,其次是试管九、试管1,试管c的颜色最深应为+++(或多于+++).
故答案为:1.8;+++(或多于+++)
(2)该实验的目的是比较甲、乙、丙三种微生物所产生的淀粉酶的活性,因而实验的自变量是不同的淀粉酶,其他如9H、温度、提取液的量和浓度都为无关变量,应相同且适宜.
故答案为:不同来源的淀粉酶;各组间9H、温度、提取液的量和浓度、淀粉溶液的量和浓度等;
(九)实验结果是用碘液检测分解后的淀粉量,也可以用斐林试剂检测淀粉分解的产物.5组实验中试管c为对照,从结果可推测试管2中淀粉酶的活性最高.
故答案为:斐林试剂;试管2;
(c)淀粉酶的化学本质是蛋白质,是由基因决定的,所以三种酶活性差异的根本原因是决定这三种酶的D九A(基因)不同,
故答案为:决定这三种酶的D九A(基因)不同;
(5)三种酶的活性大小的关系为乙>丙>甲,即2号试管的酶活性高于九号试管,所以九号试管的反应速率高于九号试管,曲线如图: ,故答案为:
,故答案为: .
.点评:
本题考点: 性质实验方案的设计.
考点点评: 本题有一定的综合性,考查了判断物质种类的方法及检验物质的方法,这就要求学生记住一些常见性质,同时也要学会设计一些简单实验判定物质种类;本题b以淀粉酶为素材,考查实验设计及分析,意要考查理解所学知识要点,把握知识间内在联系的能力;具备验证简单生物学事实的能力,并能对实验现象和结果进行解释、分析和处理能力.1年前查看全部
- (2011•宜春)脊髓灰质炎疫苗可以预防小儿麻痹症,这种免疫属于( )
(2011•宜春)脊髓灰质炎疫苗可以预防小儿麻痹症,这种免疫属于( )
①非特异性免疫②特异性免疫③自然免疫④计划免疫.
A.①③
B.②③
C.①④
D.②④ yh2004751年前1
yh2004751年前1 -
 zzf_exw01 共回答了24个问题
zzf_exw01 共回答了24个问题 |采纳率87.5%解题思路:疫苗是由低毒的、灭活的病原体制成的生物制品.接种疫苗能产生免疫力,有效的预防某种传染病,据此作答.由分析可知给小儿服用的小儿麻痹疫苗糖丸是由病原体制成的,只不过经过处理之后,其毒性减少或失去了活性,但依然是病原体,进入人体后不会使人得病,但能刺激免疫细胞产生相应的抗体,则这种疫苗相当于抗原,其产生的抗体只对引起小儿麻痹症的病原体起作用,对其他病原体无效,可见其免疫作用是特定的,有针对性的,属于特异性免疫.而计划免疫是指根据某些传染病的发生规律,将各种安全有效的疫苗,按照科学免疫的程序,有计划地给儿童接种,以达到预防、控制和消灭相应传染病的目的,脊髓灰质炎疫苗可以预防小儿麻痹症,像这种有计划的进行预防接种,叫计划免疫.
故选:D点评:
本题考点: 人体特异性免疫和非特异性免疫;计划免疫及其意义.
考点点评: 了解疫苗的相关知识,掌握接种疫苗产生免疫力的原理,结合题意,即可正确答题.1年前查看全部
- (2014•宜春模拟)已知函数f(x)=xn+1(n∈N*)的图象与直线x=1交于点P,若函数f(x)的图象在点P处的切
(2014•宜春模拟)已知函数f(x)=xn+1(n∈N*)的图象与直线x=1交于点P,若函数f(x)的图象在点P处的切线与x轴交点的横坐标为xn,则log2014x1+log2014x2+…+log2014x2013的值为______.
 elaine120312031年前1
elaine120312031年前1 -
 reheoo 共回答了18个问题
reheoo 共回答了18个问题 |采纳率94.4%解题思路:由题意可得P(1,1),f′(x)=(n+1)xn,根据导数的几何意义可求切线的斜率k,进而可求切线方程,切线方程,在方程中,令y=0可得,xn=[n/n+1],利用累乘可求x1x2…x2013=[1/2]•[2/3]•[3/4]•…•[2013/2014]=[1/2014],代入可求出答案.由题意可得P(1,1)
对函数f(x)=xn+1求导可得,f′(x)=(n+1)xn
∴y=f(x)在点P处的切线斜率K=f′(1)=n+1,切线方程为y-1=(n+1)(x-1)
令y=0可得,xn=[n/n+1].
∴x1x2…x2013=[1/2]•[2/3]•[3/4]•…•[2013/2014]=[1/2014],
∴log2014x1+log2014x2+log2014x3+…log2014x2013=log2014(x1x2…x2013)=log2014[1/2014]=-1.
故答案为:-1.点评:
本题考点: 利用导数研究曲线上某点切线方程.
考点点评: 本题主要考查了导数的几何意义的应用,累乘及对数的运算性质的综合应用,还考查了基本运算的能力.1年前查看全部
- (2009•宜春模拟)2008年5月12日,我国汶川发生大地震.全国人民“众志成城,抗震救灾”.
(2009•宜春模拟)2008年5月12日,我国汶川发生大地震.全国人民“众志成城,抗震救灾”.
(1)“拯救生命是第一位的”.为搜救埋在废墟下的幸存者,调用了许多搜救犬.搜救犬能根据人体发出的气味发现幸存者.从微观的角度分析搜救犬能发现幸存者的原因是BCBC.
A.分子的质量很小;B.不同分子性质不同;C.分子不断运动;D.分子间有间隔
(2)地震中许多原有的水源被破坏.新水源需检测和处理后才能成为饮用水.我国规定水质必须在感官性指标、化学指标、病理学指标等方面均达标方可成为生活饮用水.
①感官性指标中有一项要求为:不得含有肉眼可见物,水应澄清透明.为达到此要求,净化水时,可以通过加入絮凝剂凝聚、沉降,然后通过过滤过滤(填操作名称)而实现.
②化学指标中含有水源的pH和硬度两项.
测定液体pH的方法是把pH试纸放于玻璃片上,用玻璃棒蘸取待测液体滴到pH试纸上,再与比色卡对照把pH试纸放于玻璃片上,用玻璃棒蘸取待测液体滴到pH试纸上,再与比色卡对照.
日常生活中如何区分硬水与软水?请简述实验步骤与现象:加肥皂水振荡,若出现较多泡沫为软水,否则为硬水加肥皂水振荡,若出现较多泡沫为软水,否则为硬水.
③病理学指标中对细菌的含量有严格的限制.要杀灭细菌可以向水中加入漂白粉漂白粉等消毒剂,也可以通过蒸馏蒸馏操作,既杀灭细菌,又能得到几乎纯净的水.
(3)为防止灾后疫情的发生,某医疗小分队用溶质质量分数为0.5%的过氧乙酸溶液对灾民的居住环境进行消毒.要配制溶质质量分数为0.5%的过氧乙酸溶液300kg,需溶质质量分数为15%的过氧乙酸溶液1010kg,配制的主要步骤是:计算计算、称量(量取)称量(量取)、溶解(稀释)溶解(稀释). wuyu_87781年前1
wuyu_87781年前1 -
 cngdgz 共回答了19个问题
cngdgz 共回答了19个问题 |采纳率89.5%解题思路:不同的分子性质不同,分子是不断运动的,过滤可以除去不溶性的颗粒,用PH试纸可以测定溶液的酸碱度,蒸馏、消毒都是净化水的方法,加水稀释溶液时,稀释前后溶质的质量不变.(1)分子不同,性质也不同,分子是不断运动的.故填:B、C
(2)过滤可以除去不溶性的颗粒.故填:①过滤
②用pH试纸测定溶液的pH方法是:把pH试纸放于玻璃片上,用玻璃棒蘸取待测液体滴到pH试纸上,再与比色卡对照.
区分硬水和软水的方法是:加肥皂水振荡,若出现较多泡沫为软水,否则为硬水.
③可以消毒的物质有漂白粉或氯气、二氧化氯和臭氧等,一种即可故填:漂白粉;
蒸馏可以得到几乎纯净的水.故填:蒸馏.
(3)设需溶质质量分数为15%的过氧乙酸溶液 的质量为X
300kg×0.5%=15%X
X=10kg
答:需溶质质量分数为15%的过氧乙酸溶液 的质量为10kg.
配制的主要步骤是:计算、称量(量取)、溶解(稀释).点评:
本题考点: 水的净化;一定溶质质量分数的溶液的配制;过滤的原理、方法及其应用;硬水与软水;有关溶质质量分数的简单计算;溶液的酸碱性测定;微粒观点及模型图的应用.
考点点评: 本题主要考查了微观粒子的特征、净化水的方法及其相关方面计算的内容.完成此题,可以依据题干提供的信息结合已有的知识进行.1年前查看全部
- (2009•宜春一模)已知方程f(x)=x2+ax+2b的两根分别在(0,1),(1,2)内,则f(3)的取值范围(
(2009•宜春一模)已知方程f(x)=x2+ax+2b的两根分别在(0,1),(1,2)内,则f(3)的取值范围( )
A.(2,3)
B.(2,6)
C.(3,6)
D.(2,8) 梦亮了1年前0
梦亮了1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- (2013•宜春模拟)过节时,我们经常可以看到带有“福”、“寿”、“爱”等字迹,或者带有美丽图案的“艺术苹果”.“艺术苹
(2013•宜春模拟)过节时,我们经常可以看到带有“福”、“寿”、“爱”等字迹,或者带有美丽图案的“艺术苹果”.“艺术苹果”的形成通常采用苹果长到成熟初期时贴纸的方法.下列关于“艺术苹果”的叙述,不正确的是( )
A.“艺术苹果”供我们食用的部分是由子房壁发育而来
B.将“艺术苹果”的种子播种后,也能长出艺术苹果
C.“艺术苹果”有字和图案的部分,也能进行呼吸作用
D.给“艺术苹果”成熟初期贴纸时,应选择不透光的黑纸 慕小鱼1年前1
慕小鱼1年前1 -
 黄加索 共回答了16个问题
黄加索 共回答了16个问题 |采纳率93.8%解题思路:苹果属于果实,由果皮和种子组成,果皮由子房壁发育而成,当苹果进入成熟期时,人们就用不透光的黑色纸,精心地剪制成各种各样的字样,贴在苹果向阳的一面上.由于被黑色纸遮住的地方阳光照射不到,不能进行光合作用,同时,花青素的形成也会受到一定的影响,并且还产生了其它的颜色,比如黄色,而没有被黑色纸遮住的地方,因为阳光充足,花青素增多,生长速度教快,就会形成红色.这样,撕掉黑色纸后,一个长成有黄色艺术字的苹果.A、“艺术苹果”供我们食用的部分属于果皮,是由子房壁发育而来,A正确.
B、将“艺术苹果”的种子播种后,不能长出艺术苹果,“艺术苹果”的形成通常采用苹果长到成熟初期时贴纸的方法,B错误;
C、生物体中的活细胞都能进行呼吸作用,“艺术苹果”有字和图案的部分,也能进行呼吸作用,故C正确;
D、苹果成熟初期,在向阳面贴上不透光的黑纸,就可在苹果成熟后形成艺术字苹果,D正确.
故选B.点评:
本题考点: 光合作用的概念.
考点点评: 明确植物呼吸作用及果实和种子的形成过程即能正确答题.1年前查看全部
- (2014•宜春模拟)如图所给的程序运行结果为S=35,那么判断框中应填入的关于k的条件是( )
(2014•宜春模拟)如图所给的程序运行结果为S=35,那么判断框中应填入的关于k的条件是( )
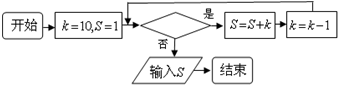
A.k=7
B.k≤6
C.k<6
D.k>6 zpjzpjzpj1年前1
zpjzpjzpj1年前1 -
 wuming309 共回答了16个问题
wuming309 共回答了16个问题 |采纳率87.5%解题思路:根据程序,依次进行运行得到当S=35时,满足的条件,即可得到结论.当k=10时,S=1+10=11,k=9,
当k=9时,S=11+9=20,k=8,
当k=8时,S=20+8=28,k=7,
当k=7时,S=28+7=35,k=6,
此时不满足条件输出,
∴判断框中应填入的关于k的条件是k>6,
故选:D.点评:
本题考点: 程序框图.
考点点评: 本题主要考查程序框图的识别和判断,依次将按照程序依次进行运行即可.1年前查看全部
- (2913•宜春模拟)已知一次函数y=x-1地图象与反比例函数y=kx地图象地一个交点是(-1,b),则反比例函数地解析
(2913•宜春模拟)已知一次函数y=x-1地图象与反比例函数y=
地图象地一个交点是(-1,b),则反比例函数地解析式是k x y=[2/x]y=[2/x]. love-ypgl1年前1
love-ypgl1年前1 -
 金永 共回答了17个问题
金永 共回答了17个问题 |采纳率94.1%解题思路:将交点坐标代入一次函数解析式求出b的值,确定出交点坐标,代入反比例解析式求出k的值,即可确定出反比例解析式.将(-1,b)代入y=2-1小得:b=-1-1=-2,即(-1,-2),
将2=-1,y=-2代入y=[k/2]小得:k=2,
则反比例解析式为y=[2/2].
故答案为:y=[2/2]点评:
本题考点: 反比例函数与一次函数的交点问题.
考点点评: 此题考查了反比例函数与一次函数的交点问题,利用了待定系数法,熟练掌握待定系数法是解本题的关键.1年前查看全部
- (2010•宜春)果园农艺师通过人工授粉,将毛桃的花粉授到未授粉的水蜜桃花柱头上,结出的桃子味道是( )
(2010•宜春)果园农艺师通过人工授粉,将毛桃的花粉授到未授粉的水蜜桃花柱头上,结出的桃子味道是( )
A.毛桃味
B.水蜜桃味
C.两种口味均有
D.以上都不对 鸭王之王XTF1年前0
鸭王之王XTF1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- (2014•宜春模拟)下列说法正确的是( )
(2014•宜春模拟)下列说法正确的是( )
A.按系统命名法,有机物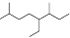 可命名为3,7-二甲基-4-乙基辛烷
可命名为3,7-二甲基-4-乙基辛烷
B.环己醇分子中所有的原子可能共平面
C.谷氨酸分子(α-氨基戊二酸)缩合只能形成1种二肽(不考虑立体异构)
D.在一定条件下,1.0 mol的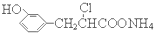 ,最多能与含3.0 mol NaOH的溶液完全反应
,最多能与含3.0 mol NaOH的溶液完全反应  berryz工房1年前1
berryz工房1年前1 -
 shuizhimei198414 共回答了10个问题
shuizhimei198414 共回答了10个问题 |采纳率100%解题思路:A.根据命名原则分析;
B.环己醇中碳连接4个原子或原子团,为四面体结构;
C.根据缩合原理和谷氨酸分子不对称分析;
D.能和氢氧化钠反应的基团为酚羟基、卤素原子和铵根离子.A.命名时要使最先遇到的简单取代基位次最小,正确的命名为:2,6-二甲基-5-乙基辛烷,故A错误;
B.环己醇中碳连接4个原子或原子团,为四面体结构,所有原子不可能共平面,故B错误;
C.缩合是氨基和羧基形成肽键,谷氨酸分子不对称,缩合最多可形成2种二肽,故C错误;
D.能和氢氧化钠反应的基团为酚羟基、卤素原子和铵根离子,各需要1mol氢氧化钠,故D正确;
故选D.点评:
本题考点: 常见有机化合物的结构;有机化合物命名;有机物的结构和性质;人体必需的氨基酸.
考点点评: 本题考查有机物的命名、结构与性质,把握官能团与性质的关系为解答的关键,题目难度不大.1年前查看全部
- (2010•宜春)传染病流行期间,坚持锻炼身体,加强营养,这属于传染病预防措施中的______.
 182466251年前1
182466251年前1 -
 松风水寒 共回答了15个问题
松风水寒 共回答了15个问题 |采纳率100%解题思路:此题考查传染病的预防措施,即控制传染源、切断传播途径、保护易感人群等措施,据此答题.传染病能够在人群中流行,必须具备传染源、传播途径、易感人群这三个环节,缺少其中任何一个环节,传染病就流行不起来.传染源是指能够散播病原体的人或动物;传播途径是指病原体离开传染源到达健康人所经过的途径;易感人群是指对某种病原体缺乏免疫力而容易感染该病的人群,病原体是指引起传染病的细菌、真菌、病毒和寄生虫等生物.传染病的预防措施包括控制传染源、切断传播途径、保护易感人群等措施.坚持锻炼身体,加强营养,属于传染病措施的保护易感人群.
故答案为:保护易感人群点评:
本题考点: 传染病的预防措施.
考点点评: 传染病的预防措施是考查的重点,多以选择题或是材料题的形式出现,难度一般.1年前查看全部
- (2009•宜春模拟)写出下列反应的化学方程式:
(2009•宜春模拟)写出下列反应的化学方程式:
(1)木炭与氧化铜反应2CuO+C
2Cu+CO2↑高温 .2CuO+C.
2Cu+CO2↑高温 .
(2)实验室用氯酸钾制取氧气2KClO3
2KCl+3O2↑MnO2 ..△ 2KClO3.
2KCl+3O2↑MnO2 ..△  BrianBA1年前1
BrianBA1年前1 -
 ft_cr 共回答了17个问题
ft_cr 共回答了17个问题 |采纳率88.2%解题思路:只有熟悉质量守恒定律的两个原则和化学方程式的书写方法,就能得出本题的正确答案.(1)碳与氧化铜在高温条件下反应生成铜和二氧化碳.
该反应的化学方程式为:2CuO+C
高温
.
2Cu+CO2↑.
(2)氯酸钾在二氧化锰的催化作用和加热条件下反应生成氯化钾和氧气.
该反应的化学方程式为:2KClO3
MnO2
.
△2KCl+3O2↑.
故答案为:
(1)2CuO+C
高温
.
2Cu+CO2↑
(2)2KClO3
MnO2
.
△2KCl+3O2↑点评:
本题考点: 书写化学方程式、文字表达式、电离方程式.
考点点评: 本题主要考查质量守恒定律的应用和化学方程式的书写,难度较小.1年前查看全部
- (2014•宜春模拟)香花石由前20号元素中的6种组成,其化学式为X3Y2(ZWR4)3T2,X、Y、Z为金属元素,Z的
(2014•宜春模拟)香花石由前20号元素中的6种组成,其化学式为X3Y2(ZWR4)3T2,X、Y、Z为金属元素,Z的最外层电子数与次外层相等,X、Z位于同主族,Y、Z、R、T位于同周期,R最外层电子数为次外层的3倍,T无正价,X与R原子序数之和是W的2倍.下列说法错误的是( )
A.原子半径:Y>Z>R>T
B.气态氢化物的稳定性:W<R<T
C.最高价氧化物对应的水化物碱性:X>Z
D.XR2、WR2两化合物中R的化合价相同 辽大乱舞1年前1
辽大乱舞1年前1 -
 hunancxdjp 共回答了24个问题
hunancxdjp 共回答了24个问题 |采纳率83.3%解题思路:T无正价,则T为氟元素;Y、Z、R、T位于同周期,则在第二周期,由R最外层电子数为次外层的3倍,则R为氧元素;Z的最外层电子数与次外层相等,则Z为铍元素;Y、Z为金属元素,Y在第二周期,则Y为锂元素;X、Z位于同主族,则X为镁元素或钙元素;若X为镁元素,则由X与R原子序数之和是W的2倍,则[12+8/2]=10,推出W为氖元素不符合题意,若X为钙元素,则由X与R原子序数之和是W的2倍,[20+8/2]=14,推出W为硅元素,即X为钙元素、W为硅元素符合题意;
A、利用电子层越多,原子半径越大,同周期元素的原子半径从左向右半径在减小;
B、非金属性越强,则气态氢化物越稳定;
C、金属性越强,则最高价氧化物对应的水化物碱性越强;
D、根据常见元素的化合价及化合价原则来分析.根据T无正价,则T为氟元素;Y、Z、R、T位于同周期,则在第二周期,由R最外层电子数为次外层的3倍,则R为氧元素;Z的最外层电子数与次外层相等,则Z为铍元素;Y、Z为金属元素,Y在第二周期,则Y为锂元素;X、Z位于同主族,则X为镁元素或钙元素;若X为镁元素,则由X与R原子序数之和是W的2倍,则[12+8/2]=10,推出W为氖元素不符合题意,若X为钙元素,则由X与R原子序数之和是W的2倍,[20+8/2]=14,推出W为硅元素,
即X为钙元素、Y为锂元素、Z为铍元素、R为氧元素、W为硅元素、T为氟元素符合题意;
A、Y为锂元素、Z为铍元素、R为氧元素、T为氟元素,位于同周期,元素的原子半径从左向右半径在减小,故A正确;
B、W为硅元素、R为氧元素、T为氟元素,非金属性F>O>Si,则气态氢化物的稳定性W<R<T,故B正确;
C、X为钙元素、Z为铍元素,钙的金属性强,则最高价氧化物对应的水化物碱性X>Z,故C正确;
D、XR2、WR2两化合物CaO2、SiO2,因钙元素为+2价、硅元素为+4价,则R的化合价分别为-1、-2价,即XR2、WR2两化合物中R的化合价不相同,故D错误;
故选D.点评:
本题考点: 原子结构与元素周期律的关系;位置结构性质的相互关系应用.
考点点评: 本题考查学生利用元素的位置及原子的结构来推断元素,然后利用元素周期律及化合价知识来解答即可.1年前查看全部
- (2011•宜春模拟)同学们关注过上个月漫山遍野的油菜花吗?嫩黄嫩黄的!看到这春天的美丽让人心情特别愉快,而保持心情愉快
(2011•宜春模拟)同学们关注过上个月漫山遍野的油菜花吗?嫩黄嫩黄的!看到这春天的美丽让人心情特别愉快,而保持心情愉快正是我们青少年______健康的核心.另外我们还能看到勤劳的蜜蜂在花丛中飞舞,它们在采蜜的同时帮助植物完成了开花之后受精之前另一重要生理过程--______.
 愤怒的大胡子1年前1
愤怒的大胡子1年前1 -
 nina0516 共回答了19个问题
nina0516 共回答了19个问题 |采纳率84.2%解题思路:此题考查的知识点是健康的概念,还涉及了植物传粉和受精的知识,思考解答.传统的健康观是“无病即健康”,现代入的健康观是整体健康,世界卫生组织认为,健康是指一种身体上、心理上和社会适应方面的良好状态,而不仅仅是没有疾病和不虚弱.而保持心情愉快是心理健康的核心.
绿色开花植物在花开放之后要经过传粉和受精才能结出果实和种子,蜜蜂在花丛中飞舞,在采蜜的同时还能帮助植物传粉.
故答案为:心理;传粉点评:
本题考点: 健康的概念;传粉和受精.
考点点评: 熟练掌握健康的概念,明确绿色开花植物在花开放之后要经过传粉和受精才能结出果实和种子.即可正确解答.1年前查看全部
- (2013•宜春一模)阅读材料,回答下列问题.
(2013•宜春一模)阅读材料,回答下列问题.
材料一欧洲部分地区图
(1)图中平原中北部和南部地表形态差异大,根据外力作用分析成因.
(2)有人建议将图中A城的冶金工业迁往B城,你认为是否合理,请阐述理由.
材料二R河气候资料
(3)据材料二分析图中R河的水文特征及其成因.月份 1 2 3 4 5 6 7 8 9 10 11 12 全年 气温(℃) -13 -11 -4.5 6.4 14.9 18.5 20.6 18.6 12.8 4.4 -2.5 -8.7 3.2 降水(mm) 46.6 39.0 34.9 38.7 32.9 56.0 58.1 52.1 45.0 52.5 54.2 53.0 563
材料三沿50°E年降水量、蒸发量和>10°C积温图
(4)大约以55°N为界,东欧平原南、北植被类型有明显差异,试结合材料三加以说明. 墙墙在线1年前1
墙墙在线1年前1 -
 tongtong-feifei 共回答了18个问题
tongtong-feifei 共回答了18个问题 |采纳率94.4%解题思路:读图,图中最大的平原为东欧平原,北部主要受冰川沉积作用,南部主要受流水沉积作用;结合图中A、B两地发展冶金工业的优势条件分析将图中A城的冶金工业迁往B城的利与弊;根据图中R河的地理位置判断该河的水文特征及成因;根据图中信息分析大约以55°N为界,东欧平原南、北植被类型差异.(1)外力作用形式不同造成地表形态的不同,北部纬度高,受冰川沉积导致平原中地表波状起伏;南部纬度低,受流水沉积导致平原地形平坦开阔.
(2)B地位于欧洲西部,发展冶金工业的有利条件:水陆交通便利;接近消费市场;技术力量较强.A地发展冶金工业的有利条件:靠近资源、能源产地;土地租金低、生产成本低.结合两者的优势条件加以分析.
(3)读图,根据图中R河的地理位置可以判断,受湿润西风的影响,降水量多,河流水量丰富;冬季气温低,降水量多,积雪量大,春季气温回升,积雪融化形成春汛;冬季低温时间长,结冰期长.
(4)读图,大约以55°N为界,东欧平原南部降水量大于蒸发量,气候较干旱,但热量较好,植被类型以温带草原、荒漠为主;东欧平原北部降水量大于蒸发量,气候湿润,但热量少,植被类型以亚寒带针叶林为主.
故答案为:
(1)冰川沉积导致平原中北部地表波状起伏,流水沉积导致平原南部地形平坦开阔.
(2)不合理--远离资源、能源产地;污染环境;土地租金(劳动力工资水平)高、生产成本高.
合理--水陆交通便利;接近消费市场;技术力量较强.
(3)受湿润西风的影响,降水量多,河流水量丰富;冬季气温低,降水量多,积雪量大,春季气温回升,积雪融化形成春汛;冬季低温时间长,结冰期长.
(4)北部降水量大于蒸发量,气候湿润,但热量少,植被类型以亚寒带针叶林为主;
南部降水量大于蒸发量,气候较干旱,但热量较好,植被类型以温带草原、荒漠为主.点评:
本题考点: 地理环境的地域分布规律.
考点点评: 主要考查了学生对区域自然和人文地理知识掌握情况.1年前查看全部
- (2013•宜春模拟)已知:CuI是难溶于水的白色固体.氧化性Cu2+>I2>Cu+,还原性Cu>I->Cu+
(2013•宜春模拟)已知:CuI是难溶于水的白色固体.氧化性Cu2+>I2>Cu+,还原性Cu>I->Cu+
(1)根据物质氧化性还原性的强弱推测,在溶液中Cu2+和I-反应的产物是______;
(2)久置于空气中的HI溶液呈黄色,向其中加入一些铜粉,可使溶液黄色消失,反应的化学方程式为______;
(3)欲消除(2)中HI溶液的黄色,也可向其中通入少量H2S,这是因为当浓度接近时,还原性H2S______(填“>”、“<”、“=”)I-;与加入铜粉的方法相比,用此方法得到的HI溶液浓度______(填“高”、“低”、“相等”);
(4)CuI可用于监测空气中是否含有汞蒸气:4CuI(白色)+Hg═Cu2HgI4(亮黄色)+2Cu.下列关于该化学方程式的说法错误的是______.
a.该反应被氧化的元素是铜元素和汞元素
b.该反应的氧化剂为CuI
c.Cu2HgI4只是氧化产物. 两目山1年前1
两目山1年前1 -
 forever4032 共回答了20个问题
forever4032 共回答了20个问题 |采纳率95%解题思路:(1)根据铜离子和碘离子对应的氧化产物知识来回答;
(2)久置于空气中的HI溶液呈黄色,是因为其中的碘离子被氧化为碘单质后的颜色,根据铜和碘单质间的反应来回答;
(3)根据碘离子和硫离子的还原性顺序来分析;
(4)根据氧化还原反应中的基本概念来回答.(1)根据题意:还原性Cu>I->Cu+,碘离子对应的氧化产物是单质碘,铜离子做氧化剂时被还原为低价的亚铜离子,故答案为:CuI、I2;
(2)久置于空气中的HI溶液呈黄色,是因为其中的碘离子被氧化为碘单质的缘故,加入金属铜,金属铜可以和碘单质反应,即2Cu+I2=2CuI↓,故答案为:2Cu+I2=2CuI↓;
(3)碘离子的还原性比硫离子的还原性弱,所以碘单质可以和硫化氢反应生成单质硫和碘化氢,这种方法与加入铜粉的方法相比,得到的HI溶液浓度更高,故答案为:>;高;
(4)a、氧化还原反应中,被氧化的元素是化合价升高的汞元素,故a错误;
b、氧化还原反应中,化合价降低的Cu元素所在的反应物CuI是氧化剂,故b正确;
c、化合价升高的汞元素所在产物Cu2HgI4是氧化产物,故c正确;
故选a.点评:
本题考点: 氧化性、还原性强弱的比较;铜金属及其重要化合物的主要性质.
考点点评: 本题考查学生氧化还原反应中,氧化性和还原性强弱以及基本概念的知识,考查学生分析和解决问题的能力,难度不是很大.1年前查看全部
- (2014•宜春模拟)尿素(H2NCONH2)是一种非常重要的高氮化肥,工业上合成尿素的反应如下:
(2014•宜春模拟)尿素(H2NCONH2)是一种非常重要的高氮化肥,工业上合成尿素的反应如下:
2NH3(l)+CO2(g)⇌H2O(l)+H2NCONH2 (l)△H=-103.7kJ•mol-1
试回答下列问题:
(1)下列措施中有利于提高尿素的产率的是______.
A.采用高温B.采用高压C.寻找更高效的催化剂
(2)合成尿素的反应在进行时分为如下两步:
第一步:2NH3(l)+CO2(g)⇔H2NCOONH4(氨基甲酸铵)(l)△H1
第二步:H2NCOONH4(l)⇔H2O(l)+H2NCONH2(l)△H2
某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分随时间的变化如下图Ⅰ所示: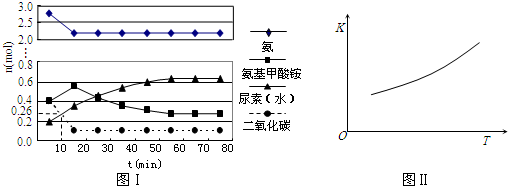
①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第______步反应决定,总反应进行到______时到达平衡.
②反应进行到10 min时测得CO2的物质的量如图所示,则用CO2表示的第一步反应的速率v(CO2)=______.
③第二步反应的平衡常数K随温度的变化如上右图Ⅱ所示,则△H2______0(填“>”“<”或“=”) hunterspulit1年前1
hunterspulit1年前1 -
 david247157200 共回答了23个问题
david247157200 共回答了23个问题 |采纳率87%解题思路:(1)2NH3(l)+CO2(g)⇌H2O(l)+H2NCONH2(l)△H=-103.7kJ•mol-1 ,反应是放热反应,反应前后气体体积减小;有利于提高尿素的生成速率需要依据影响化学反应速率的因素进行分析;
(2)①已知总反应的快慢由慢的一步决定,结合图象变化趋势,图象表达反应的判断,反应快慢可以依据第一步和第二步反应的曲线斜率比较大小;当氨基甲酸铵、尿素物质的量不再变化时,反应达到平衡;
②根据图象中二氧化碳在10 min时测得CO2的物质的量计算出用CO2表示的第一步反应的速率v(CO2);
③依据化学平衡常数的表达意义和计算分析判断平衡移动方向.(1)A.采用高温,反应是放热反应,平衡向着逆向进行,尿素的产率降低,故A错误;
B.反应由气体参加,反应前后气体体积减小,采用高压,增大压强,反应正向进行,尿素的产率增大,故B正确;
C.寻找更高效的催化剂,催化剂可以加快反应速率,但不改变平衡,尿素的产率不变,故C错误;
故选B;
(2)①由图象可知在15分钟左右,氨气和二氧化碳反应生成氨基甲酸铵后不再变化发生的是第一步反应,氨基甲酸铵先增大再减小最后达到平衡,发生的是第二部反应,从曲线斜率不难看出第二部反应速率慢,所以已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第二步决定,由图象变化可知当进行到55分钟时,反应达到平衡,
故答案为:2;55min;
②反应进行到10 min时测得CO2的物质的量为0.26mol,二氧化碳的浓度变化为:c(CO2)=[1mol−0.26mol/0.5L]=1.48mol/L,则用CO2表示的第一步反应的速率v(CO2)=[1.48mol/L/10min]=0.148 mol/(L•min),
故答案为:0.148 mol/(L•min);
③第二步反应的平衡常数K随温度的升高增大,说明反应是吸热反应,△H2>0,
故答案为:>.点评:
本题考点: 化学平衡的影响因素;化学反应速率的影响因素.
考点点评: 本题考查了化学平衡的影响因素分析、化学反应速率计算等知识,题目难度中等,注意明确影响化学平衡的因素及化学反应速率的计算方法,试题能够提高学生的分析、理解能力及计算能力.1年前查看全部
- (2014•宜春模拟)(1)A、B、C、D、E、F六种物质在一定条件下有如图所示的转化关系,所有反应物和生成物均已给出.
 (2014•宜春模拟)(1)A、B、C、D、E、F六种物质在一定条件下有如图所示的转化关系,所有反应物和生成物均已给出.
(2014•宜春模拟)(1)A、B、C、D、E、F六种物质在一定条件下有如图所示的转化关系,所有反应物和生成物均已给出.
①若反应①②③均为水溶液中的置换反应,A、D、E都为卤素单质,化合物中的阳离了均为Na+,则A、D、E的氧化性由弱到强的顺序为______(写化学式).在一定条件下E和D以物质的量比为5:1在硫酸溶液中恰好完全反应,写出该反应的离子方程式:______.
②若把B、C、F三种溶液汇集在一起得到1L混合溶液,并物质的转化关系给其中加入一定量的E,溶液中卤素阴离子的物质的量与通入E的体积(标准状况)的关系如下表所示(x和y均大于0).各离子的量与E的体积的关系
Ⅰ.当通入E的体积为2.8L时,溶液中发生反应的离子方程式为______.E的体积(标准状况) 2.8L 5.6L 11.2L n(F的阴离子)/mol 1.25 1.5 2 n(C中的阴离子)/mol 1.5 1.4 y n(B中的阴离子)/mol x 0 0
Ⅱ.x=______,y=______(填具体数据).
Ⅲ.当通入E的体积为11.2L时,该溶液中c(Na+)=______mol•L-1(通入E后溶液的体积变化忽略不计).
(2)用H2O2可除去工业尾气中的Cl2,相关反应:H2O2(l)+Cl2(g)⇌2HCl(g)+O2(g)△H>0.
①为了提高H2O2的除氯效果,采取的措施最好的是______(只改变一种条件),其原因是:______.
②已知 2H2O2(l)=2H2O(l)+O2(g),△H1=-196.46kJ•mol-l
H2(g)+[1/2]O2(g)=H2O(l),△H2=-285.84kJ•mol-l
Cl2(g)+H2(g)=2HClO(g),△H3=-184.6kJ•mol-l
则H2O2(l)与Cl2(g)反应生成HCl(g)和O2(g)的热化学方程式为______. 阿纳1年前1
阿纳1年前1 -
 花和月 共回答了19个问题
花和月 共回答了19个问题 |采纳率94.7%解题思路:(1)①若反应①②③均为水溶液中的置换反应,A、D、E为卤素单质,通常状况下A为液态非金属单质,可推知A为Br2.B的焰色反应为黄色,含有Na元素,反应①②③均为水溶液中的置换反应,结合框图转化关系可知,E为单质,D为单质,氧化性应有E>A>D,故B为NaI、C为NaBr、D为碘、E为氯气、F为NaCl;在一定条件下E和D以物质的量比为5:1在硫酸溶液中恰好完全反应,结合电子守恒分析产物,配平书写离子方程式;
②Ⅰ、E为Cl2,F的阴离子为Cl-,C的阴离子为Br-,B的阴离子为I-,当通入E的体积为2.8L时,结合图标数据分析,氯气氧化碘离子为碘单质;
Ⅱ、依据消耗氯气计算反应的溴离子物质的量,得到x、y值;
Ⅲ、依据电荷守恒计算;
(2)①依据反应特征和影响反应速率和平衡移动的因素分析判断;
②由已知热化学方程式和盖斯定律计算得到所需热化学方程式.(1)①A、D、E为卤素单质,通常状况下A为液态非金属单质,可推知A为Br2.B的焰色反应为黄色,含有Na元素,反应①②③均为水溶液中的置换反应,结合框图转化关系可知,E为单质,D为单质,氧化性应有E>A>D,A、D、E的氧化性由弱到强的顺序为I2<Br2<Cl2;故B为NaI、C为NaBr、D为碘、E为氯气、F为NaCl;
在一定条件下E和D以物质的量比为5:1在硫酸溶液中恰好完全反应,生成写出该反应的离子方程式:5Cl2+I2+6H2O=10Cl-+2IO3-+12H+,
故答案为:I2<Br2<Cl2;5Cl2+I2+6H2O=10Cl-+2IO3-+12H+;
②Ⅰ、E为Cl2,F的阴离子为Cl-,C的阴离子为Br-,B的阴离子为I-,n(Cl2)=[2.8L/22.4L/mol]=0.125mol,通入氯气,先与I-反应,生成单质碘,方程式为:Cl2+2I-=I2+2Cl-,
故答案为:Cl2+2I-=I2+2Cl-;
Ⅱ、由于还原性:I->Br-,加入氯气2.8L时溶液中I-amol,
则说明通入2.8LCl2只发生:Cl2+2I-=I2+2Cl-,
此时n(Cl2)=[2.8L/22.4L/mol]=0.125mol,消耗n(I-)=2×0.125mol=0.25mol,生成n(Cl-)=2×0.125mol=0.25mol,
此时n(Br-)=1.5mol,则说明原溶液中n(Br-)=1.5mol,
根据表数据:2.8L变成5.6L,消耗2.8LCl2的物质的量为[2.8L/22.4L/mol]=0.125mol,
Cl2 +2Br-=Br2+2Cl-
0.05mol 0.1mol
Cl2+2I-=I2+2Cl-
0.075mol 0.15mol
则x=0.15mol,所以原溶液中:
n(I-)=0.25mol+0.15mol=0.4mol,
n(Cl-)=1.25mol-0.25mol=1mol,
通入氯气5.6L到11.2L,通入消耗氯气5.6L,物质的量=[5.6L/22.4L/mol]=0.25mol,反应为CL2+2Br-=Br2+2Cl-,反应Br-物质的量=0.25mol×2=0.5mol,y=1.4mol-0.5mol=0.9mol;
故答案为:0.15;0.9;
Ⅲ、当通入E的体积为11.2L时,溶液中Cl-物质的量为2mol,Br-为0.9mol,依据电荷守恒,溶液体积为1L,该溶液中c(Na+)=c(Cl-)+c(Br-)=2.9mol/L;
故答案为:2.9;
(2)①H2O2(l)+Cl2(g)⇌2HCl(g)+O2(g)△H>0,反应是吸热反应,为了提高H2O2的除氯效果,平衡正向进行,采取的措施最好的是适当升高温度,平衡正向进行;
故答案为:适当升高温度;反应是吸热反应,升温加快反应速率,平衡正向进行;
②a、2H2O2(l)=2H2O(l)+O2(g),△H1=-196.46kJ•mol-l
b、H2(g)+[1/2]O2(g)=H2O(l),△H2=-285.84kJ•mol-l
c、Cl2(g)+H2(g)=2HClO(g),△H3=-184.6kJ•mol-l
依据盖斯定律,a×[1/2]-b+c得到H2O2(l)与Cl2(g)反应生成HCl(g)和O2(g)的热化学方程式为:H2O2(l)+Cl2(g)=2HCl(g)+O2(g)△H=+3.01KJ/mol;
故答案为:H2O2(l)+Cl2(g)=2HCl(g)+O2(g)△H=+3.01KJ/mol.点评:
本题考点: 无机物的推断;热化学方程式;化学平衡的影响因素.
考点点评: 本题考查了物质推断方法和物质性质的分析应用,主要是氧化还原反应定量计算分析判断产物,热化学方程式书写,掌握基础是关键,题目难度中等.1年前查看全部
- (2014•宜春模拟)某同学用沉淀法测定Na2CO3和NaOH混合物中NaOH的质量分数,有关叙述如下.
(2014•宜春模拟)某同学用沉淀法测定Na2CO3和NaOH混合物中NaOH的质量分数,有关叙述如下.
①可以使用MgCl2溶液作沉淀剂,使OH-转化为氢氧化镁沉淀
②检验CO32-是否完全沉淀的操作方法是取上层清液,向其中继续滴加沉淀剂溶液,观察是否有沉淀继续生成
③用BaCl2溶液代替CaCl2溶液作沉淀剂,优点是能提高实验结果的准确度
④用BaCl2溶液代替CaCl2溶液作沉淀剂,优点是CO32-能100%转化为沉淀.其中正确的叙述是( )
A.①②
B.②③
C.①③④
D.都正确 秕谷1年前1
秕谷1年前1 -
 闫安迷926 共回答了22个问题
闫安迷926 共回答了22个问题 |采纳率95.5%解题思路:①使用MgCl2溶液作沉淀剂,氢氧化镁比MgCO3更难溶,OH-转化为沉淀;
②取上层清液中加沉淀剂,生成沉淀则没有沉淀完全,否则沉淀完全;
③用BaCl2溶液代替CaCl2溶液作沉淀剂,可排除氢氧化钙对实验的影响;
④用BaCl2溶液代替CaCl2溶液作沉淀剂,优点是CO32-能100%转化为沉淀,而OH-不会转化为沉淀.①使用MgCl2溶液作沉淀剂,氢氧化镁比MgCO3更难溶,OH-转化为沉淀,则可以使用MgCl2溶液作沉淀剂,但需要合适的指示剂进行滴定,故正确;
②取上层清液中加沉淀剂,生成沉淀则没有沉淀完全,否则沉淀完全,所以观察是否有沉淀继续生成可检验CO32-是否完全沉淀,故正确;
③用BaCl2溶液代替CaCl2溶液作沉淀剂,因氢氧化钙的溶解度较小,可排除氢氧化钙对实验的影响,能提高实验结果的准确度,故正确;
④用BaCl2溶液代替CaCl2溶液作沉淀剂,优点是CO32-能100%转化为沉淀,而OH-不会转化为沉淀,方法更好,故正确;
故选D.点评:
本题考点: 化学实验方案的评价.
考点点评: 本题考查化学实验方案的评价,为高频考点,涉及沉淀法测定物质含量、离子检验及复分解反应等,注重实验原理及物质性质的考查,注意实验的操作性、评价性分析,题目难度不大.1年前查看全部
- (2013•宜春模拟)X、Y、Z、W都是中学化学常见的物质,其中X、Y、Z均含有同一种元素.在一定条件下相互转化的关系如
 (2013•宜春模拟)X、Y、Z、W都是中学化学常见的物质,其中X、Y、Z均含有同一种元素.在一定条件下相互转化的关系如图所示(部分反应中的H2O已略去).请按要求回答下列问题:
(2013•宜春模拟)X、Y、Z、W都是中学化学常见的物质,其中X、Y、Z均含有同一种元素.在一定条件下相互转化的关系如图所示(部分反应中的H2O已略去).请按要求回答下列问题:
(1)若X可用于自来水消毒,W为金属单质,且W是用量最大、用途最广的金属,若加热蒸干Y的溶液没有得到Y的盐,则反应③的离子方程式为______.
(2)若X常用作制冷剂,Y和W为空气的主要成分,则反应③的化学方程式为 4NH3+6NO=5N2+6H2O.
(3)若W为氯碱工业的重要产品,Y有两性,反应③的离子方程式可以是______.通过氯碱工业制取W的化学方程式为2NaCl+2H2O
2NaOH+H2↑+Cl2↑电解 .2NaCl+2H2O.
2NaOH+H2↑+Cl2↑电解 .
(4)若X、Z、W都是常见气体,Z是形成酸雨的主要气体,则反应③的化学方程式为______. 灰色不灰1年前1
灰色不灰1年前1 -
 bll107 共回答了19个问题
bll107 共回答了19个问题 |采纳率94.7%解题思路:(1)若X可用于自来水消毒,应为Cl2,W为金属单质,且W是用量最大、用途最广的金属,应为Fe,Y为FeCl3,Z为FeCl2;
(2)X用作制冷剂,则X是氨气,Y和W为空气的主要成分,W是氧气,Y是氮气,Z为NO;
(3)若W为氯碱工业的重要产品,Y有两性,由转化关系可知W为NaOH,Y为Al(OH)3,X含有Al3+,Z含有AlO2-;
(4)Z是形成酸雨的主要气体,应为SO2,则X为H2SH2S,W为SO2,Y为S.(1)若X可用于自来水消毒,应为Cl2,W为金属单质,且W是用量最大、用途最广的金属,应为Fe,Y为FeCl3,Z为FeCl2,反应③的离子方程式为2Fe2++Cl2=2Fe3++2 Cl-,
故答案为:2Fe2++Cl2=2Fe3++2Cl-;
(2)X用作制冷剂,则X是氨气,Y和W为空气的主要成分,W是氧气,Y是氮气,Z为NO,反应③的化学方程式为4NH3+6NO=5N2+6H2O,
故答案为:4NH3+6NO=5N2+6H2O;
(3)若W为氯碱工业的重要产品,Y有两性,由转化关系可知W为NaOH,Y为Al(OH)3,X含有Al3+,Z含有AlO2-或[Al(OH)4]-,反应③的离子方程式可以是Al3++3[Al(OH)4]-=4Al(OH)3↓或Al3++3 AlO2-+6H2O=4Al(OH)3↓,通过氯碱工业制取W的化学方程式为2NaCl+2H2O
电解
.
2NaOH+H2↑+Cl2↑,
故答案为:Al3++3[Al(OH)4]-=4Al(OH)3↓或Al3++3 AlO2-+6H2O=4Al(OH)3↓;2NaCl+2H2O
电解
.
2NaOH+H2↑+Cl2↑;
(4)Z是形成酸雨的主要气体,应为SO2,则X为H2SH2S,W为SO2,Y为S,反应③的化学方程式为2H2S+SO2=3S+2H2O,
故答案为:2H2S+SO2=3S+2H2O.点评:
本题考点: 无机物的推断.
考点点评: 本题考查较为综合,涉及元素化合物的推断,为高频考点,侧重于学生的分析能力,物质性质是解题关键,题目具有一定难度,做题时注意把握推断的思路.1年前查看全部
- (2012•宜春模拟)下列各组离子在指定溶液中可能大量共存的是( )
(2012•宜春模拟)下列各组离子在指定溶液中可能大量共存的是( )
①加入铝能产生氢气的溶液:Fe3+、Al3+、NO3-、SO42-
②加入淀粉显蓝色的溶液:K+、NH4+、Cl-、I-
③无色溶液中:K+、AlO2-、NO3-、HCO3-
④澄清透明的溶液中:Cu2+、Fe3+、NO3-、Cl-
⑤常温下,KW/c(H+)=10-13mol•L-1溶液中:NH4+、Mg2+、NO3-、SO42-.
A.①③⑤
B.②③
C.②④⑤
D.②④ sanpi371年前1
sanpi371年前1 -
 慧琳迷 共回答了10个问题
慧琳迷 共回答了10个问题 |采纳率100%解题思路:①加入铝能产生氢气的溶液可能呈酸性,也可能呈碱性;
②加入淀粉显蓝色的溶液,说明溶液中含有I2;
③AlO2-与HCO3-发生互促水解反应;
④澄清透明的溶液中互不发生反应的离子能大量共存;
⑤常温下,KW/c(H+)=10-13mol•L-1溶液中,c(OH-)=10-13mol•L-1,溶液呈酸性.①加入铝能产生氢气的溶液可能呈酸性,也可能呈碱性,酸性条件时,溶液为硝酸,不能生成氢气,碱性条件下,
Fe3+、Al3+不能大量共存,故①错误;
②加入淀粉显蓝色的溶液,说明溶液中含有I2,K+、NH4+、Cl-、I-之间不发生任何反应,可以大量共存,故②正确;
③AlO2-与HCO3-发生互促水解反应而不能大量共存,故③错误;
④澄清透明的溶液中,离子之间互不发生反应,能大量共存,故④正确;
⑤常温下,KW/c(H+)=10-13mol•L-1溶液中,c(OH-)=10-13mol•L-1,溶液呈酸性,在酸性条件下大量共存,故⑤正确.
故选C.点评:
本题考点: 离子共存问题.
考点点评: 本题考查离子共存问题,题目难度中等,解答本题时注意各项中所给的隐含信息,为解答该题的关键.1年前查看全部
- (2014•宜春模拟)根据表中信息判断,下列选项正确的是( )
(2014•宜春模拟)根据表中信息判断,下列选项正确的是( )
序号 反应物 产物 ① KMnO4、H2O2、H2SO4 K2SO4、MnSO4… ② C12、FeBr2 FeC13、FeBr3 ③ MnO4-… Cl2、Mn2+…
A.第①组反应的其余产物为H2O
B.第②组反应中Cl2与FeBr2的物质的量之比小于或等于1:2
C.第③组反应中生成1mol Cl2,转移电子5mol
D.氧化性由强到弱顺序为MnO4->Cl2>Fe3+>Br2 了望天空1年前1
了望天空1年前1 -
 phpzhz 共回答了14个问题
phpzhz 共回答了14个问题 |采纳率92.9%解题思路:依据氧化还原反应中原子守恒,电子守恒和电荷守恒分析配平化学方程式判断选项;
A、锰元素化合价降低,过氧化氢中氧元素化合价升高生成氧气;
B、亚铁离子还原性大于溴离子,产物说明氯气反应过程中亚铁离子全部氧化,溴离子部分氧化;
C、依据反应2MnO4-+16H++10Cl-=5Cl2↑+2Mn2++8H2O,计算电子转移;
D、氧化还原反应中氧化剂的氧化性大于氧化产物分析判断.A、锰元素化合价降低,过氧化氢中氧元素化合价升高生成氧气,2KMnO4+5H2O2+3H2SO4=K2SO4+2MnSO4+8H2O+5O2↑,故A错误;
B、2C12+6FeBr2=3FeC13+4FeBr3 ,亚铁离子还原性大于溴离子,产物说明氯气反应过程中亚铁离子全部氧化,溴离子部分氧化,Cl2与FeBr2的物质的量之比小于或等于1:2,故B正确;
C、2MnO4-+16H++10Cl-=5Cl2↑+2Mn2++8H2O,生成1mol Cl2,转移电子10mol,故C错误;
D、氧化剂的氧化性大于氧化产物,依据化学方程式分析判断,氧化性由强到弱顺序为MnO4->Cl2>Br2>Fe3+,故D错误;
故选B.点评:
本题考点: 氧化性、还原性强弱的比较;氧化还原反应的电子转移数目计算.
考点点评: 本题考查了氧化还原反应反应实质,电子转移的计算应用,主要是反应产物的判断,掌握离子性质和氧化还原反应规律应用是解题关键,题目难度中等.1年前查看全部
- (2011•宜春模拟)怎样在显微镜视野内寻找洋葱表皮细胞( )
(2011•宜春模拟)怎样在显微镜视野内寻找洋葱表皮细胞( )
A.在镜筒上升过程中用右眼寻找
B.在镜筒上升过程中用左眼寻找
C.在镜筒下降过程中用右眼寻找
D.在镜筒下降过程中用左眼寻找 lb965781年前1
lb965781年前1 -
 夏日里的野百合 共回答了18个问题
夏日里的野百合 共回答了18个问题 |采纳率94.4%解题思路:此题考查的是显微镜的使用方法和步骤.显微镜使用步骤包括:1、对光2、安放装片3、观察4、整理和存放.
此题考查的是第三步观察:(1)从侧面注视物镜,双手同时转动粗准焦螺旋,使镜筒缓缓下降至接近装片2毫米处.(2)左眼注视目镜,同时反方向转动粗准焦螺旋,使镜筒缓缓上升,直到发现物像为止.(3)缓缓移动装片注意物像的移动方向.根据观察中的(2)可知答案.
故选:B点评:
本题考点: 显微镜的基本构造和使用方法.
考点点评: 显微镜的使用方法和成像特点,中考中经常出现,应熟练掌握.1年前查看全部
- (2013•宜春一模)Ⅰ.某溶液中仅含如表离子中的5种离子(不考虑水的电离及离子的水解),且离子的物质的量均为1mol.
 (2013•宜春一模)Ⅰ.某溶液中仅含如表离子中的5种离子(不考虑水的电离及离子的水解),且离子的物质的量均为1mol.
(2013•宜春一模)Ⅰ.某溶液中仅含如表离子中的5种离子(不考虑水的电离及离子的水解),且离子的物质的量均为1mol.
①若向原溶液中加入KSCN溶液,无明显变化.②若向原溶液中加入过量的盐酸,有气体生成,溶液中阴离子种类不变.试回答下列问题阴离子 SO42-、NO3-、Cl- 阳离子 Fe3+、Fe2+、NH4+、Cu2+、Al3+
(1)若先向原溶液中加入过量的盐酸,再加入KSCN溶液,现象是______.
(2)原溶液中含有的阳离子是______.
(3)向原溶液中加入足量的盐酸,发生反应的离子方程式为______.
(4)向原溶液中加入足量的NaOH溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体用托盘天平称量质量为______.
Ⅱ.草酸亚铁晶体(FeC2O4•2H2O)、碳酸锂和二氧化硅在氩气中高温反应可制备锂电池的正极材料硅酸亚铁锂(Li2FeSiO4).草酸亚铁晶体在氩气气氛中进行热重分析,结果如图所示(TG%表示残留固体质量占原样品总质量的百分数),请回答下列问题:
(5)草酸亚铁晶体中碳元素的化合价为:______
(6)A→B发生反应的化学方程式为FeC2O4.2H2O
FeC2O4+2H2O△ .FeC2O4.2H2O.
FeC2O4+2H2O△ .
(7)精确研究表明,B→C实际是分两步进行的,每一步只释放一种气体,第二步释放的气体的相对分子质量较第一步的大,则第一步释放的气体化学式为:______; 释放第二种气体时,反应的化学方程式为FeCO3
FeO+CO2↑△ .FeCO3.
FeO+CO2↑△ . 注册了三次1年前1
注册了三次1年前1 -
 朝花昭拾 共回答了11个问题
朝花昭拾 共回答了11个问题 |采纳率90.9%解题思路:Ⅰ、各种离子的物质的量均为1mol,某同学向原溶液中加入KSCN溶液,无明显变化,则一定不含有铁离子,若向原溶液中加入足量的盐酸,有无色气体生成,反应后溶液中阴离子种类没有变化,根据表中的离子,可以推知是 Fe2+、NO3-在酸性环境下生成的一氧化氮,加入盐酸,溶液中阴离子种类不变,所以原来溶液中含有Cl-,再根据电荷守恒确定还含有的其他离子;
Ⅱ、(5)根据化合价规则确定碳元素的化合价;
(6)根据图中提供的信息,通过计算可以判断反应的化学方程式;
(7)草酸亚铁晶体分解产生气体是含有碳元素的化合物:一氧化碳和二氧化碳,第二步释放的气体二氧化碳的相对分子质量较第一步一氧化碳的大,据此来回答.Ⅰ、各种离子的物质的量均为1mol,某同学向原溶液中加入KSCN溶液,无明显变化,则一定不含有铁离子,若向原溶液中加入足量的盐酸,有无色气体生成,反应后溶液中阴离子种类没有变化,根据表中的离子,可以推知是Fe2+...
点评:
本题考点: 常见离子的检验方法;氧化还原反应.
考点点评: 学实验现象是化学实验最突出、最鲜明的部分,也是进行分析推理得出结论的依据,掌握物质的性质和相互之间的反应关系,并有助于提高观察、实验能力.所以,对化学实验不仅要认真观察,还应掌握观察实验现象的方法.1年前查看全部
- (2009•宜春)“好雨知时节,当春乃发生.随风潜入夜,润物细无声”中主要描写了哪种环境因素( )
(2009•宜春)“好雨知时节,当春乃发生.随风潜入夜,润物细无声”中主要描写了哪种环境因素( )
A.光
B.水
C.空气
D.土壤 amysun1年前1
amysun1年前1 -
 seamus123 共回答了13个问题
seamus123 共回答了13个问题 |采纳率76.9%解题思路:本题考查的是环境对生物的影响,首先明确有哪些环境因素对生物会造成影响.影响生物生活的非生物因素有:阳光、空气、水分、温度.在“好雨知时节,当春乃发生.随风潜入夜,润物细无声”中,主要描述了水滋润着生物,影响了生物的生活,使生物开始发萌.
故选:B点评:
本题考点: 环境对生物的影响.
考点点评: 对于非生物因素对生物的影响,可结合着具体的实例掌握.1年前查看全部
- (20六2•宜春)构成植物体的结构层次由大到小的顺序是( )
(20六2•宜春)构成植物体的结构层次由大到小的顺序是( )
A.细胞--组织--器官
B.细胞--组织--系统
C.器官--组织--细胞
D.器官--系统--细胞 有架雪铁龙1年前1
有架雪铁龙1年前1 -
 显示器LCD 共回答了16个问题
显示器LCD 共回答了16个问题 |采纳率87.5%解题思路:此题主要考查的是植物体的结构层次.植物体的结构层次由小到大依次是:细胞(受精卵)→组织→器官→植物体.据此解答.细胞是植物体结构和功能的基本单位,一般地说,植物体的生长发育是从受精卵开始的.受精卵经过细胞分裂、分化,形成组织、器官,进而形成植物体.植物体的几种主要组织有:分生组织、保护组织、营养组织、输导组织、机械组织.组织进一步形成器官,绿色开花植物是由根、茎、叶、花、果实、种子六二器官组成的.根、茎、叶为营养器官,花、果实、种子为生殖器官.可见,植物体的结构层次由二到小依次是植物体→器官→组织→细胞.与动物体的结构层次相比,植物体无系统.可见,选项C符合题意.
故选:C.点评:
本题考点: 绿色开花植物体的结构层次.
考点点评: 解此题的关键是理解掌握植物体的结构层次.1年前查看全部
- (2009•宜春模拟)只用一种试剂,即可一次性鉴别K2SO4、NaOH和AgNO3三种溶液,这种试剂是( )
(2009•宜春模拟)只用一种试剂,即可一次性鉴别K2SO4、NaOH和AgNO3三种溶液,这种试剂是( )
A.BaCl2
B.FeCl3
C.NaCl
D.H2SO4 知世19821年前1
知世19821年前1 -
 fasfdasdf 共回答了22个问题
fasfdasdf 共回答了22个问题 |采纳率90.9%解题思路:将题中所提供的四个选项分别与三种物质反应,若出现三种完全不同的现象,这种试剂就能一次性鉴别K2SO4、NaOH和AgNO3三种溶液.否则就不能鉴别.A、BaCl2与AgNO3溶液反应,产生白色沉淀,但不与K2SO4、NaOH反应,BaCl2不能将三种物质一次性鉴别; B、FeCl3与AgNO3溶液反应产生白色沉淀,FeCl3与NaOH反应产生红褐色沉淀,FeCl3不与K2SO4反应,...
点评:
本题考点: 酸、碱、盐的鉴别.
考点点评: 本题主要考查了利用所选试剂在与被鉴别的物质反应的现象应是完全不同的.在进行试验时,要加强对实验现象的观察.1年前查看全部
- (2012•宜春一模)在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系.下列条件关于离子共存说法中正确的是(
 (2012•宜春一模)在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系.下列条件关于离子共存说法中正确的是( )
(2012•宜春一模)在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系.下列条件关于离子共存说法中正确的是( )
A.d点对应的溶液中大量存在:Na+、K+、ClO-、Cl-
B.b点对应的溶液中大量存在:Fe2+、Ba2+、K+、NO3-
C.c点对应的溶液中大量存在:Na+、Ba2+、Cl-、Al3+
D.a点对应的溶液中大量存在:CO32-、Na+、Cl-、SO42- 123hha1年前1
123hha1年前1 -
 xx在磨刀 共回答了17个问题
xx在磨刀 共回答了17个问题 |采纳率76.5%解题思路:A.d点温度高于25℃,c(OH-)>c(H+),溶液显碱性;
B.b点为25℃,c(OH-)<c(H+),溶液显酸性;
C.d点温度高于25℃,c(OH-)=c(H+),溶液显中性;
D.a点为25℃,c(OH-)=c(H+),溶液显中性.A.d点温度高于25℃,c(OH-)>c(H+),溶液显碱性,该组离子之间不反应,能大量共存,故A正确;
B.b点为25℃,c(OH-)<c(H+),溶液显酸性,Fe2+、H+、NO3-发生氧化还原反应,不能大量共存,故B错误;
C.d点温度高于25℃,c(OH-)=c(H+),溶液显中性,不能存在大量的Al3+,故C错误;
D.a点为25℃,c(OH-)=c(H+),溶液显中性,不能大量存在CO32-,故D错误;
故选:A.点评:
本题考点: 离子共存问题.
考点点评: 本题考查离子的共存,为高考常见题型,侧重信息的抽取和图象分析能力的考查,把握离子之间的反应即可解答,氧化还原反应为解答的难点,题目难度不大.1年前查看全部
- (2012•宜春一模)某研究性学习小组将一定浓度Na2CO3溶液滴入CuSO4溶液中得到蓝色沉淀.甲同学认为两者反应只生
(2012•宜春一模)某研究性学习小组将一定浓度Na2CO3溶液滴入CuSO4溶液中得到蓝色沉淀.甲同学认为两者反应只生成CuCO3一种沉淀;乙同学认为只生成Cu(OH)2一种沉淀;丙同学认为生成CuCO3和Cu(OH)2两种沉淀.(查阅资料知:CuCO3和Cu(OH)2均不带结晶水)
Ⅰ、在探究沉淀物成分前,须将沉淀从溶液中分离并净化.具体操作为______、______、______.
Ⅱ、请用如图1所示装置,选择必要的试剂,定性探究生成物的成分.
(1)各装置连接顺序为______→______→______.
(2)装置C中装有试剂的名称是______.
(3)能证明生成物中有CuCO3的实验现象是______.
Ⅲ、若CuCO3和Cu(OH)2两者都有,可通过图2所示装置的连接(每个装置只使用一次),进行定量分析来测定其组成.
(1)各装置连接顺序为______→______→______→______;
(2)实验后还要通入过量的空气,其作用是______;
若沉淀样品的质量为m克,装置B质量增加了n克,则沉淀中CuCO3的质量分数为:(1-[49n/9m])×100%(1-[49n/9m])×100%;
若将C装置去掉,将导致测定结果中CuCO3的质量分数______(填“增大”、“减小”或“无影响”). 杨柳山枫1年前1
杨柳山枫1年前1 -
 一念之間 共回答了8个问题
一念之間 共回答了8个问题 |采纳率100%解题思路:Ⅰ、沉淀从溶液中分离并净化,要先把沉淀从溶液中过滤出,要洗去附着的杂质,然后干燥.
Ⅱ、利用加热的方法检验,氢氧化铜和碳酸铜加热分解得到氧化铜、水和二氧化碳,若有氢氧化铜可用无水硫酸铜检验,若有碳酸铜可用澄清的石灰水检验产生的二氧化碳,澄清石灰水变浑浊说明含有CuCO3;
Ⅲ、(1)实验开始时装置的空气中会有水蒸气和二氧化碳,若不排除被吸收装置吸收会对计算结果产生较大的误差,故开始时先用除去水和二氧化碳的空气将装置中的水蒸气和二氧化碳排除(注意实验结束氢氧化铜和碳酸铜加热分解后会在反应装置中残留二氧化碳和水蒸气,也应通过用除去水和二氧化碳的空气将装置中的水蒸气和二氧化碳赶出被吸收装置完全吸收);
(2)为保证样品加热分解生成的二氧化碳和水蒸气完全被吸收,应通入空气;
装置B质量增加了n克,说明分解生成ng水,根据水的质量计算沉淀中氢氧化铜的质量,沉淀质量减去氢氧化铜的质量等于碳酸铜的质量,再利用质量分数的定义计算;
由于空气中含有二氧化碳和水蒸气,应先通过盛有碱石灰的装置C吸收空气的中二氧化碳和水蒸气,若C装置去掉,装置B质量偏大.Ⅰ、沉淀从溶液中分离并净化,要先把沉淀从溶液中过滤出,要洗去附着的杂质,然后干燥除去沉淀中的水分,
故答案为:过滤、洗涤、干燥;
Ⅱ、(1)利用加热的方法检验,氢氧化铜和碳酸铜加热分解得到氧化铜、水和二氧化碳,若有氢氧化铜可用无水硫酸铜检验,若有碳酸铜可用澄清的石灰水检验产生的二氧化碳,
故答案为:A;C;B;
(2)装置C检验是否有水生成,可用无水硫酸铜检验,若无水硫酸铜变蓝色说明有水生成,验证沉淀中有氢氧化铜生成,否则沉淀中无氢氧化铜,
故答案为:无水硫酸铜;
(3)用澄清的石灰水检验是否产生二氧化碳,装置B中澄清石灰水变浑浊,说明生成二氧化碳,即说明含有CuCO3,
故答案为:装置B中澄清石灰水变混浊;
Ⅲ、(1)若CuCO3和Cu(OH)2两种沉淀都有,加热时生成CO2和H2O,定量检验时,可用浓硫酸吸收水,用碱石灰吸收二氧化碳,实验时,为减小误差,应排除空气中水和二氧化碳的干扰,并保证水和二氧化碳完全吸收,则实验仪器的连接顺序应为C A B E D(或C A B D E),
故答案为:C A B E D(或C A B D E);
(2)为保证样品加热分解生成的二氧化碳和水蒸气完全被吸收,应通入空气,将装置中滞留的H2O蒸汽赶入B中;
装置B质量增加了n克,说明分解生成ng水,水的物质的量为[n/18]mol,根据氢元素守恒可知氢氧化铜的物质的量为[n/18]mol,故氢氧化铜的质量为[n/18]mol×98g/mol=[49n/9]g,沉淀中CuCO3的质量分数为
m−
49n
9
m×100%=(1-[49n/9m])×100%,
由于空气中含有二氧化碳和水蒸气,应先通过盛有碱石灰的装置C吸收空气的中二氧化碳和水蒸气,若C装置去掉,装置B质量偏大,即吸收的水的质量偏大,求出氢氧化铜的质量偏大,则碳酸铜的质量偏小,将导致测定结果中CuCO3的质量分数减小;
故答案为:将装置中滞留的H2O蒸汽赶入B中;(1-[49n/9m])×100%;减小.点评:
本题考点: 物质分离和提纯的方法和基本操作综合应用;探究物质的组成或测量物质的含量.
考点点评: 本题考查了物质性质的探究实验设计和实验分析应用,物质性质的熟练掌握和实验基本操作是解题关键,题目难度中等.1年前查看全部
- (2014•宜春模拟)已知两圆相交于A(1,3),B(-3,-1)两点,且两圆圆心都在直线y=mx+n上,则m+n=__
(2014•宜春模拟)已知两圆相交于A(1,3),B(-3,-1)两点,且两圆圆心都在直线y=mx+n上,则m+n=______.
 香巴佬儿1年前1
香巴佬儿1年前1 -
 辛酉年 共回答了20个问题
辛酉年 共回答了20个问题 |采纳率95%解题思路:由相交弦的性质,相交两圆的连心线垂直平分相交弦,可得AB与直线y=mx+n垂直,且AB的中点在这条直线y=mx+n上;由AB与直线y=mx+n垂直,可得[−1−3/−3−1]=-[1/m],解可得m的值,进而可得AB中点的坐标,代入直线方程可得n=0;进而将m、n相加可得答案.根据题意,由相交弦的性质,相交两圆的连心线垂直平分相交弦,
可得AB与直线y=mx+n垂直,且AB的中点在这条直线y=mx+n上;
由AB与直线y=mx+n垂直,可得[−1−3/−3−1]=-[1/m]解得:m=-1
故AB中点为(-1,1),且其在直线y=mx+n上,
代入直线方程可得,-1×(-1)+n=1,可得n=0;
故m+n=-1;
故答案为:-1.点评:
本题考点: 直线的一般式方程与直线的垂直关系.
考点点评: 本题考查相交弦的性质,解题的关键在于利用相交弦的性质,即两圆的连心线垂直平分相交弦.1年前查看全部
- (2013•宜春模拟)如图所示是一种汽车装饰品--小盆景,花盆表面有一个太阳能电池板,塑料小花在阳光下能不断摇摆.请你猜
 (2013•宜春模拟)如图所示是一种汽车装饰品--小盆景,花盆表面有一个太阳能电池板,塑料小花在阳光下能不断摇摆.请你猜测花盆里还有一个重要的装置是______(选填“发电机”或“电动机”),这种装置的工作原理是______.
(2013•宜春模拟)如图所示是一种汽车装饰品--小盆景,花盆表面有一个太阳能电池板,塑料小花在阳光下能不断摇摆.请你猜测花盆里还有一个重要的装置是______(选填“发电机”或“电动机”),这种装置的工作原理是______.  zhanghq1001年前1
zhanghq1001年前1 -
 wjing422 共回答了24个问题
wjing422 共回答了24个问题 |采纳率91.7%解题思路:该题中的小盆景在太阳能电池板的作用下能不断的摆动,即消耗电能而运动,故花盆中肯定有一个小电动机,它的工作原理是利用通电导线在磁场中受力的作用.由于该装置在太阳能提供电能的情况下运动,即将电能转化为机械能,故里面应该有一个电动机,它是利用通电导线在磁场中受力的作用的原理制成的.
故答案为:电动机;通电导线在磁场中受力的作用.点评:
本题考点: 直流电动机的原理.
考点点评: 据现象能推导出实质,即能通过判断能量的转化,进而确定花盆里面是电动机还是发电机.1年前查看全部
- (2012•宜春模拟)一般较强酸可制取较弱酸,这是复分解反应的规律之一.已知在常温下测得浓度均为0.1mol/L的下列6
(2012•宜春模拟)一般较强酸可制取较弱酸,这是复分解反应的规律之一.已知在常温下测得浓度均为0.1mol/L的下列6种溶液的pH:
(1)①请根据上述信息判断下列反应不能发生的是______(填编号).溶质 CH3COONa NaHCO3 Na2CO3 NaClO NaCN C6H5ONa pH 8.1 8.8 11.6 10.3 11.1 11.3
A.CH3COOH+NaCN═CH3COONa+HCN
B.CO2+H2O+2NaClO═Na2CO3+2HClO
C.2HCN+Na2CO3-→2NaCN+CO2+H2O
D.Na2CO3+C6H5OH-→NaHCO3+C6H5ONa
E.CO2+H2O+C6H5ONa-→NaHCO3+C6H5OH
②已知HA、H2B是两种弱酸,存在以下关系:H2B(少量)+2A-=B2-+2HA,则A-、B2-、HB-三种阴离子结合H+的难易顺序为______.
(2)一些复分解反应的发生还遵循其他规律.下列变化都属于复分解反应:
①将石灰乳与纯碱溶液混合可制得苛性钠溶液 ②向饱和碳酸氢铵溶液中加入饱和食盐水可获得小苏打固体③蒸发KCl和NaNO3的混合溶液,首先析出NaCl晶体.根据上述反应,总结出复分解反应发生的另一规律为______.
(3)常温下某电解质溶解在水中后,溶液中的c(H+)=10-9mol•L-1,则该电解质可能是______(填序号).
A. CuSO4B. HClC. Na2SD.NaOHE.K2SO4
(4)常温下,将pH=3的盐酸a L分别与下列三种溶液混合,结果溶液均呈中性.
①浓度为1.0×l0-3mol.L-1的氨水b L;
②c(OH -)=1.0×10-3mol.L-l的氨水c L;
③c(OH-)=1.0×10-3mol•L-1的氢氧化钡溶液d L.
则a、b、c、d之间由大到小的关系是:______.
(5)一定温度下,向等体积等物质的量浓度的下列三份溶液:①NaOH、②CH3COOH、③CH3COONa分别加等量水,pH变化最小的是______(填编号).一定温度下,向等体积纯水中分别加入等物质的量的CH3COONa和NaCN,两溶液中阴离子的总物质的量分别为n1和n2,则n1和n2的关系为n1______n2(填“>”、“<”或“=”).
(6)己知常温时Ksp(AgCl)=1.8×10-10mol2•L-2,向50mL 0.018mol•L-1的AgNO3溶液中加入相同体积0.020mol•L-1的盐酸,则c(Ag+)=______,此时所得混合溶液的pH=______. jc07231年前1
jc07231年前1 -
 77cx75 共回答了20个问题
77cx75 共回答了20个问题 |采纳率75%解题思路:(1)①六种盐都为强碱弱酸盐,盐的pH越大,说明对应的酸水解程度越大,则对应的酸越弱,根据强酸生成弱酸的特点判断反应能否进行;
②根据反应H2B(少量)+2A-=B2-+2HA,可知,HA酸性小于H2B,HA酸性最弱,酸性越弱,对应的酸根离子得H+能力越强;
(2)复分解反应中有一种条件是生成难溶物质,由②③可以看出,在饱和溶液中,可生成溶解度更小的物质;
(3)溶液中的c(H+)=10-9mol.L-1,说明溶液呈碱性;
(4)一水合氨为弱电解质,不能完全电离,pH相同时,氨水浓度最大;
(5)CH3COONa为强碱弱酸盐,水解呈碱性,且水解程度较小,加水稀释时,浓度减小同时促进水解,但pH变化不大;向等体积纯水中分别加入等物质的量的CH3COONa和NaCN,NaCN水解程度比大CH3COONa,结合溶液电中性原则分析;
(6)根据溶度积常数计算.(1)①六种盐都为强碱弱酸盐,盐的pH越大,说明对应的酸水解程度越大,则对应的酸越弱,则
A.CH3COOH酸性大于HCN,反应能发生,故A正确;
B.酸性H2CO3>HClO>HCO3-,应生成NaHCO3,反应不能发生,故B错误;
C.酸性H2CO3>HClO>HCN,应生成NaHCO3,不能生成CO2,故C错误;
D.酸性C6H5OH>HCO3-,反应能发生,故D正确;
E.酸性H2CO3>C6H5OH>HCO3-,反应能发生,故E正确,
故答案为:BC;
②据反应H2B(少量)+2A-=B2-+2HA,可知,HA酸性小于H2B,HA酸性最弱,酸性越弱,对应的酸根离子得H+能力越强,没有HB-生成,说明得电子能力A-大于HB-,则得电子能力顺序为A->B2->HB-,故答案为:A->B2->HB-;
(2)各反应均有固体生成,其溶解度更小,故复分解反应能够向生成更难溶的物质的方向进行,
故答案为:由溶解度相对较大的物质向生成溶解度相对较小的物质的方向进行;
(3)溶液中的c(H+)=10-9mol•L-1,说明溶液呈碱性,只有Na2S和NaOH符合,故答案为:CD;
(4)一水合氨为弱电解质,不能完全电离,与盐酸反应至中性时,氨水应稍过量,则b>a,c(OH -)=1.0×10-3mol•L-1的氨水,一水合氨浓度远大于1.0×10-3mol.L-l的氨水,反应至中性时,a>c,氢氧化钡为强碱,与盐酸完全中和时,a=d,则b>a=d>c,
故答案为:b>a=d>c;
(5)CH3COONa为强碱弱酸盐,水解呈碱性,且水解程度较小,加水稀释时,浓度减小同时促进水解,但pH变化不大;向等体积纯水中分别加入等物质的量的CH3COONa和NaCN,NaCN水解程度比大CH3COONa,两种溶液中c(Na+)相等,由于CH3COONa溶液中H+浓度大于NaCN溶液中H+的浓度,则CH3COONa溶液中阴离子浓度较大,
故答案为:③;>;
(6)向50mL 0.018mol•L-1的AgNO3溶液中加入相同体积0.020mol•L-1的盐酸,盐酸过量,反应后的c(Cl-)=[0.02mol/L×0.05L-0.018mol/L×0.05L/0.1L]=0.001mol/L,
则c(Ag+)=
Ksp(AgCl)
c(Cl-)=
1.8×10-10
0.001mol/L=1.8×10-7 mol/L,
c(H+)=[0.02mol/L×0.05L/0.1L]=0.01mol/L,
pH=2,
故答案为:1.8×10-7 mol/L; 2.点评:
本题考点: 酸碱混合时的定性判断及有关ph的计算;弱电解质在水溶液中的电离平衡;难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题考查较为综合,题目难度较大,易错点为(1),注意弱电解质的比较方法以及判断角度.1年前查看全部
大家在问
- 1there is ____ what the weather will be like.
- 2关于生态系统(初二生物)在一个菜市场上,有鸡、鸭、鱼、虾、萝卜、白菜等,还有许多附着在它们身上的细菌、真菌,有同学认为它
- 381分之2乘11分之10等于多少?
- 4新建的一个小学教学楼基地长64米,宽24米,用1:2000的比例尺把它画出来.(写出计算的过程)
- 5如图,四边形ABCD为矩形,四边形ABDE为等腰梯形,AE∥BD,那么△BED与△BCD全等吗?为什么?
- 6做观察生物口腔上皮细胞的试验中,为什么要滴入稀碘液?
- 7碱式碳酸铜可表示为:xCuCO3•yCu(OH)2•zH2O(x、y、z取整数),测定碱式碳酸铜组成的方法有多种.现采用
- 8求一些用英语写的校规,班规,越多越好!
- 9求反应时间 一位司机驾车行驶速度为40[km/h] 反映距离7m 制动距离8m 求司机的反应时间
- 10建立物质的微粒观念是初中化学学习的任务之一,下列关于微粒的说法正确的是( ) A.金和铝的密度不同,主要原因之一是由于
- 11在光合作用的发现过程中,几位科学家做了几个著名的实验,各个实验的设计都有其逻辑上的严密性和意义.下述对应错误的是( )
- 12now可放在句前吗I am reading now.Now I am reading.Now,I am reading.
- 13Look,this is my s____.It's very n____.There 's a s
- 14电话提示音please down the phone number ,with the other什么什么的是什么意思?
- 15如图 28题的第二小题
