氢氧化钡溶液和醋酸反应的离子方程式
 lianleave2022-10-04 11:39:543条回答
lianleave2022-10-04 11:39:543条回答
已提交,审核后显示!提交回复
共3条回复
 bocqd 共回答了20个问题
bocqd 共回答了20个问题 |采纳率95%- CH3COOH+oh-=CH3COO-+H2O
希望对你有用,常见的醋酸盐都是可溶的. - 1年前
 善灵 共回答了24个问题
善灵 共回答了24个问题 |采纳率- ch3cooh+2oh-+ba=bacooh+h20+h;
有些符号不会打,你自己先看。 - 1年前
 aa人在外省 共回答了231个问题
aa人在外省 共回答了231个问题 |采纳率- CH3COOH+Ba2+=CH3COO-+H2O+Ba2+
- 1年前
相关推荐
- 三个方程式帮写下1.氯化钡和硫酸钠反应2.碳酸钾和稀盐酸3.氢氧化钡于稀硝酸
 magiclady1年前4
magiclady1年前4 -
 cdz0529 共回答了18个问题
cdz0529 共回答了18个问题 |采纳率83.3%BaCl2+Na2SO4==BaSO4↓ + 2NaCl
K2CO3+2HCl==2KCl + H2O+CO2↑
Ba(OH)2+2HNO3==Ba(NO3)2+2H2O1年前查看全部
- 相同浓度、相同质量的氢氧化钙、氢氧化钠、氢氧化钾、氢氧化钡吸收二氧化碳最多的是哪一个?说明理由
 kq4b28e1年前3
kq4b28e1年前3 -
 susansz88 共回答了23个问题
susansz88 共回答了23个问题 |采纳率82.6%相同质量的氢氧化钙、氢氧化钠、氢氧化钾、氢氧化钡吸收二氧化碳最多的是氢氧化钙1年前查看全部
- 鉴别稀盐酸,稀硫酸,氢氧化钡溶液,碳酸钠溶液和氯化钠溶液,五瓶无标签的溶液时
 偶然触碰记忆的伤1年前1
偶然触碰记忆的伤1年前1 -
 我已经想ee了 共回答了15个问题
我已经想ee了 共回答了15个问题 |采纳率100%1)C是HCl,有气泡产生.
2)酸性,BaSO4
3)BaCl21年前查看全部
- 向氢氧化钡溶液中加入少量亚硫酸氢钠 2HSO3-+Ba2+2OH-=BaSO3沉淀+SO32-+2H2O为什么不对?
 7鲨鱼1年前5
7鲨鱼1年前5 -
 醉玄 共回答了16个问题
醉玄 共回答了16个问题 |采纳率100%我感觉因为是向氢氧化钡溶液中加入少量亚硫酸氢钠,说明Ba(OH)2过量,而HSO3根应全部用完,所以不应有SO3根剩余,方程式应为HSO3-+(Ba2+)+(OH-)==BaSO3(沉淀)+H2O.倘若反过来向亚硫酸氢钠溶液中加入氢氧化钡,就是上边标题那个式子.
要注意谁少量,谁过量,这种题经常在这里做文章.
谁多可以不按比例系数写电离的离子,如(Ba2+)+(OH-),而少量的不行,如过量亚硫酸氢钠 2HSO3-+2OH-+Ba2+=BaSO3+SO32-+2H2O .1年前查看全部
- 硫酸和氢氧化钡的反应 反应类型
 dlljxy1年前4
dlljxy1年前4 -
 长红hh的兔子 共回答了12个问题
长红hh的兔子 共回答了12个问题 |采纳率100%H2SO4+Ba(OH)2===BaSO4+2H2O
中和反应.1年前查看全部
- 碳酸钠,硝酸,碳酸钡,亚硫酸,氢氧化铝,氢氧化钡属于强电解质的有
 cgxqyx1年前1
cgxqyx1年前1 -
 303037992 共回答了13个问题
303037992 共回答了13个问题 |采纳率100%碳酸钠是强电解质1年前查看全部
- 将氢氧化钠和氢氧化钡的混合物5.42克完全溶解在水中,加入足量的硫酸钠溶液,得到4.66克的白色沉淀.计算:
将氢氧化钠和氢氧化钡的混合物5.42克完全溶解在水中,加入足量的硫酸钠溶液,得到4.66克的白色沉淀.计算:
(1)原混合物中氢氧化钠的质量分数;
(2)再加入多少克20%的稀硫酸反应,混合液才能刚好呈中性? a000_19801年前2
a000_19801年前2 -
 莱卡27 共回答了14个问题
莱卡27 共回答了14个问题 |采纳率92.9%解题思路:(1)根据氢氧化钡和硫酸钠反应的方程式可知,生成的沉淀是硫酸钡,由硫酸钡的质量代入化学反应方程式计算,求出有关的量即可.
(2)根据(1)可计算出氢氧化钠的质量,即可计算出所需稀硫酸的质量.由氢氧化钡和硫酸钠溶液恰好完全反应可知沉淀为硫酸钡,其质量为4.66g,
设原混合物中氢氧化钡的质量为x,生成的氢氧化钠质量为y
Ba(OH)2+Na2S04═BaS04↓+2NaOH
171233 80
x 4.66g y
[171/x=
233
4.66g],[233/4.66g=
80
y]
x=3.42g y=1.6g
(1)原混合物中氢氧化钠的质量分数:[5.42g−3.42g/5.42g×100%=36.9%;
(2)设,再加入质量为x的20%的稀硫酸反应,混合液才能刚好呈中性;
H2SO4 +2NaOH═Na2SO4+2H2O
98 80
x×20% 5.42g-3.42g+1.6g
98
x×20%=
80
5.42g−3.42g+1.6g]
x=22.05g
答:(1)原混合物中氢氧化钠的质量分数36.9%(2)再加入质量为22.05g的20%的稀硫酸反应,混合液才能刚好呈中性.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 本题不简单,考查学生利用化学反应方程式的计算,(1)直接将硫酸钡质量代入化学反应方程式计算即可;(2)较复杂,需根据混合物中的氢氧化钠和生成的氢氧化钠的和来计算所需稀硫酸的质量.1年前查看全部
- 氢氧化钾、氢氧化钠、氢氧化钙、氢氧化钡的碱性谁强?
 第十微分1年前3
第十微分1年前3 -
 yur09 共回答了16个问题
yur09 共回答了16个问题 |采纳率100%跟溶解度无关,楼上误导
Ba(OH)2溶解度只有6点几克,不照样强过NaOH
而且他排序也错了,的确按照金属性的大小来排,但是金属性最强的是K不是Ba
所以正确排序是KOH>Ba(OH)2>NaOH>Ca(OH)21年前查看全部
- 向氢氧化钡溶液中滴加硫酸氨溶液和向碳酸氢氨溶液中滴加氢氧化钠溶液的化学方程式及离子方程式
 killy06211年前1
killy06211年前1 -
 red_2005 共回答了18个问题
red_2005 共回答了18个问题 |采纳率94.4%(1)向氢氧化钡溶液中滴加硫酸铵溶液,不管怎么加,反应只有一种情况
Ba(OH)2+(NH4)2SO4=BaSO4↓+2NH3·H2O
(2)向碳酸氢铵溶液中滴加氢氧化钠溶液,有2种情况
刚开始,由于滴加的NaoH量少.反应2NH4HCO3+2NaOH=(NH4)2CO3+Na2CO3+2H2O
离子方程式:HCO3- +OH-=CO32+H2O
再继续滴加NaOH,后续反应:(NH4)2CO3+2NaOH=Na2CO3+2NH3·H2O
离子方程式:NH4+ +OH-=NH3·H2O
如果一下子加入大量的NaOH:NH4HCO3+2NaOH=Na2CO3+NH3·H2O+H2O
离子方程式:
NH4+ +HCO3-+2OH- =CO32- +NH3·H2O+H2O1年前查看全部
- 碳酸钠溶液和氢氧化钡溶液反应的化学方程式和离子方程式
 ny89571391年前1
ny89571391年前1 -
 qq280477121 共回答了24个问题
qq280477121 共回答了24个问题 |采纳率87.5%化学方程式 Na2CO3 + Ba(OH)2 = BaCO3↓ + 2 NaOH
离子方程式 CO32- + Ba2+ = BaCO3↓1年前查看全部
- 向硫酸溶液中逐滴加入氢氧化钡溶液 其溶液的导电性如何变化
向硫酸溶液中逐滴加入氢氧化钡溶液 其溶液的导电性如何变化
溶液的导电性会否降为0 最后溶液的导电性会不会成为一个定值而不变了? AKQJ_sh1年前6
AKQJ_sh1年前6 -
 maggiq 共回答了20个问题
maggiq 共回答了20个问题 |采纳率90%会先减小到0 假如认为水的导电性很微弱的话
氢氧化钡过量后又增加
会接近一个定值就是原氢氧化钡溶液的导电性1年前查看全部
- 氢氧化钡加什么可以生成蓝色沉淀
 kxncdxv1年前2
kxncdxv1年前2 -
 天使最美丽 共回答了23个问题
天使最美丽 共回答了23个问题 |采纳率87%含Cu2+的溶液就行
如CuSO4、Cu(NO3)2、CuCl2
因为发生离子反应:Cu2+ +2OH- ==Cu(OH)2↓
Cu(OH)2为蓝色沉淀
虽然加CuSO4会生成BaSO4白色沉淀,但问题是“可以生成蓝色沉淀”,没说生不生成别的,我认为也对1年前查看全部
- 某中学化学课外活动小组对某工厂排放的含少量硫酸的废水进行抽样检测.取一定量的废水,用质量分数为1%的氢氧化钡溶液中和(其
某中学化学课外活动小组对某工厂排放的含少量硫酸的废水进行抽样检测.取一定量的废水,用质量分数为1%的氢氧化钡溶液中和(其它物质不与氢氧化钡反应),当恰好中和时,消耗氢氧化钡溶液的质量为171g,过滤后,测得滤液的质量为268.67g.(不考虑过滤时滤液质量损失)(计算结果保留二位小数)
求:①反应中生成沉淀的质量为多少?
②该工厂排放的废水中所含硫酸的质量分数为多少?
 zny861年前1
zny861年前1 -
 HomeKit 共回答了19个问题
HomeKit 共回答了19个问题 |采纳率94.7%171g*1%=1.71g
Ba(OH)2+H2SO4==BaSO4↓+2H2O
171 98 233
1.71g x y
171/1.71g=98/x=233/y
x=0.98g
y=2.33g
①反应中生成沉淀的质量为 2.33g
②该工厂排放的废水中所含硫酸的质量分数为 0.98g/(268.67g+2.33g-171g)*100%=0.98%1年前查看全部
- 硫酸、氢氧化钾、氢氧化钡、硫酸钠、硫酸铝、盐酸在水中发生电离的电离方程式
 火星蟑螂1年前2
火星蟑螂1年前2 -
 全额为如下 共回答了20个问题
全额为如下 共回答了20个问题 |采纳率90%H2SO4=2H++SO42-
KOH=K++OH-
Ba(OH)2=Ba2++2OH-
Na2SO4=2Na++SO42-
Al2(SO4)3=2Al3++3SO42-
HCl=H++Cl-1年前查看全部
- 氢氧化钡和氯化铵常温下生成氨气吗?为什么?
 朱丽叶家的苍蝇1年前1
朱丽叶家的苍蝇1年前1 -
 joke126 共回答了21个问题
joke126 共回答了21个问题 |采纳率90.5%可以,但必须是浓氢氧化钡
一水合氨的电离是可逆的氢氧根离子浓度大时,一水合氨电离受制,且水中饱和时就会放出氨气.所以浓氢氧化钡和氯化铵常温下生成氨气1年前查看全部
- 【在线急等】硫酸氢钠与足量氢氧化钡反应
【在线急等】硫酸氢钠与足量氢氧化钡反应
看了很多人的提问 还是不懂
硫酸氢钠与足量氢氧化钡反应和硫酸氢钠与少量氢氧化钡反应的化学方程式和离子方程式各是什么?我老是搞不清楚 麻烦讲仔细一点 nu181年前5
nu181年前5 -
 chzzz110 共回答了15个问题
chzzz110 共回答了15个问题 |采纳率100%硫酸氢钠与足量氢氧化钡反应
先看方程式
因为Ba(OH)2过量
所以NaHSO4+Ba(OH)2=NaOH+BaSO4(沉淀)+H2O
因此离子方程式为
HSO4+ +Ba2+ +OH- =BaSO4(沉淀)+H2O
硫酸氢钠与少量氢氧化钡反应
因为NaHSO4过量
所以相当于发生NaOH+NaHSO4=Na2SO4+H2O的反应
所以反应有2NaHSO4+Ba(OH)2=Na2SO4+BaSO4(沉淀)+2H2O
所以离子方程式为
2HSO4- +Ba2+ +2OH- =BaSO4(沉淀)+SO42- +2H2O
以上为考虑HSO4-为不完全电离
若认为HSO4-为完全电离得到H+和SO42-
则离子方程式改为
H+ +SO42- +Ba2+ +OH- =H2O+BaSO4(沉淀)(Ba(OH)2过量)
2H+ +SO42- +Ba2+ +2OH- =BaSO4(沉淀)+2H2O(NaHSO4过量)1年前查看全部
- 1.碳酸钙和盐酸的离子方程式 氯气与溴化钠的离子方程式 氢氧化钡和稀硫酸混合的离子方程式
 hackmt1年前3
hackmt1年前3 -
 buck1984 共回答了20个问题
buck1984 共回答了20个问题 |采纳率80%CaCO3 + 2 H+==Ca2+ +CO2 + H2O
CL2 + 2Br- ==2CL- + Br2
Ba2+ + OH- + H+ +SO42- == BaSO4 + H2O1年前查看全部
- 一定温度下,在氢氧化钡的悬浊液中,存在氢氧化钡固体与其他电离的离子间溶解平衡关系:Ba(OH)2=Ba2+ +2OH-
一定温度下,在氢氧化钡的悬浊液中,存在氢氧化钡固体与其他电离的离子间溶解平衡关系:Ba(OH)2=Ba2+ +2OH- 想此种悬浊液中加入少量的氢氧化钡粉末,下列叙述正确的是:
A:溶液中钡离子数目减小 B:溶液中钡离子浓度减少
C:溶液中氢氧根离子浓度增大 D:PH减小
我不明白题里已经说是悬浊液了,就代表已经饱和了,再氢氧化钡粉末也不会再溶解了.所以什么都应该不变啊
包括答案和分析,越明白越好
...使平衡移动的条件是浓度改变..固体好象不存在浓度的问题吧.. 温水里的冰1年前6
温水里的冰1年前6 -
 从四分之一开始 共回答了15个问题
从四分之一开始 共回答了15个问题 |采纳率100%氢氧化钡和硫酸铜一样,加到它的饱和溶液里会形成结晶水合物
加入氢氧化钡后会形成Ba(OH)2·8H2O,所以溶液中水的量减少,Ba2+的数目会减小,但离子浓度不变.
所以选A1年前查看全部
- 硫酸在水溶液中的电离方程式氢氧化钡在水溶液中的电离方程式
 buyiding1年前3
buyiding1年前3 -
 layla_princess 共回答了22个问题
layla_princess 共回答了22个问题 |采纳率95.5%H2SO4=2H+ + SO42-
Ba(OH)2=Ba2+ +2OH-1年前查看全部
- 向硫酸氢那溶液中逐滴加入氢氧化钡溶液至中性,请写出发生反应的离子方程式
 yushihai101年前2
yushihai101年前2 -
 xzcyp 共回答了15个问题
xzcyp 共回答了15个问题 |采纳率86.7%2H+ + SO42- + Ba2+ + 2OH- ==2H20+BaSO4 (沉淀)
在高中阶段认为硫酸是二元强酸,是完全电离的.1年前查看全部
- 高中化学:100℃下,PH=8的氢氧化钡与PH=5的盐酸混合后恰好中和,两者体积比是?
高中化学:100℃下,PH=8的氢氧化钡与PH=5的盐酸混合后恰好中和,两者体积比是?
可不可以用中和那么算,就是H离子等于OH离子浓度?而不用Kw 忆苦的薄荷1年前1
忆苦的薄荷1年前1 -
 szgood9 共回答了17个问题
szgood9 共回答了17个问题 |采纳率82.4%100℃时,水的离子积为1×10^-12,PH=6时为中性
PH=8的氢氧化钡溶液C(OH-)=1×10^-4
PH=5的稀盐酸C(H+)=1×10^-5
混合后PH=7,即呈碱性,
设二者体积分别为V1、V2,则
V1×1×10^-4 - V2×1×10^-5=1×10^-5×(V1+V2)
v1:v2=2:91年前查看全部
- 稀硫酸与氢氧化钡反应中和热等于-57.3kJ/mol吗
稀硫酸与氢氧化钡反应中和热等于-57.3kJ/mol吗
我资料上说因为生成硫酸钡会使中和热偏大于57.3kJ/mol(此处不含负号),而我试卷上说就等于57.3kJ/mol,到底哪个正确? mhj638134471年前1
mhj638134471年前1 -
 3djaah 共回答了13个问题
3djaah 共回答了13个问题 |采纳率92.3%因为1mol氢离子和1mol氢氧根反应的中和热是57.3k/mol,硫酸和氢氧化钡反应是2mol.另一方面,中和反应指酸和碱反应生成水的过程,硫酸钡的影响不应考虑在内.1年前查看全部
- 氢氧化钡与稀硫酸反应的化学方程式
 鬼魅浓烈1年前10
鬼魅浓烈1年前10 -
 翡翠落红尘 共回答了23个问题
翡翠落红尘 共回答了23个问题 |采纳率91.3%Ba(OH)2+H2SO4=BaSO4↓+2H2O
BaSO4为白色沉淀.1年前查看全部
- 某白色固体可能由氢氧 某白色固体可能由氢氧化钡(化学式为Ba(OH) 2 )、氢氧化钠中的一种或两种组成.为确定该固体物
某白色固体可能由氢氧
某白色固体可能由氢氧化钡(化学式为Ba(OH) 2 )、氢氧化钠中的一种或两种组成.为确定该固体物质的成分,某化学兴趣小组进行下列探究活动,请你认真阅读有关信息,回答相关问题.
【查阅资料】(1)Ba(OH) 2 是一种强碱,具有NaOH相似的化学性质.
(2)部分酸、碱、盐的溶解性如下表所示: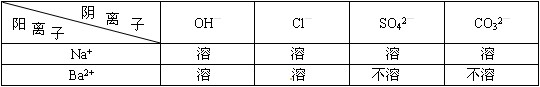
【提出猜想】猜想Ⅰ:该固体是NaOH;猜想Ⅱ:该固体是Ba(OH) 2 ;猜想Ⅲ:该固体是Ba(OH) 2 、NaOH的混合物
【设计实验】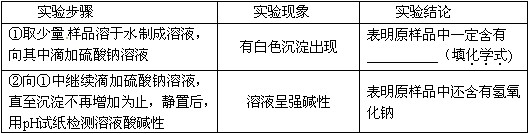
【问题讨论】(1)实验步骤①中发生反应的化学方程式为_______________.
(2)实验步骤②得出的实验结论_______(填“正确”或“不正确”).
(3)如果在上述实验中用稀硫酸代替硫酸钠溶液,实验步骤和实验现象均相同,你可以判断出猜想______是成立的. ppppg1年前1
ppppg1年前1 -
 liboshuism 共回答了18个问题
liboshuism 共回答了18个问题 |采纳率94.4%【设计实验】①Ba(OH) 2
【问题讨论】(1)Na 2 SO 4 +Ba(OH) 2 ==2NaOH+BaSO 4 ↓
(2)不正确
(3)Ⅲ1年前查看全部
- 高一化学电解质1.稀硫酸 2. 液氨 3. 氨水 4.铝条 5.熔融氯化钠 6.石墨 7.氢氧化钡溶液8.二氧化硫 9.
高一化学电解质
1.稀硫酸 2. 液氨 3. 氨水 4.铝条 5.熔融氯化钠 6.石墨 7.氢氧化钡溶液
8.二氧化硫 9.水 10.熔融Na2O 11 盐酸 12.乙醇
判断上述物质 ,A能够导电的是
B属于电解质的是
C属于非电解质的是
D属于强电解质的是
CO2 通入石灰水,溶液的导电能力先减弱而后又逐渐加强.试解析其化学变化的原因_______________,______________________________(用化学方程式表示)
金属导电是因为存在___________________,电解质导电是因为存在___________________________.液态HCl不导电是因为__________________________,HCl的水溶液能导电是因为________________,NaCl晶体不导电是因为_______________,熔融的NaCl能导电是因为__________________ winter19821年前2
winter19821年前2 -
 橙色燃烧 共回答了18个问题
橙色燃烧 共回答了18个问题 |采纳率88.9%1.稀硫酸 2.液氨 3.氨水 4.铝条 5.熔融氯化钠 6.石墨 7.氢氧化钡溶液8.二氧化硫 9.水 10.熔融Na2O 11 盐酸 12.乙醇
判断上述物质 ,A能够导电的是1 3 4 5 6 7 10 11
B属于电解质的是5 9 10
C属于非电解质的是2 8 12
D属于强电解质的是5 10
CO2 通入石灰水,先生成碳酸钙,导电能力减弱;过量后生成碳酸氢钙,导电能力又增强了.
金属导电是因为存在可自由移动的电子,电解质导电是因为存在可自由移动的离子.液态HCl不导电是因为共价化合物,熔融态不导电,HCl的水溶液能导电是因为存在自由移动的氢离子和氯离子,NaCl晶体不导电是因为没有课自由移动的离子,熔融的NaCl能导电是因为存在可自由移动的钠离子和氯离子1年前查看全部
- 八水合氢氧化钡与氯化铵反应的化学方程式
 EzNc战1年前3
EzNc战1年前3 -
 weigy 共回答了19个问题
weigy 共回答了19个问题 |采纳率89.5%八水合氢氧化钡与氯化铵反应的化学方程式
Ba(OH)2·8H2O+2NH4Cl=BaCl2+10H2O+2NH3↑
如果本题有什么不明白可以追问,1年前查看全部
- 为什么PH小于7?PH之和为13的硫酸和氢氧化钡溶液,为什么PH小于7
 rochester1981年前4
rochester1981年前4 -
 mfkgmyliern 共回答了18个问题
mfkgmyliern 共回答了18个问题 |采纳率100%无论酸碱都是2元的,无论是8+5还是4+9……无论是等体积还是不等体积,氢离子总多于氢氧根.其实你做很多题以后自然就会发现这个规律了.平安夜快乐1年前查看全部
- 有下列七种溶液:A、氢氧化钠溶液;B、氢氧化钡溶液;C、硫酸铝溶液;D、明矾溶液;E、混有少量硝酸的硫酸镁溶液;F、氯化
有下列七种溶液:A、氢氧化钠溶液;B、氢氧化钡溶液;C、硫酸铝溶液;D、明矾溶液;E、混有少量硝酸的硫酸镁溶液;F、氯化铁溶液;任取其中的一种溶液(甲)逐滴加入到另一种溶液(乙)中至过量,观察到自始至终均有白色沉淀.试回答下列问题:
(1)产生上述实验现象的试剂组合有(请用字母代号逐一列出,表格各栏可填满,可不填满,也可补充)
(2)请在下列坐标中作出第1组实验所得沉淀的物质的量(n 沉淀 /mol)随B溶液体积(V B /L)变化的曲线.组别 1 2 3 4 5 6 7 8 甲 B 乙 D
(3)如图是某一组实验中所得沉淀的物质的量(n 沉淀 /mol)随甲溶液中溶质的物质的量(n 甲 /mol)变化的曲线.符合图(右)曲线的试剂组合是:甲______(填化学式)、乙______(填化学式).
 999感冒药1年前1
999感冒药1年前1 -
 接龙822 共回答了20个问题
接龙822 共回答了20个问题 |采纳率95%(1)B(氢氧化钡溶液)+D(明矾溶液) 自始至终都有白色沉淀(BaSO 4 );B(氢氧化钡溶液)+C(硫酸铝溶液) 自始至终都有白色沉淀(BaSO 4 );B(氢氧化钡溶液)+E(混有少量硝酸的硫酸镁溶液) 自始至终都有白色沉淀(BaSO 4 );这三组中的甲、乙两种物质互相交换,又得到3种组合,共有6种组合,另A(氢氧化钠溶液)+E(混有少量硝酸的硫酸镁溶液),将A加入到E中开始没有白色沉淀生成,则有:
组别 1 2 3 4 5 6 7 8
甲 B C B E E D
乙 C B E B A B 故答案为:
组别 1 2 3 4 5 6 7 8
甲 B C B E E D
乙 C B E B A B (2)将氢氧化钡溶液逐滴加入明矾溶液中,当
n[Ba(O H) 2 ]
n[KAl( SO 4 ) 2 ] =
3
2 时,产生沉淀的物质的量最大,此时反应式为:
3Ba(OH) 2 +2KAl(SO 4 ) 2 =3BaSO 4 ↓+2Al(OH) 3 ↓+K 2 SO 4 ;当
n[Ba (OH) 2 ]
n[KAl ( SO 4 ) 2 ] =2 时,产生沉淀的物质的量最小,反应为:
2Ba(OH) 2 +KAl(SO 4 ) 2 =2BaSO 4 ↓+KAlO 2 +2H 2 O;产生1 mol Al(OH) 3 沉淀时需消耗3 mol OH - ,溶解1 mol Al(OH) 3 沉淀时需消耗1 mol OH - ,据此作出图象如下: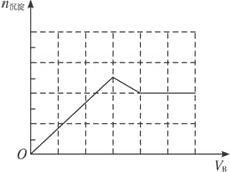
,故答案为:
;
(3)甲为Ba(OH) 2 ,乙为HNO 3 和MgSO 4 的混合溶液时,符合给出的图示关系,原理:将Ba(OH) 2 溶液逐滴加入HNO 3 和MgSO 4 的混合溶液中,开始加入的Ba(OH) 2 将HNO 3 中和,产生的沉淀只有BaSO 4 ;等到将HNO 3 完全被中和后再继续滴加Ba(OH) 2 溶液,在产生BaSO 4 沉淀的同时还会产生Mg(OH) 2 沉淀,图象中线的斜率增大(陡度增大);等到溶液中的 完全沉淀后,再继续滴加Ba(OH) 2 溶液,只产生Mg(OH) 2 沉淀,此时图象中直线的斜率变小,当溶液中的Mg 2+ 完全沉淀后,产生的沉淀量保持不变(图象保持水平).
故答案为:Ba(OH) 2 ;HNO 3 和MgSO 41年前
81年前查看全部
- 向含1mol盐酸和1mol硫酸镁的混合溶液中加入1mol/L氢氧化钡溶液,产生沉淀的物质的量(n)与加入氢氧化钡
向含1mol盐酸和1mol硫酸镁的混合溶液中加入1mol/L氢氧化钡溶液,产生沉淀的物质的量(n)与加入氢氧化钡
溶液体积(V)间的关系图正确的是
A.0-1L时,沉淀从0变成1mol,是直线;从1到1.5mol,沉淀从1.5-2mol,然后沉淀恒定在2mol
B.0-1.5L时,沉淀从0变成2mol,1.5-2L时,沉淀从2mol变成1.5mol,然后沉淀恒定在1.5mol
C.0-0.5L时,沉淀从0变成0.5mol,0.5-1L时沉淀从0.5mol到1.5mol,1-1.5L时,沉淀从1.5-2mol,然后沉淀恒定在2mol 快乐小虫220331年前2
快乐小虫220331年前2 -
 bule_xu 共回答了26个问题
bule_xu 共回答了26个问题 |采纳率96.2%C 过程中有两种沉淀产生硫酸钡及氢氧化镁.在加入0-0.5L时,会产生硫酸钡不会产生氢氧化镁,因为有盐酸要被中和,所以有沉淀从0变成0.5mol;在加入0.5-1L时,两种沉淀都会产生,沉淀从0.5mol到1.5mol;在加入1-1.5L时,只有氢氧化镁沉淀,沉淀从1.5-2mol1年前查看全部
- 含八个水分子的氢氧化钡晶体与氯化铵晶体反应的方程式
 greenli1年前1
greenli1年前1 -
 kristofic 共回答了15个问题
kristofic 共回答了15个问题 |采纳率93.3%Ba(OH)2.8H2O + 2NH4Cl = BaCl2 + 2NH3(^) + 10H2O
方程式上不用写条件:玻璃棒搅1年前查看全部
- (2002•西城区)实验室有一瓶存放时间较长的氢氧化钠,其中的一部分已转化成了碳酸钠,现要用该药品配置10%的氢氧化钡溶
(2002•西城区)实验室有一瓶存放时间较长的氢氧化钠,其中的一部分已转化成了碳酸钠,现要用该药品配置10%的氢氧化钡溶液,取50.6g 该药品,溶于200mL水中,然后慢慢地滴入17.1%的氢氧化钡溶液,当用去100g氢氧化钡溶液时,碳酸钠恰好反应完全[Na2CO3+Ba(OH)2=BaCO3↓+2NaOH.求:
(1)50.6g 该药品中碳酸钠的质量.
(2)滤出沉淀后所得溶液中溶质的质量和溶液的质量.
(3)向所得溶液中加入多少毫升水才能配制成10%的氢氧化钠溶液? 明天又是新一天了1年前1
明天又是新一天了1年前1 -
 zhongshan0508 共回答了19个问题
zhongshan0508 共回答了19个问题 |采纳率89.5%(1)反应的氢氧化钡的质量=100g×17.1%=17.1g
设50.6克该药品中碳酸钠的质量为x,生成NaOH的质量为y,生成BaCO3的质量为z.
Na2CO3+Ba(OH)2═BaCO3↓+2NaOH
10617119780
x 17.1gz y
则
106
x=
80
y=
197
z=
171
17.1g,
解得:x=10.6g y=8g,z=19.7g
(2)氢氧化钠溶液中溶质的质量=50.6g-10.6g+8g=48g
氢氧化钠溶液的质量=50.6g+200mL×1g/mL+100g-19.7g=330.9g
(3)需加入水的体积=(48g÷10%-330.9g)÷1g/mL=149.1mL
答:(1)50.6g 该药品中碳酸钠的质量为10.6g.
(2)滤出沉淀后所得溶液中溶质的质量为48g.溶液的质量为330.9g.
(3)向所得溶液中再加入149.1mL水才能配成10%的氢氧化钠溶液.1年前查看全部
- 下列各组溶液,相互不能发生反应的是( ) A.氯化铁和氢氧化钠 B.硝酸银和盐酸 C.氢氧化钡和硝酸 D.硫酸钠和碳酸
下列各组溶液,相互不能发生反应的是( ) A.氯化铁和氢氧化钠 B.硝酸银和盐酸 C.氢氧化钡和硝酸 D.硫酸钠和碳酸钾  sgping1231年前1
sgping1231年前1 -
 emily_xu 共回答了20个问题
emily_xu 共回答了20个问题 |采纳率95%A、因氯化铁和氢氧化钠相互交换成分能生成氢氧化铁沉淀,则能发生化学反应,故A错误;
B、因硝酸银和盐酸相互交换成分能生成氯化银沉淀,则能发生化学反应,故B错误;
C、因氢氧化钡和硝酸相互交换成分能生成水,则能发生化学反应,故C错误;
D、因硫酸钠和碳酸钾之间相互交换成分不能生成水、气体、沉淀,则不能反应,故D正确;
故选D.1年前查看全部
- 带8个结晶水的氢氧化钡与氯化铵反应是什么能转化为什么能?
 爱喝七喜的猫1年前2
爱喝七喜的猫1年前2 -
 maydayzhang125 共回答了23个问题
maydayzhang125 共回答了23个问题 |采纳率100%BA(OH)2.8H2O+2NH4CL=BACL2+NH3+10H2O主要是生成氨气促进反应转化1年前查看全部
- NH4Fe(SO4)2和过量氢氧化钡.方程式.为什么
 没被占用1年前2
没被占用1年前2 -
 czyong333 共回答了18个问题
czyong333 共回答了18个问题 |采纳率83.3%2NH4Fe(SO4)2+Ba(OH)2=2NH3↑+2H2O+Fe2(SO4)3+BaSO4↓
【因为2Fe3++ 3SO42-+ 3Ba2++6OH-=3BaSO4↓+ 2Fe(OH)3↓】1年前查看全部
- 写出下列反应的离子方程式:①向氢氧化钠溶液中加入氯化铜溶液:______②稀硫酸与氢氧化钡溶液反应:______③向碳酸
写出下列反应的离子方程式:
①向氢氧化钠溶液中加入氯化铜溶液:______
②稀硫酸与氢氧化钡溶液反应:______
③向碳酸氢钠溶液中加入稀盐酸:______
④过量二氧化碳通入澄清石灰水:______. 亩亩不1年前1
亩亩不1年前1 -
 jian520174 共回答了22个问题
jian520174 共回答了22个问题 |采纳率90.9%解题思路:①反应生成氢氧化铜沉淀和氯化钠;②反应生成硫酸钡沉淀和水;③反应生成氯化钠和是、二氧化碳;④反应生成碳酸氢钙.①向氢氧化钠溶液中加入氯化铜溶液反应生成氢氧化铜沉淀和氯化钠,该离子反应为Cu2++2OH-=Cu(OH)2↓,故答案为:Cu2++2OH-=Cu(OH)2↓;
②稀硫酸与氢氧化钡溶液反应生成硫酸钡沉淀和水,该离子反应为2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,故答案为:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O;
③向碳酸氢钠溶液中加入稀盐酸反应生成氯化钠和是、二氧化碳,该离子反应为HCO3-+H+=C02↑+H2O,故答案为:HCO3-+H+=C02↑+H2O;
④过量二氧化碳通入澄清石灰水中反应生成碳酸氢钙,该离子反应为CO2+OH-=HCO3-,故答案为:CO2+OH-=HCO3-.点评:
本题考点: 离子方程式的书写.
考点点评: 本题考查离子反应方程式的书写,明确发生的化学反应是解答本题的关键,注意离子反应的书写方法即可解答,题目难度不大.1年前查看全部
- 碳酸氢钠 和少量的 氢氧化钡 生成什么?和过量的 氢氧化钡 生成什么?
 qy33261年前2
qy33261年前2 -
 xiaoziyuen 共回答了16个问题
xiaoziyuen 共回答了16个问题 |采纳率93.8%少量:2NaHCO3 + Ba(OH)2====Na2CO3 + BaCO3 + 2H2O
过量:NaHCO3 + Ba(OH)2====NaOH + BaCO3 + H2O
楼下这位真懒诶1年前查看全部
- 氢氧化钡和硫酸反应的方程式这个式子是H2SO4+Ba(OH)2=BaSO4(沉淀)+2H20这个式子是这样写吗,为什么写
氢氧化钡和硫酸反应的方程式
这个式子是
H2SO4+Ba(OH)2=BaSO4(沉淀)+2H20
这个式子是这样写吗,为什么写不出离子反映方程式 算了你不懂1年前3
算了你不懂1年前3 -
 为你等在夜未央 共回答了14个问题
为你等在夜未央 共回答了14个问题 |采纳率100%你写得完全正确
因为硫酸钡是难溶物,在水中不能电离出钡离子和硫酸根离子.水的电离也很小,所以也忽略不计了.
要是写离子反应方程式,只能将左边的稀硫酸和氢氧化钡写成离子形式,而右边还是这么写.
关于硫酸钡和水的电离问题,是大学中无机化学的电离常数Ksp的内容,高中不涉及,等你到大学学到的时候就知道了.由于内容太多,这里就不展开讲了.1年前查看全部
- 氢氧化钡和稀硝酸反应方程式
 alice321年前1
alice321年前1 -
 天上莵间 共回答了20个问题
天上莵间 共回答了20个问题 |采纳率80%Ba(OH)2+2HNO3=Ba(NO3)2+2H2O
中和反应1年前查看全部
- 硫酸加入氢氧化钡溶液有没有沉淀生成?
 ljjzyn1年前3
ljjzyn1年前3 -
 apm0 共回答了22个问题
apm0 共回答了22个问题 |采纳率95.5%一定有,因为该沉淀不溶于稀硝酸,更别说是H2SO4了,所以该反应可以发生,该反应的方程式如下:H2SO4+Ba(OH)2=BaSO4(沉淀符号)+2H2O1年前查看全部
- 等物质量的氢氧化钡与明矾反应的离子方程式如何写
等物质量的氢氧化钡与明矾反应的离子方程式如何写
应该教我渔.不要只给我鱼 丰言锋语1年前1
丰言锋语1年前1 -
 leomohair 共回答了14个问题
leomohair 共回答了14个问题 |采纳率85.7%在加入氢氧化钡不到1.5倍物质的量之前都是这个反应:
2Al3++3SO42-+3Ba2++6OH-====2Al(OH)3↓+3BaSO4↓
已经简化到底了,再看不懂就没办法了1年前查看全部
- 硫酸氢钠和足量和不足量氢氧化钡的离子方程式 氢氧化钙与足量和不足量的碳酸氢钠的离子方程式 一共四
硫酸氢钠和足量和不足量氢氧化钡的离子方程式 氢氧化钙与足量和不足量的碳酸氢钠的离子方程式 一共四
硫酸氢钠和足量和不足量氢氧化钡的离子方程式 氢氧化钙与足量和不足量的碳酸氢钠的离子方程式 一共四个 lpg111年前1
lpg111年前1 -
 dying_in_the_sun 共回答了16个问题
dying_in_the_sun 共回答了16个问题 |采纳率93.8%这个不是很难1年前查看全部
- 2L0.4mol/L的硝酸铵和5L0.1mol/L的氢氧化钡混合,溶液中各离子浓度
2L0.4mol/L的硝酸铵和5L0.1mol/L的氢氧化钡混合,溶液中各离子浓度
A.c(NO3 -)>c(OH -)>c(NH4 +)>c(Ba 2+)
B.c(NO3 -)>c(Ba 2+)>c(OH -)>c(NH4 +)
原因
三楼的,OH-有1MOL,NH4+有0.8MOL,而Ba2+是0.5MOL,那么c(Ba 2+) ws00101年前5
ws00101年前5 -
 zhutianli 共回答了19个问题
zhutianli 共回答了19个问题 |采纳率94.7%0.8mol NO3 - 0.8mol NH4+ 1mol OH - 0.5mol Ba2+
由于有向外排除 并且不同溶液混合体积不一定为简单相加 溶液体积不定
发生反应为 NH4+ 与 OH - 1:1进行
0.8mol NH4+ 1mol OH - 变为 0.8mol NH3 0.8molH2O 0.2molOH -
现在溶液含
0.8mol NO3 - 0.2molOH - 0.5mol Ba2+(0.4mol Ba(NO3)2 1molBa(OH)2 )
溶液体积V
c=n/V 显然 为B1年前查看全部
- 0.01mol/l硫酸铝铵与0.02mol/l氢氧化钡溶液等体积混合离子方程式
 qwpxyz1年前2
qwpxyz1年前2 -
 孙铁铺 共回答了15个问题
孙铁铺 共回答了15个问题 |采纳率93.3%Al3+ +NH4+ +2SO4 2- +2Ba2+ +4OH-=2BaSO4+H2O+NH3+Al(OH)31年前查看全部
- 验证溶液中含有氯离子和硫酸根离子 为什么不能用氢氧化钡
 易哥哥1年前2
易哥哥1年前2 -
 涛声飞扬 共回答了12个问题
涛声飞扬 共回答了12个问题 |采纳率83.3%Ba2+只能检验SO42-,无法检验Cl-
如果要检验溶液中是否同时含有Cl-和SO42-.
应该这样:
1、向待测溶液加入少量Ba(OH)2,如产生沉淀,则进行过滤,将沉淀单独放置.
2、然后对沉淀滴加稀盐酸,如果沉淀不溶解,则说明溶液中含有SO42-
3、向第1步中的滤液滴加AgNO3,如产生不溶于HNO3的白色沉淀,说明溶液中含有Cl-
所以,只用Ba(OH)2无法同时检验出溶液中含有Cl-和SO42-1年前查看全部
- 在氢氧化钠,氢氧化钡,氢氧化钙,氨气中按溶解性,按电离程度排序
 2007yexin1年前3
2007yexin1年前3 -
 佩玉女子SOPHIA 共回答了17个问题
佩玉女子SOPHIA 共回答了17个问题 |采纳率88.2%楼上及基本正确,但最后一个错了.因为在有两级电离的情况下,是先发生一级电离,然后再二级电离,而且第二个可忽略.
NaOH = Na+ + OH-
Ba(OH)2 = Ba2+ + 2OH-
Ca(OH)2 = Ca2+ + 2OH-
MgCI2 = Mg2+ + 2CI-
CuSO4 = Cu2+ + SO42-
NaCO3 = 2Na+ + CO32-
K2SO4 =2 K+ + SO42-
FeCI3 = Fe3+ + 3CI-
(NH4)2CO3 = 2NH4+ + CO32-
NaHCO3 = Na+ + HCO3- ,HCO3-=H+ + CO32-1年前查看全部
- 碳酸氢钡与氢氧化钡混合比例结果如何
 ee人1年前1
ee人1年前1 -
 指舞 共回答了20个问题
指舞 共回答了20个问题 |采纳率85%任意比例反应都是一样的.
Ba(HCO3)+Ba(OH)2===2BaCO3↓+2H2O1年前查看全部
- 帮我写几个离子方程式,硫酸亚铁中加入经硫酸酸化的双氧水小苏打溶液与烧碱溶液反应氯气通入水中三氯化铁与氢碘酸反应氢氧化钡溶
帮我写几个离子方程式,
硫酸亚铁中加入经硫酸酸化的双氧水
小苏打溶液与烧碱溶液反应
氯气通入水中
三氯化铁与氢碘酸反应
氢氧化钡溶液与稀硫酸的反应
用氨水吸收过量二氧化碳
向漂白粉中通入二氧化碳气体
碳酸氢钠中加入少量氢氧化钡溶液
氨水与硝酸作用
硫化亚铁与稀硝酸作用
氯化铁制备氢氧化铁胶体 Jiang_linyan1年前1
Jiang_linyan1年前1 -
 zhanglia 共回答了23个问题
zhanglia 共回答了23个问题 |采纳率82.6%2Fe2+ + H2O2 + 2H+ = 2Fe3+ + 2H2O
HCO3- + OH- = CO32- + H2O
Cl2 + H2O = Cl- + HClO + H+
2Fe3+ + 2I- = 2Fe2+ +I2↓
OH- + H+ =H2O
CO2 + NH3·H2O = NH4+ + HCO3-
Ca2+ + 2ClO- +H2O + CO2 = CaCO3↓+2HClO
或ClO- + H2O + CO2 = HCO3- + HClO
HCO3- + Ba2+ + OH- = BaCO3↓+H2O
NH3·H2O +H+ =NH4+ + H2O
FeS + 6H+ + 3NO3-=Fe3+ + S + 3NO2↑ + 3H2O
Fe3+ + 3OH- = Fe(OH)31年前查看全部
- 有四种物质的溶液,1氢氧化钡2硫酸钠3硝酸4氯化铁
有四种物质的溶液,1氢氧化钡2硫酸钠3硝酸4氯化铁
不用其他试剂就可以将它们逐一鉴别出来,其鉴别顺序是?
A 1234
B 4321
C 3124
D 4132 liquan21281年前3
liquan21281年前3 -
 阳光ss 共回答了16个问题
阳光ss 共回答了16个问题 |采纳率87.5%氯化铁呈黄色,所以先鉴别出来是氯化铁.
用三支试管,各取少量其它三种待测液,然后分别加入氯化铁溶液,产生红褐色沉淀的为氢氧化钡溶液.
再另取二支试管,各取已产生的红褐色沉淀,然后分别其它二种待测液,红褐色沉淀消失的为硝酸,无现象的为硫酸钠.
所以答案为D.1年前查看全部
- 将氢氧化钡溶液逐渐滴入一点量的明矾溶液中沉淀的物质量最大时它的化学方程式
 Iacta_alea_est1年前1
Iacta_alea_est1年前1 -
 maxell1153 共回答了20个问题
maxell1153 共回答了20个问题 |采纳率85%设明矾为1摩尔.则加入1.5摩尔氢氧化钡时铝离子恰好全部沉淀完,而硫酸根还剩下0.5摩尔
此时再加入X mol 氢氧化钡,生成X mol BaSO4的同时消耗2X mol的氢氧化铝沉淀.
因此总的来说沉淀物质的量是减少的,因此铝离子全部沉淀时沉淀物质的量最大
方程为 :
3Ba(OH)2+2KAl(SO4)2==3BaSO4(沉淀)+2Al(OH)3(沉淀)+K2SO41年前查看全部
大家在问
- 1在月球上,不穿厚宇航服,能在地上走,和在地上坐这吗?
- 2(2013•黄冈模拟)如图所示,电磁铁的左下方有一铁块,在恒力F作用下沿水平面向右直线运动,若铁块从电磁铁的左下方运动到
- 3二点五乘四点八有几种简便方法计算
- 4实践证明,()多样化的趋势能满足人民多样化的需求,促进国民经济的发展?
- 5英语座右铭有哪些?
- 6请你参加下面的活动,并根据情境和要求答题。(8分)
- 7帮我算一道数学题(图)不知道怎么倒过来的
- 82{(根号a-1)+根号(b+2)+根号c+1)]=a+b+c+5,求a+b+c,
- 9小汤家三口人的年龄之和是100岁,爸爸比妈妈大2岁,小汤比妈妈小25岁,你能算出小汤一家三口的年龄分别是多少吗?试试列方
- 10化学 晶体结构原子的堆积形式有哪几种,分别是什么样的? 对应的英文简写分别是什么比如说hcp 还有哪几种?分别形容一下
- 11已知∃x0∈R,使f(x)=mx0^2-x0+1
- 124,9,x,25,36,x是什么/
- 13{6x+6Y=120 6X+4y=10}
- 14alice can swims very well.单句改错
- 15limx —>3(x²-2x+k)/(x-3)=4,求K的值
