侯氏制碱法的步骤如下:试回答下列问题:(1)写出Ⅰ和Ⅱ的总反应的化学方程式为______.(2)由此反应可知NaCl比N
 长蛇2022-10-04 11:39:541条回答
长蛇2022-10-04 11:39:541条回答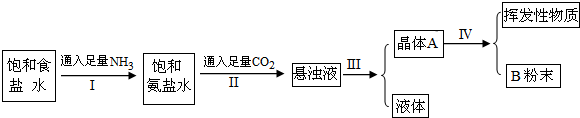
试回答下列问题:
(1)写出Ⅰ和Ⅱ的总反应的化学方程式为______.
(2)由此反应可知NaCl比NaHCO3溶解度______.
(3)操作Ⅰ、Ⅱ不能颠倒的原因是______.
(4)Ⅲ的操作叫______,晶体A的名称______.
(5)Ⅳ的操作叫______,化学反应方程式
| ||
| ||
(6)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶入水后,再滴加______.

已提交,审核后显示!提交回复
共1条回复
 jposdjo 共回答了13个问题
jposdjo 共回答了13个问题 |采纳率92.3%- 解题思路:(1)根据反应物和生成物书写化学方程式;
(2)根据NaCl比NaHCO3存在状态判断溶解度大小;
(3)根据二氧化碳和氨气的溶解度来分析;
(4)根据所要分离物质的状态选择分离装置;
(5)根据晶体A的性质选择操作方法,书写化学方程式;
(6)根据氯离子的检验方法选择试剂.(1)由试验操作Ⅰ和Ⅱ可知,反应Ⅰ和Ⅱ的反应物为,氯化钠、二氧化碳、氨气和水,生成物为碳酸氢钠沉淀和氯化铵,总化学方程为:NaCl+NH3+H2O+CO2=NaHCO3↓+NH4Cl
(2)氯化钠溶液中通入氨气、二氧化碳,析出碳酸氢钠晶体,说明氯化钠比碳酸氢铵的溶解度大;
(3)氨气极易溶于水,二氧化碳在水中的溶解度小,若操作Ⅰ和Ⅱ颠倒,会因CO2在水中溶解度小,会使NH3和CO2溶解量太小,生成的NaHCO3太少,而不能析出;
(4)Ⅲ的操作是为了分离出碳酸氢钠和氯化铵,碳酸氢钠为晶体,氯化铵溶解在水中,采用过滤的方法分离,晶体A为碳酸氢钠;
(5)碳酸氢钠不稳定,受热分解生成碳酸钠、二氧化碳和水,操作Ⅳ采用煅烧的方法来得到碳酸氢钠,化学方程式为:2NaHCO3
△
.
Na2CO3+CO2↑+H2O↑;
(6)要检验产品碳酸钠中是否含有氯化钠,实际上就是检验氯离子的存在,可先滴加过量稀硝酸,排除碳酸根离子的干扰,在滴加硝酸银溶液,如果有白色沉淀生成,则含有氯离子.
故答案为:
(1)NaCl+NH3+H2O+CO2=NaHCO3↓+NH4Cl
(2)大
(3)若颠倒,因CO2在水中溶解度小,会使NH3和CO2溶解量太小,生成的NaHCO3太小,而不能析出
(4)过滤、碳酸氢钠
(5)煅烧2NaHCO3
△
.
Na2CO3+CO2↑+H2O↑
(6)稀HNO3和AgNO3溶液点评:
本题考点: 书写化学方程式、文字表达式、电离方程式;过滤的原理、方法及其应用;酸、碱、盐的鉴别;物质的相互转化和制备.
考点点评: 化学来源于生产、生活,又服务于生产、生活,氨碱工业是初中化学重要的应用之一,是考查重点,常涉及化学方程式的书写,二氧化碳和氨气的性质以及有关化学方程式的计算等. - 1年前
相关推荐
- NaCl+NH3+H2O+CO2=NH4Cl+NaHCO3是侯氏制碱法的重要反应,反应生成的一种盐达到一定浓度时会从溶液
NaCl+NH3+H2O+CO2=NH4Cl+NaHCO3是侯氏制碱法的重要反应,反应生成的一种盐达到一定浓度时会从溶液中先结晶出来.下面正确的是
A.这个反应属于复分解反应
B.NaHCO3一定是溶于水的物质
C.反应后的溶液中存在NH4 2+
D.结晶出NaHCO3后的溶液中没有Na2+
为什么啊,
每一个选项最好都有解释,为什么对或错 loner1年前1
loner1年前1 -
 把十三手 共回答了19个问题
把十三手 共回答了19个问题 |采纳率94.7%A 该反应不属于复分解反应范畴 AB + CD==AC + BD 这才是复分解反应
B NaHCO3 这里是沉淀 错
C 明显存在NH4+,因此产物有NH4Cl,而NH4Cl极易溶于水
D 溶液里还有少量NaHCO3,因此有Na+ 存在1年前查看全部
- 采用“侯氏制碱法”生产的工业纯碱(碳酸钠)中含有少量氯化钠杂质.现欲测定某工业纯碱中碳酸钠的质量分数,进行以下实验:称取
采用“侯氏制碱法”生产的工业纯碱(碳酸钠)中含有少量氯化钠杂质.现欲测定某工业纯碱中碳酸钠的质量分数,进行以下实验:称取10.0g该纯碱样品,加入适量蒸馏水溶解,再加入足量的氯化钙溶液充分反应,过滤、洗涤、干燥后称得滤渣质量为9g,计算;
(1)该纯碱样品中碳酸钠的质量分数.(计算结果精确到0.1%,下同)
(2)该工业纯碱样品中钠元素的质量分数. 疯子爱丹1年前1
疯子爱丹1年前1 -
 万鬼 共回答了18个问题
万鬼 共回答了18个问题 |采纳率88.9%(1)设产生9g碳酸钙沉淀需要碳酸钠的质量为 x生成氯化钠的质量为y则;
Na 2 CO 3 +CaCl 2 ═CaCO 3 ↓+2NaCl
106100 117
x 9g y
根据:
106
100 =
x
9g 解得:x=9.54g,根据
100
117 =
9g
y 解得y=10.53g
所以样品中Na 2 CO 3 质量分数为:
9.54g
10g ×100%=95.4%
答:纯碱样品中碳酸钠的质量分数为95.4%;
(2)原混合物中氯化钠的质量为:10g-9.54g=0.46g,所以纯碱样品中钠元素的质量为:(0.46g+10.53g)×
23
58.5 ×100%+9.54g×
46
106 ×100%=8.46g,所以该工业纯碱样品中钠元素的质量分数:
8.46g
10g ×100%=84.6%.
故答案为:(1)95.4%;(2)84.6%.1年前查看全部
- 侯氏制碱法中哪些物质可以循环使用?
侯氏制碱法中哪些物质可以循环使用?
不要复制百科告诉我它的优点,只要知道哪些可以循环使用… 8w1jr1年前1
8w1jr1年前1 -
 zjpbzq 共回答了16个问题
zjpbzq 共回答了16个问题 |采纳率81.3%此法最大的优点就是氯化钠的高回收利用率.1年前查看全部
- 侯氏制碱法是制纯碱还是烧碱?
 笨猪1011年前2
笨猪1011年前2 -
 闲情逸致第一 共回答了20个问题
闲情逸致第一 共回答了20个问题 |采纳率85%纯碱碳酸钠
祝好!1年前查看全部
- 侯氏制碱法为纯碱工业的发展做出了杰出的贡献.用此方法制得的工业纯碱产品中会含有一定量的氯化钠.为测定一种用侯氏制碱法生产
侯氏制碱法为纯碱工业的发展做出了杰出的贡献.用此方法制得的工业纯碱产品中会含有一定量的氯化钠.为测定一种用侯氏制碱法生产的工业纯碱产品中碳酸钠的纯度,现取26.5g该工业纯碱样品.加入100g某溶质质量分数的稀盐酸,恰好完全反应,得到117.7g不饱和溶液.请回答下列问题:
(1)加入稀盐酸发生反应的化学方程式为 ;
(2)求解样品中碳酸钠质量(x)的比例式为 ;
(3)样品中碳酸钠的纯度为 ;
(4)若向反应后的溶液中加入54.5g水,则所得溶液中溶质和溶剂的质量最简比为 ;
(5)工业上常用碳酸钠和氢氧化钙反应来制取氢氧化钠.若要用这种方法制得20t含氢氧化钠80%的工业烧碱,需要上述用侯氏制碱法获得的工业纯碱产品的质量是 . solofly19821年前1
solofly19821年前1 -
 13粉丝8 共回答了22个问题
13粉丝8 共回答了22个问题 |采纳率100%(1)Na 2 C0 3 +2HCl═2NaCl+H 2 0+C0 2 ↑;(2) =
= ;(3)80%;(4)1:5;(5)26.5t.
;(3)80%;(4)1:5;(5)26.5t.
(1)碳酸钠和盐酸反应生成了氯化钠、水和二氧化碳,可以写出反应的化学方程式为:Na 2 C0 3 +2HCl═2NaCl+H 2 0+C0 2 ↑;
(2)根据质量守恒定律可以知道生成二氧化碳的质量为:100g+26.5g﹣117.7g=8.8g;
设样品中碳酸钠质量为x,生成氯化钠的质量为y
Na 2 C0 3 +2HCl═2NaCl+H 2 0+C0 2 ↑;
106 117 44
x y 8.8g
根据化学方程式中碳酸钠和二氧化碳的质量关系可以列出它们的比例关系为: =
= 解得:x=21.2g
解得:x=21.2g 解得:y=23.4g
解得:y=23.4g
(3)根据(2)中比例式可以求出碳酸钠的质量为:21.2g
所以该样品中碳酸钠的质量分数为: ×100%=80%;
×100%=80%;
(4)反应溶液中氯化钠的质量为:25.6g﹣21.2g+23.4g=28.7g
而加入54.5g水后,溶液在溶剂的质量为:54.5g+117.7g﹣28.7g=143.5g
所以该溶液中溶质和溶剂的质量比为:28.7g:143.5g=1:5;
(5)设需要改纯碱的质量为z,则:
Ca(OH) 2 +Na 2 CO 3 ═CaCO 3 ↓+2NaOH
106 80
80%•z 20t×80%=16t
解得:z=26.5t
答:需要上述用侯氏制碱法获得的工业纯碱产品的质量是26.5t.1年前查看全部
- 1926年,我国著名化学家侯德邦先生创立了侯氏制碱法,促进了世界制碱技术的发展,以从海水中提取出来的食盐为主要原料制取纯
1926年,我国著名化学家侯德邦先生创立了侯氏制碱法,促进了世界制碱技术的发展,以从海水中提取出来的食盐为主要原料制取纯碱.其生产过程中有下列反应:①NaCl+NH3+CO2+H2O═NaHCO3+NH4Cl;②2NaHCO3
Na2CO3+H2O+CO2↑;△ .
试回答下列问题:
(1)在反应①的六种物质中,焙制糕点是时常用作发酵粉的是______;
(2)胺盐水比食盐水更容易吸收二氧化碳的原因是______.
(3)氯化钠和碳酸钠的溶解度如图2,t2℃时,氯化钠饱和溶液溶质的质量分数______碳酸钠饱和溶液溶质的质量分数
(填“大于”“小于”“等于”之一).
(4)生活在盐碱湖附近的人们有一句谚语“夏天晒盐,冬天捞碱”,请结合溶解度曲线,说明这句谚语的原理:______.
 1233657581年前1
1233657581年前1 -
 nykevinyiu 共回答了20个问题
nykevinyiu 共回答了20个问题 |采纳率85%解题思路:(1)碳酸氢钠在焙制糕点时常用作发酵粉.
(2)氨气溶于水呈碱性,更容易吸收酸性氧化物二氧化碳.
(3)根据饱和溶液溶质质量分数=[溶解度/100g+溶解度]×100%进行分析.
(4)根据碳酸钠和氯化钠的溶解度随温度的变化情况来判断结晶的方法.(1)碳酸氢钠在焙制糕点时常用作发酵粉,故答案为:碳酸氢钠;
(2)氨气溶于水呈碱性,更容易吸收酸性氧化物二氧化碳,故答案为:氨气溶于水呈碱性,更容易吸收酸性氧化物二氧化碳;
(3)t2℃时,氯化钠的溶解度小于碳酸钠的溶解度,根据饱和溶液溶质质量分数=[溶解度/100g+溶解度]×100%可知,t2℃时,氯化钠的饱和溶液中溶质的质量分数小于碳酸钠的饱和溶液中溶质的质量分数,故答案为:小于;
(4)氯化钠的溶解度随温度变化不大,由于夏天气温高,水分蒸发快,氯化钠易结晶析出;纯碱的溶解度随温度的变化大,冬天气温很低,使碳酸钠结晶析出,故答案为:氯化钠的溶解度随温度变化不大,由于夏天气温高,水分蒸发快,氯化钠易结晶析出;纯碱的溶解度随温度的变化大,冬天气温很低,使碳酸钠结晶析出.点评:
本题考点: 纯碱的制取;结晶的原理、方法及其应用;固体溶解度曲线及其作用;溶质的质量分数、溶解性和溶解度的关系;常用盐的用途.
考点点评: 本题难度不是很大,主要考查了碳酸氢钠的用途、饱和溶液中溶解度的计算以及根据固体的溶解度曲线解决相关的问题等,培养分析问题、解决问题的能力.1年前查看全部
- (2013•泉州)我国著名的闽籍制碱专家侯德榜,在纯碱制造方面做出了重大贡献.用“侯氏制碱法”制得的纯碱中常含有氯化钠等
(2013•泉州)我国著名的闽籍制碱专家侯德榜,在纯碱制造方面做出了重大贡献.用“侯氏制碱法”制得的纯碱中常含有氯化钠等杂质,化学兴趣小组欲对某品牌纯碱样品中碳酸钠的质量分数进行实验探究,在老师的指导下,他们设计了下列两种实验方案进行试验.
资料摘要:
Ⅰ.碳酸钠和氯化钙能发生复分解反应.
Ⅱ.浓硫酸具有很强的吸水性;碱石灰常用于吸收水蒸气和二氧化碳.
[方案一]样品与氯化钙溶液反应,测定Na2CO3的质量分数
(1)样品与氯化钙溶液的反应实验(杂质不与氯化钙溶液反应):
(2)分析滴加的CaCl2溶液要过量的原因:______;实验操作 实验现象 实验结论 取一定量纯碱样品配成溶液后,滴加过量的CaCl2溶液. 产生白色沉淀 反应的化学方程式:
______
(3)将反应后的混合物进行过滤,把获得的沉淀物进行洗涤、干燥、称量.利用沉淀物质量计算Na2CO3的质量分数为91%.如果不洗涤沉淀物会造成测定结果大于91%,这是因为______.
[方案二]样品与稀盐酸反应,测定Na2CO3的质量分数
利用下图所示实验装置(铁架台略去)和试剂,通过测定样品和稀盐酸反应产生的CO2气体的质量,计算Na2CO3的质量分数(装置气密性良好,忽略盐酸的挥发性且每步反应或作用都是完全的).
(4)打开止水夹K,先对装置A和B(已连接)通入已除去CO2的空气一会儿,以排尽装置A和B中含有的______,再接上装置C和D.
(5)关闭止水夹K,加入足量的稀盐酸(杂质不与盐酸反应),装置A中样品产生气体的化学方程式为______.
(6)待装置A中的反应结束后,再一次打开止水夹K,继续往装置通入已除去CO2的空气一会儿.根据______ 定律,装置______(填标号)在反应前后的质量差就是产生CO2的质量,由此计算出该样品中Na2CO3的质量分数.若没有装置D,将会使测定结果______(选填“偏大”或“偏小”). xxyy0231年前1
xxyy0231年前1 -
 美望树 共回答了17个问题
美望树 共回答了17个问题 |采纳率88.2%解题思路:(1)根据碳酸钠溶液和氯化钙溶液反应生成碳酸钙沉淀和氯化钠进行解答;
(2)根据滴加的CaCl2溶液要过量的原因与碳酸钠充分反应进行解答;
(3)根据不洗涤碳酸钙表面可能会附着一层可溶性物质使沉淀物质量增加进行解答;
(4)根据空气中含有二氧化碳进行解答;
(5)根据盐酸和碳酸钠反应生成氯化钠、水和二氧化碳进行解答;
(6)根据质量守恒定律可知装置C中反应前后的质量差就是产生CO2的质量进行解答.(1)碳酸钠溶液和氯化钙溶液反应生成碳酸钙沉淀和氯化钠,反应的化学方程式:Na2CO3+CaCl2═CaCO3↓+2NaCl;故填:Na2CO3+CaCl2═CaCO3↓+2NaCl;
(2)滴加的CaCl2溶液要过量的原因与碳酸钠充分反应;故填:与碳酸钠充分反应;
(3)不洗涤碳酸钙表面可能会附着一层可溶性物质使沉淀物质量增加,所以使得计算出的碳酸钠的质量增大从而导致样品中Na2CO3的质量分数偏大;故填:不洗涤碳酸钙表面可能会附着一层可溶性物质使沉淀物质量增加,所以使得计算出的碳酸钠的质量增大;
(4)空气中含有二氧化碳,所以打开止水夹K,先对装置A和B(已连接)通入已除去CO2的空气一会儿,以排尽装置A和B中含有的二氧化碳,再接上装置C和D;故填:二氧化碳;
(5)盐酸和碳酸钠反应生成氯化钠、水和二氧化碳,化学方程式为Na2CO3+2HCl═2NaCl+H2O+CO2↑;故填:Na2CO3+2HCl═2NaCl+H2O+CO2↑;
(6)由质量守恒定律可知装置C中反应前后的质量差就是产生CO2的质量,装置D的作用是防止空气中的二氧化碳和水蒸气进入装置C,所以若没有装置D,将会使测定结果偏大.故填:质量守恒;C;偏大.点评:
本题考点: 实验探究物质的组成成分以及含量;常见气体的检验与除杂方法;盐的化学性质;质量守恒定律及其应用;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题将计算和实验有机地结合起来进行考查,通过认真审题,结合题干中已给出一系列的提示,根据提出的问题,发现有用的信息,充分发挥联想,与已有的知识建立联系,然后进行类比推导,从而达到解决问题的目的.1年前查看全部
- (2008•松北区一模)“侯氏制碱法”制得的纯碱中通常含有少量的氯化钠.某同学想测定含有氯化钠杂质的纯碱样品中杂质的质量
(2008•松北区一模)“侯氏制碱法”制得的纯碱中通常含有少量的氯化钠.某同学想测定含有氯化钠杂质的纯碱样品中杂质的质量分数.老师给出如下试剂:稀盐酸、碳酸钾溶液、氯化钙溶液.该同学操作如下;取样品5g全部溶解在20g水中,向所得溶液中加入29g某所选试剂,恰好完全反应.过滤后称得滤液质量为50g.试回答:
(1)发生反应的化学方程式是______;
(2)求解样品中纯碱质量(x)的比例式为______;
(3)样品中杂质氯化钠的质量分数为______;
(4)所得滤液中溶质的质量分数______. 八指神僧1年前1
八指神僧1年前1 -
 hailianguliu 共回答了24个问题
hailianguliu 共回答了24个问题 |采纳率83.3%解题思路:(1)纯碱就是Na2CO3,根据已知条件可知,反应前各物质质量之和=20g+5g+29g=54g,完全反应后滤液质量为50g,减少了4g,说明反应中有气体或沉淀生成;那么试剂一定不是碳酸钾溶液,因为碳酸钾溶液与碳酸钠不反应,与氯化钠反应没有气体或沉淀生成;如果试剂是盐酸,则需碳酸钠大约9g才能完全反应,也不符合,故判断所选试剂为氯化钙溶液;
(2)根据碳酸钠与氯化钙反应的化学方程式和生成沉淀的质量,列出比例式,即可得出求解样品中纯碱质量(x)的比例式,进而计算出参与反应的碳酸钠的质量和生成的氯化钠的质量;
(3)根据“[样品中氯化钠质量/样品质量]×100%”计算即可;
(4)所得滤液中溶质质量=样品中氯化钠的质量+反应后生成的氯化钠质量,然后根据溶质质量分数=[溶质质量/溶液质量]×100%计算即可.(1)氯化钙与碳酸钠反应的化学方程式为:Na2CO3+CaCl2=CaCO3↓+2NaCl;
(2)设参与反应的碳酸钠的质量为x,生成的氯化钠的质量为y,
Na2CO3+CaCl2=CaCO3↓+2NaCl
106 100 117
x 4g y
∴106:100=x:4g;
100:117=4g:y,
解之得:x=4.24g,y=4.68g;
(3)样品中杂质氯化钠的质量分数为:[5g−4.24g/5g]×100%=15.2%;
(4)所得滤液中溶质的质量为:4.68g+5g-4.24g=5.44g,
所得滤液中溶质的质量分数为:[5.44g/50g]×100%=10.88%.
故答案为:(1)Na2CO3+CaCl2=CaCO3↓+2NaCl;(2)106:100=x:4g;(3)15.2%;(4)10.88%.点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题主要考查学生利用化学方程式和溶质质量分数公式综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.1年前查看全部
- (2014•青岛二模)我国化学家侯德榜创立了著名的“侯氏制碱法”(流程简图如图),反应原理为NH3+H2O+CO2+Na
(2014•青岛二模)我国化学家侯德榜创立了著名的“侯氏制碱法”(流程简图如图),反应原理为NH3+H2O+CO2+NaCl=NH4Cl+NaHCO3(析出),促进了世界制碱技术的发展.下列说法正确的是( )

A.沉淀池中得到的沉淀是NaHCO3,因为该条件下NaHCO3的溶解度比NH4Cl小
B.过滤得到的“母液”中一定只含有两种溶质
C.图中X可能是氨气
D.通入氨气的作用是使溶液呈碱性,促进二氧化碳的吸收,更多地析出沉淀 1jkhla1年前1
1jkhla1年前1 -
 泪多 共回答了17个问题
泪多 共回答了17个问题 |采纳率94.1%解题思路:A、根据NaHCO3的溶解度比NH4Cl小分析;
B、过滤得到的“母液”中含有的溶质有碳酸氢钠、氯化铵,还有可能含有过量的反应物;
C、根据碳酸氢钠受热分解的生成物考虑;
D、根据氨气的水溶液显碱性考虑.A、在该温度下NaHCO3的溶解度比NH4Cl小,NaHCO3会在沉淀池中沉淀出来,故A正确;
B、过滤得到的“母液”中含有的溶质有碳酸氢钠、氯化铵,还有可能含有过量的氯化钠,故B错;
C、碳酸氢钠分解生成碳酸钠、水、二氧化碳,所以X是二氧化碳,故C错;
D、氨气的水溶液显碱性,能更好的吸收二氧化碳,使反应物浓度大,反应速度快,故D正确.
答案:AD.点评:
本题考点: 纯碱的制取.
考点点评: 解答本题关键是要知道沉淀池中发生的反应,熟悉碳酸氢钠受热分解的产物,知道考虑反应后溶液中溶质时,还需要考虑反应物是否过量问题.1年前查看全部
- “NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl”是著名的”侯氏制碱法“的重要反应. 下面是4位
“NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl”是著名的”侯氏制碱法“的重要反应. 下面是4位同学对该反应涉及的有关知识发表的部分见解.其中不正确的是( )
A.甲同学说:该条件下NaHCO3的溶解度较小
B.乙同学说:NaHCO3不是纯碱
C.丙同学说:析出NaHCO3固体后的溶液中只含氯化铵和氯化钠
D.丁同学说:从该反应生成的NaHCO3可以加热制取纯碱 hanxu1971年前1
hanxu1971年前1 -
 bl8kg 共回答了17个问题
bl8kg 共回答了17个问题 |采纳率82.4%解题思路:A、从“NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl”可以看出,碳酸氢钠的溶解度小,以沉淀的形式析出.B、碳酸氢钠俗称小苏打,碳酸钠俗称纯碱.C、析出碳酸氢钠,说明剩余的溶液为碳酸氢钠的饱和溶液,据此进行分析判断.D、根据碳酸氢钠的化学性质进行分析判断.A、从“NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl”可以看出,碳酸氢钠以沉淀的形式析出,说明碳酸氢钠的溶解度小,在该温度下结晶析出;故选项说法正确.
B、碳酸氢钠俗称小苏打,不是纯碱,故选项说法正确.
C、析出固体后的溶液一定是碳酸氢钠的饱和溶液,故析出NaHCO3固体后的溶液中还含有碳酸氢钠,故选项说法错误.
D、加热碳酸氢钠可生成碳酸钠、水、二氧化碳,碳酸钠俗称纯碱,故从该反应生成的NaHCO3可以加热制取纯碱,故选项说法正确.
故选C.点评:
本题考点: 纯碱的制取;碳酸钠、碳酸氢钠与碳酸钙.
考点点评: 本题有一定难度,考查同学们新信息获取、处理及灵活运用所学知识进行分析问题、解决问题的能力.1年前查看全部
- 我国化学家侯德榜创立了著名的“侯氏制碱法”(流程简图如图),促进了世界制碱技术的发展.下列有关说法正确的是( )
我国化学家侯德榜创立了著名的“侯氏制碱法”(流程简图如图),促进了世界制碱技术的发展.下列有关说法正确的是( )

A.沉淀池中的反应物共含有七种元素
B.过滤得到的“母液”中一定只含有两种溶质
C.图中X可能是氨气
D.通入氨气的作用是使溶液呈碱性,促进二氧化碳的吸收,更多地析出沉淀 ceci81381年前1
ceci81381年前1 -
 teiww 共回答了10个问题
teiww 共回答了10个问题 |采纳率90%解题思路:A、根据沉淀池中发生的反应是氯化钠、氨气、二氧化碳和水,再分析元素种类即可;
B、过滤得到的“母液”中含有的溶质有碳酸氢钠、氯化铵,还有可能含有过量的反应物;
C、根据碳酸氢钠受热分解的生成物考虑;
D、根据氨气的水溶液显碱性考虑.A、沉淀池中发生的反应的反应物是氯化钠、氨气、二氧化碳和水,所以含有钠、氯、氮、氢、碳、氧六种元素,故A错误;
B、过滤得到的“母液”中含有的溶质有碳酸氢钠、氯化铵,还有可能含有过量的氯化钠,故B错误;
C、碳酸氢钠分解生成碳酸钠、水、二氧化碳,所以X是二氧化碳,故C错误;
D、氨气的水溶液显碱性,能更好的吸收二氧化碳,使反应物浓度大,反应速度快,故D正确.
故选D.点评:
本题考点: 纯碱的制取.
考点点评: 解答本题关键是要知道沉淀池中发生的反应,熟悉碳酸氢钠受热分解的产物,知道考虑反应后溶液中溶质时,还需要考虑反应物是否过量问题.1年前查看全部
- (2009•大连二模)采用“侯氏制碱法”生产的工业纯碱(碳酸钠)中含有少量氯化钠杂质.现欲测定某工业纯碱中碳酸钠的质量分
(2009•大连二模)采用“侯氏制碱法”生产的工业纯碱(碳酸钠)中含有少量氯化钠杂质.现欲测定某工业纯碱中碳酸钠的质量分数,进行以下实验:称取10.0g该纯碱样品,加入适量蒸馏水溶解,再加入足量的氯化钙溶液充分反应,过滤、洗涤、干燥后称得滤渣质量为9g,计算;
(1)该纯碱样品中碳酸钠的质量分数.(计算结果精确到0.1%,下同)
(2)该工业纯碱样品中钠元素的质量分数. duchao5301年前1
duchao5301年前1 -
 黑白乔依 共回答了24个问题
黑白乔依 共回答了24个问题 |采纳率83.3%解题思路:样品中只有碳酸钠和氯化钙溶液反应生成碳酸钙沉淀,所以根据化学方程式计算出碳酸钠的质量,进而计算出碳酸钠的质量分数和钠元素的质量分数.(1)设产生9g碳酸钙沉淀需要碳酸钠的质量为 x生成氯化钠的质量为y则;
Na2CO3+CaCl2═CaCO3↓+2NaCl
106100 117
x 9g y
根据:[106/100=
x
9g]解得:x=9.54g,根据[100/117=
9g
y]解得y=10.53g
所以样品中Na2CO3质量分数为:[9.54g/10g]×100%=95.4%
答:纯碱样品中碳酸钠的质量分数为95.4%;
(2)原混合物中氯化钠的质量为:10g-9.54g=0.46g,所以纯碱样品中钠元素的质量为:0.46g×[23/58.5]×100%+9.54g×[46/106]×100%=4.32g,所以该工业纯碱样品中钠元素的质量分数:[4.32g/10g]×100%=43.2%.
故答案为:(1)95.4%;(2)43.2%.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 根据化学反应方程式计算的过程中,一定要注意:(1)设未知量x时,x的后面不要带单位;(2)书写化学方程式的时候,切记严格地按照“写→配→标→注”步骤细心书写;(3)找质量关系时,最好先找下一行的实际质量关系(即已知量和未知量),然后再对应着找上一行的相对质量关系.并且,切记将它们都写在相应的化学式的正下方,分居上下两行.(4)列比例式时,要按照“上一行的相对质量比等于下一行的实际质量比”的顺序来列;保证是对应比相等.(5)求算x时,可以参考着化学方程式下面的两行质量关系中的上下或左右的倍数关系来求算.当没有倍数关系时,再按照一般的方法来求算便是.(6)在写答案时,只需要简明扼要地答出关键语句即可.1年前查看全部
- (2002•昆明)某化工厂运用我国著名化学家侯德榜先生的“侯氏制碱法”制得的纯碱(Na2CO3)中含有少量氯化钠.现取某
(2002•昆明)某化工厂运用我国著名化学家侯德榜先生的“侯氏制碱法”制得的纯碱(Na2CO3)中含有少量氯化钠.现取某种仅含有氯化钠杂质的纯碱样品11.1g,全部溶解在120g水中,再加入氯化钡溶液144g,恰好完全反应并生成碳酸钡沉淀:
Na2CO3+BaCl2═BaCO3↓+2NaCl过滤干燥后,称得沉淀质量为19.7g.求:
(1)纯碱样品中Na2CO3的质量.
(2)滤液中溶质的质量分数(计算结果精确到0.1). xdcity1年前1
xdcity1年前1 -
 一只浅水鱼 共回答了20个问题
一只浅水鱼 共回答了20个问题 |采纳率90%解题思路:(1)根据碳酸钠和氯化钡反应的化学方程式,得出各物质之间的质量比,列出比例式,可以计算出纯碱样品中Na2CO3的质量;
(2)根据碳酸钠和氯化钡反应的化学方程式,可以计算出反应后生成NaCl的质量.由此可以计算出反应后溶质的质量=纯碱样品中含氯化钠的质量+反应后生成NaCl的质量;反应后溶液质量=参与反应的物质质量-生成沉淀的质量.然后根据溶质质量分数公式计算即可.(1)设纯碱样品中Na2CO3的质量为x,反应后生成NaCl的质量为y,
Na2CO3+BaCl2=BaCO3↓+2NaCl
106 197 117
x 19.7g y
∴[106/x=
197
19.7g],[197/19.7g=
117
y],
解之得:x=10.6g,y=11.7g,
(2)反应后溶液的质量为:120g+11.1g+144g-19.7g=255.4g,
溶质的质量为:11.1g-10.6g+11.7g=12.2g,
滤液中溶质的质量分数为 [12.2g/255.4g]×100%=4.78%.
答:(1)纯碱样品中Na2CO3的质量为10.6g;
(2)滤液中溶质的质量分数为4.78%.点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
考点点评: 本题主要考查学生运用化学方程式和溶质质量分数公式进行计算的能力.1年前查看全部
- 某研究性学习小组学习了工业“侯氏制碱法”的原理后,知道如下反应:
某研究性学习小组学习了工业“侯氏制碱法”的原理后,知道如下反应:
NaCl + NH 3 + CO 2 + H 2 O = NaHCO 3 ↓+ NH 4 Cl 。
【提出问题】能否在实验室模拟“侯氏制碱法”制取NaHCO 3 的过程呢?
【实验验证】如下图是该学习小组进行模拟实验时所用到的部分主要装置和药品。
请回答下列问题:
⑴ 检验A装置气密性的方法是:塞紧带长颈漏斗的橡胶塞,夹紧弹簧夹后,从漏斗注入一定量的水,使漏斗内的水面高于试管内的水面,停止加水后,若 ,说明装置不漏气。
⑵该实验中用B装置制取的气体是 (填化学式),B装置中盛装浓氨水的仪器名称为 ,本实验中使用该仪器的优点是 。
⑶D是连接在装置A与装置C之间的气体净化装置,进气口是 (填a或b),D的作用是除去HCl气体,反应的化学方程式为 。
⑷实验时先向饱和NaCl溶液中通入较多的NH 3 (溶液显碱性),再通入足量的CO 2 ,其原因是 (填写序号)。
① 使CO 2 更易被吸收② NH 3 比CO 2 更易制取③ CO 2 的密度比NH 3 大
⑸用 的方法将生成的NaHCO 3 晶体从混合物中分离出来。
【得出结论】利用“侯氏制碱法”在实验室可以制取NaHCO 3 。 boayangfei1年前1
boayangfei1年前1 -
 iir_9belx7b86 共回答了18个问题
iir_9belx7b86 共回答了18个问题 |采纳率77.8%(1)漏斗中与试管中的液(水)面差保持不变或漏斗中的液(水)面不再下降 (2)NH 3
分液漏斗 便于控制气体的产生速率和产量 (3)a NaHCO 3 + HCl =" NaCl" + H 2 O + CO 2 ↑ (4) ① (5)过滤
1年前查看全部
- 侯氏制碱法为纯碱工业的发展做出了杰出的贡献.用此方法制得的工业纯碱产品中会含有一定量的氯化钠.为测定一种用侯氏制碱法生产
侯氏制碱法为纯碱工业的发展做出了杰出的贡献.用此方法制得的工业纯碱产品中会含有一定量的氯化钠.为测定一种用侯氏制碱法生产的工业纯碱产品中碳酸钠的纯度,现取26.5g该工业纯碱样品.加入100g某溶质质量分数的稀盐酸,恰好完全反应,得到117.7g不饱和溶液.请回答下列问题:
(1)加入稀盐酸发生反应的化学方程式为______;
(2)求解样品中碳酸钠质量(x)的比例式为______;
(3)样品中碳酸钠的纯度为______;
(4)若向反应后的溶液中加入54.5g水,则所得溶液中溶质和溶剂的质量最简比为______;
(5)工业上常用碳酸钠和氢氧化钙反应来制取氢氧化钠.若要用这种方法制得20t含氢氧化钠80%的工业烧碱,需要上述用侯氏制碱法获得的工业纯碱产品的质量是______. 烟雨凄谜1年前1
烟雨凄谜1年前1 -
 非常飘雪 共回答了20个问题
非常飘雪 共回答了20个问题 |采纳率95%解题思路:(1)碳酸钠和盐酸反应生成了氯化钠、水和二氧化碳,可以据此写出反应的化学方程式;
(2)根据中质量守恒定律可以求算出生成二氧化碳的质量,然后结合反应的化学方程式可以列出样品中求算碳酸钠的比例式;
(3)根据(2)比例式可以求算出碳酸钠的质量,进而求算出碳酸钠的纯度;
反应后的溶液为氯化钠溶液,求出氯化钠的质量,本题迎刃而解;
(5)根据碳酸钠和氢氧化钙反应的化学方程式,结合氢氧化钠的质量可以求算出所需纯碱的质量.(1)碳酸钠和盐酸反应生成了氯化钠、水和二氧化碳,可以写出反应的化学方程式为:Na2C03+2HCl═2NaCl+H20+C02↑;
(2)根据质量守恒定律可以知道生成二氧化碳的质量为:100g+26.5g-117.7g=8.8g;
设样品中碳酸钠质量为x,生成氯化钠的质量为y
Na2C03+2HCl═2NaCl+H20+C02↑;
106 11744
xy8.8g
根据化学方程式中碳酸钠和二氧化碳的质量关系可以列出它们的比例关系为:
[106/44]=[x/8.8g] 解得:x=21.2g
[117/y=
44
8.8g] 解得:y=23.4g
(3)根据(2)中比例式可以求出碳酸钠的质量为:21.2g
所以该样品中碳酸钠的质量分数为:[21.2g/26.5g]×100%=80%;
(4)反应溶液中氯化钠的质量为:26.5g-21.2g+23.4g=28.7g
而加入54.5g水后,溶液在溶剂的质量为:54.5g+117.7g-28.7g=143.5g
所以该溶液中溶质和溶剂的质量比为:28.7g:143.5g=1:5;
(5)设需要改纯碱的质量为z,则:
Ca(OH)2+Na2CO3═CaCO3↓+2NaOH
10680
80%•z 20t×80%=16t
[106/80%•z=
80
16t]
解得:z=26.5t
答:需要上述用侯氏制碱法获得的工业纯碱产品的质量是26.5t.
故答案为:(1)Na2C03+2HCl═2NaCl+H20+C02↑;(2)[106/44]=[x/8.8g];(3)80%;(4)1:5;(5)26.5t.点评:
本题考点: 纯碱的制取;碳酸钠、碳酸氢钠与碳酸钙;根据化学反应方程式的计算.
考点点评: 要想解答好这类题目,首先,要理解和熟记碳酸钠、碳酸氢钠与碳酸钙等相关知识.然后,根据所给的实验、问题情景或图表信息等,结合所学的相关知识和技能,以及自己的生活经验所得,细致地分析题意等,联系起来综合分析,并细心地探究、推理后,按照题目要求进行认真地解答即可.1年前查看全部
- 中学化学中的一些常见物质有下图转化关系(部分产物未给出)。其中A的焰色呈黄色,D常温下为黄绿色气体,反应③为侯氏制碱法反
中学化学中的一些常见物质有下图转化关系(部分产物未给出)。其中A的焰色呈黄色,D常温下为黄绿色气体,反应③为侯氏制碱法反应原理之一,E是常见的金属。

回答下列问题。
(1)F的电子式为 。
(2)G的化学式为 。
(3)写出反应①的化学方程式 。
(4)写出反应②的离子方程式 。 心玉1年前1
心玉1年前1 -
 虽弓木对口 共回答了17个问题
虽弓木对口 共回答了17个问题 |采纳率76.5%1年前查看全部
- 侯氏制碱法问题“向滤出的NaHCO3晶体后的NH4Cl溶液加入食盐,使其中的NH4Cl单独结晶析出” 请问NH4Cl怎么
侯氏制碱法问题
“向滤出的NaHCO3晶体后的NH4Cl溶液加入食盐,使其中的NH4Cl单独结晶析出” 请问NH4Cl怎么析出?溶剂质量也没变,温度也没变,溶解度也没变, yang200608281年前4
yang200608281年前4 -
 吉林长春金乌炭雕 共回答了22个问题
吉林长春金乌炭雕 共回答了22个问题 |采纳率86.4%这一步要冷却的,NH4Cl 在常温时的溶解度比 NaCl 大,而在低温下却比 NaCl 溶解度小,在 278K 283K(5 10 ℃ ) 时,向母液中加入食盐细粉,而使 NH4Cl 单独结晶析出供做氮肥1年前查看全部
- (2014•毕节市)我国著名的化学家侯德榜发明的“侯氏制碱法”,是向饱和食盐水中通入过量氨气,再通入过量的二氧化碳,即可
(2014•毕节市)我国著名的化学家侯德榜发明的“侯氏制碱法”,是向饱和食盐水中通入过量氨气,再通入过量的二氧化碳,即可析出NaHCO3固体,将其加热得到纯碱.反应的化学方程式为:NaCl+H2O+CO2+NH3═NaHCO3↓+NH4Cl
2NaHCO3
Na2CO3+CO2↑+H2O△ .
由上述信息可知,NaHCO3常温下溶解度较______,受热易______,若Na2CO3中混有NaHCO3杂质,可用______方法将杂质除去. llnec1年前1
llnec1年前1 -
 busuzhike 共回答了21个问题
busuzhike 共回答了21个问题 |采纳率85.7%解题思路:向饱和食盐水中通入过量氨气,再通入过量的二氧化碳,即可析出NaHCO3固体,说明NaHCO3常温下的溶解度减小;
碳酸氢钠受热分解生成碳酸钠、水和二氧化碳;
碳酸钠的热稳定性强,受热不容易分解.因为向饱和食盐水中通入过量氨气,再通入过量的二氧化碳,即可析出NaHCO3固体,说明NaHCO3常温下的溶解度减小;
碳酸氢钠受热分解生成碳酸钠、水和二氧化碳,说明碳酸氢钠受热易分解;
若Na2CO3中混有NaHCO3杂质,可用加热方法将杂质除去.
故填:小;分解;加热.点评:
本题考点: 纯碱的制取;盐的化学性质.
考点点评: 实验现象是物质之间相互作用的外在表现,因此要学会设计实验、观察实验、分析实验,为揭示物质之间相互作用的实质奠定基础.1年前查看全部
- (2003•大连)工业上用“侯氏制碱法”制得的纯碱中常含有少量的氯化钠.为测定某纯碱样品中碳酸钠的质量分数,三位同学分别
(2003•大连)工业上用“侯氏制碱法”制得的纯碱中常含有少量的氯化钠.为测定某纯碱样品中碳酸钠的质量分数,三位同学分别设计了甲、乙、丙三套实验装置(如图所示).
 测定的方法是:取一定质量的纯碱样品,加入足量的稀硫酸,产生的二氧化碳气体用足量的氢氧化钠溶液吸收,根据氢氧化钠溶液(盛装在甲乙丙装置中Ⅰ、Ⅱ、Ⅲ瓶中)在实验前后的质量差,通过计算,确定碳酸钠的质量分数.操作时,甲.丙装置中气囊内的空气可以根据需要排出装置中的气体.在滴加稀硫酸前,连接甲乙丙装置的a、b管口.上述装置中,______(填“甲”、“乙”或“丙”)装置能比较准确地测得样品中碳酸钠的质量分数.请分别指出另外两套装置的一点不足:______.
测定的方法是:取一定质量的纯碱样品,加入足量的稀硫酸,产生的二氧化碳气体用足量的氢氧化钠溶液吸收,根据氢氧化钠溶液(盛装在甲乙丙装置中Ⅰ、Ⅱ、Ⅲ瓶中)在实验前后的质量差,通过计算,确定碳酸钠的质量分数.操作时,甲.丙装置中气囊内的空气可以根据需要排出装置中的气体.在滴加稀硫酸前,连接甲乙丙装置的a、b管口.上述装置中,______(填“甲”、“乙”或“丙”)装置能比较准确地测得样品中碳酸钠的质量分数.请分别指出另外两套装置的一点不足:______.  忍不住有话要说1年前1
忍不住有话要说1年前1 -
 文子9541 共回答了16个问题
文子9541 共回答了16个问题 |采纳率87.5%解题思路:为了防止反应产生的气体从长颈漏斗逸出,长颈漏斗末端应该浸没在液面以下;
因为是利用氢氧化钠吸收二氧化碳的方法来测定纯碱样品中碳酸钠的质量分数,因此该实验中应该除去空气中的二氧化碳,以免影响实验结果.丙装置中,通过氢氧化钠溶液可以除去空气中的二氧化碳,通过浓硫酸可以除去二氧化碳中的水蒸气,使干燥的二氧化碳被氢氧化钠溶液吸收,从而能比较准确地测得样品中碳酸钠的质量分数.
故填:丙.
甲装置的不足之处:反应生成的气体会从长颈漏斗逸出,空气中的二氧化碳没有除去,这些都能够影响实验结果;乙装置的不足之处:装置中空气中的二氧化碳没有除去,会影响实验结果.
故填:甲装置的不足之处:反应生成的气体会从长颈漏斗逸出;乙装置的不足之处:装置中空气中的二氧化碳没有除去.点评:
本题考点: 实验探究物质的组成成分以及含量;气体的净化(除杂);盐的化学性质.
考点点评: 实验是化学的重要组成部分,正确的实验操作是得出科学结论的前提条件之一,因此要学会设计实验、进行实验、分析实验,为得出正确的结论奠定基础.1年前查看全部
- (8分) “侯氏制碱法”制得的纯碱(Na 2 CO 3 )中常含有少量氯化钠。某化学兴趣小组的同学拟测定某纯碱样品中Na
(8分) “侯氏制碱法”制得的纯碱(Na 2 CO 3 )中常含有少量氯化钠。某化学兴趣小组的同学拟测定某纯碱样品中Na 2 CO 3 的质量分数。
【方案一】沉淀分析法(如下图所示)。
(1)溶液M含有的溶质是CaCl 2 和 ;沉淀N的化学式是 。
【方案二】气体分析法
称取该纯碱样品21.5g,加入到盛有150 g的稀盐酸的烧杯中,样品完全反应后,测得烧杯内混合物的质量为162.7 g。
(2)写出实验室检验反应中生成气体的化学方程式: 。
(3)求该纯碱样品中Na 2 CO 3 的质量分数。(写出具体计算过程) 。
(4)假如称量准确,通过计算得到的纯碱样品中Na 2 CO 3 的质量分数比实际数值偏小,你认为其中可能的原因是 。 zhengdatou1年前1
zhengdatou1年前1 -
 NoRegrets 共回答了14个问题
NoRegrets 共回答了14个问题 |采纳率100%1年前查看全部
- Na2CO3与NaHCO3都易溶于水 但为什么侯氏制碱法中NaHCO3能析出 且反应方程式打沉
Na2CO3与NaHCO3都易溶于水 但为什么侯氏制碱法中NaHCO3能析出 且反应方程式打沉
Na2CO3与NaHCO3都易溶于水 但为什么侯氏制碱法中NaHCO3能析出 且反应方程式打沉淀符号 hn1251年前3
hn1251年前3 -
 再扒就把你吃掉2 共回答了22个问题
再扒就把你吃掉2 共回答了22个问题 |采纳率86.4%因为碳酸氢钠溶解度低1年前查看全部
- 侯氏制碱法中在过滤后的母液中加入氯化钠粉末,通入氨气,来使副产品氯化铵晶体析出
侯氏制碱法中在过滤后的母液中加入氯化钠粉末,通入氨气,来使副产品氯化铵晶体析出
加入细小食盐颗粒并冷却,就是利用氯化铵在低温下溶解度比NaCL小的原理,来析出氯化铵,一直不理解为什么氯化铵在低温下溶解度比NaCL小就能使氯化铵析出,这跟氯化铵和氯化钠的溶解度有关吗 还有,如果不加入氯化钠不可以吗 ss市民1年前4
ss市民1年前4 -
 xu568306675 共回答了14个问题
xu568306675 共回答了14个问题 |采纳率100%不可以的,加入氯化钠是因为氯化钠可以在溶液中加入氯离子,而且溶解度很高,其实如果不再加氯化钠,也可以析出氯化铵,因为氯化铵低温溶解度较小,低温下易饱和.而加入氯化钠之后可让氯化铵析出更多.NH4(+)+Cl-==NH4Cl(中间为可逆号)加入氯化钠,氯离子增多,促进方程式右移,析出增多.1年前查看全部
- (2011•东丽区一模)用“侯氏制碱法”制得的纯碱中常含有少量的氯化钠.为测定某纯碱样品中碳酸钠的质量分数,小雯同学称取
(2011•东丽区一模)用“侯氏制碱法”制得的纯碱中常含有少量的氯化钠.为测定某纯碱样品中碳酸钠的质量分数,小雯同学称取该样品5.6 g加入到盛有100g稀盐酸的烧杯中,完全反应后称得烧杯中的溶液质量为103.4g.(反应的化学方程式为:Na2CO3+2HCl=2NaCl+CO2↑+H2O)
求:
(1)完全反应后生成二氧化碳的质量为______ g.
(2)该纯碱样品中碳酸钠的质量分数.(结果精确到0.1%) 不知道35981年前1
不知道35981年前1 -
 chang990 共回答了17个问题
chang990 共回答了17个问题 |采纳率94.1%解题思路:(1)根据质量守恒定律,反应前后烧杯中总质量减少的质量为二氧化碳的质量;
(2)由二氧化碳的质量,根据碳酸钠与盐酸反应的方程式,求出碳酸钠的质量,就可以求出该纯碱样品中碳酸钠的质量分数.(1)由质量生守定律及题意可知,生成的二氧化碳的质量为:5.6 g+100g-103.4g=2.2g;
(2)设碳酸钠的质量为X
Na2CO3+2HCl=2NaCl+CO2↑+H2O
106 44
X2.2g
[106/44=
X
2.2g] 解得:X=5.3g
该纯碱样品中碳酸钠的质量分数为:
[5.3g/5.6g]×100%=94.6%
答:(1)2.2;(2)该纯碱样品中碳酸钠的质量分数94.6%.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 利用质量守恒定律分析反应前后质量变化,获得反应生成二氧化碳的质量,由此体现运用基础知识对问题的分析能力.1年前查看全部
- 侯氏制碱法中向NH4CL溶液中加食盐,为什么NH4CL会单独结晶析出
 相爱至yy1年前1
相爱至yy1年前1 -
 大智慧ddyy 共回答了21个问题
大智慧ddyy 共回答了21个问题 |采纳率95.2%因为氯化钠的溶解度大于氯化铵的原因、氯化铵会析出结晶1年前查看全部
- 侯氏制碱法,为什么先通NH3,再通CO2?
侯氏制碱法,为什么先通NH3,再通CO2?
为什么饱和NaCl中先通NH3,再通过量CO2制NaHCO3,
而不能先CO2再NH3? sylian1年前2
sylian1年前2 -
 梦叛逆 共回答了23个问题
梦叛逆 共回答了23个问题 |采纳率95.7%首先,NH3在水中溶解度大,1:700.而CO2在水中溶解度小.
所以先通溶解度大的气体,而且NH3通入后,使溶液变为弱碱性,CO2是酸性气体,这样就可以加大CO2的溶解度了.1年前查看全部
- (2008•西城区一模)NaCl+CO2+NH3+H2O═NaHCO3↓+NH4Cl是“侯氏制碱法”的重要反应.下面四位
(2008•西城区一模)NaCl+CO2+NH3+H2O═NaHCO3↓+NH4Cl是“侯氏制碱法”的重要反应.下面四位同学对该反应发表的见解正确的是( )
A.
B.
C.
D.
 1qaz000001年前1
1qaz000001年前1 -
 Z_dahlia 共回答了17个问题
Z_dahlia 共回答了17个问题 |采纳率94.1%解题思路:反应类型有四个:化合反应、分解反应、置换反应和复分解反应.置换反应是一种单质和一种化合物反应生成另一种单质和另一种化合物的化学反应;复分解反应是两种化合物互相交换成分生成另外两种化合物.A、化合反应是多变一,故选项错误;
B、NaHCO3是小苏打,碳酸钠才是纯碱,故选项错误;
C、析出固体后是碳酸氢钠的饱和溶液,故选项错误;
D、NH4Cl是氮肥,故选项正确;
故选D点评:
本题考点: 反应类型的判定;饱和溶液和不饱和溶液;碳酸钠、碳酸氢钠与碳酸钙;常见化肥的种类和作用.
考点点评: 本考点考查了基本反应类型的判断和盐的性质,要牢记四个基本反应类型的概念和盐的性质,并会理解应用.本考点基础性比较强,主要出现在选择题和填空题中.1年前查看全部
- 侯氏制碱法的原理是什么将几个化学式合并起来回答
 congjin11年前2
congjin11年前2 -
 男人森林110 共回答了18个问题
男人森林110 共回答了18个问题 |采纳率88.9%NH3+H2O+CO2=NH4HCO3
NH4HCO3+NaCl=NH4Cl+NaHCO3↓
2NaHCO3=(加热)=Na2CO3+H2O+CO2↑1年前查看全部
- 1.NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl是著名的“侯氏制碱法”的重要反应的化学方程式下列关于该反
1.
NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl
是著名的“侯氏制碱法”的重要反应的化学方程式
下列关于该反应的说法不正确的是:( )
A.该条件下NaHCO3的溶解度较小
B.NaHCO3不是纯碱
C.析出固体后的溶液为NaHCO3的不饱和溶液
D.NaHCO3是一种盐类物质
2.填空
检验氯离子的通常做法是取少量样品,滴入几滴______和_______,如果生成了不溶于稀硝酸的_______,就可以证明样品中含有_______. zz3715059321年前3
zz3715059321年前3 -
 周家伟2006 共回答了22个问题
周家伟2006 共回答了22个问题 |采纳率86.4%我帮你回答 第一题选C 是饱和溶液 第二题滴入几滴HNO3和AgNO3,如果生成了不溶于稀硝酸的 白色沉淀,就可以证明样品中含有 氯离子.加入硝酸是排除碳酸根的干扰,所以要用硝酸酸化的硝酸银.给我加分啊1年前查看全部
- 我国化学家侯德榜创立了著名的“侯氏制碱法”(流程简图如图),促进了世界制碱技术的发展.下列有关说法正确的是( )
我国化学家侯德榜创立了著名的“侯氏制碱法”(流程简图如图),促进了世界制碱技术的发展.下列有关说法正确的是( ) 
A.沉淀池中的反应物共含有六种元素 B.过滤得到的“母液”中一定只含有两种溶质 C.图中X可能是氨气 D.通入氨气的作用是使溶液呈碱性,促进二氧化碳的吸收,更多地析出沉淀  qtxsgong1年前1
qtxsgong1年前1 -
 heiheitiankong 共回答了24个问题
heiheitiankong 共回答了24个问题 |采纳率91.7%A、沉淀池中发生的反应的反应物是氯化钠、氨气、二氧化碳和水,所以含有钠、氯、氮、氢、碳、氧六种元素,故A正确;
B、过滤得到的“母液”中含有的溶质有碳酸氢钠、氯化铵,还有可能含有过量的氯化钠,故B错;
C、碳酸氢钠分解生成碳酸钠、水、二氧化碳,所以X是二氧化碳,故C错;
D、氨气的水溶液显碱性,能更好的吸收二氧化碳,使反应物浓度大,反应速度快,故D正确.
故选AD.1年前查看全部
- 侯氏制碱法为啥先通氨气后通二氧化碳
 langwj13131年前1
langwj13131年前1 -
 pwen 共回答了12个问题
pwen 共回答了12个问题 |采纳率83.3%简单的来说 氨气的溶解度比二氧化碳高 氨气及易溶于水形成氨水 而氨水和二氧化碳反应相当于酸碱中和此反应更容易进行 而二氧化碳溶于水形成碳酸 碳酸生成的量不仅少而且不稳定进 而 生成的碳酸氨的量大大减少 所以先通氨气后通二氧化碳.1年前查看全部
- 侯氏制碱法依次通入CO2 NH3至饱和行吗?
 望日莲的渴望1年前1
望日莲的渴望1年前1 -
 火箭粑粑 共回答了23个问题
火箭粑粑 共回答了23个问题 |采纳率95.7%NH3在通常情况下溶解度为700:1(气体与水体积之比,下同),而CO2仅为1:1.只有先通入足量的NH3后再通入足量的CO2才能产生大量的NaHCO3晶体析出1年前查看全部
- 侯氏制碱法为什么用饱和食盐水我问的是为什么用饱和食盐水。兄弟们看好了哈
 兵临城下db1年前1
兵临城下db1年前1 -
 女人半边天 共回答了16个问题
女人半边天 共回答了16个问题 |采纳率100%形成饱和氨盐水
要制得碳酸氢钠就要有大量钠离子和碳酸氢根离子,所以就在饱和食盐水中通入氨气,形成饱和氨盐水,再向其中通入二氧化碳,在溶液中就有了大量的钠离子,铵根离子,氯离子和碳酸氢根离子,这其中NaHCO3溶解度最小,所以析出,其余产品处理后可作肥料或循环使用.1年前查看全部
- 氯化铵为什么降低温度溶解度降低懂侯氏制碱法的来回答.用氢键变化的角度来解释.
 孤烟白驹1年前1
孤烟白驹1年前1 -
 robben0622 共回答了22个问题
robben0622 共回答了22个问题 |采纳率81.8%绝大多数盐都是这样的呀.1年前查看全部
- 侯氏制碱法中怎样正,怎样证明NaCl的溶解度比Na2CO3的大?
 安安丽1年前1
安安丽1年前1 -
 ksrf 共回答了18个问题
ksrf 共回答了18个问题 |采纳率100%碳酸钠比氯化钠先析出1年前查看全部
- 著名的“侯氏制碱法”第一步反应是向饱和氨化盐水中通入二氧化碳,该反应可表示为NaCl+NH3+CO2+H2O=NaHCO
著名的“侯氏制碱法”第一步反应是向饱和氨化盐水中通入二氧化碳,该反应可表示为NaCl+NH3+CO2+H2O=NaHCO3+NH4Cl有关物质的溶解度数据如下(g/100g水):
NaCl NaHCO3NH4Cl
10℃35.88.1533.0
45℃37.014.050.0
现在45℃时,向434g饱和食盐水中通入适量氨气,再向其中通入二氧化碳后,按上述反应进行完全.试计算并回答下列问题(计算结果保留三位有效数字).
(1)反应完全后45℃时析出的晶体的化学式是______,并计算析出晶体的质量.
(2)过滤除去晶体后再降温至10℃,此时析出的晶体是(填化学式)______,计算所析出晶体的质量. 吹鼓手1年前1
吹鼓手1年前1 -
 mcq116 共回答了15个问题
mcq116 共回答了15个问题 |采纳率93.3%解题思路:(1)45℃时,434g饱和食盐水中,NaCl的质量为434g×[37/137]=117g,n(NaCl)=[117g/58.5g/mol]=2mol,根据反应的方程式计算生成NaHCO3的质量,结合溶解度计算析出晶体的质量;
(2)计算出水的质量,结合各物质的溶解度判断析出晶体并计算质量.(1)45℃时,434g饱和食盐水中,NaCl的质量为434g×[37/137]=117g,n(NaCl)=[117g/58.5g/mol]=2mol,
则NaCl+NH3+CO2+H2O=NaHCO3+NH4Cl
1 1
2mol 2mol
n(NaHCO3)=2mol,
m(NaHCO3)=2mol×84g/mol=168g,
此时,溶液中水的质量为434g×[100/137]-2×18g=280g,
溶解NaHCO3的质量为[280/100]×14≈39.0g,
所以析出的质量为168g-39g=129g,
答:析出NaHCO3晶体的质量为129g;
(2)由(1)可知水的质量为280g,则过滤除去晶体后再降温至10℃,
溶解NaHCO3的质量为8.15g×[280/100]=22.8g,
析出NaHCO3的质量为39.0-22.8=16.2g,
生成的NH4Cl质量为2mol×53.5g/mol=107g,
溶液溶解的NH4Cl质量为33.0g×[280/100]=92.4g,
则析出的NH4Cl质量为107g-92.4g=14.6g,
所以析出的物质的为NH4Cl和NaHCO3,总质量为16.2g+14.6g=30.8g,
答:析出的物质的为NH4Cl和NaHCO3,总质量为30.8g.点评:
本题考点: 化学方程式的有关计算;纯碱工业(侯氏制碱法);溶液中溶质的质量分数及相关计算.
考点点评: 本题考查纯碱的制备和计算,题目难度较大,注意有关溶解度计算的方法.1年前查看全部
- 侯氏制碱法中氯化钠溶液为什么饱和
 huyang10231年前2
huyang10231年前2 -
 WLKK0817 共回答了23个问题
WLKK0817 共回答了23个问题 |采纳率87%氯化钠浓度必须在一定值以上才能有碳酸氢钠晶体析出(沉淀),且氯化钠浓度越大生成碳酸氢钠越多.
侯氏制碱法中氯化钠溶液要求饱和就是使氯化钠浓度尽可能大.1年前查看全部
- 侯氏制碱法为啥先通氨气后通二氧化碳
 清清uu1年前1
清清uu1年前1 -
 无尾兔 共回答了18个问题
无尾兔 共回答了18个问题 |采纳率77.8%简单的来说 氨气的溶解度比二氧化碳高 氨气及易溶于水形成氨水 而氨水和二氧化碳反应相当于酸碱中和此反应更容易进行 而二氧化碳溶于水形成碳酸 碳酸生成的量不仅少而且不稳定进 而 生成的碳酸氨的量大大减少 所以先通氨气后通二氧化碳.1年前查看全部
- “NaCl+CO2+NH3+H2O=NaHCO3+NH4Cl”是著名的“侯氏制碱法”的重要反应,反应生成的一种盐达到一定
“NaCl+CO2+NH3+H2O=NaHCO3+NH4Cl”是著名的“侯氏制碱法”的重要反应,反应生成的一种盐达到一定浓度时会从溶液中首先结晶析出.下列相关认识中,正确的是( )
A. 在加压的条件下向饱和氨盐水中通二氧化碳,更有利于反应的发生
B. 析出晶体后溶液为NaHCO3的不饱和溶液
C. 该条件下NaHCO3的溶解度比NH4Cl小
D. 析出的晶体后剩余溶液中只有一种溶质 chenqian4123331年前1
chenqian4123331年前1 -
 woaiwanlin1229 共回答了17个问题
woaiwanlin1229 共回答了17个问题 |采纳率94.1%解题思路:A、在加压的条件下向饱和氨盐水中通二氧化碳,增加反应物的浓度,更有利于反应向正方向进行;
B、判断溶液是否饱和,可以采用两种方式:判断溶液底部是否存在晶体或加入晶体看是否能溶解.
C、由于反应时生成的碳酸氢钠多,而NH4Cl少,所以在溶剂质量相等的情况下,只能说碳酸氢钠更容易形成饱和溶液,不能说明溶解度就一定是碳酸氢钠的小
D、过滤出碳酸氢钠后,溶质是NH4Cl和NaCl.A、在加压的条件下向饱和氨盐水中通二氧化碳,增加反应物的浓度,更有利于反应向正方向进行,故A正确;
B、析出固体后的溶液一定是饱和溶液,所以是NaHCO3的饱和溶液.故B错误.
C、由于反应时生成的碳酸氢钠多,而NH4Cl少,所以在溶剂质量相等的情况下,只能说碳酸氢钠更容易形成饱和溶液,不能说明溶解度就一定是碳酸氢钠的小,故C错误;
D、析出的晶体后剩余溶液中溶质是NH4Cl和NaCl,故D错误;
故选A点评:
本题考点: 化学方程式的概念、读法和含义.
考点点评: 题考查了常见物质的性质以及溶液的有关知识,完成此题,可以结合化学反应的实际结合物质的性质进行解决问题.1年前查看全部
- 侯氏制碱法 NH3+CO2+H2O=NH4HCO3 NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl 2Na
侯氏制碱法 NH3+CO2+H2O=NH4HCO3 NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl 2NaHCO3=Na2CO3+CO2+H2O
NH3+CO2+H2O=NH4HCO3
NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl
2NaHCO3=Na2CO3+CO2+H2O
第二部为什么会有向下箭头? lw38871年前1
lw38871年前1 -
 zmag 共回答了20个问题
zmag 共回答了20个问题 |采纳率95%NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl 氯化铵易溶于水、碳酸氢钠溶解度小会析出结晶沉淀向下箭头.1年前查看全部
- (2010•鼓楼区二模)侯氏制碱法的工艺是由制碱和制氯化铵两个过程组成的.制碱过程是使食盐水与氨气和二氧化碳反应,生成碳
(2010•鼓楼区二模)侯氏制碱法的工艺是由制碱和制氯化铵两个过程组成的.制碱过程是使食盐水与氨气和二氧化碳反应,生成碳酸氢铵;碳酸氢铵经过滤、煅烧制得纯碱,所得滤液(主要含氯化钠和氯化铵)用于制备氯化铵.制备氯化铵的过程是使滤液吸收氨气、降温并向其中加入食盐粉,使氯化铵逐步从滤液中结晶析出,再经过滤、干燥制得氯化铵产品.过滤出氯化铵后的滤液(主要含氯化钠)再与氨气、二氧化碳反应制纯碱,使氯化钠循环使用.侯氏制碱法的工艺流程如下图所示.
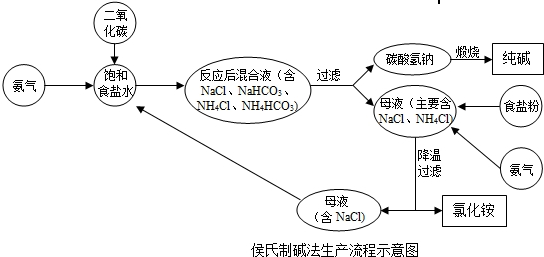
(1)写出制得碳酸氢铵的化学方程式______.
(2)写出制得纯碱的最后一步发生的化学方程式2NaHCO3
Na2CO3+H2O+CO2↑△ .2NaHCO3.
Na2CO3+H2O+CO2↑△ .
(3)写出侯氏制碱法的一个优点:______. lzw30141年前1
lzw30141年前1 -
 jpe林 共回答了29个问题
jpe林 共回答了29个问题 |采纳率96.6%解题思路:(1)食盐、氨气、水和二氧化碳发生化学反应,生成碳酸氢铵和氯化铵.据此书写化学方程式;
(2)根据化学反应的反应物、生成物以及反应条件书写化学反应方程式;
(3)从环保、节约能源等方面来总结侯氏制碱法的优点.(1)制碱过程是使食盐水与氨气和二氧化碳反应,生成碳酸氢铵;故填:NaCl+NH3+H2O+CO2═NaHCO3↓+NH4Cl;
(2)碳酸氢铵经过滤、煅烧制得纯碱;故填:2NaHCO3
△
.
Na2CO3+H2O+CO2↑;
(3)根据侯氏制碱法生产流程示意图可知,有些物质可以循环利用;故答案可以是:原料便宜易得 (或者有物质可以循环使用).点评:
本题考点: 纯碱的制取;书写化学方程式、文字表达式、电离方程式.
考点点评: 化学来源于生产、生活,又服务于生产、生活,氨碱工业是初中化学重要的应用之一,是考查重点,常涉及化学方程式的书写,二氧化碳和氨气的性质以及有关化学方程式的计算等.1年前查看全部
- “NaCl + CO 2 + NH 3 + H 2 O = NaHCO 3 ↓+ NH 4 Cl”是著名的“侯氏制碱法”
“NaCl + CO 2 + NH 3 + H 2 O = NaHCO 3 ↓+ NH 4 Cl”是著名的“侯氏制碱法”的重要反应。下面是4位同学对该反应涉及的有关知识发表的部分见解。其中不正确的是
A.甲同学说:该条件下NaHCO 3 的溶解度较小 B.乙同学说: NaHCO 3 不是纯碱 C.丙同学说:析出NaHCO 3 固体后的溶液中只含氯化铵和氯化钠 D.丁同学说:从该反应可以获得氮肥  chulian121年前1
chulian121年前1 -
 斑马宝宝 共回答了12个问题
斑马宝宝 共回答了12个问题 |采纳率100%C
1年前查看全部
- 侯氏制碱法中,为什么向母液中加入食盐细粉,而使 NH4Cl 单独结晶析出,不加食盐细粉可不可以?
 心事在飞1年前3
心事在飞1年前3 -
 用户017 共回答了12个问题
用户017 共回答了12个问题 |采纳率100%这是同离子效应,它们共同有Cl离子,而且NaCl相对于NH4Cl是强电解质.氯离子的加入,使NH4Cl电离平衡向分子方向移动,就析出来了.
在弱电解质溶液中加入含有与该弱电解质具有相同离子的强电解质,从而使弱电解质的解离平衡朝着生成弱电解质分子的方向移动,弱电解质的解离度降低的效应称为同离子效应.1年前查看全部
- 用“侯氏制碱法”制得的纯碱常含有少量的氯化钠(假定只含氯化钠杂质).某化学兴趣小组为了测定纯碱样品中碳酸钠的质量分数,做
用“侯氏制碱法”制得的纯碱常含有少量的氯化钠(假定只含氯化钠杂质).某化学兴趣小组为了测定纯碱样品中碳酸钠的质量分数,做了如下实验:称量某纯碱样品12g,加入到足量的氯化钡溶液中,恰好完全反应.过滤干燥后,称得沉淀质量为19.7g.请你帮助计算:纯碱样品中碳酸钠的质量分数(计算结果精确到0.1%).
 janok1年前1
janok1年前1 -
 xqhm 共回答了21个问题
xqhm 共回答了21个问题 |采纳率95.2%解题思路:样品中只有碳酸钠和氯化钡溶液反应生成碳酸钡沉淀,所以根据化学方程式计算出碳酸钠的质量,进而计算出碳酸钠的质量分数.设产生19.7g碳酸钡沉淀需要碳酸钠的质量为 x
Na2CO3+BaCl2═BaCO3↓+2NaCl
106197
x19.7g
[106/x=
197
19.7g]
解之得:x=10.6g
所以样品中Na2CO3质量分数为:[10.6g/12g]×100%=88.3%
答:纯碱样品中碳酸钠的质量分数为88.3%.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 根据化学反应方程式计算的过程中,一定要注意:(1)设未知量x时,x的后面不要带单位;(2)书写化学方程式的时候,切记严格地按照“写→配→标→注”步骤细心书写;(3)找质量关系时,最好先找下一行的实际质量关系(即已知量和未知量),然后再对应着找上一行的相对质量关系.并且,切记将它们都写在相应的化学式的正下方,分居上下两行.(4)列比例式时,要按照“上一行的相对质量比等于下一行的实际质量比”的顺序来列;保证是对应比相等.(5)求算x时,可以参考着化学方程式下面的两行质量关系中的上下或左右的倍数关系来求算.当没有倍数关系时,再按照一般的方法来求算便是.(6)在写答案时,只需要简明扼要地答出关键语句即可.1年前查看全部
- 高中化学,侯氏制碱法的不懂之处我知道三个步骤,也会方程式,就是不能把它们和图里的步骤对上号..首先,M1 M2两处的吸氨
高中化学,侯氏制碱法的不懂之处

我知道三个步骤,也会方程式,就是不能把它们和图里的步骤对上号..
首先,M1 M2两处的吸氨是什么意思..有什么不同
碳化又是什么意思..
最好能把每一步都说一下 谢谢!

 my85851年前2
my85851年前2 -
 递上七名报病秀女 共回答了17个问题
递上七名报病秀女 共回答了17个问题 |采纳率82.4%有图可知这是循环式制碱法,但万变不离其宗,抓住两个方程式.吸氨即在溶液中加入氨气,先加氨气可以提高二氧化碳在水中的溶解度,氨气与氯化钠生成氯化铵,氨气.二氧化碳.氯化钠生成碳酸氢钠煅烧后为纯碱,至于换热等等的词知道大致意思即可,不必深究,也不影响答题1年前查看全部
- 侯氏制碱法中NaHCO3为什么会析出
 zhixiao4761年前3
zhixiao4761年前3 -
 jlle_liu 共回答了18个问题
jlle_liu 共回答了18个问题 |采纳率83.3%因为常温下NaHCO3的溶解度非常小.
而原来使用的是NaCl饱和溶液,所以NaHCO3就过饱和而析出了.1年前查看全部
- 碳酸钠与工农业生产、日常生活紧密相关.工业碳酸钠大多采用侯氏制碱法制取,所得碳酸钠样品中往往含有少量NaCl,现欲测定样
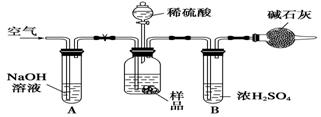
碳酸钠与工农业生产、日常生活紧密相关.工业碳酸钠大多采用侯氏制碱法制取,所得碳酸钠样品中往往含有少量NaCl,现欲测定样品中Na2CO3的质量分数,某探究性学习小组分别设计了如下实验方案.请回答下列有关问题:
方案三:质量差分析法
(3)把一定质量的样品和足量的稀硫酸反应,采用上右图所示装置,通过称量反应前后盛有碱石灰的干燥管的质量,利用其质量差求算样品的纯度.
该实验的操作步骤有:①在干燥管内填满碱石灰,质量为m g;②取n g样品装入广口瓶中;③检验装置的气密性;④缓慢鼓入空气数分钟,再称量干燥管质量为w g;⑤关闭止水夹;⑥打开止水夹;⑦缓慢加入稀硫酸至不再产生气体为止;⑧缓慢鼓入空气数分钟.
Ⅰ.正确的操作顺序是(填序号):
③―→__________―→⑥―→________―→⑤―→________―→⑦―→________―→④.
Ⅱ.若去掉装置A,测定结果________;若去掉装置B,测定结果________(填“偏大”、“偏小”或“无影响”).
求详解 舍予尔芬1年前1
舍予尔芬1年前1 -
 woainipt 共回答了25个问题
woainipt 共回答了25个问题 |采纳率88%正确的操作顺序是3,2,6,8,5,1,7,6,4检验装置的气密性后装样品没什么好说的.然后打开止水夹缓慢鼓入空气数分钟,使内部的气体组成相同.再关闭止水夹装干燥管.开启反应,反应完后打开止水夹,鼓入空气数分钟将装置里的CO2...1年前查看全部
- 在“侯氏制碱法”的工艺流程中,最后一步是用加热NaHCO3的方法来制取纯碱的,某纯碱生产制得的产品Na2CO3混有少量N
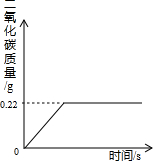 在“侯氏制碱法”的工艺流程中,最后一步是用加热NaHCO3的方法来制取纯碱的,某纯碱生产制得的产品Na2CO3混有少量NaHCO3,为了测定产品中Na2CO3的质量分数,取100g混合物加热(2NaHCO3=Na2CO3+H2O+CO2↑,Na2CO3受热不分解),反应过程中生成CO2气体的质量与反应时间的关系如图所示:
在“侯氏制碱法”的工艺流程中,最后一步是用加热NaHCO3的方法来制取纯碱的,某纯碱生产制得的产品Na2CO3混有少量NaHCO3,为了测定产品中Na2CO3的质量分数,取100g混合物加热(2NaHCO3=Na2CO3+H2O+CO2↑,Na2CO3受热不分解),反应过程中生成CO2气体的质量与反应时间的关系如图所示:
请解答下列问题:
(1)反应过程中生成CO2的质量______g;
(2)100g混合物中NaHCO3的质量;
(3)混合物中Na2CO3的质量分数. cctv19971年前1
cctv19971年前1 -
 7vbp 共回答了23个问题
7vbp 共回答了23个问题 |采纳率78.3%解题思路:根据图象可知反应产生的二氧化碳的质量为0.22克,而要求出NaHCO3的质量和Na2CO3的质量分数,最关键的是要知道只有NaHCO3加热时会出现二氧化碳气体,这样我们就可以根据二氧化碳的质量通过方程式来推导出NaHCO3的质量,从而就容易求出Na2CO3的质量分数.(1)有图象可知,生成二氧化碳的质量为0.22g
(2)设混合物中NaHCO3的质量为x
2NaHCO3
△
.
Na2CO3+H2O+CO2↑
168 44
x 0.22g
[168/44]=[x/0.22g]
x=0.84g
(3)混合物中Na2CO3的质量分数为:[100g−0.84g/100g]×100%=99.16%
答:(2)100g混合物中NaHCO3的质量为0.84g
(3)混合物中Na2CO3的质量分数为99.16%点评:
本题考点: 根据化学反应方程式的计算;物质组成的综合计算.
考点点评: 解此题的关键是要学会读图,弄清图中折点与起点的含义,看懂图才会解决题中问题.1年前查看全部
- “侯氏制碱法”制得的纯碱中通常含有少量的氯化钠.某同学想测定含有氯化钠杂质的纯碱样品中杂质的质量分数.老师给出如下试剂:
“侯氏制碱法”制得的纯碱中通常含有少量的氯化钠.某同学想测定含有氯化钠杂质的纯碱样品中杂质的质量分数.老师给出如下试剂:稀盐酸、碳酸钾溶液、氯化钙溶液.该同学操作如下;取样品5g全部溶解在20g水中,向所得溶液中加入29g某所选试剂,恰好完全反应.过滤后称得滤液质量为50g.试回答:
(1)发生反应的化学方程式是______;
(2)求解样品中纯碱质量(x)的比例式为______;
(3)样品中杂质氯化钠的质量分数为______;
(4)所得滤液中溶质的质量分数______. mickdevil1年前1
mickdevil1年前1 -
 qq的心情 共回答了21个问题
qq的心情 共回答了21个问题 |采纳率95.2%解题思路:(1)纯碱就是Na2CO3,根据已知条件可知,反应前各物质质量之和=20g+5g+29g=54g,完全反应后滤液质量为50g,减少了4g,说明反应中有气体或沉淀生成;那么试剂一定不是碳酸钾溶液,因为碳酸钾溶液与碳酸钠不反应,与氯化钠反应没有气体或沉淀生成;如果试剂是盐酸,则需碳酸钠大约9g才能完全反应,也不符合,故判断所选试剂为氯化钙溶液;
(2)根据碳酸钠与氯化钙反应的化学方程式和生成沉淀的质量,列出比例式,即可得出求解样品中纯碱质量(x)的比例式,进而计算出参与反应的碳酸钠的质量和生成的氯化钠的质量;
(3)根据“[样品中氯化钠质量/样品质量]×100%”计算即可;
(4)所得滤液中溶质质量=样品中氯化钠的质量+反应后生成的氯化钠质量,然后根据溶质质量分数=[溶质质量/溶液质量]×100%计算即可.(1)氯化钙与碳酸钠反应的化学方程式为:Na2CO3+CaCl2=CaCO3↓+2NaCl;
(2)设参与反应的碳酸钠的质量为x,生成的氯化钠的质量为y,
Na2CO3+CaCl2=CaCO3↓+2NaCl
106 100 117
x 4g y
∴106:100=x:4g;
100:117=4g:y,
解之得:x=4.24g,y=4.68g;
(3)样品中杂质氯化钠的质量分数为:[5g−4.24g/5g]×100%=15.2%;
(4)所得滤液中溶质的质量为:4.68g+5g-4.24g=5.44g,
所得滤液中溶质的质量分数为:[5.44g/50g]×100%=10.88%.
故答案为:(1)Na2CO3+CaCl2=CaCO3↓+2NaCl;(2)106:100=x:4g;(3)15.2%;(4)10.88%.点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题主要考查学生利用化学方程式和溶质质量分数公式综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.1年前查看全部
- 侯氏制碱法中关键一步的反应原理是将NH3和CO2 通入饱和食盐水中,可生成小苏打和一种氮肥NH4HCO3 怎么表示
 echo19921年前3
echo19921年前3 -
 无限之际 共回答了13个问题
无限之际 共回答了13个问题 |采纳率92.3%NH3+CO2+NaCl+H2O=NaHCO3+NH4Cl(生成的氮肥不是NH4HCO3吧).1年前查看全部
大家在问
- 1修路队要修一条21千米长的公路,已修的长度与未修的长度之比是四比三,问已修多少千米?
- 2写两句有关磨练才可以成功的诗句咧:1.宝剑锋出磨砺出,梅花香自苦寒来。2.不经历风雨,怎能见彩虹?还有什么?
- 3It is rarely possible-or even particularly fruitful-to look
- 4已知一个闭合回路R1=2欧,R2=4欧两个电阻串联时的电流是1.5安培 求①当俩个电阻串联的电压分别是多少?
- 512分之5小时等于几分钟 20分之1吨等于几千克
- 6已知,如图,直角梯形ABCD中,AD‖BC,∠A=90°,BC=CD=10,sin=4/5
- 7牛顿的小故事都有什么
- 8根据短文内容,从下框的A~F选项中选出能概括每一段主题的最佳选项,并将答案写在答题卷指定区域的横线上。选项中有一项为多余
- 9用适当的介词填空Bicycles are widely used______ Chinese people.How ar
- 10一个圆柱,它的侧面展开是一个边长为18.84厘米的正方形,这个圆柱的侧面积是______平方厘米,体积是______立方
- 11上海教育出版社 初三物理 课本答案
- 12log9(9a+b)=log3√ (ab),求4a+b 的最小值,
- 13下面是某兴趣小组同学做的2个小实验.根据实验内容回答下列问题.
- 14whom is the young woman looking at?the young woman is lookin
- 15赤壁怀古中谈笑间,樯橹灰飞烟灭指什么历史事件



