盛放氧气的瓶口盖上玻璃片的目的
 放肆爱你2022-10-04 11:39:541条回答
放肆爱你2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 飞天神经猪 共回答了17个问题
飞天神经猪 共回答了17个问题 |采纳率94.1%- 保证集气瓶里面氧气的纯净,防止混入太多空气
- 1年前
相关推荐
- 长期盛放石灰石的试剂瓶内有一层白雾,欲除去这层白膜使试剂瓶变的更明净的最好方法是
 享受哀艳的战火1年前1
享受哀艳的战火1年前1 -
 iyciyvqtn 共回答了16个问题
iyciyvqtn 共回答了16个问题 |采纳率81.3%加适量稀盐酸冲洗后再用水冲洗 反应方程式 Ca(OH)2+CO2=CaCO3↓+H2O
CaCO3+2HCL=CaCL2+H2O+CO2↑1年前查看全部
- (10分)下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100 g 5.00%的NaOH溶液、足量的CuSO 4 溶液和
(10分)下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100 g 5.00%的NaOH溶液、足量的CuSO 4 溶液和100 g 10.00%的K 2 SO 4 溶液,电极均为石墨电极。



 (1)接通电源,经过一段时间后,测得丙中K 2 SO 4 浓度为10.47%,乙中c电极质量增加。
(1)接通电源,经过一段时间后,测得丙中K 2 SO 4 浓度为10.47%,乙中c电极质量增加。
据此回答问题: ①电源的N端为 极;
①电源的N端为 极; ②电极b上发生的电极反应为 ;
②电极b上发生的电极反应为 ; ③电极b上生成的气体在标准状况下的体积:
③电极b上生成的气体在标准状况下的体积:
 ④电极c的质量变化是 g;
④电极c的质量变化是 g; (2)如果电解过程中铜全部析出,此时电解能否继续进行,为什么?
(2)如果电解过程中铜全部析出,此时电解能否继续进行,为什么?  。
。 ⑤电解前后各溶液的pH如何变化。(填增大,减小或不变)
⑤电解前后各溶液的pH如何变化。(填增大,减小或不变) 甲溶液 ;
甲溶液 ; 乙溶液_______;
乙溶液_______; 丙溶液_______;
丙溶液_______; junmyu1年前1
junmyu1年前1 -
 koala2000 共回答了25个问题
koala2000 共回答了25个问题 |采纳率84%(1)①正极②4OH - -4e - =2H 2 O + O 2 ↑。③2.8L④16g
(2)能继续进行,因为CuSO 4 溶液已转变为H 2 SO 4 溶液,反应也就变为水的电解反应。
⑤增大, 减小, 不变
(1)乙中c电极质量增加,说明c电极是阴极,则d电极是阳极,e是阴极,f是阳极。所以N是电源但正极,M是电源的负极,a是阴极,b是阳极,OH - 放电,反应式为4OH - -4e - =2H 2 O + O 2 ↑。丙中电解水,硫酸钾不变,所以电解后溶液酸质量是 ,因此被电解的水是100g-95.5g=4.5g,物质的量是0.25mol,转移电子是0.25mol×2=0.5mol。所以生成氧气是0.125mol,标准状况下的体积是0.125mol×22.4L=2.8L。根据电子得失守恒可知,c电极析出铜是0.25mol,质量是0.25mol×64g/mol=16g。
,因此被电解的水是100g-95.5g=4.5g,物质的量是0.25mol,转移电子是0.25mol×2=0.5mol。所以生成氧气是0.125mol,标准状况下的体积是0.125mol×22.4L=2.8L。根据电子得失守恒可知,c电极析出铜是0.25mol,质量是0.25mol×64g/mol=16g。
(2)铜全部析出后,溶液是硫酸溶液,所以继续通电,反应也就变为水的电解反应。甲相当于电解水,溶液浓度增大,pH增大。Y中有硫酸生成,pH减小,丙也是相当于电解水,浓度增大,但硫酸钾溶液显中性,所以pH不变。1年前查看全部
- 为什么磨口瓶不适合盛放碱性溶液,也不能盛放氢氟酸
 舐剑1年前3
舐剑1年前3 -
 德威漂 共回答了16个问题
德威漂 共回答了16个问题 |采纳率87.5%玻璃中的SiO2会与OH-反应产生粘性的SiO32-,导致瓶盖黏住,拔不开;
HF会与SiO2反应,产生SiF4;
有问题请追问~1年前查看全部
- 当试管内残留下列物质时,不能用稀盐酸浸泡除去的是( ) A.盛放石灰水留下的白色固体 B.氯化铁溶液和氢氧化钠溶液反应
当试管内残留下列物质时,不能用稀盐酸浸泡除去的是( ) A.盛放石灰水留下的白色固体 B.氯化铁溶液和氢氧化钠溶液反应后留下的红褐色固体 C.氢气还原氧化铜后留下的红色固体 D.盛放过生锈铁钉留下的铁锈  zhaolunshui1年前1
zhaolunshui1年前1 -
 剑阁26 共回答了16个问题
剑阁26 共回答了16个问题 |采纳率100%A、长时间盛放石灰水的试剂瓶壁上留下的白色固体是碳酸钙,能与盐酸反应生成可溶于水的氯化钙,可以除掉.
B、氯化铁与氢氧化钠反应后残留的红褐色固体是氢氧化铁,能与盐酸发生中和反应,并生成可溶的氯化铁,可以除掉.
C、氢气还原氧化铜实验留下的红色固体是金属铜,铜不能与盐酸反应,不能被洗掉.
D、铁锈的主要成分是氧化铁能与盐酸反应生成可溶的氯化铁,可以除掉.
故选C1年前查看全部
- 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO 4 溶液和l
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO 4 溶液和l00g 10.00%的K 2 SO 4 溶液.电极均为石墨电极. 
(1)接通电源,经过一段时间后,测得丙中K 2 SO 4 浓度为10.37%,乙中c电极质量增加.据此回答问题:
①电源的N端为______极.
②电极b上发生的电极反应为______.
③电解前后乙溶液 pH______(填“增大”、“减小”或“不变”),丙溶液 pH=______.
④电极b上生成的气体在标准状况下的体积______;电极c的质量增加了______g.
(2)写出乙溶液中的电解反应的离子方程式:______. qjr6661年前1
qjr6661年前1 -
 binger55 共回答了20个问题
binger55 共回答了20个问题 |采纳率85%(1)①该装置是电解池,接通电源,经过一段时间后,乙中c电极质量增加,说明C电极是电解池阴极,则d电极是阳极,连接电解池阳极的原电池电极是正极,所以N是原电池正极.
故答案为:正极.
②电解氢氧化钠溶液时,阳极上氢氧根离子放电生成氧气,电极反应式为:4OH - -4e - =2H 2 O+O 2 ↑.
故答案为:4OH - -4e - =2H 2 O+O 2 ↑.
③电解硫酸铜溶液时,阴极上析出铜,阳极上析出氧气,导致溶液中氢离子浓度大于氢氧根离子浓度,溶液呈酸性,所以溶液的pH值变小;电解硫酸钠溶液时,阴极上析出氢气,阳极上析出氧气,实际上电解的是水,硫酸钠溶液的浓度增大,但溶液的pH值不变.
故答案为:减小;不变.
④l00g 10.00%的K 2 SO 4 溶液电解一段时间后K 2 SO 4 浓度变为
l00g ×10.00%
10.37% ,电解硫酸钾溶液实际上是电解的水,所以电解水的质量为100-
l00g ×10.00%
10.37% =3.6g,减少3.6g水转移电子的物质的量=
3.6g
18g/mol ×2 =0.4mol;当转移0.4mol电子时,b上生成的气体体积=
0.4mol
4 ×22.4L/mol =2.24L;电极c增加的质量=
0.4mol
2 ×64g/mol =12.8g.
故答案为:2.24L;12.8g.
(2)电解硫酸铜溶液时阴极上析出铜,阳极上析出氧气,2Cu 2+ +2H 2 O
电解
.
2Cu+O 2 ↑+4H +
故答案为:2Cu 2+ +2H 2 O
电解
.
2Cu+O 2 ↑+4H +
1年前
41年前查看全部
- 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、500mL 1.0
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、500mL 1.0mol/L CuSO4溶液和500mL 1.0mol/L的K2SO4溶液,电极均为石墨电极.

(1)接通电源,经过一段时间后,乙中c电极质量增加12.8g.据此回答问题:
①电源的N端为______极;
②电极b上发生的电极反应为______;
③电极f上生成的气体在标准状况下的体积:______;
④电解前后甲溶液PH变换______(填“升高”或“降低”)简述其原因:______;
⑤电解后要使丙溶液恢复500mL 1.0mol/L应当向乙溶液加入______(化学式)质量______g.
(2)若将乙烧杯改为粗铜的电解精炼.在粗电解过程中,粗铜板是乙中电极______(填图中的字母);在电极c上发生的电极反应为______. 爱到风起1年前1
爱到风起1年前1 -
 云过山巅 共回答了20个问题
云过山巅 共回答了20个问题 |采纳率100%解题思路:(1)乙中C电极质量增加,则c处发生的反应为:Cu2++2e-=Cu,即C处为阴极,由此可推出b为阳极,a为阴极,M为负极,N为正极.甲中相当于电解水,故NaOH的浓度增大,pH变大.乙中阴极为Cu2+放电,阳极为OH-放电,所以H+增多,故pH减小.丙中为电解水,并结合电解原理及电子守恒计算解答;
(2)若将乙烧杯改为粗铜的电解精炼,粗铜作阳极,纯铜作阴极,阴极上铜离子得电子.(1)(①乙中C电极质量增加,则c处发生的反应为:Cu2++2e-=Cu,即C处为阴极,由此可推出b为阳极,a为阴极,M为负极,N为正极,
故答案为:正;
②甲中为NaOH,相当于电解H2O,阳极b处为阴离子OH-放电,即4OH--4e-=2H2O+O2↑,
故答案为:4OH--4e-=2H2O+O2↑;
③c处发生的反应为:Cu2++2e-=Cu,f发生反应为:4OH--4e-═2H2O+O2↑,由电子守恒可知:4e‑~2Cu~O2↑,则气体的体积为[12.8g/64g/mol]×[1/2]×22.4L/mol=2.24L,
故答案为:2.24L;
④甲中相当于电解水,水减少,故NaOH的浓度增大,pH变大;
故答案为:升高;因为电解后,水量减少,溶液中NaOH浓度增大故PH升高;
⑤丙中为电解水,所以电解后要使丙溶液恢复500mL 1.0mol/L应当向乙溶液加入H20,由电子守恒:2H20~4e‑~2Cu,则n(H20)=n(Cu)=0.2mol,则水的质量为3.6g;
故答案为:H20;3.6g;
(2)若将乙烧杯改为粗铜的电解精炼,粗铜作阳极,则d为粗铜,纯铜作阴极,c为纯铜,阴极上铜离子得电子,则c电极上的电极方程式为:Cu2++2e-═Cu;
故答案为:d;Cu2++2e-═Cu.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题为电化学知识的综合应用,做题时要注意根据电极反应现象判断出电解池的阴阳级,进而判断出电源的正负极,要注意三个电解池为串联电路,各电极上得失电子的数目相等.做题时要正确写出电极方程式,准确判断两极上离子的放电顺序,题目难度中等.1年前查看全部
- 农药波尔多液不能用铁质容器盛放,是因为贴能与该农药中的硫酸铜其反应,
农药波尔多液不能用铁质容器盛放,是因为贴能与该农药中的硫酸铜其反应,
是氧化剂、是还原剂、被氧化、被还原?
2.在下列反应中,HCL作氧化剂的是( ),作还原剂的是( )
1.NaOH+HCL=NaCL+H2O
2.Zn+2HCL=ZnCL2+H2
3.MnO2+4HCL=MnCL2+2H2O+CL2
4.CuO+2HCL=CuCL2+H2O warboy51年前1
warboy51年前1 -
 skx10000 共回答了18个问题
skx10000 共回答了18个问题 |采纳率88.9%反应后化合价升高的做还原剂,铁反应后从0价变为正2价,所以其为还原剂
2HCL中H从正1价变为0价,所以其为氧化剂
3中HCL中的CL从负1价变为0价,所以为还原剂1年前查看全部
- 有一堆糖果共有123个,分别盛放在编号1~12的十二个果盘里.已知编号相邻的四格果盘所盛放水果个数之和相等
有一堆糖果共有123个,分别盛放在编号1~12的十二个果盘里.已知编号相邻的四格果盘所盛放水果个数之和相等
且第6号果盘放有8个水果.把全部盛有8个水果的果盘拿走,余下的果盘按编号由大到小,每三个果盘为一组,组中每盘盛的水果数依次多一个.那么第12号果盘盛放多少个水果? miandanyun1年前1
miandanyun1年前1 -
 芝芝最亲爱的 共回答了19个问题
芝芝最亲爱的 共回答了19个问题 |采纳率89.5%设第二个盘子里有 x 个水果,第三个盘子里有 y 个水果,已知,编号相邻的三个果盘中水果数的和都相等,则有:第 1、4、7、10、13 个盘子里...1年前查看全部
- 某容器中盛放有一氧化碳和二氧化碳的混合气体,若其中含有a个一氧化碳分子和a个氧气分子,点燃反应结束后
某容器中盛放有一氧化碳和二氧化碳的混合气体,若其中含有a个一氧化碳分子和a个氧气分子,点燃反应结束后
容器中碳原子和氧原子的个数比为
A.2:3 B.1:2 C.1:3 D.3:2 dd良家秀才1年前3
dd良家秀才1年前3 -
 feng1954 共回答了18个问题
feng1954 共回答了18个问题 |采纳率100%分析:根据化学反应前后原子的种类和个数不变,
反应前容器中含有碳原子个数为:a
反应前容器中含有氧原子个数为:a+2a=3a
所以反应后容器中碳原子与氧原子的个数比为1:3
答案:选择C1年前查看全部
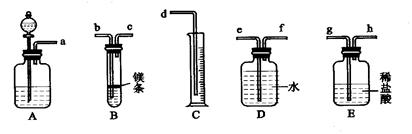
- 欲在室温和1.01×105Pa条件下测定镁的相对分子质量,请利用下图给定的仪器(盛放镁条的隔板有小孔)组装成一套实验装置
欲在室温和1.01×105Pa条件下测定镁的相对分子质量,请利用下图给定的仪器(盛放镁条的隔板有小孔)组装成一套实验装置(每种仪器只允许用一次).请回答下列问题:
(1)装置A中的分液漏斗中盛放的液体是
水
,其作用是
使A瓶中的气体进入E瓶,增大E瓶中的气压,将稀盐酸压入B装置与Mg发生化学反应;
;
(2)假设气流方向由左向右,则各仪器的接口连接的先后顺序为(填小字母)
a、h、g、b、c、f、e、d
;
(3)连接好仪器后,要进行的操作有以下几步:①待仪器B中的物质恢复到室温时,测得量筒C中水的体积(若假设将测定的体积换算为标准状况下为VmL);②擦掉镁条表面的氧化膜,将其置于天平上称量(假定其质量为mg),并将其投入试管B中;③检查各装置的气密性;④旋开仪器A上分液漏斗的活塞,当镁条完全溶解时再关闭活塞.上述几步操作的先后顺序为
③②④①
;
(4)若未将试管B冷却至室温就测量量筒C中水的体积,这将会使所得镁的相对原子质量数据(选填“偏高”或“偏低”或“无影响”)
偏低
;
(5)若未擦净镁条表面氧化膜就进行实验,这将会使所测镁的相对原子质量数据(选填“偏高”或“偏低”或“无影响”)
偏高
我认为第一题分液漏斗中的物质也可以是氢氧化钠.少杯中的物质是水,氢氧化钠溶解放热,也能使E瓶气压增大~ 我的想法对么?
第五题中没有擦净氧化膜,硫酸与氧化镁反应后仍然可以与镁条反应,那么生成的氢气质量不是不变么?怎么会偏高呢?

. XX爱OO1年前4
XX爱OO1年前4 -
 陈幸福 共回答了23个问题
陈幸福 共回答了23个问题 |采纳率95.7%你的想法是错误的,分液漏斗不可以装固体,
当然会变,MgO与硫酸反应不生成气体.
是偏高,
Mg+H2SO4=MgSO4+H2(?)
MgO+H2SO4=MgSO4+H2O
假如固体有mg,气体有nmol,那理论上是m/n,但因为有MgO,产生的气体会变少,所以是偏高.懂了么?1年前查看全部
- 要除去气体中混有的少量水蒸气,可在广口瓶中盛放哪些液体?
 1冬之蝉11年前2
1冬之蝉11年前2 -
 再到位 共回答了24个问题
再到位 共回答了24个问题 |采纳率87.5%浓磷酸,不适合碱性气体
浓硫酸,不适合碱性气体、还原性气体
最好的是甘油1年前查看全部
- 一个水箱高2.5米宽2米长2米能盛放多少立方水
 莎莎-等你1年前2
莎莎-等你1年前2 -
 笑傲明天 共回答了17个问题
笑傲明天 共回答了17个问题 |采纳率100%2.5*2*2=101年前查看全部
- 在一密闭容器中,盛放a、b、c三种物质各30g,经电火花引燃,充分反应后,各物质质量变化如下:
在一密闭容器中,盛放a、b、c三种物质各30g,经电火花引燃,充分反应后,各物质质量变化如下:
关于此反应,下列说法正确的是( )物质 a b c 新物质d 反应前物质的质量(g) 30 30 30 0 反应后物质的质量(g) 待测 33 0 22
A. c物质中所含有的元素种类是a、b、d三种物质中所有元素种类之和
B. 变化后待测的a质量为5g
C. 该变化的基本反应类型是分解反应
D. a物质有不可能是单质 chao99711年前2
chao99711年前2 -
 tt3202 共回答了17个问题
tt3202 共回答了17个问题 |采纳率88.2%解题思路:根据质量守恒定律,在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和.计算出变化后待测的a质量;然后根据反应类型的特征确定反应类型;根据质量守恒定律,在化学反应中,反应前后原子的种类没有改变,数目没有增减,原子的质量也没有改变.确定A的正误;根据分解反应的概念确定C的正误.根据质量守恒定律可知,变化后待测的a质量=(30+30+30)-(33+22)=35g.由图表数据可知,反应过程中c物质完全反应,a、b物质质量增加,还生成了新物质d.故此反应符合“一变多”,则属于分解反应,化学方程式为:c=a+b+d.
A、由分析可知:c物质中所含有的元素种类是a、b、d三种物质中所有元素种类之和,故A正确;
B、计算可知,变化后待测的a质量为35g,故B错误;
C、由分析可知:该变化的基本反应类型是分解反应,故C正确;
D、分解反应的产物可能是单质,也可能是化合物,在这个题目中同样是没有限制的.故D错误.
故选:A、C.点评:
本题考点: 质量守恒定律及其应用;单质和化合物的判别;反应类型的判定.
考点点评: 本题主要考查学生运用所学化学知识综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.1年前查看全部
- 标准氢氧化钠溶液滴定待测盐酸盛放待测盐酸的锥形瓶下方垫一张白纸的作用是什么?
 旧时上苑1年前2
旧时上苑1年前2 -
 zhaoxiantao 共回答了19个问题
zhaoxiantao 共回答了19个问题 |采纳率100%作用是便于准确观察颜色的变化1年前查看全部
- 如果通入的二氧化碳中含有少量一氧化碳,要将其中的一氧化碳转化为二氧化碳,装置中应盛放的物质是
 joinli1年前1
joinli1年前1 -
 pug01 共回答了22个问题
pug01 共回答了22个问题 |采纳率95.5%如果通入的二氧化碳中含有少量一氧化碳,要将其中的一氧化碳转化为二氧化碳,装置中应盛放的物质是CuO
CO+CuO=△=Cu+CO21年前查看全部
- 应用题1.编号为1-10的十个果盘里,每盘都盛有水果,共盛放100个.其中第一盘里有16个,并且编号相邻的三个果盘里水果
应用题
1.编号为1-10的十个果盘里,每盘都盛有水果,共盛放100个.其中第一盘里有16个,并且编号相邻的三个果盘里水果数的和相等.问第八个盘中水果最多可能有多少个? pc000041年前4
pc000041年前4 -
 kongliangd 共回答了14个问题
kongliangd 共回答了14个问题 |采纳率92.9%前两位推理挺好,可惜前提出错了,别忘了没有9、10、1和10、1、2这样的排列相加
通过推理可知,1号、4号、7号、10号盘子里苹果数都是16
100-16*4=36个这36个苹果放到6个盘子里,又知
2号+3号=5号+6号=8号+9号
所以8号+9号=36/3=12个
又每个盘子里都有,所以9号至少有一个,
8号盘子里最多有12-1=11个1年前查看全部
- 毕淑敏《精神的三间小屋》中认为人应该有精神的小屋,你有多少精神小屋,你用它盛放什么?
 yemantaoqi1年前1
yemantaoqi1年前1 -
 bingxueer1395 共回答了19个问题
bingxueer1395 共回答了19个问题 |采纳率94.7%我的精神有这样的三间小屋:第一间盛放回忆,酸甜苦辣,是否美好,有空去那歇会儿.第二间盛放情感,爱恨情仇,是否幸福,时常去那体会儿.第三间盛放遐想,喜怒乐哀,是否愉快,也要去那放飞会儿.灵魂的归宿是心,就是这样的精...1年前查看全部
- (2006•顺义区一模)实验室用棕色试剂瓶盛放浓硝酸,由此猜测浓硝酸可能具有的化学性质是( )
(2006•顺义区一模)实验室用棕色试剂瓶盛放浓硝酸,由此猜测浓硝酸可能具有的化学性质是( )
A.它是深棕色液体
B.它是见光易分解的物质
C.它是易跟氧气反应的物质
D.它具有挥发性 天天天崖呀1年前1
天天天崖呀1年前1 -
 踢败 共回答了17个问题
踢败 共回答了17个问题 |采纳率100%解题思路:在实验室中见光易分解的物质通常保存在棕色试剂瓶中,同时也能够说明这种物质的化学性质不稳定,所以可以根据这一知识点进行分析并作出判断.在实验室中通常用棕色的试剂瓶来盛放见光易分解的物质,而浓硝酸用棕色试剂瓶盛放,所以可以推断浓硝酸是见光易分解的物质,同时也可以判断出硝酸银的化学性质不稳定,至于它的颜色、是否易跟氧气反应、是否具有挥发性则无法得出;
故选B.点评:
本题考点: 化学性质与物理性质的差别及应用.
考点点评: 熟练掌握实验室中存放药品的注意事项,存放固体通常用广口瓶,而存放液体试剂通常用细口瓶,而见光易分解的药品通常放在棕色试剂瓶中.1年前查看全部
- NaOH溶液的盛放NaOH溶液一般用玻璃瓶盛放,但NaOH溶液会与玻璃中的SiO2反应,生成NaSiO3,难道不影响Na
NaOH溶液的盛放
NaOH溶液一般用玻璃瓶盛放,但NaOH溶液会与玻璃中的SiO2反应,生成NaSiO3,难道不影响NaOH溶液的纯净? happysir1年前1
happysir1年前1 -
 透明雨love_rain 共回答了9个问题
透明雨love_rain 共回答了9个问题 |采纳率100%当然影响!所以装氢氧化钠溶液的瓶子瓶塞都是橡皮塞子,而且实验室里氢氧化钠溶液一般是现配现用,就是为了减少误差1年前查看全部
- 盛放NaOH的试剂瓶口,出现了白色粉末
 楚楚的小猪1年前1
楚楚的小猪1年前1 -
 ff2046 共回答了20个问题
ff2046 共回答了20个问题 |采纳率75%白色粉末是Na2CO3,这是倒出NaOH溶液时,残留在瓶口部位的NaOH与空气中的CO2反应生成的 CO2+2NaOH=Na2CO3+H2O (玻璃中的SiO2与NaOH反应没那么容易,需要玻璃都是磨口的并且长时间接触)1年前查看全部
- 下列容器不宜长期用来盛放醋的是() A 玻璃瓶 B 塑料瓶 C 易拉罐 D 陶瓷瓶
 yanyingooo1年前1
yanyingooo1年前1 -
 zhuoxiaodian 共回答了19个问题
zhuoxiaodian 共回答了19个问题 |采纳率100%c因为醋成酸性,易拉罐是铝质的,虽然有层保护膜,但不宜长时间盛放,塑料瓶也不应长时间存放.塑料分很多种的,有的塑料可以允许存放一定的时间.1年前查看全部
- 宇宙存在怎样空间,如果存在盛放宇宙的空间,这个空间又存放在那个空间呢?
宇宙存在怎样空间,如果存在盛放宇宙的空间,这个空间又存放在那个空间呢?
以此类推,宇宙空间是怎样的无极限的? 六叶苜蓿1年前1
六叶苜蓿1年前1 -
 黄色ff人 共回答了21个问题
黄色ff人 共回答了21个问题 |采纳率76.2%宇宙这个词代表了所有的时间和空间,所以就不存在宇宙外的空间这个说法.如果你说的宇宙是指总星系,也就是空间约100亿光年,时间约150亿年这么大的时空,那这个时空外面肯定还有更高级的时空存在,只是所有这一切时空的总和就叫作宇宙.打个简单的比方,实数集里面,任何一个具体的实数,都有无限多个实数比这个具体的实数大,但总包含在实数集之中.1年前查看全部
- 破损的陶盆不能用来盛放波尔多液,其主要原因是(用化学方程式表示)
 djy86561年前2
djy86561年前2 -
 继续流浪着的流浪 共回答了11个问题
继续流浪着的流浪 共回答了11个问题 |采纳率100%陶盆会把构成波尔多液的CuSO4中的CU置换出来
Fe+CuSO4===FeSO4+Cu
陶盆里应该是Fe,不是就把Fe改为其他比Cu活泼的金属,原理都一样的.1年前查看全部
- 有一纯净气体X,可能是氢气,甲烷,一氧化碳中的一种,现将该气体燃烧后的产物通入如图所示的装置A、B(A盛放了浓硫酸,B盛
有一纯净气体X,可能是氢气,甲烷,一氧化碳中的一种,现将该气体燃烧后的产物通入如图所示的装置A、B(A盛放了浓硫酸,B盛放了氢氧化钙溶液,用导管连接两个集气瓶)来进行验证,试将分析结论填在下表空格中.
质量变化
A B X
增重 不变 ()
不变 增重 ()
增重 增重 () 不是男孩1年前1
不是男孩1年前1 -
 dick_du 共回答了16个问题
dick_du 共回答了16个问题 |采纳率93.8%不变 增重1年前查看全部
- 11月26日名师导学化学15页2.密闭的烧瓶里盛放气体A,在25°C时建立如下平衡:
11月26日名师导学化学15页2.密闭的烧瓶里盛放气体A,在25°C时建立如下平衡:
2A(g)
 B(g),△H < 0,把烧瓶置于100℃的沸水中,在建立新平衡的过程中,烧瓶内混合气体的物理量始终不变的是 ( )
B(g),△H < 0,把烧瓶置于100℃的沸水中,在建立新平衡的过程中,烧瓶内混合气体的物理量始终不变的是 ( ) A.平均相对分子质量 B.密度 C.容器内的压强 D.物质的量
请帮忙详细解析,谢谢!
 dc66801681年前2
dc66801681年前2 -
 mmbb520 共回答了17个问题
mmbb520 共回答了17个问题 |采纳率88.2%2A(g) ==可逆== B(g),△H<0,即放热
把烧瓶置于100℃的沸水中,相当于升温,反应逆向移动
A,平均相对分子质量=(n1M1+n2M2+...)/(n1+n2+...),(n1M1+n2M2+.)是定值(质量守恒),反应逆向移动,反应逆向移动使得(n1+n2+...)增大,所以平均相对分子质量减小,错误
B,密度=m/V,m不变,V不变(定容),密度不变,正确
C,反应逆向移动,即气体向体积增大的方向移动,定容情况下压强增大,错误
D,反应逆向移动使得(n1+n2+...)增大,错误
综上选B1年前查看全部
- 在0℃的室内将盛放冰水混合物的铁盒放到盛有酒精的敞口容器中,经过一段时间会看到的现象是
在0℃的室内将盛放冰水混合物的铁盒放到盛有酒精的敞口容器中,经过一段时间会看到的现象是
A.熔化,水不凝固,冰和水的数量不变
B.一部分水凝固,冰增加,水减少
C.部分冰熔化,冰减少,水增加
D.冰水混合物的温度降到0℃以下 童话里王子和公主1年前3
童话里王子和公主1年前3 -
 媛玲 共回答了21个问题
媛玲 共回答了21个问题 |采纳率90.5%选B
因为水的凝点是0℃ ,酒精蒸发吸热温度下降,而冰水混合物的温度是0℃ ,水会变成冰,固液共存的时候温度不会下降1年前查看全部
- 初三科学竞赛题在天平的两端,各放一只等质量的烧杯,烧杯中盛放等质量等浓度的稀硫酸.像两只烧杯中分别放入一块镁片和铝片(均
初三科学竞赛题
在天平的两端,各放一只等质量的烧杯,烧杯中盛放等质量等浓度的稀硫酸.像两只烧杯中分别放入一块镁片和铝片(均与硫酸完全反应),若天平保持平衡,则放入的镁片和铝片的比是
A.32:33 B.33:32 C.4:3 D.3:4 999381年前1
999381年前1 -
 漂泊的人_ss 共回答了16个问题
漂泊的人_ss 共回答了16个问题 |采纳率93.8%选A,设镁的质量为X,铝为Y.根据其各自与稀硫酸反应的特点得出,
镁置换出的氢气为x/12,铝为Y/9.得到等式X-X/12=Y-Y/9.计算后得出A.1年前查看全部
- 下图所示装置中,直流电源用的是甲烷燃料电池,甲乙丙三个烧杯分别是盛放200g10%的NaOH溶液、足量的CuSO4
下图所示装置中,直流电源用的是甲烷燃料电池,甲乙丙三个烧杯分别是盛放200g10%的NaOH溶液、足量的CuSO4
溶液、足量的K2SO4溶液,电极均为石墨电极.
接通电源后.经过一段时间后,测的乙中c电极增加16g.
1、点解过程中消耗甲烷的体积
2、甲中NaOH百分含量变为 (保留四位有效数字)

 kk的覅1年前1
kk的覅1年前1 -
 cyc200079 共回答了16个问题
cyc200079 共回答了16个问题 |采纳率87.5%C电极增重16g,说明生成16g(即1/4mol)Cu,所以转移电子数0.5mol 又1molCH4完全氧化转移4mole,所以消耗了1/8摩尔CH4,即标况下2,8L
甲的本质是电解水,且电解掉的水为0.25mol,即4.5g.
所以NaOH质量分数变为20/(200-4.5)=10.2%1年前查看全部
- 下列叙述中不正确的是( ) A.铝制、铁制容器常温下可以盛放浓硫酸和浓硝酸 B.久置的浓硝酸呈黄色 C.金属钠与CuS
下列叙述中不正确的是( ) A.铝制、铁制容器常温下可以盛放浓硫酸和浓硝酸 B.久置的浓硝酸呈黄色 C.金属钠与CuSO 4 溶液反应能析出单质Cu D.浓硫酸是一种干燥剂,能够干燥Cl 2 、氧气等气体  wergredf1年前1
wergredf1年前1 -
 陶晶姚莹 共回答了22个问题
陶晶姚莹 共回答了22个问题 |采纳率86.4%A.常温下,Al、Fe和浓硫酸、浓硝酸反应生成一层致密的氧化物薄膜而阻止进一步被氧化,该现象是钝化现象,故A正确;
B.浓硝酸不稳定,易分解生成二氧化氮,二氧化氮溶于稀硝酸而使溶液呈黄色,故B正确;
C.钠投入硫酸铜溶液中时,钠和水反应生成NaOH和氢气,NaOH和硫酸铜发生复分解反应生成氢氧化铜,所以不能置换出Cu,故C错误;
D.浓硫酸具有酸的通性、强氧化性,能干燥酸性或中性的非还原性气体,浓硫酸和Cl 2 、氧气等气体不反应,所以可以干燥Cl 2 、氧气等气体,故D正确;
故选C.1年前查看全部
- 小刚在化学实验室发现,盛放NaOH溶液的试剂瓶瓶口和橡皮塞上出现了白色粉末.小刚叫来小军和小红,共同探究这种白色粉末的成
小刚在化学实验室发现,盛放NaOH溶液的试剂瓶瓶口和橡皮塞上出现了白色粉末.小刚叫来小军和小红,共同探究这种白色粉末的成分.
他们依据所学的化学知识,对这种白色粉末的成分作了如下猜想:
①可能是NaOH; ②可能是Na 2 CO 3 ; ③可能是NaOH与Na 2 CO 3 的混合物.
为了验证猜想,他们分别做了下面的实验.
(1)小刚取少量白色粉末,滴加稀盐酸,有气体生成.由此小刚认为白色粉末是Na 2 CO 3 .
请判断小刚所得结论是否正确,并简述理由.______.
(2)小军取少量白色粉末溶于水,向所得溶液中滴加酚酞试液,溶液变为红色.由此小军认为白色粉末是NaOH.请判断小刚所得结论是否正确,并简述理由.______. 78771年前1
78771年前1 -
 暖暖四月天 共回答了20个问题
暖暖四月天 共回答了20个问题 |采纳率90%(1)根据取少量白色粉末,滴加稀盐酸,有气泡产生,则可能是Na 2 CO 3 ,也可能是NaOH与Na 2 CO 3 的混合物;
故答案为:不正确,这一反应只能证明有碳酸钠,也可能是NaOH与Na 2 CO 3 的混合物;
(2)根据碳酸钠水溶液呈强碱性,也能使无色酚酞溶液,变为红色;故答案为:不正确,因为碳酸钠溶液也呈碱性;1年前查看全部
- 下列试剂的存放正确的是( )A.钾、钠在空气中极易氧化,与水发生剧烈反应,应放在盛有煤油的广口瓶中以隔绝空气B.盛放氢
下列试剂的存放正确的是( )
A.钾、钠在空气中极易氧化,与水发生剧烈反应,应放在盛有煤油的广口瓶中以隔绝空气
B.盛放氢氧化钠溶液的瓶口用玻璃塞塞紧,不能用橡皮塞
C.浓硝酸、硝酸银见光易分解,应存放在棕色细口瓶中,低温避光保存
D.以上方法都不正确 tianhu881年前1
tianhu881年前1 -
 a12336 共回答了22个问题
a12336 共回答了22个问题 |采纳率81.8%解题思路:A.钾、钠能与氧气、水反应,存放固体一般存放在广口瓶;
B.盛放氢氧化钠溶液的试剂瓶不能用玻璃塞;
C.存放固体一般存放在广口瓶.A.钾、钠能与氧气、水反应,应放在盛有煤油的广口瓶中以隔绝空气,故A正确;
B.实验室盛放氢氧化钠溶液的试剂瓶不能用玻璃塞,其原因是在常温下,氢氧化钠与玻璃中的二氧化硅缓慢地发生反应,产物使瓶口与瓶塞粘合在一起,故B错误;
C.硝酸银应放在棕色广口瓶中,故C错误;
故选A.点评:
本题考点: 化学试剂的存放.
考点点评: 本题考查试剂的存放,明确物质的性质与保存方法的关系是解答本题的关键,题目难度不大.1年前查看全部
- 盛放汽油的容器不能用胶塞
 aolinmin1年前1
aolinmin1年前1 -
 扑鱼子 共回答了20个问题
扑鱼子 共回答了20个问题 |采纳率95%普通的胶塞肯定不行,汽油有强烈的腐蚀性,胶塞会被腐蚀膨胀坏掉,要视容器的材质,选用金属或耐油塑料的盖子.1年前查看全部
- 用容积为30毫升的使馆盛放液体加热时,液体体积不应超过( ).A.5毫升 B.10毫升 C.15毫升 D.20毫升
用容积为30毫升的使馆盛放液体加热时,液体体积不应超过( ).A.5毫升 B.10毫升 C.15毫升 D.20毫升
用容积为30毫升的使馆盛放液体加热时,液体体积不应超过( ).
A.5毫升 B.10毫升 C.15毫升 D.20毫升
快,马上. 九尾天狐木1年前1
九尾天狐木1年前1 -
 tyjojo 共回答了24个问题
tyjojo 共回答了24个问题 |采纳率100%10毫升1年前查看全部
- 下列物质能用铁制容器盛放的是,A.稀硫酸B.稀盐酸C.浓盐酸D.浓硫酸
 扎果1年前1
扎果1年前1 -
 不听话的猪耳朵 共回答了18个问题
不听话的猪耳朵 共回答了18个问题 |采纳率88.9%D.浓硫酸
浓硫酸具有很强的氧化性,能把铁表面氧化成致密的氧化物薄膜,阻止反应继续进行.而稀硫酸、盐酸会与铁反应.1年前查看全部
- 液体内部的压强是由于液体受______产生的,1648年帕斯卡曾经做了一个实验,如图所示,能盛放许多水的木桶,却不能再承
液体内部的压强是由于液体受______产生的,1648年帕斯卡曾经做了一个实验,如图所示,能盛放许多水的木桶,却不能再承受几杯水的重量.这是因为液体的压强与______成正比,若你在高为5米的阳台上做这个实验,比较稳定后,管中灌满水时对水桶底部的压强为______Pa. 
 四漆屏1年前1
四漆屏1年前1 -
 bblg 共回答了20个问题
bblg 共回答了20个问题 |采纳率80%液体之所以产生压强是因为液体受到重力;
细管内灌满水,因深度h很大,对桶产生很大的压强,水桶因承受不了这么大的压强而被压裂;
细管灌满水后水对木桶底部产生的压强:
p=ρgh=1×10 3 kg/m 3 ×9.8N/kg×5m=4.9×10 4 Pa.
故答案为:重力;深度;4.9×10 4 .1年前查看全部
- 如图所示,燃烧匙内盛放硫粉,金属丝为电加热用,容器内盛有氧气,U型管内盛有汞,反应前U型管两侧汞液面持平,电加热使硫反应
如图所示,燃烧匙内盛放硫粉,金属丝为电加热用,容器内盛有氧气,U型管内盛有汞,反应前U型管两侧汞液面持平,电加热使硫反应后,左侧汞液面上升,右侧下降,恢复到原来温度时,汞液面又持平.

(1)根据实验现象可得出结论是:______.
(2)若U型管内盛的不是汞而是水,可观察到的现象是______,产生这种现象的原因是______. 东山更起1年前1
东山更起1年前1 -
 one110 共回答了19个问题
one110 共回答了19个问题 |采纳率84.2%解题思路:(1)从放热的角度分析即可.
(2)从生成物是二氧化硫,可与水反应造成气压减小分析即可(1)温度高时左侧汞液面上升,右侧下降,恢复到原来温度时,汞液面又持平,说明硫燃烧时会放出大量的热;
(2)硫燃烧时虽然消耗氧气但同时又生成了同体积的二氧化硫,压强无变化,所以恢复温度后水银管的液面不会变化,如果盛的是水,二氧化硫可与水反应生成亚硫酸钠,造成右侧气压减小,故U型管内左侧液面下降,右侧液面上升.
故答案为:(1)硫燃烧时会放出大量的热;(2)U型管内左侧液面下降,右侧液面上升;二氧化硫与水反应造成气压减小.点评:
本题考点: 氧气的化学性质.
考点点评: 此题是一道实验知识考查题,解题时抓住生成物质的特点是解题的关键所在.1年前查看全部
- (2006•无锡)在四个小烧杯中分别盛放下列物质,在空气中放置一段时间后,质量会增加的是( )
(2006•无锡)在四个小烧杯中分别盛放下列物质,在空气中放置一段时间后,质量会增加的是( )
A.汽水
B.浓盐酸
C.浓硫酸
D.饱和食盐水 mr_white1年前1
mr_white1年前1 -
 我家住在18楼 共回答了16个问题
我家住在18楼 共回答了16个问题 |采纳率93.8%解题思路:物质放入到空气中质量增加,不外乎与空气中的物质发生了化学变化或者是吸收了空气中的物质但未发生化学变化,结合这些知识对四个选项逐一分析即可解决问题.A、汽水在空气中会由于二氧化碳的放出,而质量减小.故此选项错误.
B、浓盐酸在空气中会挥发出氯化氢气体使溶液质量减小,故此选项错误.
C、浓硫酸具有吸水性,放置在空气中会吸收空气中的水蒸气,而使自身的质量增加,故此选项正确.
D、饱和食盐水在空气中会蒸发水分,质量减小.故此选项错误.
故选C.点评:
本题考点: 空气中常见酸碱盐的质量或性质变化及贮存法.
考点点评: 此题是对常见化合物特性的考查,解题的关键是能对四种物质的特性有所了解,属基础性知识考查题1年前查看全部
- 在分开盛放的M、N两溶液中,各含下列十四种离子中的七种:Al3+、Na+、K+、Fe3+、NH4+、H+、Cl-、NO3
在分开盛放的M、N两溶液中,各含下列十四种离子中的七种:Al3+、Na+、K+、Fe3+、NH4+、H+、Cl-、NO3-、OH-、S2-、MnO4-、SO42-、AlO2-、CO32-,且两溶液里所含离子不相同,已知M溶液中的阳离子只有两种,则N溶液中的离子应该有( )A.NH4+ S2- CO32- B.MnO4- SO42- NO3- C.NO3- Cl- SO42- D.AlO2- SO42- MnO4- 我想问的是最后推出氨根离子,氢离子,高锰酸根在N中.为什么呢.高锰酸根在酸性条件下不会氧化氨根吗.百度了一下说是要氧化,那这个题怎么解释呢.
 我QQ3961367951年前3
我QQ3961367951年前3 -
 大反对地方方法 共回答了14个问题
大反对地方方法 共回答了14个问题 |采纳率85.7%原理是可以,但NH3或说NH4+的N-H的键能很大.而且还是3个N-H键.这样通常NH4+和硝酸或者高锰酸不会反应,在浓度都很大,或者直接铵盐固体,加热的条件可以,比如氨水和硝酸反应生成硝酸铵,一般加热硝酸铵固体会发生氧化还原.1年前查看全部
- 某学生利用一支底部有破损的试管和一个广口瓶组装成制取二氧化碳的发生装置(如图所示),在铜网上应该盛放的是______,广
某学生利用一支底部有破损的试管和一个广口瓶组装成制取二氧化碳的发生装置(如图所示),在铜网上应该盛放的是______,广口瓶中应盛放的是______.若将铜网换成铁网,产生的后果是______.

 jefforer1年前1
jefforer1年前1 -
 a78063380 共回答了17个问题
a78063380 共回答了17个问题 |采纳率88.2%解题思路:从大理石是固体稀盐酸是液体,铁可以和稀盐酸反应去分析.大理石(主要成分是CaCO3)和稀盐酸(主要成分HCl),二者接触即可发生反应生成氯化钙、水和二氧化碳.由于大理石是固体,所以放在铜网上,稀盐酸盛放在广口瓶中;由于铁可以和稀盐酸反应生成氯化亚铁和氢气,所以会使生成的二氧化碳中含有氢气.故答案为:大理石 稀盐酸 生成的二氧化碳中含有氢气.
点评:
本题考点: 二氧化碳的实验室制法;金属的化学性质.
考点点评: 如果把铜网换成铁网,由于铁网和稀盐酸反应,当铁反应完后,试管中的石灰石就会掉到烧杯中,会导致无法控制反应的发生与停止.1年前查看全部
- 用稀盐酸洗去盛放石灰水的瓶壁上留有的白色痕迹的化学方程式
 漂亮男人1年前2
漂亮男人1年前2 -
 花落红 共回答了14个问题
花落红 共回答了14个问题 |采纳率92.9%2HCl+CaCO3==CaCl2+H2O+CO2↑1年前查看全部
- 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和l00
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和l00g 10.00%的K2SO4溶液.电极均为石墨电极.

(1)接通电源,经过一段时间后,测得丙中K2SO4浓度为10.37%,乙中c电极质量增加.据此回答问题:
①电源的N端为______极.
②电极b上发生的电极反应为______.
③电解前后乙溶液 pH______(填“增大”、“减小”或“不变”),丙溶液 pH=______.
④电极b上生成的气体在标准状况下的体积______;电极c的质量增加了______g.
(2)写出乙溶液中的电解反应的离子方程式:2Cu2++2H2O
2Cu+O2↑+4H+电解 .2Cu2++2H2O.
2Cu+O2↑+4H+电解 . 丑的特别1年前1
丑的特别1年前1 -
 rockrose 共回答了22个问题
rockrose 共回答了22个问题 |采纳率100%解题思路:(1)①该装置是电解池,接通电源,经过一段时间后,乙中c电极质量增加,说明C电极是电解池阴极,则d电极是阳极,连接电解池阳极的原电池电极是正极.
②电解氢氧化钠溶液时,阳极上氢氧根离子放电生成氧气.
③电解硫酸铜溶液时,阴极上析出铜,阳极上析出氧气,根据溶液中氢氧根离子浓度的变化判断pH值的变化;电解丙溶液时,根据阴阳极上析出的物质确定溶液中氢离子浓度是否变化来判断溶液的pH值是否变化.
④根据丙溶液中水减少的质量结合转移电子数相等计算电极b上生成的气体体积和电极c的质量增加.
(2)电解硫酸铜溶液时阴极上析出铜,阳极上析出氧气.(1)①该装置是电解池,接通电源,经过一段时间后,乙中c电极质量增加,说明C电极是电解池阴极,则d电极是阳极,连接电解池阳极的原电池电极是正极,所以N是原电池正极.
故答案为:正极.
②电解氢氧化钠溶液时,阳极上氢氧根离子放电生成氧气,电极反应式为:4OH--4e-=2H2O+O2↑.
故答案为:4OH--4e-=2H2O+O2↑.
③电解硫酸铜溶液时,阴极上析出铜,阳极上析出氧气,导致溶液中氢离子浓度大于氢氧根离子浓度,溶液呈酸性,所以溶液的pH值变小;电解硫酸钠溶液时,阴极上析出氢气,阳极上析出氧气,实际上电解的是水,硫酸钠溶液的浓度增大,但溶液的pH值不变.
故答案为:减小;不变.
④l00g 10.00%的K2SO4溶液电解一段时间后K2SO4浓度变为[l00g ×10.00%/10.37%],电解硫酸钾溶液实际上是电解的水,所以电解水的质量为100-[l00g ×10.00%/10.37%]=3.6g,减少3.6g水转移电子的物质的量=[3.6g/18g/mol×2=0.4mol;当转移0.4mol电子时,b上生成的气体体积=
0.4mol
4×22.4L/mol=2.24L;电极c增加的质量=
0.4mol
2×64g/mol=12.8g.
故答案为:2.24L;12.8g.
(2)电解硫酸铜溶液时阴极上析出铜,阳极上析出氧气,2Cu2++2H2O
电解
.
]2Cu+O2↑+4H+
故答案为:2Cu2++2H2O
电解
.
2Cu+O2↑+4H+
点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了原电池原理以及物质的量的有关计算,根据转移电子数相等来分析解答即可,难度不大.1年前查看全部
- 生活、生产中处处充满化学,下列说法中正确的是( ) A.用生石灰处理含酸量超标的工业污水 B.用铁桶盛放农药波尔多液
生活、生产中处处充满化学,下列说法中正确的是( ) A.用生石灰处理含酸量超标的工业污水 B.用铁桶盛放农药波尔多液 C.铵态氮肥可与熟石灰混合使用 D.油脂使人肥胖,进食时要避免摄入脂肪  Hut___1年前1
Hut___1年前1 -
 wusheng314 共回答了17个问题
wusheng314 共回答了17个问题 |采纳率88.2%A、生石灰遇到水变成熟石灰,且熟石灰是比较经济的碱,可以和酸性废水发生酸碱中和,所以正确;
B、铁能和波尔多液中的硫酸铜发生置换反应使硫酸铜的药效失去,所以错误;
C、铵态氮肥中的铵根离子会和熟石灰的氢氧根离子反应生成氨气溢出,造成氮素的损失,所以错误;
D、油脂是人体的重要供能物质,是备用能源,根据合理膳食原则,应适量摄入,所以错误.
故选项为:A.1年前查看全部
- 某学生为了使过滤操作能自动添加液体,设计了“自动加液过滤器”,如图所示.在倒置的烧瓶中盛放待过滤的液体,液体从“液体流出
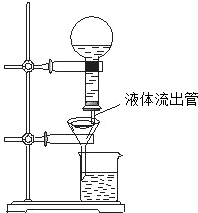 某学生为了使过滤操作能自动添加液体,设计了“自动加液过滤器”,如图所示.在倒置的烧瓶中盛放待过滤的液体,液体从“液体流出管”流入漏斗.为使液体顺利流下,还需插入“空气导入管”与大气相通.
某学生为了使过滤操作能自动添加液体,设计了“自动加液过滤器”,如图所示.在倒置的烧瓶中盛放待过滤的液体,液体从“液体流出管”流入漏斗.为使液体顺利流下,还需插入“空气导入管”与大气相通.
(1)“空气导入管”下口应在______,上口应在______.
A.滤纸边沿下方B.滤纸边沿上方C.待过滤液液面上D.待过滤液中E.A和B项均可F.C和D项均可
(2)试简要说明自动加液过滤的原理.
______. BabyFace_临1年前1
BabyFace_临1年前1 -
 troyaynait 共回答了17个问题
troyaynait 共回答了17个问题 |采纳率88.2%解题思路:(1)与大气相通的“空气导入管”下端要在滤纸边沿下方,符合过滤装置的“一贴二低三靠”的原则,上端在待过滤液液面上;
(2)为保证过滤的效果和正常进行,组装时应控制“空气导入管”的下端低于滤纸边缘,上端在待过滤液液面以上.利用封液的方法达到自动过滤的目的.(1)过滤时,当液体由液体流出管进入漏斗且达到一定高度时(约1cm),形成液封,液体将停止进入漏斗,随着过滤的进行漏斗内的液面下降,在大气压强的作用下液体继续进入漏斗,如此反复,能达到“自动过滤”的目的.所以“空气导入管”下口应在滤纸边沿下方;上口应在待过滤液液面上;
故选A、C.
(2)过滤的原理是:待过滤的液体沿液体流出管流入漏斗,当漏斗里的液面封住“空气导入管”的管口,空气停止进入烧瓶,液体停止流入漏斗;随着过滤的进行,当漏斗里的液面降到空气导入管的下口以下时,空气又进入烧瓶,液体又流入漏斗.点评:
本题考点: 过滤的原理、方法及其应用.
考点点评: 本题以过滤实验为切入点,考查同学们对课本知识的运用,培养同学们的利用知识的能力.1年前查看全部
- 下列试剂的保存不正确的是A碘必须保存在煤油中C用玻璃试剂瓶盛放氢氟酸D液溴用一层水封盖在密闭保存于低温处
 哪个谁1年前1
哪个谁1年前1 -
 龙在通用 共回答了13个问题
龙在通用 共回答了13个问题 |采纳率92.3%A不正确.因为碘不会与空气反应,放煤油里主要就是为了隔绝空气
所以碘不用
B不正确.玻璃的主要成分是SiO2氢氟酸很容易与SiO2发生 如下反应OHSiFHFSiO24224因而不能用玻璃试剂瓶盛放氢氟酸1年前查看全部
- 欲在室温和1.01×10 5 Pa条件下测定镁的原子量。请利用下图给定的仪器(盛放镁条的隔板有小孔)组成一套实验装置(每
欲在室温和1.01×10 5 Pa条件下测定镁的原子量。请利用下图给定的仪器(盛放镁条的隔板有小孔)组成一套实验装置(每种仪器只允许用一次)。请回答下列问题:
⑴假设气流方向由左向右,则各仪器的接口连接的先后顺序为a→ → →b→c→f→e→d(填写字母)。
⑵装置A中的分液漏斗中盛放的液体是 ,作用是 。
⑶连好仪器后,要进行的操作步骤有以下几步:
① 待仪器B中的物质恢复至室温时,测量量筒C中水的体积(假设将测定的体积换算成标准状况下为VmL);
② 擦掉镁条表面的氧化膜,将其置于天平上称量(假设其质量为mg),并将其投入试管B 中;
③ 检查各装置的气密性;
④ 旋开仪器A上分液漏斗的活塞,当镁条完全溶解时再关闭活塞。
上述几步操作的先后顺序是 。(2分)
⑷若未将试管B冷却至室温就测量量筒C中水的体积,这将会使所测镁的相对原子质量的数据(填偏高、偏低和无影响) 。
⑸若未擦净镁条表面氧化膜就进行实验,这将会使所测镁的相对原子质量的数据(填偏高、偏低和无影响) 。
⑹甲、乙、丙三位同学用下图装置来测定一定质量的镁完全反应后生成氢气的体积: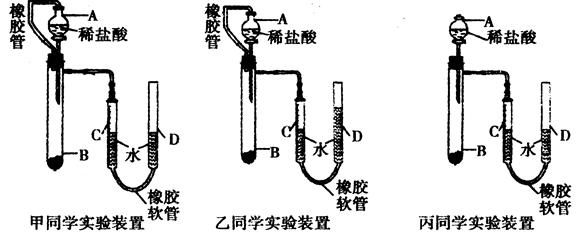
实验步骤如下:
① 检查装置的气密性;
② 向试管B中加入镁条;
③ 准确操作,记录C中液面刻度(C为带有刻度的量气管,D为可上下移动的水准管);
④ 由A向B中滴加稀盐酸至过量;
⑤ B中不在有气体产生并恢复至室温后,准确操作,记录C中液面刻度,计算得到气体的体积为Vml
Ⅰ、甲同学检查该装置气密性的方法是连接好装置,从D管注水,C、D两管液面形成高度差,做好标记,一段时间后,两边高度差 (填“变大”、“变小”或“不变”),说明气密性良好。为使测得的气体体积更精确,记录C中液面刻度时,除使视线与凹液面的最低处相平、冷至室温外,还应 ;
Ⅱ、甲同学认为镁带在实验前应打磨,目的是 ;
Ⅲ、通常实验前须估算药品用量,如果实验过程中,发现盐酸的量不足,应中途加酸还是重新实验: ;理由是 。
Ⅳ、以上是乙、丙两位同学所用实验装置,在步骤⑤读数时所处的稳定状态图,则将会对实验结果产生的影响是(假设其余步骤完善且操作准确无误):乙 ,丙 (填“偏大”、“偏小”或“无影响”)。 水儿的家1年前1
水儿的家1年前1 -
 忘记密码uu 共回答了16个问题
忘记密码uu 共回答了16个问题 |采纳率100%⑴h、g(1分)水使A瓶中的气体进入E瓶,增大E瓶中的气压,将稀盐酸压入B装置与Mg发生化学反应;
⑶③②④① (2分)⑷偏低 ⑸偏高
⑹不变调节D管,使CD两管中液面相平
Ⅱ、除去表面的氧化层;
Ⅲ、重新实验因为中途加酸,装置中的气体会逸出
Ⅳ、偏小偏大
(1)E图中气体应该从长管进来,否则就会将液体压出去了。
(2)装置A中的分液漏斗中盛放的液体是水,其作用是可以使A瓶中的气体进入E瓶,增大E瓶中的气压,将稀盐酸压入B装置与Mg发生化学反应;
(3)先后顺序为③②④①
(4)若未将试管B冷却至室温,会导致测量的气体偏多,也就会使测得的相对原子质量会偏少,
(5)若未擦净镁条表面氧化膜就进行实验,则所测得气体质量会偏少,也就会使测得的相对原子质量会偏大,
(6)高度差不变,就说明气密性良好。调节D管,使CD两管中液面相平,这样可以消除液体压强的影响。
镁表面有氧化膜,不除掉会影响测量结果。
因为中途加酸,装置中的气体会逸出,就会使测量结果不准确。
乙同学的装置图右边液面高,就会使右边压强比左边大,会使左边测得的气体体积偏小,所以乙同学的测量结果偏小,丙同学的装置左边是密闭的,当盐酸流下后会使左边气压变小,所以最终使测量结果偏高大。1年前查看全部
- 甲乙两烧杯中,分别盛放50毫升等物质量浓度的稀硫酸,向甲烧杯中加入mgFe粉,向乙烧杯中加入mgZn粉,
甲乙两烧杯中,分别盛放50毫升等物质量浓度的稀硫酸,向甲烧杯中加入mgFe粉,向乙烧杯中加入mgZn粉,
完全反应后,发现一烧杯金属仍有剩余,若稀硫酸的物质的量浓度为xmol/L,
则x的范围应是? 花开年龄时_uu1年前1
花开年龄时_uu1年前1 -
 leizicom 共回答了18个问题
leizicom 共回答了18个问题 |采纳率94.4%先算mgFe或Zn完全反应消耗硫酸的情况:
Fe+H2SO4=FeSO4+H2 Zn+H2SO4=ZnSO4+H2
56g 1mol 65g 1mol
m a m b
a=m/56 b=m/65
所以铁消耗硫酸量大,金属仍有剩余的一定是铁,硫酸物质的量大于m/65小于m/56
得浓度大于20m/65mol/L 小于20m/56 mol/L1年前查看全部
- 波尔多液农药不能用铁制容器盛放,是因为铁能与农药中的硫酸铜起反应.在该反应中,铁是( )
波尔多液农药不能用铁制容器盛放,是因为铁能与农药中的硫酸铜起反应.在该反应中,铁是( )
A.氧化剂
B.还原剂
C.催化剂
D.发生了还原反应 水妖36571年前1
水妖36571年前1 -
 8053903 共回答了16个问题
8053903 共回答了16个问题 |采纳率93.8%解题思路:根据反应的方程式Fe+Cu2+=Fe2++Cu,从化合价的角度分析.反应的化学方程式为Fe+Cu2+=Fe2++Cu,Fe元素的化合价升高,应为还原剂.
故选B.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,题目难度不大,注意根据元素的化合价的变化判断氧化还原反应的有关概念.1年前查看全部
- 甲、乙两烧杯中分别盛放500mL等物质的量浓度的稀硫酸,向甲烧杯中加入mg铁粉,向乙烧杯加mg锌粒,完全反应后发现有一烧
甲、乙两烧杯中分别盛放500mL等物质的量浓度的稀硫酸,向甲烧杯中加入mg铁粉,向乙烧杯加mg锌粒,完全反应后发现有一烧杯中仍有金属剩余,若H2SO4的物质的量浓度为xmol·L-1,则x的范围是
 桃花梦梦1年前1
桃花梦梦1年前1 -
 ho6ho630 共回答了22个问题
ho6ho630 共回答了22个问题 |采纳率95.5%因为锌的相对原子质量为64,铁为56,故剩余的为铁,因为H2SO4的物质的量浓度为xmol·L-1,所以H2SO4为0.5xmol,反应的铁为28xg,锌为32xg,所以28x<m,32x≥m,联立解得m/28>x≥m/321年前查看全部
- 33.如图是一个用来测定液密度的装置,A管插人的甲烧杯中,B管插人盛放加有紫色石蕊试液的稀硫酸的乙烧杯中
 nnlx1年前1
nnlx1年前1 -
 然犯 共回答了24个问题
然犯 共回答了24个问题 |采纳率91.7%A为两端开口的试管,B为一轻塑料片,烧杯中装有盐水,B在盐水中的深度是你的问题说清楚了吗?如果开始时将B堵在试管的一段,放在盐水中,由于盐水1年前查看全部
大家在问
- 1play a joke;piay the piano;play chess;play basketball中文是什么
- 289年9月到14年9月算多少周岁
- 3抛物线y=x2-(2m-1)x-6m与x轴交于(x1,0)和(x2,0)两点,已知x1x2=x1+x2+49,要使此抛物
- 4如图所示,从S点发出的一条光线,经平面镜MN反射后,其反射光线恰好通过P点.请你作出这条入射光线并完成光路图.
- 5七步诗这首诗里写了哪几种事物 这首诗里有几个表示动作的词分别找出来并解释
- 61千克的8分之3是( )kg;3千克的8分之1是( )kg
- 7下列有关生活中常见有机物的说法中正确的是( ) A.乙醇、乙酸能用碳酸钠溶液、紫色石蕊溶液、酸性高锰酸钾溶液等多种方法
- 8一张纸叠1次有1条折痕,叠2次有3条,叠3次有7条,叠4次有15条,那叠n次有几条?请给下过程,
- 9若一个正数的平方根是2x-1和-x+2,x= 则这个正数是
- 10将50个数据分成5组列出频数分布表,其中第一组的频数是6,第二组与第五组的频数和是20,第三组的频率是0.2,则第四组的
- 11《一块五的遗言》文中划线句在内容和结构方面有什么作用?
- 12倾斜地球同步轨道卫星是运转轨道面与地球赤道面有夹角的轨道卫星,它的运转周期也是24小时,又称24小时轨道,卫星的轨道周期
- 13造句:I have/haven’t .for.
- 14电影院的第一排有12)电影院的第一排有10个座位,后面一排比紧挨的前面一排多一个座位,如果某
- 15下列离子方程式书写不正确的是( )
