CO还原氧化铁的化学方程式
 楚歌汉舞2022-10-04 11:39:549条回答
楚歌汉舞2022-10-04 11:39:549条回答
已提交,审核后显示!提交回复
共9条回复
 消逝的雨 共回答了15个问题
消逝的雨 共回答了15个问题 |采纳率80%- Fe2O3+3CO=高温=2Fe+3CO2
- 1年前
 haruga2003 共回答了73个问题
haruga2003 共回答了73个问题 |采纳率- 3CO+Fe2O3==加热==2Fe +3CO2
- 1年前
 酸奶dē罐头 共回答了9个问题
酸奶dē罐头 共回答了9个问题 |采纳率- CO还原氧化铜、氧化铁的化学方程式: CO+CuO==△==Cu+CO2 3CO+Fe2O3==高温==3CO2+2Fe C还原氧化铜、氧化铁的化学方程式: C+2CuO==△==CO2+2Cu
- 1年前
 yanyu2552 共回答了61个问题
yanyu2552 共回答了61个问题 |采纳率- 3CO+Fe2O3 (高温) 2Fe +3CO2
- 1年前
 msak 共回答了46个问题
msak 共回答了46个问题 |采纳率- 3CO+Fe2O3=3CO2+2Fe(等号上写高温)
- 1年前
 kjkjl 共回答了1个问题
kjkjl 共回答了1个问题 |采纳率- Fe2O3+3CO=高温=2Fe+3CO2
- 1年前
 smlzmm 共回答了15个问题
smlzmm 共回答了15个问题 |采纳率80%- CO还原氧化铜、氧化铁的化学方程式: CO+CuO==△==Cu+CO2 3CO+Fe2O3==高温==3CO2+2Fe C还原氧化铜、氧化铁的化学方程式: C+2CuO==△==CO2+2Cu
- 1年前
 遲早是我的 共回答了717个问题
遲早是我的 共回答了717个问题 |采纳率- 3CO + Fe2O3 =高温 2Fe + 3CO2
- 1年前
 白雪娉婷 共回答了72个问题
白雪娉婷 共回答了72个问题 |采纳率- 3CO+ Fe2O3 ==== 2Fe + 3CO2(高温)
- 1年前
相关推荐
- 某同学收集了班级其他同学做的“氢气还原氧化铜“的实验后的固体残渣(含铜和氧化铜),欲从中回收单质铜和制取硫酸铜溶液,他设
某同学收集了班级其他同学做的“氢气还原氧化铜“的实验后的固体残渣(含铜和氧化铜),欲从中回收单质铜和制取硫酸铜溶液,他设计了如下实验方案:
(1)称量.称量收集到的固体残渣20g,需要的仪器名称是______.
(2)溶解.将20g称量好的固体残渣放入烧杯中,加入过量的稀硫酸溶液,用玻璃棒不断搅拌,直至反应完全.烧杯中发生反应的化学方程式为______
(3)过滤.除滤纸外,还需要从下图中选用哪些仪器______(填字母).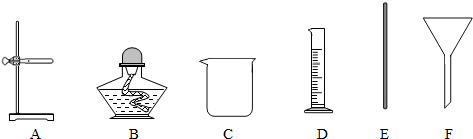
(4)洗涤干燥.洗净滤纸上的固体,干燥后称量,此固体名称为______.
(5)收集滤液.滤液中所含溶质的化学式是______
(6)分析.为了除去滤液中过量的硫酸,应往滤液中加入过量的下列______(填编号)固体粉末,过滤.
①氧化铜②氢氧化钠③铁④硫酸铜
判断固体过量的实验现象是______. tiger_lisa1年前1
tiger_lisa1年前1 -
 鬼爷 共回答了12个问题
鬼爷 共回答了12个问题 |采纳率100%(1)称量固体使用的仪器是托盘天平,所以本题答案为:托盘天平;
(2)氧化铜能与硫酸反应生成硫酸铜和水,所以本题答案为:CuO+H 2 SO 4 ═CuSO 4 +H 2 O;
(3)过滤所用的仪器有漏斗、烧杯、玻璃棒和铁架台,所以本题答案为:A,C,E,F;
(4)铜不与硫酸反应,过滤后留在滤纸上,所以本题答案为:铜;
(5)硫酸过量,故滤液中含有硫酸和生成的硫酸铜,所以本题答案为:H 2 SO 4 和CuSO 4 ;
(6)要除去滤液中的硫酸,不能引入新的杂质,选用氧化铜比较合适,当硫酸全部参加反应时,加入的氧化铜不再溶解,有固体剩余,所以本题答案为:①,有固体不溶解.1年前查看全部
- 在下列各氧化还原反应中,水既不作氧化剂,也不作还原剂的是( )
在下列各氧化还原反应中,水既不作氧化剂,也不作还原剂的是( )
A.2F2+2H2O=4HF+O2
B.C+H2O
CO+H2△ .
C.2Na+2H2O=2NaOH+H2↑
D.Cl2+H2O=HCl+HClO 心肝宝贝是我1年前1
心肝宝贝是我1年前1 -
 大ll007 共回答了13个问题
大ll007 共回答了13个问题 |采纳率100%解题思路:H2O中H元素的化合价为+1价,O元素的化合价为-2价,如水既不是氧化剂也不是还原剂,则H和O的化合价不变化.A.反应中O的化合价升高,水为还原剂,故A错误;
B.反应中,水中H元素的化合价降低,则水作氧化剂,故B错误;
C.反应中,水中H元素的化合价降低,则水作氧化剂,故C错误;
D.反应中,水中H和O元素的化合价不变,所以水既不作氧化剂又不作还原剂,故D正确;
故选D.点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应及氧化还原反应中水的作用,明确元素的化合价变化是解答的关键,难度不大.1年前查看全部
- 下列叙述正确的是( )A. 元素的单质一定由氧化或还原该元素的化合物制得B. 在化学反应中,得电子越多的氧化剂,其氧化
下列叙述正确的是( )
A. 元素的单质一定由氧化或还原该元素的化合物制得
B. 在化学反应中,得电子越多的氧化剂,其氧化性就越强
C. 阳离子只能得到电子被还原,阴离子只能失去电子被氧化
D. 含有最高价元素的化合物不一定具有很强的氧化性 舞珞1年前4
舞珞1年前4 -
 cathy0517 共回答了22个问题
cathy0517 共回答了22个问题 |采纳率95.5%解题思路:A.不活泼金属元素的单质可由自然界直接得到;
B.氧化性的强弱与得电子的难易程度有关,与数目无关;
C.处于中间价态的离子既能被氧化又能被还原;
D.一般含最高价元素的化合物具有很强的氧化性.A.大多数元素的单质由氧化或还原该元素的化合物制得,但不活泼金属元素的单质可由自然界直接得到,故A错误;
B.氧化性的强弱与得电子的难易程度有关,则在化学反应中,得电子越多的氧化剂,其氧化性不一定强,故B错误;
C.处于中间价态的离子既能被氧化又能被还原,如Fe2+、SO32-等,故C错误;
D.一般含最高价元素的化合物具有很强的氧化性,如高锰酸钾、硝酸等,但二氧化碳不具有强氧化性,故D正确;
故选D.点评:
本题考点: 氧化还原反应;氧化性、还原性强弱的比较.
考点点评: 本题考查氧化还原反应,熟悉氧化还原反应的概念及元素的化合价与离子、物质的性质即可解答,注意利用实例来解答,难度不大.1年前查看全部
- H2O+CL2=HCLO+HCL问转移电子数是多少?因为CL2既被氧化又被还原,所以得失各1NA,总共转移2NA
H2O+CL2=HCLO+HCL问转移电子数是多少?因为CL2既被氧化又被还原,所以得失各1NA,总共转移2NA
但貌似我的思路或概念不对.请高手指点下为什么标况下,2.24LCL2与NAOH完全反应转移电子数为0.1NA 骑猫踏天山1年前5
骑猫踏天山1年前5 -
 平宝宝 共回答了14个问题
平宝宝 共回答了14个问题 |采纳率85.7%2.24LCL2是0.1摩尔.
2NaOH+Cl2=NaCl+NaClO+H2O
因为CL2既被氧化又被还原,两个氯原子其中一个给了另外一个,得失电子数只有一个,得失电子数不能相加,0.1摩尔的氯气与NAOH完全反应转移电子数为0.1NA.1年前查看全部
- 一氧化碳还原氧化铁时的颜色变化
 gdhk1年前1
gdhk1年前1 -
 zhw861270 共回答了18个问题
zhw861270 共回答了18个问题 |采纳率88.9%有红褐色变成黑色1年前查看全部
- 指出2na2o2+2h2o=4naoh+o2氧化剂还原剂氧化产物还原产物
 我杯茶1年前2
我杯茶1年前2 -
 syftyzt 共回答了23个问题
syftyzt 共回答了23个问题 |采纳率78.3%氧化剂还原剂都是Na2O2;
氧化产物是NaOH;
还原产物是O2;1年前查看全部
- 物质的量之比为2:5的锌与稀硝酸反应,若硝酸被还原的产物为N2O,反应结束后锌没有剩余,则该反应中被还原的硝酸与未被还原
物质的量之比为2:5的锌与稀硝酸反应,若硝酸被还原的产物为N2O,反应结束后锌没有剩余,则该反应中被还原的硝酸与未被还原的硝酸的物质的量之比是( )
A. 1:4
B. 1:5
C. 2:3
D. 2:5 jlingka1年前3
jlingka1年前3 -
 Eaglet_01 共回答了15个问题
Eaglet_01 共回答了15个问题 |采纳率86.7%解题思路:锌与稀硝酸反应时硝酸既表现酸性又表现氧化性,根据原子守恒和电子守恒规律来解决.锌与稀硝酸反应时硝酸既表现酸性又表现氧化性,根据原子守恒和电子守恒,2mol锌失去4mol电子,生成2mol锌离子,由于生成硝酸锌,则其结合的硝酸根离子是4mol,则剩余的1mol的硝酸被还原为N2O就得到4mol电子,硝酸也全部反应,则该反应中被还原的硝酸与未被还原的硝酸的物质的量之比是1:4,即4Zn+10HNO3(一般稀)=4Zn(NO3)2+N2O↑+5H2O.故选A.
点评:
本题考点: 硝酸的化学性质;氧化还原反应的电子转移数目计算.
考点点评: 本题是对硝酸的氧化性知识的考查,注意电子守恒思想在氧化还原反应中的运用.1年前查看全部
- 逐步还原 奥数题拜托各位了 3Q
逐步还原 奥数题拜托各位了 3Q
甲乙丙三个班共有学生144人,先从加班调出与乙班相同的人数给乙班,再从乙班调出与丙班相同的人数到丙班,最后从丙班调出与甲班相同的人数给甲班,这样甲乙丙三个班人数相等,则原来甲班比乙班多多少人?
 云海波涛1年前1
云海波涛1年前1 -
 zxjee 共回答了25个问题
zxjee 共回答了25个问题 |采纳率92%144/3=48 48/2=24 24+48=72 72/2=36 144-24-36=84 84/2=42 144-42-36=66 66-42=24 追问: 很好,很简便 回答: 其实到第二步就可以得出答案了,只是解释起来有点麻烦.
麻烦采纳,谢谢!1年前查看全部
- C还原SiO2为什么生成CO而不是CO2?
C还原SiO2为什么生成CO而不是CO2?
C即使不过量也会生成CO么? xucheng99331年前1
xucheng99331年前1 -
 saulnier 共回答了15个问题
saulnier 共回答了15个问题 |采纳率73.3%高温下CO更稳定1年前查看全部
- NaOH,Na2O,Na2CO3,Na2O2 哪一个放在空气中,会发生氧化还原反应而变质?
NaOH,Na2O,Na2CO3,Na2O2 哪一个放在空气中,会发生氧化还原反应而变质?
希望能详细解答,谢谢了! realsunny1年前5
realsunny1年前5 -
 wdc1000 共回答了14个问题
wdc1000 共回答了14个问题 |采纳率92.9%Na2O2会发生变质与空气中得水蒸气和CO2反应生成氧气
NaO也会发生变质只不过生成NaOH没有发生氧化还原,
NaCO3在空气中性质稳定
NaOH在空气中会潮解,也会与CO2反应生成NaCO3但都不是氧化还原1年前查看全部
- 详解:什么是氧化还原反应?a.详解氧化反应b.详解还原反应c.什么反应是氧化还原反应d.这种反应的规律e.几个氧化反应方
详解:什么是氧化还原反应?
a.详解氧化反应b.详解还原反应c.什么反应是氧化还原反应d.这种反应的规律e.几个氧化反应方程式和几个还原反应 lehui1年前2
lehui1年前2 -
 0000799787 共回答了24个问题
0000799787 共回答了24个问题 |采纳率91.7%一般判断氧化还原反应通过元素化合价的升降就能判断.
元素化合价升高,该元素组成的物质就是还原剂
元素化合价降低,该元素组成的物质就是氧化剂
比如氢气还原氧化铜生成铜和水,氢元素化合价升高,所以氢气就是还原剂,铜元素化合价降低,氧化铜是氧化剂.还原剂被氧化,氧化剂被还原1年前查看全部
- 为什么碳在氧气中燃烧属于氧化还原反应啊?
为什么碳在氧气中燃烧属于氧化还原反应啊?
我觉得不属于吧...要讲清楚啊!
哪有变化?.. 木曜日的诞生1年前4
木曜日的诞生1年前4 -
 rochardhao 共回答了26个问题
rochardhao 共回答了26个问题 |采纳率84.6%碳可以算作0价,氧也是0价.不完全燃烧碳为+2价,氧为-2价,碳被氧化,氧被还原.完全燃烧碳+4价,氧-2价,还是碳被氧化,氧被还原.所以为氧化还原反应.1年前查看全部
- 有下列几种反应类型:①消去②加聚③水解④加成⑤还原⑥氧化,用丙醛制取1,2一丙二醇,按正确的合成路线依次发生的反应所属类
有下列几种反应类型:①消去②加聚③水解④加成⑤还原⑥氧化,用丙醛制取1,2一丙二醇,按正确的合成路线依次发生的反应所属类型应是( ) A.⑤①④③ B.⑥④③① C.①②③⑤ D.⑤③④①  异维之心1年前1
异维之心1年前1 -
 127fl 共回答了14个问题
127fl 共回答了14个问题 |采纳率85.7%用丙醛制取1,2一丙二醇,官能团发生变化,官能团数目变化,1,2一丙二醇有2个羟基,且处于相邻的碳原子上,
所以应先制备丙烯,先加氢还原为丙醇,在浓硫酸加热条件下发生消去反应,得丙烯;
再与溴加成,制得1,2一二溴丙烷,再在碱的水溶液条件下水解,得1,2一丙二醇.
故合成路线依次发生的反应所属类型顺序为⑤①④③,
故选A.1年前查看全部
- 氯水食盐漂白粉3种物质在空气中变质过程中 既有氧化还原反应又有非氧化还原反应的是?
 居士清云1年前1
居士清云1年前1 -
 qquu 共回答了16个问题
qquu 共回答了16个问题 |采纳率100%氯水分解是氧化还原反应.
食盐变质是物理变化.
漂白粉变质跟二氧化碳和水反应,是非氧化还原反应.生成的次氯酸分解是氧化还原反应.1年前查看全部
- 在木炭还原氧化 碳的实验中.木炭在高温中会不会与试管内的氧气反应 生成二氧化碳.而二氧化碳与碳在高温
在木炭还原氧化 碳的实验中.木炭在高温中会不会与试管内的氧气反应 生成二氧化碳.而二氧化碳与碳在高温
又能生成一氧化碳.那出来的气体不就是一氧化碳 感觉怪怪的
 假辰xx1年前1
假辰xx1年前1 -
 xiaodao0505 共回答了10个问题
xiaodao0505 共回答了10个问题 |采纳率100%这个要是能站在微观的角度来考虑就好办了.在这个反应中试管内的氧气可以忽略不考虑,主要是要考虑谁过量.“木炭还原氧化 碳”到底是什么?1年前查看全部
- 在氢气还原四氯化硅的反应中,氢气的作用是什么?
 yunlifei19861年前2
yunlifei19861年前2 -
 zgmin12 共回答了24个问题
zgmin12 共回答了24个问题 |采纳率83.3%是还原剂1年前查看全部
- ①N2+3H2——2NH3,参考书上说N2→NH3,氮元素发生的是还原反应!可我认为化合价升高是氧化反应啊?怎么会是还原
①N2+3H2——2NH3,参考书上说N2→NH3,氮元素发生的是还原反应!可我认为化合价升高是氧化反应啊?怎么会是还原反应.②4NH3+5o2——4NO+6H2O 2NO+O2——2NO2 参考书上说NH3→NO,NO→NO2,氮元素发生的均为氧化反应!可是化合价降低才是还原反应啊?
 jasmine18001年前1
jasmine18001年前1 -
 jinyaya 共回答了18个问题
jinyaya 共回答了18个问题 |采纳率94.4%①N2+3H2——2NH3 的反应中,氮元素从零价降低到负三价(NH3中氮元素是负三价,氢元素是正一价),化合价降低发生的是还原反应.
②4NH3+5o2——4NO+6H2O 2NO+O2——2NO2
这两个反应中氮元素化合价都是升高的.4NH3+5o2——4NO+6H2O 中氮元素从负三升高到正二价,2NO+O2——2NO2 中从正二升高到正四价.都是氧化反应.
注意:NH3中氮元素是负三价,氢元素是正一价,这一点你开始弄错了.1年前查看全部
- 碳与氧气的反应中具有什么性?木炭还原氧化铜的反应中被氧化的物质是什么?议论文的分论点是什么?
 zlf261261年前2
zlf261261年前2 -
 edmc 共回答了22个问题
edmc 共回答了22个问题 |采纳率90.9%还原性
木炭
支撑中心论点的小观点1年前查看全部
- 关于高一的氧化还原反应.今有三个氧化还原反应:(1)2FeCl3+2KI===2FeCl2+2KCl+I2(2)2FeC
关于高一的氧化还原反应
.今有三个氧化还原反应:
(1)2FeCl3+2KI===2FeCl2+2KCl+I2
(2)2FeCl2+Cl2===2FeCl3
(3)KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O
若某溶液中有Fe2+和I-共存,要氧化除去I-离子而又不影响Fe2+和Cl-可加入的试剂是( )
A、Cl2 B、KMnO4 C、FeCl3 D、HCl
解析:
本题主要考查根据化学方程式进行判断物质氧化性的强弱.
由(1)知:FeCl3具有氧化性,它可以氧化I-;
由(2)知:Cl2具有氧化性,且氧化性Cl2>FeCl3,Cl2可以氧化FeCl2;
由(3)知,KMnO4具有氧化性,且氧化性KMnO4>Cl2,KMnO4可以氧化Cl-,故本题应加入的试剂应为FeCl3,选C.
我的疑问:(1)中不是三价铁的氧化性大于碘单质吗 为什么说是碘离子?还有(3)的双线桥怎么标? shinemidnight1年前1
shinemidnight1年前1 -
 sunsova 共回答了18个问题
sunsova 共回答了18个问题 |采纳率83.3%(1)铁离子将碘离子氧化成了碘单质,而铁离子被碘离子还原成了亚铁离子.要看电子转移的状况,是铁离子将2mol e-转移给了碘离子而不是碘单质.
(2) +7 -1 +2 0
2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O
1.从+7价Mn到Cl2,得10*e-,被还原,还原反应
2..从-1价Cl到+2价Mn,失2*5e-,被氧化,氧化反应1年前查看全部
- 电解还原水的问题1.是目前来说人类最健康的饮用水吗?2.什么成分?
 tima20061年前1
tima20061年前1 -
 当兵的岁月 共回答了14个问题
当兵的岁月 共回答了14个问题 |采纳率92.9%一般来讲,电解还原水是由普通的自来净化水,然后通过阴阳电极,在电场的作用下将水分子团打散、变小、重新排列,使水分子的结构发生改变,使其中一部分水的氧化还原电位呈正值,另一部分水的氧化还原电位呈负值,最后通过膜分离技术得到电解还原水,使之具有医疗保健作用.
电解还原水是养生保健水
电解还原水之所以能全面促进人体健康,其奥秘就在于它的水分子团小(5~7个水分子),重氢含量少,并含有多种有益于生命的元素及其含水络合离子群.在普通饮水中,重氢含量多,水分子团大(10~13个).而电解还原水重氢含量少、水分子团小,其活性大、渗透力强、溶解性好,有利于各种营养素的吸收、运送和利用,并促进人体生化反应的速度和细胞DNA的合成、复制、转录.电解还原水中含有的多种元素(钠、钾、镁、锌、钙、铁、铬等)及其含水络合离子群,在人体生化反应过程中起催化激活作用,有的直接成为生物酶的活化中心,有的影响DNA的合成、复制.
此外电解还原水的PH值呈弱碱性,长期饮用有助于调节人体的酸碱平衡,为细胞新陈代谢创造良好的生活环境;同时电解还原水带负电位,具有很强的抗氧化作用,有利于清除人体内多余的“垃圾”,保护细胞健康,延缓人体衰老.1年前查看全部
- 较不活泼的金属单质不能还原较活泼的金属阳离子,为什么不对阿?
 maxiaohai1年前1
maxiaohai1年前1 -
 山上的猪 共回答了17个问题
山上的猪 共回答了17个问题 |采纳率94.1%Cu+2Fe3+=Cu2+ +2Fe2+1年前查看全部
- 化学高手进!关于氧化还原和硝酸(NO3离子)的问题
化学高手进!关于氧化还原和硝酸(NO3离子)的问题
书上说,硝酸(HNO3)有强的氧化性,所以可以与一些物质发生氧化还原反应.
例如HNO3+Cu的反应.
书上的E.C.S.的列表,写的是NO3-是强的氧化剂(oxidizing agent)
我想问,那么在Fe(铁)和Cu(NO3)2的反应中,为什么NO3-不是氧化剂了?是因为只要不是硝酸,而是和其他元素组成盐,它就不具氧化性了? 江南茶秀1年前4
江南茶秀1年前4 -
 dhscjx 共回答了19个问题
dhscjx 共回答了19个问题 |采纳率89.5%NO3的强氧化性要在酸性条件下才显现出来.在铁和硝酸铜的反应中,若加入硫酸,NO3-的氧化性就会显现出来了.1年前查看全部
- fe+h2so4=feso4+h2上升 那个元素化合价升高 那个降低 还原几是 氧化生产物是
 忘忧雨1年前1
忘忧雨1年前1 -
 szking521 共回答了15个问题
szking521 共回答了15个问题 |采纳率93.3%铁元素的化合价从0到+2,升高,被氧化,得到的FeSO4是氧化产物,本身是还原剂
氢元素的化合价从+1到0,降低,被还原,得到的H2是还原产物,本身是氧化剂1年前查看全部
- 三阶魔方第三层还原公式…… 顶层和底层OK第三层的两个角有个公式…还有角OK后的中间那个块的.要详
三阶魔方第三层还原公式…… 顶层和底层OK第三层的两个角有个公式…还有角OK后的中间那个块的.要详
三阶魔方第三层还原公式……
顶层和底层OK第三层的两个角有个公式…还有角OK后的中间那个块的.最好图文 不要单一公式!不要链接!




 北大生生不息1年前1
北大生生不息1年前1 -
 jenny0824 共回答了18个问题
jenny0824 共回答了18个问题 |采纳率94.4%以白色为底,黄色为上,红色为左,橙色为右,绿色为前,蓝色为后,做公式
左顺,上逆,右顺,上顺顺,左逆,上顺,左顺,右逆,上逆,右顺,上顺顺,左逆,上顺,右逆,上顺.
如果看不懂,可以加yinliming198245,手法演示给你看,希望你喜欢我的答案1年前查看全部
- 急求!为什么在锌与硫酸铜的反应中铜是还原产物
 悟空来了剿清妖1年前4
悟空来了剿清妖1年前4 -
 rainrain9 共回答了14个问题
rainrain9 共回答了14个问题 |采纳率78.6%在锌与硫酸铜的反应中,铜离子做氧化剂,得电离,被还原为单质铜,铜为还原产物.
氧化剂 +电子----->还原产物
还原剂 -电子----->氧化产物1年前查看全部
- 1木炭不充分燃烧2 一氧化碳燃烧 3甲烷燃烧4 酒精燃烧5碳和二氧化碳反应6碳还原氧化铜7碳还原氧化铁8氢气还原氧化铜9
1木炭不充分燃烧2 一氧化碳燃烧 3甲烷燃烧4 酒精燃烧5碳和二氧化碳反应6碳还原氧化铜7碳还原氧化铁8氢气还原氧化铜9工业煅烧石灰石10一氧化碳还原氧化铜 11加热铜粉 最好发图片谢谢
 qwteryeru1年前1
qwteryeru1年前1 -
 cqitic-solow 共回答了14个问题
cqitic-solow 共回答了14个问题 |采纳率92.9%1、2C+O2=2CO
2、2CO+O2=2CO2
3、CH4+2O2=CO2+2H2O
4、C2H5OH+3O2=2CO2+3H20
5、C+CO2=2CO
6、C+CUO=CO+CU;C+2CUO=CO2+2CU
7、3C+Fe2O3=3CO+2Fe;3C+2Fe2O3=2CO2+4Fe
8、H2+CUO=CU+H2O
9、CaCO3=CaO+CO2
10、CO+CUO=CU+CO2
11、2CU+O2=2CUO
我的答题到此结束,谢谢
希望我的答案对你有帮助1年前查看全部
- 由物质得氧叫氧化,物质失氧叫还原的观点来分析下列化学反应属于氧化还原反应的是( )
由物质得氧叫氧化,物质失氧叫还原的观点来分析下列化学反应属于氧化还原反应的是( )
A.氢气在氧气中燃烧 B.氢气还原氧化铜
C.CO还原Fe2O3 D.石灰石和稀盐酸反应制CO2 紫竹林轩1年前1
紫竹林轩1年前1 -
 son_of_wind 共回答了14个问题
son_of_wind 共回答了14个问题 |采纳率92.9%选A吧,我觉得1年前查看全部
- 关于铜和浓硫酸的反应这个反应中氧化剂还原剂和氧化产物还原产物分别是什么?
 zoujuan1年前3
zoujuan1年前3 -
 理查德泰森123 共回答了17个问题
理查德泰森123 共回答了17个问题 |采纳率88.2%氧化剂浓硫酸,还原剂铜
氧化产物硫酸铜,还原产物二氧化硫
Cu+2H2SO4(浓)=加热=CuSO4+SO2↑+2H2O1年前查看全部
- 图是一个正方体的展开图如果将它还原为正方体那么AB,CD,EF,GF这四条线段
 胖胖女1年前0
胖胖女1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- Na2o2参加的氧化还原反应中除了岐化反应还有什么反应?举例说明
 vzshgfdh1年前1
vzshgfdh1年前1 -
 hml1984 共回答了17个问题
hml1984 共回答了17个问题 |采纳率88.2%氧化剂 Na2o2+SO2=Na2SO4
还原剂 Na2O2+H2SO4+KMnO4=MnSO4+Na2SO4+H2O+O2(没配平)1年前查看全部
- 镁和氯化铁溶液反应中为什么镁不会将铁还原为2价?
 建缘1年前1
建缘1年前1 -
 oooofish 共回答了14个问题
oooofish 共回答了14个问题 |采纳率92.9%由于氯化铁溶液呈酸性,镁易与酸反应,而不与铁离子发生氧化还原反应.
FeCl3+3H2O=(可逆)=Fe(OH)3(沉淀)+3HCl
Mg+2HCl==MgCl2+H2(气体)
3Mg+2FeCl3+6H2O==3MgCl2+2Fe(OH)3(沉淀)+3H2(气体)
故不会将铁还原成二价1年前查看全部
- 1.用还原赤铁矿可得到一种具有银白色金属光泽的单质A,A在纯氧中燃烧得到一种黑色固体B,将B投入到稀硫酸中,可得到溶质为
1.用还原赤铁矿可得到一种具有银白色金属光泽的单质A,A在纯氧中燃烧得到一种黑色固体B,将B投入到稀硫酸中,可得到溶质为C和D的混合溶液,则A、B、C、D的化学式分别是:
2. 将一定质量的镁铝合金投入100mL一定物质的量浓度HCl中,合金全部溶解,向所得溶液中滴加5mol/L的NaOH溶液到过量,生成沉淀的质量与加入的NaoH溶液的体
积关系如图:
求A点为多少?具体的方程式和式子)
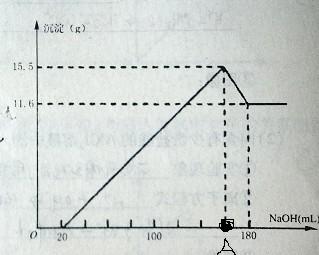
图上有个地方错了。A点的地方,沉淀是19.4... 5513600011年前1
5513600011年前1 -
 alexissui 共回答了19个问题
alexissui 共回答了19个问题 |采纳率94.7%赤铁矿被还原生成铁单质,A是Fe.Fe在纯氧中燃烧生成四氧化三铁B为Fe3O4.Fe3O4可视为FeO·Fe2O3所以C和D分别为FeSO4和Fe2(SO4)3.就是这个分析,真的没有计算方法.
2.当加入体积为20ml的时候把盐酸完全的中和了,在A点的时候生成Mg(OH)2和Al(OH)3,在180的时候Al(OH)3反应生成AlO2^-
Al(OH)3 + OH- = AlO2^- + 2H2O.得到Al(OH)3的质量为15.5 - 11.6 = 3.9g 氢氧化铝的物质的量为3.9/78 = 0.05mol,消耗氢氧根为0.05mol
11.6为氢氧化镁的质量Mg(OH)2,物质的量为11.6/58 = 0.2mol,则消耗氢氧根的量为0.4mol
共消耗氢氧化钠0.45mol.体积为0.45/5 x 1000 = 90ml
加上一开始中和盐酸的20ml,则在A点的体积为90+20 = 110ml
不够详细,很多都是文字,请见谅.
有问题欢迎追问.
希望我的回答能够对你有所帮助1年前查看全部
- 第四题,我不会还原,最好有图,我还原变成三角形了……
 flying_yao1年前1
flying_yao1年前1 -
 flrs79 共回答了21个问题
flrs79 共回答了21个问题 |采纳率95.2%选b,1年前查看全部
- 简单说一下有机物不能发生消去 加成 取代 氧化 还原的情况特征
 1833877871年前1
1833877871年前1 -
 zisedeputao 共回答了16个问题
zisedeputao 共回答了16个问题 |采纳率81.3%·
碳原子连接的有氢原子,即可发生取代.
存在碳碳双键、醛基、酮基,即可发生加成.
连接碳原子的氢原子、羟基、醛基、碳碳双键、连接苯环的烃基,都可以被氧化.加氧即为氧化.
碳碳双键、醛基、酮基与氢气的加成即为还原.1年前查看全部
- 为测定某纯净的铁的氧化物的组成,称取14.4g该氧化物,在加热的条件下用CO气体还原该氧化物,并将反应后导出的气体通入过
为测定某纯净的铁的氧化物的组成,称取14.4g该氧化物,在加热的条件下用CO气体还原该氧化物,并将反应后导出的气体通入过量的澄清石灰水中,得到20g沉淀,试确定铁的氧化物的化学式.
 背着氧气的鱼1年前1
背着氧气的鱼1年前1 -
 xufeiya 共回答了18个问题
xufeiya 共回答了18个问题 |采纳率88.9%FexOy --------- yCO------yCO2------yCaCO3
56x+16y---------------------------------------100y
14.4------------------------------------------------20
解得,x:y=1:1
即FeO1年前查看全部
- 在氧化还原反应中什么叫氧化性/还原性、被氧化/被还原、氧化产物/还原产物
在氧化还原反应中什么叫氧化性/还原性、被氧化/被还原、氧化产物/还原产物
和其他氧化还原反应的知识点! 散落的记忆1年前5
散落的记忆1年前5 -
 sunle008 共回答了18个问题
sunle008 共回答了18个问题 |采纳率88.9%反应中得到电子的,化合价降低,就是氧化剂;失去电子,化合价升高,就是还原剂(两者都是反应物)
氧化物被还原,生成还原产物;还原物被氧化,生成氧化产物(是不是像绕口令?去年我也这么被搞糊涂的)1年前查看全部
- 魔方CFOP公式中的OLL公式视频一次还原,我为什么有的只是还原顶层?
 quite11年前3
quite11年前3 -
 一路无语 共回答了23个问题
一路无语 共回答了23个问题 |采纳率91.3%魔方标准CFOP公式是建立在“记忆最少的公式来还原魔方”的基础上.
如果OLL时直接还原,那是特殊情况使用的特殊公式.
CFOP的OLL步骤只是调整顶层朝向,角块和楞块还需重新调整,这个过程就是CFOP的PLL步骤.
PLL一般也分两步,调整角->调整棱,标准做法中是先调整角而不去管棱的走向,然后再调整棱,不过在高级转法中就有很多特殊公式去同时调整角和棱,可以参考三阶高级公式或者盲拧公式,作为学会标准CFOP转法后的提速补充.1年前查看全部
- 用氢气还原8gCuO,将反应后的气体全部通入足量的浓硫酸,浓硫酸的质量增加了0.9g,则剩余的固体是什么?
用氢气还原8gCuO,将反应后的气体全部通入足量的浓硫酸,浓硫酸的质量增加了0.9g,则剩余的固体是什么?
额........只有Cu Raincho1年前1
Raincho1年前1 -
 吃了八分饱 共回答了25个问题
吃了八分饱 共回答了25个问题 |采纳率96%根据题目可得:浓硫酸增加的质量应该为H2还原CuO生成的水的质量,所以n(H2O)=0.9/18=0.05mol.因为n(CuO)=8/80=0.1mol,得n(CuO)>n(H2O),所以固体中含有Cu和CuO,且均为0.05mol1年前查看全部
- 怎么生成氯化亚铁这是一个氧化还原的反应~还原性从 大 到小:K,Ca,Na,Mg,Al,Zn,Fe,Sn,Pb,H,Cu
怎么生成氯化亚铁
这是一个氧化还原的反应~
还原性从 大 到小:K,Ca,Na,Mg,Al,Zn,Fe,Sn,Pb,H,Cu,Hg,Ag,Hb,Au.
氧化性从 小 到大:K+,Ca2+,Na+,Mg2+,Al3+,Zn2+,Fe2+,H+,Cu2+,Fe3+,Hg+,Ag+.其实这是按照金属活动性顺序排列的.
铁离子的氧化性是很强的,所以铁会被氧化成亚铁离子.
2Fe3+ +Fe=3Fe2+ 不太懂,谁能细说一下 zz之南1年前4
zz之南1年前4 -
 GDHDLLW 共回答了16个问题
GDHDLLW 共回答了16个问题 |采纳率93.8%Fe3+和金属活动性顺序无关,因为它不由金属Fe通过置换反应直接生成.
氧化性:……Al3+1年前查看全部
- 写两个有单质参加的化合反应,两个化合反应,两个不是分解反应的,两个不是置换反应的化学方程式,方程式中带有氧化还原反应,用
写两个有单质参加的化合反应,两个化合反应,两个不是分解反应的,两个不是置换反应的化学方程式,方程式中带有氧化还原反应,用双线桥表示,写的明白点,有急用
 dsf435dgbf1年前1
dsf435dgbf1年前1 -
 yb177 共回答了16个问题
yb177 共回答了16个问题 |采纳率87.5%2SO2+O2=2SO3,2NO+O2=2NO2,C+CO2=2CO,后边意思没明白1年前查看全部
- 一道高一氧化还原反应题目有三个氧化还原反应,2FeCl3+2kI==2Fecl2+2KCl+I22FeCl2=+Cl2=
一道高一氧化还原反应题目
有三个氧化还原反应,
2FeCl3+2kI==2Fecl2+2KCl+I2
2FeCl2=+Cl2==2FeCl3
2KMnO4+16HCl==2KCl+2MnCL2+5cl2↑+8H2O
若某溶液中有二价铁离子负一价碘离子共存,要氧化负一价碘离子,二又不影响二价铁离子和负一价的氯离子,可加入试剂是
ACL2 BKMnO4 C2FeCL3
D浓盐酸 笨笨的飘飘1年前3
笨笨的飘飘1年前3 -
 yz0127 共回答了14个问题
yz0127 共回答了14个问题 |采纳率100%A.CL2氧化二价铁
2FeCl2+Cl2==2FeCl3
B.KMnO4氧化负一价氯
2KMnO4+16HCl==2KCl+2MnCL2+5cl2↑+8H2O
D.浓盐酸
不能氧化负一价碘
故:选C1年前查看全部
- 生物竞赛的几道判断题1单糖具有还原性,所以可以用氧化还原的原理测定其含量2淀粉的还原性大于纤维素3动物油韩不饱和脂肪酸比
生物竞赛的几道判断题
1单糖具有还原性,所以可以用氧化还原的原理测定其含量
2淀粉的还原性大于纤维素
3动物油韩不饱和脂肪酸比植物油多
4固醇类化合物的基本结构是环戊烷多氢菲
5磷脂,糖脂等作为细胞膜成分(或部于细胞表面),在细胞识别,神经传导,组织免疫等多方面发挥作用 板板9131年前2
板板9131年前2 -
 旋律再生 共回答了18个问题
旋律再生 共回答了18个问题 |采纳率88.9%对
错 他们的还原性极弱
错动 物的脂肪酸结构比较简单,多是饱和脂肪酸
对
对1年前查看全部
- 碳需要积多少热量才能把二氧化碳还原一氧化碳
碳需要积多少热量才能把二氧化碳还原一氧化碳
化学方程式(C+CO2=2CO),积热的碳可以使二氧化碳还原成一氧化碳.但是在还原的时候需要多少热量或者多少温度却没有说 , driver_b1年前1
driver_b1年前1 -
 _kuangchun_ 共回答了23个问题
_kuangchun_ 共回答了23个问题 |采纳率95.7%C+ 1/2 O2 = CO+110.5 kJ
C+ O2= CO2+ 393.5 kJ
CO+ 1/2O2 = CO2+ 283 kJ
由盖斯定律知道
把第一个式子、第二个式子合并,消去O2项【即式子1×2-式子2】
得 C+CO2=2CO-172.5kJ
所以可得,1molC与1molCO2反应,需要吸收172.5KJ热量1年前查看全部
- 偏亚硫酸氢钠有络合能力亚硫酸钠具有还原脱色作用,但是为何需要比较高的浓度?例如12wt%.是否是亚硫酸钠还具有与有色物质
偏亚硫酸氢钠有络合能力
亚硫酸钠具有还原脱色作用,但是为何需要比较高的浓度?例如12wt%.是否是亚硫酸钠还具有与有色物质形成络合物的能力,从而将有色物质除去. poeeva1681年前1
poeeva1681年前1 -
 panshijack 共回答了11个问题
panshijack 共回答了11个问题 |采纳率100%任何问题都要从其发生变化的本质来研究
化学问题也是的
比如该题,亚硫酸钠之所以能够使花退色,是因为亚硫酸钠与花中的碱性物质发生了中和反应,导致了花的退色.1年前查看全部
- 木炭粉、一氧化碳分别还原相同质量的氧化铜,则所需木炭粉、一氧化碳二者的质量比
木炭粉、一氧化碳分别还原相同质量的氧化铜,则所需木炭粉、一氧化碳二者的质量比
C+2CuO=2Cu+CO2
12 160
CO+CuO=Cu+CO2
28 80
x=56 160
12:56=3:14
不是3:7 可是x=56是怎么来的啊 只爱奕1年前1
只爱奕1年前1 -
 2337425 共回答了21个问题
2337425 共回答了21个问题 |采纳率85.7%CO+CuO=Cu+CO2 28 80 x=56 160 28/x=80/160 x=561年前查看全部
- 因发生氧化还原反应在水溶液中不能大量共存的离子组是A.Ca2+,Cl-,Fe3+ ,CO32-,B.Na+,SO32-,
因发生氧化还原反应在水溶液中不能大量共存的离子组是A.Ca2+,Cl-,Fe3+ ,CO32-,B.Na+,SO32-,NO3-,H+ ,C.Fe3+,Mg2+,Cl-,SO42-,D.Na+,Al3+,SO42-,HCO3-
 jcsea1231年前1
jcsea1231年前1 -
 水光浮动 共回答了21个问题
水光浮动 共回答了21个问题 |采纳率95.2%选择B.
A、Ca2+与CO32-沉淀,Fe3+与CO32-双水解.
B、酸性条件下,NO3-能氧化SO32-,属于氧化还原反应.
C、可以共存.
D、Al3+与HCO3-双水解.1年前查看全部
- 离子共存问题中的氧化还原反应能发生氧化还原反应的离子是不能共存的,『但我不知道怎么判断是否会发生氧化还原反应,怎么判断』
离子共存问题中的氧化还原反应
能发生氧化还原反应的离子是不能共存的,『但我不知道怎么判断是否会发生氧化还原反应,怎么判断』还有是怎么看离子是具有还原性还是氧化性的?求详细解答离子共存中氧化还原反应这一块.(求列出高中化学中会发生氧化还原反应的离子,要详细) sr8k1年前2
sr8k1年前2 -
 男画皮 共回答了22个问题
男画皮 共回答了22个问题 |采纳率90.9%常见的判断氧化性/还原性强弱的方法有:
1.从元素的价态考虑
最高价态——只有氧化性,如Fe3+ H2SO4 KMnO4
最低价态——只有还原性,如金属单质 Cl- S2-
中间价态——既有氧化性有有还原性,如Fe2+ S等
同种元素的价态高,其氧化性较强;价态低,其还原性较强.
2.根据金属活动顺序表判断
金属越活泼,金属单质的还原性越强,其对应离子的氧化性越弱.
单质还原性:按金属活动顺序表的顺序依次减弱.
金属离子氧化性:按金属活动顺序表的顺序依次减弱.(铁指Fe2+)
如氧化性:Ag+ > Hg2+ > Fe3+ > Cu2+ > H+ > Fe2+
3.根据非金属的活泼型判断
非金属性越强,单质的氧化性越强,其对应离子的还原性越弱.
单质氧化性:F2 > Cl2 > Br2 > I2 > S
离子还原性:S2- > I- > Br- > Cl- > F-
4.通过化学反应比较
氧化剂 + 还原剂 → 氧化产物 + 还原产物
氧化性:氧化剂 > 氧化产物
还原剂:还原剂 > 还原产物
5.通过与同一物质反应的产物比较
如:2Fe + 3Cl2 =(点燃) 2FeCl3
3Fe + 2O2 =(点燃) Fe3O4
可得出氧化性Cl2 > O2.
高锰酸根离子、次氯酸根离子、过氧根离子、高铁酸根离子都是强氧化性
硫离子,卤素离子都是青还原性
至于反应的判断,具有氧化性的和具有还原性的一起都会反应
如果一种离子价态还能更高,说明具有还原性,反之亦然1年前查看全部
- Had you listened to the doctor ,还原后是什么
 kitcheen1年前4
kitcheen1年前4 -
 ginger0001 共回答了22个问题
ginger0001 共回答了22个问题 |采纳率90.9%You had listened to the docto1年前查看全部
- 1、离子是否一定能溶解在水中2、不是离子是否一定不能溶解在水中3、2H2O2==催化剂==2H2O+O2↑是不是氧化还原
1、离子是否一定能溶解在水中
2、不是离子是否一定不能溶解在水中
3、2H2O2==催化剂==2H2O+O2↑是不是氧化还原反应,若是,那什么是还原剂?什么是氧化剂?
要原因 萧亚轩1年前4
萧亚轩1年前4 -
 A_nan 共回答了19个问题
A_nan 共回答了19个问题 |采纳率78.9%1.离子不一定能溶解在水中.比如氧离子,过氧离子就不能在水中存在.
2.不是离子也可以溶解在水中,比如乙醇,甲醛,氯气(溶于水后,发生反应,生成HCl,HCLO,也有一部分氯气分子溶于水,使溶液显出黄绿色).
3.过氧化氢发生了歧化反应,氧化剂还原剂都是它本身.1年前查看全部
大家在问
- 1已知函数f(x)=ax3+bx2+c是奇函数,则( )
- 2补写出下列名句名篇中的空缺部分。(只选做3小题)
- 3已经理解F2L可以靠理解来转,还需要背F2L公式吗?
- 4两个非连续自然数的和乘以它们的差,积是57,这两个自然数是—和—.
- 5如图,E是矩形ABCD的边AD上的一个动点,点F在射线BC上,AB=6,AD=8.设AE=x.(1)当x为何值时,∠AB
- 6她在比赛中获得了金牌的英语翻译
- 7已知函数f(x)+ax平方-c满足-4
- 8Do or not do,no
- 9十八世纪,亚当。斯密发现在一家扣针厂里,生产一枚扣针需要经过18道工序。这家工厂由10个工人分别承担1-2道工序,每天共
- 10阅读文言文《伤仲永》,完成30-34题。(8分) 伤仲永王安石
- 11根据下面一段文字提供的信息,给“无性繁殖”下一个定义。
- 12阅读答案《触摸春天》触摸春天 邻居的小孩安静,是个盲童.春天来了,小区的绿地上花繁叶茂,桃花开了,月季花开了,浓郁的花香
- 13已知空间四边形ABCD,E.H.G分别是AB,BC,CD的中点
- 14问几道5年纪数学题 给80分1.建造一个长方体的游泳池,长30m,宽1.m 深1.6m.求这个水池能蓄水多少升?2.一个
- 15各色的鲜花在春日中开放(拟人句)
