四氧化二氮(N 2 O 4 )是卫星运载火箭燃料之一,下列叙述正确的是 [
 yezi81482022-10-04 11:39:541条回答
yezi81482022-10-04 11:39:541条回答| 四氧化二氮(N 2 O 4 )是卫星运载火箭燃料之一,下列叙述正确的是 |
| [ ] |
| A.N 2 O 4 中氮元素和氧元素的质量比是1:2 B.N 2 O 4 由2个氮元素和4个氧元素组成 C.1个N 2 O 4 分子由6个原子构成 D.1molN 2 O 4 约含有6.02×10 23 个氮原子 |

已提交,审核后显示!提交回复
共1条回复
 山关行足_山关望 共回答了13个问题
山关行足_山关望 共回答了13个问题 |采纳率100%- C
- 1年前
相关推荐
- 发射通信卫星的火箭用联氨(N 2 H 4 )做燃料,用四氧化二氮(N 2 O 4 )助燃,生成物不会对大气造成污染。
发射通信卫星的火箭用联氨(N 2 H 4 )做燃料,用四氧化二氮(N 2 O 4 )助燃,生成物不会对大气造成污染。
(1)反应的化学方程式为2N 2 H 4 +N 2 O 4 =3__________+4H 2 O,请在横线上填写化学式以完成该化学方程式。
(2)请计算9.6gN 2 H 4 完全燃烧需要助燃物N 2 O 4 的质量。 Amy雪儿1年前1
Amy雪儿1年前1 -
 匪徒不要命 共回答了20个问题
匪徒不要命 共回答了20个问题 |采纳率90%(1)N 2 (2)13.8g
1年前查看全部
- 46克二氧化氮和四氧化二氮混合气中含有原子总数为多少Na 要详解
 高老师zz1年前2
高老师zz1年前2 -
 58jynq6kjn 共回答了26个问题
58jynq6kjn 共回答了26个问题 |采纳率92.3%二氧化氮和四氧化二氮最简式都是NO2,所以可以看做46g NO2,共有原子数3Na1年前查看全部
- 发射“嫦娥二号”的长三丙火箭由三个子级构成,其中一子级上部装有液体四氧化二氮(N 2 O 4 ).下部装有液体偏二甲肼(
发射“嫦娥二号”的长三丙火箭由三个子级构成,其中一子级上部装有液体四氧化二氮(N 2 O 4 ).下部装有液体偏二甲肼(C 2 H 8 N 2 ).发动机内燃烧的化学方程式为:C 2 H 8 N 2 +2N 2 O 4 →3N 2 +2CO 2 +4H 2 O.该反应中( ) A.C 2 H 8 N 2 发生还原反应 B.C 2 H 8 N 2 是氧化剂 C.N 2 O 4 发生氧化反应 D.N 2 O 4 是氧化剂  漆黑夜空1年前1
漆黑夜空1年前1 -
 西贝赤赤 共回答了19个问题
西贝赤赤 共回答了19个问题 |采纳率84.2%偏二甲肼的化学式为C 2 H 8 N 2 ,H为+1价,C为-1价,N为-3价,
则反应C 2 H 8 N 2 +2N 2 O 4 →3N 2 +2CO 2 +4H 2 O中,
C 2 H 8 N 2 中N元素的化合价和C元素的化合价升高,N 2 O 4 中N元素的化合价降低,
则C 2 H 8 N 2 作还原剂,发生氧化反应;N 2 O 4 作氧化剂,发生还原反应;
故选:D.1年前查看全部
- 二氧化氮转化为四氧化二氮的原因
 辣椒兔子1年前2
辣椒兔子1年前2 -
 chafy 共回答了18个问题
chafy 共回答了18个问题 |采纳率88.9%2NO2==加压、或者升高温度==N2O4
N2O4==减压或者降低温度===2NO2
勒夏特列原理1年前查看全部
- 二氧化氮生成四氧化二氮的可逆反应,达到平衡时,加入少量四氧化二氮,二氧化氮的质量分数为什么减小
 0o女夭米青o01年前1
0o女夭米青o01年前1 -
 Betty1986 共回答了19个问题
Betty1986 共回答了19个问题 |采纳率89.5%这个可逆反应平衡的移动与压力关系密切,压力大,反应往生成四氧化二氮方向进行,加入少量四氧化二氮后,二氧化氮总质量是增加的,四氧化二氮也增加了,但是两者不是对等的增加,反应的K=c(N2O4)/[c(NO2)*c(NO2)],K在条件...1年前查看全部
- 发射通讯卫星的火箭用联氨(N2H4)做燃料,用四氧化二氮(N204)助燃,反应的化学方程式如下:2N2H4+N204
发射通讯卫星的火箭用联氨(N2H4)做燃料,用四氧化二氮(N204)助燃,反应的化学方程式如下:2N2H4+N204
3N2+4H20,生成物不污染空气,低碳环保.点燃 .
(1)N2O4中N的化合价为______;
(2)请计算9.6kg N2H4燃完全燃烧需要助燃剂N204的质量. haipinglj1年前1
haipinglj1年前1 -
 kkkk-llll 共回答了15个问题
kkkk-llll 共回答了15个问题 |采纳率86.7%解题思路:(1)根据化合物中各元素的化合价的代数和为0进行解答;
(2)根据反应的化学方程式,利用反应消耗反应物联氨(N2H4)的质量可计算同时需要消耗反应物四氧化二氮(N204)的质量.(1)根根据在化合物中正负化合价代数和为零,氧元素显-2,设氮元素的化合价是x,可知N2O4中氮元素的化合价:2x+(-2)×4=0,则x=+4;故填:+4;(2)设需要助燃物N204的质量为x2N2H4+N204 点燃 . 3...
点评:
本题考点: 根据化学反应方程式的计算;有关元素化合价的计算.
考点点评: 利用反应的化学方程能表示反应中各物质的质量关系的含义,根据反应中任一物质的质量都可以计算出反应中其它物质的质量.1年前查看全部
- (13分)在100℃时,将0.100 mol 的四氧化二氮气体充入 1 L 恒容真空的密闭容器中,隔一段时间对该容器内的
(13分)在100℃时,将0.100 mol 的四氧化二氮气体充入 1 L 恒容真空的密闭容器中,隔一段时间对该容器内的物质浓度进行分析得到下表数据:
(1)该反应的平衡常数表达式为______________________;时间(s) 0 20 40 60 80 c (N 2 O 4 )(mol/L) 0.100 c 1 0.050 c 3 c 4 c (NO 2 )(mol/L) 0.000 0.060 c 2 0.120 0.120
从表中分析: c 1 ________ c 2 ; c 3 ________ c 4 (填“>”、“<”或“=”)。
(2)在下图中画出并标明此反应中 c (N 2 O 4 )和 c (NO 2 )的浓度随时间变化的曲线。
(3)在上述条件下,从反应开始直至达到化学平衡时,四氧化二氮的平均反应速率为__ mol/(L·s)。
(4)反应达到平衡后,下列条件的改变可使NO 2 气体的浓度增大的是
A.增大容器的容积 B.再充入一定量的N 2 O 4
C.分离出一定量的NO 2 D.再充入一定量的He eedcdc1年前1
eedcdc1年前1 -
 arrowsui 共回答了20个问题
arrowsui 共回答了20个问题 |采纳率95%(13分) (1) K =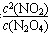 ,<, =
,<, =
(2)
(3)0.001 (4)B
】(1)N 2 O 4 2NO 2
2NO 2
初n: 0.10 0
20s: 0.07 0.06
40s 0.05 0.10
60s: 0.04 0.12
80s: 0.04 0.12
(3) =0.001 mol/(L·s)
=0.001 mol/(L·s)
(4)增大容器的容积,各物质浓度均减少,虽然平衡略向右移,但NO 2 气体的浓度相对原平衡仍然是减小;而在题设条件下,恒容,分离出一定量的NO 2 ,其浓度减少,虽然平衡略向右移,但NO 2 气体的浓度相对原平衡仍然是减小;再充入一定量的He,各物质浓度不变,平衡不移动;再充入一定量的N 2 O 4 ,平衡正向移动,NO 2 气体的浓度增大,符合题意。1年前查看全部
- 氮和氧有多种化合物,如一氧化氮、二氧化氮、三氧化二氮、四氧化二氮、五氧化二氮等.
氮和氧有多种化合物,如一氧化氮、二氧化氮、三氧化二氮、四氧化二氮、五氧化二氮等.
1772年,英国科学家普利斯特里将铜与稀硝酸作用,得到一种无色气体,该气体是一氧化氮.一氧化氮密度比空气略小,与空气混合后,易与空气中的氧气反应,生成二氧化氮,这是一种黄棕色气体--二氧化氮.一氧化氮微溶于水,而二氧化氮可以溶于水后,二氧化氮溶于水后与水反应生成硝酸和一氧化氮.
(1)一氧化氮的物理性质有______,
(2)一氧化氮化学性质的文字表达式______,
(3)一氧化氮收集方法可以为______,
(4)氮氧化合物中,氮的化合价相同的一组是______. blkblkblk1年前1
blkblkblk1年前1 -
 欲哭无泪泪 共回答了12个问题
欲哭无泪泪 共回答了12个问题 |采纳率100%(1)一氧化氮的物理性质有:无色气体,密度不空气小,微溶于水.故填:无色气体,密度不空气小,微溶于水.
(2)一氧化氮和氧气反应能生成二氧化氮,反应的文字表达式为:一氧化氮+氧气→二氧化氮.故填:一氧化氮+氧气→二氧化氮.
(3)一氧化氮能和氧气反应,不能用排气法收集,一氧化氮微溶于水,可以用排水法收集.故填:排水法.
(4)氮氧化合物中,一氧化氮、二氧化氮、三氧化二氮、四氧化二氮、五氧化二氮等物质中氮元素化合价分别为:+2价,+4价,+3价,+4价,+5价.故填:二氧化氮和四氧化二氮.1年前查看全部
- 发射卫星的火箭用联氨(N2H2)作燃料,以四氧化二氮(N2O4)作氧化剂,燃烧尾气由氮气和水蒸气组成.写出反应方程式.是
发射卫星的火箭用联氨(N2H2)作燃料,以四氧化二氮(N2O4)作氧化剂,燃烧尾气由氮气和水蒸气组成.写出反应方程式.是不是这个

不好意思联氨(N2H4) yan25751年前3
yan25751年前3 -
 wufei0247 共回答了16个问题
wufei0247 共回答了16个问题 |采纳率93.8%应该是:4N2H2+N2O4=点燃=5N2+4H2O1年前查看全部
- 发射“嫦蛾一号”的火箭用偏二甲肼(C 2 H 8 N 2 )和四氧化二氮(N 2 O 4 )作常规推进剂,其完全反应的化
发射“嫦蛾一号”的火箭用偏二甲肼(C 2 H 8 N 2 )和四氧化二氮(N 2 O 4 )作常规推进剂,其完全反应的化学方程式:C 2 H 8 N 2 +2N 2 O 4 =3X+2CO 2 +4H 2 O,则X的化学式为 ( )
A.N 2 B.H 2 C.O 2 D.CO  金鱼的vv1年前1
金鱼的vv1年前1 -
 外研社123 共回答了22个问题
外研社123 共回答了22个问题 |采纳率95.5%A
1年前查看全部
- 氧化还原反应下角标的问题就是比如在计算题中 方程式未知 只知道反应物为硝酸 它被还原成了四氧化二氮 这时候N的电子转移个
氧化还原反应下角标的问题
就是比如在计算题中 方程式未知 只知道反应物为硝酸 它被还原成了四氧化二氮 这时候N的电子转移个数应该是2还是1啊?乘不乘下角标呢?求大神解释下这个下角标的问题…… hugh128661年前3
hugh128661年前3 -
 jufy 共回答了16个问题
jufy 共回答了16个问题 |采纳率87.5%要乘的,你要保证反应前后的氮(N)守恒,比如你说的硝酸还原成四氧化二氮,计算电子转移就要相当于两个硝酸被还原成一个四氧化二氮,要将硝酸乘以2,然后再去算电子的转移,希望可以帮到你!1年前查看全部
- 用适当的数字和化学符号表示:(1)氩气______;(2)2个硝酸根离子______;(3)3个四氧化二氮分子_____
用适当的数字和化学符号表示:
(1)氩气______;(2)2个硝酸根离子______;(3)3个四氧化二氮分子______
(4)人体中含量最高的金属元素______;
(5)氧化镁中,氧元素的化合价Mg−2 O Mg.−2 O  薛251年前1
薛251年前1 -
 gh01 共回答了22个问题
gh01 共回答了22个问题 |采纳率81.8%解题思路:(1)氩气是稀有气体元素,由稀有气体元素组成的单质是单原子分子,所以氩气的化学式就是表示氖元素的元素符号,进行解答;
(2)根据离子的表示方法:在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.若表示多个该离子,就在其元素符号前加上相应的数字;进行解答;
(3)根据分子的表示方法:正确书写物质的化学式,表示多个该分子,就在其化学式前加上相应的数字,进行解答;
(4)人体中含量最高的金属元素是钙元素,依据元素符号的写法进行解答;
(5)根据元素化合价的表示方法:确定出化合物中所要标出的元素的化合价,然后在其化学式该元素的上方用正负号和数字表示,正负号在前,数字在后,进行解答.(1)氩气是稀有气体元素,由稀有气体元素组成的单质是单原子分子,所以氩气的化学式就是表示氖元素的元素符号,因此氩气 表示为:Ar;故答案为:Ar;(2)根据离子的表示方法:在表示该离子的元素符号右上角,标出...
点评:
本题考点: 化学符号及其周围数字的意义;化学式的书写及意义;常见元素与常见原子团的化合价.
考点点评: 本题主要考查学生对化学用语的书写和理解能力,题目设计既包含对化学符号意义的了解,又考查了学生对化学符号的书写,考查全面,注重基础.1年前查看全部
- 制备五氧化二氮阳极 四氧化二氮加无水硝酸做电解液 阴极 硝酸水溶液中间有隔膜阻止水通过 求阴阳极板方程式
 dd娃儿5201年前1
dd娃儿5201年前1 -
 iczga2x 共回答了12个问题
iczga2x 共回答了12个问题 |采纳率83.3%阳极:
N2O4 + 2HNO3 - 2e- === 2N2O5 + 2H+
阴极:
2H+ + 2e- ==== H2气体
总反应是N2O4 + 2HNO3 == 2N2O5 + H21年前查看全部
- 2009年3月1日16时13分,“嫦娥一号”成功撞击月球.发射“嫦娥一号”的火箭用偏二甲肼(C2H8N2)和四氧化二氮(
2009年3月1日16时13分,“嫦娥一号”成功撞击月球.发射“嫦娥一号”的火箭用偏二甲肼(C2H8N2)和四氧化二氮(N2O4)作常规推进荆,其完全反应的化学方程式:C2H8N2+2N2OX=3N2+2CO2+4H2O,则X的值为( )
A.1
B.2
C.3
D.4 vantaxy1年前1
vantaxy1年前1 -
 _rqw_f93etu3_e9e 共回答了26个问题
_rqw_f93etu3_e9e 共回答了26个问题 |采纳率92.3%解题思路:由题意,根据“完全反应的化学方程式:C2H8N2+2N2OX=3N2+2CO2+4H2O”,结合质量守恒定律的元素守恒,可知反应前后的元素种类不变,原子个数相等,则可推测x的值.由“完全反应的化学方程式:C2H8N2+2N2OX=3N2+2CO2+4H2O”,结合质量守恒定律的元素守恒,则:反应前:碳原子2个,氢原子8个,氮原子6个,氧原子2x个;反应后:碳原子2个,氢原子8个,氮原子6个,氧原子8个,故氧原子2x=8,故x=4.
故选D.点评:
本题考点: 质量守恒定律及其应用;有关化学式的计算和推断.
考点点评: 本题是运用化学中的基本思想质量守恒思想,通过计算反应前后原子的个数,从而培养了学生的处理问题的能力.1年前查看全部
- 发射通讯卫星用联氨(H2N4)作燃料用四氧化二氮(N2O4)助燃,反应的化学方程式如下
发射通讯卫星用联氨(H2N4)作燃料用四氧化二氮(N2O4)助燃,反应的化学方程式如下
2N2H4+N2O4点燃3N2+4H2O,生成物不会对大气造成污染.试计算:3.2kgN2H4完全燃烧需要助燃物N2O4的质量.详细 tigerrfh1年前3
tigerrfh1年前3 -
 lsr520134 共回答了16个问题
lsr520134 共回答了16个问题 |采纳率93.8%3.2kgN2H4恰好是0.1kmol,需要N2O4为0.05kmol,质量为4.6kg1年前查看全部
- 发射神州九号飞船时,使用的燃料是偏二甲肼,它和四氧化二氮反应的化学方程式为:2N2O4+R═3N2+2CO2+4H2O,
发射神州九号飞船时,使用的燃料是偏二甲肼,它和四氧化二氮反应的化学方程式为:2N2O4+R═3N2+2CO2+4H2O,则R的化学式是( )
A.C3H5O
B.C2H8N2
C.C2H8
D.C2H5N newminer1年前1
newminer1年前1 -
 Mr000Bean 共回答了22个问题
Mr000Bean 共回答了22个问题 |采纳率95.5%解题思路:由质量守恒定律:反应前后,原子种类、数目均不变,据此由反应的化学方程式推断反应物R的化学式.根据反应的化学方程式2N2O4+R═3N2+2CO2+4H2O,反应物中氮、氧原子个数分别为4、8,反应后的生成物中氮、氧、碳、氢原子个数分别为6、8、2、8,根据反应前后原子种类、数目不变,则每个R分子由2个碳原子、8个氢原子和2个氮原子构成,则物质R的化学式为C2H8N2.
故选B.点评:
本题考点: 质量守恒定律及其应用.
考点点评: 本题难度不大,利用化学反应前后元素守恒、原子守恒来确定物质的化学式是正确解题的关键.1年前查看全部
- 发射卫星的火箭用联氨(N 2 H 4 )作燃料,用四氧化二氮(N 2 O 4 )作助燃剂,反应的化学方程式为:2N 2
发射卫星的火箭用联氨(N 2 H 4 )作燃料,用四氧化二氮(N 2 O 4 )作助燃剂,反应的化学方程式为:2N 2 H 4 +N 2 O 4 =3N 2 +4X,生成物不污染空气.则X的化学式为( ) A.NO B.NO 2 C.H 2 O D.N 2 O  时间81751年前1
时间81751年前1 -
 zxm751024 共回答了22个问题
zxm751024 共回答了22个问题 |采纳率81.8%根据质量守恒定律,化学变化前后原子的种类不变、原子个数没有增减.从化学方程式2N 2 H 4 +N 2 O 4 =3N 2 +4X看,反应前反应物中氮、氢、氧元素的原子个数依次为:6、8、4;反应后生成物中除4X外,氮元素的原子个数为6.比较反应前后原子种类及个数可得知,4X中应含有8个氢原子、4个氧原子,所以X的化学式为H 2 O.
故选C.1年前查看全部
- 高中化学关于氮的氧化物的计算足量的铜与一定量的浓硝酸反应,得到硝酸铜溶液和二氧化氮、四氧化二氮、一氧化氮的混合气体,这些
高中化学关于氮的氧化物的计算
足量的铜与一定量的浓硝酸反应,得到硝酸铜溶液和二氧化氮、四氧化二氮、一氧化氮的混合气体,这些气体与1.68L(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸.若向所得硝酸铜溶液中加入5mol/L氢氧化钠溶液支铜离子恰好完全沉淀,求所消耗的氢氧化钠的体积.(由于无法打出部分的化学式,请见谅) 7c2l1年前2
7c2l1年前2 -
 bluesea_6199 共回答了21个问题
bluesea_6199 共回答了21个问题 |采纳率95.2%这些气体与1.68L(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸.-与1.68L 的什么啊 化学式呢?应该是O2吧,不然不行了.-总反应中被Cu还原的氮全部又被O2氧化了,故其转移的电子一致于是Cu的物质的量为O2的2倍 ,为2*22.4/1.68=80/3 mol由最后一个反应方程式可知道,每mol的Cu2+消耗2mol的NaOH所以NaOH有160/3 mol体积为 32/3 L1年前查看全部
- (3分)发射通讯卫星的火箭用联氨(N 2 H 4 )做燃料,用四氧化二氮(N 2 O 4 )助燃,生成物不会对大气造成污
(3分)发射通讯卫星的火箭用联氨(N 2 H 4 )做燃料,用四氧化二氮(N 2 O 4 )助燃,生成物不会对大气造成污染,其反应的化学方程式为:2N 2 H 4 + N 2 O 4 点燃 3N 2 + 4H 2 O,请计算12.8 g N 2 H 4 完全燃烧需要N 2 O 4 的质量。
 xiezeyu1年前1
xiezeyu1年前1 -
 宽容就会快乐 共回答了12个问题
宽容就会快乐 共回答了12个问题 |采纳率100%18.4g。
1年前查看全部
- 二氧化氮与四氧化二氮的转换 是二氧化氮与四氧化二氮的转换的方程式了
 浪花微微1年前2
浪花微微1年前2 -
 wanliang2003 共回答了15个问题
wanliang2003 共回答了15个问题 |采纳率93.3%2NO2==加压、或者升高温度==N2O4
N2O4==减压或者降低温度===2NO2
哎,我写的就是二氧化氮和四氧化二氮的转换
只不过在知道上我不知道怎么写成可逆的形式,而且将条件标在可逆符号的上面和下面,只有分开写了1年前查看全部
- 在100℃时,将0.200mol的四氧化二氮气体充入2L抽空的密闭容器中,每隔一定时间对该容器内的物质进行分析,得到如下
在100℃时,将0.200mol的四氧化二氮气体充入2L抽空的密闭容器中,每隔一定时间对该容器内的物质进行分析,得到如下表格:
试填空:时间 0 20 40 60 80 100 c(N2O4) 0.100 c1 0.050 c3 a b c(NO2) 0.000 0.060 c2 0.120 0.120 0.120
(1)该反应的化学方程式为______,达到平衡时四氧化二氮的转化率为______%.
(2)20s时四氧化二氮的浓度c1=______mol•L-1,在0~20s时间段内,四氧化二氮的平均反应速率为______mol•L-1•s-1.
(3)若在相同情况下最初向容器中充入的是二氧化氮气体,要达到上述同样的平衡状态,二氧化氮的初始浓度为______mol•L-1. 曾那么接近幸福1年前1
曾那么接近幸福1年前1 -
 whj0880 共回答了16个问题
whj0880 共回答了16个问题 |采纳率93.8%解题思路:(1)由表可知,60s时反应达平衡,根据方程式计算△c(N2O4),根据转化率计算平衡时N2O4的转化率;60s后反应达平衡,反应混合物各组分的浓度不变.
(2)由△c(NO2),根据方程式计算△c(N2O4),20s的四氧化二氮的浓度=起始浓度-△c(N2O4);根据v=[△c/△t]计算v(N2O4).
(3)恒温恒容条件下,且反应前后气体的物质的量发生变化,起始向容器中充入的是二氧化氮气体,要达到相同的平衡状态,按化学计量数转化到N2O4一边,满足N2O4的浓度为0.1mol/L.(1)由表可知,60s时反应达平衡,c(NO2)=0.120mol/L,
N2O4⇌2 NO2,
浓度变化:0.06mol/L 0.120mol/L
所以平衡时N2O4的转化率为[0.06mol/L/0.1mol/L]×100%=60%;
故答案为:60;
(2)由表可知,20s时,c(NO2 )=0.060mol/L,所以
N2O4⇌2 NO2,
浓度变化:0.03mol/L 0.060mol/L
所以20s的四氧化二氮的浓度c1=0.1mol/L-0.03mol/L=0.070mol/L;
在0s~20s内四氧化二氮的平均反应速率为v(N2O4)=[0.03mol/L/20S]=0.0015mol•(L•s)-1.
故答案为:0.070mol/L;0.0015mol•(L•s)-1;
(3)恒温恒容条件下,且反应前后气体的物质的量发生变化,起始向容器中充入的是二氧化氮气体,要达到相同的平衡状态,按化学计量数转化到N2O4一边,满足N2O4的浓度为0.1mol/L,由N2O4(g)⇌2 NO2(g)可知,二氧化氮的初始浓度=2×0.1mol/L=0.2mol/L,
故答案为:0.2.点评:
本题考点: 化学平衡的计算;反应速率的定量表示方法.
考点点评: 本题考查化学反应速率、化学平衡常数、化学平衡的有关计算、等效平衡等,难度中等,注意基础知识的积累掌握.1年前查看全部
- 二氧化氮和四氧化二氮混合气体的平均相对分子质量是不是就是二氧化氮的相对分子质量?
 newlpwh1年前1
newlpwh1年前1 -
 lijinand 共回答了18个问题
lijinand 共回答了18个问题 |采纳率94.4%当然不是啊.
平均相对分子质量常用于混合气体.平均相对分子质量相当于把混合物看作一个“单一组分”,这一“单一组分”的相对分子质量就是平均相对分子质量.
其计算总式为M(平均)=m总/n总.在总式下它有三种计算方法:
(1)根据混合物中各组分在混合物中所占的份额多少来衡量它们对相对分子质量的贡献来计算.所占份额以各组分在混合物中所占的物质的量分数(对气体而言,也就等于体积分数)来计算,其数学表达式为:
设某混合物组分分别为A、B、C……,它们的相对分子质量依次为MA、MB、MC……,它们在混合物中所占的物质的量分数分别为xA、xB、xC……,则此混合物的平均相对分子质量为:MA*xA+MB*xB+MC*xC……
(2)根据摩尔质量的概念来确定
平均相对摩尔质量就数值上就等于1mol物质的质量
m总和n总分别为混合物的总质量和总的物质的量
(3)根据密度计算
①在标准状况下, 22.4*密度
②根据相对密度计算:设混合气体对某气体(相对分子质量为M)的相对密度为d,则混合气体的平均相对分子质量为:M(平均)=Md (推导过程:d=P1/P2=M1/M2)1年前查看全部
- 在100℃时,将0.200mol的四氧化二氮气体充入2L抽空的密闭容器中,每隔一定时间对该容器内的物质进行分析,得到如下
在100℃时,将0.200mol的四氧化二氮气体充入2L抽空的密闭容器中,每隔一定时间对该容器内的物质进行分析,得到如下表格:
试填空:时间 0 20 40 60 80 100 c(N2O4) 0.100 c1 0.050 c3 a b c(NO2) 0.000 0.060 c2 0.120 0.120 0.120
(1)该反应的化学方程式为______,达到平衡时四氧化二氮的转化率为______,该温度时,平衡常数值为______.
(2)80s时四氧化二氮的浓度a=______,在0~20s时间段内,四氧化二氮的平均反应速率为______.
(3)若在相同情况下最初向容器中充入的是二氧化氮气体,要达到上述同样的平衡状态,二氧化氮的初始浓度为______. 假冒黑客1年前1
假冒黑客1年前1 -
 13825421314 共回答了17个问题
13825421314 共回答了17个问题 |采纳率76.5%解题思路:(1)由表可知,60s时反应达平衡,利用三段式计算各组分的浓度变化量、平衡浓度,转化率=浓度变化量÷起始浓度,据此计算四氧化二氮的转化率,平衡常数k=c2(NO2)c(N2O4);(2)80s时处于平衡状态,根据(1)计算可知a的值;根据浓度变化量之比等于化学计量数之比计算△c(N2O4),再根据v=△c△t计算v(N2O4);(3)恒温恒容条件下,且反应前后气体的物质的量发生变化,起始向容器中充入的是二氧化氮气体,要达到相同的平衡状态,按化学计量数转化到N2O4一边,满足N2O4的浓度为0.1mol/L.(1)反应的化学方程式为:N2O4⇌2NO2,
由表可知,60s时反应达平衡,平衡时c(NO2)=0.120mol/L,N2O4的起始度为0.1mol/L,则:
N2O4(g)⇌2NO2(g)
起始(mol/L):0.1 0
变化(mol/L):0.06 0.12
平衡(mol/L):0.04 0.12
所以平衡时N2O4的转化率=[0.06mol/L/0.1mol/L]×100%=60%,
平衡常数K=
c2(NO2)
c(N2O4)=
0.122
0.04=0.36,
故答案为:N2O4⇌2NO2;60%;0.36;
(2)80s时处于平衡状态,根据(1)计算可知a=0.04;
由表中数据可知,20s时c(NO2 )=0.06mol/L,浓度变化量之比等于化学计量数之比,所以,在0~20s时间段内,△c(N2O4)=[1/2]×0.06mol/L=0.03mol/L,故v(N2O4)=[0.03mol/L/20s]=0.0015mol/(L•s),
故答案为:0.04;0.0015mol/(L•s);
(3)恒温恒容条件下,且反应前后气体的物质的量发生变化,起始向容器中充入的是二氧化氮气体,要达到相同的平衡状态,按化学计量数转化到N2O4一边,满足N2O4的浓度为0.1mol/L,由N2O4(g)⇌2 NO2(g)可知,二氧化氮的初始浓度=2×0.1mol/L=0.2mol/L,
故答案为:0.2mol/L.点评:
本题考点: 化学平衡建立的过程;化学平衡的计算.
考点点评: 本题考查化学反应速率、化学平衡常数、化学平衡的有关计算、等效平衡等,难度中等,注意基础知识的积累掌握.1年前查看全部
- 假设2个二氧化氮 生成一个四氧化二氮 ,那么这个是放热反应,那么这个放热表现在哪里?是 反应物的动能增加 还是生成物的
假设2个二氧化氮 生成一个四氧化二氮 ,那么这个是放热反应,那么这个放热表现在哪里?是 反应物的动能增加 还是生成物的 动能增加呢(温度的实际是分子的动能的表现)?小弟 在此 谢过了 大哥帮小弟解答下啊
请问下 禾呈月月鸟 :那么 还没反应的反应物 他的平均分子动能不会增加吗 cjf20061231年前3
cjf20061231年前3 -
 ai2r0kcc 共回答了14个问题
ai2r0kcc 共回答了14个问题 |采纳率92.9%化学反应过程中 化学键的断裂和重组 释放出能量
这些能量转化为 生成物的平均分子动能 也就是温度升高了
严格来说 热量是自动的向四周辐射 还没反应的反应物的确也会升温1年前查看全部
- 偏二甲肼与四氧化二氮反应生成氮气,为什么会污染空气?
 marry8881年前2
marry8881年前2 -
 yuan8888 共回答了23个问题
yuan8888 共回答了23个问题 |采纳率87%充分燃烧的产物不会污染空气.但不完金燃烧产坐的一氧化碳及剩余的燃料或氧化剂都是大气污染物.其中N2O4会部分分解为NO2.NO2等氮氧化物在紫外线的作用下能强烈地破坏臭氧层,威力不下于氟氯代烷.1年前查看全部
- 四氧化二氮的自偶电离为什么四氧化二氮的电离不是生成硝酰正离子和亚硝酸根而是生成硝酸根和亚硝酰正离子和硝酸根?好像它们的稳
四氧化二氮的自偶电离
为什么四氧化二氮的电离不是生成硝酰正离子和亚硝酸根而是生成硝酸根和亚硝酰正离子和硝酸根?好像它们的稳定性是差不多的,亚硝酸根的稳定性在没有酸的时候比硝酸根还要稳定(从派键和硝酸盐的热分解可以看出)那为什么主要生成的是硝酸根和亚硝酰正离子?而且好像二氧化氮的二聚就是应为不成对电子的原因么?在聚合形成的键的地方异裂不是更容易么? Scorpius1年前1
Scorpius1年前1 -
 zhouhongfui 共回答了22个问题
zhouhongfui 共回答了22个问题 |采纳率90.9%这个问题问得很好.
为什么:液态N2O4 ---> NO+ + NO3-; 而不是两个NO2,或NO2+ + NO2-?
想一想再回答.1年前查看全部
- 什么情况下二氧化氮转化为四氧化二氮,做题时什么时候考虑这个问题呢?快指教啊,谢谢啦
 yuenver1年前3
yuenver1年前3 -
 恐龙爱谁 共回答了20个问题
恐龙爱谁 共回答了20个问题 |采纳率80%这个我们化学老师说过 在坐选择的时候涉及到压强 平衡问题的时候都要考虑 比如说46g二氧化氮含1mol分子 这个就是错的 就是选择中一般都是考虑的 但填空题中有提示的比如说填大于,小于号的考虑这个变换 平衡问题中考虑
在简单计算中 比如求反应生成二氧化氮的量这个就可以不考虑 在试验题的折算中不考虑
在比较正规的卷子二卷中这个都有比较明显的暗示仔细看题目就不难发现是不是考虑这些 对于一卷中的题目几乎都考虑的 尤其对是关于物质的量的题目
总之见到关于二氧化氮的题目 往这样方面想想 是否考虑两种情况带入检验一下 保证万无一失 以后这种题写得多了感觉出来自然就知道了1年前查看全部
- 二氧化氮转化成四氧化二氮增大二氧化氮浓度平衡怎样移动,二氧化氮的浓度增大·
 淡定9511年前3
淡定9511年前3 -
 爱你19nn15 共回答了14个问题
爱你19nn15 共回答了14个问题 |采纳率92.9%右移1年前查看全部
- 镁和浓硝酸 反应方程式是什么 配平 好像有四氧化二氮生成
 A200126931年前1
A200126931年前1 -
 4125086631 共回答了23个问题
4125086631 共回答了23个问题 |采纳率78.3%仿照Cu的就像1 4 1 2 2;mg+4HNO3(浓)=Mg(NO3)2+2NO2+2H2O;至于N2O4,是NO2自身转变的:2NO2=N2O4在任何情况下都发生,只不过平衡常数不同(反应程度不同).以上两个方程式可以用任意比相加,就得到你题目的答案1年前查看全部
- 平衡移动在二氧化氮与四氧化二氮的转换实验中保持温度与体积不变,加入四氧化二氮平衡如何移动
 Peleus1年前1
Peleus1年前1 -
 小白小白小白小白 共回答了19个问题
小白小白小白小白 共回答了19个问题 |采纳率94.7%向左(即生成二氧化氮的方向)1年前查看全部
- 偏二甲基肼与四氧化二氮反应方程式
偏二甲基肼与四氧化二氮反应方程式
如上,谁知道 cherryhe_0981年前2
cherryhe_0981年前2 -
 cxksdfoiuasdfpoi 共回答了13个问题
cxksdfoiuasdfpoi 共回答了13个问题 |采纳率92.3%(CH3)2NNH2+N2O4=(CH3)2NNHNO+HNO31年前查看全部
- 二氧化氮转化为四氧化二氮的反应具体是怎么回事?
 香辣猪舌1年前2
香辣猪舌1年前2 -
 落雪飞猪 共回答了19个问题
落雪飞猪 共回答了19个问题 |采纳率89.5%2NO2=N2O4(符号误,因为是可逆反应)
在常温下就能发生的可逆反应,若升高温度,平衡向二氧化氮合成的方向移动;降低温度,平衡向四氧化二氮合成的方向移动.1年前查看全部
- 二氧化氮可逆生成四氧化二氮密闭加热,平衡如何移动?
二氧化氮可逆生成四氧化二氮密闭加热,平衡如何移动?
2NO2=可逆=N2O4
正反应放热,加热逆移
逆移压强增大,反应正移? 去年烟火没落时1年前2
去年烟火没落时1年前2 -
 chen300498 共回答了13个问题
chen300498 共回答了13个问题 |采纳率100%这里加热是根本变化,而压强跟平衡都是被动变化的.所以反应会逆向移动;只不过到达一定程度时压强与温度产生的影响会抵消,这就到了一个新的平衡.1年前查看全部
- FeS与一定浓度的HNO3反应,生成硝酸铁 硫酸铁 二氧化氮 四氧化二氮 一氧化氮和水,当二氧化氮 四氧化二氮 的物质的
FeS与一定浓度的HNO3反应,生成硝酸铁 硫酸铁 二氧化氮 四氧化二氮 一氧化氮和水,当二氧化氮 四氧化二氮 的物质的量之比为1比1比1时,实际参加反应的FeS与HNO3的物质的量之比为?
 jhf23164541年前1
jhf23164541年前1 -
 c_ailj 共回答了14个问题
c_ailj 共回答了14个问题 |采纳率92.9%说明:当生成的二氧化氮、四氧化二氮、一氧化氮的物质的量之比为1:1:1时,化合价的变化和为6(降低),当1摩尔的FeS生成硝酸铁,硫酸铁时化合价的变化为:铁升1,硫升8,即总升9,所以参加氧化还原的FeS与HNO3的物质的量之比为1:6.但是生成物中还有硝酸铁生成,因而有一部分硝酸起了酸性介质作用,通过元素守恒可得方程式中FeS与HNO3的比列为6:42,即1:7.1年前查看全部
- 火箭常用偏二甲肼(C2H8N2)、液态氢等作为燃料,而用液态氧、四氧化二氮(N2O4)等作助燃剂.下列有关偏二甲肼的说法
火箭常用偏二甲肼(C2H8N2)、液态氢等作为燃料,而用液态氧、四氧化二氮(N2O4)等作助燃剂.下列有关偏二甲肼的说法不正确的是( )
A.偏二甲肼的相对分子质量是60
B.一个偏二甲肼分子是由2个碳原子、8个氢原子和2个氮原子构成的
C.偏二甲肼中碳、氢、氮三种元素的质量比为2:8:2
D.偏二甲肼中碳元素的质量分数为40% weistudio1年前0
weistudio1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 四氧化二氮,二氧化氮,氧气,臭氧,烯烃,一氧化氮,在标准状况下的状态是什么
 海中1年前2
海中1年前2 -
 cqpipilu 共回答了17个问题
cqpipilu 共回答了17个问题 |采纳率88.2%四氧化二氮在标准状况下的状态是液体
二氧化氮在标准状况下的状态是气体
氧气在标准状况下的状态是气体
臭氧在标准状况下的状态是气体
烯烃(小分子烯烃例如乙烯在标准状况下的状态是气体,大的烯烃在标准状况下的状态可能是液体饿固体)
一氧化氮在标准状况下的状态是气体1年前查看全部
- 46克二氧化氮和46克四氧化二氮含有的原子数均为3NA,怎么算的
 yangsir20001年前2
yangsir20001年前2 -
 晕鱼 共回答了18个问题
晕鱼 共回答了18个问题 |采纳率94.4%二氧化氮NO2,摩尔质量为46,四氧化二氮N2O4,摩尔质量为92.46克的NO2摩尔量是N2O4的2倍,但是N2O4的原子数是NO2的2倍,所以它们原子数相等.1年前查看全部
- 四氧化二氮与二氧化氮如何转化
 在有人我1年前3
在有人我1年前3 -
 wuxianwang 共回答了33个问题
wuxianwang 共回答了33个问题 |采纳率81.8%这是一个化学平衡 2 NO2(g) ==可逆== N2O4(l),△H < 0
这是体积减小的放热反应,高压、低温,有利于平衡右移,即有利于生成N2O4,低压、高温,有利于平衡左移,即有利于生成NO2.1年前查看全部
- 发射“嫦娥一号”的火箭用偏二甲肼(C2H8N2)和四氧化二氮(N2O4)作常规推进剂,其完全反应的化学方程式:C2H8N
发射“嫦娥一号”的火箭用偏二甲肼(C2H8N2)和四氧化二氮(N2O4)作常规推进剂,其完全反应的化学方程式:C2H8N2+2N2O4═3X+2CO2+4H2O,则X的化学式为( )
A.N2
B.H2
C.O2
D.CO 玄海小师父1年前1
玄海小师父1年前1 -
 灰猫仕 共回答了19个问题
灰猫仕 共回答了19个问题 |采纳率94.7%解题思路:根据质量守恒定律的微观解释:化学反应前后原子的种类和数目不变.可知在化学反应方程式中,反应物和生成物中所含的原子的种类和数目相同.由此可推断化学反应方程式中反应物或生成物的化学式.在化学反应前后除X外,其他各原子相差的个数分别是:C:2-2=0,H:8-4×2=0,N:2+2×2-0=6,O:2×4-2×2-4×1=0,所以3个X分子中共含有6个N原子,每个X分子中含有2个N原子,即X的化学式为N2.
故选:A.点评:
本题考点: 有关化学式的计算和推断;质量守恒定律及其应用.
考点点评: 利用质量守恒定律推断化学方程式中未知的化学式,是常见的有关化学式的计算题,根据质量守恒定律,化学反应前后原子的种类和数目不变,即可推断出化学式.1年前查看全部
- 一定质量二氧化氮 四氧化二氮原的混合物中原子个数是一定的吗
 百分百131年前1
百分百131年前1 -
 落满星辰的夏夜 共回答了21个问题
落满星辰的夏夜 共回答了21个问题 |采纳率90.5%是,但是分子数不是一定的.因为一个四氧化二氮到两个二氧化氮的反应是可逆的,跟据外部条件的变化平衡移动.1年前查看全部
- 二氧化氮——四氧化二氮的可逆反应中,保持体积不变,加入少许二氧化氮,正逆反应速率将如何变化
 hyyuan_1231年前1
hyyuan_1231年前1 -
 苏丰 共回答了17个问题
苏丰 共回答了17个问题 |采纳率88.2%2NO2==可逆==N2O4
保持体积不变,加入少许二氧化氮,压强变大,二氧化氮浓度增大,正逆反应速率都将增大.(这里要区别反应速率和化学平衡)1年前查看全部
- 取x克铜镁合金完全溶于浓硝酸中,反应过程中硝酸被还原只产生8960ml的二氧化氮和672ml的四氧化二氮(标况),在反应
取x克铜镁合金完全溶于浓硝酸中,反应过程中硝酸被还原只产生8960ml的二氧化氮和672ml的四氧化二氮(标况),在反应后的溶液中加足量的氢氧化钠溶液,生成的沉淀质量为17.02克.则x为?
 ihjhny1年前2
ihjhny1年前2 -
 weitesi 共回答了18个问题
weitesi 共回答了18个问题 |采纳率94.4%先折成二氧化氮0.46摩 每个二氧化氮得1个电子 共得0.46摩电子.故金属失去0.46摩电子.
而铜镁每失一个电子,加氢氧化钠后就上一个氢氧根,故沉淀中有0.46摩氢氧根
总质量减去氢氧根的质量可得金属质量
17.02-0.46*17=9.2 克
或者设m摩铜 n摩镁 根据电子守恒和沉淀质量列方程组1年前查看全部
- 发射“嫦娥二号”的长征火箭由三个子级构成。其中一子级上部装有液体四氧化二氮(N 2 O 4 ),下部装有液体偏二甲肼(C
发射“嫦娥二号”的长征火箭由三个子级构成。其中一子级上部装有液体四氧化二氮(N 2 O 4 ),下部装有液体偏二甲肼(C 2 H 8 N 2 )高能燃料。发动机内燃烧的化学方程式为:C 2 H 8 N 2 +2N 2 O 4 =3N 2 ↑+2CO 2 ↑+4H 2 O↑,该反应中
A.C 2 H 8 N 2 发生还原反应 B.C 2 H 8 N 2 是氧化剂 C.N 2 O 4 发生氧化反应 D.N 2 O 4 是氧化剂  zjxfyhj1年前1
zjxfyhj1年前1 -
 shenjdaoke 共回答了26个问题
shenjdaoke 共回答了26个问题 |采纳率92.3%D
1年前查看全部
- 在100℃时,将0.100mol的四氧化二氮气体充入1L抽空的密闭容器中.隔一定时间对该容器内的物质浓度进行分析得到如下
在100℃时,将0.100mol的四氧化二氮气体充入1L抽空的密闭容器中.隔一定时间对该容器内的物质浓度进行分析得到如下表数据:
时间(S) 0 20 40 60 80
c(N2O4)/mol/L 0.100 a 0.050 c d
c(NO2)/mol/L 0.000 0.06 b 0.120 0.120
(1).20s时N2o4浓度a=( ) ;在0-20s内N2O4的平均反应速率为( );
表中b()c()d (填>.<.= )
(2.)该反应到达平衡时N2O4的转化率为( ) 平衡时容器内压强与开始时压强之比是() 衔杯袒腹1年前2
衔杯袒腹1年前2 -
 ay2137 共回答了23个问题
ay2137 共回答了23个问题 |采纳率82.6%一个N2O4可逆变成两个NO2,20S时产生NO2 0.06mol/l,
因此消耗N2O4 0.03mol/l.还剩0.07mol/l.即a=0.07,同理b=0.1,c=d=0.04.
然后根据各个问的定义进行计算即可.1年前查看全部
- 二氧化氮生成四氧化二氮是放热还是吸热,方程式?
 海底烟花1年前1
海底烟花1年前1 -
 可怜的大西瓜 共回答了15个问题
可怜的大西瓜 共回答了15个问题 |采纳率80%2NO2==可逆==N2O4
加热向左进行,是放热反应1年前查看全部
- 二氧化氮变成四氧化二氮的反应是不是化合反应?
二氧化氮变成四氧化二氮的反应是不是化合反应?
是否是化合反应?
但是我们老师说有两个NO2 abcdeabc1年前1
abcdeabc1年前1 -
 phar 共回答了17个问题
phar 共回答了17个问题 |采纳率88.2%不是,两种或两种以上的物质生成一种新物质才是化合反应.1年前查看全部
- 在80℃时,将0.20mol的四氧化二氮气体充入1L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得
在80℃时,将0.20mol的四氧化二氮气体充入1L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
根据本题内容和表格中提供的数据填空(C1、C2、C3、A、B表示相应的浓度)请回答下列各小题:时间(s)
浓度(mol•L-1)0 20 40 60 80 100 c(N2O4) 0.20 C1 0.10 C3 A B c(NO2) 0.00 0.12 C2 0.22 0.22 0.22
(1)该反应的化学方程式为______;达到平衡时四氧化二氮的转化率为______%,表中C2______C3______A(填“<”、“>”=)
(2)20s时,四氧化二氮的浓度C1=______mol•L-1,在0s~20s内四氧化二氮的平均反应速率为______. 马申亚1年前1
马申亚1年前1 -
 blackcomet_711 共回答了18个问题
blackcomet_711 共回答了18个问题 |采纳率100%解题思路:(1)依据图表数据分析,反应物和生成物分析判断;由表可知,60s时反应达平衡,根据方程式计算△c(N2O4),根据转化率计算平衡时N2O4的转化率;60s后反应达平衡,反应混合物各组分的浓度不变;
(2)化学平衡的三段式列式计算,结合化学反应速率概念计算0~20s内N2O4的平均反应速率.(1)由表可知,60s时反应达平衡,c(NO2)=0.22mol/L,反应的N2O4浓度为0.11mol/L,反应的化学方程式为:N2O4⇌2 NO2,
N2O4⇌2 NO2,
浓度变化:0.11mol/L 0.22mol/L
所以平衡时N2O4的转化率为[0.11mol/L/0.20mol/L]×100%=55%;
60s后反应达平衡,反应混合物各组分的浓度不变,所以C3=A=B=0.20mol/L-0.11mol/L=0.09mol,40s时:
N2O4⇌2 NO2,
0.2mol/L 0
0.1mol/L 0.2mol/L
0.1mol/L C2=0.2mol/L
C2=0.2mol/L>C3=A=B=0.09mol/L;
故答案为:N2O4⇌2NO2;55%;>;=;
(2)进行到20s;
N2O4 ⇌2NO2
起始量(mol/L) 0.20 0
变化量(mol/L) 0.06 0.12
20S末(mol/L) 0.14 0.12
20s时,N2O4的浓度=C1=0.14mol/L;
0~20s内N2O4的平均反应速率=[0.06mol/L/20s]=0.003mol/(L•s),
故答案为:0.14;0.003mol/(L•s).点评:
本题考点: 化学平衡建立的过程;化学平衡的计算.
考点点评: 本题考查了化学反应速率的计算、化学平衡常数的含义等知识点,注意化学平衡常数只与温度有关,与物质的浓度无关.1年前查看全部
- 发射卫星的火箭用联氨(N2H4)作燃料,以四氧化二氮作氧化剂,燃烧尾气由氮气与水蒸气组成.该反应的化学方程式为2N2H4
发射卫星的火箭用联氨(N2H4)作燃料,以四氧化二氮作氧化剂,燃烧尾气由氮气与水蒸气组成.该反应的化学方程式为2N2H4+N2O4
3N2+4H2O点燃 .2N2H4+N2O4.
3N2+4H2O点燃 . shangxinzhidi1年前1
shangxinzhidi1年前1 -
 品尝qq 共回答了11个问题
品尝qq 共回答了11个问题 |采纳率90.9%解题思路:根据题意,发射卫星的火箭用联氨(N2H4)作燃料,以四氧化二氮作氧化剂,燃烧尾气由氮气与水蒸气组成,写出反应的化学方程式即可.联氨(N2H4)作燃料,以四氧化二氮作氧化剂,燃烧尾气由氮气与水蒸气组成,反应的化学方程式为:2N2H4+N2O4
点燃
.
3N2+4H2O.
故答案为:2N2H4+N2O4
点燃
.
3N2+4H2O.点评:
本题考点: 书写化学方程式、文字表达式、电离方程式.
考点点评: 本题难度不大,考查学生根据反应原理书写化学方程式的能力,化学方程式书写经常出现的错误有不符合客观事实、不遵守质量守恒定律、不写条件、不标符号等.1年前查看全部
- 46克二氧化氮与四氧化二氮混合气体中含有原子数这种问题怎么解决?
 巫山不是云15081年前4
巫山不是云15081年前4 -
 落叶83 共回答了19个问题
落叶83 共回答了19个问题 |采纳率89.5%象NO2与N2O4这类原子个数比[成比例的],计算起来是非常方便的,根本不用考虑它们之间的差异,直接按46克NO2来计算和直接按46克N2O4来计算,结果全同,都是3NA个原子.1年前查看全部
大家在问
- 1(1)下列说法正确的是______
- 2Full Bust:Waist:Hips:Length-shoulder Length-head to
- 3英语综合填词,急The next time that you hear a baby cry ,listen c___
- 4行万里路我做不到读万卷书便是我唯一的消遣这句话运用了什么修辞手法
- 5The blue is ( )(he),not ( )(I).
- 6夏天的阳光就像_____.
- 7一个数四舍五入省略万位后面尾数之后是5万,这数省略之前最大是多少最小是多少
- 8(—2)2007+(—2)2008=?注:2007和2008是指数.请各位大哥大姐帮帮忙,
- 9为节约能源,某物业公司按以下规定收取每月电费:用电不超过140度,按每度0.43元收费;如果超过140度,超过部分按每度
- 10谢谢您,老师 作文
- 11这就是我幸福的家庭 用英语怎么说
- 12父亲节,小芳送给爸爸一份生日礼物,如图:
- 13落落 翻译成英文读什么 知道的说下
- 14“在火车上我们可以随意坐吗”英语怎么译
- 15平行四边形的底是2分米,高是底的1.2倍.他的面积是多少平方厘米
