用Cu电极作阴极,C电极作阳极电解CuSO4水溶液,请写出电极反应式及总反应式
 jackylujie2022-10-04 11:39:541条回答
jackylujie2022-10-04 11:39:541条回答
用Cu电极作阴极,C电极作阳极电解CuSO4水溶液,请写出电极反应式及总反应式
阴极:阳极:总反应式:
阴极:阳极:总反应式:

已提交,审核后显示!提交回复
共1条回复
 hkkd 共回答了13个问题
hkkd 共回答了13个问题 |采纳率76.9%- 阴极:Cu2+ +2e- =Cu
阳极:2H2O-4e- =4H+ +O2 (或 4OH- -4e- =O2 + 2H2O)
总反应式:2Cu2+ +2H2O =电解= 2Cu +4H+ +O2 - 1年前
相关推荐
- 用Cu电极电解CuSO4溶液时,溶液的pH为什么是不变的,不是生成酸的.
 107724191年前4
107724191年前4 -
 luckyduck222 共回答了21个问题
luckyduck222 共回答了21个问题 |采纳率95.2%Cu作电极.则阳极反应为:Cu-2e-=Cu2+.阴极为:Cu2++2e-=Cu.可以看出,电解质溶液中Cu2+的浓度并未发生改变,也未发生如你所说的酸生成的反应.所以溶液的pH是不变的.1年前查看全部
- 用如图装置进行实验(A为电流计),观察到现象:装置图1:Cu电极上产生大量的无色气泡;装置图2:Cu电极上无气泡产生,而
用如图装置进行实验(A为电流计),观察到现象:装置图1:Cu电极上产生大量的无色气泡;装置图2:Cu电极上无气泡产生,而Cr电极上产生大量气泡,则下列说法正确的是( )

A.图1是电解池,图2是原电池
B.两个电池中,电子均由Cr电极流向Cu电极
C.图2中Cr电极可能被浓HNO3钝化成惰性电极
D.由实验现象可知金属活动性:Cu>Cr dongwei10011年前1
dongwei10011年前1 -
 骑墙盼性 共回答了18个问题
骑墙盼性 共回答了18个问题 |采纳率83.3%解题思路:观察到图1装置铜电极上产生大量的无色气泡,说明图1中,Cr为负极,铜为正极,正极上析出氢气,而图2装置中铜电极上无气体产生,铬电极上产生大量气体,说明铜被氧化应为负极,正极上应是硝酸被还原生成二氧化氮气体,以此解答该题.A.图1与图2中均没有外加电源,所以均为原电池装置,故A错误;
B.图1中Cr为负极,铜为正极,电子由Cr经导线流向Cu,图2中Cr为正极,Cu为负极,电子由Cu极经导线流向Cr,故B错误;
C.图2中Cr电极被浓HNO3钝化成惰性电极作正极,Cu失电子作负极,故C正确;
D.由图1根据原电池原理知金属铬的活动性比铜强,故D错误.
故选C.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题综合考查原电池知识,侧重于学生的分析能力的考查,注意把握原电池的工作原理,答题时注意体会原电池电极的判断方法,难度中等.1年前查看全部
- 如图所示,通电一段时间后,Cu电极增重2.16 g,同时在A池中收集到标准状况下的气体224 mL,设A池中原混合液的体
如图所示,通电一段时间后,Cu电极增重2.16 g,同时在A池中收集到标准状况下的气体224 mL,设A池中原混合液的体积为100 mL,则通电前A池中原混合溶液Cu 2 + 的浓度为
A.0.05 mol/L B.0.035 mol/L C.0.025 mol/L D.0.020 mol/L  fengyin9t1年前1
fengyin9t1年前1 -
 谁说都有理 共回答了21个问题
谁说都有理 共回答了21个问题 |采纳率95.2%1年前查看全部
- (2013•重庆模拟)如图所示,通电一段时间后,Cu电极增重2.16g,同时在A池中收集到标准状况下的气体224mL,设
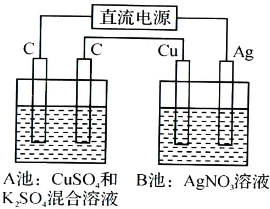 (2013•重庆模拟)如图所示,通电一段时间后,Cu电极增重2.16g,同时在A池中收集到标准状况下的气体224mL,设A池中原混合液的体积为100mL,则通电前A池中原混合溶液Cu2+的浓度为( )
(2013•重庆模拟)如图所示,通电一段时间后,Cu电极增重2.16g,同时在A池中收集到标准状况下的气体224mL,设A池中原混合液的体积为100mL,则通电前A池中原混合溶液Cu2+的浓度为( )
A.0.05mol•L-1
B.0.035mol•L-1
C.0.025mol•L-1
D.0.020mol•L-1 ss尼熊1年前1
ss尼熊1年前1 -
 sunshineboy_ty 共回答了13个问题
sunshineboy_ty 共回答了13个问题 |采纳率92.3%解题思路:由图可知,B装置为电解池,Cu极增重2.16g,发生Ag++e-═Ag,则Cu为阴极,Ag为阳极,A装置中阳极发生4OH--4e-═O2↑+2H2O,阴极发生Cu2++2e-═Cu、2H++2e-═H2↑,以此来解答.由图可知,B装置为电解池,铜电极增重2.16g,发生Ag++e-═Ag,n(Ag)=0.02mol,则转移电子为0.02mol,A池中收集到标准状况下的气体224mL,所以气体的物质的量为[0.224L/22.4L/mol]=0.01mol,
A装置中阳极发生4OH--4e-═O2↑+2H2O,转移0.02mol电子生成气体为0.005mol,
所以2H++2e-═H2↑,
0.01 0.005
Cu2++2e-═Cu
0.005 0.01
即Cu2+的物质的量为[0.02−0.005×2/2]mol=0.005mol,
c(Cu2+)=[0.005mol/0.1L]=0.05mol/L,
故答案为:0.05mol/L;
故选:A.点评:
本题考点: 电解原理.
考点点评: 本题考查了电解原理,明确A中阴极上生成物是解本题关键,结合转移电子守恒进行解答,难度中等.1年前查看全部
- 在标准Cu电极和标准Zn电极组成的原电池中,如想使电动势增加,则采取
在标准Cu电极和标准Zn电极组成的原电池中,如想使电动势增加,则采取
A.增大Zn2+浓度
B.减小Cu2+浓度
C.向Cu2+溶液中加氨水
D.向Zn2+溶液中加氨水 flatvhl1年前2
flatvhl1年前2 -
 lylong_0516 共回答了26个问题
lylong_0516 共回答了26个问题 |采纳率100%答案是D.
减小氧化产物的浓度或者增加氧化剂浓度都能提高电动势.
氨水能使Zn^2+形成络离子,从而使Zn^2+浓度降低.1年前查看全部
- 原电池电解质溶液为稀HNO3时,Fe和Cu电极分别是什么极?
 太过现实1年前3
太过现实1年前3 -
 任爱展翅 共回答了19个问题
任爱展翅 共回答了19个问题 |采纳率100%铁为阴极(负极)铜为正极(阳极)
电极反应式:阴极Fe===Fe2++2e 阳极:NO3-+4H++3e===NO↑+2H2O 电极总反应:3Fe+2NO3+8H+===3Fe2++2NO↑+4H2O
Fe(II)-(0) Fe2++2e-=Fe -0.447
Fe(III)-(II) Fe3++e-=Fe2+ 0.771
Cu(II)-(0) Cu2++2e-=Cu 0.3419
因为还原反应是在阳极发生的(NO3-+4H++3e===NO↑+2H2O),也就是说,阴极释放的电子能量要大于阳极(金属铜)能释放的电子的能量,这样才能做到阴极电势大于阳极.所以,金属铁只被氧化为二价铁.1年前查看全部
- Cu电极 电解一定量饱和硫酸钠溶液 一段时间后 阴极放出Amol气体并析出b克十水合硫酸钠 求剩余溶液溶质的?
Cu电极 电解一定量饱和硫酸钠溶液 一段时间后 阴极放出Amol气体并析出b克十水合硫酸钠 求剩余溶液溶质的?
质量分数 xtee19811年前1
xtee19811年前1 -
 kyue 共回答了16个问题
kyue 共回答了16个问题 |采纳率93.8%电解Na2SO4溶液就是电解水.
阳极生成O2 Amol
2H2O =通电= 2H2↑ + O2↑
所以被电解的水的物质的量 = 2A mol
原溶液饱和,电解2A mol H2O后析出b克十水合硫酸钠,说明b克十水合硫酸钠 溶于2A mol H2O即36A g H2O恰好形成饱和溶液.
b克十水合硫酸钠中m(Na2SO4) = b/322 * 142 = 71b/161 g
b克十水合硫酸钠中m(H2O) = 90b/161 g
所以71b/161 g Na2SO4溶于(90b/161 + 36A) g 水中恰好形成饱和溶液
所以剩余溶液溶质的质量分数 = (71b/161) /(b + 36A)1年前查看全部
- 原电池中Cu电极为什么能在酸性溶液作电解液条件下发生吸氧腐蚀?(原电池中另一电极为石墨)
 小青龙20001年前1
小青龙20001年前1 -
 捻月为盟 共回答了18个问题
捻月为盟 共回答了18个问题 |采纳率94.4%一般认为,pH>4.3发生吸氧腐蚀,酸性溶液较弱时,发生吸氧腐蚀是可能的1年前查看全部
- 用pt电极电解CUSO4溶液和用CU电极电解CUSO4溶液的电极方程式有什么不同呢?
 hzww20001年前3
hzww20001年前3 -
 trireoiwoir 共回答了18个问题
trireoiwoir 共回答了18个问题 |采纳率100%pt电极:阳极反应式:2H2O-4 e- =O2+4H+
Cu电极:阳极反应式:Cu-2 e- =Cu2+
阴极反应式相同:Cu2+ + 2e- =Cu1年前查看全部
大家在问
- 1一篇英语作文.急假定你是李华,收到笔友Tom的来信.Tom在信中提到他最近在劝好友Andy戒烟,但Andy却因此要与他绝
- 2已知,如图,在△ABC中,∠B=60°,AB=2BC.求证:∠C=90°
- 3老师,我想送您三句话 作文
- 4一、已知一次函数y=kx+2,当x=5时y的值为4,求k值.二、已知直线y=kx+b经过点(9,0)和点(24,20),
- 5President Obama made a speech for half an hour without
- 6通过这一段时间的化学学习,你已经掌握了实验室制取气体的有关规律,请结合下图回答问题:
- 7sodium chloride什么意思
- 8判断:正方体的体积和棱长不成比例
- 9下面句子汉语意思——Do you think he would have given you a hand in you
- 10急求~~有才的大神能帮我填两句词~~
- 11△ABC中,R为△ABC半径2R(sinA方-sinC方)=(a-b)sinB,求角C 若R=1,求三角形周长的取值范围
- 12My brother ________ a watch and his watch ________ on the be
- 13用所给词的正确形式填空nothing could be ………(good) 详解,
- 14(2007•西城区一模)如图所示,在半径为R,质量分布均匀的某星球表面,有一倾角为θ的斜坡.以初速度v0向斜坡水平抛出一
- 15速求甲乙两城相距29千米,一辆客车从甲城出发,向乙城驶去每小时行45千米.一辆货车从乙城出发,驶向甲城,每小时行42千米



