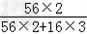1.2克CH4所含有的共价键数与0.1moNH3所含有的共价键数相同吗?
 hotbandage2022-10-04 11:39:543条回答
hotbandage2022-10-04 11:39:543条回答
已提交,审核后显示!提交回复
共3条回复
 烦人老太太 共回答了19个问题
烦人老太太 共回答了19个问题 |采纳率78.9%- 相同 1.2g 等于1.2/6mol cH4有四个共价键 等于0.3mol
- 1年前
 傻傻滴MF 共回答了13个问题
傻傻滴MF 共回答了13个问题 |采纳率76.9%- 相同
- 1年前
 1013的第25次耳语 共回答了1个问题
1013的第25次耳语 共回答了1个问题 |采纳率- 不同,物质的量也不同
- 1年前
相关推荐
- 汽车蓄电池中稀硫酸的溶质质量分数为28%,密度为1.2克/厘米3.若要在实验室用溶质质量分数为98%的浓硫酸配制这种稀硫
汽车蓄电池中稀硫酸的溶质质量分数为28%,密度为1.2克/厘米3.若要在实验室用溶质质量分数为98%的浓硫酸配制这种稀硫酸630克.求:
(1)630克稀硫酸的体积是多少毫升?
(2)需要浓硫酸多少克? caffeinss1年前1
caffeinss1年前1 -
 钦赐 共回答了22个问题
钦赐 共回答了22个问题 |采纳率86.4%解题思路:(1)根据溶液的质量=溶液的密度×溶液的体积分析解答;
(2)依据溶质的质量分数=[溶质的质量/溶液的质量]×100%,进行公式变形求解.(1)630克稀硫酸的体积是:630克÷1.2克/厘米3=525厘米3,即525毫升;
(2)要配制的28%的硫酸其溶质来源于98%的浓硫酸,则需要浓硫酸的质量是:630克×28%÷98%=180克;
答:630克稀硫酸的体积是525毫升;配制这种稀硫酸630克需要浓硫酸的质量是180克.点评:
本题考点: 有关溶质质量分数的简单计算.
考点点评: 本题考查了根据溶质的质量分数和溶液的质量的计算式的简单计算,要在记住计算式的基础了认真计算.1年前查看全部
- 6克碳充分燃烧能生成 克二氧化碳; 3克碳、1.2克碳呢?
 wjy75672941年前1
wjy75672941年前1 -
 tthxs 共回答了14个问题
tthxs 共回答了14个问题 |采纳率85.7%C+O2=CO2
12 44
6g X
12/44=6g/X
X=22g
同理,若是3gC,则生成11gCO2
1.2gC生成4.4gCO21年前查看全部
- 化学奥林匹克竞赛题某盐溶液50克,蒸发10克水,回复至原温度有1.2克晶体析出,另取10克该溶液,蒸发3克水,恢复至原温
化学奥林匹克竞赛题
某盐溶液50克,蒸发10克水,回复至原温度有1.2克晶体析出,另取10克该溶液,蒸发3克水,恢复至原温度有0.48克晶体析出,该盐在此温度下溶解度为( ). qsxtbhjulop1年前5
qsxtbhjulop1年前5 -
 30162466 共回答了19个问题
30162466 共回答了19个问题 |采纳率89.5%另取10克该溶液,要注意这个.
得先算原溶液中溶质的质量分数.先设为x,先后两份溶液蒸发后形成饱和溶液,溶质的质量分数相等.
(50x-1.2)/(50-10-1.2)=(10x-0.48)/(10-3-0.48)=S/(100+S)
(50x-1.2)/(50-10-1.2)=(10x-0.48)/(10-3-0.48)可以解得x
(10x-0.48)/(10-3-0.48)=S/(100+S)可以解的溶解度S .
应该不会是16的,我这里没笔,算不了.1年前查看全部
- 一升牛奶里含钙1.2克,含蛋白质34克.红红早晨喝了250毫升牛奶,他可以吸收多少克钙,多少克蛋白质
 zyjp0071年前1
zyjp0071年前1 -
 暖好 共回答了15个问题
暖好 共回答了15个问题 |采纳率93.3%由于250毫升等于1/4升,可知250毫升里含有的钙为1.2g*(1/4)=0.3g,含有的蛋白质为34g*(1/4)=8.5g.1年前查看全部
- t度时氢氧化钠饱和溶液的密度为1.2 质量分数为0.1 .则钠离子的浓度是多少 t度时氢氧化钠饱和溶液的密度为1.2克每
t度时氢氧化钠饱和溶液的密度为1.2 质量分数为0.1 .则钠离子的浓度是多少 t度时氢氧化钠饱和溶液的密度为1.2克每毫升 质量分数为0.1 .则钠离子的浓度是多少
 洽米1年前1
洽米1年前1 -
 zhaodawei8979 共回答了20个问题
zhaodawei8979 共回答了20个问题 |采纳率90%取1L该溶液则有:V液=1L
m(NaOH)=1.2g/l*1000ml*0.1=120g
n(NaOH)=120/40=3mol
C(Na+)= C(NaOH)=3mol/1L1年前查看全部
- 在t℃时将60克某物质溶于水,得到250毫升(密度为1.2克/厘米³)的饱和溶液,求该物质在t℃时的溶解度
 motage1351年前1
motage1351年前1 -
 E脸坏笑 共回答了17个问题
E脸坏笑 共回答了17个问题 |采纳率82.4%m溶液=ρV=1.2g/cm^3*250cm^3=300g
∴m溶剂=m溶液-m溶质=300g-60g=240g
∴ω=m溶质/m溶剂*100=60g/240g*100=251年前查看全部
- 1、现有镁铝铜合金1.2克,加入过量的盐酸,在标准情况下放出氢气1.12升,反应后过滤得到沉淀0.2克.若将此合金放入过
1、现有镁铝铜合金1.2克,加入过量的盐酸,在标准情况下放出氢气1.12升,反应后过滤得到沉淀0.2克.若将此合金放入过量的烧碱溶液中,反应后,标准情况下,大约能产生多少氢气?
2、将6克铁粉加入200毫升硫酸铁和硫酸铜的混合溶液中,充分反应得到200毫升0.5摩尔每升硫酸亚铁溶液和5.2克固体沉淀物.计算反应后生成铜的质量,和原硫酸铁溶液的物质的量浓度. 54188016161年前2
54188016161年前2 -
 yy老臭虫 共回答了7个问题
yy老臭虫 共回答了7个问题 |采纳率100%1.现有镁铝铜合金1.2g,加入过量的盐酸中,在标准状况下放出氢气1.12L,反应后滤得沉淀0.2g.若将此合金放入过量的烧碱溶液中反应后,在标准状况下,大约能产生多少升氢气?
镁铝能和盐酸反应,而金属铜不与盐酸反应,所以为0.2g n==0.05mol
联立方程Mg+2HCl=MgCl2+H2 2Al+6HCl=2AlCl3+3H2
24g 1mol 54g 3mol
x y 1-x 0.05-y
解方程得到x=0.4 g y=1/60mol
铝的质量为:0.6g
2Al+2NaOH+2H2O=2NaAlO2+3H2
54g 3mol
0.6g z z=1/30mol
氢气的体积为1/30×22.4=0.747L
2.将6克铁粉加入200毫升硫酸铁和硫酸铜的混合溶液中,充分反应得到200毫升0.5摩尔每升硫酸亚铁溶液和5.2克固体沉淀物.计算反应后生成铜的质量,和原硫酸铁溶液的物质的量浓度.
解析:由上述内容可是加入的铁粉过量.发生反应为:
Fe+Cu2+ =Fe2+ +Cu,Fe+2Fe3+ =3Fe 2+
设原溶液中Cu2+为x mol Fe3+为y mol则:
6.0-56(y/2+x)+64x=5.2g ①
x+3y/2=0.2×0.50mol ②
联立 ①、②可得:x=0.04 mol ,y=0.04 mol
所以反应后生成铜质量为0.04×64g=2.56g
加入铁粉前Fe2(SO4)3物质的量浓度为:0.04÷2÷0.2mol/L=0.1mol/L
希望采纳为最佳答案~谢谢1年前查看全部
- 一根横截面直径为0.4厘米直径的铜线,一米长度的重量是多少?我算出来的是1.2克左右,
 zptswd1年前3
zptswd1年前3 -
 独步沧海 共回答了17个问题
独步沧海 共回答了17个问题 |采纳率94.1%3.14*0.2*0.2*100*8.9=111.8克1年前查看全部
- 一道关于化学溶解度的计算题.汽车蓄电池中稀硫酸的溶质质量分数为28%密度为1.2克每立方厘米,若要在实验室用质量分数为9
一道关于化学溶解度的计算题.
汽车蓄电池中稀硫酸的溶质质量分数为28%密度为1.2克每立方厘米,若要在实验室用质量分数为98%的浓硫酸配置这种稀硫酸630克,求需要浓硫酸多少克? wsq20461年前1
wsq20461年前1 -
 tjsyw 共回答了28个问题
tjsyw 共回答了28个问题 |采纳率92.9%稀硫酸中的溶质的质量是630*28%=176.4g
根据稀释前后的溶质相等可得,
设,要浓硫酸是xg
98%x=176.4
x=180g1年前查看全部
- 关于化学溶解度的一道计算题.汽车蓄电池中稀硫酸的溶质质量分数为28%密度为1.2克每立方厘米.若要在实验室用溶质质量分数
关于化学溶解度的一道计算题.
汽车蓄电池中稀硫酸的溶质质量分数为28%密度为1.2克每立方厘米.若要在实验室用溶质质量分数为98%的浓硫酸配置这种稀硫酸630克.求需要浓硫酸多少克? plqitkfagc1年前1
plqitkfagc1年前1 -
 别吭声 共回答了22个问题
别吭声 共回答了22个问题 |采纳率100%稀硫酸中的溶质的质量是630*28%=176.4g
根据稀释前后的溶质相等可得,
设,要浓硫酸是xg
98%x=176.4
x=180g1年前查看全部
- 7.2克含杂质的锌粒和80毫升密度为1.2克/厘米3的稀硫酸恰好完全反应(杂质不与酸反应,且不溶于水
7.2克含杂质的锌粒和80毫升密度为1.2克/厘米3的稀硫酸恰好完全反应(杂质不与酸反应,且不溶于水
生成0.2克氢气.将反应后得到的硫酸锌溶液蒸发掉36.2克水后,再冷却到20摄氏度,刚好形成饱和溶液~问20摄氏度硫酸锌饱和溶液中水的质量 xqonly1年前1
xqonly1年前1 -
 TOP_HU 共回答了18个问题
TOP_HU 共回答了18个问题 |采纳率94.4%0.2克氢气,就是对应着6.5g的锌,恰好完全反应说明硫酸溶液中的硫酸是9.8g.那么硫酸溶液中水的质量是86.2g(80×1.2-9.8).
蒸发了36.2g水,并且假设氢气的溢出不带走水分,那么水的质量为86.2-36.2=50.0g水.1年前查看全部
- 钙是人体内第五位重要的元素,人体骨中钙的总含量约为1.2~1.5千克,青少年处于生长发育期,每天应摄入约为1.2克左右的
钙是人体内第五位重要的元素,人体骨中钙的总含量约为1.2~1.5千克,青少年处于生长发育期,每天应摄入约为1.2克左右的钙元素,才能维持骨骼的健康发育.关注两种补钙剂的说明书,回答以下问题:
(1)补充说明书上的空格处.
(2)若青少年每天所需摄入的钙元素(1.2克)全部由补钙药品提供,试计算:
每天至少服用“钙尔奇”几片?若改用“葡萄糖酸钙口服溶液”,按说明用量的最大剂量服用,是否能满足补钙需求? jnm1681年前1
jnm1681年前1 -
 张天渊 共回答了19个问题
张天渊 共回答了19个问题 |采纳率73.7%(1)每片钙尔奇所含钙元素的质量为:1.5g×
40
40+12+16×3 =0.6g 横线上应填写0.6g
(2)每天至少服用“钙尔奇”的片数:1.2÷0.6g=2片
由说明书可以看出,葡萄糖酸钙口服溶液一天最多服用6支,则6支葡萄糖酸钙口服溶液所含钙元素的质量为:6g×
40
430 =0.6g;
由于0.6g<1.2g,所以若改用葡萄糖酸钙口服溶液,按说明用量的最大剂量服用,不能满足补钙需求.
答:每天至少服用2片;
若改用葡萄糖酸钙口服溶液,按说明用量的最大剂量服用,不能满足补钙需求.1年前查看全部
- 将18.25%的盐酸与适量的烧碱反应,可得到密度为1.2克每立方厘米的氯化钠溶液,求所得溶液的质量分数
 小满四月1年前1
小满四月1年前1 -
 tingtan 共回答了15个问题
tingtan 共回答了15个问题 |采纳率100%条件不足,你再看看题,有没有漏什么条件1年前查看全部
- 蒸发15克食盐溶液得到1.2克食盐晶体,计算原食盐溶液的溶质质量分数
 宝宝追击1年前1
宝宝追击1年前1 -
 lili850505 共回答了21个问题
lili850505 共回答了21个问题 |采纳率85.7%1.2/15=8%1年前查看全部
- 资料显示:碳还原氧化铁的过程如下: 如图所示的实验中,反应前氧化铁和碳粉的质量分别为32克和1.2克,反应后得到气体A和
资料显示:碳还原氧化铁的过程如下: 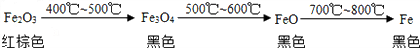
如图所示的实验中,反应前氧化铁和碳粉的质量分别为32克和1.2克,反应后得到气体A和28.8克黑色固体B. 
(1)求白色沉淀的质量;
(2)推断黑色固体B的化学式.(要求写出推断过程) jslylk1年前1
jslylk1年前1 -
 馨香淡茶 共回答了25个问题
馨香淡茶 共回答了25个问题 |采纳率92%1年前查看全部
- 现有下列反应:2X+Y2=2Z,若1.2克X完全反应后生成2克Z,已知Y的相对原子质量为16,则Z相对分子质量 A20
现有下列反应:2X+Y2=2Z,若1.2克X完全反应后生成2克Z,已知Y的相对原子质量为16,则Z相对分子质量 A20 B2
现有下列反应:2X+Y2=2Z,若1.2克X完全反应后生成2克Z,已知Y的相对原子质量为16,则Z相对分子质量( )
A20 B40 C30 D50 mydym5201年前4
mydym5201年前4 -
 予毒分子 共回答了22个问题
予毒分子 共回答了22个问题 |采纳率100%质量守恒 Y2的质量=2-1.2=0.8克
设Z相对分子质量为a
2X + Y2 == 2Z
32 2a
1.2 0.8 2
2a*0.8=32*2
a=401年前查看全部
- 将15克氯化钠溶液蒸干后得到1.2克氯化钠,计算原溶液中氯化钠的质量分数?
 cggks41年前1
cggks41年前1 -
 落地的云 共回答了21个问题
落地的云 共回答了21个问题 |采纳率100%质量分数=溶质质量/溶液质量=1.2g/15g= 8%1年前查看全部
- 汽车蓄电池中稀硫酸的溶质质量分数为28%,密度为1.2克/厘米3.若要在实验室用溶质质量分数为98%的浓硫酸配制这种稀硫
汽车蓄电池中稀硫酸的溶质质量分数为28%,密度为1.2克/厘米3.若要在实验室用溶质质量分数为98%的浓硫酸配制这种稀硫酸630克.求:
(1)630克稀硫酸的体积是多少毫升?
(2)需要浓硫酸多少克? 寒号鸟垒窝1年前1
寒号鸟垒窝1年前1 -
 alphe_xia 共回答了17个问题
alphe_xia 共回答了17个问题 |采纳率82.4%解题思路:(1)根据溶液的质量=溶液的密度×溶液的体积分析解答;
(2)依据溶质的质量分数=[溶质的质量/溶液的质量]×100%,进行公式变形求解.(1)630克稀硫酸的体积是:630克÷1.2克/厘米3=525厘米3,即525毫升;
(2)要配制的28%的硫酸其溶质来源于98%的浓硫酸,则需要浓硫酸的质量是:630克×28%÷98%=180克;
答:630克稀硫酸的体积是525毫升;配制这种稀硫酸630克需要浓硫酸的质量是180克.点评:
本题考点: 有关溶质质量分数的简单计算.
考点点评: 本题考查了根据溶质的质量分数和溶液的质量的计算式的简单计算,要在记住计算式的基础了认真计算.1年前查看全部
- 反应2a+5b=2c,1.2克a完全反应,生成2克c,若b相对分子质量32,求c相对分子质量,2C*0.8=5*32*2
反应2a+5b=2c,1.2克a完全反应,生成2克c,若b相对分子质量32,求c相对分子质量,2C*0.8=5*32*2啥意思
 我是你亲爷爷1年前2
我是你亲爷爷1年前2 -
 raynexsh 共回答了16个问题
raynexsh 共回答了16个问题 |采纳率87.5%也就是说a=1.2g,c=2g,就可以得出b=0.8g
2C就是2c的相对分子质量,5b-----2c
5*32 2C
0.8g 2g
最后5*32*2=2C*0.8
C=200即c相对分子质量为2001年前查看全部
- 配制0.03的过氧化氢,体积500毫升密度1.2克每立方厘米,
配制0.03的过氧化氢,体积500毫升密度1.2克每立方厘米,
取34克加二氧化锰反应,称剩余总质量是33.8克,将剩余物质过滤后得3克,问氧气质量是多少?瓶内过氧化氢溶液溶质质量分数多少? huahua1401年前1
huahua1401年前1 -
 9271965 共回答了15个问题
9271965 共回答了15个问题 |采纳率80%剩下的3g是催化剂二氧化锰
氧气质量34g+3g-33.8g=3.2g
2H2O2=2H2O+O2
68g 32g
x 3.2g
X=1.7g
1.7g/34g*100%=5%1年前查看全部
- 在反应2A+b=2c中,1.2克a完全反应生成t克c,又知b的相对分子质量32,则c的相对质量为多少
 VCD555DCV1年前3
VCD555DCV1年前3 -
 staojings 共回答了19个问题
staojings 共回答了19个问题 |采纳率84.2%根据物质守恒,消耗b的量:t-1.2
(t-1.2)/32*2=t/M
M=16t/(t-1.2)1年前查看全部
- 汽车蓄电池中稀硫酸的溶质质量分数为28%,密度为1.2克/厘米 3 。若要在实验室用溶质质量分数为98%的浓硫酸配制这种
汽车蓄电池中稀硫酸的溶质质量分数为28%,密度为1.2克/厘米 3 。若要在实验室用溶质质量分数为98%的浓硫酸配制这种稀硫酸630 克。求:
(1)630 克稀硫酸的体积是多少毫升?
(2)需要浓硫酸多少克? 阿里粑粑1年前1
阿里粑粑1年前1 -
 registertype 共回答了16个问题
registertype 共回答了16个问题 |采纳率87.5%(1)525毫升 (2)180克
本题主要考查溶质质量分数的计算,解题关键是明确浓溶液配制稀溶液的过程中溶质的质量没有发生变化。(1)根据V=m/ρ可以直接求出体积。
(2)根据稀释前后溶液中溶质的质量不变来求。(1)630克稀硫酸的体积是630克÷1.2克/厘米 3 =525厘米 3 =525毫升;(2)设需要浓硫酸的质量为m,28%×
630克=98%×m,m=180克。1年前查看全部
- 20℃时,某物质溶液50克各两瓶,一瓶蒸发掉10克水,析出晶体1.2克;另一瓶蒸发掉15克水,析出晶体2.4克,问此物质
20℃时,某物质溶液50克各两瓶,一瓶蒸发掉10克水,析出晶体1.2克;另一瓶蒸发掉15克水,析出晶体2.4克,问此物质的溶解度
 明月照白杨1年前3
明月照白杨1年前3 -
 我在开网店 共回答了17个问题
我在开网店 共回答了17个问题 |采纳率94.1%一瓶蒸发掉10克水,析出晶体1.2克.剩下的是饱和溶液.再蒸发5g水即蒸发掉15克水,析出晶体2.4克.所以饱和溶液蒸发5g水析出2.4g-1.2g=1.2g
20℃时,此物质的溶解度 1.2g/5g*100g=24g1年前查看全部
- 多少克二氧化碳中含碳元素1.2克?
 西域虎王1年前3
西域虎王1年前3 -
 zero和我 共回答了11个问题
zero和我 共回答了11个问题 |采纳率90.9%1.2*44/12=4.4克1年前查看全部
- 科学 汽车蓄电池中稀硫酸的溶质质量分数为百分之二十八,密度为1.2克/一立方。若是在实验室用溶质质量分数为百分之九十八的
科学 汽车蓄电池中稀硫酸的溶质质量分数为百分之二十八,密度为1.2克/一立方。若是在实验室用溶质质量分数为百分之九十八的浓硫酸配置这种稀硫酸630克。求:(1)630克稀硫酸的体积为多少毫升
(2)需要浓硫酸多少克
 手左1年前1
手左1年前1 -
 无泪配方 共回答了12个问题
无泪配方 共回答了12个问题 |采纳率100%(1)稀硫酸体积=稀硫酸质量/密度=630/1.2=525(立方厘米)
(2)配制后稀硫酸溶质的克数=浓硫酸溶质的克数,所以有
稀硫酸克数*28%=浓硫酸克数*98%
630*28%=浓硫酸克数*98%
则可得需要浓硫酸180克。1年前查看全部
- 高一化学题现有镁铝铜合金1.2克,加入过量的盐酸中,在标况下放出氢气1.12升,反应后过滤得沉淀0.2克,若将此合金放入
高一化学题
现有镁铝铜合金1.2克,加入过量的盐酸中,在标况下放出氢气1.12升,反应后过滤得沉淀0.2克,若将此合金放入过量的烧碱溶液中,反应后,在标准状况下,产生氢气的体积约为多少?(有详细的步骤) skraeling1年前6
skraeling1年前6 -
 红玫瑰还是白玫瑰 共回答了17个问题
红玫瑰还是白玫瑰 共回答了17个问题 |采纳率94.1%Cu不与盐酸反应,所以加入盐酸反应后过滤得到的沉淀0.2g为合金中的Cu.则合金中的Mg、Al质量和为1.2g-0.2g=1.0g.
设合金中含xmolMg,ymolAl:
Mg + 2H+ = Mg2+ + H2↑
1 1
x x
2Al + 6H+ = 2Al3+ + 3H2↑
2 3
y 1.5y
根据Mg、Al质量共1.0g,得:24x + 27y = 1.0
根据氢气为1.12L÷22.4L/mol=0.05mol,得:x + 1.5y = 0.05
两式联立,解得:x = 1/60,y = 2/90.
2Al + 2OH- + 2H2O = 2AlO2- + 3H2↑
2 3
y 1.5y = 1/30
1/30 mol × 22.4L/mol = 0.747L = 747mL1年前查看全部
- 标准状况下1体积水溶解500体积氯化氢,所得溶液密度1.2克每立方厘米,则所得溶液的物质的量浓度为?质量分数为多少?
 米粒3651年前1
米粒3651年前1 -
 selina王悦 共回答了17个问题
selina王悦 共回答了17个问题 |采纳率88.2%设有1L水与500L HCl气体.
HCl的物质的量是n=V/Vm=500/22.4=22.3mol
HCl的质量是m=nM=22.3*36.5=814g
水的质量是1000g,溶液的质量是1000 814=1814g
HCl的质量分数是814/1814*100%=44.9%
溶液的体积是1814/1.19=1524.4mL=1.5244L
HCl的物质的量浓度是c=n/V=22.3/1.5244=14.6mol/L
所以物质的量浓度是14.6mol/L,质量分数是44.9%1年前查看全部
- 1.2克铁丝在氧气中燃烧后,称得固体总质量为1.5克,则参加反应的氧气的质量为多少?
 zp5551年前22
zp5551年前22 -
 火石鱼 共回答了19个问题
火石鱼 共回答了19个问题 |采纳率89.5%因为Fe的燃烧反应是化合反应,所以固体质量的增量即参与反应的氧气的质量
1.5-1.2=0.3g1年前查看全部
- 用多少克的98%的浓硫酸可配制630克28%的稀硫酸(密度为1.2克/厘米^3)
 galaha1年前2
galaha1年前2 -
 海汐爱协 共回答了18个问题
海汐爱协 共回答了18个问题 |采纳率83.3%设所需浓硫酸的质量为X,依据溶液稀释过程中,溶质的质量不变的规律有:
X * 98%=630克×28%
X=180g
答:用180克98%的浓硫酸可配制630克28%的稀硫酸
原创性回答,如果认可我的回答,请尽早点击下面的“选为满意回答”按钮
如果还没解决您的疑难,请追问
[知识黑洞]和[夕阳无限好]团队的老队员“qaz2231a”祝您学习进步
如还有其他需要帮助的问题,可向我们两个团队求助,我们尽力为您解答1年前查看全部
- 关于溶解度和压强的问题要将一瓶内装50厘米^3的盐水(密度为1.2克/厘米^3)稀释成密度为1.1克/厘米^3,体积为9
关于溶解度和压强的问题
要将一瓶内装50厘米^3的盐水(密度为1.2克/厘米^3)稀释成密度为1.1克/厘米^3,体积为95.5毫升,需加水多少克?
双溪漂流旅行团中有8位游客,平均体重650牛,现有12根圆木组成的木筏,每根重500牛,体积是0.08米^3,这8位乘客能否都坐在木筏上漂流(人不能浸入水),请通过分析计算回答.(g=9.8牛/千克)
某温度时,将100克A溶液,在温度不变情况下,蒸发掉20可水,析出晶体4克,若再蒸发掉10克水,析出晶体3克,则该温度下溶解度是多少?
向墙壁上按图钉,已知图钉的面积是1厘米^2,钉尖面积为0.05毫米^2,手对图钉帽压强是2*10^5帕,则图钉尖对墙壁的压强为多大? zlbok16981年前2
zlbok16981年前2 -
 BerserkCai 共回答了11个问题
BerserkCai 共回答了11个问题 |采纳率81.8%1、=95.5×1.1-50×1.2=45.05g.
2、8×650+12×500=11200牛
木筏正好被淹没时所占用水的体积为12×0.08=0.96立方米.该体积所对应的水的重量为0.96×1×1000×9.8=9408牛.结论:不能.
3、3/10=0.3 则该温度下溶解度为30%.
4、=2×10^5×100/0.05=4×10^8帕.1年前查看全部
- 汽车蓄电池中稀硫酸的溶质质量分数为28%,密度为1.2克/厘米 3 .若要在实验室用溶质质量分数为98%的浓硫酸配制这种
汽车蓄电池中稀硫酸的溶质质量分数为28%,密度为1.2克/厘米 3  .若要在实验室用溶质质量分数为98%的浓硫酸配制这种稀硫酸630克.求:
.若要在实验室用溶质质量分数为98%的浓硫酸配制这种稀硫酸630克.求:
(1)630克稀硫酸的体积是多少毫升?
(2)需要浓硫酸多少克? hanfeng1561年前1
hanfeng1561年前1 -
 chitosanfe 共回答了24个问题
chitosanfe 共回答了24个问题 |采纳率100%(1)630克稀硫酸的体积是:630克÷1.2克/厘米 3 =525厘米 3 ,即525毫升;
(2)需要浓硫酸的质量是:630克×28%÷98%=180克;
答:630克稀硫酸的体积是525毫升;配制这种稀硫酸630克需要浓硫酸的质量是180克.1年前查看全部
- 科学 汽车蓄电池中稀硫酸的溶质质量分数为百分之二十八,密度为1.2克/一立方。若是在实验室用溶质质量分数为百分之九十八的
科学 汽车蓄电池中稀硫酸的溶质质量分数为百分之二十八,密度为1.2克/一立方。若是在实验室用溶质质量分数为百分之九十八的浓硫酸配置这种稀硫酸630克。求:(1)630克稀硫酸的体积为多少毫升
(2)需要浓硫酸多少克 阿卡布1年前1
阿卡布1年前1 -
 风遗言 共回答了11946个问题
风遗言 共回答了11946个问题 |采纳率0.6%(1)稀硫酸体积=稀硫酸质量/密度=630/1.2=525(立方厘米) (2)配制后稀硫酸溶质的克数=浓硫酸溶质的克数,所以有 稀硫酸克数*28%=浓硫酸克数*98% 630*28%=浓硫酸克数*98% 则可得需要浓硫酸180克。1年前查看全部
- 高一化学题关于物质的量浓度计算将密度为1.8克每毫升,质量分数为37%和密度为1.2克每毫升,质量分数为27%的两样硫酸
高一化学题关于物质的量浓度计算
将密度为1.8克每毫升,质量分数为37%和密度为1.2克每毫升,质量分数为27%的两样硫酸溶液混合,混合物的密度为1.54克每毫升,求混合溶液的物质的量,和物质的量浓度 喜欢双儿1年前4
喜欢双儿1年前4 -
 DQQandTY 共回答了25个问题
DQQandTY 共回答了25个问题 |采纳率92%设前一个的体积是V1,后一个的体积是V2
由题有0.0018*V1*37%=M1
0.0012*V2*27%=M2
求的是n=(M1+M2)/M(h2so4)
c=1.54n/(0.0018*V1+0.0012*V2)
没有更多的条件了吗?比如说质量体积什么的?有的话代进去试试看1年前查看全部
- 将足量铁投入200毫升硫酸和硫酸铜的混合溶液中,充分反应后,产生氢气1.12升,铁块质量减轻1.2克
 lhw19991年前1
lhw19991年前1 -
 vbyjm 共回答了13个问题
vbyjm 共回答了13个问题 |采纳率84.6%铁比铜,以及氢离子都活泼,所以铁既与硫酸反应,也与硫酸铜反应,由于氢气来自于硫酸中的氢离子所以由氢气的量可以算出硫酸的量.由硫酸的量算出与硫酸反应的铁的量,铁与硫酸反应会减轻,与硫酸铜反应会由于在铁表面生成铜而增重,所以减轻的1.2g铁等于铁与硫酸反应的减重减去因铜的生成引起的增重.然后用硫酸铜和硫酸的物质量分别除以体积就得到物质的量浓度.
生成的氢气为1.12升,由于一摩尔气体是22.4升,所以可算出生成氢气为1.12/22.4=0.05摩尔.---------说明硫酸为0.05摩尔.
所以与硫酸反应的铁是0.05摩尔,即2.8g
铁减轻了1.2克,即1.2/56=0.02摩尔
2.8g-1.2g=1.6g,即为铜增重.由差量法算得,1.6/(64-56)=0.2摩尔,---------说明硫酸铜为1.2摩尔.
硫酸铜物质的量浓度为1.2摩尔/0.2升=6摩尔/升
硫酸 物质的量浓度为0.05摩尔/0.2升=0.01摩尔/升1年前查看全部
- .某有机物1.2克完全燃烧生成0.896L二氧化碳和0.72克水.该有机物蒸汽密度条件下氢气的30倍
.某有机物1.2克完全燃烧生成0.896L二氧化碳和0.72克水.该有机物蒸汽密度条件下氢气的30倍
求该有机物的摩尔质量和分子式 風和日麗的日子1年前1
風和日麗的日子1年前1 -
 zluoli 共回答了20个问题
zluoli 共回答了20个问题 |采纳率80%M=30*2=60g/mol
C2H4O21年前查看全部
- 两种金属的混合物1.2克,与足量盐酸反应,生成0.1克氢气,则两种金属可能是?
两种金属的混合物1.2克,与足量盐酸反应,生成0.1克氢气,则两种金属可能是?
MG CU
AL FE
ZN AG
AL CU HOM迷1年前5
HOM迷1年前5 -
 rain1978dotnet 共回答了15个问题
rain1978dotnet 共回答了15个问题 |采纳率80%假设1.2g全是Mg,可生成H2 0.1g
Cu-0
Al-0.133
Fe-0.042
Zn-0.0375
Ag-0
因为是两种金属混合物共1.2g,放出氢气1.0g.所以两种金属反应放出的氢气的量,应该一个大于0.1一个小于0.1
所以选AL FE或 AL CU1年前查看全部
- 甲、乙两同学在室温下各取50克某溶液分别做制晶体实验,甲将溶液蒸发掉10克水后冷却至室温得晶体1.2克(晶体不含结晶水)
甲、乙两同学在室温下各取50克某溶液分别做制晶体实验,甲将溶液蒸发掉10克水后冷却至室温得晶体1.2克(晶体不含结晶水),乙将溶液蒸发掉15克水后冷却至室温,得晶体2.4克.若两人实验结果都正确,则原50克某溶液中溶质的质量分数为( )
A. 1.1%
B. 17.4%
C. 22.2%
D. 36.1% 光晕1年前1
光晕1年前1 -
 liujiaxian 共回答了16个问题
liujiaxian 共回答了16个问题 |采纳率87.5%解题思路:可以把乙同学的蒸发溶液的过程分为两部分:先蒸发掉10g水,再蒸发掉5g水,由于两同学所用溶液是同样的溶液,则先蒸发掉10g水时也应该析出1.2g晶体,溶液达到饱和,再蒸发掉5g水时即蒸发饱和溶液时析出的晶体的质量为1.2g,即1.2g溶质溶解在5g水中恰好形成饱和溶液,则说明原溶液是多了5g水的饱和溶液.根据题意可知,可以将乙同学蒸发的过程表示为:50g溶液
蒸发10g水
析出1.2g晶体
蒸发掉5g水
析出1.2g晶体,说明原溶液中多了5g水,若蒸发掉这5g水,则剩余的45g溶液应为饱和溶液,有图示不难看出,1.2g溶质溶解在5g水中恰好达到饱和形成6.2g溶液,则设原溶液中即45g饱和溶液中溶质的质量为x,则
[x/45g]=[1.2g/6.2g] x=[45g×1.2g/6.2g]=8.7g
则原溶液中溶质的质量分数为:[8.7g/50g]×100%=17.4%
故选B.点评:
本题考点: 有关溶质质量分数的简单计算.
考点点评: 本题难度较大,主要考查了溶液中溶质的质量分数的有关简单的计算,重在培养学生的分析能力.1年前查看全部
- 在标况下,将224升氯化氢溶于635克水,所得盐酸密度是1.2克每立方厘米,若取上述10ml,稀释至60ml,其物质的量
在标况下,将224升氯化氢溶于635克水,所得盐酸密度是1.2克每立方厘米,若取上述10ml,稀释至60ml,其物质的量浓度为多少
 htuh1年前1
htuh1年前1 -
 烟烟102 共回答了25个问题
烟烟102 共回答了25个问题 |采纳率88%楼主好!
224升HCl是10mol,也就是365g.整个溶液的质量就是365+635=1000g,使用密度,得到V=1000/1.2=833.3ml.
所以取出来的溶液里面有HCl的物质的量是:
10*(10/833.3)=0.0012mol.
而稀释到60ml,c=0.0012/0.06=0.02mol/L
所以物质的量浓度就是0.02mol了~1年前查看全部
- 汽车蓄电池中稀硫酸的溶质质量分数为百分之二十八,密度为1.2克立方厘米.若要在实验室用溶质质量分数为百分之九十八的浓硫酸
汽车蓄电池中稀硫酸的溶质质量分数为百分之二十八,密度为1.2克立方厘米.若要在实验室用溶质质量分数为百分之九十八的浓硫酸配制这种稀硫酸630克.求630克稀硫酸的体积是多少毫升?
 w8515201年前1
w8515201年前1 -
 erxi001 共回答了16个问题
erxi001 共回答了16个问题 |采纳率81.3%630/1.2=525立方厘米(毫升)
质量除以密度等于体积1年前查看全部
- 有120克含量百分之12的盐水,如果平均每小时蒸发1.2克,
有120克含量百分之12的盐水,如果平均每小时蒸发1.2克,
有120克含量百分之12的盐水,如果平均每小时蒸发1.2克,问几小时能
达到含量百分之15的盐水?问蒸发几个小时,加入10克盐达到含量百分之25的盐水? yinchenwu1年前1
yinchenwu1年前1 -
 飘流一生 共回答了13个问题
飘流一生 共回答了13个问题 |采纳率100%如果平均每小时蒸发1.2克,问几小时能达到含量百分之15的盐水?
120×12%÷15%=96(克)
(120-96)÷1.2=20(小时)
问蒸发几个小时,加入10克盐达到含量百分之25的盐水?
(120×12%+10)÷25%=97.6(克)
97.6-10=87.6(克)
(120-87.6)÷1.2=27(小时)1年前查看全部
- 500ml盐水.质量600克密度1.2克每立方厘米加多少水变成密度1.1克每立方厘米
 hzmwhy1年前1
hzmwhy1年前1 -
 kg9566 共回答了7个问题
kg9566 共回答了7个问题 |采纳率100%设加水Xml
(600+X)÷(500+x)=1.1
600+x=550+1.1X
X=500
所以,加水500毫升,密度变为1.1g/ml1年前查看全部
- 两道数学题.高手速来```①杯中有浓度为12%的盐水120克,如果平均每小时蒸发掉1.2克水分.(1)经过几小时后,杯中
两道数学题.高手速来```
①杯中有浓度为12%的盐水120克,如果平均每小时蒸发掉1.2克水分.
(1)经过几小时后,杯中盐水浓度为15%?
(2)经过几小时后,再往杯中加入10克盐,所得浓度为25%?
②一只巡逻船在一段河流中行驶,顺水速度是逆水速度的2倍,如果它在静水中的速度是40千米/时,一个航监员报告,半小时前,有一只有安全隐患的竹筏从它现在的位置漂流而下,应速去截住,问这只船用多长时间可追上竹筏?
高手请帮忙,写下解问题的过程和答案.
 lanmda1年前1
lanmda1年前1 -
 b__gvw2_39zc5c87 共回答了20个问题
b__gvw2_39zc5c87 共回答了20个问题 |采纳率100%1、(1)设X小时.
盐的质量为120*12%=14.4克.X小时后蒸发掉水分1.2X,此时盐水浓度=14.4/(120-1.2X)=15%.解得X=20
(2)设Y小时.盐的质量为120*12%=14.4克.Y小时后蒸发掉水分1.2Y,盐的质量为14.4+10=24.4克,此时盐水浓度为24.4/(120-1.2Y+10)=25%,解得Y=27
2、设X小时追上.顺水速度=40+水速,逆水速度=40-水速,且顺水速度是逆水速度的2倍,漂流时船速等于水速.可知水速=40/3千米/时,顺水速度=160/3千米/时.
追上竹筏时,有 (160/3)*X=(40/3)*(X+0.5)
解得X=1/6,即10分钟追上1年前查看全部
- 已知配制的盐水520克,体积400立方厘米,求加多少水再配成密度为1.2克每立方厘米的盐水
 weiwei5061年前1
weiwei5061年前1 -
 赌坊的十一 共回答了16个问题
赌坊的十一 共回答了16个问题 |采纳率81.3%这个很容易的啦,
设加X克的水.
然后520+X是加水后的质量,
由于水是1克每立方厘米的密度,
所以X克水有X立方厘米,
所以总体积是400+X立方厘米,
之后520+X除以400+X=1.2.
就可以解方程了啊.1年前查看全部
- 称取8克固体,加水制成120克溶液,溶液密度为1.2克/毫升,求NaoH的物质的量浓度
 5025boy1年前1
5025boy1年前1 -
 蓝色小舟 共回答了21个问题
蓝色小舟 共回答了21个问题 |采纳率100%V=120/1.2=100ml=0.1L
n(NaOH)=8/40=0.2mol
物质的量浓度:0.2/0.1=2mol/L1年前查看全部
- 将足量铁投入200毫升硫酸和硫酸铜的混合溶液中,充分反应后,产生氢气1.12升,铁块质量减轻1.2克
将足量铁投入200毫升硫酸和硫酸铜的混合溶液中,充分反应后,产生氢气1.12升,铁块质量减轻1.2克
求硫酸铜和硫酸的物质量浓度 追云逐梦1年前2
追云逐梦1年前2 -
 okwap166 共回答了16个问题
okwap166 共回答了16个问题 |采纳率93.8%如果产生的气体在标准状态下的话,H2的物质的量0.05mol,与H2SO4反应的铁2.8g.可求出硫酸浓度是0.25mol/L.
与H2SO4反应的铁(2.8g)-置换出来的铜="铁块"质量的减轻(1.2g)
所以置换出de铜1.6g——0.025mol——硫酸铜0.125mol/L1年前查看全部
- 200mL密度为1.2克每毫升,质量分数为31%的硝酸的物质的量浓度
 tuili1年前1
tuili1年前1 -
 hhzz 共回答了17个问题
hhzz 共回答了17个问题 |采纳率100%先给你列解的式子,看不懂的话讲解在下方:200ml乘1.2g/ml乘31%除以63除以0.2升
200ml乘1.2g/ml是硝酸溶液的质量(以g为单位)
乘31%是因为硝酸不纯,只有31%是硝酸,其他是水.
除以63是因为我们要算它的物质的量,63是硝酸的摩尔质量HNO3=1+14+16*3=63
除以0.2升是因为我们算它的物质的量浓度,就要用物质的量除以溶液体积
答案是5.90476mol/L1年前查看全部
- 甲、乙两同学在室温下各取50克某溶液分别做制晶体实验,甲将溶液蒸发掉10克水后冷却至室温得晶体1.2克(晶体不含结晶水)
甲、乙两同学在室温下各取50克某溶液分别做制晶体实验,甲将溶液蒸发掉10克水后冷却至室温得晶体1.2克(晶体不含结晶水),乙将溶液蒸发掉15克水后冷却至室温,得晶体2.4克.若两人实验结果都正确,则原50克某溶液中溶质的质量分数为( )
A. 1.1%
B. 17.4%
C. 22.2%
D. 36.1% qinguojun19791年前1
qinguojun19791年前1 -
 zjy26zjy 共回答了14个问题
zjy26zjy 共回答了14个问题 |采纳率92.9%解题思路:可以把乙同学的蒸发溶液的过程分为两部分:先蒸发掉10g水,再蒸发掉5g水,由于两同学所用溶液是同样的溶液,则先蒸发掉10g水时也应该析出1.2g晶体,溶液达到饱和,再蒸发掉5g水时即蒸发饱和溶液时析出的晶体的质量为1.2g,即1.2g溶质溶解在5g水中恰好形成饱和溶液,则说明原溶液是多了5g水的饱和溶液.根据题意可知,可以将乙同学蒸发的过程表示为:50g溶液
蒸发10g水
析出1.2g晶体
蒸发掉5g水
析出1.2g晶体,说明原溶液中多了5g水,若蒸发掉这5g水,则剩余的45g溶液应为饱和溶液,有图示不难看出,1.2g溶质溶解在5g水中恰好达到饱和形成6.2g溶液,则设原溶液中即45g饱和溶液中溶质的质量为x,则
[x/45g]=[1.2g/6.2g] x=[45g×1.2g/6.2g]=8.7g
则原溶液中溶质的质量分数为:[8.7g/50g]×100%=17.4%
故选B.点评:
本题考点: 有关溶质质量分数的简单计算.
考点点评: 本题难度较大,主要考查了溶液中溶质的质量分数的有关简单的计算,重在培养学生的分析能力.1年前查看全部
- 有一块正方形玻璃重6.75千克,已知此种玻璃板每平方厘米重1.2克,求这块玻璃板的边长.
 oppig1年前2
oppig1年前2 -
 是在游戏里尽情的 共回答了20个问题
是在游戏里尽情的 共回答了20个问题 |采纳率95%解题思路:首先把6.75千克化为6.75×1000克,然后用其结果除以1.2克即为正方形的面积,最后根据正方形的面积等于边长的平方即可求出这块玻璃板的边长6.75×1000÷1.2=5625=752,
答:这块玻璃板的边长75cm.点评:
本题考点: 有理数的混合运算.
考点点评: 此题考查了有理数的混合运算的应用,解本题的关键是弄清题意列出正确的式子.1年前查看全部
- 密度为1.2克每立方厘米,体积为500毫升.现要把它稀释为密度1.1克每立方厘米.需要多少水?
 mzy00031年前2
mzy00031年前2 -
 蚵蚵茧 共回答了26个问题
蚵蚵茧 共回答了26个问题 |采纳率92.3%密度不是溶液的浓度,故1 楼理解有误.
设需x毫升的水(水的密度为1,故式中应该乘密度1时都省略而直接只写x)
(500×1.2+x)/ (500+x)=1.1
解得 x=500
------------------------------------------------------------------------------------------------
验算:质量=500*1.2+500*1=600+500=1100
体积=500+500=1000
密度=1100/1000=1.11年前查看全部
大家在问
- 1They have tried for ten years to capture it.(英语同义句)
- 2为什么基准邻苯二甲酸氢钾COD为500mg/L测量出来结果是578mg/L?
- 3下列各句中,加点的成语使用恰当的一句是( ) A.她不属于学院派,自然少受那些清规戒律
- 4谁知道凸函数和凹函数的定义与性质
- 5There will be a talk ______English teaching this afternoon.A
- 6读者的优美句子 50字10句要好点的
- 7初中学习的新特点表现在 [ ] ①咋课堂上可以学到更多的知识
- 8才开始学.
- 9All that is needed is a continuous supply of fuel and oil有两i
- 102005的2次方减去2005乘于4008加2004的2次方
- 11我拿什么奉献给您 作文 写给老师的
- 12我喜欢养一些鸡鸭和种一些植物用英文怎么说
- 131/e^2与(e^2)-2怎么比较大小
- 14早两句句子了投机在词典里有两种解释,1.见解相同 2.钻空与谋取私利。 请根据不同的解释,各写一个句子。 快快快快快,紧
- 15AB相距13千米,甲从A地到B,在B地停半小时后从B地回A地,乙从B地到A,在A地停留45分钟后回B地,·····