负极 熔融态电解液co .正极 o2和co2 .电解液 熔融态k2co3
 五阿哥2022-10-04 11:39:541条回答
五阿哥2022-10-04 11:39:541条回答明天考试.我要完整的 电极反应方程式.最好加上原理、、因为 它与普通的 电极不一样.

已提交,审核后显示!提交回复
共1条回复
 锥立 共回答了18个问题
锥立 共回答了18个问题 |采纳率83.3%- 燃料电池:负极CO发生氧化反应,氧元素来自熔盐中的碳酸根,生成二氧化碳;正极O2发生还原反应,生成的氧离子和二氧化碳结合成碳酸根.(+)2CO+2CO32-=4CO2+4e-;(-)O2+2CO2+4e-=2CO32-.总反应:2CO+O2=2CO2.
- 1年前
相关推荐
- 生物原电池中负极发生的反应1、 生物体中细胞膜内的葡萄糖,细胞膜外的富氧液体及细胞膜构成微型的生物原电池则负极的反应的式
生物原电池中负极发生的反应
1、 生物体中细胞膜内的葡萄糖,细胞膜外的富氧液体及细胞膜构成微型的生物原电池则负极的反应的式是怎样的?
请给出具体的电极反应式子 niznheng1年前1
niznheng1年前1 -
 长大的柯南 共回答了15个问题
长大的柯南 共回答了15个问题 |采纳率100%设想普通电池,一般金属做负极,即负极是负极物质发生氧化反应,失去电子从而使化合价升高.此反应是富阳液体氧化葡萄糖,所以应该是膜内的葡萄糖做负极,生成葡萄糖酸.
推测而已.仅供参考.1年前查看全部
- 由Mg、Al、NaOH溶液组成的原电池、其负极反应式为:Al - 3e- +4OH-====AlO2-+2H2O 相对于
由Mg、Al、NaOH溶液组成的原电池、其负极反应式为:Al - 3e- +4OH-====AlO2-+2H2O 相对于NaOH溶液而言、Al比Mg更活泼、铝为负极.
我想问”相对于NaOH溶液而言、Al比Mg更活泼“这是为什么啊、还有这个规律吗、详细是怎样的?
还有就是有碱参与的原电池中、我见好多都是负极生成碱而这个是AlO2-+2H2O、能类比吗? 西北风七八级1年前6
西北风七八级1年前6 -
 mandylucy 共回答了18个问题
mandylucy 共回答了18个问题 |采纳率100%因为铝具有两性,就是铝可以和酸或者碱反应,如果和碱反应的话就是生成偏铝酸根也就是你说的ALO2-铝是特殊的例子,这个要记的,这是两性定义 .两性元素:既有金属性又有非金属性,在周期表中金属元素与非金属元素交界处(阶梯线附近)的元素.
两性物质:既能跟酸反应,又能跟碱反应,如Al,Al2O3,
ZnO等(望丢分)下面是我去搜的两性物质,太多了,不愿打= =对了、、、你看下我的再结合下楼上的377680504他的也比较全面1年前查看全部
- 电流源方向是正极指向负极,还是负极指向正极.
 凡事皆有因果1年前1
凡事皆有因果1年前1 -
 马行天下 共回答了26个问题
马行天下 共回答了26个问题 |采纳率88.5%电流源就是电源,在电源的外部是从正极流向负极,在电源的内部是从负极流向正极,你问的应该就是电源的内部,从负极到正极!1年前查看全部
- 电路中的用电器是在电流流过它时发光还是在电流返回负极时发光?
 jane_qiu1年前0
jane_qiu1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 把a、b、c、d四块金属板浸入稀H2SO4中,用导线两两相连,可以形成原电池.若a、b相连时,a为负极;c、d相连时,c
把a、b、c、d四块金属板浸入稀H2SO4中,用导线两两相连,可以形成原电池.若a、b相连时,a为负极;c、d相连时,c为负极;a、c相连时,c极上产生大量气泡,b、d相连时,b极上有大量气泡.则四块金属的活动顺序是( )
A. a>c>d>b
B. c>a>b>d
C. a>c>b>d
D. c>a>d>b lsp1oo1年前3
lsp1oo1年前3 -
 papayafruit 共回答了18个问题
papayafruit 共回答了18个问题 |采纳率83.3%解题思路:形成原电池时,活泼金属做负极,根据电极反应现象首先判断电池的正负极,再判断金属的活泼性强弱.形成原电池时,活泼金属做负极,若a、b相连时,a为负极,则金属活动性a>b,c、d相连时,c为负极,活动性c>d,a、c相连时,c极上产生大量气泡,说明在c极上产生氢气,c极上发生还原反应,c极为正极,则活动性a>c,b、d相连时,b极上有大量气泡产生,说明在b极上产生氢气,b极上发生还原反应,b极为正极,则活动性d>b,所以四种金属的活动性顺序为a>c>d>b,
故选A.点评:
本题考点: 原电池和电解池的工作原理;常见金属的活动性顺序及其应用.
考点点评: 本题考查金属的活动性的顺序强弱比较,题目难度不大,本题考查角度为形成原电池反应,注意活泼金属做负极.1年前查看全部
- 正极负极 阴极阳极 这两个有什么区别?
 都督大kk1年前1
都督大kk1年前1 -
 任性飞扬 共回答了18个问题
任性飞扬 共回答了18个问题 |采纳率83.3%正负极是电路中的,阴阳极是化学里电池中的.1年前查看全部
- 1.是不是与电源正极连着的极板是正极板,与负极连着的极板是负极板?若不是,怎么区分?
1.是不是与电源正极连着的极板是正极板,与负极连着的极板是负极板?若不是,怎么区分?
2.上下极板是不是指上面下面的极板?
学完好久了,连基本概念都忘了. Q跳水鱼Q1年前2
Q跳水鱼Q1年前2 -
 zsz0579 共回答了15个问题
zsz0579 共回答了15个问题 |采纳率66.7%1如果不是有极性的电容器(电解电容器有正负极性的区分,不能接错,不然会损坏电容器),那么与电源正极连着的极板就是正极板,与负极连着的极板就是负极板.
2上下极板就是分别指上面下面的极板1年前查看全部
- 用铁钉电解饱和食盐水,负极产生大量气泡,正极先产生少量的气泡,然后产生了青绿色的沉淀.
用铁钉电解饱和食盐水,负极产生大量气泡,正极先产生少量的气泡,然后产生了青绿色的沉淀.
1.正极产生少量的气泡是氧气吗?
2.正极产生青绿色的沉淀是什么? r1idn1年前1
r1idn1年前1 -
 liangjingxi 共回答了19个问题
liangjingxi 共回答了19个问题 |采纳率94.7%电解饱和食盐水(无隔膜)主要生成氢气和氯气和氢氧根,少量生成氢气和氧气.
所以.
正极产生少量的气泡是氧气.
正极产生青绿色的沉淀是氢氧化亚铁.1年前查看全部
- 铝与炭棒在烧碱中形成原电池、负极反应怎么写?只写负极!
 大海滩上1年前2
大海滩上1年前2 -
 无限接近于蓝 共回答了14个问题
无限接近于蓝 共回答了14个问题 |采纳率100%Al - 3e- +4OH- ===[Al(OH)4]-
或者Al -3e- +4OH- ===AlO2- +2H2O1年前查看全部
- 电解池中,电子是由负极经外电路流向正极,还是有电解质溶液流向负极?电流是由经过外电路还是电解质溶液
 天职也1年前1
天职也1年前1 -
 qepwq133 共回答了22个问题
qepwq133 共回答了22个问题 |采纳率86.4%一个电路中,导电的质子,带正电荷的就跟电流方向相同,带负电的就跟电流方向相反,这个是由电流的定义决定的.
所以电路回路中,有电子参与导电的部分,电子流动方向是跟电流相反的.
整个回路都有电流,包括外电路跟电解质溶液.外电路中,电子从电源负极流出,到达电解质溶液,由电解质溶液的导电离子参与导电(正离子与电流方向相同,流向负极;负离子与电流方向相反,流向正极),最后从导电溶液出来的电子流向电源正极.1年前查看全部
- 电子?电流?电路?"电流是因为电子定向移动而产生的."既然产生电流的是电子,而它从负极出发,为什么说电流从正极出发?原子
电子?电流?电路?
"电流是因为电子定向移动而产生的."
既然产生电流的是电子,而它从负极出发,为什么说电流从正极出发?
原子中,电子绕着原子核飞速运功.电子带负电,原子核带正电.那什么是电荷?"电流的方向指的是正电荷的移动方向."原子核能移动?
引号中是我摘录的.我想了解微观的.
不好意思,有点乱. 小瓶啤酒1年前1
小瓶啤酒1年前1 -
 catagory1314 共回答了29个问题
catagory1314 共回答了29个问题 |采纳率89.7%电流从正极出发是正确的,电子是阴极射线,是能量的吸收系统,哪里有多余的能量就会到哪里去.当电路接通的瞬间,电场总是从正极开始形成多余能量的外泻,也是正极附近的电子先流动,远处的电子在发现感应了这一电场现象后才继续形成电流.
因此,一般不是原子核在移动(溶液中的情况出外,有时甚至原子团都在带电流动),而是原子核辐射的正电荷引力子在以电场的方式移动而导致电子反方向移动形成我们需要的能量流(电流).1年前查看全部
- 下列说法不正确的是( )A. 铅蓄电池在放电过程中,负极质量减小,正极质量增加B. 常温下,反应C(s)+CO2(g)
下列说法不正确的是( )
A. 铅蓄电池在放电过程中,负极质量减小,正极质量增加
B. 常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的△H>0
C. 一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率
D. 相同条件下,溶液中Fe3+、Cu2+、Zn2+的氧化性依次减弱 栖神静乐1年前1
栖神静乐1年前1 -
 小妖甲 共回答了15个问题
小妖甲 共回答了15个问题 |采纳率73.3%解题思路:根据铅蓄电池的总反应式为:PbO2+Pb+2H2SO4
2PbSO4 +2H2O,其中负极:Pb+SO42--2e-=PbSO4;正极:PbO2+4H++SO42-+2e-=PbSO4+2H2O,不难看出铅蓄电池在放电过程中,负极生成PbSO4质量增加,正极生成PbSO4质量也增加;反应C(s)+CO2(g)=2CO(g)中△S>0,不能自发进行,则该反应的△H>0;利用催化剂同等程度增加正逆反应速率,平衡不发生移动,并不能提高反应物的平衡转化率;按金属活动性顺序,金属性依次减弱,金属单质还原性也依次减弱,对应离子氧化性依次增强,同时Fe3+对应排在Cu2+之后.另外据Fe3++Cu=Fe2++Cu2+、通电 .
Fe+Cu2+=Fe2++Cu也不难看出溶液中的氧化性依次减弱次序为:Fe3+>Cu2+>Zn2+.A、铅蓄电池电极反应:负极:Pb+SO42--2e-=PbSO4 正极:PbO2+4H++SO42-+2e-=PbSO4+2H2O 不难看出铅蓄电池在放电过程中,负极生成PbSO4质量增加,正极生成PbSO4质量也增加,故A错误;
B、因熵增、焓减的化学反应可能自发进行,反应气体体积增大△S>0,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的△H>0,故B正确;
C、因催化剂能同等程度地加快正逆反应速率,对平衡移动无影响,则不能提高反应物的平衡转化率;故C错误;
D、由Fe3++Cu=Fe2++Cu2+、Zn+Cu2+=Zn2++Cu可判断出溶液中的氧化性依次减弱次序为:Fe3+>Cu2+>Zn2+,故D正确.
故选:AC.点评:
本题考点: 常见化学电源的种类及其工作原理;氧化性、还原性强弱的比较;反应热和焓变;化学平衡的影响因素.
考点点评: 本题为小综合,主要属于基本理论的范畴,也带有元素化合物知识.做题时尤其要注意铅蓄电池的电极反应.1年前查看全部
- Al-Cu-浓HNO3 形成的原电池谁是负极?
Al-Cu-浓HNO3 形成的原电池谁是负极?
我知道 Al在浓HNO3中发生钝化,由于钝化Al不会接触NO3-而成为原电池负极,即电子不能从氧化膜中出去,同样NO3-在Cu作负极时也不能在Al处得到电子,故不存在电极方程式,而直接是Cu和HNO3反应的方程式
请问我哪里说错了?请各位指出,并教我该怎么看
学生先谢谢了 amylase1年前1
amylase1年前1 -
 dcryf 共回答了22个问题
dcryf 共回答了22个问题 |采纳率100%这里由于铜的活动性小于铝,所以铝做负极,失电子,不过这电子是跑到铜上面才失去的,不会受到钝化的影响,溶液中会出现铝离子!1年前查看全部
- 电源内部电子在外场力作用下由正极移向负极吗
 sean_ice1年前2
sean_ice1年前2 -
 A2313 共回答了19个问题
A2313 共回答了19个问题 |采纳率84.2%电源内部电子在非静电力作用下由正极移向负极.1年前查看全部
- 现有一个蓄电池,仍能供电,但正、负极的标识已模糊不清,请你设计两种方法,判断出它的正、负极(所需器材可任选).
 李艳妮妮1年前1
李艳妮妮1年前1 -
 ldycr 共回答了12个问题
ldycr 共回答了12个问题 |采纳率100%解题思路:电压表可以直接接在电源上,当正接线柱与电源的正极相连时,电压表正向偏转;也可以用电流表来辩别电源的正负接线柱.方法一:当电压表直接并联在电源上时,当正接线柱与电源的正极相连时,电压表要正向偏转,若与负接线柱相连时,要反向偏转.
方法二:让一个电流表与一个电灯串联,再接到电源的两极上,观察电流表指针偏转方向,若指针向反方向偏转,则与电流表正接线柱靠近的一端是蓄电池的负极,若指针正向偏转,则与电流表正接线柱靠近的一端是蓄电池的正极.点评:
本题考点: 电压表的使用.
考点点评: 本题考查了利用电压表和电流表判断蓄电池的正负接线柱.注意使用电流表时要串联一个电阻或电灯,防止短路.1年前查看全部
- 请问,在水的电解试验中,为什么与正极相连的试管内的气体体积小,而与负极相连的试管内的气体体积大?
 冰之伤1年前5
冰之伤1年前5 -
 msdos106 共回答了15个问题
msdos106 共回答了15个问题 |采纳率86.7%这个反应是:2H2O=2H2+O2,条件是电解,正极的气体是O2,负极的H2.从化学方程式看体积比(就是系数的比).H2:O2=2:11年前查看全部
- 直流电源焊接时,正接法是焊条接正极,工件接负极,主要用于焊接较厚的工件 判断题
 BB籽1年前1
BB籽1年前1 -
 我想笑 共回答了20个问题
我想笑 共回答了20个问题 |采纳率85%以上题目应该为直流正接时,是否焊条接正,工件接负.这种说法是否正确?
答:不对 直流正接应该是以工件接正极,焊条接负极才对.这也不是主要用于焊接较厚的工件,这是酸性焊条的接法.
如果是碱性焊条,就应该直流反接,焊条接正极,工件接负极,以稳定焊接电流和减少飞溅.1年前查看全部
- 如何使用兆欧表24V低压电路,正极对地之间的绝缘阻值为20兆欧姆,负极对地之间的绝缘电阻为50兆欧姆是否正常?
 肖文华1年前1
肖文华1年前1 -
 空心sh 共回答了18个问题
空心sh 共回答了18个问题 |采纳率94.4%兆欧表的使用
兆欧表又称绝缘电阻表,俗称摇表.
1、使用摇表时应远离磁场,按放水平位置;
2、按顺时针方向转动摇手柄,使速度逐渐增至每分钟120转左右.在调速器发生滑动后,即可得到稳定的电阻读数.
3、绝缘测定:将待测定的两端分别连接于“线路”及“接地”两接线柱上.
4、通地测定:将待测端及良好的地线依次接于“线路”及“接地”两接线柱上.
5、在测定特高电阻时,保护环应接于被测两端之间最内层的绝缘层上,以消除因漏电而引起的读数误差.
24V低压电路,正极对地之间的绝缘阻值为20兆欧姆,负极对地之间的绝缘电阻为50兆欧姆是正常的.1年前查看全部
- 请问这两个电路电源正极负极怎么连?才开始学电路
 karanafeng1年前1
karanafeng1年前1 -
 浪漫无道理 共回答了18个问题
浪漫无道理 共回答了18个问题 |采纳率83.3%用3V的电源,正极接在图上标有“3V”的那个端子上,负极接在图上标有“接地”符号的端子上(即左图中芯片的5、6脚,右图中芯片的12脚)即可!
手打不易,或点击右上角的满意,1年前查看全部
- 正极是铁,负极是铁,电解质溶液是氯化铜,写出电极反应和总反应
 不长叶子之树1年前4
不长叶子之树1年前4 -
 男人孟 共回答了20个问题
男人孟 共回答了20个问题 |采纳率95%负极,Cu2+ +2e-=cu
正极,2cl- -2e-=Cl2
CuCl2=(电解)=Cu+Cl21年前查看全部
- 原电池负极失电子的实质是什么?zn cu 硫酸电池,zn失电子与电解质硫酸有关吗?如果无关为什么Mg Al NaOH电池
原电池负极失电子的实质是什么?
zn cu 硫酸电池,zn失电子与电解质硫酸有关吗?如果无关为什么Mg Al NaOH电池中Al做负极?不明白失电子是与活泼性有关还是电解质有关 阳光无线1年前1
阳光无线1年前1 -
 huaquqq 共回答了23个问题
huaquqq 共回答了23个问题 |采纳率87%看能不能自发的进行氧化还原反应,Zn能与硫酸反应,Al能与氢氧化钠反应.1年前查看全部
- 如图所示为铜锌原电池,下列有关说法不正确的是( ) A.锌片作负极 B.铜片上有气泡 C.电子由铜片经导线流向锌片 D
如图所示为铜锌原电池,下列有关说法不正确的是( ) A.锌片作负极 B.铜片上有气泡 C.电子由铜片经导线流向锌片 D.一段时间后,溶液中氢离子的物质的量减小 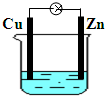
 36634991年前1
36634991年前1 -
 余强 共回答了24个问题
余强 共回答了24个问题 |采纳率87.5%A.该装置中锌易失电子作负极,故A正确;
B.铜作正极,正极上氢离子得电子生成氢气,所以Cu上有气泡生成,故B正确;
C.电子从负极沿导线流向正极,即电子从负极锌沿导线流向正极铜,故C错误;
D.正极上氢离子得电子发生还原反应生成氢气,所以一段时间后,溶液中氢离子的物质的量减小,故D正确;
故选C.1年前查看全部
- 由水和氧气在放电条件下生成臭氧和过氧化氢的正、负极电极反应方程式
 zzq_cqy1年前1
zzq_cqy1年前1 -
 棠中铁 共回答了17个问题
棠中铁 共回答了17个问题 |采纳率88.2%2O2+H2O=放电=O3+H2O2
阴极:2O2 +e ===O3 + O-(-1价)
阳极:H2O -e + O- ===H2O21年前查看全部
- 高中化学(电解)刚刚看到这句话:电子流向是,电子由电解池的阳极流出,流回直流电源的正极.由直流电源负极流出流到电解池的阴
高中化学(电解)
刚刚看到这句话:电子流向是,电子由电解池的阳极流出,流回直流电源的正极.由直流电源负极流出流到电解池的阴极.
那老师上课说的 电子的流向从负极到正极
电子流向到底从哪到哪啊
 9522191年前1
9522191年前1 -
 wuqinghui1984 共回答了18个问题
wuqinghui1984 共回答了18个问题 |采纳率88.9%电解池外接电源的正极,是电解池中的阳极;外接的负极,是电解池中的阴极.
在电解池的外部,电子由正极流向负极.
在电解池的内部,阴离子带着电子从阴极流向阳极;阳离子带着正电荷从阳极流向阴极.
你一定把老师的的话听错了.因为在电解池内部没有负极和正极只有阴极和阳极.老师也不可能说电解池中“ 电子的流向从负极到正极”,因为电解池中是离子的转移,或称流动也可以,不是电子的流动.1年前查看全部
- 根据通电螺线管旁的小磁针的N、S极指向,在图中标出通电螺线管的N、S极和电源的正、负极.
 十分历害1年前0
十分历害1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 写原电池反应方程式时,怎么判断负极失了几个电子?
 晶晶02161年前4
晶晶02161年前4 -
 Lucy8378 共回答了22个问题
Lucy8378 共回答了22个问题 |采纳率86.4%可以先写出总方程式例如2H2+O2=2H2O(原电池)由升失氧降得还得出氢气失电子.因为H原子要变成氢离子所以一个H2要失两个电子,所以负极要失4个电子.1年前查看全部
- 银锌纽扣电池和银锌蓄电池的负极反应为什么不一样?都是一样的反应物,产物为什么不同?
银锌纽扣电池和银锌蓄电池的负极反应为什么不一样?都是一样的反应物,产物为什么不同?
正极反应相同
负极
纽扣电池的产物是ZnO2+H2O
蓄电池的产物是Zn(OH)2
为什么?
电极,电解质都是一样的。继续期待正确答案! 紫月诗云1年前4
紫月诗云1年前4 -
 lanqiuyu 共回答了15个问题
lanqiuyu 共回答了15个问题 |采纳率80%好像银锌纽扣电池和银锌蓄电池的负极反应都是
Zn + 2OH- - 2e- = ZnO + H2O
不过碱性锌锰干电池的负极反应
Zn + 2OH- - 2e- = Zn(OH)21年前查看全部
- 原电池中活泼金属做正极还是负极
 JohnnyBeAR1年前1
JohnnyBeAR1年前1 -
 beta113 共回答了22个问题
beta113 共回答了22个问题 |采纳率86.4%一般作负极.但不是绝对的,应该视具体情况而定.如Mg、Al,NaOH溶液组成的原电池中,Al作负极,Mg作正极.
严格应该是这样说:失去电子的一极充当负极.得到电子的一极作正极.1年前查看全部
- 电路中有两个电源时,电流的方向怎么看出来,如果两个电源电流从正极流向负极有些时候,会在一条支路中有两条方向相反的电流,我
电路中有两个电源时,电流的方向怎么看出来,如果两个电源电流从正极流向负极有些时候,会在一条支路中有两条方向相反的电流,我看也不会抵消啊.那就看不出方向了,跪求清晰地方法,一步一步的说明
如图

 jxytzln1年前0
jxytzln1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 举一个带盐桥的原电池并写出正极负极的反应方程式和总的
 tangyan111年前1
tangyan111年前1 -
 evsq 共回答了18个问题
evsq 共回答了18个问题 |采纳率100%两个烧杯,一个装硫酸铜,一个装硫酸锌,硫酸铜里插铜棒,硫酸锌里插锌棒,盐桥是硫酸钾,锌棒与铜棒用导线相连!
锌棒为负极,反应式是Zn - 2e- ==== Zn2+
铜棒为正极,反应式为Cu2+ + 2e- ==== Cu
总反应为Zn + Cu2+ ==== Zn2+ + Cu1年前查看全部
- Zn.Cu和H2SO4组成的原电池的电极反应式 负极:正极:
 彻底hpl1年前1
彻底hpl1年前1 -
 blueyong 共回答了18个问题
blueyong 共回答了18个问题 |采纳率88.9%2H+ + 2e- =H2 Zn-2e- =Zn2+1年前查看全部
- 燃料电池是怎样反应起来的我学过燃料电池的反应原理,我想问的是它是怎么反应起来的?说是氢气在负极失电子氧气在正极得电子的,
燃料电池是怎样反应起来的
我学过燃料电池的反应原理,我想问的是它是怎么反应起来的?说是氢气在负极失电子氧气在正极得电子的,它怎会失电子又怎么会得电子?一般情况下把氢气跟氧气通入碱液也没见它们能反应啊… 南京1912酒吧1年前2
南京1912酒吧1年前2 -
 zjgzzh 共回答了26个问题
zjgzzh 共回答了26个问题 |采纳率84.6%经由催化剂的作用,使得阳极的氢原子分解成两个氢质子(proton)与两个电子(electron),其中质子被氧『吸引』到薄膜的另一边,电子则经由外电路形成电流后,到达阴极.在阴极催化剂之作用下,氢质子、氧及电子,发生反应形成水分子1年前查看全部
- “电流从电流表正极流入,负极流出”这里的正极、负极说法,
“电流从电流表正极流入,负极流出”这里的正极、负极说法,
“电流从电流表(正极)流入,(负极)流出”这里的正极、负极说法,如果是填空题,填正极、负极, arthurllb1年前4
arthurllb1年前4 -
 嘟噜飞 共回答了17个问题
嘟噜飞 共回答了17个问题 |采纳率82.4%电流表和电压表上都标有“+”、“-”接线柱,“+”接线柱插红色表笔,“-”接线柱插黑色表笔.我们说是正接线柱和负接线柱,而不说是正极、负极.1年前查看全部
- 关于电压、电动势和电流的问题为什么电路中电流总是从正极流出而不能从负极流出?为什么要沿外电路流向负极极,而不从电源内部流
关于电压、电动势和电流的问题
为什么电路中电流总是从正极流出而不能从负极流出?为什么要沿外电路流向负极极,而不从电源内部流向负极?电动势又是什么角色?请通俗易懂点,小弟被这几个概念困住了~ 朱飞机1年前3
朱飞机1年前3 -
 今天开始变gg 共回答了22个问题
今天开始变gg 共回答了22个问题 |采纳率90.9%1、电流的方向规定为正电荷定向移动的方向(负电荷定向移动的相反方向).
2、电源的正极聚集了很多正电荷,负极聚集了很多负电荷,当电路接通时,由于电力的作用,正电荷应从电源的正极出发,通过导体定向移动到负极,负电荷应从电源的负极出发,通过导体定向移动到正极,对于金属导线而言,实际上只是自由电子,从电源的负极出发,通过导线定向移动到正极,形成了电流.
3、电动势是电源内部的一种力量,它不是静电力,而是一种外来的力,通常是化学力,磁场力,等.这种力量使得电源内部,正电荷从电源的负极出发,移动到正极,负电荷从电源的正极出发,移动到负极.1年前查看全部
- 有关电化学原理的推断正确的是 A.金属腐蚀就是金属原子失去电子被还原的过程 B.钢铁吸氧腐蚀时,负极反应式为:2H 2
有关电化学原理的推断正确的是
A.金属腐蚀就是金属原子失去电子被还原的过程 B.钢铁吸氧腐蚀时,负极反应式为:2H 2 O+O 2 +4e→4OH - C.氯碱工业中,阳极发生的反应为:2Cl - –2e→Cl 2 ↑ D.镀锌铁皮的镀层损坏后,铁更容易腐蚀  jimoivy1年前1
jimoivy1年前1 -
 明天就是艳阳天 共回答了30个问题
明天就是艳阳天 共回答了30个问题 |采纳率76.7%C
1年前查看全部
- 大地(电容器的负极)与高压线(电容器的正极)之间,可以形成电容器吗放电特性?为什么?
大地(电容器的负极)与高压线(电容器的正极)之间,可以形成电容器吗放电特性?为什么?
介质为空气! 灰龙_ff1年前3
灰龙_ff1年前3 -
 迥然相同 共回答了17个问题
迥然相同 共回答了17个问题 |采纳率94.1%前半句,是肯定句,表示有电容,后半句到底问有电容,还是放电?那个“吗”在哪合适?
高压线是交流,有直流.一般电容怎会有极性?
电压高过一定时,就会有电晕放电,但不符合电容放电的特性.
高压线若有火花或电弧放电,就无法使用了.1年前查看全部
- 某原电池总反应的离子方程式为2Fe 3+ +Fe=3Fe 2+ ,可以实现上述反应的原电池是( ) A.正极:Fe负极
某原电池总反应的离子方程式为2Fe 3+ +Fe=3Fe 2+ ,可以实现上述反应的原电池是( ) A.正极:Fe负极:Zn电解质溶液:Fe 2 (SO 4 ) 3 B.正极:Sn负极:Fe电解质溶液:FeCl 2 C.正极:Ag负极:Fe电解质溶液:CuSO 4 D.AB正极:Cu负极:Fe电解质溶液:Fe 2 (SO 4 ) 3  水中漫游1年前1
水中漫游1年前1 -
 人正废第二 共回答了16个问题
人正废第二 共回答了16个问题 |采纳率100%A、锌的活泼性大于铁,锌作负极,铁作正极,电解质溶液为Fe 2 (SO 4 ) 3 溶液,所以是不能实现该反应的原电池,故A错误.
B、铁的活泼性大于Sn,铁作负极,Sn作正极,电解质溶液为FeCl 2 溶液不是含Fe 3+ 的盐溶液,但氯化亚铁和铁不反应,所以不能形成原电池,故B错误.
C、铁的活泼性大于银,铁作负极,银作正极,电解质溶液为CuSO 4 溶液不是含Fe 3+ 的盐溶液,所以是不能实现该反应的原电池,故C错误.
D、铁的活泼性大于铜,铁作负极,铜作正极,电解质溶液为Fe 2 (SO 4 ) 3 溶液,所以是能实现该反应的原电池,故D正确.
故选D.1年前查看全部
- Cu能做原电池负极,那为什么Pt不能做负极?
 阿鸭1年前2
阿鸭1年前2 -
 四级受骗者 共回答了17个问题
四级受骗者 共回答了17个问题 |采纳率94.1%原电池的负极要参与电化学反应,要有电子的得失
铜虽然不很活泼,但能得失电子变成正2价铜离子,所以能做负极,比铜不活泼的物质做正极,譬如Pt.
而Pt 非常不活泼,不容易得失电子
所以不能做原电池中的负极
写的有点乱
参考一下1年前查看全部
- Pb02+SO42-+4H++2e=PbS04+2H2O 负极Pb+SO42--2e=PbSO4 负极流过1mol 电子
Pb02+SO42-+4H++2e=PbS04+2H2O 负极Pb+SO42--2e=PbSO4 负极流过1mol 电子会增重多
 yzlover991年前1
yzlover991年前1 -
 水蔺草 共回答了23个问题
水蔺草 共回答了23个问题 |采纳率78.3%2mol电子增重1mol硫酸根
则流过1mol 电子会增重0.5mol即48g1年前查看全部
- 化学电极反应中得注意负极生成的阳离子能否和电解质中的阴离子共存,不能共存则写入反应式中,为什么呢
化学电极反应中得注意负极生成的阳离子能否和电解质中的阴离子共存,不能共存则写入反应式中,为什么呢
Zn Cu Hcl原电池中Zn离子不能和Cl离子共存,可以生成Zncl,Cl离子怎么不写到电极反应式中呢? 窗子的aa1年前1
窗子的aa1年前1 -
 niunai80_hh 共回答了15个问题
niunai80_hh 共回答了15个问题 |采纳率100%Zn离子和Cl离子可以共存啊,ZnCl2在溶液中是以离子存在的 ,ZnCl2在熔融态也是有着很好的导电性能,虽然Zn和Al一样都是两性金属,但是氯化铝是共价化合物,熔融态不导电,但是氯化锌是可以的,这一点你可以搜百科:http://baike.baidu.com/view/525735.htm1年前查看全部
- 以铜为正极其它物质为负极.电解NACCL得什么?
 大白菜烧豆腐1年前2
大白菜烧豆腐1年前2 -
 13家的咕噜猫11 共回答了24个问题
13家的咕噜猫11 共回答了24个问题 |采纳率87.5%阳极是铜失电子成为亚铜离子进入溶液,阴极是氢离子得电子成为氢气逸出.
电极反应式如下
阳极:2Cu-2e-=2Cu+
阴极:2H++2e-=H2
氢离子放电导致溶液碱性,Cu+与OH-结合为CuOH,是橙黄色沉淀.1年前查看全部
- 燃料电池上,若用C2H4来做燃料,负极反应式是什么
燃料电池上,若用C2H4来做燃料,负极反应式是什么
能知道正极反应式吗 庄梦鱼1年前4
庄梦鱼1年前4 -
 秋意已浓YOYO 共回答了20个问题
秋意已浓YOYO 共回答了20个问题 |采纳率100%打错了 O2+2H2O+4e- =4OH- 是正极的反应 负极的是C2H4+3O2-4e-=2CO2+2H2O1年前查看全部
- 现有一金属丝a端接电源正级,b端接电源负极,则电流方向是由______端流向_____端
 jt29251年前1
jt29251年前1 -
 milo11 共回答了16个问题
milo11 共回答了16个问题 |采纳率87.5%电流的方向是a端流向b端 因为电子带负电荷 而b端是负极带负电荷 所以电子从b端流向a端 又电流方向跟电子流向相反 所以电流的方向是a端流向b端
或者只需记住电流从电势高(电源正极)流向电势低(电源负极) a端带正电是正的所以电势高 b端带负电是负的所以电势低1年前查看全部
- 一个并联电路,有一个支路有个灯泡,一个没有,在离负极最近的干路有1灯泡,这样的电路会短路吗?
一个并联电路,有一个支路有个灯泡,一个没有,在离负极最近的干路有1灯泡,这样的电路会短路吗?
如题,并说明原因 gdmilaoshu1年前2
gdmilaoshu1年前2 -
 lianlihuihui 共回答了18个问题
lianlihuihui 共回答了18个问题 |采纳率83.3%因为之路的灯泡短接后,依然有干路上的灯泡保护,所以不会短路1年前查看全部
- 静电喷涂物理工作时静电喷涂的喷枪或喷盘、喷杯,涂料微粒部分接负极,工件接正极并接地!为什么工件接正极了,还要接地呀?接地
静电喷涂物理
工作时静电喷涂的喷枪或喷盘、喷杯,涂料微粒部分接负极,工件接正极并接地!
为什么工件接正极了,还要接地呀?接地不是正极的正电荷被和中和了吗?那涂料怎么被工件吸附呢? wscyl1年前3
wscyl1年前3 -
 zyh24 共回答了19个问题
zyh24 共回答了19个问题 |采纳率100%你见过哪的静电喷涂 在工件上加正电?
都是在喷枪或者是涂料上加上负电.
之所以会吸附,是因为高压的喷枪靠近工件,同性相斥,
工件表面的负电荷就会从接地跑出去,工件就带上了正电.
这个效应叫做 静电感召.
一楼二楼,回去补习一下高中物理,不要在这里胡说八道.1年前查看全部
- 定向移动的电子流究竟是电池负极的物质提供的还是导线中的电子在运动
定向移动的电子流究竟是电池负极的物质提供的还是导线中的电子在运动
也就是说电池也是导体,导线是导体,电池和导线中的电子都在电场的作用下定向移动是吗
电子为什么总是从负极出发,且方向一直不改变 爱薪无敌1年前2
爱薪无敌1年前2 -
 希望xw 共回答了19个问题
希望xw 共回答了19个问题 |采纳率73.7%任何物体内都有电子,只不过导体内的电子有一部份能够自由移动,当电池与用电器通过导线组成闭合电路时,由于电池提供的电压(高中会学电压的本质,叫做电场)传播的速度是光速,所以当电路接通的瞬间,在整个闭合电路中,所有导体中的自由电子都在这个电压的作用下,同时沿从电池负极→用电器→电池正极→电池负极的方向移动.
也就是说,在电池的内部,也有电流通过,不过这个电流的方向是从电池负极到电池正极(电子的运动方向是从电池正极到电池负极),正好与外电路相反(但是如果用钟表上的顺、逆时针来看,则是同方向的).
而所有物质中的电子都是同样的微观粒子,没有区别,所以不能说电子是由电池提供的,也不能说电子是由导线提供的.
对于楼主的补充提问,补充回答如下:
是的,组成电路的所有导体中的自由电子都在电场的作用下定向移动.
对于“电子为什么总是从负极出发,而且方向一直不变?”这个问题,请看我今天对另一道题的回答,应当能解决楼主的疑惑:
http://zhidao.baidu.com/question/50129102.html1年前查看全部
- MOS管寄生二极管方向是不是随D,S极那边电压高,二极管的负极就与高电压端相连 ,正极连低压端
 lucidtea1年前1
lucidtea1年前1 -
 adanny008 共回答了19个问题
adanny008 共回答了19个问题 |采纳率89.5%不是.这个跟MOS管的类型有关系.
如果是NMOS,二极管的正极接S极,负极接D极.如果是PMOS,则二极管的正极接D极.并不会随着D、S加的电压变化而变化.1年前查看全部
- 如何判断正极负极是什么物质在反应
如何判断正极负极是什么物质在反应
是根据什么金属活动性顺序总结的那个. 井Mickey1年前4
井Mickey1年前4 -
 iamtoby 共回答了12个问题
iamtoby 共回答了12个问题 |采纳率83.3%通常情况下金属活动顺序表越前面越活泼,作为负机,发生氧化反应失电子.正极金属活动顺序表后面的金属,或者石墨,发生还原反应得电子1年前查看全部
- 锌锰电池的负极是锌吗
 mouseshu1年前3
mouseshu1年前3 -
 hdisu 共回答了22个问题
hdisu 共回答了22个问题 |采纳率90.9%锌锰干电池是最常见的化学电源.干电池的外壳(锌)是负极,中间的碳棒是正极,在碳棒的周围是细密的石墨和去极化剂MnO2的混合物.
在混合物周围再装入以NH4Cl溶液浸润的ZnCl2,NH4Cl和淀粉或其他填充物(制成糊状物).为了避免水的蒸发,干电池用蜡封好.干电池在使用时的电极反应为 碳极:2NH4+ + 2e- = 2NH3 + H2 +)H2 + 2MnO2 = 2MnO(OH) 锌极:Zn - 2e- = Zn2+ 总反应:Zn + 2MnO2 + 2NH4+ = 2MnO(OH) + 2NH3 + Zn2+ 从反应式看出:加MnO2是因为碳极上NH 离子获得电子产生H2,妨碍碳棒与NH 的接触,使电池的内阻增大,即产生“极化作用”.添加MnO2就能与H2反应生成MnO(OH).这样就能消除电极上氢气的集积现象,使电池畅通.所以MnO2起到消除极化的作用,叫做去极剂.此外,普通碱性干电池,也是用Zn和MnO2或HgO做反应物,但在KOH碱性条件下工作.例如汞电池是最早应用的微型电池,有Zn(负极)和HgO(正极)组成,电解质为KOH浓溶液,电极反应为 负极:Zn(s) + 2OH- Zn(s) + H2O + 2e- 正极:HgO(s) + H2O + 2e- Hg(1) + 2OH- 总反应:Zn(s) + HgO(s) ZnO(s) + Hg (1) 电动势为1.35V,特点是在有效使用期内电势稳定.另有一种氧化银电池由Zn和Ag2O组成,电解质为碱性溶液,电动势为1.5V.1年前查看全部
大家在问
- 1以读书妙悟为主题的作文,不少于600字
- 2△ABC中,cosA=根号2/2,cosB=根号3/2,若a-b=4-2倍根号2,求△ABC的面积
- 3her books are pink, I'm fine thanks, his pens are blue, My b
- 4已知:如图,要判断△ABC≌△A′B′C′,BE,B′E′分别是AC和A′C′上的高.求证:BE=B′E′.
- 5从屋檐上落下的雨滴可看成自由落体运动,某人测得雨滴经过2m的窗户所用时间0.1s,求
- 6求一篇英语作文,材料背景:学校组织召开了一次座谈会,目的是了解学生对校长、老师和家长的看法.
- 7如图,∠B与哪个角是内错角,与哪个角是同旁内角?他们分别是哪两条直线被哪一条直线所截形成?与∠C进行同样
- 8—What do you think of the little blind singer?
- 9(2009•龙岩模拟)如图所示,直线MN下方无磁场,上方空间存在两个匀强磁场I和II,其分界线是半径为R的半圆弧,I和I
- 10某同学做家庭作业看钟 ,发现时针和分针都指在7与8之间,并且分针在时针后一小格.当他完成作业时,发现时针指向8与9之间,
- 11求一篇关于科技的英语作文,160字左右大神们帮帮忙
- 12当三角形在rt三角形abc中,角c等于90度 ,ac等于根号3,bc为1点d在ac上,将三角形adb沿直线bd翻折后,点
- 13他只是开玩笑而已,不要把他的话放在心里 英文怎么说?
- 14在三角形ABC中三个内角的度数均为整数,且角A
- 15H2O2与Fe2O3发生反应吗?
