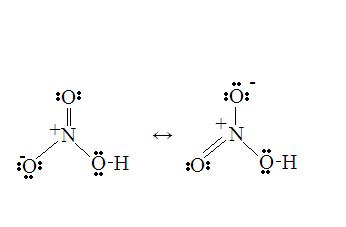
求alcl3的路易斯结构式,配图,谢谢!
 stanleyshine2022-10-04 11:39:540条回答
stanleyshine2022-10-04 11:39:540条回答
求alcl3的路易斯结构式,配图,谢谢!
说什么在气态阶段两个三氯化铝结合在一起什么的,题是英文的,读不太明白,!
说什么在气态阶段两个三氯化铝结合在一起什么的,题是英文的,读不太明白,!

已提交,审核后显示!提交回复
共0条回复
相关推荐
- 一氧化二氮的氧化数是多少?如果O-2 N就应该都是+1 但是看了他的路易斯结构式以后我又觉得每个氮原子氧化数并不相同
 永flj1年前1
永flj1年前1 -
 306638012 共回答了16个问题
306638012 共回答了16个问题 |采纳率75%确实如此,两个氮不一样.
平均为+1 .细算与氧相连的中间N为+2(+3),另一端的N为0(-1) .
其实氧化数在共价化合物当中穷究原子意义不大(共振态的存在,各个共振态的单个原子价态可以不同),就从分子看更合理一些.1年前查看全部
- 硝酸的路易斯结构式 + 解释+图
 xiaotuyy1年前2
xiaotuyy1年前2 -
 campbellxw 共回答了11个问题
campbellxw 共回答了11个问题 |采纳率90.9%1年前查看全部
- NO的路易斯结构式怎么写呢?谢谢
 巍子呵1年前1
巍子呵1年前1 -
 苦儿 共回答了15个问题
苦儿 共回答了15个问题 |采纳率93.3%1年前查看全部
- 写出下列分子的路易斯结构式并指出中心原子可能采用的杂化轨道类型,并预测分子的几何构型.
写出下列分子的路易斯结构式并指出中心原子可能采用的杂化轨道类型,并预测分子的几何构型.
(1) PCl3 (2)BCl3 (3)CS2 (4) C12O xiaolin_2181年前0
xiaolin_2181年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 电子式与路易斯结构式相同吗?我在德国读大学,在化学考试中总是要求写物质的路易斯结构式,请问高人,路易斯结构式与在高中学的
电子式与路易斯结构式相同吗?
我在德国读大学,在化学考试中总是要求写物质的路易斯结构式,请问高人,路易斯结构式与在高中学的电子式相同吗.比如硫酸根离子的结构式怎么写
 阿呆是谁1年前1
阿呆是谁1年前1 -
 明月1773 共回答了23个问题
明月1773 共回答了23个问题 |采纳率87%电子式要求要把最外层的所有电子都标出来;而Lewis结构式只要标出未成键的电子(单电子、孤对电子)即可,成键电子对要用断线表示,实际上:Lewis结构式就是在普通的结构式上标出未成键电子即可1年前查看全部
- 1)什么是路易斯结构式?(2)书写规则是什么?(3)写这个有什么意义
 爱情不是屁1年前1
爱情不是屁1年前1 -
 cainc1988 共回答了15个问题
cainc1988 共回答了15个问题 |采纳率93.3%人们把这类(用短棍表示共价键,同时用小黑点表示非键合的"孤对电子")添加了孤对电子的结构式叫做路易斯结构式,也叫电子结构式.
路易斯结构式
分子结构
1916年,Lewis
共价分子——分子中原子之间可以通过共享电子对而使每一个原子具有稳定的稀有气体电子结构.
共价键——通过共用电子对而形成的化学键.
路易斯结构式(电子结构式)
短棍表示共价键
小黑点表示非键合的"孤对电子"
路易斯结构式
分子结构
路易斯结构式(电子结构式)
短棍表示共价键
小黑点表示非键合的"孤对电子"
分子结构
贡献:初步解释了简单非金属原子间形成共价分子的过程.
3.1年前查看全部
- 路易斯结构式怎么写?不要粘贴的!写点要注意的问题和主要的写法,(包括那些应写那些不应写)!粘贴的不要!
 hzh6811年前1
hzh6811年前1 -
 厕所里的灵感 共回答了19个问题
厕所里的灵感 共回答了19个问题 |采纳率78.9%路易斯结构式源于路易斯结构理论,又称为八隅体理论.该理论对描述非过渡元素共价化合物的键合情况比较简单、使用.
该理论的基本要点:1、一个共价化合物(或共价分子)能够稳定存在,是由于电子对的共享使每个原子能够形成一种稳定的稀有气体电子构型2、在构成路易斯结构时,院子提供的价电子数,是按周期表的族数给出的3、在两原子间路易斯结构的表示为一对“电子点”或横短线相联结.
路易斯结构式的写法,对于简单的分子或离子通过观察即可确定,但对复杂的分子或离子,必须通过计算,知道分子中的键数和孤电子对数目.接下来进行原子排布,链状分子中,一般电负性较小的原子居中,而H及电负性较大的原子(如O Cl)则处于端基的位置.依次排好所有各个原子的位置后,两原子间以短线相连;孤对电子有一对“电子点”先从端基原子排起,依次到各个原子(每个原子周围应有4对电子,H为1对)使其达到所计算的孤对电子数目.若排列方式不止一种,应将所有的一一列出.对同一分子(或离子),在几种较稳定的排布中,彼此排列方式互为共振结构式.1年前查看全部
- 原子间键级 路易斯如何用过路易斯结构式和共振式求分子中两原子的键级?
 cutejiazi1年前2
cutejiazi1年前2 -
 翡翠公公 共回答了16个问题
翡翠公公 共回答了16个问题 |采纳率87.5%一般用分子轨道,键级=(成键电子-反键电子)/21年前查看全部
- SO3的路易斯结构式为什么两个双键一个单键?三个双键不行吗?
SO3的路易斯结构式为什么两个双键一个单键?三个双键不行吗?
如题 为爱喜欢你1年前0
为爱喜欢你1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 路易斯结构式中的nonbonding electron和lone pair有什么区别?
 2004-12-251年前1
2004-12-251年前1 -
 6VIEW 共回答了20个问题
6VIEW 共回答了20个问题 |采纳率100%意义一样,都是没有成键
nonbonding electron:非键电子,指电子个数
lone pair孤对电子,一对2个电子1年前查看全部
- 重氮甲烷的路易斯结构式正确答案是两个共振式但是百度百科上的图画的是重氮甲烷中C和N成配位键但如果这样中间的N显然形式电荷
重氮甲烷的路易斯结构式
正确答案是两个共振式
但是百度百科上的图画的是重氮甲烷中C和N成配位键
但如果这样中间的N显然形式电荷是2-不稳定
但其实我也认为N的孤对电子进入C的空P轨道
怎么搞的? songhaijing19781年前1
songhaijing19781年前1 -
 474641985 共回答了18个问题
474641985 共回答了18个问题 |采纳率88.9%配位键也算是一个键啊 中间那个氮有4根键 QF应该是+1 碳的QF是-1 一正一负相对稳定啊
另一个共振式是两个双键吧 那中间氮QF是+1 右边氮QF是-1 也是相对稳定的啊
至于N孤对电子进入C空轨道 你就按它说的理解就是了
= =反正C的确是有2P空轨嘛 N的确是有孤对电子嘛1年前查看全部
- 求CF4的路易斯结构式最好有图+解释
 zzzxxxccc8861年前1
zzzxxxccc8861年前1 -
 liuyw822 共回答了19个问题
liuyw822 共回答了19个问题 |采纳率100%F
|
路易斯结构式:F-C-F,每一个氟上面都有三对孤对电子没有标出
|
F
在路易斯结构式中,“—”表示共用一对电子,“=”表示共用两对电子,“≡”表示共用三对电子,但是每个原子都要满足"八隅律"(其实这个理论有一定局限性,比如无法解释SO3,P2O5,BF3等分子的问题,之后又提出了富电子和缺电子分子).1年前查看全部
- 关于路易斯结构式的高中化学题目.(竞赛的)
关于路易斯结构式的高中化学题目.(竞赛的)
求P7 3-(7个磷原子带三个负电荷)的路易斯结构式. 深圳大笨笨1年前2
深圳大笨笨1年前2 -
 相印红 共回答了16个问题
相印红 共回答了16个问题 |采纳率81.3%P7 3-可以看成是在P4上加了3个P,再加3个电子形成的.而P4正四面体,取任意三个顶点都是等效的.
P4中每个P都有一对孤对电子,用於与新加的P配位,P的3个p轨道电子发生变化,变成2+1的形式,空出一个p轨道来接受P4的配位.这样一来新P的最外层就有2s,2p3以及配位的2,共7电子.此时再加上外面给的1电子变成8,满足八隅律.
画路易斯结构式,你就画P4的其中3顶点对三个P进行配位,然後三个P上分别画三个负号表示每个P原子多一个外来电子.1年前查看全部
- 如何以路易斯结构式表示大π键那如何以路易斯结构式表示π键?二楼可否详说规则?
 柠檬西瓜1年前2
柠檬西瓜1年前2 -
 microoo 共回答了23个问题
microoo 共回答了23个问题 |采纳率95.7%1年前查看全部
- 硫酸根离子的路易斯结构式为什么硫向氧提供孤对电子?氧有空轨道吗?
 差了28分了1年前1
差了28分了1年前1 -
 a254724315 共回答了16个问题
a254724315 共回答了16个问题 |采纳率93.8%氧最外层6电子,L层的P亚层才4电子,还有一个空轨道.1年前查看全部
- 有关形式电荷的问题我在写硝酸的路易斯结构式时碰到一个问题,按照公式来说HNO3一共5根共价键,那么必然会有两根N-O单键
有关形式电荷的问题
我在写硝酸的路易斯结构式时碰到一个问题,按照公式来说HNO3一共5根共价键,那么必然会有两根N-O单键,但是我发现N连4根键,没有孤对电子,形式电荷为+1,但是一个氧连一根共价键,有2对孤对电子,形式电荷=价电子-键数-孤对电子*2=+1,这个和答案上的O的形式电荷为负矛盾,有人能告诉我这是怎么回事吗?
看来我没解释清楚。路易斯结构式中
成键数=(所有原子成为8电子(H是2电子)结构时的电子总数-所有原子价电子总数)/2
那么HO-NO2中一共24个价电子,所有原子成为8电子(H是2电子)结构时的电子总数=34,差值为10,那么一共有5根共价键即:H-O-N、O=N和O-N。
我的问题是关于这个只连了一个西格玛键的O为什么形式电荷为-1,不是你们说的那种共振式或者是大派键理论。 5345046851年前3
5345046851年前3 -
 hushangjun 共回答了17个问题
hushangjun 共回答了17个问题 |采纳率70.6%是这样连的:HO-NO2,而不是都连在N上,1年前查看全部
- 书写路易斯结构式的计算方法基本的结构是会写了,但是老师说的一套计算方法我没听明白,哪个高手指点下,详细点谢谢,主要是要计
书写路易斯结构式的计算方法
基本的结构是会写了,但是老师说的一套计算方法我没听明白,哪个高手指点下,详细点谢谢,主要是要计算如何书写!
 bonixiao1年前1
bonixiao1年前1 -
 uuuu 共回答了20个问题
uuuu 共回答了20个问题 |采纳率85%电子式会写就会路易斯结构式.
保留孤对电子,将共用电子对换成共价键(线)就OK了.1年前查看全部
- 要求回答下列各题.(1)写出下列物质的路易斯结构式.POCl3:______
要求回答下列各题.
(1)写出下列物质的路易斯结构式.
POCl3:______HOCN:______
(2)用价层电子对互斥模型预测SO2Cl2、ICl4-的立体结构,并给出中心原子的氧化数和杂化轨道类型.
(3)写出下列粒子中的Π键类型.(例如CO2:粒子 立体结构 中心原子
氧化数中心原子
杂化轨道类型SO2Cl2 ICl4-
)2π 43
O3:π 43SO3:π 43π 64.π 64 w542458271年前0
w542458271年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 硫酸根的路易斯结构式为什么不是线性?
硫酸根的路易斯结构式为什么不是线性?
如果只是计算的话感觉O-O-S-O-O的结构也满足计算结果呀 为什么结构是十字形呢? dilwie1年前1
dilwie1年前1 -
 jhzs 共回答了17个问题
jhzs 共回答了17个问题 |采纳率88.2%根据前线轨道理论,其结构中,一个S和两个O有配位键的形成,即有类似“=”(双键)的存在!
也就是,一个S上下各有1个O,左右再有O1年前查看全部
- 关于分子结构的一些问题,7.分子结构.路易斯结构式(电子式).价层电子对互斥模型对简单分子(包括离子)几何构型的预测.杂
关于分子结构的一些问题,
7.分子结构.路易斯结构式(电子式).价层电子对互斥模型对简单分子(包括离子)几何构型的预测.杂化轨道理论对简单分子(包括离子)几何构型的解释.共价键.键长、键角、键能.σ 键和π 键.离域π 键.共轭(离域)的一般概念.等电子体的一般概念.分子的极性.相似相溶规律.希望您能给出关于这些知识点的详细情况, xqzr5201年前2
xqzr5201年前2 -
 guilao 共回答了14个问题
guilao 共回答了14个问题 |采纳率92.9%1. 离子键与共价键的形成过程不同
离子键是原子间得、失电子而生成阴、阳离子,然后阴、阳离子通过静电作用而形成的;共价键是原子间通过共用电子对而形成的,原子间没有得失电子,形成的化合物中不存在阴阳离子.
2. 离子键和共价键在成键时方向性不同
离子键在成键时没有方向性,而共价键却有方向性.我们知道离子键是阴阳离子间通过静电引力形成的化学键.由于阴阳离子的电荷引力分布是球形对称的,一个离子在任何方向都能同样吸引带相反电荷的离子,因此离子键没有方向性.而共价键却大不相同,共价键的形成是成键原子的电子云发生重叠,如果电子云重叠程度越多,两核间电子云密度越大,形成的共价键就越牢固,因此共价键的形成将尽可能地沿着电子云密度最大的方向进行.除s轨道的电子云是球形对称,相互重叠时无方向性外,其余的p、d、f轨道的电子云在空间都具有一定的伸展方向,故成键时都有方向性.
共价键的方向性,决定分子中各原子的空间排布.原子排布对称与否,对于确定分子的极性有重要作用.
3. 离子键和共价键在成键时饱和性不同
离子键没有饱和性,而共价键则有饱和性.离子键没有饱和性是指一个离子吸引相反电荷的离子数可超过它的化合价数,但并不意味着吸引任意多的离子.实际上,由于空间效应,一个离子吸引带相反电荷的离子数是一定的.如在食盐晶体中,一个Na+吸引六个Cl-,同时一个Cl-吸引六个Na+.也可以说Na+与Cl-的配位数都是六.
共价键的饱和性,指共价键是通过电子中不成对的电子形成的.一个原子中有几个未成对电子,就可与几个自旋方向相反的电子配对形成几个共价键.成键后,再无未成对电子,也就再不能形成更多的键了.
我们知道如果共用电子对处于成键的两个原子中间,是非极性键;如果共用电子对稍偏向某个原子,是弱极性键;共用电子对偏向某个原子很厉害,则是强极性键;共用电子对偏向某个原子太厉害时,甚至失去电子便成为离子键了.
因此可以说,非极性键和离子键是共价键的两个极端,而极性键则是由非极性键向离子键过渡的中间状态.
故离子键、极性键和非极性键并无严格的界限.也就是说纯离子键和纯共价键只是一部分,而大多数键则是具有一定程度离子性和共价性的极性键.只有同种非金属原子间的共价键,其共价性为100%,不同原子间的键则具有一定的离子性.已赞同46| 评论1年前查看全部
- 结构式与路易斯结构式的区别 (举例)
 没有钱的鱼1年前1
没有钱的鱼1年前1 -
 高孙堂 共回答了17个问题
高孙堂 共回答了17个问题 |采纳率100%路易斯结构式 就是在结构式上加上孤对电子
HCN的结构式是 H—C≡N 路易斯结构式是 H—C≡N :
N2的 结构式是 N≡N 路易斯结构式是 :N≡N :
等等1年前查看全部
- HNO3 的路易斯结构式怎么写
 rfshi401年前2
rfshi401年前2 -
 1985judy 共回答了23个问题
1985judy 共回答了23个问题 |采纳率78.3%很简单.N在中间,连一个OH,连一个双键的O,然后再加一个单键的O.要标上电子,N是带正电子,单键O 带负电.(因为N 失去一个电子才能成4个键)1年前查看全部
- 三硫化四磷为什么易与氧气反应?能不能用三硫化四磷的路易斯结构式
 小李子45281年前0
小李子45281年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 图示的硫酸根离子的路易斯结构式有错么?如果没错,为什么?错的话错在哪里?
图示的硫酸根离子的路易斯结构式有错么?如果没错,为什么?错的话错在哪里?
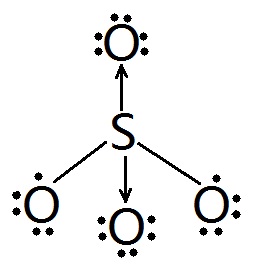
能顺便大概介绍一下路易斯结构式及其书写规则么(如果少许文字不能说清楚的话只是解释关于硫酸根的问题就可以了)? 心真的碎了1年前1
心真的碎了1年前1 -
 rebelx1 共回答了20个问题
rebelx1 共回答了20个问题 |采纳率95%这样写就可以了,但是事实上SO4中4O是等效的,实际不会有配位键和共价键之分.
而且你共价键这边的O原子电子少了,每个O都少了一个电子.每个O周围都应该是8e-.
所以你画4根单键出来就好了,如果考虑了S和O之间的p-π共轭,可以画SO双键,也是4组.1年前查看全部
- CO的结构路易斯结构式
 xlwoxiangni1年前3
xlwoxiangni1年前3 -
 melody_2004 共回答了18个问题
melody_2004 共回答了18个问题 |采纳率94.4%人们把这类(用短棍表示共价键,同时用小黑点表示非键合的"孤对电子")添加了孤对电子的结构式叫做路易斯结构式,也叫电子结构式.
路易斯结构式
分子结构
1916年,Lewis
共价分子——分子中原子之间可以通过共享电子对而使每一个原子具有稳定的稀有气体电子结构.
共价键——通过共用电子对而形成的化学键.
路易斯结构式(电子结构式)
短棍表示共价键
小黑点表示非键合的"孤对电子"
路易斯结构式
分子结构
路易斯结构式(电子结构式)
短棍表示共价键
小黑点表示非键合的"孤对电子"
分子结构1年前查看全部
- NH2OH HNO3 的路易斯结构式怎么写
 楚地小草1年前1
楚地小草1年前1 -
 xxr7310569 共回答了9个问题
xxr7310569 共回答了9个问题 |采纳率88.9%是硝酸羟胺?1年前查看全部
- 路易斯结构式中,是否要表示出配位键、离域π键?如要,什么时候需要?谢谢
 rain0snow1年前2
rain0snow1年前2 -
 爱上太阳 共回答了10个问题
爱上太阳 共回答了10个问题 |采纳率90%路易斯结构式的缺陷就是无法表示出这些东西,为此Pauling提出共振理论,弥补这一缺陷.1年前查看全部
- 关于N2O的路易斯结构式n2o的路易斯结构式是三元环结构(有两条n-n)还是两个双键呢?他们都能存在呢?怎么判断应该那种
关于N2O的路易斯结构式
n2o的路易斯结构式是三元环结构(有两条n-n)还是两个双键呢?
他们都能存在呢?
怎么判断应该那种存在的可能性更大呢? 广州外来人1年前3
广州外来人1年前3 -
 避风港951 共回答了17个问题
避风港951 共回答了17个问题 |采纳率82.4%N=N=O吧?
这是事实,其中形成大派键,类似于CO21年前查看全部
- 路易斯结构式中要写没有成键的孤对电子吗
 h123w99891年前1
h123w99891年前1 -
 jiangbo_728 共回答了20个问题
jiangbo_728 共回答了20个问题 |采纳率90%要写,1年前查看全部
- NOCl 的路易斯结构式氧和氮之间为什么是单键
 欢雨1年前1
欢雨1年前1 -
 jaimekkee 共回答了17个问题
jaimekkee 共回答了17个问题 |采纳率94.1%Lewis提出了“共用电子对理论,“—”表示共用一对电子.H—H “=”表示共用两对电子.H—O—H O=O “≡”表示共用三对电子.N≡N
那就是写错了,因为O=N-Cl刚好是每个8电子稳定结构,N=O必然是双键.1年前查看全部
大家在问
- 137、瑞雪这篇课文中为什么把这场雪叫瑞雪?
- 2为了测量两张纸之间的动摩擦因数,某同学设计了一个实验:如图所示,在木块A和板B上贴上待测的纸,B木板水平固定,砂桶通过细
- 3已知3a的平方+2b的平方-7=0,求6a的平方+4b的平方-3的值
- 4解方程:56/(X+2) + 2 = 50/X
- 5甲仓给乙仓七分之一后,两仓粮食相等,原来甲乙两仓粮食的比是,并计算
- 6pull-down assay和免疫共沉淀的区别
- 7(2013•日照)向烧杯中逐滴加入x溶液至过量(图甲),生成沉淀或气体的质量与加入x溶液的质量关系符合图乙的是( )
- 8求∠A+∠B+∠C+∠D+∠E+∠F+∠G=﹙ ﹚并说明理由
- 9按课文内容填空。我是水,我会变成(气)——( )——(雨)——( )——(雪)
- 10电工题 第一题:一台三相电动机,绕组为星形连接,接到线电压 的三相交流电源上,测得线电流 ;此时电动机输出的功率为 ,效
- 11表是小明同学利用如图所示的实验装置探究液体压强规律时所测得的部分数据.
- 12微分方程20y∧2-500=y'怎么解,高数上微分方程好像没有含有y的平方项
- 13CoCl2和HCI反应现象是什么
- 14制冷压缩机出口制冷剂的温度为什么会上升
- 15一个大型模板如图7-14所示,设计要求AB与CD相交成30°角,因为交点不在板上,不便测量交角,你能否帮助工人师傅设计一