足量氢氧化钡溶液与碳酸钠溶液混合的方程式和离子方程式~
 鸟忆高飞2022-10-04 11:39:542条回答
鸟忆高飞2022-10-04 11:39:542条回答
已提交,审核后显示!提交回复
共2条回复
 wuyf1155 共回答了23个问题
wuyf1155 共回答了23个问题 |采纳率95.7%- Ba(OH)2 + Na2CO3 === BaCO3(沉淀)+ 2NaOH
Ba 2+ + CO3 2- === BaCO3(沉淀) - 1年前
 spinage88 共回答了298个问题
spinage88 共回答了298个问题 |采纳率- Ba(OH)2+Na2CO3=BaCO3(s)+2NaOH
Ba2+ + CO3 2- = BaCO3(s) - 1年前
相关推荐
- 足量的锌粉跟500mL盐酸反应,产生的氢气在标准下的体积为1.12L,则这种盐酸的物质的量浓度为______
 cougar14121年前3
cougar14121年前3 -
 冰川天侣 共回答了17个问题
冰川天侣 共回答了17个问题 |采纳率82.4%Zn+2HCL=ZnCl2+H2
1.12/22.4=0.05mol
所以用了HCl为0.05*2=0.1mol
0.1/0.5=0.2mol/L
所以浓度为0.2mol/L1年前查看全部
- 足量金属与等质量等溶液质量分数的稀盐酸(硫酸)反应所得氢气质量 那个多?
 pppwh1年前1
pppwh1年前1 -
 nzy008 共回答了17个问题
nzy008 共回答了17个问题 |采纳率94.1%质量相等、质量分数相等,说明二者溶质质量相等,而硫酸相对分子质量是98,每分子硫酸产生1单位的H2;HCl的却只有36.5,每分子产生0.5单位的H2,要产生等量的H2,HCl要两单位,要相对分子质量731年前查看全部
- 碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中,下列说法正确的是( )
碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中,下列说法正确的是( )
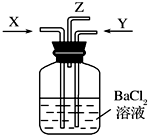 A. 洗气瓶中产生的沉淀是碳酸钡
A. 洗气瓶中产生的沉淀是碳酸钡
B. Z导管出来的气体中无二氧化碳
C. 洗气瓶中产生的沉淀是硫酸钡
D. Z导管口有无色气体出现 jvvlsl1年前1
jvvlsl1年前1 -
 orangezt 共回答了17个问题
orangezt 共回答了17个问题 |采纳率100%解题思路:碳与浓硫酸共热产生的X气体为CO2和SO2的混合气体,铜与浓硝酸反应产生的Y气体是NO2,同时通入时因NO2与水和SO2共同作用要产生SO42-和NO,NO在空气中又会生成NO2,以此解答该题.碳与浓硫酸共热产生的X气体为CO2和SO2的混合气体,CO2和SO2与氯化钡均不反应,故不能生成碳酸钡、亚硫酸钡沉淀;铜与浓硝酸反应产生的Y气体是NO2,SO2+H2O+NO2=H2SO4+NO,硫酸与氯化钡反应产生硫酸钡沉淀,Z处逸出的气体中有CO2和NO,NO遇到空气中的氧气生成了红棕色的NO2.
故选C.点评:
本题考点: 二氧化硫的化学性质;氮的氧化物的性质及其对环境的影响.
考点点评: 本题考查硝酸、浓硫酸的性质以及二氧化硫与二氧化氮等物质的性质题目难度不大,注意相关元素化合物知识的积累.1年前查看全部
- 现有CO和CO2的混合气体25g,跟足量灼热的CuO充分反应,得到33gCO2,计算混合气体中C元素的质量分数
 lfjlfy35122871年前1
lfjlfy35122871年前1 -
 bdbqbdbq 共回答了21个问题
bdbqbdbq 共回答了21个问题 |采纳率95.2%因为混合气体中的一氧化碳完全反应,所以,得到33克二氧化碳所增加的气体重量为氧的重量.
CO+CuO==CO2+Cu CO2------对应-----O
28 44 1 44 1 16
y 22 X 8
X=22克
y=14克
所以混合气体中CO 14克 CO2 11克
所以C的质量分数为=(14*12/28+11*12/44)/25=9/251年前查看全部
- 足量的盐酸与250g碳酸钙反应,生成二氧化碳的质量是多少?
 zhouyanqq1年前1
zhouyanqq1年前1 -
 zhugekongming 共回答了17个问题
zhugekongming 共回答了17个问题 |采纳率88.2%解题思路:利用碳酸钙与盐酸反应的化学方程式和碳酸钙的质量,列出比例式,就可计算出生成二氧化碳的质量.设生成二氧化碳的质量为x,
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
250g x
∴[100/44]=[250g/x]
∴x=[250g×44/100]=110g.
答:生成二氧化碳的质量是110g.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 本题主要考查学生运用化学方程式综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.1年前查看全部
- 取 a g某物质在氧气中完全燃烧,将其产物跟足量的过氧化钠固体完全反应,反应后固体的质量增加小于 a g。下列物质中能满
取 a g某物质在氧气中完全燃烧,将其产物跟足量的过氧化钠固体完全反应,反应后固体的质量增加小于 a g。下列物质中能满足上述结果的是
A.H 2 和 CO B.葡萄糖 C.蔗糖 D.甲酸  liumaoduo1年前1
liumaoduo1年前1 -
 深山小鼠 共回答了21个问题
深山小鼠 共回答了21个问题 |采纳率90.5%D
上述四个选项的物质完全燃烧后产物都是水和二氧化碳,
2Na 2 O 2 +2H 2 O==4NaOH+O 2 ↑ 每个Na 2 O 2 相当于增加了1个H 2
2Na 2 O 2 +2CO 2 ==2Na 2 CO 3 +O 2 ↑ 每个Na 2 O 2 相当于增加了1个CO
所以只要满足CO、H 2 、Cm(H 2 O)n这种最简式的化合物反应后固体的质量均不变,只有D不符合Cm(H 2 O)n1年前查看全部
- 在一定条件下16克A和22克B反应生成4.5克D和C.在相同条件下8克a与足量b生成0.125molc和d.求c的摩尔质
在一定条件下16克A和22克B反应生成4.5克D和C.在相同条件下8克a与足量b生成0.125molc和d.求c的摩尔质量
 gxg4231年前1
gxg4231年前1 -
 wangb0315 共回答了15个问题
wangb0315 共回答了15个问题 |采纳率100%A + B = C + D
16g 22 4.5g
8g 足量 4.5/2
0.125mol
M(C)=2.25/0.125=18
哈哈1年前查看全部
- 已知Co3+的配位数为6,将化学组成为CoCl3·4NH3的紫色固体配制成溶液,向其中加入足量的AgNO3溶液后,只有1
已知Co3+的配位数为6,将化学组成为CoCl3·4NH3的紫色固体配制成溶液,向其中加入足量的AgNO3溶液后,只有1/3的氯从沉淀析出.该配合物的内界含有几个Cl-和几个NH3?
 pas_trop_froid1年前1
pas_trop_froid1年前1 -
 旺旺鸡蛋饼 共回答了24个问题
旺旺鸡蛋饼 共回答了24个问题 |采纳率100%此配合物为:[Co(NH3)4Cl2]Cl,氯化二氯·四氨合钴(III)
1、只有1/3的氯从沉淀析出,说明外界只有一个氯,内界有二个.
2、Co3+的配位数为6,除了四个氨以外还有二个氯在内界.1年前查看全部
- 某饱和一元醇37g跟足量金属钠反应,收集到5.6L的氢气.此醇是
某饱和一元醇37g跟足量金属钠反应,收集到5.6L的氢气.此醇是
答案是C4H9OH! 756181841年前1
756181841年前1 -
 江龙河 共回答了14个问题
江龙河 共回答了14个问题 |采纳率92.9%条件不充分,氢气的体积应注明标准状况下.
假设是在标准状况下,1mol气体的体积是22.4L,5.6L氢气是0.25mol(0.5g),由方程式的定量关系可计算出醇的分子量为74,CnH(n+2)O 12n+2n+2+16=74,n=41年前查看全部
- 向10ML碳酸钠和硫酸钠的混合溶液中啊计入足量的氯化钡溶液,生成陈淀的质量为6.24g,
向10ML碳酸钠和硫酸钠的混合溶液中啊计入足量的氯化钡溶液,生成陈淀的质量为6.24g,
向所得陈淀中加入足量的稀盐酸,陈淀质量减少到2.33g,并放出气体,试计算原混合物中硫酸钠的物质的量的浓度 偶是胖胖呀1年前1
偶是胖胖呀1年前1 -
 迁舒 共回答了24个问题
迁舒 共回答了24个问题 |采纳率95.8%NA2CO3+BACL2=BACO3+2NACL
NA2SO4+BACL2=BASO4+2NACL
152 233
1.52g 2.33g
BACO3+2HCL=BACL2+H2O+CO2
197 44
6.24g- 2.33g=3.91
1.52g/152/0.01L=1MOL/L原混合物中硫酸钠的物质的量的浓度1mol/l1年前查看全部
- 将16g含有杂质的锌粒投入到盛有足量稀硫酸的烧杯中(杂质跟稀硫酸不反应).测得加入锌粒前烧杯和稀硫酸的总质量为200g,
将16g含有杂质的锌粒投入到盛有足量稀硫酸的烧杯中(杂质跟稀硫酸不反应).测得加入锌粒前烧杯和稀硫酸的总质量为200g,反应停止后,烧杯和烧杯内剩余物的总质量为215.6g.求:
(1)反应中生成氢气的质量;______
(2)这16g含杂质的锌粒中金属锌的质量分数.______. 潇然991年前1
潇然991年前1 -
 honzp 共回答了20个问题
honzp 共回答了20个问题 |采纳率90%解题思路:根据题意,由于锌与硫酸反应放出氢气而使锌完全反应前后物质的总质量有所减小,减小的质量即放出氢气的质量,运用质量守恒定律,求出氢气质量;然后由氢气质量,根据反应的化学方程式,计算出含杂质的锌粒中金属锌的质量即可求得含杂质的锌粒中金属锌的质量分数.(1)根据质量守恒定律,反应中生成氢气的质量=16g+200g-215.6g=0.4g;(2)设含杂质的锌粒中金属锌的质量为xZn+H2SO4═ZnSO4+H2↑65&nbs...
点评:
本题考点: 含杂质物质的化学反应的有关计算;根据化学反应方程式的计算.
考点点评: 利用质量守恒定律求出反应放出氢气的质量,是进行后面计算的基础,体现出运用知识分析问题的能力.1年前查看全部
- 化学反应少量,足量,过量,的离子方程式书写原则
化学反应少量,足量,过量,的离子方程式书写原则
比如
少量NaOH和足量Ca(HCO3)2反应
足量NaOH和少量Ca(HCO3)2反应
2者反应式是不同的,我想知道那么写的根据是什么?有其他类似的反应怎么处理?
我们老师讲的是将少量的放在前面,后面的根据前面的离子,把前面的离子反应完
那么第一个是 NaOH + 1/2 Ca(HCO3)2 反应完OH-
第二个是 Ca(HCO3)2 + 2NaOH 反应完HCO3-
两者是一样的.感觉,后者是前者乘以2而已 低烧看客1年前1
低烧看客1年前1 -
 这次我不哭 共回答了19个问题
这次我不哭 共回答了19个问题 |采纳率100%简言之,就是有没有多的东西让你干别的
做这种题时,假设,在溶液里面,高价态的那种我就放一个分子进去,(有些说是分子不怎么妥,毕竟可能不是分子,但只是这么思考而已),然后低价位的那中,我再一个分子一个分子的放
比如,该题,溶液里我就放一个Ca(HCO3)2分子,
第一种情况不是少量吗,好,就放一个NaOH,这种情况就是反应完OH-
第二种情况是过量,那我就多放几个NaOH,多放几个就会反应完HCO3-了
注意:要这么想象,Ca(HCO3)2我就放一个.然后,NaOH, 我就一个一个的往里面丢,应该会怎么变化.
面对这少量,足量,过量的问题,你都可以这么想.1年前查看全部
- 6克铁与某金属的混合物跟足量的稀硫酸反应,放出0.2克氢气,则铁中混有的金属是什么
6克铁与某金属的混合物跟足量的稀硫酸反应,放出0.2克氢气,则铁中混有的金属是什么
有4个选项
A Mg
B Zn
C Ca
D Na 冷锋991年前3
冷锋991年前3 -
 zhshkhyy 共回答了18个问题
zhshkhyy 共回答了18个问题 |采纳率83.3%Fe+H2SO4==FeSO4+H2
56g 2g
5.6g 0.2g
如果只有铁与稀硫酸反应,生成0.2克H2,则只需要铁56克
而混合物质量是6克,5.61年前查看全部
- 1.在CO 和 CO2的混合气体中.氧元素的质量分数是64%,将该气体5g通过足量CUO粉末,完全反映后,气体通入足量的
1.在CO 和 CO2的混合气体中.氧元素的质量分数是64%,将该气体5g通过足量CUO粉末,完全反映后,气体通入足量的澄清的石灰水,得到白色沉淀多少?
简要说明过程.
2.碘的某种氧化物可以测空气中CO的污染程度,该氧化物 一个分子可以将5个CO分子氧化为5个CO2分子,同时生成1个I2分子.该碘氧化物化学式? chenpcb1年前1
chenpcb1年前1 -
 a5426599 共回答了22个问题
a5426599 共回答了22个问题 |采纳率95.5%15g
I2O51年前查看全部
- (2013•天津)现将10g A和足量B混合加热,A和B发生化学反应,10g A完全反应后生成8g C和4g D,则参加
(2013•天津)现将10g A和足量B混合加热,A和B发生化学反应,10g A完全反应后生成8g C和4g D,则参加反应的A和B的质量比是( )
A.1:1
B.2:1
C.4:1
D.5:1 qun10241年前1
qun10241年前1 -
 kongchao0055 共回答了8个问题
kongchao0055 共回答了8个问题 |采纳率75%解题思路:由题意可知,反应物是A和B,生成物是C和D,根据质量守恒定律可以求出参加反应的B的质量,进而求出参加反应的A和B的质量比.10gA完全反应后生成8gC和4gD,由质量守恒定律可知,参加反应的B的质量为2g,故参加反应的A和B的质量比是10g:2g=5:1.
故选D.点评:
本题考点: 质量守恒定律及其应用;常见化学反应中的质量关系.
考点点评: 本题解题的关键是运用化学中的基本思想:质量守恒思想.1年前查看全部
- 取25G大理石(主要成分为CACO3)加入足量盐酸,待反应完全后共收集到8.8G二氧化碳假设杂质不与盐酸反应,试求大理石
取25G大理石(主要成分为CACO3)加入足量盐酸,待反应完全后共收集到8.8G二氧化碳假设杂质不与盐酸反应,试求大理石中碳酸钙的质量分数?
 zpxxgq1年前1
zpxxgq1年前1 -
 wenlongliao 共回答了21个问题
wenlongliao 共回答了21个问题 |采纳率90.5%CaCO3+2HCl=CaCl2+H2O+CO2
100 44
x 8.8g
100/x=44/8.8g
x=20g
20g/25g*100%=80%1年前查看全部
- 铜粉和铁粉的混合物20克,加入足量的20%的硫酸溶液,待完全反应后,得到氢气0.2 克.
铜粉和铁粉的混合物20克,加入足量的20%的硫酸溶液,待完全反应后,得到氢气0.2 克.
问:⑴混合物中铁为多少克 ⑵要使混合物中的铁完全反应,至少需20%的硫酸溶液多少克 zyzcb1年前1
zyzcb1年前1 -
 好好点 共回答了16个问题
好好点 共回答了16个问题 |采纳率81.3%铜不反应,只有铁反应
1.关系式:Fe---H2
56 2
x 0.2
得:m(Fe)=x=5.6 g
2.Fe + H2SO4 ==FeSO4 + H2
98 2
y 0.2
得:y=9.8 g
所以至少需H2SO4溶液质量=9.8/0.2=49 g1年前查看全部
- 标准状况下,0.56L CH4和C2H4的混合气体通入足量溴水中,溴水增重0.28g(假设C2H4完全被吸收)
标准状况下,0.56L CH4和C2H4的混合气体通入足量溴水中,溴水增重0.28g(假设C2H4完全被吸收),则乙烯占混合气体体积的( )
A. 20%
B. 40%
C. 60%
D. 80% 逆风的小丑1年前1
逆风的小丑1年前1 -
 japson 共回答了23个问题
japson 共回答了23个问题 |采纳率82.6%解题思路:乙烯具有双键,性质较活泼,能和溴水发生加成反应,甲烷较稳定,不和溴水反应,所以溴水增重的质量为乙烯的质量,根据V=nVm=
Vm计算乙烯的体积,再根据m M
×100%计算即可.V(乙烯) V(混合气体) 乙烯具有双键,性质较活泼,能和溴水发生加成反应,甲烷较稳定,不和溴水反应,所以溴水增重的质量为乙烯的质量.
乙烯的体积为:V=nVm=
m
M×Vm=
0.28g
28g/mol×22.4L/mol=0.224L;
乙烯占混合气体体积的
0.224L
0.56L ×100%=40%;
故选B.点评:
本题考点: 乙烯的化学性质;化学方程式的有关计算;甲烷的化学性质.
考点点评: 本题以乙烯为载体考查了物质的量的有关计算,难度不大,明确溴水增重的物质是解本题的关键.1年前查看全部
- 在ch3coona溶液中加入足量ch3cooh,可使na离子与ch3coo根离子浓度相等吗?
 tina874261年前2
tina874261年前2 -
 echoleejin 共回答了15个问题
echoleejin 共回答了15个问题 |采纳率80%可以,1年前查看全部
- 200℃时,11.6g由二氧化碳和水组成的混合气体与足量过氧化钠充分反应后,固体质量增加3.6g,则原混合气体的平均相对
200℃时,11.6g由二氧化碳和水组成的混合气体与足量过氧化钠充分反应后,固体质量增加3.6g,则原混合气体的平均相对分子质量为?
 angelalzn1年前1
angelalzn1年前1 -
 清醒糊涂 共回答了17个问题
清醒糊涂 共回答了17个问题 |采纳率88.2%解题思路:200℃时水为气态,向足量的固体Na2O2中通入11.6gCO2和H2O,发生反应方程式为:2Na2O2+2CO2=Na2CO3+O2、2Na2O2+2H2O=4NaOH+O2↑,固体只增加了3.6g,是因为生成O2,根据质量守恒定律可知m(O2)=11.6g-3.6g=8g,根据n=[n/M]计算生成氧气的物质的量,根据方程式可知n(混合气体)=2n(O2),进而计算原混合气体的平均相对分子质量.200℃时水为气态,向足量的固体Na2O2中通入11.6gCO2和H2O,发生反应方程式为:2Na2O2+2CO2=Na2CO3+O2、2Na2O2+2H2O=4NaOH+O2↑,固体只增加了3.6g,是因为生成O2,根据质量守恒定律可知m(O2)=11.6g-3.6g=8g,氧气的物质的量为:n(O2)=[8g/32g/mol]=0.25mol,
根据方程式2Na2O2+2CO2=Na2CO3+O2、2Na2O2+2H2O=4NaOH+O2↑可知:n(混合气体)=2n(O2)=2×0.25mol=0.5mol,
所以原混合气体的平均摩尔质量为:[11.6g/0.5mol]=23.2g/mol,故混合气体的平均相对分子质量为23.2,
答:原混合气体的平均相对分子质量为23.2g.点评:
本题考点: 有关混合物反应的计算.
考点点评: 本题考查有关混合物反应的计算、过氧化钠的性质等,题目难度中等,明确固体质量变化的原因是解答本题的关键,注意掌握根据化学反应进行的化学计算的方法.1年前查看全部
- 足量的铁粉与50g稀硫酸反应生成0.2g氢气,则所用稀硫酸的溶质质量分数是多少?
 verglas_yiyi1年前1
verglas_yiyi1年前1 -
 karenkam 共回答了26个问题
karenkam 共回答了26个问题 |采纳率84.6%Fe + H2SO4 === FeSO4 + H2↑
98 2
x 0.2g
98/x=2/0.2g
x=9.8g
9.8g/50g*100%=19.6%1年前查看全部
- 实验室用锌跟足量的稀盐酸(HCl)反应,可制得氯化锌和氢气.如果用65g的锌,可制得氢气多少克?
 珠儿01年前1
珠儿01年前1 -
 fenghui_l 共回答了17个问题
fenghui_l 共回答了17个问题 |采纳率82.4%解题思路:由锌的质量根据锌与稀盐酸反应的化学方程式结合锌的质量可以计算出生成氢气的质量.设生成氢气的质量为x
Zn+2HCl═ZnCl2+H2↑
65 2
65g x
[65/65g]=[2/x]
解得:x=2g
答:可制得氢气2克.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 本题主要考查有关化学方程式的计算,难度较小,注重基础.1年前查看全部
- 5.85g NaCl样品(其中含少量下列一种盐类),当它跟足量硝酸银溶液充分反应后,得到白色沉淀14.5g,则可能混入的
5.85g NaCl样品(其中含少量下列一种盐类),当它跟足量硝酸银溶液充分反应后,得到白色沉淀14.5g,则可能混入的盐是( )
A. KCl
B. CaCl2
C. MgCl2•10H2O
D. AlCl3 火凤凰与猫头鹰1年前3
火凤凰与猫头鹰1年前3 -
 gengqngyi 共回答了28个问题
gengqngyi 共回答了28个问题 |采纳率96.4%解题思路:先假设5.85g样品全部是氯化钠,根据化学方程式计算出生成沉淀的质量,如果实际生成的沉淀质量>假设5.85g全部是氯化钠时生成的沉淀质量,则说明杂质物质中氯元素的质量分数要大于氯化钠中氯元素的质量分数.假设5.85克样品全部都是NaCl,根据方程式计算跟足量硝酸银反应生成氯化银的质量为m
NaCl+AgNO3═AgCl↓+NaNO3
58.5 143.5
5.85g m
[58.5/143.5=
5.85g
m] 解得:m=14.35g
由计算可知,实际生成的沉淀14.5g>假设5.85g全部是氯化钠时生成的沉淀14.35g.
如果多生成沉淀的话,则应该样品中的氯离子数应该是比纯的氯化钠含有的氯离子数多,分析四个选项,则CaCl2和AlCl3含的氯离子的质量比同质量的氯化钠的氯离子的质量高.所以,B、D正确,A、C错误.
故选:BD.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 本题主要考查学生灵活运用化学方程式和元素的质量分数解答问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力1年前查看全部
- 某一元醇A10g,跟足量乙酸反应,生成乙酸酯11.17g,已知醇的转化率为82%,则A的相对分子质量约为
某一元醇A10g,跟足量乙酸反应,生成乙酸酯11.17g,已知醇的转化率为82%,则A的相对分子质量约为
[ ]
A.88 B.102 C.116 D.166 goldenfox_qi1年前1
goldenfox_qi1年前1 -
 班尼鲁 共回答了13个问题
班尼鲁 共回答了13个问题 |采纳率84.6%因为醇的转化率为82%,所以有10*0.82=8.2g的醇反应
设该醇分子式R-OH,R的相对分子质量为X
所以
R-OH+CH3COOH→CH3COOR+H2O
解得X=99g
所以该醇的相对分子质量=99+17=116
答案选C1年前查看全部
- 海水中富含大量的金属元素.现有海水样品(含NaCl、MgCl 2 、CaCl 2 )400g,加入足量澄清石灰水,充分反
海水中富含大量的金属元素.现有海水样品(含NaCl、MgCl 2 、CaCl 2 )400g,加入足量澄清石灰水,充分反应后得沉淀1.16g.
(1)求海水样品中MgCl 2 的质量分数.
(2)向过滤后的沉淀中加入71g溶质质量分数为2%的稀盐酸,恰好完全反应.所得溶液中溶质是______,该溶液的总质量为______g.(计算结果保留2位小数) 风知我心1年前1
风知我心1年前1 -
 zrj4208 共回答了20个问题
zrj4208 共回答了20个问题 |采纳率95%(1)设设海水样品中MgCl 2 的质量为x
MgCl 2 +Ca(OH) 2 ═Mg(OH) 2 ↓+CaCl 2
95 58
x 1.16g
95
x =
58
1.16g
x=1.9g
海水样品中氯化镁的质量分数=
1.9g
400g ×100 %=0.48%
答:MgCl 2 的质量分数为0.48%.
(2)氢氧化镁与盐酸反应生成氯化镁和水,所得溶液的溶质是氯化镁.
所得溶液的质量=71g+1.16g=72.16g
故答案为:氯化镁; 72.16g1年前查看全部
- 一种不纯的铁,已知它含有铜、铝、钙、镁等金属中的一种或几种,5.6g这样的铁跟足量的稀硫酸作用,生成氢气2.24L(标准
一种不纯的铁,已知它含有铜、铝、钙、镁等金属中的一种或几种,5.6g这样的铁跟足量的稀硫酸作用,生成氢气2.24L(标准状态),则铁块中一定含有的金属杂质是______.
解释下,谢谢! ya123ya1年前4
ya123ya1年前4 -
 goodto1 共回答了18个问题
goodto1 共回答了18个问题 |采纳率77.8%必须要有铜啊.
2.24L氢气是0.1mol,生成的是0.1mol氢气,则若反应物都是铁,就刚好是0.1mol也就是5.56g.因为这是不纯的铁,所以必须要有一种元素在5.56g能够生成氢气比铁多,一种比铁少,铝,钙,镁都比铁多,则是任何一种都可以,而比铁少的只有铜,所以必须要铜1年前查看全部
- .1mol 乙醛与足量新制 Cu(OH)2 悬浊液反应,转移电子数目为
 产_权1年前1
产_权1年前1 -
 骆骆无为 共回答了14个问题
骆骆无为 共回答了14个问题 |采纳率92.9%1mol 乙醛与2mol Cu(OH)2 反应,
Cu的化合价从+2下降到+1,
所以转移电子数目为2mol *(2-1)==2mol,或者2NA个1年前查看全部
- 向足量碳酸氢钡溶液中逐渐滴加硫酸氢钠溶液离子方程式
 林之冬阳1年前2
林之冬阳1年前2 -
 妖女托托 共回答了17个问题
妖女托托 共回答了17个问题 |采纳率94.1%硫酸氢钠溶少量
Ba(HCO3) 2+ NaHSO4 = NaHCO3 +CO2 + BaSO4 + H20
因为
硫酸氢钠溶少量
只能和一份的Ba(HCO3) 2的HCO3反应1年前查看全部
- 某溶液中可能含有SO42-,S2-,CO32-离子中的一种或数种,取此溶液加入足量氯化钡溶液时,有白色沉淀生成,然后加入
某溶液中可能含有SO42-,S2-,CO32-离子中的一种或数种,取此溶液加入足量氯化钡溶液时,有白色沉淀生成,然后加入足量稀盐酸,沉淀部分溶解,同时有无色,无刺激性气味的气体生成,则溶液中含有的离子推断?
 asdfasdf4441年前1
asdfasdf4441年前1 -
 raduy 共回答了21个问题
raduy 共回答了21个问题 |采纳率90.5%肯定有SO42-和CO32-
因为生成无色,无刺激性气味的气体(CO2),所以有CO32-
不可能有 S2-,因为H+会与S2-结合生成H2S气体,有臭鸡蛋味.
又因为有部分沉淀溶解,所以生成的沉淀为BaCO3和BaSO4
因为BaSO4不溶于盐酸而BaCO3溶于盐酸
所以含有SO42-
综上,含有SO42-和CO32-,没有S2-.1年前查看全部
- (8分)一个重100g的洁净烧瓶中,加入两种饱和一元醛A和B的混合液2.55g,向混合液中加入足量的银氨溶液,并水浴加热
(8分)一个重100g的洁净烧瓶中,加入两种饱和一元醛A和B的混合液2.55g,向混合液中加入足量的银氨溶液,并水浴加热,经充分反应后,过滤、仔细洗涤、干燥,称得瓶和固体质量共110.8g。已知B比A的相对分子质量大14。求:
(1)写出A和B的结构简式;(2)求A和B的物质的量之比。 hz_cmin1年前1
hz_cmin1年前1 -
 xiatiandeyu 共回答了16个问题
xiatiandeyu 共回答了16个问题 |采纳率93.8%(1) CH 3 CHO CH 3 CH 2 CHO (2) 1:1
略1年前查看全部
- 向FeCl3和AlCl3混合溶液中先加入过量的NaI溶液,再加入足量的Na2S溶液,可生成FeS、S和Al(OH)3
向FeCl3和AlCl3混合溶液中先加入过量的NaI溶液,再加入足量的Na2S溶液,可生成FeS、S和Al(OH)3
问为什么会有Al(OH)3和FeS?还有Al2S3和Fe2S3为什么不可以?
请写出具体的方程式 nanli11年前2
nanli11年前2 -
 宝贝爱佬公 共回答了11个问题
宝贝爱佬公 共回答了11个问题 |采纳率90.9%主要是碘离子有还原性,会把三价的Fe,还原为二价
而硫化铝在水中完全水解生成氢氧化铝沉淀和硫化氢
所以你所说的两个都是不会产生的
我帮你写出离子方程式
先产生二价铁
2Fe3+ + 2I- ==2Fe2+ + I2
再二价铁和硫离子反应
Fe2+ + S2- =FeS
关于铝的
2Al3+ + 3S2- =A l2S3
再水解
Al2S3 +6H2O=2Al(OH)3 + 3H2S
然后再鄙视一下楼上的,回答问题和分数又没关系1年前查看全部
- 1L0.1mol/L稀HNO3外加足量稀H2SO4能溶解多少Cu?请写出详细过程,谢谢!
 几棵树和蜗牛看花1年前1
几棵树和蜗牛看花1年前1 -
 mrjk 共回答了22个问题
mrjk 共回答了22个问题 |采纳率95.5%使用离子方程式算因为Cu加稀HNO3后硝酸根还有 会与稀H2SO4中的H离子再结合生成硝酸再与铜反应所以要用离子方程式 写出后比一下即可1年前查看全部
- 氧化铜和铜混合物20克加热使其与足量一氧化碳充分反应后气体全通足澄清石灰水中得白色沉淀10克原混合物铜
氧化铜和铜混合物20克加热使其与足量一氧化碳充分反应后气体全通足澄清石灰水中得白色沉淀10克原混合物铜
你能详细点给我说说吗?氧化铜和铜混合物20克加热使其与足量一氧化碳充分反应后气体全通足澄清石灰水中得白色沉淀10克原混合物铜的质量 sk171131年前3
sk171131年前3 -
 SHADOUDOUO66 共回答了20个问题
SHADOUDOUO66 共回答了20个问题 |采纳率90%CO2+ Ca(OH)2 == CaCO3 + H2O
44 100 质量数
可求出 CO2 质量为 4.4g
CuO + CO == Cu + CO2
80 44 质量数
可求出 CuO质量为 8g
所以Cu 是12g
初学化学的话这个方法挺好用1年前查看全部
- NaAlO2溶液中通入少量CO2、足量CO2的化学方程式
 可可西里1111年前2
可可西里1111年前2 -
 huanglinkang 共回答了11个问题
huanglinkang 共回答了11个问题 |采纳率90.9%NaAlO2+CO2+H2O=NaHCO3+Al(OH)3↓ (CO2过量)
2NaAlO2+CO2+3H2O=Na2CO3+2Al(OH)3↓ (CO2少量)1年前查看全部
- 将mg铝铁合金分成两等份一份与足量盐酸充分反应收集到标准状况下氢气体积为17.92L另一份与足量的氢氧化钠充分反应收到1
将mg铝铁合金分成两等份一份与足量盐酸充分反应收集到标准状况下氢气体积为17.92L另一份与足量的氢氧化钠充分反应收到1.2g氢气球M值.
 脆弱的鱼儿1年前5
脆弱的鱼儿1年前5 -
 科学163 共回答了17个问题
科学163 共回答了17个问题 |采纳率82.4%铁与NaOH不反应
这两种金属反应产物化合价分别是+2、+3
对应的,置换出的氢原子对应的系数就是2和3
设n(Fe) = xmol n(Al) = y mol
56x + 27y = m
2x + 3y = 17.92 * 2 / 22.4
3y = 1.2 * 2 / 2
(2、3式氢物质的量乘2的原因是1个氢气分子占2个氢原子)
解出以上3个方程得:
x = 0.2 mol
y = 0.4 mol
m = 22 g1年前查看全部
- 将标准状况下5.6L氯化氢气体溶于蒸馏水制成100ml溶液 密度为1.1g /ml 向其中加入足量的锌来制取氢气.
将标准状况下5.6L氯化氢气体溶于蒸馏水制成100ml溶液 密度为1.1g /ml 向其中加入足量的锌来制取氢气.
试回答1.盐酸的物质的量浓度时多少?
2.标准状况下能制的氢气多少L?
3.盐酸的质量分数是多少? xiaojin2001年前1
xiaojin2001年前1 -
 qingxingleleng06 共回答了18个问题
qingxingleleng06 共回答了18个问题 |采纳率83.3%1.氯化氢物质的量0.25mol,溶液体积0.1L,所以物质的量浓度为2.5mol/L
2.两分子氯化氢对应一分子氢气,所以氢气体积为氯化氢的一半2.8L
3.溶质质量0.25×36.5=9.125g 溶液质量=体积×密度=110g
质量分数约为8.30%1年前查看全部
- 问一道有关浮力的问题把质量158克的实心铁球投入足量的水中,静止后它受到的浮力为多少?将该铁球投入足量水银中,静止后受浮
问一道有关浮力的问题
把质量158克的实心铁球投入足量的水中,静止后它受到的浮力为多少?将该铁球投入足量水银中,静止后受浮力为多少牛顿?(铁的密度为7.9乘以10的三次方千克每立方米,g为10牛顿每千克) 小小爱321年前2
小小爱321年前2 -
 灿烂宝宝 共回答了15个问题
灿烂宝宝 共回答了15个问题 |采纳率93.3%[思路分析]
首先根据铁球的质量和密度求出该铁球的体积,由于铁的密度大于水的密度,而小于
水银的密度,所以铁球投入足量水中,将下沉,排开的水的体积就是铁球的体积,投入足量水银中,
则处于漂浮状态,此时铁球受到的浮力就等于铁球本身的重力.
[解题过程]
铁的密度为铁的密度7.9克/立方厘米
实心铁球的体积为158/7.9=20立方厘米
所以投入水中后受到的浮力大小为
F1=p水Vg=1000*(20*10^-6)*10=0.2N
水银的密度为13.6克/厘米^3>7.9克/立方厘米
所以铁球投入水银中后要漂浮,所以
铁球在水银中受到的浮力大小为
F2=0.158*10=1.58N1年前查看全部
- 在同温同压下,把等体积的空气和二氧化碳混合,在高温下跟足量的焦炭充分反应.若氧气和二氧化碳都转化为一氧化碳,则反应后气体
在同温同压下,把等体积的空气和二氧化碳混合,在高温下跟足量的焦炭充分反应.若氧气和二氧化碳都转化为一氧化碳,则反应后气体中一氧化碳的体积分数约是( )
A. 0.75
B. 0.70
C. 0.64
D. 0.60 1331581年前1
1331581年前1 -
 lyl7102 共回答了11个问题
lyl7102 共回答了11个问题 |采纳率90.9%解题思路:发生反应2C+O2
2CO、C+CO2高温 .
2CO,令空气和二氧化碳的体积分别为1L,根据空气中氧气约占空气体积的[1/5]算出氧气的体积,再根据方程式计算氧气、二氧化碳反应生成CO的体积及反应后气体体积增大量,进而计算CO的体积分数.高温 .令空气和二氧化碳的体积分别为1L,则氧气的体积为1L×[1/5]=0.2L,
2C+O2
高温
.
2CO 体积增大
1 22-1=1
0.2L0.4L 0.2L
C+CO2
高温
.
2CO 体积增大
1 2 2-1=1
1L 2L 1L
故反应后V(CO)=0.4L+2L=2.4L,反应后气体总体积为1L+1L+0.2L+1L=3.4L,
则反应后气体中一氧化碳的体积分数约是[2.4L/3.2L]=0.75,
故选A.点评:
本题考点: 化学方程式的有关计算.
考点点评: 本题考查混合物计算、根据方程式计算,难度不大,计算混合后气体的体积是关键,注意差量法的运用.1年前查看全部
- 初中物理竞赛题将一个空心铁球投入足量稀硫酸中,充分反应后,容器底受到的压强减少500帕,求空心铁球刚放入稀硫酸中时受到的
初中物理竞赛题
将一个空心铁球投入足量稀硫酸中,充分反应后,容器底受到的压强减少500帕,求空心铁球刚放入稀硫酸中时受到的浮力.答案等于56N,求过程,请各位大虾帮忙. 恩雷1年前4
恩雷1年前4 -
 hiand234 共回答了20个问题
hiand234 共回答了20个问题 |采纳率90%我觉得应该是,遵循质量守恒,和化学中的反应前后质量不变,减少的500帕,应该是氢气的质量,Fe+H2SO4=====FeSO4+H2 就是放出的氢气的压强是500帕P=F/S就是说那些氢气的重力是500*S,重力加速度按a算,那么铁的质量就能算出来56/?=2/((500*s)/a),算出?就是铁的质量具体下面是怎样就想不出来,
不过你给出的答案是铁的摩尔质量56,应该是从化学方面入手.
好多年了都忘记了.1年前查看全部
- 足量的稀盐酸与镁、锌、铁反应,当放出的氢气质量相同时,参加反应的镁、锌、铁的质量比为
 黄山之斌1年前2
黄山之斌1年前2 -
 新新VS都都 共回答了17个问题
新新VS都都 共回答了17个问题 |采纳率88.2%因为题目中所有元素在化合物中均为+2价,所以,我们可以设金属为R,
R+2HCl=RCl2+H2↑
R 2
X m
X=Rm/2
可见,当氢气质量相同时,参加反应的金属质量与相对原子质量成正比.
结果:24:65:561年前查看全部
- 足量二氧化碳通入次氯化钙溶液中的离子方程式和化学方程式
足量二氧化碳通入次氯化钙溶液中的离子方程式和化学方程式
-0- zouhuikings1年前1
zouhuikings1年前1 -
 sophiechu 共回答了21个问题
sophiechu 共回答了21个问题 |采纳率100%Ca(ClO)2+CO2+H2O=CaCO3+2HClO
Ca2+ +2ClO+CO2+H2O=CaCO3+2HCl1年前查看全部
- 2.1g铜跟足量的2.0mol/L稀硝酸完全反应.计算生成NO的体积.反应消耗稀硝酸多少毫升?
 酷哥P1年前1
酷哥P1年前1 -
 上风铃 共回答了17个问题
上风铃 共回答了17个问题 |采纳率88.2%Cu与稀硝酸反应,3Cu+8HNO3=3Cu(NO3)2+4H2O+2NO.Cu消耗8/3HNO3.Cu:2.1/64mol.所以硝酸7/80mol.消耗硝酸体积(7/80)/2=7/160=0.04375L=43.75ml.1年前查看全部
- 4.35gMnO2 与 含HCl 0.4 mol的浓盐酸混合加热 反应够加入足量硝酸银溶液 生成了白色沉淀 求:
4.35gMnO2 与 含HCl 0.4 mol的浓盐酸混合加热 反应够加入足量硝酸银溶液 生成了白色沉淀 求:
被氧化的盐酸是多少摩尔?
什么叫被氧化的盐酸啊 没教过 plspay2me1年前2
plspay2me1年前2 -
 bb_zhu 共回答了21个问题
bb_zhu 共回答了21个问题 |采纳率95.2%反应中,盐酸既是酸,又是还原剂.
被氧化的盐酸就是指发生氧化反应得到氯气的这部分盐酸.
二氧化锰物质的量:4.35/87=0.05mol
MnO2 + 4HCl(浓)= MnCl2+ 2H2O + Cl2 ↑(条件加热)
1 4 1
0.05 0.4(过量)
MnO2——Cl2 ——2HCl
产生的氯气物质的量:0.05mol,
被氧化的盐酸为0.1摩尔1年前查看全部
- 11.9克铝,铁,铜,混合物,与足量的稀硝酸反应生成标况下一氧化氮,6.72升再加入足量氢氧化钠溶液是金属离子完全变成沉
11.9克铝,铁,铜,混合物,与足量的稀硝酸反应生成标况下一氧化氮,6.72升再加入足量氢氧化钠溶液是金属离子完全变成沉淀,问生成沉淀的值是,
 fjljxc1年前3
fjljxc1年前3 -
 guoxue 共回答了18个问题
guoxue 共回答了18个问题 |采纳率83.3%设铝,铁,铜的物质的量分别为,X,Y,Z mol,设生成的沉淀质量为 M 克
因为 铝,铁,铜,混合物 质量为 11.9克
所以
27X + 56Y + 64Z = 11.9 -----------------(1)
生成一氧化氮的物质的量为:6.72 / 22.4 = 0.3 mol
2Al + 8HNO3 (稀)== 2Al(NO3)3 + 2NO↑ + 4H2O
2------------------------------------------2
Xmol-------------------------------------Xmol
所以铝生成 Xmol NO
Fe + 4HNO3 == Fe(NO3)3 + NO↑ + 2H2O
1-------------------------------------1
Y mol--------------------------------Y mol
所以Fe生成 Ymol NO
3Cu + 8HNO3(稀) == 3Cu(NO3)2 + 2NO↑+ 4H2O
3---------------------------------------------2
Z mol---------------------------------------(2/3) Z mol
所以Cu生成(2/3) Z molNO
所以 X + Y + (2/3) Z = 0.3 -------------(2)
生成沉淀的物质为:Al(OH),Fe(OH)3,Cu(OH)2
所以
沉淀的质量为:
78X + 107Y + 98Z = M ----------------(3)
所以只有结合三个方程式 求出M 即可
(3)式 - (1)式 得
51X + 51 Y + 34Z = (M - 11.9 ) ----------(4)
将(4)式两边同时除以51得
X + Y + (2/3) Z = (M - 11.9 ) / 51 -------------(4)
这时不妨看看(2)式 就可以得到
(M - 11.9 ) / 51 = 0.3
得
M=27.2 克
所以沉淀的质量是 27.2 克1年前查看全部
- 某碳酸钙与碳酸氢钙的混合物跟足量盐酸 消耗H+和产生CO2的物质的量之比为5:4 该混合物中碳酸钙与碳酸氢钙
某碳酸钙与碳酸氢钙的混合物跟足量盐酸 消耗H+和产生CO2的物质的量之比为5:4 该混合物中碳酸钙与碳酸氢钙
的物质的量之比是多少 SIYUE8402051年前1
SIYUE8402051年前1 -
 lyjchly 共回答了22个问题
lyjchly 共回答了22个问题 |采纳率86.4%解设该混合物中含碳酸钙与碳酸氢钙的物质的量分别为X、Y
CaCO3 + 2HCl =CaCl2 + H2O + CO2↑
1 2 1
X 2X X
Ca(HCO3)2 + 2HCl =CaCl2 + 2H2O + 2CO2↑
1 2 2
Y 2Y 2Y
则(2X+2Y):(X+2Y)=5:4
X:Y=2:3
答:该混合物中含碳酸钙与碳酸氢钙的物质的量之比为2:31年前查看全部
- 实验室中需要标准状况下11.2升的二氧化碳,现在含碳酸钙99%的石灰石与250毫升足量的稀盐酸反应,该石灰石中的杂质不与
实验室中需要标准状况下11.2升的二氧化碳,现在含碳酸钙99%的石灰石与250毫升足量的稀盐酸反应,该石灰石中的杂质不与盐酸反应,问至少需要含碳酸钙90%的石灰石多少克?
 170355411年前4
170355411年前4 -
 装靓宝宝 共回答了18个问题
装靓宝宝 共回答了18个问题 |采纳率94.4%11.2 L 0.5 mol
CaCO3 + 2 H+ = Ca2+ + H2O + CO2(气体)
0.5 mol 0.5 mol
0.5 mol / 90% * 100 g/mol = 55.6 g
答案:55.6g1年前查看全部
- 有关Na的计算题由钠、镁、铝三种金属中的两种组成的混合物共10克,跟足量的盐酸反应,生成0.5克标况下的氢气,则此混合物
有关Na的计算题
由钠、镁、铝三种金属中的两种组成的混合物共10克,跟足量的盐酸反应,生成0.5克标况下的氢气,则此混合物中必定含有( )
A.AL
B.MA
C.NA
D.都不可能含有 fengyun_haha1年前3
fengyun_haha1年前3 -
 sky5217 共回答了18个问题
sky5217 共回答了18个问题 |采纳率77.8%选C
列方程式``
2Al+6HCl=2AlCl3+3H2↑
Mg+2HCl=MgCl2+H2↑
2Na+2HCl=2NaCl+H2↑
分三步``假设这个物质全为一种金属`
根据第一个方程``把氢质量为0.5g带进去算``
算出来Al质量为4.5g
根据第二个``算出来Mg质量为6g``
第三个``算出来Na质量为11.5g``
那就想``这混合物得有10克啊``你要是Al和Mg``怎么平均也不能为10克啊```所以必须得有Na在里面啊```
所以选C``
回答完毕``谢谢``
如有不懂就继续问哈```^-^``1年前查看全部
- 某化工厂排出的澄清废水中,加入BaCl2溶液产生白色沉淀,再加入足量稀硝酸,沉淀部分溶解,并放出能使澄清石灰水变浑浊的气
某化工厂排出的澄清废水中,加入BaCl2溶液产生白色沉淀,再加入足量稀硝酸,沉淀部分溶解,并放出能使澄清石灰水变浑浊的气体,下列说法正确的是:
1.废液中一定有CO3(2-) 2.废液中有H2SO4
3.废液中一定有Ag+ 4.废液中一定有SO4(2-)
答案是1和4,可是我不明白为什么说1和3不行呢? lyyong12341年前1
lyyong12341年前1 -
 doudoufly 共回答了22个问题
doudoufly 共回答了22个问题 |采纳率90.9%“俊狼猎英”团队为您解答.
分析:通过“再加入足量稀硝酸,沉淀部分溶解,并放出能使澄清石灰水变浑浊的气体”可知,溶液中一定含有CO3(2-),那么如果有CO3(2-)的话,就一定没有H2SO4和Ag+,因为CO3(2-)和酸是不能共存的(反应会产生二氧化碳),CO3(2-)和Ag+结合会变成碳酸银沉淀,如果没有Ag+的话,那么再加入足量稀硝酸,沉淀部分溶解,说明有不溶于硝酸的沉淀,就不是氯化银,而是硫酸钡沉淀了,所以溶液中一定含有SO4(2-),明白么?不明白可以追问!1年前查看全部
- 为什么碳酸钠溶液中通足量二氧化碳会生成碳酸氢钠
 窝火了1年前1
窝火了1年前1 -
 侯金利 共回答了11个问题
侯金利 共回答了11个问题 |采纳率100%碳酸根是弱酸根,结合氢离子的能力很强.而通入多量二氧化碳后,生成碳酸,氢离子逐渐增多,逐渐被碳酸根离子结合,成为碳酸氢根.即:生成碳酸氢钠1年前查看全部
大家在问
- 1一位古希腊科学家曾说:“给我一个支点,我将撬动整个地球!”这位科学家是 [
- 2在探究凸透镜成像规律的实验中,当蜡烛距透镜20cm时,光屏上得到清晰等大的像,则该透镜的焦距是________cm.增大
- 3观察给定的分式是 :1/x,--2/x的平方,4/x的3次方,--8/x4次方……,猜想并探索归率,第10个是什么,第n
- 4关于遵循事物规律的成语如水到渠成、风吹草动、瓜熟蒂落等!
- 5生殖细胞的基因类型什么意思?
- 6在四边形abcd中,小明:ab平行于cd,小丽∠b=∠d,小亮:ad平行于bc(1)请你用小明小丽小亮中任何两人所给的事
- 7干细胞是一种尚未充分分化的未成熟的细胞,它具有再生各种细胞、器官的潜能,医学家们正尝试利用干细胞治疗一些顽疾,用骨髓移植
- 8如图所示,把一个装有空气的瓶子倒着放在装有密度较大的红棕色的二氧化氮气体的瓶子上,使两瓶口相对,两瓶口之间用一块玻璃板隔
- 9(2014•滨湖区二模)分解因式(x-1)2-1的结果是( )
- 10读“某地等高线地形图”,回答:(1)图中所示地区最高处的高度大约是______米以上,F处与N处的相对高度是______
- 11在数列(an)和(bn)中a1=2,且对于任意自然数n,an+1=2an,bn是an与an+1的
- 12Henry took ages to answer the door.翻译成中文.
- 13be worried about =worried about 还是 be worry about =worried a
- 14设数列{a n }、{b n }、{c n }满足:b n =a n -a n +2 ,c n =a n +2a n +
- 15《西游记》写作背景50字
