在80℃时,0.40mol的N2O4气体充入2L固定容积的密闭容器中发生如下反应:N2O4(g) ==2NO2(g) Δ
 q49492022-10-04 11:39:542条回答
q49492022-10-04 11:39:542条回答改变条件并达到新平衡,要使NO2在平衡体系中的含量变小,可采取的措施有(填序号) .
A.向混合气体中再通入N2O4 B.保持容积不变,通入He
C.使用高效催化剂 D.降低温度
参考答案选AD.不是很理解A选项
一方面,N2O4量增加,使浓度商Q

已提交,审核后显示!提交回复
共2条回复
 anrryli 共回答了25个问题
anrryli 共回答了25个问题 |采纳率92%- 刚学平衡的同学确实会遇到这样的困惑.
用Q和K的大小进行判断,用于判断平衡移动方向;而体系平衡后某物质的含量,则是结果.
如果条件的改变的是温度、压强、催化剂等,而不是加减某种物质的话,平衡移动和结果有一致的逻辑关系.
如果是加减某种物质,则移动和结果不一定存在严密的逻辑关系. - 1年前
 山村僵尸 共回答了39个问题
山村僵尸 共回答了39个问题 |采纳率- (一)浓度对化学平衡移动的影响
在其他条件不变时,增大反应物的浓度或减小生成物的浓度,有利于正反应的进行,平衡向右移动;增加生成物的浓度或减小反应物的浓度,有利于逆反应的进行平衡向左移动。单一物质的浓度改变只是改变正反应或逆反应中一个反应的反应速率而导致正逆反应速率不相等,而导致平衡被打破。
(二)压强对化学平衡移动的影响
对于气体反应物和气体生成物分子数不等的可逆反应来说... - 1年前
相关推荐
- 在一固定容积为10L的密闭容器中充入0.40molSO2和0.20molO2,并放出35.28kJ热量,若再通入0.40
在一固定容积为10L的密闭容器中充入0.40molSO2和0.20molO2,并放出35.28kJ热量,若再通入0.40molSO2和0.20molO2.则平衡向什么方向移动?再次达平衡后,SO2的物质的量的取值范围?
 明我大地1年前1
明我大地1年前1 -
 isohunter 共回答了13个问题
isohunter 共回答了13个问题 |采纳率76.9%反应物达到平衡后添加反应物平衡正向移动,SO2在0.4mol到0.8mol之间1年前查看全部
- 0.50mol/L的某金属氯化物(McLn)溶液10.00ml,与0.40mol/L的NaOH溶液25.00ml恰好完
0.50mol/L的某金属氯化物(McLn)溶液10.00ml,与0.40mol/L的NaOH溶液25.00ml恰好完
全反应,生成沉淀M(OH)n,则n等于 些着急1年前1
些着急1年前1 -
 孤独踏上 共回答了16个问题
孤独踏上 共回答了16个问题 |采纳率87.5%0.40mol/L的NaOH溶液25.00ml、物质的量为0.4×0.025 = 0.01mol
0.50mol/L的某金属氯化物(McLn)溶液10.00ml中,含有MCln物质的量为 0.005mol
反应如下:
MCln + nNaOH ==== M(OH)n + nNaCl
1 n
0.005 0.01
===> n = 2
所以,生成的沉淀为M(OH)2、n=21年前查看全部
- 物质的量的浓度浓度为0.5mol/L的某金属阳离子M^n+的溶液10ml,恰好与0.40mol/L的NaOH溶液12.5
物质的量的浓度
浓度为0.5mol/L的某金属阳离子M^n+的溶液10ml,恰好与0.40mol/L的NaOH溶液12.50mL完全反映,生成沉淀,则n=?
由题目可知反应后生成的沉淀是M(0H)n
即金属离子所带正电荷总数等于氢氧根离子所带负电荷总数.
0.5*10*n=0.4*12.5*1
n=1
为什么n要乘上M的物质的量, ZXDCTE1年前3
ZXDCTE1年前3 -
 k52521 共回答了11个问题
k52521 共回答了11个问题 |采纳率100%就像你写的那样啊 M的物质的量乘以该金属阳离子的正电荷带电数=氢氧根离子所带负电荷总数 很容易理解的1年前查看全部
- 某50ml溶液含0.2mol/LAl2(SO4)3和0.005molH2SO4,向此溶液中缓缓滴加0.40mol/L的N
某50ml溶液含0.2mol/LAl2(SO4)3和0.005molH2SO4,向此溶液中缓缓滴加0.40mol/L的NaOH溶液至生成的沉淀恰好溶解,试计算(填写计算结果,不必书写计算过程):
(1)开始沉淀时,加入NaOH溶液的体积.
(2)生成沉淀质量最大时加入的NaOH溶液的体积.
(3)沉淀完全溶解时,加入NaOH溶液的最小体积. stateman1101年前1
stateman1101年前1 -
 fiona884 共回答了17个问题
fiona884 共回答了17个问题 |采纳率100%解题思路:(1)开始生成沉淀时发生:H++OH-=H2O,根据硫酸的物质的量计算NaOH的物质的量,进而计算体积;
(2)生成沉淀质量最大时,所发生的反应为H++OH-=H2O和Al3++3OH-=Al(OH)3↓,根据反应的方程式计算;
(3)沉淀完全溶解时,所发生的反应为H++OH-=H2O和Al3++4OH-=AlO2-+H2O,根据反应的方程式计算.(1)n(H+)=0.005mol×2=0.01mol,开始生成沉淀时发生:H++OH-=H2O,n(NaOH)=0.01mol,
则加入NaOH溶液的体积为[0.01mol/0.40mol/L]=0.025L=25mL,
答:开始沉淀时,加入NaOH溶液的体积为25mL;
(2)生成沉淀质量最大时,所发生的反应为H++OH-=H2O和Al3++3OH-=Al(OH)3↓,中和硫酸需要0.01molNaOH溶液,
n(Al3+)=0.2mol/L×2×0.05L=0.02mol,需要NaOH0.02mol×3=0.06mol,
共需NaOH0.06mol+0.01mol=0.07mol,所以需要NaOH的体积为[0.07moL/0.4mol/L]=0.175L=175mL,
答:生成沉淀质量最大时加入的NaOH溶液的体积为175mL;
(3)沉淀完全溶解时,所发生的反应为H++OH-=H2O和Al3++4OH-=AlO2-+H2O,
中和硫酸需要0.01molNaOH溶液,
发生Al3++4OH-=AlO2-+H2O,需要n(NaOH)=0.02mol×4=0.08mol,
共需NaOH的物质的量为0.08mol+0.01mol=0.09mol,
体积为[0.09mol/0.4mol/L]=0.225L=225mL,
答:沉淀完全溶解时,加入NaOH溶液的最小体积为225mL.点评:
本题考点: 有关混合物反应的计算;化学方程式的有关计算.
考点点评: 本题考查混合物的计算,题目难度中等,注意把握相关反应的化学方程式,根据方程式计算.1年前查看全部
- 某同学用固体NaOH配制1000mL 0.40mol/L的NaOH溶液,回答下列问题:
 某同学用固体NaOH配制1000mL 0.40mol/L的NaOH溶液,回答下列问题:
某同学用固体NaOH配制1000mL 0.40mol/L的NaOH溶液,回答下列问题:
(1)请补充完整实验的简要步骤:
①计算;②称量NaOH固体______g;③溶解;④冷却并移液;⑤洗涤并转移;⑥______;⑧上下振荡;⑨装瓶
(2)如图是某同学转移溶液的示意图,图中有两处错误,请写出:
①______;
②______.
(3)下列操作使所配溶液浓度偏大的有______(填字母,下同);偏小的有______;无影响的有______.
A.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中
B.往容量瓶转移时有少量液体溅出
C.未洗涤溶解NaOH的烧杯
D.定容时仰视刻度线
E.容量瓶未干燥就用来配制溶液. stevenzx1年前1
stevenzx1年前1 -
 vv校博士 共回答了19个问题
vv校博士 共回答了19个问题 |采纳率89.5%解题思路:(1)根据配制溶液的体积和浓度计算出需要氢氧化钠的质量;
溶液配制的一般操作步骤有:计算、称量、溶解、移液、洗涤移液、定容、摇匀等操作;
(2)转移溶液时不能直接倾倒,应用玻璃棒引流;容量瓶规格不是1000mL;
(3)据物质的量浓度的表达式c=[n/V]进行误差分析.(1)配制1000mL 0.40mol/L的NaOH溶液,需氢氧化钠的质量为m=1L×0.40mol•L-1×40g/mol=16g,
溶液配制一般步骤是:计算→称量→溶解、冷却→移液→洗涤→定容→摇匀→装瓶贴签,故答案为:16、定容;
(2)转移溶液时不能直接倾倒,应用玻璃棒引流;应该选用1000mL容量瓶;
故答案为:未用玻璃棒引流;未采用1000 mL容量瓶;
(3)A、NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中,冷却后溶液体积偏小,配制的溶液浓度偏高;
B、往容量瓶转移溶液时,有少量液体溅出,导致溶质的物质的量偏小,配制的溶液的浓度偏低;
C、未洗涤烧杯、玻璃棒,会导致配制的溶液中溶质的物质的量减小,浓度偏低;
D、定容时仰视度线,导致加入的蒸馏水体积偏大,配制的溶液浓度偏低;
E、容量瓶未干燥即用来配制溶液,对溶质的物质的量、溶液的体积都没有影响,所以不影响配制结果;
故答案为:A;BCD;E.点评:
本题考点: 配制一定物质的量浓度的溶液.
考点点评: 本题考查一定物质的量浓度溶液的配制方法步骤、误差分析、注意事项等,难度不大,注意根据c=[n/V]理解溶液配制原理与误差分析.1年前查看全部
- (2013•江苏模拟)900℃时,向2.0L恒容密闭容器中充入0.40mol乙苯,发生反应:
(2013•江苏模拟)900℃时,向2.0L恒容密闭容器中充入0.40mol乙苯,发生反应:
 .
.
经一段时间后达到平衡.反应过程中测定的部分数据见下表:
下列说法正确的是( )时间/min 0 10 20 30 40 n(乙苯)/mol 0.40 0.30 0.24 n2 n3 n(苯乙烯)/mol 0.00 0.10 n1 0.20 0.20
A.反应在前20 min的平均速率为v(H2)=0.008mol•L-1•min-1
B.保持其他条件不变,升高温度,平衡时,c(乙苯)=0.08mol•L-1,则a<0
C.保持其他条件不变,向容器中充入不参与反应的水蒸气作为稀释剂,则乙苯的转化率为50.0%
D.相同温度下,起始时向容器中充入0.10mol乙苯、0.10mol苯乙烯和0.30molH2,达到平衡前v正>v逆 dicksion1年前1
dicksion1年前1 -
 huang126 共回答了19个问题
huang126 共回答了19个问题 |采纳率68.4%解题思路:A.由表中数据可知,20min内乙苯的物质的量变化量为0.4mol-0.24mol=0.16mol,根据v=
计算v(乙苯),再根据速率之比等于化学计量数之比计算v(H2);△n V △t
B.由表中数据可知,30min时处于平衡状态,平衡时苯乙烯的物质的量为0.2mol,计算平衡时乙苯的浓度,根据升高温度乙苯的浓度变化,判断温度对平衡的影响,据此解答;
C.保持其他条件不变,向容器中充入不参与反应的水蒸气作为稀释剂,反应混合物的浓度不变,平衡不移动,乙苯的转化率不变,根据表中数据计算乙苯的转化率,据此解答;
D.利用三段式平衡时各组分的平衡浓度,计算平衡常数,计算此时的浓度商Qc,与平衡常数比较,判断反应进行方向,据此解答.A.由表中数据可知,20min内乙苯的物质的量变化量为0.4mol-0.24mol=0.16mol,故v(乙苯)=
0.16mol
2L
20min=0.004mol•L-1•min-1,速率之比等于化学计量数之比,则v(H2)=v(乙苯)=0.004mol•L-1•min-1,故A错误;
B.由表中数据可知,30min时处于平衡状态,平衡时苯乙烯的物质的量为0.2mol,由方程式可知,参加反应的乙苯的物质的量为0.2mol,故平衡时乙苯的浓度为[0.4mol−0.2mol/2L]=0.1mol/L,升高温度乙苯的浓度变为0.08mol•L-1,说明平衡向正反应移动,正反应为吸热反应,故a>0,故B错误;
C.由表中数据可知,30min时处于平衡状态,平衡时苯乙烯的物质的量为0.2mol,由方程式可知,参加反应的乙苯的物质的量为0.2mol,故乙苯的转化率为[0.2mol/0.4mol]×100%=50%.保持其他条件不变,向容器中充入不参与反应的水蒸气作为稀释剂,反应混合物的浓度不变,平衡不移动,乙苯的转化率不变为50%,故C正确;
D.由表中数据可知,30min时处于平衡状态,平衡时苯乙烯的物质的量为0.2mol,平衡时苯乙烯的浓度为[0.2mol/2L]=0.1mol/L,由方程式可知,氢气的平衡浓度为0.1mol/L,参加反应的乙苯的物质的量为0.2mol,故平衡时乙苯的浓度为0.1mol/L,故平衡常数k=[0.1×0.1/0.1]=0.1.相同温度下,起始时向容器中充入0.10mol乙苯、0.10mol苯乙烯和0.30molH2,此时浓度商Qc=
0.1
2×
0.3
2
0.1
2=0.15,大于平衡常数0.1,反应向逆反应进行,故达到平衡前v正<v逆,故D错误;
故选C.点评:
本题考点: 化学平衡的影响因素.
考点点评: 本题考查化学反应速率计算、化学平衡有关计算、化学平衡常数计算与应用,难度中等,注意D选项中利用平衡常数判断反应进行方向.1年前查看全部
- (2013•江苏三模)80℃时,将0.40mol的N2O4气体充入容积为2L的恒容密闭容器中,发生反应:N2O4(g)⇌
(2013•江苏三模)80℃时,将0.40mol的N2O4气体充入容积为2L的恒容密闭容器中,发生反应:N2O4(g)⇌2NO2(g).反应过程中测定的部分数据见下表:
下列说法正确的是( )时间/s 0 20 40 60 80 100 n(N2) 0.40 0.20 n(NO2) 0.00 0.24 0.52 0.60 0.60
A.反应在20~40 s之间的平均速率v(N2O4)=0.0020 mol•L-1
B.保持其他条件不变,将温度升高至t℃时的平衡常数为2.0,则反应的△H<0
C.保持其他条件不变,向平衡体系中再充入0.20 mol N2O4,则反应达到新平衡时N2O4的转化率增大
D.相同温度下,将0.40 mol的N2O4充入容积为1 L的恒容密闭容器中,反应达平衡时,c(NO2)<0.6 mol•L-1 夏传子1年前1
夏传子1年前1 -
 makc 共回答了14个问题
makc 共回答了14个问题 |采纳率85.7%解题思路:A、根据20s时二氧化氮的物质的量计算参加反应的四氧化二氮的物质的量,从而得出a值,根据v=
计算四氧化二氮的反应速率;△n V △t
B、依据化学三段式列式计算80s时平衡状态的平衡常数,依据平衡常数大小比较分析;
C、加入N2O4,则平衡状态相当于增大压强,平衡左移;
D、体积缩小相当于增大压强,平衡左移.A、在20 s时n(N2O4)=0.28 mol,v(N2O4)=
0.12mol
2L
20s=0.0030 mol/L•s,故A错误;
B、由表中数据可知反应在80 s时达到平衡,平衡时c(N2O4)=0.05 mol•L-1,c(NO2)=0.3 mol•L-1,平衡常数K=
c2(NO2)
c(N2O4)=
0.32
0.05=1.8,升高温度平衡常数增大,平衡正向移动,正反应为吸热反应,故B错误;
C、再加入N2O4后,平衡状态相当于增大压强,平衡左移,N2O4的转化率减小,故C错误;
D、当体积变为1 L时,若平衡未移动,则c(NO2)=0.6mol•L-1,实际上缩小体积相当于增大压强,平衡逆向移动,则c(NO2)<0.6 mol•L-1,故D正确;
故选D.点评:
本题考点: 化学平衡建立的过程.
考点点评: 本题考查了化学平衡的三段式计算应用,影响因素的分析判断方法,平衡常数的计算应用,题目难度中等.1年前查看全部
- 在80℃时,0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中发生如下反应:N2O4=2NO2 ΔH>0
在80℃时,0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中发生如下反应:N2O4=2NO2 ΔH>0 ,
要增大该反应的K值,可采取的措施有(填序号) D ,若要重新达到平衡时,使[NO2]/[N2O4]值变小,可采取的措施有(填序号) AB .
A.增大N2O4的起始浓度 B.向混合气体中通入NO2
C.使用高效催化剂 D.升高温度
问:为什么A和B可以使[NO2]/[N2O4]值变小(重点是为什么选B?)
B中加入的NO2,平衡移动只是减小NO2,到底体系的NO2还是增加了,这样不会令到比值反而变大么? linjiarui1年前3
linjiarui1年前3 -
 xianjinghu 共回答了21个问题
xianjinghu 共回答了21个问题 |采纳率81%关键是 固定容积的密闭容器 这个前提!
假设未作任何改变时,有体积为50%的是NO2,另50%是N2O4,
现在通入NO2,会增加压强,通入的一部分NO2会反应生成N2O4,继续通入NO2,会在一定压强下,所有的NO2都反应生成N2O4,NO2不复存在!
所以你可以理解,继续通入NO2,是朝着NO2消失的状态发展,所以不用计算,就可以得出结论B.1年前查看全部
- 在100℃时,将0.40mol的二氧化氮气体充入2L抽真空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下
在100℃时,将0.40mol的二氧化氮气体充入2L抽真空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
(1)上述条件下,反应开始至20s时,二氧化氮的平均反应速率为______mol•L -1 •min -1 .时间(s) 0 20 40 60 80 n(NO 2 )/mol 0.40 n 1 0.26 n 3 n 4 n(N 2 O 4 )/mol 0.00 0.05 n 2 0.08 0.08
(2)n 3 ______n 4 (填“>”、“<”或“=”),该反应的平衡常数值为______;
(3)若在相同情况下最初向该容器充入的是四氧化二氮气体,要达到上述同样的平衡状态,四氧化二氮的起始浓度是______mol/L,假设在80s时达到平衡,请在如图所示的图中画出并标明该条件下此反应中N 2 O 4 和NO 2 的浓度随时间变化的曲线.
(4)在(3)中条件下达到平衡后四氧化二氮的转化率为______.
(5)达到平衡后,如升高温度,气体颜色会变深,则升高温度后,反应2NO 2 ⇌N 2 O 4 的平衡常数将______(填“增大”、“减小”或“不变”)
 pee31年前1
pee31年前1 -
 billowt 共回答了20个问题
billowt 共回答了20个问题 |采纳率95%(1)由表中数据可知,从反应开始直至20s时,v(N 2 O 4 )=
0.05mol
2L
20s
60s/min =0.075mol•L -1 •min -1 ,则v(NO 2 )=2v(N 2 O 4 )=2×0.075mol•L -1 •min -1 =0.015mol•L -1 •min -1 ,
故答案为:0.15;
(2)反应达到60s时达到化学平衡状态,二氧化氮的物质的量不再变化,所以n 3 =n 4 ,
根据反应方程式计算:2NO 2 ⇌N 2 O 4
初始:0.4mol 0
转化:0.16mol 0.08mol
平衡:0.24mol 0.08mol
则平衡时的浓度分别为:c(N 2 O 4 )=
0.08mol
2L =0.04mol/L,c(NO 2 )=
0.24mol
2L =0.12mol/L,
k=
c( N 2 O 4 )
c(N O 2 ) =
0.04mol/L
0.12mol/L×0.12mol/L =2.8(mol/L) -1 ,
故答案为:=;2.8;
(3)根据反应 2NO 2 ⇌N 2 O 4 可知,0.4molNO 2 与0.2molN 2 O 4 相当,若在相同情况下最初向该容器充入的是四氧化二氮气体,要达到上述同样的平衡状态,四氧化二氮的起始浓度是:
0.2mol
2L =0.1mol/L;从放入N 2 O 4 到平衡时需要80s,初始加入的N 2 O 4 为0.2mol,物质的量浓度为0.1mol/L,二氧化氮浓度为0;终点N 2 O 4 的浓度为0.04mol/L,终点二氧化氮浓度为0.12mol/L,图象可取20s,40s,80s等几个点用平滑曲线来连接,该条件下此反应中N 2 O 4 和NO 2 的浓度随时间变化的曲线为: ,故答案为:0.1mol/L;
,故答案为:0.1mol/L; ;
;
(5)根据等效平衡,在(4)中条件下达到平衡后四氧化二氮的物质的量为0.08mol,与充入二氧化氮为相同平衡状态,则反应的四氧化二氮的物质的量为0.2mol-0.08mol=0.012mol,所以达到平衡后四氧化二氮的转化率为转化率为:
0.012mol
0.2mol =60%,
故答案为:60%;
(6)升高温度,气体颜色会变深,说明升高温度平衡向左移动,二氧化氮浓度增大,四氧化二氮浓度减小,化学平衡常数减小,故答案为:减小.1年前查看全部
- .物质的量浓度为0.50mol/L的MCln的溶液10.00mL,与物质的量浓度为0.40mol/L的NaOH溶液25.
.物质的量浓度为0.50mol/L的MCln的溶液10.00mL,与物质的量浓度为0.40mol/L的NaOH溶液25.00mL完全反应生成
为什么我算的是n=根下2 rudy8951年前2
rudy8951年前2 -
 ii798 共回答了18个问题
ii798 共回答了18个问题 |采纳率100%MCLn+nNAOH==nNACL+M(OH)n
1 n
0.5*10 0.4*25
计算0.5*10*n=0.4*25
n=21年前查看全部
- (2013•上海模拟)在80℃时,0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中发生如下反应:
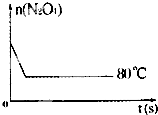 (2013•上海模拟)在80℃时,0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中发生如下反应:
(2013•上海模拟)在80℃时,0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中发生如下反应:
N2O4(无色)⇌2NO2(红棕色)Q<0,隔一段时间对该容器内的物质进行分析得到如下数据:
(1)计算20s-40s内用N2O4表示的平均反应速率为______.
时间(s)
n(mol)0 20 40 60 80 100 n(N2O4) 0.40 a 0.20 c d e n(NO2) 0.00 0.24 b 0.52 0.60 0.60
(2)反应进行至100s后将反应混合物的温度降低,混合气体的颜色______(填“变浅”、“变深”或“不变”).
(3)若要重新达到平衡时,使c(NO2)/c(N2O4)值变小,可采取的措施有(填序号)______.
A. 增大N2O4的起始浓度B.向混合气体中通入NO2 C.使用高效催化剂D.升高温度
(4)如果在80℃、将0.40mol的N2O4气体放入一个起始体积为2L、且压强维持不变的容器中发生上述反应.则达到平衡时n(NO2)______0.60mol(填“大于”“等于”或“小于”).
(5)如图是80℃时容器中N2O4物质的量的变化曲线,请在该图中补画出该反应在60℃时N2O4物质的量的变化曲线. miluco1年前1
miluco1年前1 -
 孤独ZY 共回答了18个问题
孤独ZY 共回答了18个问题 |采纳率83.3%解题思路:(1)先根据二氧化氮物质的量计算20s内反应的四氧化二氮的物质的量,进而计算20s时容器内四氧化二氮的物质的量,再计算20s~40s参加反应的四氧化二氮的物质的量,再根据速率定义式计算四氧化二氮的平均反应速率;
(2)该反应正反应是吸热反应,降低温度平衡向逆反应方向移动,NO2浓度减小;
(3)若使c(NO2)/c(N2O4)值变小,需使平衡向逆反应方向移动;
(4)压强不变则比原平衡的压强大,平衡向生成四氧化二氮的方向移动,使压强减小;
(5)降低温度,化学反应速率减小,平衡向放热方向移动.(1)20s时△n(NO2)=0.24mol,故△n(N2O4)=[1/2]△n(NO2)=[1/2]×0.24mol=0.12mol,所以a=0.4mol-0.12mol=0.28mol,故20s~40s参加反应的四氧化二氮的物质的量为0.28mol-0.2mol=0.08mol,所以20s-40s内用N2O4表示的平均反应速率为
0.08mol
2L
20s=0.002mol/(L•S),
故答案为:0.002mol/(L•S);
(2)该反应正反应是吸热反应,降低温度平衡向逆反应方向移动,NO2浓度减小,气体的颜色变浅,
故答案为:变浅;
(3)若使c(NO2)/c(N2O4)值变小,需使平衡向逆反应方向移动,
A、增大N2O4的起始浓度,按勒夏特列原理,平衡移动的结果只能减弱这种改变,不能消除,所以,c(NO2)/c(N2O4)值变小,故A正确;
B、向混合气体中通入NO2 时,因为同时增大了体系的压强,平衡移动的结果,会使c(NO2)/c(N2O4)值变小,故B正确;
C、催化剂只能加快化学反应速率,不会影响平衡移动,故C错误;
D、升高温度会使平衡向生成二氧化氮的方向移动,会使c(NO2)/c(N2O4)值变大,故D错误;
故选:AB;
(4)压强不变则比原平衡的压强小,平衡向体积增大的方向移动,即向生成二氧化氮的方向移动,所以,n(NO2)增大,
故答案为:大于;
(5)当降低温度,化学反应速率减小,到达平衡所需时间增大,平衡向逆反应方向移动,所以到达新平衡时四氧化二氮的物质的量比第一次平衡时少,60℃曲线为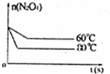 .
.
故答案为:
点评:
本题考点: 化学平衡的影响因素;反应速率的定量表示方法;化学平衡建立的过程.
考点点评: 本题考查了化学反应速率、平衡移动、外界条件对化学平衡的影响图象,题目难度不大.1年前查看全部
- 物质的量的浓度浓度为0.5mol/L的某金属阳离子M^n+的溶液10ml,恰好与0.40mol/L的NaOH溶液12.5
物质的量的浓度
浓度为0.5mol/L的某金属阳离子M^n+的溶液10ml,恰好与0.40mol/L的NaOH溶液12.50mL完全反映,生成沉淀,则n=? 爱情如雪1年前1
爱情如雪1年前1 -
 fsddsf999 共回答了18个问题
fsddsf999 共回答了18个问题 |采纳率94.4%由题目可知反应后生成的沉淀是M(0H)n
即金属离子所带正电荷总数等于氢氧根离子所带负电荷总数.
0.5*10*n=0.4*12.5*1
n=11年前查看全部
- 高中化学题题目:在硫酸铝、硫酸钾和明矾的混合溶液中,如果SO42-的离子浓度为0.40mol/L,当加入等体积0.40m
高中化学题
题目:在硫酸铝、硫酸钾和明矾的混合溶液中,如果SO42-的离子浓度为0.40mol/L,当加入等体积0.40mol/L KOH溶液时,生成的沉淀恰好完全溶解,则反应后溶液中K+的离子的浓度最接近于 A.0.25mol.L-1 B.0.45mol.L-1 C.0.50mol.L-1 D.0.90mol.L-1
我的解法是:假设溶液有1L,设Al2(SO4)3 amol,k2SO4 bmol KAl(SO4)2 cmol
按照SO4 2-浓度为0.4mol/L,得出3a+b+2c=0.4
再按照电荷守恒.所有正电荷数:Al3+ :3×2×a,K+=2×b×1+c
Al3+: 3×c;所有负电荷数:SO4 2-:0.4×2
所以有3×2×a+2b+4c=0.4×2
最后按照OH-是Al3+的4倍,得到:4×(2a+c)=0.4
列出三元一次方程组
为什么无解? jin88123451年前4
jin88123451年前4 -
 bogany 共回答了16个问题
bogany 共回答了16个问题 |采纳率93.8%答案为:B.在硫酸铝、硫酸钾和明矾的混合溶液中的离子有:SO4^2-、K^+、Al^3+.加入KOH溶液生成的沉淀恰好完全溶解,最后溶液中的离子有:SO4^2-、K^+、AlO2^-.
加入 KOH溶液时的反应为:3OH^-+Al^3+=Al(OH)3,Al(OH)3+OH^-=2H2O+AlO^2-,
由以上反应可以假设原溶液为1L,则Al^3+的量为a,那么KOH的量为4a,所以a=0.1.
设原溶液中K^+的量为b,由电荷平衡可以得到3a+b=0.4×2,所以b=0.5
所以Al^3+的总量为0.5+0.4=0.9,所以Al^3+的浓度为0.9/2=0.45.1年前查看全部
大家在问
- 1求专业人士翻译2010安徽高考题B
- 2边长是1米的正方形周长是4米,面积是1平方米.______.(判断对错)
- 3英语必修四第十单元联系第一道题目是:
- 4孙悟同学为探究光照对菜豆种子萌发的影响,设计了如下表所示实验.10天后,两组种子均未萌发,最可能的原因是( )
- 5己组词造句
- 6已知a的平方+b的平方+2a-6b+10=0,求2a的平方+4b-3的值
- 7一箱货 用英语怎么说正式的商务英语里,一箱的概念用什么单词?case么?BOX肯定是不行的吧!
- 8英语翻译以下是我在国庆节假期的计划,放假第一天,就是国庆节,我和朋友们去逛了一天街,第二天,我去沙滩玩和去了博物馆,里面
- 9例1:装饰工程有如下4个施工过程,每个施工过程的工程量,定额和施工人数,如下表1-1所示,求流水节拍,
- 10伴性遗传基因非成对存在,是否符合基因分离定律?
- 11四分之一和九分之二通分之后是多少。要有过程。
- 12七年级上册英语书36页{单词复数形式}
- 13五一班同学分组做游戏.如果每4个人一组,正好分完.如果每6人一组,也能正好分完.已知这个班人数在4
- 14概率论与数理统计问题概率论中的一个重要的结论:“在…………的条件下,(n-1)S^2/σ^2~χ^(n-1);s^2与ξ
- 15两个一次函数的图像交点的意义是?
