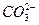甲、乙两池电极材料如图所示.请按要求回答下列问题:(1)若两池中均为CuSO 4 溶液,反应一段时间后:①有红色物质析出
 bianxingji2022-10-04 11:39:541条回答
bianxingji2022-10-04 11:39:541条回答| 甲、乙两池电极材料如图所示. 请按要求回答下列问题: (1)若两池中均为CuSO 4 溶液,反应一段时间后:①有红色物质析出的是:甲池中的______棒(填“铁”或“碳”)、乙池中的______极(填“阴”或“阳”); ②乙池中阳极电极反应式是______. (2)若两池中均为足量饱和NaCl溶液: ①写出乙池中总反应的化学方程式______; 若电极上转移0.2mole - ,则阴极上生成______mol气体;再加入______(填化学式)可恢复到原来浓度. ②甲池中碳极上电极反应式是______,其原理与金属的______腐蚀原理相同;若要防止铁的腐蚀可采取的措施为______(填序号). a.将甲图碳棒换成铜棒 b.碳棒换成锌棒 c.在铁、碳之间连接一个直流电源,把铁接到负极上 d.把铁接到直流电源的正极上. 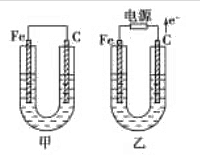 |

已提交,审核后显示!提交回复
共1条回复
 sharonxyz 共回答了12个问题
sharonxyz 共回答了12个问题 |采纳率91.7%- (1)①甲池为原电池,原电池中活泼金属做负极,发生氧化反应,碳棒做正极,有Cu析出,乙池为电解池,阴极发生还原反应有Cu析出,故答案为:碳;阴;
②电解质溶液中的铜离子在原电池正极析出,在电解池阴极析出;惰性电极电解硫酸铜溶液,阳极氢氧根离子放电生成氧气,电极反应为4OH - 4e - =2H 2 O+O 2 ↑,
故答案为:4OH - 4e - =2H 2 O+O 2 ↑;
(2)①若电解质溶液为饱和氯化钠溶液,则乙池就是用惰性电极电解氯化钠溶液,方程式为2NaCl+2H 2 O
电解
.
Cl 2 ↑+H 2 ↑+2NaOH,
若电极上转移0.2mole - ,则阴极生成0.1mol氢气,阳极生成0.1mol氯气,若要恢复电解质溶液浓度,只需加入0.2molHCl即可,
故答案为:2NaCl+2H 2 O
电解
.
Cl 2 ↑+H 2 ↑+2NaOH;0.1mol;HCl;
②甲池中碳棒为正极,发生还原反应,氧气得到电子生成氢氧根,与吸氧腐蚀的电极反应相同,用电化学方法防止金属腐蚀就要让被保护的金属做原电池的正极或电解池的阴极.
故答案为:O 2 +2H 2 O+4e - =4OH - ;吸氧;b、c. - 1年前
相关推荐
- 传感器是一种采集信息的重要器件,如图所示的是一种测定压力的电容式传感器,当待测压力F作用于可动膜片电极上时,以下说法中正
 传感器是一种采集信息的重要器件,如图所示的是一种测定压力的电容式传感器,当待测压力F作用于可动膜片电极上时,以下说法中正确的是( )
传感器是一种采集信息的重要器件,如图所示的是一种测定压力的电容式传感器,当待测压力F作用于可动膜片电极上时,以下说法中正确的是( )
A.若F向上压膜片电极,电路中有从a到b的电流
B.若F向上压膜片电极,电路中有从b到a的电流
C.若F向上压膜片电极,电路中不会出现电流
D.压力F作用稳定时,电流表有示数 飘渺的烟ZQ1年前1
飘渺的烟ZQ1年前1 -
 jwjw520123 共回答了22个问题
jwjw520123 共回答了22个问题 |采纳率90.9%解题思路:根据电容的决定式C=[ɛS/4πkd]分析电容的变化,根据Q=CU判断电量的变化,即可判断电路中电流的方向.电容器的电压不变.若F向上压膜片电极,电容增大,电量增大,电容器充电,电路中形成顺时针方向的电流,电流表指针发生偏转.电流表有示数,则说明压力F发生变化.A、B、C由题可知,电容器的电压不变.若F向上压膜片电极,根据电容的决定式C=[ɛS/4πkd]分析可知,电容增大,由电容的定义式C=[Q/U]得知,电容器的带电量增大,电容器充电,电路中形成顺时针方向的充电电流,即电路中有从b到a的电流.故AC错误,B正确.
D、当压力F变化时,电容变化,电量变化,电路中就有电流,电流表有示数.相反,压力F作用稳定时,电流表没有示数.故D错误.
故选:B.点评:
本题考点: 电容器的动态分析.
考点点评: 本题是实际问题,实质是电容器动态变化分析的问题,关键要抓住不变量:电压不变.运用电容的两个公式进行.1年前查看全部
- 一道物理题离子发动机是一种新型空间发动机,它能给卫星轨道纠偏或调整姿态提供动力,其中有一种离子发动机是让电极发射的电子撞
一道物理题
离子发动机是一种新型空间发动机,它能给卫星轨道纠偏或调整姿态提供动力,其中有一种离子发动机是让电极发射的电子撞击氙原子,使之电离,产生的氙离子经加速电场加速后从尾喷管喷出,从而使卫星获得反冲力,这种发动机通过改变单位时间内喷出离子的数目和速率,能准确获得所需的纠偏动力.假设卫星(连同离子发动机)总质量为M,每个氙离子的质量为m,电量为q,加速电压为U,设卫星原处于静止状态,若要使卫星在离子发动机起动的初始阶段能获得大小为F的动力,则发动机单位时间内应喷出多少个氙离子?此时发动机动发射离子的功率为多大? 4292591701年前1
4292591701年前1 -
 qawsedrf111 共回答了19个问题
qawsedrf111 共回答了19个问题 |采纳率100%跟踪练习第4题有详细答案
【解析】 设离子喷出尾喷管时的速度为v,单位时间内喷出n个离子,则△t时间内喷出离子数为n△t1年前查看全部
- 电子在匀强电场中的运动题目1.已知电子以10^6m/s的速度沿平行电极的中线进入电极,若电子不硑板,则:两极间的电子偏转
电子在匀强电场中的运动题目
1.已知电子以10^6m/s的速度沿平行电极的中线进入电极,若电子不硑板,则:两极间的电子偏转角为多大?离开电极的电子旳速度多大?两极间的电压最大为多少?(已知:两板间距离d为2cm,板长L为10cm,上板是负,下板是正,条件没有说电压是多少) yeefielee1年前1
yeefielee1年前1 -
 d0212 共回答了21个问题
d0212 共回答了21个问题 |采纳率90.5%电子做平抛运动,若恰好不打到平行板飞出,则
水平运动距离10cm=0.1m,垂直运动距离d/2=1cm=0.01m
分别沿水平竖直方向列方程
vt=0.1
1/2at^2=0.01
求得a=2*10^12m/s^2 t=10^-7s
飞出时竖直方向速度为at=2*10^5m/s
合速度为10^5*√104 约等于1.02*10^6m/s
方向为与水平方向成arctg(1/5)约等于11.31度
设最大电压为U
U/d=E
Eq/m=a
所以
(Uq)/(dm)=a
U=adm/q
代入电子质量m=9.1*10^-31kg,电子电量q=1.6*10^-19库仑
得到U=0.2275V1年前查看全部
- (2008•建湖县模拟)电气化铁路的高压输电线,无论冬夏都要绷直,才能使高压线与列车的电极接触良好,这就必须对高压线施加
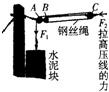 (2008•建湖县模拟)电气化铁路的高压输电线,无论冬夏都要绷直,才能使高压线与列车的电极接触良好,这就必须对高压线施加恒定的拉力.为此,工程师设计了一个恒拉力系统,原理图如图所示.则图中的A、B滑轮为______(定滑轮/动滑轮).若水泥块的总重为7800N,则滑轮组对高压线的拉力为______N.
(2008•建湖县模拟)电气化铁路的高压输电线,无论冬夏都要绷直,才能使高压线与列车的电极接触良好,这就必须对高压线施加恒定的拉力.为此,工程师设计了一个恒拉力系统,原理图如图所示.则图中的A、B滑轮为______(定滑轮/动滑轮).若水泥块的总重为7800N,则滑轮组对高压线的拉力为______N.  我很帅H1年前1
我很帅H1年前1 -
 末日ル 共回答了14个问题
末日ル 共回答了14个问题 |采纳率92.9%解题思路:轴固定不动的是定滑轮.滑轮组由几段绳子承担物重,提起物体的力就是物重的几分之一.AB轴固定不动,所以AB是定滑轮.由图知,此滑轮组由3段绳子承担物重.水泥块在绳端.
根据G水泥=
1
3F2,F2=3G水泥=3×7800N=23400N.
故答案为:定滑轮;23400.点评:
本题考点: 滑轮组及其工作特点;滑轮组绳子拉力的计算;定滑轮及其工作特点.
考点点评: 此题主要考查了定滑轮的特点及滑轮组的省力计算.1年前查看全部
- 用pt电极电解CUSO4溶液和用CU电极电解CUSO4溶液的电极方程式有什么不同呢?
 hzww20001年前3
hzww20001年前3 -
 trireoiwoir 共回答了18个问题
trireoiwoir 共回答了18个问题 |采纳率100%pt电极:阳极反应式:2H2O-4 e- =O2+4H+
Cu电极:阳极反应式:Cu-2 e- =Cu2+
阴极反应式相同:Cu2+ + 2e- =Cu1年前查看全部
- 对支持绝缘子,加均压环能提高闪络电压的原因是 改善(电极附近)电场分布 ,为什么
 yueyue200621年前1
yueyue200621年前1 -
 我快封了孓 共回答了16个问题
我快封了孓 共回答了16个问题 |采纳率100%加装了均压环,消除了尖端放电.1年前查看全部
- 传感器是一种采集信息的重要器件.如图所示为测定压力的电容式传感器,A为固定电极,B为可动电极,组成一个电容大小可变的电容
 传感器是一种采集信息的重要器件.如图所示为测定压力的电容式传感器,A为固定电极,B为可动电极,组成一个电容大小可变的电容器.可动电极两端固定,当待测压力施加在可动电极上时,可动电极发生形变,从而改变了电容器的电容.现已知该电容式传感器充电完毕且电量不变,将它与静电计相连,如图.当待测压力增大时( )
传感器是一种采集信息的重要器件.如图所示为测定压力的电容式传感器,A为固定电极,B为可动电极,组成一个电容大小可变的电容器.可动电极两端固定,当待测压力施加在可动电极上时,可动电极发生形变,从而改变了电容器的电容.现已知该电容式传感器充电完毕且电量不变,将它与静电计相连,如图.当待测压力增大时( )
A.电容器的电容将增大,静电计指针偏角将增大
B.电容器的电容将增大,静电计指针偏角将减小
C.电容器的电容将减小,静电计指针偏角将减小
D.电容器的电容将不变,静电计指针偏角不变 王命他留守1年前1
王命他留守1年前1 -
 888186 共回答了25个问题
888186 共回答了25个问题 |采纳率96%解题思路:当待测压力增大时,电容器极板间的距离减小,由电容的决定式C=[ɛS/4πkd]分析电容的变化,由电容的定义式C=[Q/U],分析极板间电压的变化,即可判断静电计指针张角的变化.当待测压力增大时,电容器极板间的距离减小,由电容的决定式C=[ɛS/4πkd]可知电容增大,电量不变,则由电容的定义式C=[Q/U],分析可知极板间电压减小,则静电计指针张角将减小.故B正确.
故选:B.点评:
本题考点: 电容器的动态分析.
考点点评: 本题是电容器的动态变化分析问题,关键掌握电容的决定式C=[ɛS/4πkd]和定义式C=[Q/U],两者结合进行分析.1年前查看全部
- 用惰性电极电解亚硫酸钠溶液的电极方程式如何写
 martliu1231年前1
martliu1231年前1 -
 TS尚品 共回答了12个问题
TS尚品 共回答了12个问题 |采纳率100%2SO3^2- - 4e^ = 2SO2+O2 追问:可材料上为什么说“当电解质为活泼金属的含氧酸盐时,相当于电解水” 回答:我的理解是这样的·当电解质为强酸强碱盐的时候 相当于水的电解·· 如果是强碱弱酸盐的时候情况有所变化· 我们可以列出 水中的离子···NA+ ,SO3^2- ,OH- ,H+ 所以我们也可以认为水中含有 氢氧化钠与亚硫酸··· 所以电解过程中会有 二氧化硫溢出·· 追问:你能告诉我碘离子、亚硫酸根离子、氯离子、二价硫离子、氢氧根离子还原性的强弱吗 回答:碘离子、亚硫酸根离子、氯离子、二价硫离子、氢氧根离子
二价硫离子>碘离子>亚硫酸根离子>氢氧根离子 >氯离子 6年不碰化学·我不敢保证对错·但是可以肯定的是非金属单质的氧化性越强,其阴离子的还原性就越弱 追问:我现在真有点晕!回答:比如说 氯气的氧化性很强 那么氯离子的还原性就很弱··硫 以前我们学习的时候最出名的一个实验就是硫在氧气中燃烧 所以硫相对来说还原性比较强·所以硫离子的氧化性就弱了 而相对它的还原性就强些··· 追问:你是干什么工作的啊,都这么多年了你还记得,佩服!回答:我是学计算机的··上大学以后就没碰过化学·不过以前很喜欢罢了· 其实个人感觉化学学的很多都是我们生活中经常遇到的东西 ··高中化学就是看着元素周期表来把那些经常用到的元素归纳起来就能学好了·算术题很多都是些初中数学的知识··· 追问:你就读那所大学啊,这么厉害!回答:=.=!1年前查看全部
- 下列反应的离子方程式书写正确的是 A.明矾溶液中加入过量的氨水: B.次氯酸钙溶液中通人过量二氧化碳: C.用石墨作电极
下列反应的离子方程式书写正确的是
A.明矾溶液中加入过量的氨水: 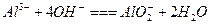
B.次氯酸钙溶液中通人过量二氧化碳: 
C.用石墨作电极电解饱和食盐水: 


D.澄清的石灰水中加人少量的  溶液:
溶液:
 空中雪花1年前1
空中雪花1年前1 -
 hslc311 共回答了24个问题
hslc311 共回答了24个问题 |采纳率91.7%1年前查看全部
- 能回答多少算多少,1.电解NaCL制备金属Na的电极反应:①2Na+ + 2e- ——→2Na ② 2CL- —→CL2
能回答多少算多少,
1.电解NaCL制备金属Na的电极反应:①2Na+ + 2e- ——→2Na
② 2CL- —→CL2↑+ 2e- 总反应式:2NaCL =(通电)= 2Na +CL2↑
其中,①的2能否省略,为什么?
2.电解NaOH(aq)阳极:4OH- —→ O2↑+ 2 H2O + 4e-
阴极:2H+ + 2e- —→ H2↑
总反应:2 H2O =(通电)= 2 H2↑ + O2↑
question:为何阳极生成4e- ,阴极却只用到2e- 不是电荷守恒吗?
3.铜的电解精炼,Cu做阳极会形成阳极泥(含Ag,Au,Pt等),离子放电顺序不是Ag+ ,Au+ 在Cu 2+ 为什么会形成阳极泥,而不是氧化?
4.材料:铁钉,铜片,石墨棒,CuSO4溶液,导线,电源.
为什么在电镀过程中,电镀液的SO4 2- ,H+ 和OH- 等不参加反应?为什么OH-不参加反应?
5.在碱性环境中的电极反应和在酸性或中性环境中的电极反应有何不同?最好举例说明. 周波是我呀1年前1
周波是我呀1年前1 -
 huangronghua22 共回答了14个问题
huangronghua22 共回答了14个问题 |采纳率85.7%1①的2不能省略,与下一个方程2CL- —→CL2↑+ 2e-得失电子平衡
2那就把阴极方程改为4H+ + 4e- —→ 2H2
3金属活动性顺序铜比金活泼,那是单质,现在是离子,不同的概念,铜比金容易失去电子,所以铜失去电子但金不会,仍然是单质保留下来,记住,阳极的金属都是单质,不是离子!
4 Cu2+的得电子能力强于H+,因为H单质比Cu容易失去电子,电镀的话,阳极铜失去电子,因为它是阳极,有电,所以是它失去电子,没有任何物质比他容易失去电子了,阴极铜离子得到电子,原因就是第一句话~!1年前查看全部
- 正极是铁,负极是铁,电解质溶液是氯化铜,写出电极反应和总反应
 不长叶子之树1年前4
不长叶子之树1年前4 -
 男人孟 共回答了20个问题
男人孟 共回答了20个问题 |采纳率95%负极,Cu2+ +2e-=cu
正极,2cl- -2e-=Cl2
CuCl2=(电解)=Cu+Cl21年前查看全部
- 电解氯化镁是否生成沉淀?以石墨棒作为电极
 fkloveqf1年前4
fkloveqf1年前4 -
 又被你雷倒了 共回答了24个问题
又被你雷倒了 共回答了24个问题 |采纳率87.5%看用什么电解棒了
溶液为 MgCl2 + 2H2O === Cl2 + Mg(OH)2 + H21年前查看全部
- 将含有0.4molNaCl和0.5mol Cu(N03)2的水溶液1L,用惰性电极电解一段时间后,在一个电极上
将含有0.4molNaCl和0.5mol Cu(N03)2的水溶液1L,用惰性电极电解一段时间后,在一个电极上得到0.3mol Cu,则在另一个电极上析出的气体(标准状况下)的体积是( )
A.4.48L
B.5.6L
C.6.72L
D.11.2L Cappuccino10281年前1
Cappuccino10281年前1 -
 zhlnn 共回答了21个问题
zhlnn 共回答了21个问题 |采纳率85.7%解题思路:根据电解的原理分析电极反应,写出电极反应,依据电子守恒计算;混合溶液中阴离子Cl-、OH-移向阳极,阳离子Cu2+、H+移向阴极,依据离子放电顺序写出电极反应,根据溶液中的离子物质的量和电解过程中电子守恒进行计算判断;将含有0.4mol NaCl和0.5mol Cu(N03)2的水溶液1L,用惰性电极电解,溶液中的阳离子有Cu2+、H+、Na+;移向阴极,发生的电极反应为:Cu2++2e-=Cu
阴离子Cl-、OH-、NO3-;移向阳极;电极反应为:2Cl--2e-=Cl2↑,0.3molCu生成转移电子为0.6mol;溶液中氯离子物质的量为0.4mol,全部反应失去电子物质的量为0.4mol,生成氯气为0.2mol,还有0.2mol电子是氢氧根离子失去发生电极反应为:4OH--4e-=2H2O+O2↑生成氧气为0.05mol,所以共生成气体标准状况下生成气体体积为(0.05mol+0.2mol)×22.4L/mol=5.6L;
故选B.点评:
本题考点: 电解原理;氧化还原反应的计算.
考点点评: 本题考查了电解原理的应用,混合电解电极产物的判断与计算,主要是离子放电顺序和电子守恒的应用书写电极反应和进行有关计算.1年前查看全部
- D1651是什么管,三个引脚各是哪个电极,电学精英快帮忙,有急用
 野百合_yuki1年前1
野百合_yuki1年前1 -
 一直孤单 共回答了20个问题
一直孤单 共回答了20个问题 |采纳率90%D1651是彩电行输出管.最大反向电压Vceo=1500V,最大集电极电流Icm=5A,最大集电极耗散功率Pcm=60W;最高工作频率3MHz.
↖的是+极
↙的是-极1年前查看全部
- 由水和氧气在放电条件下生成臭氧和过氧化氢的正、负极电极反应方程式
 zzq_cqy1年前1
zzq_cqy1年前1 -
 棠中铁 共回答了17个问题
棠中铁 共回答了17个问题 |采纳率88.2%2O2+H2O=放电=O3+H2O2
阴极:2O2 +e ===O3 + O-(-1价)
阳极:H2O -e + O- ===H2O21年前查看全部
- 高一必修二化学原电池的练习试题有人设计以pt 和zn为电极材料 埋入人体内作为某种心脏病人的心脏起搏器的能源 它依靠人体
高一必修二化学原电池的练习试题
有人设计以pt 和zn为电极材料 埋入人体内作为某种心脏病人的心脏起搏器的能源 它依靠人体内体液中含有一定浓度的溶解氧 氢离子 锌离子进行工作 请写出两极反应的方程式 狼狼的天1年前4
狼狼的天1年前4 -
 yinbaokang 共回答了20个问题
yinbaokang 共回答了20个问题 |采纳率85%负极:2Zn - 4e- =2Zn2+
正极:4OH- + 4e- = 2H2O + O21年前查看全部
- 一个电化学填空在铁钉中部紧绕铜丝,放在含有K3【Fe(CN)6】和酚酞的冻胶里面.形成腐蚀电池.其中铜丝是( )级,电极
一个电化学填空
在铁钉中部紧绕铜丝,放在含有K3【Fe(CN)6】和酚酞的冻胶里面.形成腐蚀电池.其中铜丝是( )级,电极反应是( ),故铜丝附近出现()色.
铁钉是( )级,电极反应是( ),故铁钉附近出现()色,这是由于生成了()的原因 ncdaizf1年前1
ncdaizf1年前1 -
 猫猫袄 共回答了20个问题
猫猫袄 共回答了20个问题 |采纳率100%其中铜丝为阴极,其电极反应为:O2 + 2H2O + 4e- = 4OH- ,故铜丝附近显红色,铁钉为阳极,其电极反应为Fe - 2e- = Fe2+ ,铁钉附近显蓝绿色,这是由于生成了Fe3[Fe(CN)6]21年前查看全部
- 已知电极材料:铁、铜、银、石墨、锌、铝;电解质溶液:CuCl2溶液、Fe2(SO4)3溶液、盐酸.按要求回答下列问题:
已知电极材料:铁、铜、银、石墨、锌、铝;电解质溶液:CuCl2溶液、Fe2(SO4)3溶液、盐酸.按要求回答下列问题:
(1)电工操作上规定:不能把铜导线和铝导线连接在一起使用.请说明原因______.
(2)若电极材料选铜和石墨,电解质溶液选硫酸铁溶液,外加导线,能否构成原电池______,若能,请写出电极反应式,负极______,正极______.(若不能,后两空不填)
(3)设计一种以铁和硫酸反应为原理的原电池,要求画出装置图:(需标明电极材料及电池的正负.) hajimija1年前0
hajimija1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 有关电化学三极与两极传感器电路对于两极电化学气体传感器,工作极WORKING,对电极COUNTER,进入的气体量越大,反
有关电化学三极与两极传感器电路
对于两极电化学气体传感器,工作极WORKING,对电极COUNTER,进入的气体量越大,反应越强烈,则电位差越大,电流越大;当气体浓度大到一定程度时,由于极化作用,两电极之间的电位差会缩小,使输出电流与气体浓度不能成线性关系;于是引入参考电极REFERENCE,可是引入参考电极后,只是把工作电极W的电位固定而已,当气体浓度变大时,工作电极W与对电极C之间照样会因极化作用缩小电位差,输出电流也不能与气体浓度成线性关系啊?为什么还要引入参考电极,说使测量范围变大?
谢谢! wu_di1年前1
wu_di1年前1 -
 wuxin3153 共回答了15个问题
wuxin3153 共回答了15个问题 |采纳率80%参考电极的作用是稳定电位,而不是减小极化反应.1年前查看全部
- 甲醇燃料电池分别在酸中和碱中的化学方程式和电极方程式?
 zkr19881年前2
zkr19881年前2 -
 小雨阳光小草 共回答了16个问题
小雨阳光小草 共回答了16个问题 |采纳率87.5%碱性条件
化学方程式:2CH4O + 3O2 + 4OH-= 2CO32- + 6H2O
正极:O2 + 4e(-)+ 2H20 → 4OH(-)
负极:CH4O - 6e(-) + 8OH(-) → CO3(2-) + 6H2O
酸性条件
化学方程式:2CH4O +3O2→2CO2+4H2O
正极:O2 + 4e(-) + 4H(+) → 2H2O
负极:CH4O - 6e(-) + H2O → 6H(+) + CO21年前查看全部
- 把铜作为电极去电解水,会产生什么颜色的水?
把铜作为电极去电解水,会产生什么颜色的水?
水里如果没杂质是什么颜色?如果有是什么颜色?为什么阿? BOBBY1年前1
BOBBY1年前1 -
 txixia3268 共回答了22个问题
txixia3268 共回答了22个问题 |采纳率100%看铜作什么极,阳极:颜色应该是蓝色.阴极:没有颜色.1年前查看全部
- 用铜和碳棒做电极电解水生成什么用铜做阳极,用碳棒做阴极,生成的淡蓝色的东西是什么?
 jiangbo_andy1年前4
jiangbo_andy1年前4 -
 llna8 共回答了16个问题
llna8 共回答了16个问题 |采纳率87.5%因为阳极是活泼电极,阳极参加氧化还原反应,阳极铜失去电子变为铜离子电极反应为:
阳极:Cu-2e^-=Cu2+
阴极:2H2O+2e-=H2+2OH-
所以会生成淡蓝色的氢氧化铜.
望采纳,谢谢!1年前查看全部
- 1.以等质量的铂棒喝铜棒做电极,电解硫酸铜溶液,通电一段时间后,其中一极质量增加了ag,此时两级的质量差为
1.以等质量的铂棒喝铜棒做电极,电解硫酸铜溶液,通电一段时间后,其中一极质量增加了ag,此时两级的质量差为
A.可能为ag,也可能为2ag
B.只能为2ag
2.用惰性电极电解某金属硫酸盐溶液时,在阴极上析出ag金属,同时在阳极上放出0.8g气体,如果该金属的相对原子质量为b,则其化合价是:
A.+b/10a B.+ab fengaicangqing1年前1
fengaicangqing1年前1 -
 真正的人-向日葵 共回答了19个问题
真正的人-向日葵 共回答了19个问题 |采纳率78.9%1.A.可能为ag,也可能为2ag
若铜棒为阴极,铂棒为阳极,则阴极增加a克,阳极不变,此时两级的质量差为
a克;
若铜棒为阳极,铂棒为阴极,则阴极增加a克,阳极减少a克,此时两级的质量差为2a克;
2,阳极上放出0.8g气体,是O2的质量,其物质的量为0.8/32=0.025mol,失去电子的物质的量为0.025*4=0.1mol;金属的物质的量为a/b摩尔,即生成a/b摩尔的金属得到0.1摩尔电子,则金属的化合价为+0.1/(a/b)=+b/10a,所以A是正确的.1年前查看全部
- 电极与标准氢电极组成的原电池怎样判断正负极?
电极与标准氢电极组成的原电池怎样判断正负极?
是不是在不同的原电池组合中正负极不是一成不变的!也就是说,标准氢电极可以为负极也可以为正极? yiyilinyoyo1年前1
yiyilinyoyo1年前1 -
 joision 共回答了20个问题
joision 共回答了20个问题 |采纳率95%另一个电极的电极电势是负数那麼就是负极,正数就是正极1年前查看全部
- 传感器是一种采集信息的重要器件,如图是由电容器作为传感器来测定压力变化的电路,当待测压力作用于膜片电极上时,下列说法中正
 传感器是一种采集信息的重要器件,如图是由电容器作为传感器来测定压力变化的电路,当待测压力作用于膜片电极上时,下列说法中正确的是( )
传感器是一种采集信息的重要器件,如图是由电容器作为传感器来测定压力变化的电路,当待测压力作用于膜片电极上时,下列说法中正确的是( )
A.若F向下压膜片电级,电路中有从a到b的电流
B.若F向下压膜片电级,电路中有从b到a的电流
C.若F向下压膜片电级,电路中不会有电流产生
D.若电流表有示数,说明压力F发生变化 mggfr1年前1
mggfr1年前1 -
 我亦三生杜牧 共回答了16个问题
我亦三生杜牧 共回答了16个问题 |采纳率93.8%解题思路:根据C=[ɛS/4πkd]判断电容的变化,抓住电势差不变,根据Q=CU得出电量的变化,从而判断出电路中的电流方向.A、B、C、若F向下压膜片电极,两极板间的距离减小,根据C=[ɛS/4πkd]知电容增大,根据Q=CU得,电量增加,电路中b到a的电流.故AC错误,B正确.
D、E、当电流表有示数,知电容发生变化,则压力F发生变化.故D正确,E错误.
故选:BD.点评:
本题考点: 电容器的动态分析.
考点点评: 本题是电容器的动态变化分析问题,根据电容的决定式C=[ɛS/4πkd]、定义式C=[Q/U]结合分析.1年前查看全部
- 用石墨作电极,分别电解下列各物质的溶液①CuCl 2 ②CuSO 4 ③NaBr ④NaNO 3 ⑤盐酸 ⑥H 2
用石墨作电极,分别电解下列各物质的溶液①CuCl 2 ②CuSO 4 ③NaBr ④NaNO 3 ⑤盐酸 ⑥H 2 SO 4 ⑦KOH。其中只有水被电解的有 [ ]A.①②⑤
B.③④⑥⑦
C.④⑥⑦
D.③⑤⑥⑦ 雨吧1年前1
雨吧1年前1 -
 我不是黄飞鸿 共回答了18个问题
我不是黄飞鸿 共回答了18个问题 |采纳率100%C1年前查看全部
- 下列说法正确的是( )A. 铅蓄电池放电时铅电极发生还原反应B. 电解饱和食盐水在阳极得到氯气,阴极得到金属钠C. 给
下列说法正确的是( )
A. 铅蓄电池放电时铅电极发生还原反应
B. 电解饱和食盐水在阳极得到氯气,阴极得到金属钠
C. 给铁钉镀铜可采用CuSO4作电镀液
D. 生铁浸泡在食盐水中发生析氢腐蚀 雪晶乐乐1年前1
雪晶乐乐1年前1 -
 persha 共回答了19个问题
persha 共回答了19个问题 |采纳率78.9%解题思路:A.铅蓄电池放电时铅电极为原电池的负极;
B.电解饱和食盐水得到氢气、氯气和氢氧化钠;
C.电镀时用含镀层金属的阳离子的盐做电解质溶液;
D.生铁浸泡在食盐水中发生吸氧腐蚀.A.铅蓄电池放电时铅电极为原电池的负极,发生氧化反应,正极发生还原反应,故A错误;
B.电解饱和食盐水得到氢气、氯气和氢氧化钠,阴极上得到氢气和氢氧化钠,故B错误;
C.电镀时用含镀层金属的阳离子的盐做电解质溶液,则给铁钉镀铜可采用CuSO4作电镀液,故C正确;
D.生铁浸泡在食盐水中发生吸氧腐蚀,在酸性溶液中发生析氢腐蚀,故D错误.
故选C.点评:
本题考点: 常见化学电源的种类及其工作原理;原电池和电解池的工作原理.
考点点评: 本题考查电化学知识,题目难度不大,注意原电池的工作原理、电镀以及金属的腐蚀及防护措施.1年前查看全部
- 氯化亚汞/汞 这个电对的标准电极电势比 Hg2+/Hg的低
氯化亚汞/汞 这个电对的标准电极电势比 Hg2+/Hg的低
而且HgCl2/Hg2Cl2也比Hg2+/亚汞离子的低
在Cl-存在下汞的还原性是不是增强了 gracetju1年前2
gracetju1年前2 -
 shawnhuang 共回答了19个问题
shawnhuang 共回答了19个问题 |采纳率100%那是当然的,根据能斯特方程
E=Eo'+ RT/nF ln[氧化态]/[还原态]
由于Cl-的存在,生成了[HgCl4]2-络离子或Hg2Cl2沉淀
导致氧化态的Hg(+1、+2)浓度大大减小,导致E较小
再根据E3=E1+E2算出E(HgCl2/Hg2Cl2)
从而计算得出在Cl-存在下汞的还原性增强了1年前查看全部
- 对于电子在匀强电场中偏转问题的疑惑.设加速电极电压为U1,偏转电极电压为U2.
对于电子在匀强电场中偏转问题的疑惑.设加速电极电压为U1,偏转电极电压为U2.
电子从加速电极射出时1/2mv^2=eu1.电子进入偏转电极.求电子从偏转电极射出时竖直方向的速度Vy.为什么书上都是Vy=at.不可以用动能定理1/2m(Vy)^2=eU2计算?从偏转电极射出动能增加量不就是竖直方向动能增加量么. liuzhen08161年前1
liuzhen08161年前1 -
 0nly爷 共回答了25个问题
0nly爷 共回答了25个问题 |采纳率88%答:动能定理是标量式,即不能列分方向动能定理,即使结果对,考试时也会一分没有,大忌呀!
而运动学规律、动量定理、动量守恒、牛顿第二定律、平衡方程都可以列分方向表达式.1年前查看全部
- 如图所示,甲、乙两池电极材料都是铁棒和碳棒,请回答下列问题:
如图所示,甲、乙两池电极材料都是铁棒和碳棒,请回答下列问题:
(1)若两池中均为CuSO 4 溶液,反应一段时间后:
①有红色物质析出的是甲池中的______棒,乙池中的______棒.
②乙池中阳极的电极反应式是______.
(2)若两池中均为饱和NaCl溶液:
①写出乙池中总反应的离子方程式______.
②甲池中碳极上电极反应式是______,乙池碳极上电极反应属于______(填“氧化反应”或“还原反应”).
③若乙池转移0.02mol e - 后停止实验,池中溶液体积是200mL,则溶液混合均匀后的所得NaOH溶液的物质的量浓度为______.
 花迪1年前1
花迪1年前1 -
 yahx 共回答了14个问题
yahx 共回答了14个问题 |采纳率85.7%(1)①甲池为原电池,原电池中活泼金属做负极,发生氧化反应,碳棒做正极,有Cu析出,乙池为电解池,外电路电子流向电源正极,所以碳棒为阳极,放出氯气,阴极铁电极上发生还原反应有Cu析出,故答案为:碳;铁;
②乙池中,惰性电极为阳极,电解硫酸铜溶液,阳极氢氧根离子放电生成氧气,电极反应为4OH - -4e - =2H 2 O+O 2 ↑,故答案为:4OH - -4e - =2H 2 O+O 2 ↑;
(2)①若电解质溶液为饱和氯化钠溶液,则乙池就是用惰性电极为阳极电解氯化钠溶液,方程式为:2NaCl+2H 2 O
通电
.
Cl 2 ↑+H 2 ↑+2NaOH,
故答案为:2NaCl+2H 2 O
通电
.
Cl 2 ↑+H 2 ↑+2NaOH;
②甲池中碳棒为正极,发生还原反应,氧气得到电子生成氢氧根,与吸氧腐蚀的电极反应相同,O 2 +2H 2 O+4e - =4OH - ,乙装置中,碳棒是阳极,发生失电子的氧化反应,
故答案为:O 2 +2H 2 O+4e - =4OH - ;氧化反应;
③电解氯化钠溶液的方程式为:2NaCl+2H 2 O
通电
.
Cl 2 ↑+H 2 ↑+2NaOH,乙池转移0.02mole - 后,会生成0.02mol的氢氧化钠,所以所得NaOH溶液的物质的量浓度c=
n
V =
0.02mol
0.2L =0.1mol/L,故答案为:0.1mol/L.1年前查看全部
- 常用的化学电池的种类、名称、形状、电极、电解质、可否再充电、价格、存放期、特点、用途、回收途径有哪
常用的化学电池的种类、名称、形状、电极、电解质、可否再充电、价格、存放期、特点、用途、回收途径有哪
希望可以快点,
我星期一急需.. 涂雅小盐1年前1
涂雅小盐1年前1 -
 来上网吧003 共回答了17个问题
来上网吧003 共回答了17个问题 |采纳率94.1%碳性氯化锌电池,包括D、C、AA、AAA、N及9伏型号
氯化锌电池的化学成份 - 正极:二氧化锰 负极:锌壳 电解液:氯化锌水.
氧化银钮扣型电池
化学成份 - 正极:氧化银 负极:锌 电解液:氢氧化钾
碱性钮扣型电池
化学成份 - 正极:二氧化锰 负极:锌 电解液:氢氧化钾
专用电池
化学成份:锂离子或镍金属氢化物(NiMH)
充电电池
化学成份:镍金属氢化物(NIMH)
一次性锂电池
化学成份:锂,碱 这个是在朋友问题里摘的 请看1年前查看全部
- )电气化铁路的高压输电线,无论在严冬还是盛夏都要绷 直,才能使高压线与列车的电极接触良好,这就必须对高压线施加恒定的 拉
)电气化铁路的高压输电线,无论在严冬还是盛夏都要绷 直,才能使高压线与列车的电极接触良好,这就必须对高压线施加恒定的 拉力.为此,工程师设计了如图甲所示的恒拉力系统,其简化原理图如图
乙所示.实际测量得到每个水泥块的体积为1.5×10 -2 m 3 ,共悬挂20个水
泥块.已知水泥块的密度为2.6×10 3 kg/m 3 ,g取10N/kg.(不计滑轮和 钢丝绳的重力和一切摩擦)求:(1)每个水泥块的重力是多少?(2)请指出图乙中的动滑轮和定滑轮分别是哪个? zsz_ss1年前1
zsz_ss1年前1 -
 为你亡命dd 共回答了15个问题
为你亡命dd 共回答了15个问题 |采纳率93.3%图呢?这个还是很好算的
每一个重力G=mg=Vpg=390N1年前查看全部
- 某电解池内盛有Cu(NO3)2溶液,插入两根电极,接通直流电源后,欲达到如下要求:阳极质量不变;a阳极质量不变,b阴极质
某电解池内盛有Cu(NO3)2溶液,插入两根电极,接通直流电源后,欲达到如下要求:阳极质量不变;a阳极质量不变,b阴极质量增加;c电解液pH减小,则应选用的电极是( )
①阴阳两极都用石墨
②铜作阳极铁作阴极
③铁作阳极铜作阴极
④铂作阳极铜作阴极.
A.①③
B.①②
C.③④
D.①④ 纪海1年前1
纪海1年前1 -
 忧游uu 共回答了16个问题
忧游uu 共回答了16个问题 |采纳率81.3%解题思路:依据电解原理分析,电极若是惰性电极,溶液中的阴离子在阳极失电子发生氧化反应,若阳极是活性电极,则电极本身是单质发生氧化反应,电极质量减小;阴极是溶液中阳离子得到电子发生还原反应;欲达到如下要求:a阳极质量不变 b阴极质量增加 c电解液pH减小,是惰性电极做阳极,电解质溶液中铜离子得到电子在阴极析出,阳极是溶液中氢氧根离子放电生成氧气,溶液中氢离子浓度增大,pH减小.依据电解原理分析,电极若是惰性电极,溶液中的阴离子在阳极失电子发生氧化反应,若阳极是活性电极,则电极本身是单质发生氧化反应,电极质量减小;阴极是溶液中阳离子得到电子发生还原反应;欲达到如下要求:a阳极质量不变 b阴极质量增加 c电解液pH减小,是惰性电极做阳极,电解质溶液中铜离子得到电子在阴极析出,阳极是溶液中氢氧根离子放电生成氧气,溶液中氢离子浓度增大,pH减小,
①阴阳两极都用石墨电极,电解反应为2CuSO4+2H2O
通电
.
2Cu+O2↑+2H2SO4,符合要求条件,故①符合;
②铜作阳极,铁作阴极,阳极是活性电极铜失电子质量减小,不符合题干条件,故②不符合;
③铁作阳极,铜作阴极,阳极是活性电极铁失电子质量减小,不符合题干条件,故③不符合;
④铂作阳极,铜作阴极,阳极是惰性电极,电解反应为2CuSO4+2H2O
通电
.
2Cu+O2↑+2H2SO4,符合要求条件,故④符合;
故选:D.点评:
本题考点: 电解原理.
考点点评: 本题考查了电解原理的分析判断,主要是阳极材料的分析应用,掌握基础是关键,题目难度中等.1年前查看全部
- 如图所示是一种测定压力的电容式传感器,当待测压力F作用于可动膜片电极上时,可使膜片产生形变,从而引起电容的变化。将传感器
如图所示是一种测定压力的电容式传感器,当待测压力F作用于可动膜片电极上时,可使膜片产生形变,从而引起电容的变化。将传感器、灵敏电流计和电源串接成闭合电路,那么 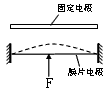
[ ]
A.当F向上压膜片电极时,电容将减小
B.当F向上压膜片电极时,电容将增大
C.若电流计有示数,则压力F发生变化
D.若电流计有示数,则压力F不发生变化 2w21319871年前1
2w21319871年前1 -
 时空雨 共回答了14个问题
时空雨 共回答了14个问题 |采纳率92.9%BC1年前查看全部
- 常有的化学电池有那几种?要求:电池种类、名称、形状、电极、电解质、电压、可否能充电、价格、存放期、特点、用途.回收途径等
常有的化学电池有那几种?
要求:电池种类、名称、形状、电极、电解质、电压、可否能充电、价格、存放期、特点、用途.回收途径等. 玉笔幽灵1年前1
玉笔幽灵1年前1 -
 angel7wing 共回答了14个问题
angel7wing 共回答了14个问题 |采纳率85.7%化学电池按工作性质可分为:一次电池(原电池);二次电池(可充电电池);铅酸蓄电池.其中:一次电池可分为:糊式锌锰电池、纸板锌锰电池、碱性锌锰电池、扣式锌银电池、扣式锂锰电池、扣式锌锰电池、锌空气电池、一次锂锰电池等.二次电池可分为:镉镍电池、氢镍电池、锂离子电池、二次碱性锌锰电池等.铅酸蓄电池可分为:开口式铅酸蓄电池、全密闭铅酸蓄电池.1年前查看全部
- 在有盐桥的铜锌原电池中,电解质溶液的选择为什么要与电极材料的阳离子相同?
在有盐桥的铜锌原电池中,电解质溶液的选择为什么要与电极材料的阳离子相同?
如果两个溶液都选硫酸铜,是不是在锌上析出铜,那还是叫原电池吗?请分析下原理
 jason21ce1年前1
jason21ce1年前1 -
 Prince_handsome 共回答了9个问题
Prince_handsome 共回答了9个问题 |采纳率77.8%不是,还是在铜棒上析出铜。锌棒上锌失的电子通过导线转移到铜棒上,溶液中的铜离子在铜棒上得电子,被还原。1年前查看全部
- 设计一测定水的离子积Kw 的原电池,并写出相应的电极反应和电池反应.计算Kw需要什么数据
 米老鼠爱大米1年前3
米老鼠爱大米1年前3 -
 sadglkjwrlkgrh 共回答了24个问题
sadglkjwrlkgrh 共回答了24个问题 |采纳率91.7%东师学子……1年前查看全部
- 帮帮忙~~~HAc/H2这个电极的电极反应式怎么写~~~
 小唐的麻辣烫1年前1
小唐的麻辣烫1年前1 -
 h2785 共回答了13个问题
h2785 共回答了13个问题 |采纳率92.3%2HAc(aq) + 2e- = 2Ac-(aq) + H2(g)1年前查看全部
- 1、容器中装着含有大量阴、阳离子的溶液,当溶液中插入连有电源的电极时,大量离子定向移动形成电流.测得在5S内共有6C正电
1、容器中装着含有大量阴、阳离子的溶液,当溶液中插入连有电源的电极时,大量离子定向移动形成电流.测得在5S内共有6C正电荷和6C的负电荷通过容器的竖直截面OO’,则(串联)电路中电流表的读数应为( )A
2、每种金属导体中单位体积内的自由电子数有确定的值.若两段长度之比为2:1 ,横截面积之比为1:3的镍铬合金丝并联在某电路中使用时,则这两根电阻丝内电子定向移动的平均速度之比为()
A.3:1 B.1:2 C.2:1 D.1:1 jingyihu1年前1
jingyihu1年前1 -
 活力瓶13 共回答了13个问题
活力瓶13 共回答了13个问题 |采纳率92.3%第一题应该是(6+6)/5=2.5A
第二题:同种材料同种电压条件下电子定向移动的平均速度应该相等,答案是D1年前查看全部
- 如图所示,P为一块均匀的半圆形合金薄片电阻,先将它按图甲的方式接在电极A,B之间,测得它的电阻为R,
如图所示,P为一块均匀的半圆形合金薄片电阻,先将它按图甲的方式接在电极A,B之间,测得它的电阻为R,
然后将他按图乙的方式接在电极C,D之间,则此时P的电阻(C,D)间的电阻为
4R,为什么,快

 砂石山1年前3
砂石山1年前3 -
 peter0203115 共回答了14个问题
peter0203115 共回答了14个问题 |采纳率100%电阻和长度成正比,横截面积成反比,看图,长度变成两倍了,横截面积变成二分之一了,所以电阻就四倍了1年前查看全部
- 为什么Li的电极电势大于Cs,Rb,K,Na(酸性溶液中)?
为什么Li的电极电势大于Cs,Rb,K,Na(酸性溶液中)?
错了,是小于,Li的电极电势小于。 风中漫步者1年前4
风中漫步者1年前4 -
 hqulei 共回答了22个问题
hqulei 共回答了22个问题 |采纳率95.5%以Na为例 设计热力学循环
Li(s) --> Li(g) --> Li+(g) --> Li+(aq)
Na(s) --> Na(g) --> Na+(g) --> Na+(aq)
虽然Li(s) --> Li(g)和Li(g) --> Li+(g)的ΔH比
Na(s) --> Na(g)和Na(g) --> Na+(g)的ΔH要大
但是由于Li+的半径很小 在水中有半径更大的水合层 稳定更多的水分子
因此它的水和热[即Li+(g) --> Li+(aq)]的ΔH很低(该ΔH值为一很大的负数)
弥补了气化热[即Li(s) --> Li(g)]的ΔH
和电离能[即Li(g) --> Li+(g)]的ΔH 中多消耗的能量
所以总的ΔH[M(s)-->M+(aq)]是LiM+(aq)]是Li1年前查看全部
- 在电解池中,阳极的电极材料一定发生氧化反应,这句话对吗,如果错错在
 小猪笨笨mei1年前2
小猪笨笨mei1年前2 -
 金贝子 共回答了22个问题
金贝子 共回答了22个问题 |采纳率95.5%不一定,惰性电极就不会发生氧化反应,比如石墨(C单质),金,铂.别的都会发生氧化反应.
题目的表述太绝对了,所以是错的1年前查看全部
- 稀硫酸为电解液 白金电极加入10A的电流流动电解时间为64分20秒 阴极生成气体在27度 1atm时是多少升?
稀硫酸为电解液 白金电极加入10A的电流流动电解时间为64分20秒 阴极生成气体在27度 1atm时是多少升?
A2.5 B4.5 C4.9 D9.0 E10 F13
急得很 无限感激 钟吾手心1年前1
钟吾手心1年前1 -
 传说断 共回答了16个问题
传说断 共回答了16个问题 |采纳率100%10A的电流流动电解时间为64分20秒,则电量为38600C,即0.4mol电子.
2H+ +2e-=H2
所以生成0.2molH2,阴极生成气体在27度 1atm时是4.9升1年前查看全部
- 一道有关饱和食盐水的题目在饱和食盐水中存在的离子有 通电时向阴极的离子是用pt电极电解氯化铜,氯化钠的混合溶液,阴极和阳
一道有关饱和食盐水的题目
在饱和食盐水中存在的离子有 通电时向阴极的离子是
用pt电极电解氯化铜,氯化钠的混合溶液,阴极和阳极上分别析出的物质是()
a.氢气和氯气 b,氢气和氧气c.铜和氯气 d.铜和氧气 xueliqin1年前2
xueliqin1年前2 -
 d3221837 共回答了18个问题
d3221837 共回答了18个问题 |采纳率100%在饱和食盐水中存在的离子有(H+,OH-,Na+,Cl-)( 电离方程式为2NaCl+2H2O===电解====2NaOH+H2+Cl2 )通电时向阴极(得电子)的离子是H+
用pt电极电解氯化铜,氯化钠的混合溶液,阴极和阳极上分别析出的物质是
当电解质中含氯化铜,氯化钠两种物质时析出的物质是c.铜(阴)和氯气(阳)
又当电解完氯化铜(由阳离子析出顺序可知氯化铜首先被电离完),剩氯化钠时析出的物质是a.氢气(阴)和氯气(阳),当氯化钠被电解完后电解质中剩下氢氧化钠和水,电解的实质就是电解水,此时析出物为b,氢气(阴)和氧气(阳)
1.要注意水的电离中H+,OH-对电解的影响
2.要熟记电离中阳离子析出的先后顺序Ag+>Hg2+>Cu2+>H+>Pb2+>Sn2+>Fe2+>Zn2+>Al3+>Mg2+>Na+>Ca2+>K+1年前查看全部
- 下列物质的用途中,利用其化学性质的是A钨用于制作白炽灯丝B铁用于制作炊具C一氧化碳作燃料D石墨作电极
 掸烟先生1年前1
掸烟先生1年前1 -
 太阳mami 共回答了12个问题
太阳mami 共回答了12个问题 |采纳率83.3%c一氧化碳燃烧放热1年前查看全部
- 用pt为电极,通电于稀CuSO4溶液,指出阴极部,中部,阳极部中溶液的颜色在通电过程中有何变化?
用pt为电极,通电于稀CuSO4溶液,指出阴极部,中部,阳极部中溶液的颜色在通电过程中有何变化?
若改用Cu作电极,三个部分溶液颜色变化又将如何? kk红蛙1年前1
kk红蛙1年前1 -
 天蝎座的矛盾体 共回答了23个问题
天蝎座的矛盾体 共回答了23个问题 |采纳率82.6%【不考虑因为电极上吸引和排斥导致的颜色变化】
惰性电极
那么Cu2+ OH-放电 阴极2Cu2+ + 4e-=2Cu(蓝色变浅,因为Cu2+减少)
阳极4OH- - 4e-= O2 + 2H2O(蓝色不变)
2Cu2+ + 4OH- = O2 + 2H2O+2Cu
中间:不变
Cu电极
Cu2+ + 2e-=Cu
Cu-2e-=Cu2+
阴极变深,因为生成Cu2+
阳极变浅,因为消耗Cu2+
中间不变1年前查看全部
- 关于胶体通电向电极的移动.以及胶体带电问题.
关于胶体通电向电极的移动.以及胶体带电问题.
1.带电的胶体粒子.那么通电后,向两极移动是不是一定是错的?
(我看书上说胶体通电,电泳向一极,我们老师讲课的时候说是两极,我觉得是错的.我看全品,说蛋白质胶体不移动.)
2.蛋白质胶体电泳不移动,电泳现象不是胶体的特性么?那么蛋白质胶体,为什么不具有电泳现象呢?
3.有些胶体,如蛋白质胶体,豆浆等,带电么?(我看全品高分小练习,答案给的蛋白质胶体不带电.)
胶体粒子因为带有相同电性,相互排斥而具有介稳性.那么,不带电的胶体,不具有介稳性么?如果有介稳性,是怎么得来的? 大vvjap行省1年前1
大vvjap行省1年前1 -
 小小宝宝唱歌来 共回答了22个问题
小小宝宝唱歌来 共回答了22个问题 |采纳率100%1、通常所说的胶体,叫做憎水胶体,也就是平常不溶于水的物质形成的胶体,其胶粒带同种电荷,电泳时向某一个电极定向移动;
2、蛋白质、淀粉胶体叫做亲水胶体,实际上是真溶液【分散质是形成单个分子的】,所以它们是稳定的;
3、淀粉胶体不带电,不能够电泳;蛋白质胶体情况要复杂一些,【因为其分子中有碱性的氨基和酸性的羧基】在其等电点【某一pH值】时不带电,在其他pH值时,带电,能够发生电泳.1年前查看全部
- 在标准状态下,用下列电对组成原电池,写出电池符号,电极反应和电池反应 AsO4^3-/AsO3^3-和I2/I-
在标准状态下,用下列电对组成原电池,写出电池符号,电极反应和电池反应 AsO4^3-/AsO3^3-和I2/I-
CO2/C2O4^2-和MnO4-/Mn2- -相忘于江湖-1年前2
-相忘于江湖-1年前2 -
 幻想一百 共回答了25个问题
幻想一百 共回答了25个问题 |采纳率88%写出电池符号,Pt| I2| I- || AsO4 3-| AsO3 3- |Pt
电极反应
正极:AsO4 3- + 2e +2H+ =AsO3 3- +H2O
负极:2I- - 2e = I2
电池反应
AsO4 3- + I- + 2H+ = AsO3 3- + I2 + H2O
电池符号,Pt| MnO4-|Mn2+ || CO2|C2O4 2- |Pt
电极反应
正极:MnO4- +5e+8H+ = Mn2+ +4H2O
负极:C2O4 2- -2e = 2CO2
电池反应
2MnO4- +5C2O4 2- +16 H+ =2Mn2+ +10CO2 + 8H2O1年前查看全部
- 是不是两点之间有电势差(电位差,电压),两点之间就有电场?(接下来还要问电池电极是否有电势差)
 tezhong841年前1
tezhong841年前1 -
 zheus 共回答了15个问题
zheus 共回答了15个问题 |采纳率86.7%是的,有电势差就有电场
电池两极之间有电势差,这样才能有电场,在电场的作用下电荷才能移动,在回路中形成电流.1年前查看全部
大家在问
- 1数字猜成语,2. 3.4.5.6.7.8.9 1.2.5.6.7.8.9 3.3.3.5 3.5.5.5. 5 5.10
- 2在太阳系中,地球的卫星是( )
- 3找规律填数18.9.10.5.6后面要填什么数?
- 4下面天气符号中,表示暴雨的是( )
- 5描写下棋的成语
- 6caxa2009电子图版,绘制形位公差时,方格内第一个空老是字母,换成图形符号后,所有标注字体都变了
- 7taste 是不是系动词?系动词后面的是不是就是表语?表语可以是副词么 形容词呢?所以 应该是
- 8寂静街道,浮华已逝 作文
- 9从甲堆煤中取出5分之1给乙堆煤,这时两堆煤质量相等,原来乙堆煤的质量是甲堆煤的质量的百分之几?
- 10四字成语中第三个是佳字的成语
- 111mol水蒸汽在标准状况下的体积约为22.4L
- 12由“?”想到人或事 作文标点符号虽然小,但内涵丰富,能勾起许多人的遐想,许多回忆.由“?”到“!”,你想到什么哪些人?哪
- 13随着靖江的生活水平不断提高,汽车越来越普及,在下面的汽车标志图形中,是中心对称图形但不是轴对称图形有( )
- 14关于珍惜时间的名言
- 15如图,A是某湿地保护区的平面图看图