钾元素和碘元素质的质量分数是多少?
 青小青2022-10-04 11:39:541条回答
青小青2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 spf15 共回答了10个问题
spf15 共回答了10个问题 |采纳率100%- 钾元素39.01
碘元素126.9 - 1年前
相关推荐
- 32.下表为冬小麦和花生在各自生育期对氮、磷、钾元素的吸收量(%)
32.下表为冬小麦和花生在各自生育期对氮、磷、钾元素的吸收量(%)
作物 生育期 氮(%) 磷(%) 钾(%)
冬小麦 出苗-返青 15 7 11
返青-拔节 27 23 32
拔节-开花 42 49 51
开花-成熟 16 21 6
花生 苗期 4.81 5.19 6.73
开花期 23.54 22.64 22.25
结荚期 41.94 49.52 66.35
成熟期 29.65 22.64 4.67
(1)从横向看,表中每一行中三个数值均不相同,这说明什么?.
(2)从纵向看,表中同种植物每一纵行的数值均有差异,这说是明什么?
(3)比较冬小麦和花生在各自生育期对无机盐的吸收量,你会得出什么结论? 鬼点子9231年前1
鬼点子9231年前1 -
 世界第一 共回答了23个问题
世界第一 共回答了23个问题 |采纳率87%1 冬小麦和花生在每一生育期对氮、磷、钾元素的需求量不同
2 冬小麦和花生在各自生育期对氮、磷、钾元素的需求量不同
3 冬小麦和花生在各自生育期对无机盐的需求量不同1年前查看全部
- KClO3与KMnO4共56.1g,加热至不在有气体放出,剩余固体中有8.7g MnO2 求原混合物中钾元素质量分数
 黑白心情1年前1
黑白心情1年前1 -
 阿九_玖玖 共回答了18个问题
阿九_玖玖 共回答了18个问题 |采纳率100%27.8%
设原混合物中KMnO4质量为x.
2KMnO4=△=K2MnO4+MnO2+O2↑
316 87
x 8.7g
316/x=87/8.7
x=31.6g
KClO3的质量是56.1-31.6=24.5g
KMnO4中K的质量是31.6*(39/158)=7.8g
KClO3中K的质量是24.5*(39/122.5)=7.8g
K元素的总质量是7.8+7.8=15.6g
钾元素质量分数是15.6/56.1*100%=27.8%1年前查看全部
- (2006•东城区二模)人体的血液中,钾元素含量偏低会影响肌肉和神经的功能.一种医用含钾化合物的溶液能跟硝酸银溶液反应生
(2006•东城区二模)人体的血液中,钾元素含量偏低会影响肌肉和神经的功能.一种医用含钾化合物的溶液能跟硝酸银溶液反应生成不溶于稀硝酸的白色沉淀,该化合物是( )
A.KNO3
B.K2CO3
C.KCl
D.KHCO3 bentai1年前1
bentai1年前1 -
 jane0001 共回答了21个问题
jane0001 共回答了21个问题 |采纳率85.7%解题思路:可以根据物质之间相互作用时生成物及其实验现象‘能跟硝酸银溶液反应生成不溶于稀硝酸的白色沉淀’进行分析、判断,得出正确的结论.A、硝酸钾与硝酸银不反应,故错误;
B、碳酸钾与硝酸银反应生成的碳酸银能溶于稀硝酸,故错误;
C、氯化钾能与硝酸银反应生成氯化银沉淀,氯化银不溶于稀硝酸,正确;
D、氢氧化钾不能与硝酸银反应,故错误;
故选C.点评:
本题考点: 证明盐酸和可溶性盐酸盐.
考点点评: 解答本题的关键是掌握物质的性质及其实验现象,明确常见不溶于稀硝酸的沉淀是氯化银、硫酸钡才能对问题做出正确的判断.1年前查看全部
- 微粒D+核外电子排布为2,8,8的为什么是钾元素?
 小笨12161年前2
小笨12161年前2 -
 lovelytaoqig 共回答了22个问题
lovelytaoqig 共回答了22个问题 |采纳率95.5%这类题的依据主要是:在原子中 核电荷数=质子数=核外电子数=原子序数
而离子是原子得失电子后形成的,得电子带负电;失电子带正电
D离子带一个单位正电荷,说明D原子失去了一个电子,那么D原子的核外电子排布为2、8、8、1
为19号元素,自然是钾元素了1年前查看全部
- (1)化学符号表示:3个氧分子______;1个钠离子______;钾元素的化合价为正一价+1K+1K;
(1)化学符号表示:3个氧分子______;1个钠离子______;钾元素的化合价为正一价
+1 k ;+1 k
(2)人体内含量最多的元素与地壳中含量最多的金属元素所形成的化合物的化学式为______.
(3)锂是一种金属单质,化学式为li,锂原子结构示意图为 ,易失去最外层一个电子.则锂的氧化物的化学式为______.
,易失去最外层一个电子.则锂的氧化物的化学式为______.
(4)吸毒是世界的公害.***是一种***,化学式为c9h13n,它属于______(填有机化合物或无机化合物).它由几种元素组成:______种. kkyy1年前1
kkyy1年前1 -
 ROBT1 共回答了17个问题
ROBT1 共回答了17个问题 |采纳率94.1%解题思路:(1)根据分子的表示方法:正确书写物质的化学式,表示多个该分子,就在其化学式前加上相应的数字进行分析;
根据离子的表示方法:在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略,若表示多个该离子,就在其元素符号前加上相应的数字进行分析;
根据元素化合价的表示方法:确定出化合物中所要标出的元素的化合价,然后在其化学式该元素的上方用正负号和数字表示,正负号在前,数字在后进行分析;
(2)根据人体含量最多的元素是氧元素,地壳中含量最多的金属元素是铝元素进行分析;
(3)根据锂的结构示意图进行分析;
(4)根据有机化合物和无机化合物的分类进行分析.(1)由分子的表示方法可知:正确书写物质的化学式,表示多个该分子,就在其化学式前加上相应的数字,所以3个氧分子表示为:3O2;
由离子的表示方法可知:在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略,若表示多个该离子,就在其元素符号前加上相应的数字,所以1个钠离子表示为:Na+;
由元素化合价的表示方法可知:确定出化合物中所要标出的元素的化合价,然后在其化学式该元素的上方用正负号和数字表示,正负号在前,数字在后,所以钾元素的化合价为正一价表示为:
+1
K;
(2)人体含量最多的元素是氧元素,地壳中含量最多的金属元素是铝元素,所以形成的化合物是:Al2O3;
(3)通过锂的结构示意图可以看出,最外层有一个电子,在化学反应中容易失去,所以锂的氧化物的化学式为:Li2O;
(4)有机化合物和无机化合物的不同是:是否含有碳元素,所以C9H13N属于有机化合物,通过化学式可以看出由三种元素组成.
故答案为:(1)3O2,Na+,
+1
K;
(2)Al2O3;
(3)Li2O;
(4)有机化合物,三.点评:
本题考点: 化学符号及其周围数字的意义;有机物与无机物的区别;原子结构示意图与离子结构示意图;化学式的书写及意义.
考点点评: 本题主要考查学生对化学用语的书写和理解能力,题目设计既包含对化学符号意义的了解,又考查了学生对化学符号、化学式的书写,考查全面,注重基础.1年前查看全部
- 为测定某KClO3和KCl混合物中钾元素的质量分数.某同学向187克KCIO3和KCI的混合物中加入二十克MnO2固体,
为测定某KClO3和KCl混合物中钾元素的质量分数.某同学向187克KCIO3和KCI的混合物中加入二十克MnO2固体,充分搅拌加热至不再产生气体,剩余固体混合物的质量为169克.则混合物中钾元素的质量分数为多少?
 haiserne1年前1
haiserne1年前1 -
 rodger杰哥 共回答了27个问题
rodger杰哥 共回答了27个问题 |采纳率96.3%KClO3分解过程中,O元素以O2的形式逸出,K元素和Cl元素以固体形式剩余
充分反映后剩余固体混合物169g,除去20gMnO2,149g为KCl,质量与原混合物中K、Cl元素总质量相等
其中K元素质量为149*(39/74.5)=78g
质量分数为78/187=41.7%1年前查看全部
- 取31.6g高锰酸钾加热一段时间后,测得固体剩余物中钾元素的质量分数为25.5%,求高锰酸钾的分解率
 dfe114051年前1
dfe114051年前1 -
 ly240 共回答了17个问题
ly240 共回答了17个问题 |采纳率94.1%分解率就是分解的高锰酸钾除以总的高锰酸钾.
方程式:
2KMnO4-->K2MnO4+MnO2+02
先算出总的高锰酸钾的物质的量为0.2mol
设分解掉x mol
则剩余固体总质量为:31.6-32*(x/2) g
含钾的质量:【0.2-x+(x/2)*2】*39=7.8
则7.8/(31.6-32*(x/2))=25.5%
所以,x=0.0632 mol
所以分解率是x/0.2=31.6%1年前查看全部
- (2011•南岗区一模)在我市的某生态园,想配制无土栽培营养液100kg,要求营养液中氮元素的含量为1.4%,钾元素的含
(2011•南岗区一模)在我市的某生态园,想配制无土栽培营养液100kg,要求营养液中氮元素的含量为1.4%,钾元素的含量为3.9%,若用硝酸钠和硫酸钾固体(均不含结晶水)来配制,则需要硫酸钾和水的质量分别为( )
A.8.5 kg和8.7kg
B.17.4kg和82.6 kg
C.8.7kg和91.3 kg
D.8.7kg和82.8 kg dongzhihua2001年前1
dongzhihua2001年前1 -
 flurrytime 共回答了20个问题
flurrytime 共回答了20个问题 |采纳率95%解题思路:利用溶液质量×元素的质量分数,计算出营养液中所含氮元素和钾元素的质量,进而由化合物中某元素的质量=该化合物的质量×该元素的质量分数,计算出营养液中含硝酸钠和硫酸钾的质量;再根据溶剂质量=溶液质量-溶质质量即可求得所需水的质量.由题意,配制无土栽培营养液100kg,要求营养液中氮元素的含量为1.4%,钾元素的含量为3.9%,则营养液中含氮元素的质量为100kg×1.4%=1.4kg,含钾元素的质量为100kg×3.9%=3.9kg,则营养液中含硝酸钠的质量为1.4g÷(
14
23+14+16×3×100%)=8.5kg,营养液中含硫酸钾的质量为3.9g÷(
39×2
39×2+32+16×4×100%)=8.7kg.
所需水的质量为100kg-8.5kg-8.7kg=82.8kg.
故选D.点评:
本题考点: 有关溶质质量分数的简单计算;化合物中某元素的质量计算.
考点点评: 本题难度不大,掌握溶质质量分数与化学式的有关计算并能灵活运用是正确解答本题的关键.1年前查看全部
- 探究钾元素单质与水反应的生成物A认为生成物为KOH和H2;B认为生成物是KOH和O2其中错误的是——,请从化合价的角度来
探究钾元素单质与水反应的生成物
A认为生成物为KOH和H2;B认为生成物是KOH和O2
其中错误的是——,请从化合价的角度来解释原因—— 暖暖5201年前1
暖暖5201年前1 -
 xichenqi1234 共回答了19个问题
xichenqi1234 共回答了19个问题 |采纳率84.2%B,钾元素化合价上升,固必然有元素化合价下降,如果是氧气那么没有元素化合价下降1年前查看全部
- (2012•镇江一模)钾是人体必需的元素之一,若血液中钾元素含量偏低,易引发低钾血症,严重时会引发心率失常,甚至猝死.医
(2012•镇江一模)钾是人体必需的元素之一,若血液中钾元素含量偏低,易引发低钾血症,严重时会引发心率失常,甚至猝死.医学专家提醒:应重视日常补钾.可以服用的某种钾的化合物,其水溶液可以和硝酸银溶液反应,生成不溶于稀硝酸的白色沉淀.此化合物是( )
A.KCl
B.K2CO3
C.KNO3
D.KOH seeddd1年前1
seeddd1年前1 -
 暴晒 共回答了13个问题
暴晒 共回答了13个问题 |采纳率92.3%解题思路:利用溶液能和硝酸银溶液反应,生成不溶于稀硝酸的白色沉淀AgCl,推断溶液中含有Cl-;利用钾的化合物一定含有钾元素;可判断该化合物为KCl.由物质能和硝酸银溶液反应,生成不溶于稀硝酸的白色沉淀AgCl,根据实验室使用硝酸银检验溶液中Cl-存在实验现象,可判断溶液中一定含有Cl-,即钾的化合物中一定含氯元素;因此可判断该钾的化合物为KCl;
故选A.点评:
本题考点: 有关化学式的计算和推断.
考点点评: 本题利用不溶于稀硝酸的白色沉淀为硫酸钡和氯化银两种,完成化合物组成的推断.1年前查看全部
- 氧元素氢化物的化学式是 该氢化物在常温下跟钾元素发生反应的化学方程式是
 fox---zhang1年前3
fox---zhang1年前3 -
 宝宝来抱抱 共回答了18个问题
宝宝来抱抱 共回答了18个问题 |采纳率94.4%2H2O+2K==2KOH +H2 (气体)
H2O2+2K==2KOH1年前查看全部
- (2001•重庆)在人体的血液中,如果钾元素含量偏高,会引起心脏哀竭,甚至死亡;如果钾元素含偏低,又会影响肌肉和神经的功
(2001•重庆)在人体的血液中,如果钾元素含量偏高,会引起心脏哀竭,甚至死亡;如果钾元素含偏低,又会影响肌肉和神经的功能,这时就需要补充钾.一种医用含钾化合物的水溶液能跟硝酸银溶液反应生成不溶于稀硝酸的白色沉淀.该化合物是( )
A.KNO3
B.K2CO3
C.KCl
D.KOH 不提不湖1年前1
不提不湖1年前1 -
 sunnycjy 共回答了22个问题
sunnycjy 共回答了22个问题 |采纳率90.9%解题思路:医用含钾化合物的水溶液能与AgNO3溶液反应,生成不溶于稀硝酸的白色沉淀,应生成AgCl,以此解答.由物质能和硝酸银溶液反应,生成不溶于稀硝酸的白色沉淀AgCl,根据实验室使用硝酸银检验溶液中Cl-存在实验现象,可判断溶液中一定含有Cl-,即钾的化合物中一定含氯元素;因此可判断该钾的化合物为KCl;
故选C.点评:
本题考点: 盐的化学性质.
考点点评: 本题考查氯化物的性质和检验,侧重于学生的分析能力和实验能力的考查,注意相关基础知识的积累,把握物质的性质,难度不大.1年前查看全部
- 在硫化钾中,钾元素和硫元素的质量比为多少?
 aass014701年前1
aass014701年前1 -
 乌溜溜819 共回答了20个问题
乌溜溜819 共回答了20个问题 |采纳率85%K与S的质量比是39:16
K2S,K与S的质量比是39*2:32=39:161年前查看全部
- 硝酸钾KNO3中钾元素的质量分数
 奶油红茶1年前1
奶油红茶1年前1 -
 屠龙2000 共回答了20个问题
屠龙2000 共回答了20个问题 |采纳率100%39/(39+14+16*3)*100%=38.8%1年前查看全部
- 元素周期表中,钾元素和钠元素同在一个纵行里,它们的原子结构示意图如右所示,则钾与钠的化学性质______(填相似或相似)
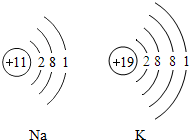 元素周期表中,钾元素和钠元素同在一个纵行里,它们的原子结构示意图如右所示,则钾与钠的化学性质______(填相似或相似),理由是______.
元素周期表中,钾元素和钠元素同在一个纵行里,它们的原子结构示意图如右所示,则钾与钠的化学性质______(填相似或相似),理由是______.  xiaoxiao2221年前1
xiaoxiao2221年前1 -
 nasanavy 共回答了15个问题
nasanavy 共回答了15个问题 |采纳率86.7%解题思路:元素的化学性质由原子的最外层电子数决定,同族的元素的原子最外层电子数相同,所以化学性质相似.元素周期表中,钾元素和钠元素同在一个纵行里,它们的原子结构示意图如右所示,则钾与钠原子的最外层电子数相同,则化学性质相似.元素周期表中,钾元素和钠元素同在一个纵行里,它们的原子结构示意图如右所示,则钾与钠原子的最外层电子数相同:电子数都为,则化学性质相似.
故答为:相似;因为钠原子和钾原子最外层电子数相同点评:
本题考点: 原子结构示意图与离子结构示意图;核外电子在化学反应中的作用.
考点点评: 了解原子结构示意图与离子结构示意图的区别和联系;掌握核外电子在化学变化中的作用和得失电子的规律特点.1年前查看全部
- 将31.6g高锰酸钾加热一段时间后冷却剩余固体中钾元素的质量分数26%,求此时高锰酸钾分解的质量
将31.6g高锰酸钾加热一段时间后冷却剩余固体中钾元素的质量分数26%,求此时高锰酸钾分解的质量
及高锰酸钾分解的质量分数. 陶陶桃子1年前1
陶陶桃子1年前1 -
 cd那些花儿 共回答了25个问题
cd那些花儿 共回答了25个问题 |采纳率80%31.6g高锰酸钾中钾元素的质量为 31.6g*39/158=7.8g
剩余固体的质量为 7.8g/26%=30g
则生成氧气的质量为31.6g-30g=1.6g
2KMnO4 =△= K2MnO4 + MnO2 + O2↑
316 32
x 1.6g
316/x=32/1.6g
x=15.8g
此时高锰酸钾分解的质量 15.8g
高锰酸钾分解的质量分数 15.8g/31.6g*100%=50%1年前查看全部
- 八下化学化合价在一个化学反应中,如果有元素化合价升高,同时就有元素化合价降低.探究钾元素(原子序数为19)单质与水反应的
八下化学化合价
在一个化学反应中,如果有元素化合价升高,同时就有元素化合价降低.探究钾元素(原子序数为19)单质与水反应的生成物.甲同学猜想生成物为KOH和H2;乙同学猜想生成物为KOH和O2,你认为( )同学的猜想不合理,请从化合价的角度解释原因( ). ZGungWen1年前3
ZGungWen1年前3 -
 vip_eason 共回答了14个问题
vip_eason 共回答了14个问题 |采纳率100%化合价在一个反应中必然是有升有降或无升无降,不可能只升不降,只降不升,所以,在这道题中,如果生成了KOH和O2,那么原来K和H2O中,K为0价,氧为-2,现在K升到+1,氧升到0,便没有降价的了,你那些多出来的电子给谁?
所以说,乙同学不合理,而事实上,甲的观点也是现实情况.1年前查看全部
- 为什么要用蓝色钴玻璃观察钾元素的火焰
 mbj1218852601年前1
mbj1218852601年前1 -
 潜水多年 共回答了13个问题
潜水多年 共回答了13个问题 |采纳率92.3%为了过滤掉火焰中的黄色.留下钾的特征颜色,紫色.1年前查看全部
- 求KClO3中钾元素的化合价
 青风扬月1年前1
青风扬月1年前1 -
 xx军_少将 共回答了19个问题
xx军_少将 共回答了19个问题 |采纳率89.5%1年前查看全部
- 草木灰的主要成分是k2co3,可用做钾肥,kg的k2co3中含有39kg钾元素
 sunfeelings1年前4
sunfeelings1年前4 -
 117467561 共回答了12个问题
117467561 共回答了12个问题 |采纳率100%设x kg的K2CO3中含39g的钾元素.
x*39*2/39*2+12+16*3=39kg
求出x就可以了.x=69kg
若解决疑惑,1年前查看全部
- 取31.6g高锰酸钾加热一段时间后,测得固体剩余物中钾元素的质量分数为25%,则固体剩余物中二氧化锰的质量分数为____
取31.6g高锰酸钾加热一段时间后,测得固体剩余物中钾元素的质量分数为25%,则固体剩余物中二氧化锰的质量分数为______.
 鸳鸯_小由1年前1
鸳鸯_小由1年前1 -
 tionlt 共回答了14个问题
tionlt 共回答了14个问题 |采纳率78.6%解题思路:根据高锰酸去钾加热生成锰酸钾、二氧化锰和氧气和质量守恒定律可知反应前后剩余固体中钾元素的质量不改变,剩余固体的质量减小且减小的质量就是生成的氧气的质量;所以求出高锰酸钾中钾元素的质量分数,然后用高锰酸钾的质量乘以这个数求出反应前钾元素的质量,用钾元素的质量除以剩余物中钾元素的质量分数求出剩余固体的质量,31.6g减去这个质量就是生成的氧气的质量,然后根据高锰酸钾制取氧气的化学方程式计算出生成的二氧化锰,然后除以剩余固体的质量即可求解.KMnO4中钾元素的质量分数为:[39/39+55+16×4]×100%=24.7%,高锰酸钾中钾元素的质量为31.6g×24.7%=7.8g,剩余固体的质量为[7.8g/25%]=31.2g,生成的氧气的质量为31.6g-31.2g=0.4g,设生成的二氧化锰的质量为x
2KMnO4
△
.
K2MnO4+MnO2+O2↑
87 32
x0.4g
[87/x]=[32/0.4g]
x=1.09g
剩余固体中二氧化锰的质量分数为[1.09g/31.2g]×100%=3.5%.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 本题主要理清反应前后钾元素的质量不变,再根据化学方程式求解即可.1年前查看全部
- 每10升海水中,可以提炼出3.8克钾元素.照这样算,1000生这样的海水可以提炼除多少克的钾元素?两种方法
 ww051年前1
ww051年前1 -
 清水火焰0 共回答了21个问题
清水火焰0 共回答了21个问题 |采纳率81%1000/10X3.8=380
1000X3.8/10=3801年前查看全部
- 由kcl、kclo3组成的混合物中钾元素的质量分数为39%,求混物中氯化钾的质量分数.
由kcl、kclo3组成的混合物中钾元素的质量分数为39%,求混物中氯化钾的质量分数.
我们老师给的答案是34.9%= 我是自由飞翔的鱼1年前1
我是自由飞翔的鱼1年前1 -
 lmchw0801 共回答了19个问题
lmchw0801 共回答了19个问题 |采纳率89.5%不管是kcl、还是kclo3钾氯质量比是一定的,都是39:35.5,所以钾元素的质量分数为39%,氯元素的质量分数为35.5%,氧氯元素的质量分数为(100-39-35.5)%=25.5% 再计算kclo3的质量分数
设混合物质量为x,氧质量为25.5% x,kclo3的质量25.5%x/16*3/122.5=65.1x
kclo3的质量分数65.1%,所以氯化钾的质量分数为1-65.1%=34.9%.1年前查看全部
- 初三化学(关于化合式计算)帮帮氯化钾与氯酸钾组成的混合物中,钾元素的质量分数为39%,则氧元素质量分数为( ),氯酸钾的
初三化学(关于化合式计算)帮帮
氯化钾与氯酸钾组成的混合物中,钾元素的质量分数为39%,则氧元素质量分数为( ),氯酸钾的质量为( ).
氯酸钾的质量分数为( ). liujie19861年前1
liujie19861年前1 -
 toshiba00 共回答了18个问题
toshiba00 共回答了18个问题 |采纳率88.9%KCl,KClO3,分析化学式特征,钾与氯的原子个数比为1:1,质量比为39:35.5,钾的质量分数是39%,则氯的质量分数是35.5%,
氧的质量分数是:1-39%-35.5%=25.5%
因为不知混合物的质量,不能计算氯酸钾的质量.
因为只有氯酸钾中含有氧,所以有下列关系式KClO3 ---------3O
122.5 --------48
w -----------25.5%
w=65.1%
则氧元素质量分数为( 25.5% ),氯酸钾的质量分数为(65.1% ).1年前查看全部
- 醋酸钾中钾元素的质量分数为多少?
醋酸钾中钾元素的质量分数为多少?
醋酸钾(CH3COOK)中钾元素的质量分数是多少? 慕M紫1年前1
慕M紫1年前1 -
 adam1314 共回答了23个问题
adam1314 共回答了23个问题 |采纳率91.3%CH3COOK的相对分子质量=12*2+3+16*2+39=98
钾元素的质量分数=39/98=39.8%1年前查看全部
- (2006•宜昌)元素周期表中,钾元素和钠元素同在一个纵行里,它们的原子结构示意图如图所示,则钾与钠的化学性质相似相似(
 (2006•宜昌)元素周期表中,钾元素和钠元素同在一个纵行里,它们的原子结构示意图如图所示,则钾与钠的化学性质相似相似(填相似或不相似),理由是它们的最外电子层相同它们的最外电子层相同.
(2006•宜昌)元素周期表中,钾元素和钠元素同在一个纵行里,它们的原子结构示意图如图所示,则钾与钠的化学性质相似相似(填相似或不相似),理由是它们的最外电子层相同它们的最外电子层相同.  ezyd_41年前1
ezyd_41年前1 -
 A20012848 共回答了15个问题
A20012848 共回答了15个问题 |采纳率100%决定元素化学性质的是最外层电子数;元素周期表中,钾元素和钠元素同在一个纵行里,由原子结构示意图可知,钾与钠原子的最外层电子数相同,故它们的化学性质相似.
故答案为:相似;它们的最外电子层相同.1年前查看全部
- (2008•通州区一模)为探究某种钾肥(成分为硫酸钾、碳酸钾和少量不含钾元素的难溶物质)中钾元素的质量分数,某实验小组进
(2008•通州区一模)为探究某种钾肥(成分为硫酸钾、碳酸钾和少量不含钾元素的难溶物质)中钾元素的质量分数,某实验小组进行了如下实验:
步骤一:取10g该钾肥样品加入适量水充分溶解后,过滤出杂质得到滤液.
步骤二:将溶质质量分数为20%,密度为1.14g/cm3 硫酸溶液逐滴加入到滤液中,至不再有气泡产生时,测得消耗硫酸溶液的体积为21.5mL.
步骤三:将反应后的溶液蒸干,称量所得白色固体的质量为11.2g.
请你根据所得实验数据(整个过程中的损失忽略不计)计算:
(1)该钾肥中含有碳酸钾的质量为6.9g6.9g.
(2)该钾肥中钾元素的质量分数是多少? 浪人杰1年前1
浪人杰1年前1 -
 jasmine7709 共回答了19个问题
jasmine7709 共回答了19个问题 |采纳率89.5%(1)碳酸钾所消耗的硫酸溶液中溶质的质量是:21.5mL×1.14g/cm3×20%=4.9g
设样品中含有碳酸钾的质量为x
K2CO3+H2SO4=K2SO4+H2O+CO2↑
13898
x4.9g
138
x=
98
4.9g
x=6.9g
(2)样品中钾元素的质量:11.2×
39×2
39×2+32+16×4×100%═5.02g
样品中钾元素的质量分数:
5.02g
10g×100%═50.2%
答:样品中的碳酸钾质量是6.9克,样品中钾元素的质量分数为50.2%.1年前查看全部
- 为什么观察钾元素的焰色反应时需用蓝色的Co玻璃片?蘸取的K2CO3溶液里怎么会有钠元素?
 出来逛街1年前1
出来逛街1年前1 -
 小不点wll 共回答了21个问题
小不点wll 共回答了21个问题 |采纳率90.5%因为钾通常是以钠钾合金形式存在的,蓝色co玻璃的作用是过滤黄光,钠燃烧就是产生黄光,所以用蓝色co玻璃原因是:为了过滤钠燃烧产生的黄光.
同样道理,钠和钾通常是合金形式存在,当钾反应成为K2CO3时,里面就残留有一定量的钠,所以有钠元素.1年前查看全部
- 在人体的血液中,如果钾元素含量偏高会引起心脏衰竭甚至死亡;如果钾元素含量偏低又会影响肌肉和神经的功能,这时就需要补充钾.
在人体的血液中,如果钾元素含量偏高会引起心脏衰竭甚至死亡;如果钾元素含量偏低又会影响肌肉和神经的功能,这时就需要补充钾.一种医用含钾化合物的水溶液能跟硝酸银溶液反应生成不溶于稀硝酸的白色沉淀,该化合物是( )
A. KNO3
B. K2CO3
C. KCl
D. KOH abcok1年前1
abcok1年前1 -
 我本善忘 共回答了19个问题
我本善忘 共回答了19个问题 |采纳率84.2%解题思路:可以根据物质之间相互作用时生成物及其实验现象方面减小分析、判断,从而得出正确的结论.A、硝酸钾与硝酸银不反应,故A错误;
B、碳酸钾与硝酸银反应生成的碳酸银能溶于稀硝酸,故B错误;
C、氯化钾能与硝酸银反应生成氯化银沉淀,氯化银不溶于稀硝酸,故C正确;
D、氢氧化钾不能与硝酸银反应,故D错误;
故选C.点评:
本题考点: 反应现象和本质的联系;证明盐酸和可溶性盐酸盐.
考点点评: 解答本题的关键是要掌握各种物质的性质及其实验现象,只有这样才能对问题做出正确的判断.1年前查看全部
- 碱金属元素中钾元素的密度为什么不合规律
 renjinjun1年前2
renjinjun1年前2 -
 tws1974 共回答了19个问题
tws1974 共回答了19个问题 |采纳率94.7%根据“密度=相对原子质量/原子体积”,可知相对原子质量的增大使密度增加,而电子层的增加又使原子体积增大使得密度减小.即单质的密度由相对原子质量和原子体积两个因素决定.对钾来说,核对最外层引力较小,体积增大的效应大于相对原子质量增加产生的影响,结果钾的密度反而比钠小.1年前查看全部
- 下列物质中含中钾元素质量分数最高的是:K2CO3 KHCO3 KCL K2SO4选一个答案.怎么算啊
 hbybwy1年前1
hbybwy1年前1 -
 zgc1231 共回答了12个问题
zgc1231 共回答了12个问题 |采纳率83.3%第一个,K的好象是39,太久了不是很记得了,就当是39拉,K的是39,H是1,C是12,O是16.
K2CO3中钾元素质量分数=39*2/39*2+12+16*3=46%
KHCO3钾元素质量分数=39/39+1+12+16*3=39%
下面也是这样算.
答案应该是第一个1年前查看全部
- 该钾肥中钾元素的含量最高为多少?
该钾肥中钾元素的含量最高为多少?
小明家的这种钾盐刚好用完,家里有KCl库存,如果用KCl代替这种钾盐来施肥,需要KCl的质量为多少?
△△牌钾肥
主要成分:K2SO4
(杂质不含钾元素)
净重:50kg
不是很懂,能不能简单点

 ktasdt1年前1
ktasdt1年前1 -
 fantasys_m 共回答了21个问题
fantasys_m 共回答了21个问题 |采纳率90.5%K2SO4中K元素的最高含量:39*2/(39*2+32+16*4)=44.8%
K2SO4-----2KCl
174 149
50Kg X
列比例,解得,
X=42.82Kg1年前查看全部
- 为探究某种钾肥(成分为硫酸钾、碳酸钾和少量不含钾元素的难溶物质)中钾元素的质量分数,某实验小组进行了如下实验:
为探究某种钾肥(成分为硫酸钾、碳酸钾和少量不含钾元素的难溶物质)中钾元素的质量分数,某实验小组进行了如下实验:
步骤一:取10g该钾肥样品加入适量水充分溶解后,过滤出杂质得到滤液.
步骤二:将溶质质量分数为20%,密度为1.14g/cm 3 硫酸溶液逐滴加入到滤液中,至不再有气泡产生时,测得消耗硫酸溶液的体积为21.5mL.
步骤三:将反应后的溶液蒸干,称量所得白色固体的质量为11.2g.
请你根据所得实验数据(整个过程中的损失忽略不计)计算:
(1)该钾肥中含有碳酸钾的质量为______.
(2)该钾肥中钾元素的质量分数是多少? 紫紫的木兰1年前1
紫紫的木兰1年前1 -
 loneymoon54 共回答了15个问题
loneymoon54 共回答了15个问题 |采纳率100%(1)碳酸钾所消耗的硫酸溶液中溶质的质量是:21.5mL×1.14g/cm 3 ×20%=4.9g 设样品中含有碳酸钾的质量为x...1年前查看全部
- 现有氯酸钾和氯化钾的混合物100g,其中钾元素的质量分数为39%.将该混合物充分加热,可产生氧气的质量为?
现有氯酸钾和氯化钾的混合物100g,其中钾元素的质量分数为39%.将该混合物充分加热,可产生氧气的质量为?
主要是思路.
Cl取35.5,K39,O16 修风1261年前1
修风1261年前1 -
 幻城 共回答了15个问题
幻城 共回答了15个问题 |采纳率86.7%解析:
氯酸钾KClO3 可以看成 KCl + O3
所以:
无论是氯化钾KCl 还是氯酸钾KClO3,其钾元素与氯元素原子个数比都为1:1
所以可根据钾元素质量
求出氯元素质量 ,
设氯元素质量 为 X :
因为混合物100g,其中钾元素的质量 为:100 * 39% = 39 克
K -------- Cl
39--------35.5
39------- X
则
39 / 39 = 35.5 / X
解得:
X = 35.5 克
所以
氧元素质量为 = 100 - 39 - 35.5 = 25.5 克
2KClO3=(加热、催化剂MnO2)= 2KCl + 3O2↑
由方程式看出KClO3中氧元素全部生成O2
所以
可产生氧气的质量为25.5 克
不明白HI1年前查看全部
- KCl和MgCl2的混合物中,钾元素与镁元素原子个数比为2:1,则混合物中,MgCl2的质量分数为( )
KCl和MgCl2的混合物中,钾元素与镁元素原子个数比为2:1,则混合物中,MgCl2的质量分数为( )
A、56% B、38.9% C、30% D、78%
6.有一包Mg和MgO组成的混合物,实验测知氧元素质量分数为32%,则其中镁单质占( )
A、20% B、40% C、48% D、80%
7.在O2和SO2的混合气体中,氧元素的质量分数为60%,则该混合气体中O2与SO2的质量比为( )
A、1∶1 B、2∶1 C、1∶4 D、1∶2
8.元素x、Y组成两种化合物A和B,A中x元素占 ,B中x元素占 则x、Y组成的A、B化合物的化学式分别为( )
A、xY、xY2 B、x2Y、x2Y3 C、xY2、x2Y D、xY3、x2Y4 abcnothing1年前1
abcnothing1年前1 -
 吧虫 共回答了16个问题
吧虫 共回答了16个问题 |采纳率87.5%B
设有2mol的KCl和1molMgCl2
然后算出MgCl2的质量分数
A
在MgO中镁元素占60%
氧元素质量分数占40%
镁比氧=3/2
所以由实验测知氧元素质量分数为32%
可知道在MgO中的镁元素质量为32%*3/2=48%
所以镁单质占1-48%-32%=20%
C
和上面一题一样
在SO2
S比O=1/1
因为氧元素的质量分数为60%
所以S元素的质量分数为40%
所以在SO2中氧元素的质量占总量的40%
所以氧单质的质量总量的60%-40%=20%
所以SO2的质量占总量的1-20%=80%
所以则该混合气体中O2与SO2的质量比为20%/80%=1/4
题目不完整(A中x元素占 ,B中x元素占)1年前查看全部
- 钠元素和钾元素的本质区别是什么
 jj0304401年前1
jj0304401年前1 -
 mengqx 共回答了21个问题
mengqx 共回答了21个问题 |采纳率90.5%质子数不同1年前查看全部
- 【急】探究钾元素单质和水反应的生成物
【急】探究钾元素单质和水反应的生成物
甲同学猜想生成物为KOH和H2;乙同学猜想生成物为KOH和O2.你认为( )同学的猜想不合理,请从化合价的角度解释原因. 失落夏天1年前3
失落夏天1年前3 -
 Parkhyatt 共回答了13个问题
Parkhyatt 共回答了13个问题 |采纳率76.9%乙同学的猜想不合理
该反应,K从单质变为K+,化合价升高,失去电子,被氧化,是还原剂
如果生成的是O2,则氧元素从H2O -2价,变为O2 0价,也是化合价升高,失去电子,被氧化,就没有得电子的物质(氧化剂).不符合电子得失守恒,也不符合氧化还原的规律.1年前查看全部
- 探究钾元素(原子序数为19)单质与水反应的生成物.
探究钾元素(原子序数为19)单质与水反应的生成物.
甲同学猜想生成物为KOH和H2;乙同学猜想生成物为KOH和O2,你认为________同学的猜想不合理,请从化合价的角度解释原因_________________________. acc051011年前1
acc051011年前1 -
 竹子520 共回答了12个问题
竹子520 共回答了12个问题 |采纳率75%乙同学的猜想不合理
该反应,K从单质变为K+,化合价升高,失去电子,被氧化,是还原剂
如果生成的是O2,则氧元素从H2O -2价,变为O2 0价,也是化合价升高,失去电子,被氧化,就没有得电子的物质(氧化剂).不符合电子得失守恒,也不符合氧化还原的规律.1年前查看全部
- 钾元素和钠元素本质区别是()1质子数 2中子数 3相对原子数 4电子数
 沧海一声笑我不换1年前1
沧海一声笑我不换1年前1 -
 鸭蛋输了 共回答了18个问题
鸭蛋输了 共回答了18个问题 |采纳率88.9%1
任何元素的本质差别都是因为质子数不同,相同元素的质子数一定相同1年前查看全部
- 探究钾元素单质与水反应的生成物(在线等回答)
探究钾元素单质与水反应的生成物(在线等回答)
A认为生成物为KOH和H2;B认为生成物是KOH和O2
其中错误的是——,请从化合价的角度来解释原因——
选B,为什么说钾元素化合价上升,元素化合价下降,如果是氧气那么没有元素化合价下降
怎样判断它的价是升是降,A为什么对 孤尘子1年前2
孤尘子1年前2 -
 胖狸毛毛 共回答了18个问题
胖狸毛毛 共回答了18个问题 |采纳率83.3%从生成的KOH可以看出其中K为正一价,由零价的单质钾变为正一价的钾离子,那么钾失去了电子,化合价升高了,必然就有物质得到电子化合价降低,如果生成氧气的话,则氧由H2O中的负二价变为零价,同样是化合价升高,所以不可能,而生成氢气,则氢由H2O中的正一价变为零价,化合价降低了才符合要求.1年前查看全部
- (2008•通州区一模)为探究某种钾肥(成分为硫酸钾、碳酸钾和少量不含钾元素的难溶物质)中钾元素的质量分数,某实验小组进
(2008•通州区一模)为探究某种钾肥(成分为硫酸钾、碳酸钾和少量不含钾元素的难溶物质)中钾元素的质量分数,某实验小组进行了如下实验:
步骤一:取10g该钾肥样品加入适量水充分溶解后,过滤出杂质得到滤液.
步骤二:将溶质质量分数为20%,密度为1.14g/cm3 硫酸溶液逐滴加入到滤液中,至不再有气泡产生时,测得消耗硫酸溶液的体积为21.5mL.
步骤三:将反应后的溶液蒸干,称量所得白色固体的质量为11.2g.
请你根据所得实验数据(整个过程中的损失忽略不计)计算:
(1)该钾肥中含有碳酸钾的质量为______.
(2)该钾肥中钾元素的质量分数是多少? 小狄1年前1
小狄1年前1 -
 玻璃叶子 共回答了17个问题
玻璃叶子 共回答了17个问题 |采纳率64.7%解题思路:此题是通过实验的方式进行计算,通过方程式的基本计算可求出碳酸钾的质量,混合液中加入硫酸,混合物中的碳酸钾会和硫酸反应转化成硫酸钾,蒸干后的固体即为硫酸钾,根据反应前后元素的质量守恒,所以钾肥中钾元素的质量分数就是硫酸钾中钾元素的质量在10克样品中的质量分数.(1)碳酸钾所消耗的硫酸溶液中溶质的质量是:21.5mL×1.14g/cm3×20%=4.9g
设样品中含有碳酸钾的质量为x
K2CO3+H2SO4=K2SO4+H2O+CO2↑
13898
x4.9g
[138/x]=[98/4.9g]
x=6.9g
(2)样品中钾元素的质量:11.2×[39×2/39×2+32+16×4]×100%═5.02g
样品中钾元素的质量分数:[5.02g/10g]×100%═50.2%
答:样品中的碳酸钾质量是6.9克,样品中钾元素的质量分数为50.2%.点评:
本题考点: 根据化学反应方程式的计算;化合物中某元素的质量计算.
考点点评: 本题通过实验探究的方法求混合物中钾元素的质量分数并结合化学方程式的有关计算,既训练了学生的分析计算能力又提高了学生的实验设计能力,设计的不错.1年前查看全部
- 136g的khso4,kh2po4,混合物中,钾元素质量为
 阿斯兰〓1年前2
阿斯兰〓1年前2 -
 zfan31517 共回答了21个问题
zfan31517 共回答了21个问题 |采纳率95.2%因为khso4,kh2po4相对分子质量均为136
所以不管KHSO4,KH2PO4怎么混合,其中钾元素质量分数:39/136
所以136g的khso4,kh2po4,混合物中,钾元素质量为:136×(39/136)=39克1年前查看全部
- 根据化合价解释原因探究钾元素(原子序数为19)单质与水反应的生成物,甲同学猜想生成物为H 和H2;乙同学猜想生成物为KO
根据化合价解释原因
探究钾元素(原子序数为19)单质与水反应的生成物,甲同学猜想生成物为H 和H2;乙同学猜想生成物为KOH和O2,你认为________同学的猜想不合理,请从化合价的角度解释原因_________________________________________________________________________
呃,打错了..应该是甲同学猜想生成物为KOH和H2. samsamsamho1年前1
samsamsamho1年前1 -
 hhhyyy6666 共回答了17个问题
hhhyyy6666 共回答了17个问题 |采纳率94.1%当然是乙同学的啦 钾与水反应中钾由0价上升为+1价 如果生成物是KOH和O2的话 O2中O显0价 而原价为-2价 H却没变 这样化合价升降不相等了 即整个反应中只有氧化反应 这违背了氧化还原反应的统一性1年前查看全部
大家在问
- 11,阅读下面文字,按要求答题.读书是养气."人有三宝精气神,腹有诗书气自华."读不同的书,养不同的气,"
- 2解方程:x/3+5=x/2.5-115
- 3下列哪一个物理量的单位是“库仑”( )
- 4向朋友介绍自己的英语作文 以邮件的形式
- 5数学已知a=-4,b=-8,c=-2,则ac-bc=();a除以c+b除以c=
- 6阅读古诗,回答问题。 泊船瓜洲 京口瓜洲一水间,钟山只隔数重山。春风又绿江南岸,明月何时照我还。 1.这首诗是____代
- 7逆王水是什么?
- 8for the past five years 用什么时态?【英语】
- 9直接写出的数 4 9 + 3 9 = 4 8 - 3 8 = 1 7 + 6 7 880÷8= 19×5= 36÷3÷2
- 10孔子说“逝者如斯夫,不舍昼夜”,苏轼说:逝者如斯,而未尝往也”两者表达含义有何不同
- 11师徒两人同时加工一批零件共450个,师傅每小时加工54个徒弟每小时比师傅少加工18个
- 12公斤的代表字母是kg 斤的代表字母是什么呢
- 13CA(CLO)2+2HCL=CACL2+2HCLO没有沉淀,水,气体,为什么还能发生?
- 14hui,ying,写出一个词语,第一个第一声,第二个第四声
- 15时间的计算学生上午在校时间是7:50到11:20,共上四节课,其中每次课间休息10分钟,另外还有做眼保健操5分钟,课间操

