金属钴(Co)与铁的化学性质相似,都能与稀盐酸反应,在化合物中钴元素常显+2、+3价.下列说法正确的是( )
 disan2022-10-04 11:39:541条回答
disan2022-10-04 11:39:541条回答A.CoCl3读作“氯化亚钴”
B.CoCl3中钴元素的化合价为+2价
C.金属铜不能与CoCl2溶液发生反应
D.CoCl2中钴元素的质量分数约为33.3%

已提交,审核后显示!提交回复
共1条回复
 calina99 共回答了14个问题
calina99 共回答了14个问题 |采纳率92.9%- 解题思路:A.该化合物中Co元素显+3价;
B.根据化合物中化合价的代数和为0确定Co元素化合价;
C.金属Co和Fe化学性质相似,所以Co的金属活动性大于Cu;
D.根据质量分数公式计算Co元素质量分数.A.该化合物中Co元素显+3价,所以CoCl3读作“氯化钴”,故A错误;
B.CoCl3中钴元素的化合价为+3价,故B错误;
C.金属Co和Fe化学性质相似,所以Co的金属活动性大于Cu,则金属铜不能与CoCl2溶液发生反应,故C正确;
D.CoCl2中钴元素的质量分数=
59
59+71×100%≈45.38%,故D错误;
故选C.点评:
本题考点: 常见金属的活动性顺序及其应用;根据化学式判断化合价.
考点点评: 本题考查化合价的判断、物质之间的反应、质量分数的计算等知识点,明确金属活泼性强弱、元素化合价的计算方法、质量分数的计算方法等知识点即可解答,题目难度不大. - 1年前
相关推荐
- (2012•太原二模)用金属钴板(含少量Fe、Ni)制备应用广泛的氯化钴的工艺流程如图:
(2012•太原二模)用金属钴板(含少量Fe、Ni)制备应用广泛的氯化钴的工艺流程如图:
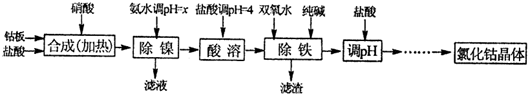
注:钴与盐酸反应极慢,需加入催化剂硝酸才可能进行实际生产.有关钴、镍和铁化合物的性质见表:
(1)“除镍”步骤中,NH3•H2O用量对反应收率的影响见表:从表中可知x=______时,除镍效果最好.化学式 沉淀完全时的pH 有关性质 Co(OH)2 9.4 Co+2HCl=CoCl2+H2↑
Co2++2NH3•H2O=Co(OH)2↓+2NH4+
Co2++2H2O⇌Co(OH)2+2H+
Ni+2HCl=NiCl2+H2↑
Ni2++6NH3•H2O=[Ni(NH3)6]2++6H2OFe(OH)2 9.6 Fe(OH)3 3.7
(2)“除镍”步骤必须控制在一定时间内完成,否则沉淀中将有部分Co(OH)2转化为Co(OH)3,此反应的化学方程式为______.加NH3•H2O调pH 收率/% Ni2+的含量/% 9 98.1 0.08 9.5 98 0.05 10 97.6 0.005 10.3 94 0.005
(3)“除铁”步骤中加入纯碱的作用是(请用离子方程式表示)______.
(4)在“调pH”步骤中,加入盐酸的作用是______.
(5)已知25℃时,KSP[Fe(OH)3]=4.0×10-38,则该温度下反应
Fe3++3H2O⇌Fe(OH)3+3H+的平衡常数K=______.
(6)已知:FeO(s)+CO(g)═Fe(s)+CO2(g)△H=-218kJ•mol-1
Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H=+640.5kJ•mol-1
写出CO气体还原Fe3O4固体得到Fe固体和CO2气体的热化学方程式:______. 咸鱼kk1年前1
咸鱼kk1年前1 -
 波波AND蓓蓓 共回答了18个问题
波波AND蓓蓓 共回答了18个问题 |采纳率94.4%解题思路:(1)根据表中的数据结合实际来回答判断;
(2)钴离子易从正二价被氧气氧化到正三价;
(3)加入纯碱碳酸钠可以和酸发生反应,起到调节溶液的pH的作用;
(4)钴离子是弱碱阳离子,能发生水解,显示酸性;
(5)根据化学平衡常数表达式结合沉淀溶解溶度积规则进行计算;
(6)依据热化学方程式和盖斯定律计算得到所需让化学方程式.(1)根据表中的数据知道,当pH等于10的时候,收率最高,镍离子的含量最小,除镍效果最好,故答案为:10;
(2)钴离子易从正二价容易被氧气氧化到正三价,发生的化学方程式为:4Co(OH)2+O2+2H2O=4Co(OH)3,故答案为:4Co(OH)2+O2+2H2O=4Co(OH)3;
(3)加入纯碱碳酸钠可以和酸发生反应,在适当的环境下,可以让铁离子形成沉淀而除去,所以加入的纯碱作用是起到调节溶液的pH的作用,2Fe3++3CO32-+H2O=2Fe(OH)3↓+3CO2↑,
故答案为:使得铁离子转化为氢氧化铁沉淀而除去;
(4)钴离子是弱碱阳离子,能发生水解,显示酸性,加入盐酸可以防止Co2+水解,故答案为:防止Co2+水解;
(5)Ksp[Fe(OH)3]=c(Fe3+)×c3(OH-)=4.0×10-38,c(H+)=
10−14
c(OH−),反应Fe3++3H2O⇌Fe(OH)3+3H+的平衡常数
K=
c3(H+)
c(Fe3+)=
10−42
c(Fe3+)c3(OH−)=2.5×10-5,故答案为:2.5×10-5;
(6)①FeO(s)+CO(g)═Fe(s)+CO2(g)△H=-218kJ•mol-1
②Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H=+640.5kJ•mol-1
依据盖斯定律①×3+②得到CO气体还原Fe3O4固体得到Fe固体和CO2气体的热化学方程式:Fe3O4(s)+4CO(g)=3Fe(s)+4CO2(g)△H=-13.5KJ/mol,
故答案为:Fe3O4(s)+4CO(g)=3Fe(s)+4CO2(g)△H=-13.5KJ/mol.点评:
本题考点: 制备实验方案的设计;难溶电解质的溶解平衡及沉淀转化的本质;物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题是一道实验探究题,能较好的考查学生分析和解决问题的能力,注意实验方案的设计原理和步骤利用关系式计算,依据已有的知识结合物质间反应的实验现象进行物质成分的推断,是解答的关键,平时注意打好扎实的基础知识和灵活应用知识解决问题的能力培养,题目难度中等.1年前查看全部
- (2012•广州)金属钴(Co)与铁具有相似的化学性质.
(2012•广州)金属钴(Co)与铁具有相似的化学性质.
(1)钴可形成化合价为+2和+3的两种氧化物,其化学式分别是______、______.
(2)已知CoCl2固体是蓝色的,CoCl2•6H20固体和CoCl2溶液都是粉红色的.将滤纸放入CoCl2溶液中浸泡,取出晾干.将干燥的粉红色滤纸用酒精灯小心烘烤,滤纸由粉红色逐渐变成蓝色,烘烤时反应的化学方程式是CoCl2•6H2O
CoCl2+6H2O△ .CoCl2•6H2O
CoCl2+6H2O△ .
(3)将金属钴投入稀硫酸中,发生化学反应Co+H2S04=CoS04+H2↑.预测可观察到的现象是______. xyxy_05011年前1
xyxy_05011年前1 -
 fangyuan_331 共回答了18个问题
fangyuan_331 共回答了18个问题 |采纳率88.9%解题思路:(1)依据氧和钴的化合价情况书写化学式即可;
(2)根据对题干信息的分析可知粉红色滤纸上存在的物质,再利用颜色的变化判断生成物并书写反应方程式即可;
(3)依据产生氢气及硫酸钴的溶液颜色判断反应的现象;(1)依据氧的化合价是-2价和钴的化合价分别为+2、+3可知:钴的两种氧化物化学式为:CoO;Co2O3;
(2)根据对题干信息的分析可知粉红色滤纸上存在的物质可能是CoCl2•6H20,加热后粉红色变成蓝色,所以产物是CoCl2,因此反应方程式为:CoCl2•6H2O
△
.
CoCl2+6H2O;
(3)由于反应产生氢气,所以反应中会有气泡产生,由于CoCl2溶液是粉红色的,由于该红色是由钴离子导致的,所以可推测CoS04的溶液也是粉红色的;
故答案为:(1)CoO;Co2O3;
(2)CoCl2•6H2O
△
.
CoCl2+6H2O;
(3)固体溶解,有无色气泡产生,溶液由无色变为粉红色.点评:
本题考点: 金属的化学性质;化学式的书写及意义;书写化学方程式、文字表达式、电离方程式.
考点点评: 此题是一道知识迁移题,解题时要注意利用所学的类似知识与题干信息相结合,并对问题进行大胆的猜测,只有这样才能顺利解题.1年前查看全部
- 氢氧化钴[Co(OH)2]可作涂料和清漆的干燥剂,其制备方法是:把金属钴与稀盐酸反应制得氯化钴(CoCl2),再将氯化钴
氢氧化钴[Co(OH)2]可作涂料和清漆的干燥剂,其制备方法是:把金属钴与稀盐酸反应制得氯化钴(CoCl2),再将氯化钴溶液与氢氧化钠溶液反应制得氢氧化钴.
【查阅资料】氯化钴溶液是粉红色,氢氧化钴是难溶于水的粉红色固体.请回答:
(1)金属钴与稀盐酸反应的化学方程式为______.
(2)氯化钴溶液与氢氧化钠溶液反应的现象是______,化学方程式为______.
(3)下列说法正确的是______.
A.钴的金属活动性比铜的强
B.氢氧化钴可以干燥氯化氢气体
C.氯化钴溶液也能和石灰水反应. 股仕阿土1年前1
股仕阿土1年前1 -
 孤独的浮云 共回答了21个问题
孤独的浮云 共回答了21个问题 |采纳率100%解题思路:(1)根据钴和稀盐酸反应生成氯化钴和氢气书写;
(2)根据氯化钴和氢氧化钠反应生成氯化钠和氢氧化钴粉红色沉淀解答;
(3)A、根据钴能和稀盐酸反应放出氢气说明比铜活泼判断;B、氢气为中性气体,氢氧化钴可干燥氢气判断;C、氯化钴和氢氧化钙反应生成氯化钠和氢氧化钴粉红色沉淀判断.(1)钴和稀盐酸反应生成氯化钴和氢气;故答案:Co+2HCl=CoCl2+H2↑;(2)氯化钴和氢氧化钠反应生成氯化钠和氢氧化钴粉红色沉淀,故答案:有粉红色的沉淀生成;CoCl2+2NaOH=2NaCl+Co(OH)2↓;(3)A、钴能和稀盐...
点评:
本题考点: 碱的化学性质;金属的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题以信息题的形式考查了金属的性质和碱的性质,注重化学知识的综合应用.1年前查看全部
- (4分)氢氧化钴[Co(OH) 2 ] 可作涂料和清漆的干燥剂,其制备方法是:把金属钴与稀盐酸反应制得氯化钴(CoCl
(4分)氢氧化钴[Co(OH) 2 ] 可作涂料和清漆的干燥剂,其制备方法是:把金属钴与稀盐酸反应制得氯化钴(CoCl 2 ),再将氯化钴溶液与氢氧化钠溶液反应制得氢氧化钴。
查阅资料:氯化钴溶液是粉红色,氢氧化钴是难溶于水的粉红色固体。请回答:
(1)金属钴与稀盐酸反应的化学方程式为 。
(2)氯化钴溶液与氢氧化钠溶液反应的现象是 ,化学方程式为 。
(3)下列说法正确的是 。
A.钴的金属活动性比铜的强
B.氢氧化钴可以干燥氯化氢气体
C.氯化钴溶液也能和石灰水反应 sohocheboy1年前1
sohocheboy1年前1 -
 qiuyifan1985 共回答了13个问题
qiuyifan1985 共回答了13个问题 |采纳率84.6%1)Co + 2HCl = CoCl 2 + H 2 ↑(2)产生粉红色沉淀,溶液逐渐由粉红色变无色 CoCl 2 +2NaOH ="==Co" (OH) 2 ↓+2NaCl(3)A C
1年前查看全部
- 请问,二氯化钴为什么用“金属钴与氯气直接合成无水二氯化钴”而不用盐酸+钴粉的方法呢
 polaris41年前1
polaris41年前1 -
 max54788 共回答了21个问题
max54788 共回答了21个问题 |采纳率85.7%与盐酸反应得到的晶体含结晶水:CoCl2.6H2O1年前查看全部
- 请问,二氯化钴为什么用“金属钴与氯气直接合成无水二氯化钴”而不用盐酸+钴粉的方法呢
 kcye1年前1
kcye1年前1 -
 cd334052315 共回答了21个问题
cd334052315 共回答了21个问题 |采纳率81%与盐酸反应得最终到的晶体含结晶水:CoCl2.6H2O ,CoCl2.6H2O 加热生成无水二氯化钴会水解1年前查看全部
- 为什么氯化钴那么贵?100g70元,把金属钴放进氯化铜里不就可以得到吗?
 欧阳逸1年前1
欧阳逸1年前1 -
 myraleaf 共回答了13个问题
myraleaf 共回答了13个问题 |采纳率92.3%你的补充问题很有意思啊!其实金属钴比氯化钴更贵!
工业上是采用氧化钴与盐酸反应制得的!自然界得到氧化钴相对还是方便的,倘若采用金属钴来制备,恐怕100克卖70元,试剂商要赔干了啊!
CoO+2HCl=CoCl2+H2O1年前查看全部
大家在问
- 11.小雨家电热毯的电阻丝断了,他爸爸将电阻线接上后继续使用,再使用中发现接头
- 2金华市婺城区乾西乡长湖路133号英文怎么翻译
- 3以“从高考看教育”为题写一篇议论文 thank you so much
- 4代印度的两大史诗是:______________、_____________.
- 5小学数学六年级篮球场长30米,宽15米,把它画在比例尺是1:1000的图纸上,长和宽各应画多长?列式:在一幅比例尺是1:
- 6王叔叔对小明说:“我15年前的岁数和你6年后的岁数相同;7年前,我的年龄是你的年龄8倍”.小明今年多少岁?王叔叔今年多少
- 7求高三外研英语周报2012-2013总第3131期B版答案.
- 8某研究所共有三个科研小组,其中参加光谱组的有20人,参加激光组的有24人,参加色谱组的有31人,同时参加
- 9应当怎样处理发展经济与合理开发利用自然资源,保护环境之间的关系
- 10我希望你的公司能变成我们的公司翻译成英文……就是我也想加入到你们的行列中去……我也想变成你们公司的一员的意思……只要翻译
- 11一篇关于新年打算的英语作文
- 12妈妈买了一套衣服,上衣打八折,裤子打六五折.结果买上衣花去240元,买裤子花去130元.
- 13铝丝浸入硫铜酸中的现象铜丝浸入硫银酸中的现象铜丝浸入硫铝酸中的现象
- 14张仲素的秋夜曲中可以看出作者怎样的心境
- 15某天股票A的开盘价为50元,上午跌了2元,下午收盘时又涨了4元,则股票A在该天的收盘价为
