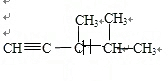
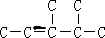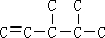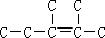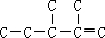将1mol H 2 (g) 和2mol I 2 (g) 置于2L密闭容器中,在一定温度下发生反应: H 2 (g)+ I
 99_s2022-10-04 11:39:541条回答
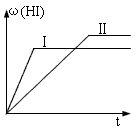
99_s2022-10-04 11:39:541条回答 将1mol H 2 (g) 和2mol I 2 (g) 置于2L密闭容器中,在一定温度下发生反应: H 2 (g)+ I 2 (g) 2HI(g) ;△H<0,并达到平衡,HI的体积分数ω(HI)随时间变化如图(II)所示。若改变反应条件,ω(HI)的变化曲线如图(Ⅰ)所示,则改变的条件可能是 2HI(g) ;△H<0,并达到平衡,HI的体积分数ω(HI)随时间变化如图(II)所示。若改变反应条件,ω(HI)的变化曲线如图(Ⅰ)所示,则改变的条件可能是 |
 |
| [ ] |
| A.恒温恒容条件下,加入适当催化剂 B.恒温恒压条件下,充入1 mol N 2 C.恒容条件下,升高温度 D.恒温恒容条件下,再充入1 mol H 2 (g) 和2 mol I 2 (g) |

已提交,审核后显示!提交回复
共1条回复
 kawase 共回答了16个问题
kawase 共回答了16个问题 |采纳率93.8%- C
- 1年前
相关推荐
- 在反应H2+Cl2=2HCl中,已知断开1mol H-H需要能量436kJ,断开1mol Cl-Cl
在反应H2+Cl2=2HCl中,已知断开1mol H-H需要能量436kJ,断开1mol Cl-Cl需要能量243kJ,断开1mol H-Cl需要能量431kJ,判断该反应是( )
A.放出83 kJ热量
B.吸收183 kJ热量
C.反应总能量低于生成物的总能量
D.放出183 kJ热量 lancome122012281年前1
lancome122012281年前1 -
 XTF1999 共回答了14个问题
XTF1999 共回答了14个问题 |采纳率92.9%解题思路:反应方程式为:H2+Cl2=2HCl,根据吸收的能量之和与放出的能量判断反应的吸放热,并计算能量.反应的反应热=拆化学键吸收的能量-形成化学键放出的能量判断;反应方程式为:H2+Cl2=2HCl,生成2molHCl,需吸收能量:436kJ+243kJ=679kJ,放出能量:2×431kJ=862kJ,放出的能量大于吸收的能量,则该反应放热,因此反应物总能量高于生成物的总能量;且放出热量为:862kJ-679kJ=1...
点评:
本题考点: 化学能与热能的相互转化.
考点点评: 本题考查反应热的计算,题目难度不大,本题注意根据反应的方程式计算.1年前查看全部
- 1mol HCO3- 1mol H+ 生成1mol CO2?
 lihuaqq141年前1
lihuaqq141年前1 -
 赌王二六号 共回答了17个问题
赌王二六号 共回答了17个问题 |采纳率94.1%生成1mol的H2CO3,也就是碳酸,其不稳定会很快分解为1mol的H2O和1mol的CO21年前查看全部
- 将1g H2和4g O2混合点燃,充分反应,放出71.45kJ热量,同样条件下1mol H
将1g H2和4g O2混合点燃,充分反应,放出71.45kJ热量,同样条件下1mol H2在O2中完全燃烧放出的热量是( )
A. 71.45 kJ
B. 142.9 kJ
C. 571.6 kJ
D. 285.8 kJ 眼见他楼塌了1年前1
眼见他楼塌了1年前1 -
 chenwen04 共回答了17个问题
chenwen04 共回答了17个问题 |采纳率100%解题思路:首先进行过量计算,确定放出71.45kJ热量时,参加反应的氢气的物质的量,据此计算同样条件下1mol H2在O2中完全燃烧放出的热量.1g H2的物质的量为[1g/2g/mol]=0.5mol,4g O2的物质的量为[4g/32g/mol]=0.125mol,
发生反应2H2+O2=2H2O,由方程式可知,0.125mol氧气完全反应需要消耗氢气为0.125mol×2=0.25mol,小于0.5mol,故氢气过量,故放出71.45kJ热量参加反应的氢气的物质的量为0.25mol,
同样条件下1mol H2在O2中完全燃烧放出的热量是:71.45kJ×[1mol/0.25mol]=285.8 kJ,
故选D.点评:
本题考点: 有关反应热的计算.
考点点评: 本题考查反应热的有关计算,难度不大,确定放出71.45kJ热量参加反应的氢气的物质的量是关键.1年前查看全部
- 将1g H2和4g O2混合点燃,充分反应,放出71.45kJ热量,同样条件下1mol H
将1g H2和4g O2混合点燃,充分反应,放出71.45kJ热量,同样条件下1mol H2在O2中完全燃烧放出的热量是( )
A.71.45 kJ
B.142.9 kJ
C.571.6 kJ
D.285.8 kJ zouyu197812051年前1
zouyu197812051年前1 -
 液封 共回答了21个问题
液封 共回答了21个问题 |采纳率90.5%解题思路:首先进行过量计算,确定放出71.45kJ热量时,参加反应的氢气的物质的量,据此计算同样条件下1mol H2在O2中完全燃烧放出的热量.1g H2的物质的量为[1g/2g/mol]=0.5mol,4g O2的物质的量为[4g/32g/mol]=0.125mol,
发生反应2H2+O2=2H2O,由方程式可知,0.125mol氧气完全反应需要消耗氢气为0.125mol×2=0.25mol,小于0.5mol,故氢气过量,故放出71.45kJ热量参加反应的氢气的物质的量为0.25mol,
同样条件下1mol H2在O2中完全燃烧放出的热量是:71.45kJ×[1mol/0.25mol]=285.8 kJ,
故选D.点评:
本题考点: 有关反应热的计算.
考点点评: 本题考查反应热的有关计算,难度不大,确定放出71.45kJ热量参加反应的氢气的物质的量是关键.1年前查看全部
- (1)在氢气与氯气反应生成氯化氢气体的反应中,若断裂1mol H-H键要吸收436.4KJ的能量,断裂1mol
(1)在氢气与氯气反应生成氯化氢气体的反应中,若断裂1mol H-H键要吸收436.4KJ的能量,断裂1mol Cl-Cl键要吸收242.7KJ的能量,断裂1mol H-Cl键要吸收431.8KJ的能量,则1mol H2在Cl2中充分燃烧的能量变化是△H=______.
(2)液态化合物N2H4和N2O4曾被用作火箭推进剂,燃烧反应的生成物是N2和H2O.
1mol N2H4与N2O4完全反应生成两种气体时放出热量516.8kJ,则该反应的热化学方程式为______.
(3)已知具有相似组成和结构的分子晶体,其熔沸点随着相对分子质量的增大而升高.可是H2O的熔沸点却比H2S更高,原因是______. HT_海天1年前1
HT_海天1年前1 -
 a1978910 共回答了15个问题
a1978910 共回答了15个问题 |采纳率93.3%解题思路:(1)化学反应中,化学键断裂吸收能量,形成新化学键放出能量,根据方程式计算分别吸收和放出的能量,以此计算反应热并判断吸热还是放热.
(2)根据热化学方程式的书写方法进行解答,注意标注物质聚集状态和对应焓变;
(3)H2O存在氢键沸点升高;(1)在反应H2+Cl2
点燃
.
2HCl中,断裂1molH-H键,1molCl-Cl键共吸收的能量为:436.4kJ+242.7KJ=679.1kJ,生成2molHCl,共形成2molH-Cl键,放出的能量为:2×431.8KJ=863.6kJ,吸收的能量少,放出的能量多,该反应为放热反应,放出的热量为:863.6kJ-679.1kJ=184.5kJ,即△H=-184.5kJ/mol,
故答案为:-184.5kJ/mol;
(2)反应方程式为:2N2H4+N2O4=3N2+4H2O,1molN2H4与N2O4完全反应生成两种气体时放出热量516.8kJ,所以热化学方程式为:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H=-1033.6kJ/mol;
故答案为:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H=-1033.6kJ/mol;
(3)H2O中存在氢键,作用力更强,因此熔沸点更高;
故答案为:H2O分子之间存在氢键作用,作用力更强.点评:
本题考点: 有关反应热的计算;热化学方程式.
考点点评: 本题主要考查了热化学方程式式的书写,反应热的计算以及氢键等知识,难度不大,注意基础知识的掌握.1年前查看全部
- 为什么1 mol CH3COOH能电离出 1mol H离子?CH3COOH是弱电解质,不是只能部分电离吗?
为什么1 mol CH3COOH能电离出 1mol H离子?CH3COOH是弱电解质,不是只能部分电离吗?
都为100mL 0.1mol/L的 HCl 和 CH3COOH 能中和等物质的量的 NaOH rr一个人的战争1年前1
rr一个人的战争1年前1 -
 changruixiang 共回答了17个问题
changruixiang 共回答了17个问题 |采纳率88.2%确实电离不出1mol氢离子,但若是和碱或碳酸盐反应,则会边消耗氢离子,同时又电离出氢离子,直到电离出1mol氢离子.1年前查看全部
- 某烷烃的结构简式如图.(1)用系统命名法命名该烃:______.(2)若该烷烃是由烯烃和1mol H 2 加成
某烷烃的结构简式如图.
(1)用系统命名法命名该烃:______.
(2)若该烷烃是由烯烃和1mol H 2 加成得到的,则原烯烃的结构有______种.(不包括立体异构,下同)
(3)若该烷烃是由炔烃和2mol H 2 加成得到的,则原炔烃的结构有______种.
(4)该烷烃在光照条件下与氯气反应,生成的一氯代烷最多有______种.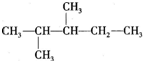
 小星星星1年前1
小星星星1年前1 -
 feifa 共回答了14个问题
feifa 共回答了14个问题 |采纳率92.9%1年前查看全部
- 在一定条件下将1mol的CO和1mol H 2 O(g)放入密闭容器中发生反应:CO(g)+H 2 O(g)⇌
在一定条件下将1mol的CO和1mol H 2 O(g)放入密闭容器中发生反应:CO(g)+H 2 O(g)⇌CO 2 (g)+H 2 (g),达到平衡时测得CO 2 为0.6mol.再通入4mol H 2 O(g),达到新平衡后,CO 2 的物质的量为( ) A.小于0.6mol大于0.4mol B.等于1mol C.大于0.6mol,小于1mol D.大于1mol  linlin60151年前1
linlin60151年前1 -
 冰点苹果 共回答了19个问题
冰点苹果 共回答了19个问题 |采纳率89.5%根据题意:CO+H 2 O(g)⇌CO 2 +H 2 ,
初始物质的量:1 1 0 0
变化物质的量:0.6 0.6 0.6 0.6
平衡物质的量:0.4 0.4 0.6 0.6
此时二氧化碳和氢气的物质的量之和是1.2mol,再通入4mol水蒸气,化学平衡会向着正反应方向进行,假设一氧化碳全部转化完毕,则会生成二氧化碳和氢气各0.4mol,此时CO 2 的物质的量1mol,但是一氧化碳不会全部转化,所以达到新的平衡后,CO 2 的物质的量介于0.6mol-1mol之间.
故选C.1年前查看全部
- 1mol H 2 (g)和1mol I 2 (g)置于某1L密闭容器中,在一定温度下发生反应:H 2
1mol H 2 (g)和1mol I 2 (g)置于某1L密闭容器中,在一定温度下发生反应:H 2 (g)+I 2 (g)⇌2HI(g)△H<0,达到平衡HI的体积分数w(HI)随时间变化如图(Ⅰ)所示.若改变反应条件,w(HI)的变化曲线如图(Ⅱ)所示,则改变的条件可能是( ) A.恒温恒容条件下,加入适当催化剂 B.恒温条件下,扩大反应容器体积 C.恒容条件下,降低温度 D.恒温条件下,再加入1molHe 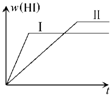
 夜未央1001年前1
夜未央1001年前1 -
 初晨朝雾 共回答了17个问题
初晨朝雾 共回答了17个问题 |采纳率94.1%A、恒温恒容条件下,加入适当催化剂,加快反应速率,不影响平衡移动,HI的体积分数w(HI)不变,故A错误;
B、恒温条件下,扩大反应容器体积,压强降低,反应速率减慢,该反应前后气体的物质的量不变,降低压强平衡不移动,平衡时HI的体积分数w(HI)不变,故B错误;
C、恒容条件下,降低温度,反应速率减慢,该反应正反应是放热反应,降低温度,平衡向正反应移动,HI的体积分数w(HI)增大,符合题意,故C正确;
D、恒温恒容条件下,充入1 molHe,反应混合物的浓度不变,反应速率不变,平衡不移动,故D错误;
故选C.1年前查看全部
- 1MOL一元酸电离是不是一定生成1MOL H
 雨桐12191年前3
雨桐12191年前3 -
 lxd0226 共回答了26个问题
lxd0226 共回答了26个问题 |采纳率88.5%不是 强酸可以完全电离
但弱酸不行
如1mol醋酸溶液中氢离子的物质的量就小于1mol1年前查看全部
- 已知破坏1mol H-H键、Cl-Cl键、H-Cl键分别需要吸收436kJ、243kJ、432kJ能量,则由H
已知破坏1mol H-H键、Cl-Cl键、H-Cl键分别需要吸收436kJ、243kJ、432kJ能量,则由H2与Cl2生成1mol HCl总的过程需要( )
A.放热185 kJ
B.吸热185 kJ
C.放热92.5 kJ
D.吸热92.5 kJ 海边听雨1年前1
海边听雨1年前1 -
 弄潮好手 共回答了14个问题
弄潮好手 共回答了14个问题 |采纳率92.9%解题思路:化学反应中,旧键断裂吸收能量,形成新键放出能量,根据反应Cl2+H2=2HCl键能计算反应热.化学反应中,旧键断裂吸收能量,形成新键放出能量,反应Cl2+H2=2HCl中,形成1molHCl时,
需要断裂0.5molCl-Cl键和0.5molH-H键,则吸收能量:0.5mol×436KJ/mol+0.5mol×243KJ/mol=339.5KJ,
生成1molHCl时需生成1molH-Cl键,放出1mol×432KJ/mol=432KJ能量,
则放出的能量为432KJ-339.5KJ=92.5KJ,
故选C.点评:
本题考点: 有关反应热的计算.
考点点评: 本题考查反应热及焓变,题目难度不大,本题注意化学键的断裂与形成与反应热的关系,注意根据化学方程式计算.1年前查看全部
- 关于下列各图的叙述,正确的是 [ ] A.甲表示1mol H
关于下列各图的叙述,正确的是 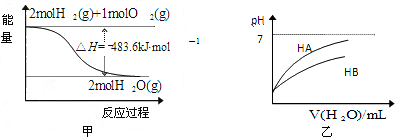 [ ]
[ ]A.甲表示1mol H 2 (g)完全燃烧生成水蒸气吸收241.8 kJ热量
B.甲表示2 mol H 2 (g)所具有的能量一定比2 mol气态水所具有的能量多483.6 kJ
C.乙表示常温 下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则同温同浓度的NaA溶液的pH小于NaB溶液的pH
D.乙图中起始时HA的物质的量浓度大于HB DEFVGGW1年前1
DEFVGGW1年前1 -
 nighthoot 共回答了21个问题
nighthoot 共回答了21个问题 |采纳率90.5%C1年前查看全部
- 下列说法正确的是( )A. 由H原子形成1mol H-H键要吸收热量B. 所有燃烧反应都是放热反应C. 据能
下列说法正确的是( )
A. 由H原子形成1mol H-H键要吸收热量
B. 所有燃烧反应都是放热反应
C. 据能量守恒定律,反应物的总能量一定等于生成物的总能量
D. 凡经加热而发生的化学反应都是吸热反应 piscesc1年前1
piscesc1年前1 -
 nicolas824 共回答了17个问题
nicolas824 共回答了17个问题 |采纳率94.1%解题思路:A.形成新键需要释放热量;
B.所有燃烧反应都是放热反应;
C.化学反应中反应物的总能量一定不等于生成物的总能量,因为化学反应一定有热效应;
D.反应吸热与放热和反应条件无关.A.形成新键需要释放热量,故A错误;
B.所有燃烧反应都是放热反应,故B正确;
C.据能量守恒定律,吸热反应中,反应物的总能量加吸收的热量等于生成物的总能量,放热反应中,反应物总能量等于生成物总能量加放出的热量,故C错误;
D.反应吸热与放热和反应条件无关,例如铝热反应需要在高温条件下发生,但是属于放热反应,故D错误;
故选:B.点评:
本题考点: 吸热反应和放热反应;反应热和焓变.
考点点评: 本题考查了吸热反应和放热反应的判断以及反应热与焓变的关系,题目难度不大,注意D选项,反应的热效应与反应的条件无关.1年前查看全部
- 将1g H2和4g O2混合点燃,充分反应,放出71.45kJ热量,同样条件下1mol H
将1g H2和4g O2混合点燃,充分反应,放出71.45kJ热量,同样条件下1mol H2在O2中完全燃烧放出的热量是( )
A. 71.45 kJ
B. 142.9 kJ
C. 571.6 kJ
D. 285.8 kJ 意唯我动1年前1
意唯我动1年前1 -
 的发行投入 共回答了23个问题
的发行投入 共回答了23个问题 |采纳率78.3%解题思路:首先进行过量计算,确定放出71.45kJ热量时,参加反应的氢气的物质的量,据此计算同样条件下1mol H2在O2中完全燃烧放出的热量.1g H2的物质的量为[1g/2g/mol]=0.5mol,4g O2的物质的量为[4g/32g/mol]=0.125mol,
发生反应2H2+O2=2H2O,由方程式可知,0.125mol氧气完全反应需要消耗氢气为0.125mol×2=0.25mol,小于0.5mol,故氢气过量,故放出71.45kJ热量参加反应的氢气的物质的量为0.25mol,
同样条件下1mol H2在O2中完全燃烧放出的热量是:71.45kJ×[1mol/0.25mol]=285.8 kJ,
故选D.点评:
本题考点: 有关反应热的计算.
考点点评: 本题考查反应热的有关计算,难度不大,确定放出71.45kJ热量参加反应的氢气的物质的量是关键.1年前查看全部
- 按要求写热化学方程式:(1)已知稀溶液中,1mol H 2 SO 4 与NaOH溶液恰好完全反应时,放出114
按要求写热化学方程式:
(1)已知稀溶液中,1mol H 2 SO 4 与NaOH溶液恰好完全反应时,放出114.6kJ热量,写出表示H 2 SO 4 与NaOH反应的中和热化学方程式______.
(2)25℃、101kPa条件下充分燃烧一定量的丁烷气体放出热量为Q kJ,经测定,将生成的CO 2 通入足量澄清石灰水中产生25g白色沉淀,写出表示丁烷燃烧热化学方程式______.
(3)已知下列热化学方程式:
①CH 3 COOH(l)+2O 2 (g)═2CO 2 (g)+2H 2 O(l)△H 1 =-870.3kJ/mol
②C(s)+O 2 (g)═CO 2 (g)△H 2 =-393.5kJ/mol
③H 2 (g)+
O 2 (g)═H 2 O(l)△H 3 =-285.8kJ/mol1 2
写出由C(s)、H 2 (g)和O 2 (g)化合生成CH 3 COOH(l)的热化学方程式______. 祷祝祭名川1年前1
祷祝祭名川1年前1 -
 彼岸花8311 共回答了17个问题
彼岸花8311 共回答了17个问题 |采纳率88.2%(1)中和热是指强酸、强碱生成1mol水放出的热量,1mol H 2 SO 4 与NaOH溶液恰好完全反应时,生成2mol水,放出114.6kJ热量,则生成1mol水时放出57.3kJ的热量,
所以H 2 SO 4 与NaOH反应的中和热化学方程式为:
1
2 H 2 SO 4 (aq)+NaOH(aq)=
1
2 Na 2 SO 4 (aq)+H 2 O(l);△H=-57.3kJ/mol,
故答案为:
1
2 H 2 SO 4 (aq)+NaOH(aq)=
1
2 Na 2 SO 4 (aq)+H 2 O(l);△H=-57.3kJ/mol;
(2)n(CaCO 3 )=
25g
100g/mol =0.25mol,
Ca(OH) 2 +CO 2 =CaCO 3 +H 2 O
1 1
0.25mol0.25mol
即丁烷燃烧生成的二氧化碳为0.25mol.
2C 4 H10+13O 2 =8CO 2 +10H 2 O
28
x 0.25mol
x=
1
16 mol
因为燃烧
1
16 mol的丁烷放出的热量为Q,则丁烷的燃烧热为16Q,
所以表示丁烷燃烧热化学方程式为 C 4 H10(g)+
13
2 O 2 (g)=4CO 2 (g)+5H 2 O(l)△H=-16QkJ/mol,
故答案为:C 4 H10(g)+
13
2 O 2 (g)=4CO 2 (g)+5H 2 O(l)△H=-16QkJ/mol;
(3)已知:
①CH 3 COOH(l)+2O 2 (g)═2CO 2 (g)+2H 2 O(l)△H 1 =-870.3kJ/mol
②C(s)+O 2 (g)═CO 2 (g)△H 2 =-393.5kJ/mol
③H 2 (g)+
1
2 O 2 (g)═H 2 O(l )△H 3 =-285.8kJ/mol
利用盖斯定律将②×2+③×2-①可得:
2C(s)+2H 2 (g)+O 2 (g)=CH 3 COOH(l);△H=2×(-393.5kJ/mol)+2×(-285.8kJ/mol)-(-870.3kJ/mol)=-488.3kJ/mol,
所以热化学方程式为2C(s)+2H 2 (g)+O 2 (g)=CH 3 COOH(l);△H=-488.3kJ/mol,
故答案为:2C(s)+2H 2 (g)+O 2 (g)=CH 3 COOH(l);△H=-488.3kJ/mol.1年前查看全部
- 在氢气与氯气反应生成氯化氢气体的反应中,若断裂1mol H-H键要吸收436KJ的能量,断裂1mol
在氢气与氯气反应生成氯化氢气体的反应中,若断裂1mol H-H键要吸收436KJ的能量,断裂1mol Cl-Cl键要吸收243KJ的能量,断裂1molH-Cl键要吸收432KJ的能量,在氯气中充分燃烧1mol H 2 的能量变化是______.  路人丙0011年前1
路人丙0011年前1 -
 情感男人 共回答了17个问题
情感男人 共回答了17个问题 |采纳率94.1%在反应H 2 +Cl 2
点燃
.
2HCl中,断裂1molH-H键,1molCl-Cl键共吸收的能量为:436kJ+243KJ=679kJ,生成2molHCl,共形成2molH-Cl键,放出的能量为:2×432KJ=864kJ,吸收的能量少,放出的能量多,该反应为放热反应,放出的热量为:864kJ-679kJ=185kJ,故答案为:放出185KJ的能量.1年前查看全部
- 将1mol H 2 (g)和2molI 2 (g)置于2L密闭容器中,在一定温度下发生反应:H 2 (g)+I
将1mol H 2 (g)和2molI 2 (g)置于2L密闭容器中,在一定温度下发生反应:H 2 (g)+I 2 (g)⇌
2HI(g)△H<0,并达到平衡,HI的体积分数w(HI)随时间变化如图(Ⅱ)所示.若改变反应条件,w(HI)的变化曲线如图(Ⅰ)所示,则改变的条件可能是( )A.恒温恒容条件下,加入适当催化剂 B.恒温恒容条件下,充入1 mol N 2 C.恒容条件下,升高温度 D.恒温恒容条件下,再充入1 mol H 2 (g)和2 molI 2 (g) 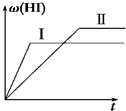
 冷风笔人1年前1
冷风笔人1年前1 -
 y0116kevin 共回答了23个问题
y0116kevin 共回答了23个问题 |采纳率78.3%A、恒温恒容条件下,加入适当催化剂,加快反应速率,但不影响平衡移动,HI的体积分数w(HI)不变,故A错误;
B、恒温恒容条件下,充入1 mol N 2 ,反应混合物的浓度不变,反应速率不变,平衡不移动,故B错误;
C、恒容条件下,升高温度,速率加快,该反应正反应是放热反应,升高温度,平衡向逆反应移动,HI的体积分数w(HI)减小,符合题意,故C正确;
D、恒温恒容条件下,再充入1 mol H 2 (g)和2 molI 2 (g),压强增大,反应速率加快,该反应前后气体的物质的量不变,压强增大平衡不移动,平衡时HI的体积分数w(HI)不变,故D错误;
故选C.1年前查看全部
- 拆开1mol H-H键,1mol N-H键,1mol N-N键分别需要能量是436kj,391kj,946kj,若有1m
拆开1mol H-H键,1mol N-H键,1mol N-N键分别需要能量是436kj,391kj,946kj,若有1molN2与H2恰好完全反应生成NH3,则反应的△H=?求具体做法,
 谈听哜1年前0
谈听哜1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 已知:①1mol H 2 分子中化学键断裂时需要吸收436kJ的能量
已知:①1mol H 2 分子中化学键断裂时需要吸收436kJ的能量
②1mol Cl 2 分子中化学键断裂时需要吸收243kJ的能量
③由H原子和Cl原子形成1mol HCl分子时释放431kJ的能量
下列叙述正确的是( )A.氢气和氯气反应生成氯化氢气体的热化学方程式是H 2 (g)+Cl 2 (g)=2HCl(g) B.氢气和氯气反应生成2mol氯化氢气体,反应的△H=183kJ/mol C.氢气和氯气反应生成2mol氯化氢气体,反应的△H=-183kJ/mol D.氢气和氯气反应生成1mol氯化氢气体,反应的△H=-183kJ/mol  城堡里的心1年前1
城堡里的心1年前1 -
 fkimi 共回答了13个问题
fkimi 共回答了13个问题 |采纳率69.2%A.热化学方程式应标出反应热的数值,故A错误;
B.H 2 (g)+Cl 2 (g)=2HCl(g)的反应热=生成物的键能减反应物的键能=436kJ?mol -1 +243kJ?mol -1 -2×431 kJ?mol -1 =-183kJ?mol -1 ,故1mol氢气与1mol氯气反应时放出热量为183KJ,△H=-183kJ/mol,故B错误;
C.反应热=生成物的键能减反应物的键能=436kJ?mol -1 +243kJ?mol -1 -2×431 kJ?mol -1 =-183kJ?mol -1 ,故1mol氢气与1mol氯气反应时放出热量为183KJ,△H=-183kJ/mol,故C正确;
D.当生成1mol氯化氢气体时,放出的热量是原来的一半,△H=-91.5kJ/mol,故D错误.
故选C.1年前查看全部
- H-H,CL-CL,H-CL的键分别为436,243,和431Kj/mol 由CL2,H2,生成1mol H-CL时,
H-H,CL-CL,H-CL的键分别为436,243,和431Kj/mol 由CL2,H2,生成1mol H-CL时,
反应是放热还是吸热?
E(反应物)=436+243=679
E(生成物)=431*2=863
所以反应物的能量小于生成物,是吸热,为什么答案是放热? 后来的人1年前2
后来的人1年前2 -
 告别城市0598 共回答了24个问题
告别城市0598 共回答了24个问题 |采纳率87.5%化学反应代表的是旧化学键的断裂和新化学键的形成过程!在反应过程中,断键要吸热,吸热符号为“+”,成键要放热,放热符号为“-”,反应是放热还是吸热取决上述过程的代数和!本题中发生反应时,H-H,CL-CL是断键过程共需吸收热量679,即+679KJ/mol!生成H-CL且是2mol,共放热863KJ/mol,即 -863KJ/mol,所以应反应的反应热为 -863KJ/mol+679KJ/mol = - 184KJ/mol,小于零,所以该反应是放热反应!1年前查看全部
- 已知拆开1mol H-H键、1mol N-H键、1mol N≡N键分别需要吸收的能量为43
已知拆开1mol H-H键、1mol N-H键、1mol N≡N键分别需要吸收的能量为436kJ、391kJ、946kJ.则由氢气和氮气反应生成1mol NH3需要______(填“放出”或“吸收”)______ kJ的热量.
 xxp8189891年前1
xxp8189891年前1 -
 他也不过如此 共回答了25个问题
他也不过如此 共回答了25个问题 |采纳率92%解题思路:化学反应中,化学键断裂吸收能量,形成新化学键放出能量,根据方程式计算焓变=反应物总键能-生成物的总键能,以此计算反应热并判断吸热还是放热.在反应N2+3H2⇌2NH3中,
断裂3mol H-H键,1mol N三N键共吸收的能量为:3×436kJ+946kJ=2254kJ,
生成2mol NH3,共形成6mol N-H键,放出的能量为:6×391kJ=2346kJ,
吸收的能量少,放出的能量多,该反应为放热反应,
放出的热量为:2346kJ-2254kJ=92kJ,
所以生成1mol NH3放出热量为46KJ;
故答案为:放出;46.点评:
本题考点: 有关反应热的计算.
考点点评: 本题考查反应热的计算,题目难度不大,注意把握从键能的角度计算反应热的方法.1年前查看全部
- 已知298K时,H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1,推测含1mol H
已知298K时,H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1,推测含1mol HCl的稀溶液与含1mol NH3的稀溶液反应放出的热量( )
A. 小于57.3 kJ
B. 等于57.3 kJ
C. 大于57.3 kJ
D. 无法确定 3540003771年前1
3540003771年前1 -
 seeddd 共回答了17个问题
seeddd 共回答了17个问题 |采纳率100%解题思路:依据中和热的概念和实质分析判断,中和热是指酸、碱的稀溶液完全反应生成1mol水时放出的热量;在稀溶液中,酸跟碱发生中和反应生成1 mol水时的反应热叫做中和热,1mol HCl的稀溶液与含1mol NH3的稀溶液反应生成1mol水,但是HF酸是弱酸,电离需要吸热,所以反应放出的热量小于57.3kJ/mol,故A正确,
故选A.点评:
本题考点: 中和热.
考点点评: 本题主要考查了中和热的概念的理解,注意弱电解质电离吸热是解题的关键.1年前查看全部
- 在2L密闭容器中充入1mol H 2 和1mol I 2 蒸气,压强为p(Pa),并在一定温度下使其发生反应:H 2 (
在2L密闭容器中充入1mol H 2 和1mol I 2 蒸气,压强为p(Pa),并在一定温度下使其发生反应:H 2 (g)+I 2 (g)==2HI(g) △H<0达到平衡时候n(H 2 )为0.8mol
(1) 保持容器容积不变,向其中加入1molH 2 ,反应速率 (填加快、减慢、不变、不确定),理由是 。
(2) 保持容器气体压强不变,向其中加入1molHe,反应速率 (填加快、减慢、不变、不确定),理由是 。平衡 (正向或逆向或不)移动
(3)计算该温度下的平衡常数 萍聚萍聚1年前1
萍聚萍聚1年前1 -
 瞬时天使 共回答了16个问题
瞬时天使 共回答了16个问题 |采纳率87.5%(1)加快 增加反应物氢气的浓度,反应速率加快,
(2)减慢 体积增大,浓度降低,所以反应速率减慢 不
(3)K=0.25
1年前查看全部
- “中和热”是一个热化学中的重要概念,“中和热”的定义为:在稀溶液中,酸跟碱发生中和反应生成1mol H 2 O时的反应热
“中和热”是一个热化学中的重要概念,“中和热”的定义为:在稀溶液中,酸跟碱发生中和反应生成1mol H 2 O时的反应热叫做中和热。以下关于中和热的叙述正确的是
A.在稀溶液中所有酸和碱反应的中和热数值都相等 B.在稀溶液中1mol酸和1mol碱反应放出的热量都相等 C.在稀溶液中HCl和NaOH反应的中和热与HNO 3 和KOH反应的中和热数值相等 D.将浓硫酸滴入氢氧化钠溶液中刚好生成1mol水时,产生的热量即为中和热  抽象的眼1年前1
抽象的眼1年前1 -
 段42 共回答了13个问题
段42 共回答了13个问题 |采纳率76.9%C
考查中和热的概念
酸、碱的元数、强弱、溶液的浓度等均可影响中和反应所放出的热量,故排除AB,C符合题意;
D项中浓硫酸在与其它水溶液混合的过量中会放出大量的热,但并非中和热,排除1年前查看全部
- 向含有1 mol HNO 3 和1mol H 2 SO 4 的混合溶液中逐渐加入铁粉至过量,溶液中金属阳离子a、b与所加
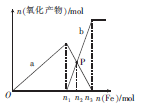
向含有1 mol HNO 3 和1mol H 2 SO 4 的混合溶液中逐渐加入铁粉至过量,溶液中金属阳离子a、b与所加铁粉的物质的量的关系如图所示(已知稀硝酸的还原产物只有NO)。下列有关判断不正确的是
A.a表示Fe 3+ 的关系曲线 B.n 1 =0.75 C.P点时,n(Fe 2+ )="0.5625" mol D.向P点溶液中加入铜粉,最多可溶解14.4 g  erick71年前1
erick71年前1 -
 0小叶子0 共回答了17个问题
0小叶子0 共回答了17个问题 |采纳率88.2%C
该反应可以看做二步①Fe+4H + + NO=Fe 3+ +NO↑+2H 2 O;硝酸根过量,氢离子不足;②2Fe 3+ +Fe=3Fe 2+ ;故A、正确,a表示Fe 3+ ;B、正确,3molH + 反应,消耗铁为0.75mol;C、P点二价铁等于三价铁,均为0.45mol,C错误。D、与0.45molFe 3+ 反应,消耗0.225mol铜,质量为14.4g。1年前查看全部
- 已知拆开1mol H-H键、1mol N-H键、1mol N≡N键分别需要的能量是436k
已知拆开1mol H-H键、1mol N-H键、1mol N≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为______.
 ss旗舰1年前1
ss旗舰1年前1 -
 zghnhhsuhua 共回答了20个问题
zghnhhsuhua 共回答了20个问题 |采纳率95%解题思路:化学反应中,化学键断裂吸收能量,形成新化学键放出能量,根据方程式计算分别吸收和放出的能量,以此计算反应热并判断吸热还是放热.在反应N2+3H2⇌2NH3中,断裂3molH-H键,1mol N三N键共吸收的能量为:3×436kJ+946kJ=2254kJ,生成2mol NH3,共形成6mol N-H键,放出的能量为:6×391kJ=2346kJ,吸收的热量少,放出的热量多,该反应为放热反应,放出的热量为:2346kJ-2254kJ=92kJ;
故答案为:N2(g)+3H2(g)=2NH3(g)△H=-92kJ•mol-1.点评:
本题考点: 热化学方程式.
考点点评: 本题主要考查了热化学方程式的书写,需要注意的有:物质的状态、反应热的数值与单位,反应热的数值与化学方程式前面的系数成正比.同时还考查了反应热的计算,题目难度不大,注意把握从键能的角度计算反应热的方法.1年前查看全部
- 已知:①1mol H 2 分子中化学键断裂时需要吸收436kJ的能量 ②1mol Cl 2 分子中化学键断裂时需要吸收2
已知:
①1mol H 2 分子中化学键断裂时需要吸收436kJ的能量
②1mol Cl 2 分子中化学键断裂时需要吸收243kJ的能量
③由H原子和Cl原子形成1mol HCl分子时释放431kJ的能量
下列叙述正确的是[ ]
A.氢气和氯气反应生成氯化氢气体的热化学方程式是 H 2 (g)+Cl 2 (g)=2HCl(g)△H=-183kJ/mol
B.氢气和氯气反应生成2mol氯化氢气体,反应的△H=183kJ/mol
C.氢气与氯气反应生成氯化氢气体的反应是吸热反应
D.氢气和氯气反应生成1mol氯化氢气体,反应的△H=-183kJ/mol 漫步田园园1年前1
漫步田园园1年前1 -
 鸽子rr 共回答了21个问题
鸽子rr 共回答了21个问题 |采纳率90.5%A1年前查看全部
- 在一定条件下将1mol的CO和1mol H 2 O(g)放入密闭容器中发生反应:CO(g)+H 2 O(g) CO 2
在一定条件下将1mol的CO和1mol H 2 O(g)放入密闭容器中发生反应:CO(g)+H 2 O(g)
 CO 2 (g)+H 2 (g),达到平衡时测得CO 2 为0.6mol。再通入4mol H 2 O(g),达到新平衡后,CO 2 的物质的量为
CO 2 (g)+H 2 (g),达到平衡时测得CO 2 为0.6mol。再通入4mol H 2 O(g),达到新平衡后,CO 2 的物质的量为 A.小于0.6mol大于0.4mol B.等于1mol C.大于0.6mol,小于1mol D.大于1mol  maillynn1年前1
maillynn1年前1 -
 吴越hua 共回答了16个问题
吴越hua 共回答了16个问题 |采纳率100%C
达到平衡后再通入4mol H 2 O(g),增大反应物浓度,平衡正向移动,所以CO 2 的物质的量增加,大于0.6mol。但作为可逆反应,反应物不能全部转化,所以“1mol的CO”不能完全反应,故CO 2 的物质的量小于1mol。故选C1年前查看全部
- 现向一密闭容器中充入omol N地和1mol H地,在一定条件下使该反应发生.下列有关说法正确二是(
现向一密闭容器中充入omol N地和1mol H地,在一定条件下使该反应发生.下列有关说法正确二是( )
A.达到化学平衡时,N2将完全转化为NH3
B.达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等
C.达到化学平衡时,正反应和逆反应的速率都为零
D.达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化 空的房1年前1
空的房1年前1 -
 玄鬼 共回答了22个问题
玄鬼 共回答了22个问题 |采纳率95.5%解题思路:可逆反应反应物不能完全反应,达到平衡状态时,正逆反应速率相等(同种物质)或正逆反应速率之比等于系数之比(不同物质),平衡时各种物质的物质的量、浓度等不再发生变化,由此衍生的一些物理量不变,以此分析.A、可逆反应反应物不能完全反应,故A错误;
q、反应平衡时各物质的浓度是否相等取决于起始时各物质的量的关系和转化的程度,N2、如2按1:3混合,化学计量数为1:3,所以转化率相等,平衡时,N2、如2的物质的量浓度一定为1:3,故q错误;
C、可逆反应时动态平衡,达到化学平衡时,正反应和逆反应的速率,但不为零,故C错误.
D、随着反应的进行,N2、如2和N如3的物质的量浓度发生变化,当N2、如2和N如3的物质的量浓度不再变化,说明到达平衡状态,故D正确;
故选D.点评:
本题考点: 化学平衡状态的判断.
考点点评: 本题考查了化学平衡状态的判断,难度不大,注意反应前后气体体积不变的化学反应平衡状态的判断标志.1年前查看全部
- (1)已知断裂1mol H-H键、1mol N≡N键分别需要吸收436kJ、946kJ的能量,生成1
(1)已知断裂1mol H-H键、1mol N≡N键分别需要吸收436kJ、946kJ的能量,生成1mol N-H键放出391kJ的能量,试写出N2(g)与H2(g)反应生成NH3(g)的热化学方程式:______.
(2)已知:C(s)+O2(g)═CO2(g)△H=-437.3kJ•mol-1
H2(g)+[1/2]O2(g)═H2O(g)△H=-285.8kJ•mol-1
CO(g)+[1/2]O2(g)═CO2(g)△H=-283.0kJ•mol-1
则煤的气化主要反应的热化学方程式是:C(s)+H2O(g)═CO(g)+H2(g)△H=______. 任大叫主1年前1
任大叫主1年前1 -
 神仙_旺财_无间道 共回答了23个问题
神仙_旺财_无间道 共回答了23个问题 |采纳率87%解题思路:(1)化学反应中,化学键断裂吸收能量,形成新化学键放出能量,根据方程式计算分别吸收和放出的能量,以此计算反应热并判断吸热还是放热;
(2)根据已知热化学方程式和盖斯定律计算得到.(1)在反应N2+3H2⇌2NH3中,断裂3molH-H键,1mol N三N键共吸收的能量为:3×436kJ+946kJ=2254kJ,生成2mol NH3,共形成6mol N-H键,放出的能量为:6×391kJ=2346kJ,吸收的能量少,放出的能量多,该反应为放热反应,放出的热量为:2346kJ-2254kJ=92kJ,
故答案为:N2(g)+3H2(g)⇌2NH3(g)△H=-92kJ•mol-1;
(2)已知:C(s)+O2(g)═CO2(g)△H=-437.3kJ•mol-1
H2(g)+[1/2]O2(g)═H2O(g)△H=-285.8kJ•mol-1
CO(g)+[1/2]O2(g)═CO2(g)△H=-283.0kJ•mol-1
依据盖斯定律①-②-③,得到:C(s)+H2O(g)═CO(g)+H2(g)△H=+131.5kJ•mol-1,
故答案为:+131.5KJ/mol.点评:
本题考点: 用盖斯定律进行有关反应热的计算;有关反应热的计算.
考点点评: 本题主要考查了反应热的计算、热化学方程式的书写、盖斯定律的应用,题目难度不大,注意把握从键能的角度计算反应热的方法.1年前查看全部
- 已知断开1mol H 2 中的化学键需要吸收436KJ的能量,断开1mol Cl 2 中的化学键需要
已知断开1mol H 2 中的化学键需要吸收436KJ的能量,断开1mol Cl 2 中的化学键需要吸收243KJ的能量,而形成1mol HCl分子中的化学键要释放431KJ的能量,则1mol氢气与1mol氯气反应时能量变化为( ) A.吸收183KJ B.吸收366KJ C.放出183KJ D.放出366KJ  山崖孤鹰1年前1
山崖孤鹰1年前1 -
 无天无崖 共回答了29个问题
无天无崖 共回答了29个问题 |采纳率79.3%H 2 (g)+Cl 2 (g)=2HCl(g)的反应热=生成物的键能减反应物的键能=436kJ•mol -1 +243kJ•mol -1 -2×431 kJ•mol -1 =
-183kJ•mol -1 ,故1mol氢气与1mol氯气反应时放出热量为183KJ,故选:C.1年前查看全部
- 在一密闭容器中充入1mol H 2 和1mol I 2 (g),并在一定温度下使其发生反应:H 2 (g)+I 2 (g
在一密闭容器中充入1mol H 2 和1mol I 2 (g),并在一定温度下使其发生反应:H 2 (g)+I 2 (g)
 2HI(g) D H <0。下列说法正确的是
2HI(g) D H <0。下列说法正确的是A.保持容器容积不变,向其中加入1molH 2 ,反应速率不变 B.保持容器容积不变,向其中加入1molAr,压强增大,平衡正向移动 C.保持容器内气体压强不变,向其中加入1molAr,化学平衡常数增大 D.保持容器内气体压强不变,向其中加入1mol H 2 (g)和1mol I 2 (g),化学平衡不移动  aria小菲1年前1
aria小菲1年前1 -
 magicsim1 共回答了23个问题
magicsim1 共回答了23个问题 |采纳率91.3%D
增大压强,必须通过增大浓度来加快反应速率。
A:氢气的浓度增大,反应速率增大
B:各物质浓度不变,反应速率不变,平衡不会移动
C:平衡常数只和温度有关
D:在题设条件下,与原平衡等效,平衡不移动。1年前查看全部
- 已知破坏1mol H-H键、Cl-Cl键分别需要吸收436kJ、243kJ、断裂1mol H-Cl键
已知破坏1mol H-H键、Cl-Cl键分别需要吸收436kJ、243kJ、断裂1mol H-Cl键要吸收432kJ能量,则由H2与Cl2生成1mol HCl总的过程需要( )
A. 放热185kJ
B. 吸热185kJ
C. 放热92.5kJ
D. 吸热92.5kJ 人形魔鬼心1年前1
人形魔鬼心1年前1 -
 jinjiang 共回答了26个问题
jinjiang 共回答了26个问题 |采纳率76.9%解题思路:反应方程式为:H2+Cl2=2HCl,根据吸收的能量之和与放出的能量判断反应的吸放热,并计算能量.反应方程式为:H2+Cl2=2HCl,
生成2molHCl,需吸收能量:436kJ+243kJ=679kJ,
放出能量:2×432kJ=864kJ,
放出的能量大于吸收的能量,则该反应放热,
且放出:864kJ-679kJ=185kJ,
生成1molHCl总的过程放热:[1/2]×185kJ=92.5kJ,
故选C.点评:
本题考点: 有关反应热的计算;化学反应中能量转化的原因.
考点点评: 本题考查反应热的计算,题目难度不大,本题注意根据反应的方程式计算,注意题目中生成1molHCl.1年前查看全部
- 在氢气与氯气反应生成氯化氢气体的反应中,若断裂1mol H-H键要吸收436KJ的能量,断裂1mol
在氢气与氯气反应生成氯化氢气体的反应中,若断裂1mol H-H键要吸收436KJ的能量,断裂1mol Cl-Cl键要吸收243KJ的能量,断裂1molH-Cl键要吸收432KJ的能量,在氯气中充分燃烧1mol H2 的能量变化是______.
 pigeon14101年前1
pigeon14101年前1 -
 霁月轩 共回答了15个问题
霁月轩 共回答了15个问题 |采纳率73.3%解题思路:化学反应中,化学键断裂吸收能量,形成新化学键放出能量,根据方程式计算分别吸收和放出的能量,以此计算反应热并判断吸热还是放热.在反应H2+Cl2
点燃
.
2HCl中,断裂1molH-H键,1molCl-Cl键共吸收的能量为:436kJ+243KJ=679kJ,生成2molHCl,共形成2molH-Cl键,放出的能量为:2×432KJ=864kJ,吸收的能量少,放出的能量多,该反应为放热反应,放出的热量为:864kJ-679kJ=185kJ,故答案为:放出185KJ的能量.点评:
本题考点: 有关反应热的计算;键能、键长、键角及其应用.
考点点评: 本题考查反应热的计算,题目难度不大,注意把握从键能的角度计算反应热的方法.1年前查看全部
- (1)在标准状况下,4g H 2 ,11.2L O 2 ,1mol H 2 O中,所含分子
(1)在标准状况下,4g H 2 ,11.2L O 2 ,1mol H 2 O中,所含分子数最多的是______,含原子数最多的是______,质量最大的是______,体积最小的是______.
(2)同温同压下,同体积的甲烷(CH 4 )和二氧化碳分子数之比为______,物质的量之比为______,原子总数之比为______,质量之比为______,密度之比为______. seaman_you1年前1
seaman_you1年前1 -
 q369321 共回答了16个问题
q369321 共回答了16个问题 |采纳率87.5%(1)在标准状况下,4g H 2 的物质的量为:n=
m
M =
4g
2g/mol =2mol,
11.2L O 2 的物质的量为:n=
V
V m =
11.2L
22.4L/mol =0.5mol,
H 2 O的物质的量为1mol,
根据N=n?N A 可知,相同条件下,气体的物质的量越多,分子数越多,故所含分子数最多的是H 2 ;
根据分子的组成可知:
4g H 2 中原子数目为2×2mol×N A /mol=4N A ,
11.2L O 2 中原子数目为2×0.5mol×N A /mol=1N A ,
1mol H 2 O中原子数目为3×1mol×N A /mol=3N A ,
所以,含原子数最多的是H 2 ;
11.2L O 2 的质量为:m=n?M=0.5mol×32g/mol=16g,
1mol H 2 O的质量为:1mol×18g/moL=18g,
所以,质量最大的是H 2 O;
相同条件下,物质的越多,气体的体积越大,但在标准状况下水为液体(或固体),体积最小,
故答案为:H 2 ; H 2 ;H 2 O;H 2 O;
(2)根据阿伏加德罗定律定律,相同条件下,相同体积的任何气体都含有相同的数目的粒子,
则:同温同压下,同体积的甲烷(CH 4 )和二氧化碳分子数之比为1:1;
根据N=n?N A 可知:物质的量之比为1:1;
1个甲烷分子中含有5个原子,1个二氧化碳分子中含有3个原子,则原子总数之比为5:3;
根据m=n?M可知,物质的量相同时,质量之比等于相对分子质量之比,则质量之比为16:44=4:11;
根据同温同压下,气体的密度之比等于相对分子质量之比,则密度之比为1:11.
故答案为:1:1;1:1;5:3;4:11;4:11.1年前查看全部
- 将1mol H 2 (g)和2mol I 2 (g)置于某2L密闭容器中,在一定温度下发生反应:H 2 (g)+I 2
将1mol H 2 (g)和2mol I 2 (g)置于某2L密闭容器中,在一定温度下发生反应:H 2 (g)+I 2 (g) 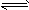 2HI(g);
2HI(g);
ΔH<0 ,并达到平衡。HI的体积分数ω(HI)随时间变化如图(Ⅰ)所示,若改变反应条件,ω(HI)的变化曲线如图(Ⅱ)所示,则改变的条件可能是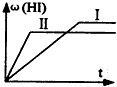
[ ]
A.恒温条件下,加入适当催化剂
B.恒温条件下,缩小反应容器体积
C.恒容条件下升高温度
D.恒温条件下,扩大反应容器体积 zhs19761年前1
zhs19761年前1 -
 郑博士我想你 共回答了19个问题
郑博士我想你 共回答了19个问题 |采纳率89.5%C1年前查看全部
- 已知断开1mol H--H键吸收的能量为436KJ,形成1molH--N键放出的能量为391KJ.根据化学方程式N2+3
已知断开1mol H--H键吸收的能量为436KJ,形成1molH--N键放出的能量为391KJ.根据化学方程式N2+3H2==2NH3.
反应掉1molN2放出的能量为92.4,则断开1molN=N需要吸收的能量.
为什么用6×391.而不是2 lxkzcjklj23lkjgl1年前4
lxkzcjklj23lkjgl1年前4 -
 羚羊丫头 共回答了17个问题
羚羊丫头 共回答了17个问题 |采纳率82.4%1molNH3中有3molN-H键,2molNH3中有6molN-H键
形成2molNH3放出能量=6×391
设断开1molN≡N键吸收能量为X
反应放出能量:-X-3×436+6*391=92.4
X=945.6KJ1年前查看全部
- 下列说法正确的是( )A.由H原子形成1mol H-H键要吸收热量B.所有燃烧反应都是放热反应C.据能量守恒
下列说法正确的是( )
A.由H原子形成1mol H-H键要吸收热量
B.所有燃烧反应都是放热反应
C.据能量守恒定律,反应物的总能量一定等于生成物的总能量
D.凡经加热而发生的化学反应都是吸热反应 哚儿1年前1
哚儿1年前1 -
 bbandbb 共回答了16个问题
bbandbb 共回答了16个问题 |采纳率87.5%解题思路:A.形成新键需要释放热量;
B.所有燃烧反应都是放热反应;
C.化学反应中反应物的总能量一定不等于生成物的总能量,因为化学反应一定有热效应;
D.反应吸热与放热和反应条件无关.A.形成新键需要释放热量,故A错误;
B.所有燃烧反应都是放热反应,故B正确;
C.据能量守恒定律,吸热反应中,反应物的总能量加吸收的热量等于生成物的总能量,放热反应中,反应物总能量等于生成物总能量加放出的热量,故C错误;
D.反应吸热与放热和反应条件无关,例如铝热反应需要在高温条件下发生,但是属于放热反应,故D错误;
故选:B.点评:
本题考点: 吸热反应和放热反应;反应热和焓变.
考点点评: 本题考查了吸热反应和放热反应的判断以及反应热与焓变的关系,题目难度不大,注意D选项,反应的热效应与反应的条件无关.1年前查看全部
- (1)已知断开 1mol H 2 中的化学键需吸收436kJ热量,断开1mol
(1)已知断开 1molH 2 中的化学键需吸收436kJ热量,断开1mol Cl 2 中的化学键需要吸收243kJ能量,而形成1molHCl分子中的化学键要释放431kJ能量,试求1mol H 2 与1mol Cl 2 反应的能量变化.△H=______.
(2)已知常温时,0.1mol/L某一元酸HA在水中有0.1%发生电离,则该溶液的PH=______,此酸的电离平衡常数K=______,由HA电离出来的H + 的浓度约为水电离出来的H + 的浓度的______倍. gaoj20011年前1
gaoj20011年前1 -
 yyypx 共回答了20个问题
yyypx 共回答了20个问题 |采纳率85%(1)断开 1mol H 2 中的化学键需吸收436kJ热量,断开1mol Cl 2 中的化学键需要吸收243kJ能量,而形成1mol HCl分子中的化学键要释放431kJ能量,发生的反应为H 2 +Cl 2 =2HCl应的焓变=断开化学键吸收的总能量-形成化学键放出的总能量=436KJ/mol+243KJ/mol-2×431KJ/mol=-183KJ/mol;故答案为:-183KJ/mol
(2)已知常温时,0.1mol/L某一元酸HA在水中有0.1%发生电离,依据电离度=
[ H + ]
C(HA) ;得到[H + ]=0.1mol/L×0.1%=1×10 -4 mol/L,PH=4;依据电离平衡HA⇌H + +A - ,K=
[ H + ][ A - ]
[HA] =
1 0 -4 ×1 0 -4
0.1-1 0 -4 =1×10 -7 mol/L;由HA电离出来的H + 的浓度为1×10 -4 mol/L,依据[H + ][A - ]=10 -14 得到水电离出来的H + 的浓度为10 -10 mol/L;所以由HA电离出来的H + 的浓度约为水电离出来的H + 的浓度的10 6 倍;故答案为:4,1×10 -7 mol/L,10 6 ;1年前查看全部
- 将1mol H 2 (g)和2mol I 2 (g)置于某2L密闭容器中,在一定温度下发生反应:H 2 (g)+I 2
将1mol H 2 (g)和2mol I 2 (g)置于某2L密闭容器中,在一定温度下发生反应:H 2 (g)+I 2 (g)  2HI(g);
2HI(g);
ΔH<0 ,并达到平衡。HI的体积分数ω(HI)随时间变化如图(Ⅰ)所示,若改变反应条件,ω(HI)的变化曲线如图(Ⅱ)所示,则改变的条件可能是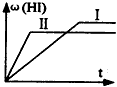 [ ]
[ ]A.恒温条件下,加入适当催化剂
B.恒温条件下,缩小反应容器体积
C.恒容条件下升高温度
D.恒温条件下,扩大反应容器体积 搞活机器1年前1
搞活机器1年前1 -
 酸吧不是罪 共回答了11个问题
酸吧不是罪 共回答了11个问题 |采纳率90.9%C1年前查看全部
- 已知拆开1mol H-H键、1mol N-H键、1mol N≡N键分别需要的能量是436k
已知拆开1mol H-H键、1mol N-H键、1mol N≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为______.
 penny66561年前2
penny66561年前2 -
 swh19850520 共回答了17个问题
swh19850520 共回答了17个问题 |采纳率88.2%解题思路:化学反应中,化学键断裂吸收能量,形成新化学键放出能量,根据方程式计算分别吸收和放出的能量,以此计算反应热并判断吸热还是放热.在反应N2+3H2⇌2NH3中,断裂3molH-H键,1mol N三N键共吸收的能量为:3×436kJ+946kJ=2254kJ,生成2mol NH3,共形成6mol N-H键,放出的能量为:6×391kJ=2346kJ,吸收的热量少,放出的热量多,该反应为放热反应,放出的热量为:2346kJ-2254kJ=92kJ;
故答案为:N2(g)+3H2(g)=2NH3(g)△H=-92kJ•mol-1.点评:
本题考点: 热化学方程式.
考点点评: 本题主要考查了热化学方程式的书写,需要注意的有:物质的状态、反应热的数值与单位,反应热的数值与化学方程式前面的系数成正比.同时还考查了反应热的计算,题目难度不大,注意把握从键能的角度计算反应热的方法.1年前查看全部
- 已知1mol H 2 SO 4 (aq)与1mol Ba(OH) 2 (aq)反应的△H=-1
已知1mol H 2 SO 4 (aq)与1mol Ba(OH) 2 (aq)反应的△H=-1 584.2kJ•mol -1 ;稀溶液中,H + (aq)+OH - (aq)═H 2 O(l)△H=-55.6kJ•mol -1 .则 B a 2+ (aq)+S
(aq) ═BaSO 4 (s)的反应热等于( )O 2-4 A.-1 528.6 kJ•mol -1 B.-1 473 kJ•mol -1 C.+1 473 kJ•mol -1 D.+1 528.6 kJ•mol -1  happybin20081年前1
happybin20081年前1 -
 gangxia 共回答了17个问题
gangxia 共回答了17个问题 |采纳率82.4%①2H + (aq)+SO 4 2- (aq)+Ba 2+ (aq)+2OH - (aq)=BaSO 4 (S)+2H 2 O(l)△H=-1584.2kJ•mol -1 ;
②H + (aq)+OH - (aq)═H 2 O(l)△H=-55.6kJ•mol -1 .
根据盖斯定律,①-②×2得,SO 4 2- (aq)+Ba 2+ (aq)=BaSO 4 (S)△H=-1473 kJ•mol -1 ,
故选B.1年前查看全部
- 1MOL H和1MOL H+和1MOLH2的含义一样吗?
 hiddendragon221年前1
hiddendragon221年前1 -
 hmyujian 共回答了15个问题
hmyujian 共回答了15个问题 |采纳率80%肯定不一样
1MOL H是1mol氢原子
1MOL H+是1mol氢离子
1MOLH2是1mol氢气1年前查看全部
- 在标准状况下,①4g H 2 ,②11.2L O 2 ,③1mol H 2 O中,所含分子
在标准状况下,①4g H 2 ,②11.2L O 2 ,③1mol H 2 O中,所含分子数最多的是______,含原子数最多的是______,质量最大的是______,体积最小的是______.(填序号)  pengjinwei601年前1
pengjinwei601年前1 -
 moondyyzm 共回答了22个问题
moondyyzm 共回答了22个问题 |采纳率77.3%①氢气的物质的量为
4g
2g/mol =2mol,其分子数为2N A ,原子数为4N A ,质量为4g,标准状况下的体积为2mol×22.4L/mol=44.8L;
②氧气的物质的量为
11.2L
22.4L/mol =0.5mol,其分子数为0.5N A ,原子数为N A ,质量为0.5mol×32g/mol=16g,标准状况下的体积为11.2L;
③水的物质的量为1mol,其分子数为N A ,原子数为3N A ,质量为1mol×18g/mol=18g,标准状况下水为液体,其体积在三者中最小;
显然分子数最多的是①,原子数最多的是①,质量最大的是③,体积最小的是③,
故答案为:①;①;③;③.1年前查看全部
- 已知破坏1mol H-H键、Cl-Cl键分别需要吸收436kJ、243kJ、断裂1mol H-Cl键
已知破坏1mol H-H键、Cl-Cl键分别需要吸收436kJ、243kJ、断裂1mol H-Cl键要吸收432kJ能量,则由H 2 与Cl 2 生成1mol HCl总的过程需要( ) A.放热185kJ B.吸热185kJ C.放热92.5kJ D.吸热92.5kJ  一阵疯1年前1
一阵疯1年前1 -
 刘盖 共回答了18个问题
刘盖 共回答了18个问题 |采纳率77.8%反应方程式为:H 2 +Cl 2 =2HCl,
生成2molHCl,需吸收能量:436kJ+243kJ=679kJ,
放出能量:2×432kJ=864kJ,
放出的能量大于吸收的能量,则该反应放热,
且放出:864kJ-679kJ=185kJ,
生成1molHCl总的过程放热:
1
2 ×185kJ=92.5kJ,
故选C.1年前查看全部
- 在25℃、101kPa的条件下,断裂1mol H-H键吸收436kJ 能量,断裂1mol
在25℃、101kPa的条件下,断裂1mol H-H键吸收436kJ 能量,断裂1mol Cl-Cl键吸收243kJ能量,形成1mol H-Cl键放出431kJ能量.H2+Cl2═2HCl的化学反应可用如图表示:

请回答下列有关问题:
(1)反应物断键吸收的总能量为______.
(2)生成物成键放出的总能量为______.
(3)判断H2+Cl2═2HCl是______(填“吸收”或“放出”)能量.
(4)反应物的总能量______(填“>”或“<”)生成物的总能量. su345201年前1
su345201年前1 -
 喀纳斯人 共回答了18个问题
喀纳斯人 共回答了18个问题 |采纳率88.9%解题思路:(1)反应物断键吸收的总能量为氢气和氯气的键能和;
(2)生成物成键放出的总能量为2molHCl的总键能;
(3)根据生成物的键能与反应物的键能的大小关系分析;
(4)根据生成物的键能与反应物的键能的大小关系分析.(1)反应物断键吸收的总能量为氢气和氯气的键能和,则反应物断键吸收的总能量为436+243=679KJ,故答案为:679KJ;
(2)生成物成键放出的总能量为2molHCl的总键能,则生成物成键放出的总能量为431×2=862KJ,故答案为:862KJ;
(3)反应热=生成物的键能减反应物的键能=436kJ•mol-1+243kJ•mol-1-2×431 kJ•mol-1=-183kJ•mol-1,△H<0,所以该反应为放热反应,故答案为:放出;
(4)由(3)可知△H<0,该反应为放热反应,所以反应物的总能量>生成物的总能量,故答案为:>.点评:
本题考点: 反应热和焓变.
考点点评: 本题主要考查了化学反应与能量的变化,注意根据键能判断△H,难度不大,注意知识的积累.1年前查看全部
- 在标准状况下,①4g H 2 ,②11.2L O 2 ,③1mol H 2 O中,所含分子
在标准状况下,①4g H 2 ,②11.2L O 2 ,③1mol H 2 O中,所含分子数最多的是______,含原子数最多的是______,质量最大的是______,体积最小的是______.(填序号)  liquidskyvivi1年前1
liquidskyvivi1年前1 -
 和氏璧一 共回答了16个问题
和氏璧一 共回答了16个问题 |采纳率100%①氢气的物质的量为
4g
2g/mol =2mol,其分子数为2N A ,原子数为4N A ,质量为4g,标准状况下的体积为2mol×22.4L/mol=44.8L;
②氧气的物质的量为
11.2L
22.4L/mol =0.5mol,其分子数为0.5N A ,原子数为N A ,质量为0.5mol×32g/mol=16g,标准状况下的体积为11.2L;
③水的物质的量为1mol,其分子数为N A ,原子数为3N A ,质量为1mol×18g/mol=18g,标准状况下水为液体,其体积在三者中最小;
显然分子数最多的是①,原子数最多的是①,质量最大的是③,体积最小的是③,
故答案为:①;①;③;③.1年前查看全部
- 1mol氢 和 1mol H 有啥区别 是同一个意思吗?顺便问一下“e-”是什么符号
 denise1611年前2
denise1611年前2 -
 81965129 共回答了12个问题
81965129 共回答了12个问题 |采纳率100%1mol H表示1mol氢原子,表示正确,而1mol氢不正确,因为没有说明氢是原子还是分子.
e-就是电子的符号.1年前查看全部
- 拆开1mol H-H键 1mol N-H键 1molN三N键 分别需要吸收能量436KJ 391KJ 946KJ
拆开1mol H-H键 1mol N-H键 1molN三N键 分别需要吸收能量436KJ 391KJ 946KJ
则 N2和H2反应生成8.5gNH3M 则_____(填吸收或释放)能量 麦香牛奶1年前2
麦香牛奶1年前2 -
 kiroro628 共回答了27个问题
kiroro628 共回答了27个问题 |采纳率92.6%8.5 g NH3相当于8.5/17 = 0.5 mol
0.25N2 + 0.75H2 = 0.5NH3
此反应须拆开0.25 mol N三N键,0.75molH-H键,形成0.5*3 = 1.5mol N-H键
净能量:1.5*391 - 0.25*946 - 0.75*436 = 23 kJ
释放能量1年前查看全部
大家在问
- 1英语翻译
- 2段中这句话 fseek(fpin,-1L,SEEK_CUR); 的具体意义和作用 这只是一个大程序的一部分
- 3人教版高二英语必修五英汉翻译!把这个句子改成倒装句.Professor White and many other gue
- 41道小学数学可能性题!1、小亮和哥哥玩卡片,这三张卡片上分别写着2,3,4,如果摆出的三位数字是单数我就赢,是双数你赢。
- 5填空:My father works ___every day.he always comes home at 2:00
- 6“春风又绿江南岸,明月何时照我还”.的作者是宋代诗人张籍.()判断题.
- 7英语课堂作业本六年级下册38页第三题
- 8我买了一个水杯,底部标有PC,2,
- 9用红黄蓝绿给一条直线上四个三角形涂色,每个三角形图一种颜色,共有多少种不同的方法
- 10某人沿着有一定坡度的坡面前进了10米,此时他与水平地面的垂直距离为25米,则这个坡面的坡度为______.
- 11已知函数fx=sinx×cos(x-6分之x)+cos²x-2分之1 1、求函数fx的单调递增区
- 12--Your speech is really wonderful!
- 13天有大声如雷,乃一大星,几如月,见于东南
- 14明水三中六年级第二次月考语文作文题目是什么呢?
- 15结合语境给加粗的字注音。1.每年汛期,山洪暴发,溪水猛 涨 ( ),人们忙着摆搭石,忙到脸都 涨 ( )得绯红。2.